ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 980-984
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.743.1
СИНТЕЗ НОВЫХ α-АМИНОФОСФОНАТОВ
НА ОСНОВЕ ЦИКЛОГЕКСИЛАМИНА
© 2020 г. А. В. Смолобочкина,*, А. С. Газизовa, К. А. Досжановаb, А. Б. Куандыковаb,
Б. Ж. Джиембаевb, А. Р. Буриловa, М. А. Пудовикa, Р. А. Черкасовc
a Институт органической и физической химии имени А. Е. Арбузова Федерального исследовательского центра
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
b Казахский государственный женский педагогический университет, Алматы, 050000 Казахстан
c Казанский федеральный университет, Казань, 420008 Россия
*e-mail: smolobochkin@iopc.ru
Поступило в Редакцию 19 февраля 2020 г.
После доработки 19 февраля 2020 г.
Принято к печати 28 февраля 2020 г.
Синтезирован ряд новых α-аминофосфонатов на основе кислотно-катализируемой реакции Кабачни-
ка-Филдса с участием диэтилфосфита, циклогексиламина и замещенного бензальдегида. Структура
продуктов реакции установлена методами ИК, ЯМР спектроскопии и масс-спектроскопии.
Ключевые слова: α-аминофосфонаты, диэтилфосфит, циклогексиламин, реакция Кабачника-Филдса
DOI: 10.31857/S0044460X20060212
Повышенный интерес исследователей к разра-
второго метода заключается в использовании как
ботке методов синтеза и изучению свойств новых
первичных, так и различных по природе вторич-
типов α-аминофосфорильных соединений связан
ных аминов. Введение в структуру аминофосфо-
с возможностями их использования благодаря вы-
рильных соединений циклогексильной группы в
сокой и разнообразной биологической активности
ряде случаев приводит к проявлению ими высо-
[1-6]. Синтетическая доступность этих соедине-
кой и разнообразной биологической активности.
ний, возможность широкого варьирования струк-
α-Аминофосфонаты, включающие такой струк-
турных фрагментов и введения фармакофорных
турный фрагмент, являются ингибиторами ацетил-
групп благоприятствуют их исследованию. Су-
холинэстеразы [14, 15], лизофосфолипазы D [16],
ществуют два наиболее разработанных и удобных
эпоксигидролазы
[17], лейцинаминопептидазы
препаративных метода их получения. Первый из
[18], аланинаминопептидазы [19], обладают про-
них базируется на использовании иминного вари-
тивораковой активностью [20, 21].
анта реакции Пудовика - на присоединении эфи-
С целью получения новых типов α-аминофос-
ров фосфористых кислот к иминам [7-9]; однако
фонатов, включающих фармакофорный циклогек-
синтетический потенциал этого метода ограничен
силаминный фрагмент, нами проведена реакция
применением для получения иминов-предше-
Кабачника-Филдса с участием ряда замещенных
ственников только первичных аминов. Большее
бензальдегидов 1а-е, диэтилфосфористой кисло-
распространение приобрел метод, основанный
ты 2 и циклогексиламина 3. На примере взаимо-
на однореакторной реакции Кабачника-Филдса -
действия 4-хлорбензальдегида, диэтилфосфита и
на конденсации в трехкомпонентной системе ги-
циклогексиламина мы оптимизировали условия
дрофосфорильное соединение-карбонильное со-
протекания реакции, варьируя температуру, при-
единение-амин [10-13]. Важное преимущество
роду растворителя и продолжительность взаимо-
980
СИНТЕЗ НОВЫХ α-АМИНОФОСФОНАТОВ
981
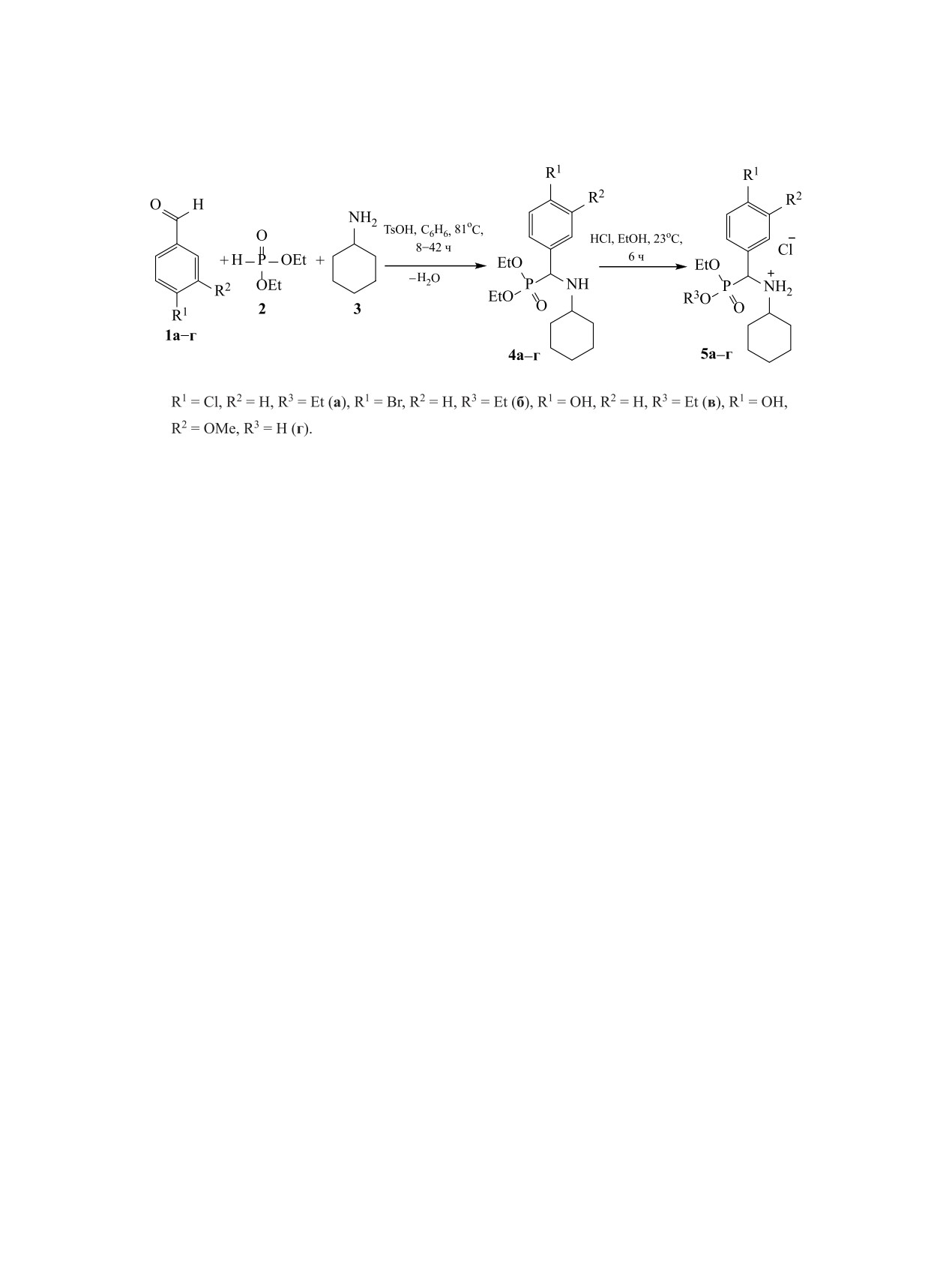
Схема 1.
действия компонентов. При проведении реакции
5a-в с количественным выходом. При обработке
Кабачника-Филдса в воде, бензоле и хлороформе
фосфоната 4г соляной кислотой происходил его
независимо от температуры во всех случаях были
частичный гидролиз с образованием соединения
получены трудноразделимые смеси веществ. Ос-
5г.
новываясь на принципах «зеленой» химии, мы
Таким образом, на основе кислотно-катализи-
предприняли попытку осуществить эту реакцию
руемой трехкомпонентной реакции Кабачника-
в отсутствие растворителя. Реакция проходит до
Филдса разработан однореакторный метод синтеза
конца при 90°С в течение 160 ч. При использо-
ранее неописанных замещенных диэтил[(фенил)-
вании в качестве катализатора п-толуолсульфоно-
(циклогексиламино)метил]фосфонатов. Включе-
вой кислоты время реакции удалось сократить до
ние в их структуру фармакофорного циклогекси-
45 ч. Наиболее оптимально проведение реакции
ламинного фрагмента предполагает появление но-
при кипячении реагентов с азеотропной отгонкой
вых биоактивных свойств, которые находятся в
воды в течение 30 ч в бензоле в присутствии 10%
стадии изучения.
п-толуолсульфоновой кислоты. Выход соединения
Диэтил[(4-хлорфенил)(циклогексиламино)-
4а составил 91%.
метил]фосфонат (4a). К смеси 0.24 г (2.10 ммоль)
Влияние структуры альдегида на протекание
диэтилфосфита в
50 мл бензола добавляли
реакции было исследовано при введении в реак-
0.20 г
(2.10 ммоль) гексиламина,
0.30 г
цию с диэтилфосфитом и циклогексиламином
(2.10 ммоль)
4-хлорбензальдегида и
0.04 г
замещенных бензальдегидов (схема 1). При вза-
(0.21 ммоль) п-толуолсульфоновой кислоты. Ре-
имодействии с альдегидами 1а и 1б, содержащи-
акционную смесь кипятили, используя насадку
ми в качестве заместителя атом галогена (хлор и
Дина-Старка, в течение 30 ч. Реакционной массы
бром), из реакционной смеси в результате 30-ча-
обрабатывали насыщенным водным раствором
сового нагревания были выделены соединения
гидрокарбоната натрия (3×10 мл). Органическую
4а и 4б с выходами 91 и 86% соответственно.
фазу отделяли и сушили в вакууме. Выход 0.69 г
Введение донорных заместителей в бензольное
(91%), желтое маслообразное вещество. Спектр
кольцо (альдегиды 1в, г) позволило уменьшить
ЯМР 1Н (CDCl3), δ, м. д.: 0.98-1.15 м (4Н, СН2),
время реакции до 8 ч; α-аминофосфонаты 4в, г
1.18 т (3Н, СН3, 3JHH = 7.1 Гц), 1.31 т (3Н, СН3,
были выделены с выходами 77 и 89% соответ-
3JHH = 7.1 Гц), 1.51-1.59 м (1Н, СН2), 1.64-1.80 м
ственно.
(3Н, СН2), 1.82-1.92 м (2Н, СН2), 2.28-2.37 м (1Н,
С целью увеличения растворимости α-ами-
СН), 3.82-3.93 м (1Н, СН2), 3.96-4.04 м (1Н, СН2),
нофосфонатов
4a-г в воде их обрабатывали
4.07-4.15 м (2Н, СН2), 4.19 д (1H, СН, 2JHР = 21.9
водно-спиртовым раствором соляной кислоты при
Гц), 7.31-7.35 м (2Н, СНAr), 7.36-7.40 м (2Н, СНAr).
комнатной температуре и выделяли гидрохлориды
Спектр ЯМР 31Р (CDCl3): δР 23.56 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
982
СМОЛОБОЧКИН и др.
Диэтил[(4-бромфенил)(циклогексиламино)-
δР 14.87 м. д. Масс-спектр (MALDI-TOF), m/z: 361
метил]фосфонат (4б). Выход 0.73 г (86%). Спектр
[M - Сl]+. Найдено, %: C 51.65; H 7.30; Cl 17.71;
ЯМР 1Н (CDCl3), δ, м. д.: 0.97-1.13 м (4Н, СН2),
N 3.69; P 7.99. C17H28Cl2NO3P. Вычислено, %: C
1.18 т (3Н, СН3, 3JHH = 7.0 Гц), 1.34 т (3Н, СН3,
51.52; H 7.12; Cl 17.89; N 3.53; P 7.82.
3JHH =7.0 Гц), 1.55-1.64 м (1Н, СН2), 1.64-1.82
N-[(4-Бромфенил)(диэтоксифосфорил)ме-
м (3Н, СН2), 1.84-1.94 м (2Н, СН2), 2.29-2.37 м
тил]циклогексанаминия хлорид
(5б). Выход
(1Н, СН), 3.83-3.94 м (1Н, СН2), 3.95-4.05 м (1Н,
96%, т. пл. 119-121°C. ИК спектр ν, см-1: 1034,
СН2), 4.08-4.15 м (2Н, СН2), 4.22 д (1H, СН, 2JHР =
1254, 2411, 2464, 2585. Спектр ЯМР 1Н (CDCl3), δ,
21.8 Гц), 7.33 д (2H, СНAr, 3JHH = 7.2 Гц), 7.40 д
м. д.: 1.01-1.17 м (4Н, СН2), 1.23 т (3Н, СН3, 3JHH
(2H, СНAr, 3JHH = 7.3 Гц). Спектр ЯМР 31Р (CDCl3):
7.1 Гц), 1.38 т (3Н, СН3, 3JHH = 7.0 Гц), 1.57-1.66 м
δР 23.78 м. д.
(1Н, СН2), 1.68-1.83 м (3Н, СН2), 1.84-1.94 м (2Н,
Диэтил[(4-гидроксифенил)(циклогексил-
СН2), 2.32-2.39 м (1Н, СН), 3.89-3.99 м (1Н, СН2),
амино)метил]фосфонат (4в). Выход 0.55 г (77%).
4.00-4.08 м (1Н, СН2), 4.09-4.18 м (2Н, СН2), 4.66
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.86 т (3Н,
д (1H, СН, 2JHР = 19.1 Гц), 7.41 д (2H, СНAr, 3JHH =
СН3, 3JHH = 7.0 Гц), 0.99 т (3Н, СН3, 3JHH = 7.0
7.2 Гц), 7.52 д (2H, СНAr, 3JHH = 7.2 Гц). Спектр
Гц), 1.04-1.20 м (4Н, СН2), 1.36-1.64 м (5Н, СН2),
ЯМР 31Р (CDCl3): δР 16.98 м. д. Масс-спектр
1.69-1.83 м (1Н, СН2), 2.56-2.69 м (1Н, СН), 3.57-
(MALDI-TOF), m/z: 405 [M - Сl + H]+. Найдено,
3.67 м (2Н, СН2), 3.69-3.90 м (3Н, СН, СН2), 7.28 д
%: C 46.45; H 6.57; Br 18.36; Cl 7.94; N 3.03; P 6.84.
(2H, СНAr, 3JHH = 8.0 Гц), 7.46 д (2H, СНAr, 3JHH =
C17H28BrClNO3P. Вычислено, %: C 46.33; H 6.40;
8.1 Гц). Спектр ЯМР 31Р (ДМСО-d6): δР 25.08 м. д.
Br 18.13; Cl 8.04; N 3.18; P 7.03.
Диэтил[(4-гидрокси-3-метоксифенил)(ци-
N-[(4-Гидроксифенил)(диэтоксифосфорил)-
клогексиламино)метил]фосфонат
(4г). Выход
метил]циклогексанаминия
хлорид
(5в).
0.69 г (89%). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
Выход 91%, т. пл. 143-145°C. ИК спектр ν, см-1:
0.99-1.19 м (4Н, СН2), 1.16 т (3Н, СН3, 3JHH =
2537, 2476, 2411, 1254, 1036. Спектр ЯМР 1Н
7.1 Гц), 1.31 т (3Н, СН3, 3JHH = 7.1 Гц), 1.52-1.59 м
(ДМСО-d6), δ, м. д.: 0.87 т
(3Н, СН3, 3JHH =
(1Н, СН2), 1.63-1.75 м (3Н, СН2), 1.79-1.95 м (2Н,
7.0 Гц), 1.01 т (3Н, СН3, 3JHH = 7.0 Гц), 1.04-1.20 м
СН2), 2.18 с (3Н, СН3), 2.33-2.42 (1Н, СН), 3.76-
(4Н, СН2), 1.38-1.66 м (5Н, СН2), 1.68-1.82 м (1Н,
3.86 м (1Н, СН2), 3.92-4.00 м (2Н, СН2), 4.08-4.12
СН2), 2.59-2.72 м (1Н, СН), 3.59-3.68 м (2Н, СН2),
м (1Н, СН2), 4.13 д (1H, СН, 2JHР = 21.1 Гц), 6.83-
3.69-3.91 м (3Н, СН, СН2), 7.33 д (2H, СНAr, 3JHH =
6.90 м (1Н, СНAr), 7.00-7.08 м (1Н, СНAr), 7.37 с
8.2 Гц), 7.57 д (2H, СНAr, 3JHH = 8.2 Гц). Спектр
(1Н, СНAr). Спектр ЯМР 31Р (CDCl3): δР 24.35 м. д.
ЯМР 31Р (ДМСО-d6): δР 18.64 м. д. Масс-спектр
N-[(Диэтоксифосфорил)(4-хлорфенил)ме-
(MALDI-TOF): m/z: 343 [M - Сl + H]+, 365 [M -
тил]циклогексанаминия хлорид (5а). К 0.69 г
Сl + Na]+. Найдено, %: C 54.26; H 7.90; Cl 9.25;
N 3.89; P 8.29. C17H29ClNO4P. Вычислено, %: C
(1.74 ммоль) α-аминофосфоната 4а в 10 мл эта-
54.04; H 7.74; Cl 9.38; N 3.71; P 8.20.
нола добавляли 0.5 мл конц. HCl. Смесь переме-
шивали при комнатной температуре 6 ч, затем
N-{(4-Гидрокси-3-метоксифенил)[гидрок-
удаляли растворитель. Остаток промывали 5 мл
си(этокси)фосфорил]метил}циклогексанами-
диэтилового эфира. Выход 0.67 г (98%), белый по-
ния хлорид (5г). Выход 98 %, т. пл. 170-173°C.
рошок, т. пл. 123-124°C. ИК спектр ν, см-1: 2573,
ИК спектр ν, см-1: 2858, 2557, 2459, 1284, 1033.
2491, 2418, 1252, 1032. Спектр ЯМР 1Н (CDCl3), δ,
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.99-1.06 м
м. д.: 0.96-1.07 м (1Н, СН2), 1.07-1.18 м (3Н, СН2),
(2Н, СН2), 1.09 т (3Н, СН3, 3JHH = 7.0 Гц), 1.23-
1.20 т (3Н, СН3, 3JHH = 7.1 Гц), 1.36 т (3Н, СН3,
1.36 м (2Н, СН2), 1.39-1.49 м (1Н, СН2), 1.52-1.61
3JHH = 7.0 Гц), 1.52-1.66 м (2Н, СН2), 1.74-1.86
м (1Н, СН2), 1.69-1.76 м (2Н, СН), 2.09 с (3Н, СН3),
м (3Н, СН2), 1.94-2.05 м (1Н, СН2), 2.45-2.54 м
2.10-2.17 м (2Н, СН2), 2.81-2.88 м (1Н, СН), 3.82-
(1Н, СН), 3.99-4.10 м (1Н, СН2), 4.13-4.23 м (2Н,
3.89 м (2Н, СН2), 4.59 д (1H, СН, 2JHР = 17.3 Гц),
СН2), 4.26-4.37 м (1Н, СН2), 4.64 д (1H, СН, 2JHР =
6.81 д (1H, СНAr, 3JHH = 8.2 Гц), 7.02 д (1H,
19.5 Гц), 7.48 д (2H, СНAr, 3JHH = 8.2 Гц), 7.80 д
СНAr, 3JHH = 8.6 Гц), 7.33 с (1H, СНAr). Спектр
(2H, СНAr, 3JHH = 8.5 Гц). Спектр ЯМР 31Р (CDCl3):
ЯМР 31Р (ДМСО-d6): δР 14.48 м. д. Масс-спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СИНТЕЗ НОВЫХ α-АМИНОФОСФОНАТОВ
983
(MALDI-TOF), m/z: 343 [M - Сl]+, 366 [M - Сl +
Med. Chem. 2019. Vol. 164. P. 47. doi 10.1016/
Na]+, 382 [M - Сl + K]+. Найдено, %: C 50.70; H
j.ejmech.2018.12.038
7.28; Cl 9.43; N 3.87; P 8.01. C16H27ClNO5P. Вычис-
5. Wang Q., Zhu M., Zhu R., Lu L., Yuan C., Xing S., Fu
X., Mei Y., Hang Q. // Eur. J. Med. Chem. 2012. Vol. 49.
лено, %: C 50.60; H 7.17; Cl 9.33; N 3.69; P 8.15.
P. 354. doi 10.1016/j.ejmech.2012.01.03
ИК спектры регистрировали на спектрометре
6. Romero-Estudillo I., Viveros-Ceballos J.L., Cazares-
Bruker Tensor 27 в таблетках KBr. Спектры ЯМР
Carreño O., González-Morales A., de Jesús B.F., López-
1Н записаны на спектрометре Bruker MSL 400
Castillo M., Razo-Hernández R.S., Castañeda-Corral G.,
(400 МГц) относительно сигналов остаточных
Ordóñez M. // Bioorg. Med. Chem. 2019. Vol. 27.
протонов дейтерированного растворителя (CDCl3,
P. 2376. doi 10.1016/j.bmc.2018.12.041
ДМСО-d6). Спектры ЯМР
31Р регистрировали
7. Пудовик А.Н. // Докл. АН СССР. 1952. Т. 83. С. 865.
на приборе Bruker Avance II-400 (161.9 МГц), в
8. Alfonsov V.A. // Phosphorus, Sulfur, Silicon,
качестве внешнего стандарта использовали 85%-
Relat. Elem. 2008. Vol. 183. P. 2637. doi 10.1080/
ную H3PO4. Масс-спектры МАЛДИ снимали на
10426500802344022
масс-спектрометре UltraFlex III TOF/TOF (Bruker
9. Zhao D., Mao L., Yang D., Wang R. // J. Org. Chem.
Daltonik GmbH, Bremen, Germany) в линейном
2010. Vol. 75. P. 6756. doi 10.1021/jo1014917
режиме. Лазер Nd:YAG, λ = 266 нм. Данные об-
10. Jemal A., Bray F., Center M.M., Ferlay J., Ward E.,
Forman D. // CA. Cancer J. Clin. 2011. Vol. 61. P. 69.
рабатывали с помощью программы FlexAnalysis
doi 10.3322/caac.20107
3.0 (Bruker Daltonik GmbH, Bremen, Germany).
11. Черкасов Р.А., Галкин В.И. // Усп. хим. 1998.
Фиксировали положительно заряженные ионы.
Т. 67. С. 940; Cherkasov R.A., Galkin V.I. // Russ.
Использовали металлическую мишень. В качестве
Chem. Rev. 1998. Vol. 67. P. 857. doi 10.1070/
матрицы использовали 2,5-дигидроксибензойную
RC1998v067n10ABEH000421
кислоту. Элементный анализ выполнен на приборе
12. Fields E.K. // J. Am. Chem. Soc. 1952. Vol. 74. P. 1528.
Carlo Erba марки EA 1108. Температуры плавления
doi 10.1021/ja01126a054
определяли в стеклянных капиллярах на приборе
13. Zefirov N.S., Matveeva E.D. // Arkivoc. 2008. Vol. 1.
Stuart SMP 10.
P. 1 doi 10.3998/ark.5550190.0009.101
14. Kaboudin B., Arefi M., Emadi S., Sheikh-Hasani V. //
БЛАГОДАРНОСТЬ
Bioorg. Chem. 2012. Vol. 41. Р. 22. doi 10.1016/
Авторы благодарят Коллективный спектро-
j.bioorg.2012.01.003
аналитический Центр физико-химических иссле-
15. Kaboudin B., Emadi S., Faghihi M.R., Fallahi M.,
дований строения и свойств Федерального иссле-
Sheikh-Hasani V. // J. Enzyme Inhib. Med. Chem. 2013.
довательского центра «Казанский научный центр
Vol. 28. P. 576. doi 10.3109/14756366.2012.663362
РАН» за техническую поддержку проведенных
16. Jiang G., Madan D., Prestwich G.D. // Bioorg. Med.
исследований.
Chem. Lett. 2011. Vol. 21. P. 5098. doi 10.1016/
j.bmcl.2011.03.068
КОНФЛИКТ ИНТЕРЕСОВ
17. Kim I.-H., Park Y.-K., Nishiwaki H., Hammock B.D.,
Авторы заявляют об отсутствии конфликта
Nishi K. // Bioorg. Med. Chem. 2015. Vol. 23. P. 7199.
doi 10.1016/j.bmc.2015.10.016
интересов.
18. Drąg M., Grembecka J., Pawełczak M., Kafarski P. //
СПИСОК ЛИТЕРАТУРЫ
Eur. J. Med. Chem. 2005. Vol. 40. P. 764. doi 10.1016/j.
1. Mucha A., Kafarski P., Berlicki Ł. // J. Med. Chem.
ejmech.2005.02.011
2011. Vol. 54. P. 5955. doi 10.1021/jm200587f
19. Węglarz-Tomczak E., Berlicki Ł., Pawełczak M., Nocek B.,
2. Seto H., Kuzuyama T., Seto H., Kuzuyama T. // Nat.
Joachimiak A., Mucha A. // Eur. J. Med. Chem. 2016.
Prod. Rep. 1999. Vol. 16. P. 589. doi 10.1039/a809398i
Vol. 117. P. 187. doi 10.1016/j.ejmech.2016.04.018
3. Fields S.C. // Tetrahedron. 1999. Vol. 55. P. 12237. doi
20. Shi L., Huang X.-F., Zhu Z.-W., Li H.-Q., Xue J.-Y., Zhu
10.1016/S0040-4020(99)00701-2
H.-L., Liu C.-H. // Aust. J. Chem. 2008. Vol. 61. P. 472.
4. Romanowska J., Kolodziej K., Sobkowski M., Rachwal-
doi 10.1071/CH08029
ak M., Jakubowski T., Golebiewska J., Kraszewski A.,
21. Abdou W.M., Bekheit M.S. // Arab. J. Chem. 2018. Vol. 11.
Boryski J., Dabrowska A., Stawinski J. // Eur. J.
P. 1260. doi 10.1016/j.arabjc.2015.04.014
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
984
СМОЛОБОЧКИН и др.
Synthesis of New α-Aminophosphonates
Based on Cyclohexylamine
A. V. Smolobochkina,*, A. S. Gazizova, K. A. Doszhanovab, A. B. Kuandykovab,
B. Zh. Jiyembayevb, A. R. Burilova, M. A. Pudovika, and R. A. Cherkasovc
a A.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center of the
Russian Academy of Sciences”, Kazan, 420088 Russia
b Kazakh State Women’s Pedagogical University, Almaty, 050000 Kazakhstan
c Kazan Federal University, Kazan, 420008 Russia
* e-mail: smolobochkin@iopc.ru
Received February 19, 2020; revised February 19, 2020; accepted February 28, 2020
A series of new α-aminophosphonates was synthesized based on the acid-catalyzed Kabachnik-Fields reaction
involving diethyl phosphite, cyclohexylamine and substituted benzaldehyde. Structure of the reaction products
was established by IR, NMR spectroscopy, and mass spectrometry methods.
Keywords: α-aminophosphonates, diethyl phosphite, cyclohexylamine, Kabachnik-Fields reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020