ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 987-993
УДК 547.234.1;547.794
СИНТЕЗ ПОТЕНЦИАЛЬНО БИОЛОГИЧЕСКИ
АКТИВНЫХ СОЕДИНЕНИЙ НА ОСНОВЕ АРИЛОКСИ-
И АРИЛАМИНОПРОПАНГИДРАЗИДОВ
© 2020 г. Т. А. Гомкцяна, Р. С. Шаиноваа, А. В. Карапетяна, А. П. Енгояна,b,*
a Исследовательский центр синтеза пестицидов, Национальный аграрный университет Армении,
ул. Теряна 74, Ереван, 0009 Армения
b Российско-Армянский университет, Ереван, 0051 Армения
*e-mail: ayengoyan@mail.ru
Поступило в Редакцию 3 марта 2020 г.
После доработки 3 марта 2020 г.
Принято к печати 10 марта 2020 г.
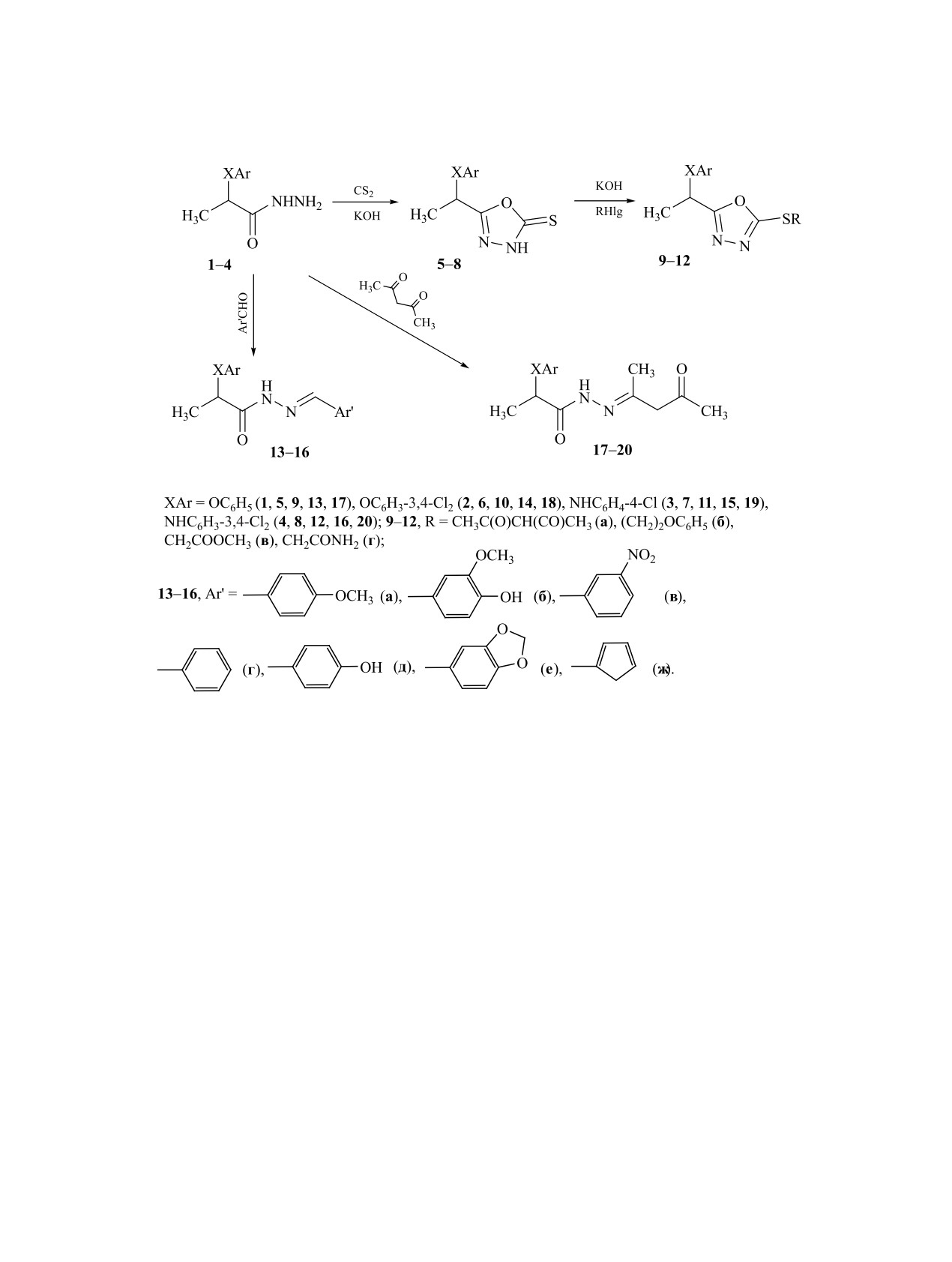
Гетероциклизацией арилокси- и ариламинопропангидразидов при действии сероуглерода и гидроксида
калия с последующим алкилированием образовавшегося 2-тиоксо-1,3,4-оксадиазольного цикла полу-
чены соответствующие S-производные. Взаимодействие исходных гидразидов с арилальдегидами и
пентан-2,4-дионом приводит к N′-арилиден- и N′-(4-оксопентан-2-илиден)производным пропангидра-
зида. При предварительных лабораторных испытаниях полученные соединения проявляли выраженное
стимулирующее действие на рост растений (активность 44-95% по сравнению с гетероауксином).
Ключевые слова: арилоксигидразиды, ариламиногидразиды, 1,3,4-оксадиазол-2(3H)-тион, N′-арил-
иден(4-оксопентан-2-илиден)-2-арилокси(ариламино)пропангидразиды, стимуляторы роста растений
DOI: 10.31857/S0044460X2007001X
Большинство фармацевтических препаратов,
тельной [7], антималярийной [8], противоопухо-
которые имитируют биологически активные при-
левой [9], противосудорожной [10] и антидепрес-
родные вещества, представляют собой гетеро-
сантной [11] активностью. В сельском хозяйстве
циклические соединения. Для получения новых
применяются некоторые производные гидразида,
гетероциклических структур в качестве исходных
в частности, гербициды (бенквинокс, сайджунмао,
соединений часто используются гидразиды и их
феноксиарилгидразиды никотиновой кислоты)
производные, в частности гидразоны. Произво-
[12]. Были обнаружены соединения с ростостиму-
дные гидразина занимают особое место в химио-
лирующей активностью [13-15].
терапии туберкулеза [1]. Гидразид изоникотиновой
С целью получения новых потенциально био-
кислоты используется в медицинской практи-
логически активных соединений нами проведе-
ке более полувека под названием изониазид и не
на реакция 2-арилокси- и 2-(ариламино)пропан-
потерял своего значения до настоящего времени.
гидразидов 1-4 с сероуглеродом и KOH в среде
На его основе были получены фтивазид, салузид,
абсолютного этанола. В результате происходила
метазид и другие модифицированные аналоги с
гетероциклизация гидразидного фрагмента с обра-
улучшенными фармакологическими свойствами.
зованием производных 1,3,4-оксадиазол-2-тиона
В медицинской практике широко используются
5-8 (схема 1, см. таблицу).
антидепрессанты ипрониазид, ниаламид (ингиби-
В спектрах ЯМР 13С соединений 5-8 при
торы моноаминооксидазы) [1]. Продолжаются ис-
177.9 м. д. наблюдаются сигналы sp2-гибридизо-
следования новых производных гидразина, среди
ванного атома углерода С=S, что свидетельствует
которых выявлены соединения с антимикробной
о тионной структуре. В спектрах ЯМР 13С продук-
[2-5], противотуберкулезной [6], противовоспали-
тов алкилирования 9-12 эти сигналы исчезают и
987
988
ГОМКЦЯН и др.
Физико-химические характеристики и стимулирующая рост растений активность соединений 5-20
Выход,
Т. пл.,
Вычислено, %
Найдено, %
Активность, %а
№
Формула
%
oC
C
H
N
C
H
N
50 мг/л
25 мг/л
5
94
80-82
54.04
4.54
12.60
C10H10N2O2S
54.11
4.40
12.33
74
51.4
6
84
Масло
41.25
2.77
9.62
C10H8Cl2N2 O2S
41.14
2.66
9.41
-
79
7
80
162-164
46.97
3.94
16.43
C10H10ClN3OS
46.88
3.89
16.17
76.3
81.1
8
81
108-110
41.39
3.13
14.48
C10H9Cl2N3OS
41.44
3.20
14.62
9a
65
108-110
56.24
5.03
8.74
C15H16N2O4S
56.14
5.12
8.55
9б
63
62-63
63.14
5.30
8.18
C18H18N2O3S
63.01
5.22
7.88
-
51.3
10в
72
Масло
42.99
3.33
7.71
C13H12Cl2N2O4S
42.85
3.28
7.55
10г
75
120-122
41.39
3.18
12.07
C12H11Cl2N3O3S
41.44
3.22
12.28
-
44.9
11б
92
112-114
57.52
4.83
11.18
C18H18ClN3O2S
57.40
4.75
11.32
88.1
56.2
11в
90
85-86
47.64
4.31
12.82
C13H14ClN3O3S
47.71
4.40
12.70
73.0
59.1
11г
83
120-122
46.08
4.19
17.91
C12H13ClN4O2S
46.00
4.05
17.73
59.9
74.9
12в
68
128-130
43.11
3.62
11.60
C13H13Cl2N3O3S
43.20
3.69
11.80
12г
71
133-135
41.51
3.48
16.14
C12H12Cl2N4O2S
41.42
3.44
15.90
-
62.0
13a
95
147-149
68.44
6.08
9.39
C17H18N2O3
68.52
6.13
9.51
43.8
65.6
13б
90
194-196
64.96
5.77
8.91
C17H18N2O4
64.88
5.71
8.73
56.6
44.5
13в
96
166-168
61.34
4.83
13.41
C16H15N3O4
61.21
4.73
13.20
67.2
64.2
14a
91
169-171
55.60
4.39
7.63
C17H16Cl2N2O3
55.49
4.28
7.37
62.2
82.0
14б
87
83-84
53.14
4.46
7.29
C17H17Cl2N2O4
53.01
4.38
7.05
63.5
76.0
14в
75
88-89
50.28
3.43
10.99
C16H13Cl2N3O4
50.17
3.33
10.74
15г
82
218-220
63.68
5.34
13.92
C16H16ClN3O
63.78
5.42
13.80
53.7
75.1
15д
77
223-225
60.48
5.08
13.22
C16H16ClN3O2
60.55
5.17
13.47
-
51.3
15е
75
205-207
59.05
4.66
12.15
C17H16ClN3O3
59.00
4.59
11.89
56.9
77.6
15ж
79
198-200
57.64
4.84
14.40
C14H14ClN3O2
57.49
4.75
14.21
61.2
66.1
16a
76
187-189
55.75
4.68
11.47
C17H17Cl2N3O2
55.64
4.60
11.27
81.0
76.0
16б
83
216-218
53.28
4.73
10.96
C17H17Cl2N3O3
53.12
4.80
10.71
94.8
70.7
16г
83
168-170
57.16
4.50
12.50
C16H15Cl2N3O
57.25
4.59
12.29
71.1
87.2
17
62
152-154
64.11
6.92
10.68
C14H18N2O3
64.01
6.83
10.49
18
65
161-163
50.77
4.87
8.46
C14H16Cl2N2O3
50.67
4.79
8.28
19
62
133-135
56.85
6.13
14.21
C14H18ClN3O2
56.99
6.20
14.45
20
63
136-138
50.92
5.19
12.73
C14H17Cl2N3O2
50.79
5.11
12.62
а В сравнении с гетероауксином, активность которого принимали за 100%.
появляются новые, соответствующие метилено-
Вследствие внутреннего заторможенного вра-
вым группам при атоме S, что указывает на про-
щения вокруг двойной связи С=N (или вследствие
текание реакции по экзоциклическому атому серы
инверсии при атоме азота) молекулы соединений
гетероцикла.
13-20 могут существовать в E- и Z-изомерных
формах. В спектрах ЯМР соединений 13-16 на-
Взаимодействие исходных гидразидов 1-4 с
блюдаются два набора сигналов, соответствующих
различными арилальдегидами в присутствии со-
E- и Z-изомерам, с соотношением интенсивностей
ляной кислоты при комнатной температуре при-
от 1:1 до 7:3. В последнем случае преобладает
водит к N′-арилиден-2-арилокси(амино)пропанги-
пространственно более выгодная Е-форма. В спек-
дразидам 13-16 (схема 1). Реакция гидразидов 1-4
трах ЯМР 1Н и 13С соединений 17-19 резонансные
с пентан-2,4-дионом в среде уксусной кислоты в
сигналы двух изомеров практически совпадают и
присутствии каталитического количества ДМФА
только в спектрах ЯМР соединения 20 химические
при комнатной температуре протекает с образова-
сдвиги сигналов с соотношением интенсивностей
нием N′-(4-оксопентан-2-илиден)-2-арилокси(ами-
1:1, соответствующих E- и Z-изомерам, лишь не-
но)пропангидразидов 17-20 (схема 1).
много различаются.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
СИНТЕЗ ПОТЕНЦИАЛЬНО БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ
989
Схема 1.
При проведении лабораторно-вегетационных
75 MГц соответственно) в смеси растворите-
испытаний практически все полученные соеди-
лей ДМСО-d6-СCl4 (3:1), в качестве внутреннего
нения продемонстрировали стимулирующее дей-
стандарта использовали ТМС. Ход реакций и чи-
ствие на рост растений. Эксперименты проводи-
стоту полученных соединений проверяли мето-
ли на семенах и саженцах фасоли обыкновенной
дом ТСХ на пластинах Silufol UV-254, в качестве
(Phaseolus vulgaris L.). Изучали влияние водных
элюента использовали смесь ацетон-гексан, 2:1.
суспензий соединений 1-14 в концентрациях 25 и
Элементный анализ выполняли на CHNS-анализа-
50 мг/л на жизнеспособность семян, прорастание
торе Eurovector EA3000. Температуры плавления
и рост рассады. Эти данные сравнивали с анало-
определяли капиллярным методом и не корректи-
гичным эффектом растворов гетероауксина тех же
ровали.
концентраций. Активность соединений колеба-
Общая методика синтеза соединений 5-8. К
лась в диапазоне 44-95% по сравнению с гетеро-
смеси 10 ммоль соединения 1-4 и 10 ммоль KOH
ауксином (см. таблицу). Вещества, проявившие в
прибавляли 10 мл абсолютного этанола и 20 ммоль
эксперименте активность выше 70% (5, 7, 11б, 11в,
сероуглерода. Полученную смесь перемешивали
11г, 14a, 14б, 15г, 15е, 16a, 16б, 16г), отобраны для
8-10 ч при 75-80°C, затем упаривали. К остатку
более глубокого исследования и дальнейших поле-
добавляли 20-30 мл воды, подкисляли соляной
вых испытаний.
кислотой до pH = 4. Осадок отфильтровывали,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
промывали водой и сушили.
Спектры ЯМР 1H и 13C снимали при 30°С на
5-(1-Феноксиэтил)-1,3,4-оксадиазол-
спектрометре ЯМР Varian Mercury-300 (300 и
2(3H)-тион (5). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
990
ГОМКЦЯН и др.
1.72 д (3H, CH3, J = 6.6), 5.52 к (1H, OCH, J = 6.6),
C6H3). Спектр ЯМР 13С, δС, м. д.: 18.1, 35.9, 68.4,
6.94-7.33 м (5H, C6H5), 14.30 с (1H, NH).
117.7, 124.3, 126.6, 127.4, 128.3, 129.3, 151.1, 164.5,
5-[1-(3,4-Дихлорфенокси)этил]-1,3,4-окса-
165.0, 167.0.
диазол-2(3H)-тион (6). Спектр ЯМР 1Н, δ, м. д. (J,
Метил-2-{5-[1-(4-хлорфениламино)этил]-
Гц): 1.75 д (3H, CH3, J = 6.5), 5.56 к (1H, OCH, J =
1,3,4-оксадиазол-2-илсульфанил}ацетат
(11в).
6.5), 7.21-7.39 м (3H, C6H3), 14.36 уш. с (1H, NH).
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.61 д (3H, CH3, J =
Спектр ЯМР 13С, δС, м. д.: 17.5, 68.5, 117.7, 124.3,
6.8), 3.70 с (3H, OCH3), 4.07 с (2H, SCH2), 4.77 д. к
126.7, 127.5, 129.3, 151.0, 160.7, 177.9.
(1H, NCH, J1 = 6.8, J2 = 8.2), 6.18 д (1H, NHCH, J =
5-[1-(4-Хлорфениламино)этил]-1,3,4-окса-
8.2), 6.60-7.04 м (4H, C6H4).
диазол-2(3H)-тион (7). Спектр ЯМР 1Н, δ, м. д. (J,
2-{5-[1-(4-Хлорфениламино)этил]-1,3,4-окса-
Гц): 1.58 д (3H, CH3, J = 6.8), 4.62 д. к (1H, NCH,
диазол-2-илсульфанил}ацетамид (11г). Спектр
J1 = 6.8, J2 = 8.2), 6.22 д (1H, NHCH, J = 8.2),
ЯМР 1Н, δ, м. д. (J, Гц): 1.61 д (3H, CH3, J = 6.8),
6.60-7.05 м (4H, C6H4), 11.10 уш. с (1H, NH).
3.97 с (2H, SCH2), 4.77 д. к (1H, NCH, J1 = 6.8, J2 =
5-[1-(3,4-Дихлорфениламино)этил]-1,3,4-
8.2), 6.20 д (1H, NHCH, J = 8.2), 6.60-7.04 м (4H,
оксадиазол-2(3H)-тион (8). Спектр ЯМР 1Н, δ,
C6H4), 7.08 и 7.57 уш. с (2H, NH2).
м. д. (J, Гц): 1.60 д (3H, CH3, J = 6.8), 4.63 д. к. (1H,
Метил-2-{5-[1-(3,4-дихлорфениламино)-
NCH, J1 = 6.8, J2 = 8.2), 6.45 д (1H, NHCH, J = 8.2),
этил]оксадиазол-2-илсульфанил}ацетат
(12в).
6.58-7.15 м (3H, C6H3), 7.20-8.50 уш. с (2H, 2NH).
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.61 д (3H, CH3,
Спектр ЯМР 13С, δС, м. д.: 18.1, 44.3, 112.4, 113.8,
J = 6.9), 3.71 с (3H, OCH3), 4.08 с (2H, SCH2), 4.79
118.5, 129.9, 131.6, 146.3, 163.5, 177.9.
д. к (1H, NCH, J1 = 6.9, J2 = 8.1), 6.46 д (1H, NHCH,
Общая методика синтеза соединений 9a, 10в,
J = 8.1), 6.57-7.16 м (3H, C6H3). Спектр ЯМР 13С,
г, 11в, г, 12в, г. К 10 ммоль калиевой соли соеди-
δС, м. д.: 18.5, 33.3, 44.2, 52.1, 112.2, 113.7, 118.3,
нения 5-8 прибавляли 10 мл ДМФА и при посто-
129.8, 131.5, 146.4, 162.3, 167.0, 168.1.
янном перемешивании при 0°C медленно добавля-
2-{5-[1-(3,4-Дихлорфениламино)этил]-
ли 11 ммоль соответствующего алкилгалогенида.
1,3,4-оксадиазол-2-илсульфанил}ацетамид
Полученную смесь перемешивали 30 мин при 0°C,
(12г). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.61 д (3H,
затем 3 ч при комнатной температуре. На следую-
CH3, J = 6.9), 3.96 с (2H, SCH2), 4.79 д. к (1H,
щий день реакционную смесь перемешивали 12 ч
NCH, J1 = 6.9, J2 = 8.2), 6.47 д (1H, NHCH, J = 8.2),
при 65-70°C, затем упаривали. Осадок обрабаты-
6.56-7.17 м (3H, C6H3), 7.08 уш. с и 7.56 уш. с (2H,
вали водой, отфильтровывали и сушили.
NH2). Спектр ЯМР 13С, δС, м. д.: 18.6, 35.8, 44.2,
3-[5-(1-Феноксиэтил)-1,3,4-оксадиазол-2-ил-
112.3, 113.7, 118.3, 129.9, 131.5, 146.5, 163.4, 167.2,
сульфанил]пентан-2,4-дион
(9а). Спектр ЯМР
167.7.
1Н, δ, м. д. (J, Гц): 1.77 д (3H, CH3, J = 6.6), 2.39 с
(6H, 2CH3), 5.66 к (1H, OCH, J = 6.6), 6.88-7.28 м
Общая методика синтеза соединений 9б, 10б,
(5H, C6H5), 10.40 с (0.6H, OH-eнoл).
11б, 12б. К смеси 10 ммоль калиевой соли соеди-
нения 5-8 и 10 мл ДМФА прибавляли 10 ммоль
Метил-2-{5-[1-(3,4-дихлорфенокси)-
(2-бромэтокси)бензола. Реакционную смесь пере-
этил]-1,3,4-оксадиазол-2-илсульфанил}ацетат
мешивали 8-10 ч при 70-75°C. Раствор упарива-
(10в). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.80 д (3H,
CH3, J = 6.6), 3.74 с (3H, OCH3), 4.12 с (2H, SCH2),
ли, осадок промывали водой, отфильтровывали и
5.72 к (1H, OCH, J = 6.6), 7.21-7.40 м (3H, C6H3).
сушили.
Спектр ЯМР 13С, δС, м. д.: 18.0, 33.3, 52.2, 68.4,
2-(1-Феноксиэтил)-5-[(2-феноксиэтил)суль-
117.6, 124.2, 126.6, 127.4, 128.3, 129.3, 151.0, 163.5,
фанил]-1,3,4-оксадиазол (9б). Спектр ЯМР 1Н, δ,
165.3, 166.9.
м. д. (J, Гц): 1.78 д (3H, CH3, J = 6.6), 3.63 т (2H,
2-{5-[1-(3,4-Дихлорфенокси)этил]-1,3,4-окса-
SCH2, J = 6.8), 4.52 т (2H, OCH2, J = 6.8), 5.65 к
диазол-2-илcульфанил}ацетамид (10г). Спектр
(1H, OCH, J = 6.6), 6.82-7.32 м (10H, C6H5).
ЯМР 1Н, δ, м. д. (J, Гц): 1.79 д (3H, CH3, J = 6.6),
N-(1-{5-[(2-Феноксиэтил)сульфанил]-
3.99 с (2H, SCH2), 5.69 к (1H, OCH, J = 6.6), 7.10
1,3,4-оксадиазол-2-ил}этил)-4-хлоранилин
уш. с и 7.57 уш. с (2H, NH2), 7.20-7.38 м (3H,
(11б). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.62 д (3H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
СИНТЕЗ ПОТЕНЦИАЛЬНО БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ
991
CH3, J = 6.8), 3.58 т (2H, SCH2, J = 6.8), 4.28 т (2H,
(2.1H, CH3, J = 6.6), 3.80 с (3H, OCH3), 4.80 к (0.3H,
OCH2, J = 6.8), 4.78 д. к (1H, NCH, J1 = 6.8, J2 = 8.2),
J = 6.6), 5.58 к (0.7H, OCH, J = 6.6), 6.78-7.65 м
6.17 д (1H, NHCH, J = 8.2), 6.60-7.32 м (9H, C6H5 +
(7H, C6H3 + C6H4), 7.95 с (0.7H, CH=N), 8.25 с
C6H4).
(0.3H, CH=N), 11.27 с (0.3H, NHCO), 11.42 с (0.7H,
Общая методика синтеза соединений 13-16.
NHCO).
К 10 ммоль соединения 1-4 прибавляли 15 мл
N′-(4-Гидрокси-3-метоксибензилиден)-
воды, 15 мл 36%-ной соляной кислоты и 12 ммоль
2-(3,4-дихлорфенокси)пропангидразид
(14б).
соответствующего альдегида. Смесь перемеши-
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.63 д (1.2H, CH3,
вали при комнатной температуре 6 ч и оставляли
J = 6.6), 1.68 д (1.8H, CH3, J = 6.6), 3.82 с (1.8H,
на ночь. На следующий день добавляли 10-15 мл
OCH3), 3.85 с (1.2H, OCH3), 4.85 к (0.4H, OCH, J =
воды, осадок отфильтровывали и сушили.
6.6), 5.58 к (0.6H, OCH, J = 6.6), 6.75-7.40 м (6H,
2C6H3), 7.90 с (0.6H, CH=N), 8.20 с (0.4H, CH=N),
N′-(4-Метоксибензилиден)-2-феноксипро-
9.00 с (1H, OH), 11.27 с (0.4H, NHCO), 11.42 с
пангидразид (13а). Спектр ЯМР 1Н, δ, м. д. (J,
(0.6H, NHCO).
Гц): 1.58 д (1.2H, CH3, J = 6.6), 1.60 д (1.8H, CH3,
J = 6.6), 4.71 к (0.4H, OCH, J = 6.6), 5.56 к (0.6H,
2-(3,4-Дихлорфенокси)-N′-(3-нитробензи-
OCH, J = 6.6), 6.76-7.63 м (9H, C6H5 + C6H4), 7.94 с
лиден)пропангидразид (14в). Спектр ЯМР 1Н,
(0.6H, CH), 8.27 с (0.4H, CH), 11.08 с (0.4H, NHCO),
δ, м. д. (J, Гц): 1.65 д (1.2H, CH3, J = 6.6), 1.70 д
11.31 с (0.6H, NHCO). Спектр ЯМР 13С, δС, м. д.:
(1.8H, CH3, J = 6.6), 4.80 к (0.4H, OCH, J = 6.6),
17.5, 18.3, 54.6, 69.1, 73.4, 113.5, 113.6, 114.2, 115.0,
5.62 к (0.6H, OCH, J = 6.6), 6.80-8.70 м (8H, C6H3,
119.9, 120.7, 126.5, 126.7, 127.9, 128.3, 128.7, 128.9,
C6H4, CH=N), 11.58 с (0.4H, NHCO), 11.80 с (0.6H,
143.4, 147.5, 157.0, 157.5, 160.4, 166.7, 171.3.
NHCO).
N′-(4-Гидрокси-3-метоксибензилиден)-2-фе-
N′-Бензилиден-2-(4-хлорфениламино)про-
ноксипропангидразид (13б). Спектр ЯМР 1Н, δ,
пангидразид (15г). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
м. д. (J, Гц): 1.58 д (1.5H, CH3, J = 6.6), 1.60 д (1.5H,
1.43 д (3H, CH3, J = 6.8), 3.90 м (0.3H, NCH), 4.88
CH3, J = 6.6), 3.83 с (1.5H, OCH3), 3.85 с (1.5H,
м (0.7H, NCH), 5.52 д (0.7H, NHCH, J = 8.2), 5.73
OCH3), 4.72 к (0.5H, OCH, J = 6.6), 5.57 к (0.5H,
д (0.3H, NHCH, J = 8.2), 6.55-7.70 м (9H, C6H5 +
OCH, J = 6.6), 6.75-7.28 м (8H, C6H5 + C6H3), 7.89
C6H4), 8.01 с (0.7H, CH=N), 8.28 с (0.3H, CH=N),
с (0.5H, CH), 8.19 с (0.5H, CH), 8.95 с (0.5H, OH),
11.15 с (0.3H, NHCO), 11.36 (0.7H, NHCO). Спектр
8.96 с (0.5H, OH), 11.05 с (0.5H, NHCO), 11.24 с
ЯМР 13С, δС, м. д.: 17.7, 18.5, 47.9, 51.9, 113.7,
(0.5H, NHCO). Спектр ЯМР 13С, δС, м. д.: 17.4, 18.4,
113.9, 120.1, 120.5, 126.48, 126.51, 126.8, 128.0,
55.26, 55.28, 69.1, 73.3, 108.7, 109.3, 114.2,114.9,
128.1, 128.2, 129.1, 129.2, 134.1, 134.2, 143.5, 146.0,
115.0, 115.1, 120.0, 120.8, 121.1, 122.0, 125.2, 125.3,
146.1, 147.0, 169.8, 174.6.
128.7, 128.9, 144.2, 147.6, 147.7, 148.5, 148.8, 149.0,
N′-(4-Гидроксибензилиден)-2-(4-хлорфенил-
157.1, 157.5, 166.8, 171.2.
амино)пропангидразид (15д). Спектр ЯМР 1Н, δ,
N′-(3-Нитробензилиден)-2-феноксипропан-
м. д. (J, Гц): 1.41 д (3H, CH3, J = 6.8), 3.89 м (0.4H,
гидразид (13в). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
NCH), 4.86 м (0.6H, NCH), 5.50 уш. с (1H, NHCH),
1.60 д (1.5H, CH3, J = 6.6), 1.62 д (1.5H, CH3, J =
6.55-7.52 м (8H, C6H4), 7.90 с (0.6H, CH=N), 8.24
6.6), 4.77 к (0.5H, OCH, J = 6.6), 5.60 к (0.5H, OCH,
с (0.4H, CH=N), 9.44 уш. с (1H, OH), 10.91 с (0.4H,
J = 6.6), 6.78-8.47 м (9H, C6H5 + C6H4), 8.13 с (0.5H,
NHCO), 11.09 с (0.6H, NHCO). Спектр ЯМР 13С,
CH), 8.49 с (0.5H, CH), 11.54 с (0.5H, NHCO), 11.71
δС, м. д.: 17.6, 18.5, 47.8, 51.8, 113.7, 113.9, 115.25,
с (0.5H, NHCO). Спектр ЯМР 13С, δС, м. д.: 17.4,
115.31, 120.0, 120.4, 124.9, 128.0, 128.1, 128.13,
18.2, 69.2, 73.5, 114.3, 115.1, 120.1, 120.9, 121.2,
128.4, 144.0, 146.0, 146.1, 147.4, 159.1, 159.3, 169.3,
123.4, 123.5, 128.7, 128.9, 129.4, 129.5, 131.9, 132.4,
174.1.
135.8, 136.2, 141.1, 145.1, 148.0, 148.1, 157.0, 157.4,
N′-(Бензо[d][1,3]диоксол-5-илметилиден)-
167.4, 171.7.
2-(4-хлорфениламино)пропангидразид
(15е).
2-(3,4-Дихлорфенокси)-N′-(4-метоксибенз-
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.41 д (3H, CH3, J =
илиден) пропангидразид (14а). Спектр ЯМР 1Н,
6.8), 3.90 м (0.3H, NCH), 4.86 м (0.7H, NCH), 5.50
δ, м. д. (J, Гц): 1.65 д (0.9H, CH3, J = 6.6), 1.69 д
уш. с (0.7H, NHCH), 5.71 уш. с (0.3H, NHCH), 6.01
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
992
ГОМКЦЯН и др.
с (2H, OCH2O), 6.57-7.28 м (7H, C6H3 + C6H4), 7.91
Гц): 1.42 д (0.9H, CH3, J = 6.8), 1.43 д (2.1H, CH3,
с (0.7H, CH=N), 8.28 с (0.3H, CH=N), 11.05 с (0.3H,
J = 6.8), 3.92 к (0.3H, NCH, J = 6.8), 4.88 к (0.7H,
NHCO), 11.22 с (0.7H, NHCO). Спектр ЯМР 13С,
NCH, J = 6.8), 5.93 уш. с (0.7H, NHCH), 6.07 уш. с
δС, м. д.: 17.6, 18.5, 47.8, 51.9, 100.9, 104.8, 105.1,
(0.3H, NHCH), 6.50-7.98 м (8H, C6H5 + C6H3), 7.98
107.6, 107.7, 113.7, 113.9, 120.0, 120.4, 122.6, 122.8,
с (0.7H, CH=N), 8.26 с (0.3H, CH=N), 11.21 с (0.3H,
128.10, 128.15, 128.5, 128.6, 143.3, 145.9, 146.1,
NHCO), 11.38 с (0.7H, NHCO). Спектр ЯМР 13С,
146.7, 147.7, 147.8, 148.6, 148.7, 169.6, 174.4.
δС, м. д.: 17.5, 18.3, 47.7, 51.5, 112.1, 112.4, 113.6,
113.7, 117.5, 126.5, 126.8, 127.6, 128.0, 128.1, 128.4,
N′-(Фуран-2-илметилиден)-2-(4-хлорфенил-
129.08, 129.12, 129.2, 129.7, 129.8, 131.4,131.7,
амино)пропангидразид (15ж). Спектр ЯМР 1Н,
134.0,134.2, 143.6, 147.0, 147.2, 147.3, 169.3, 174.1.
δ, м. д. (J, Гц): 1.40 и 1.41 д. д (3H, CH3, J = 6.8),
3.89 м (0.3H, NCH), 4.85 м (0.7H, NCH), 5.50 д
Общая методика синтеза соединений 17-20.
(0.7H, NHCH, J = 8.2), 5.72 д (0.3H, NHCH, J = 8.2),
К раствору 10 ммоль гидразида 1-4 в 10 мл уксус-
6.47-7.60 м (7H, 3H-фуран + C6H4), 7.90 с (0.7H,
ной кислоты при 0°C прибавляли 10 ммоль пен-
CH=N), 8.26 с (0.3H, CH=N), 11.15 с (0.3H, NHCO),
тан-2,4-диона и 3 капли ДМФА. Перемешивали
11.30 с (0.7H, NHCO). Спектр ЯМР 13С, δС, м. д.:
реакционную смесь 6 ч при 80°С, затем оставляли
17.6, 18.4, 47.7, 51.9, 111.27, 111.34, 111.50, 111.53,
на ночь и на следующий день добавляли 20-30 мл
113.7, 113.8, 120.0, 120.4, 128.07, 128.10, 133.3,
ледяной воды. Выпавший осадок отфильтровыва-
137.1, 143.5, 143.7, 145.9, 146.0, 149.4, 149.6, 169.8,
ли, промывали водой и сушили.
174.5.
N′-(4-Оксопентан-2-илиден)-2-феноксипро-
2-(3,4-Дихлорфениламино)-N′-(4-метокси-
пангидразид (17). Спектр ЯМР 1Н, δ, м. д. (J, Гц):
бензилиден)пропангидразид (16а). Спектр ЯМР
1.50 д (3H, CH3, J = 6.6), 1.80 с (3H, N=CCH3),
1Н, δ, м. д. (J, Гц): 1.42 д (0.9H, CH3, J = 6.8), 1.43
2.08 с (3H, COCH3), 2.80 д и 2.86 д (2H, CH2, J =
д (2.1H, CH3, J = 6.8), 3.82 с (0.9H, OCH3), 3.83 с
18.4), 5.38 к (1H, OCH, J = 6.6), 6.22 с (1H, NHCO),
(2.1H, OCH3), 3.92 м (0.3H, NCH), 4.86 м (0.7H,
6.73-7.28 м (5H, C6H5).
NCH), 5.91 уш. с (0.7H, NHCH), 6.05 уш. с (0.3H,
2-(3,4-Дихлорфенокси)-N′-(4-оксопентан-
NHCH), 6.50-7.65 м (7H, C6H3 + C6H4), 7.95 с
2-илиден)пропангидразид (18). Спектр ЯМР 1Н,
(0.7H, CH=N), 8.20 с (0.3H, CH=N), 11.06 с (0.3H,
δ, м. д. (J, Гц): 1.47 д (3H, CH3, J = 6.6), 1.79 с (3H,
NHCO), 11.22 с (0.7H, NHCO). Спектр ЯМР 13С,
N=CCH3), 2.08 с (3H, COCH3), 2.80 д и 2.86 д (2H,
δС, м. д.: 17.4, 18.3, 47.6, 51.4, 54.59, 54.61, 112.1,
CH2, J = 18.4), 5.35 к (1H, OCH, J = 6.6), 6.20 с (1H,
112.4, 113.5, 113.6, 117.4, 117.5, 126.6, 126.7, 127.9,
NHCO), 6.62-7.21 м (3H, C6H3).
128.2, 129.7, 129.8, 131.4, 143.4, 146.8, 147.3, 160.4,
N′-(4-Оксопентан-2-илиден)- 2-(4-хлорфени-
160.5, 168.9, 173.8.
ламино)пропангидразид (19). Спектр ЯМР 1Н,
N′-(4-Гидрокси-3-метоксибензилиден)-
δ, м. д. (J, Гц): 1.32 д (3H, OCH, J = 6.7), 1.75 с
2-(3,4-дихлорфениламино)пропангидразид
(3H, N=CCH3), 2.06 с (3H, COCH3), 2.79 д и 2.86
(16б). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.42 д (0.9H,
д (2H, CH2, J = 18.5), 4.65 м (1H, NCH), 5.42 уш. с
CH3, J = 6.8), 1.43 д (2.1H, CH3, J = 6.8), 3.86 с
(1H, NH), 5.92 уш. с (1H, NHCO), 6.48-7.05 м (4H,
(0.9H, OCH3), 3.87 с (2.1H, OCH3), 3.91 к (0.3H,
C6H4). Спектр ЯМР 13С, δС, м. д.: 15.7, 17.1, 26.1,
J = 6.8, NCH), 4.87 к (0.7H, J = 6.8, NCH), 5.98 уш. с
49.2, 51.5, 90.4, 113.5, 113.7, 119.9, 128.0, 146.0,
(1H, NHCH), 6.50-7.32 м (6H, C6H3 + C6H3), 7.88 с
153.6, 170.8.
(0.7H, CH=N), 8.12 с (0.3H, CH=N), 8.93 уш. с (1H,
2-(3,4-Дихлорфениламино)-N′-(4-оксопен-
OH), 11.01 с (0.3H, NHCO), 11.15 с (0.7H, NHCO).
тан-2-илиден)пропангидразид (20). Спектр ЯМР
Спектр ЯМР 13С, δС, м. д.: 17.4, 18.4, 47.6, 51.5,
1Н, δ, м. д. (J, Гц): 1.33 д (1.5H, CH3, J = 6.7), 1.34
55.3, 108.8, 109.5, 112.3, 112.5, 113.5, 113.7, 114.9,
с (1.5H, CH3), 1.76 с (1.5H, N=CCH3), 1.78 с (1.5H,
115.2, 117.5, 117.9, 121.1, 122.1, 125.3, 129.8, 129.9,
N=CCH3), 2.07 с (3H, COCH3), 2.80 д и 2.88 д (2H,
131.5, 144.3, 147.2, 147.4, 147.6, 147.7, 147.8, 148.8,
CH2, J = 18.4), 4.63 д. к (0.5H, NCH, J1 = 8.7, J2 =
149.0, 169.1, 173.8.
6.7), 4.67 д. к (0.5H, NCH, J1 = 8.7, J2 = 6.7), 5.84
N′-Бензилиден-2-(3,4-дихлорфениламино)-
д (1H, NHCH, J = 8.7), 5.95 с (0.5H, NHCO), 6.00
пропангидразид (16г). Спектр ЯМР 1Н, δ, м. д. (J,
с (0.5H, NHCO), 6.47-7.15 м (3H, C6H3). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
СИНТЕЗ ПОТЕНЦИАЛЬНО БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ
993
ЯМР 13С, δС, м. д.: 15.7, 16.9, 17.5, 25.7, 26.0, 49.1,
8. Gemma S., Kukreja G., Fattorusso C., Persico M.,
49.3, 51.6, 90.5, 112.1, 113.4, 113.7, 129.66, 129.70,
Romano M., Altarelli M., Savini L., Campiani G.,
131.36, 131.4, 147.2, 147.3, 153.8, 153.9, 170.4,
Fattorusso E., Basilico N. // Bioorg. Med. Chem. Lett.
2006. Vol. 16. P. 5384. doi 10.1016/j.bmcl.2006.07.060
170.8.
9. Gursoy E., Guzeldemirci-Ulusoy N. // Eur. J.
КОНФЛИКТ ИНТЕРЕСОВ
Med. Chem. 2007. Vol. 42. P. 320. doi 10.1016/j.
ejmech.2006.10.012
Авторы заявляют об отсутствии конфликта
10. Ragavendran J., Sriram D., Patel S., Reddy I.,
интересов
Bharathwajan N., Stables J., Yogeeswari P. // Eur.
СПИСОК ЛИТЕРАТУРЫ
J. Med. Chem. 2007. Vol. 42. P. 146. doi 10.1016/j.
ejmech.2006.08.010
1. Машковский М.Д. Лекарственные средства. М.:
11. Ergenc N., Gunay N.S. // Eur. J. Med. Chem. 1998.
Новая волна. 2019.
Vol. 33. P. 143. doi 10.1016/S0223-5234(98)80039-1
2. Masunari A., Tavaris L.C. // Bioorg. Med. Chem. 2007.
Vol. 15. P. 4229. doi 10.1016/j.bmc.2007.03.068
html.
3. Loncle C., Brunel J., Vidal N., Dherbomez M.,
Letourneux Y. // Eur. J. Med. Chem. 2004. Vol. 39.
13. Гомкцян Т.А., Карапетян А.В., Абраамян Л.Г., Енго-
P. 1067. doi 10.1016/j.ejmech.2004.07.005
ян А.П. // Хим. ж. Армении 2012. Т. 65. №3. С. 342.
4. Kucukguzel S. G., Mazi A., Sahin F., Ozturk S.,
14. Енгоян А.П., Гомкцян Т.A., Карапетян A.В., Шаино-
Stables J.P. // Eur. J. Med. Chem. 2003. Vol. 38. P. 1005.
ва Р.С. // Хим. ж. Армении. 2017. Т. 70. № 1-2.
doi 10.1016/j.ejmech.2003.08.004
С. 199.
5. Vicini P., Zani F., Cozzini P., Doytchinova I. // Eur. J.
15. Пивазян В.А., Казарян Э.А., Азарян Ж.А., Енго-
Med. Chem. 2002. Vol. 37. P. 553. doi 10.1016/S0223-
ян А.П. // ЖОХ 2019. Т. 89. Вып. 10. С. 1511; Piva-
5234(02)01378-8
zyan V.A., Kazaryan E.A., Azaryan Zh.A., Yengoyan A.P. //
6. Bijev A. // Lett. Drug Des. Discovery 2006. Vol. 3.
Russ. J. Gen. Chem. 2019. Vol. 89. N 10. P. 2010. doi
P. 506.
10.1134/S1070363219100050
7. Todeschini A.R., Miranda A.L., Silva C.M., Parrini S.C.,
16. Shainova R.S., Gomktsyan T.A., Karapetyan A.V.,
Barreiro E.J. // Eur. J. Med. Chem. 1998. Vol. 33.
Yengoyan A.P. // J. Chem. Res. 2019. Vol. 43. N 9-10.
P. 189. doi 10.1016/S0223-5234(98)80008-1
P. 352. doi 10.1177/1747519819866402
Synthesis of Potentially Biologically Active Compounds Based
on Aryloxy- and Arylaminopropanehydrazides
T. A. Gomktsyana, R. S. Shainovaa, A. V. Karapetyana, and A. P. Yengoyana,b,*
a Pesticides Synthesis Research Center, National Agrarian University of Armenia, Yerevan, 0009 Armenia
b Russian-Armenian University, Yerevan, 0051 Armenia
*e-mail: ayengoyan@mail.ru
Received March 3, 2020; revised March 3, 2020; accepted March 10, 2020
The synthesis of new derivatives based on a number of aryloxy and arylaminopropanhydrazides was carried out.
By their heterocyclization under the action of carbon disulfide and potassium hydroxide and subsequent alkyla-
tion of the resulting 2-thioxo-1,3,4-oxadiazole ring, the corresponding S-substituted products were obtained.
The reaction of the starting hydrazides with arylaldehydes and pentane-2,4-dione afforded their N′-arylidene and
N′-(4-oxopentan-2-ylidene) derivatives. In preliminary laboratory tests, the synthesized compounds showed a
pronounced stimulating effect on plant growth. Their activity was 44-95% compared with heteroauxin.
Keywords: aryloxyhydrazides, arylaminohydrazides, N′-arylidene(4-oxopentane-2-ylidene)-2-aryloxy(amino)-
propanehydrazides, 1,3,4-oxadiazole-2(3H)-thione, plant growth stimulators
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020