ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 999-1003
УДК 547.873;547.833
РЕНТГЕНОСТРУКТУРНЫЕ ИССЛЕДОВАНИЯ В РЯДУ
4-АРИЛ-1-ДИ- И
4-АРИЛ-1-ТРИХЛОРМЕТИЛИЗОХИНОЛИНОВ И ИХ
1,2,4-ТРИАЗИНОВЫХ ПРЕДШЕСТВЕННИКОВ
© 2020 г. П. А. Слепухинa,b, И. Л. Никоновa,b, Д. С. Копчукa,b, И. С. Ковалевb,
Г. В. Зыряновa,b,*, В. Л. Русиновa,b, О. Н. Чупахинa,b
a Институт органического синтеза Уральского отделения Российской академии наук,
ул. С. Ковалевской 22, Екатеринбург, 620990 Россия
b Уральский федеральный университет, Екатеринбург, 620002 Россия
*e-mail: gvzyryanov@gmail.com
Поступило в Редакцию 20 февраля 2020 г.
После доработки 20 февраля 2020 г.
Принято к печати 27 февраля 2020 г.
Методом рентгеноструктурного анализа исследована структура двух 4-арил-1-трихлорметилизохино-
линов, а также 3-дихлорметил-6-фенил-1,2,4-триазина (синтетического прекурсора соответствующего
изохинолина). Показано влияние природы заместителей в составе данных гетероциклов на их кристал-
лическую структуру. Продемонстрировано влияние акцепторных ди- и трихлорметильных групп на
характер межмолекулярных взаимодействий, реализуемых в кристаллах.
Ключевые слова: 1-трихлорметилизохинолины, 3-дихлорметил-1,2,4-триазины, рентгеноструктурный
анализ
DOI: 10.31857/S0044460X20070033
Хлорметилзамещенные изохинолины и их бен-
описаны лишь немногочисленные примеры рент-
заннелированные аналоги проявляют разнообраз-
геноструктурного анализа
1,10-фенантролинов
ную биологическую активность [1, 2] и находят
[6, 7], хинолинов [8, 9], 1,8-нафтиридинов [10],
применение в качестве синтонов для органическо-
1H-пиразоло[3,4-b]пиридинов [11], тиазоло[4,5-b]-
го синтеза, в частности, при получении бензими-
пиридинов [11], а также пиридинов [12], имеющих
дазолов [3].
ди- или трихлорметильную группу в α-положении.
При этом результаты РСА соединений изохиноли-
Недавно нами был предложен эффективный
нового или 1,2,4-триазинового рядов с такими за-
метод синтеза 4-арилизохинолинов 2а-в [4], име-
местителями в литературе к настоящему времени
ющих в положении С1 ди- или трихлорметиль-
не представлены.
ную группу, на основе соответствующих легко-
доступных [5] 3-дихлорметил- и 3-трихлорме-
Согласно полученным данным,
4-арил-1-
тил-6-арил-1,2,4-триазинов 2 путем их взаимодей-
трихлорметилизохинолины
2a, б кристаллизу-
ствия с 1,2-дегидробензолом (схема 1). В данной
ются в центросимметричной пространственной
работе мы приводим результаты рентгенострук-
группе моноклинной системы (табл. 1). Молекула
турного исследования двух продуктов данной
соединения 2а (рис. 1) неплоская. Фенильный за-
реакции - изохинолинов 2a, б, имеющих в поло-
меститель развернут под углом 56° относительно
жении С1 трихлорметильную группу, а также од-
плоскости гетероцикла. Атом Cl3 трихлорметиль-
ного из исходных 1,2,4-триазинов 1в с дихлор-
ной группы располагается в синперипланарной
метильной группой в положении С3. Необходимо
конформации относительно атома азота гетеро-
отметить, что к настоящему времени в литературе
цикла. При этом вследствие эффектов сопряжения
999
1000
СЛЕПУХИН и др.
Схема 1.
с гетероциклом длина связи С2-Сl3 оказывается
ям длин одинарных связей между Сsp2-атомами, в
несколько короче остальных связей С-Сl (табл. 2).
то время как длины прочих связей в гетероцикле
Длины связей C-N гетероцикла демонстрируют
существенно короче. Такое распределение длин
асимметрию, указывающую на нарушение аро-
связей типично для конденсированных систем
матичности кольца. Длины связей с участием уз-
нафталинового типа вообще и для производных
ловых атомов гетероцикла С4А и С8А находятся в
изохинолина в частности [13]. Существенно уко-
пределах 1.415-1.445 Å, приближаясь к значени-
роченные межмолекулярные контакты в кристалле
Таблица 1. Основные кристаллографические параметры соединений 1в, 2а и 2б
Параметр
1в
2a
2б
CCDC
1983550
1921318
1983551
Формула
C10H7Cl2N3
C16H10Cl3N
C17H12Cl3NO
М
240.08
322.60
352.63
T, K
295(2)
295(2)
295(2)
Сингония
Моноклинная
Моноклинная
Моноклинная
Пространственная группа
P21/c
P21/n
P21/n
a, Å
7.0229(3)
5.9097(2)
11.5784(12)
b, Å
12.4343(6)
19.0627(7)
7.1405(4)
c, Å
24.0299(11)
12.8598(5)
19.139(2)
β, град
90.728(4)
93.515(4)
101.027(9)
V, Å3
2098.24(17)
1445.98(9)
1553.1(2)
Z
8
4
4
dвыч, г/см3
1.520
1.482
1.508
μ, мм-1
0.585
0.621
0.590
F(000)
976.0
656.0
720
Размеры кристалла, мм
0.23×0.1×0.02
0.25×0.2×0.15
0.25×0.20×0.15
Углы рассеяния, град
6.06-61.84
6.34-61.74
3.05-56.58
Индексы отражений
-8 ≤ h ≤ 9
-7 ≤ h ≤ 8
-15 < h < 15
-17 ≤ k ≤ 12
-27 ≤ k ≤ 20
-9 < k < 5
–34 ≤ l ≤ 33
-18 ≤ l ≤ 14
-25 < l < 14
Отражений собрано
10875
7176
6797
Независимых отражений
5381
3943
3751
(Rint = 0.0323)
(Rint = 0.0178)
(Rint = 0.0283)
Данных/ограничений/
5381/0/287
3943/0/181
3751/0/200
параметров
GooF по F2
1.000
1.027
1.001
R-Факторы [I≥2σ(I)]
R1 = 0.0495
R1 = 0.0476
R1 = 0.0344
wR2 = 0.0733
wR2 = 0.1497
wR2 = 0.0693
R-Факторы по всем отражениям
R1 = 0.1135
R1 = 0.0656
R1 = 0.0734
wR2 = 0.0908
wR2 = 0.1704
wR2 = 0.0723
Остаточная электронная плотность (min/max), e/A3
0.23/-0.23
0.76/-0.64
0.235/-0.335
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
РЕНТГЕНОСТРУКТУРНЫЕ ИССЛЕДОВАНИЯ
1001
Рис. 1. Общий вид молекулы соединения 2a в
Рис. 2. Общий вид молекулы соединения 2б в
кристалле
кристалле.
отсутствуют, за исключением контакта С5–H5···N2
нию его плотности по сравнению с соединением
[x-0.5, 0.5-y, z-0.5] (на 0.092 Å меньше суммы ра-
2a, даже несмотря на уменьшение массовой доли
диусов Ван-дер-Ваальса). Впрочем, не слишком
атомов хлора.
высокое качество кристалла и достаточно большие
Рентгеноструктурный
анализ
исходного
значения пиков остаточной электронной плотно-
3-дихлорметил-6-фенил-1,2,4-триазина
1в выя-
сти не позволяют надежно локализовать атомы во-
вил, что две кристаллографически независимые
дорода молекулы и точно оценить параметры дан-
молекулы кристаллизуются в центросимментрич-
ной водородной связи. Таким образом, главную
ной пространственной группе (табл. 1). Основ-
роль в молекулярной укладке кристаллов данного
ные геометрические параметры (длины связей и
соединения играют неспецифические ван-дер-ва-
валентные углы) молекул близки между собой и
альсовы взаимодействия.
соответствуют ожидаемым (табл. 3). Общий вид и
Основные геометрические параметры молеку-
нумерация атомов одной из молекул показаны на
лы соединения 2б (рис. 2) в целом соответствуют
рис. 4. Обе молекулы неплоские. У обеих молекул
таковым для молекулы соединения 2a. В част-
протон дихлорметильной группы располагается
ности, длины связей C-Cl данных соединений
перипланарно к плоскости триазина, в син-кон-
совпадают в пределах погрешности измерения
фигурации к атому N2. Длины связей С-Сl прак-
[1.768(2), 1.775(2) и 1.789(2) Å], при этом самой
тически неразличимы. Фенильный заместитель
короткой оказывается связь C-Cl, располагающая-
развернут на 16.7 и 12.7° относительно плоскости
ся в плоскости гетероцикла. 4-Meтоксифенильный
триазина (для первой и второй молекулы соответ-
заместитель развернут относительно плоскости
ственно).
гетероцикла под углом 65°, что несколько больше
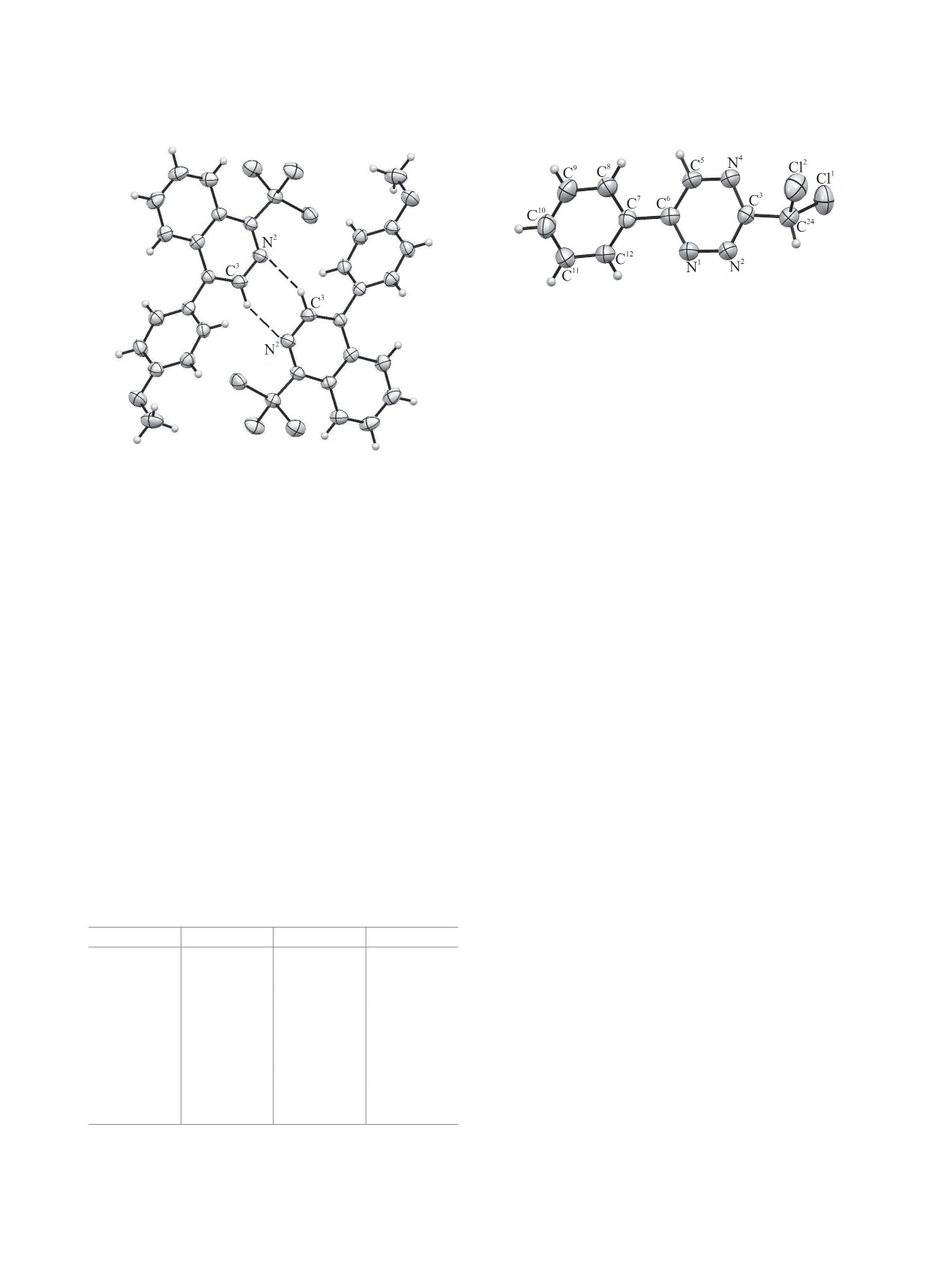
Основные различия между молекулами касают-
соответствующей величины для соединения 2a.
ся характера межмолекулярных контактов. Первая
Неводородные атомы МеО-группы лежат прак-
молекула образует укороченные межмолекулярные
тически в плоскости фенильного заместителя.
контакты с атомами хлора двух соседних молекул
В кристалле соединения также наблюдаются во-
дородные связи CH···N типа, хотя и иной геоме-
Таблица 2. Избранные длины связей в молекулах
трии. В результате взаимодействия C3H3···N1 [-x,
соединений 2a, б
2-y, -z] с расстоянием H···N 2.629 Å (на 0.121 Å
Связь
d, Å
Связь
d, Å
меньше суммы ван-дер-ваальсовых радиусов) об-
2а
2б
разуются димеры с копланарным расположением
C2-Cl1
1.777(2)
Cl1-C2
1.7748(19)
гетероциклических колец (рис. 3). Другой заслу-
C2-Cl2
1.782(2)
C2-Cl2
1.7889(18)
C2-Cl3
1.770(2)
C2-Cl3
1.7683(19)
живающий внимания контакт - связь Cl3···Cl1
C1-N2
1.296(3)
C1-N2
1.308(2)
[0.5-x, y-0.5, 0.5-z] 3.367 Å. Очевидно, реализация
C3-N2
1.355(3)
N2-C3
1.359(2)
большего количества тесных контактов в кристал-
C1-C2
1.529(3)
C1-C2
1.527(2)
ле соединения 2б приводит к некоторому увеличе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1002
СЛЕПУХИН и др.
Рис. 4. Общий вид молекулы соединения 1в в
кристалле.
плоскости (100), а внутри- и межслоевое связыва-
ние осуществляется галогенными и водородными
связями. При этом ярко выраженные π-π-контакты
между ароматическими кольцами в кристалле от-
сутствуют.
Рис. 3. Межмолекулярные контакты в кристалле
Таким образом, полученные данные по структу-
соединения 2б.
ре 4-арил-1-трихлорметилизохинолинов 2a, б слу-
жат примером взаимного влияния заместителей и
(галогенные связи N2···Cl2A [1-x, 1-y, 1-z] 3.169 Å,
гетероциклического ядра на их структуру и демон-
на 0.131 Å меньше суммы радиусов Ван-дер-Ва-
стрируют важное влияние акцепторных полихлор-
альса, и N2···Cl1A [2-x, 1-y, 1-z] 3.230 Å, на
метильных групп на характер межмолекулярных
0.070 Å меньше суммы радиусов Ван-дер-Ваальса
взаимодействий, реализуемых в кристалле. Более
[14]), направленные приблизительно по осям свя-
того, кристаллическая структура изученного заме-
зей С-Cl. Для второй молекулы важнейшими яв-
щенного 1,2,4-триазина 1в определяется возмож-
ляются укороченные межмолекулярные контакты
ностью образования СAr-Н водородных связей и
С5АН5А···N4 [2-x, -y, 1-z] по типу димерной водо-
галогенных связей с участием дихлорметильной
родной связи c расстоянием С5A···N4А 3.427(3) Å,
группы.
N4A···H5A 2.630, угол С5АН5АN4 142°. Большое
значение угла межмолекулярного контакта свя-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
зано с тем, что молекулы не лежат в одной пло-
Результаты исследований зарегистрированы в
скости. Плоскости триазиновых колец в димерах
Кембриджском банке структурных данных под но-
смещены друг относительно друга на расстояние
мерами CCDC 1983550, 1983551, 2010412.
1.349 Å. В результате формируется стопочно-слое-
1,2,4-Триазины 1а-в [5] и изохинолины 2а-в
вая упаковка, в которой плоскости ароматических
[4] были синтезированы по описанным методикам.
колец молекул ориентируются приблизительно в
Рентгеноструктурный анализ осуществлен
Таблица
3. Избранные длины связей в молекуле
на автоматическом дифрактометре Xcalibur 3 по
соединения 1в
стандартной процедуре (МоK-излучение, графи-
Связь
d, Å
Связь
d, Å
товый монохроматор, ω-сканирование с шагом 1°
Cl1-C24
1.768(2)
Cl1A-C13A
1.775(2)
при 295(2) K). Введена эмпирическая поправка
Cl2-C24
1.771(2)
Cl2A-C13A
1.768(2)
на поглощение. С использованием программного
N1-N2
1.341(3)
N1A-N2A
1.347(3)
пакета Olex2 [15], структура решена по програм-
N1-C6
1.334(3)
N1A-C6A
1.328(3)
ме SHELXS прямым методом и уточнена по про-
N2-C3
1.321(3)
N2A-C(3A
1.321(3)
грамме SHELXL [16] полноматричным МНК по F2
N4-C3
1.335(3)
N4A-C3A
1.337(3)
в анизотропном приближении для неводородных
N4-C5
1.309(3)
N4A-C5A
1.317(3)
атомов. Атомы водорода локализованы по пикам
C3-C24
1.495(3)
C3A-C13A
1.497(3)
пространственной электронной плотности и вклю-
C5-C6
1.401(3)
C5A-C6A
1.399(3)
чены в уточнение в модели наездника. Для визу-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
РЕНТГЕНОСТРУКТУРНЫЕ ИССЛЕДОВАНИЯ
1003
ализации структуры и анализа межмолекулярных
С. 1243; Kozhevnikov D.N., Kataeva N.N., Rusinov V.L.,
взаимодействий использована программа Mercury
Chupakhin O.N. // Russ. Chem. Bull. 2004. Vol. 53.
P. 1295. doi 10.1023/B:RUCB.0000042289.07168.8f
[13].
6. Fen H.-K., Chantrapromma S., Maity A.C., Goswami S. //
ФОНДОВАЯ ПОДДЕРЖКА
Acta Crystallogr. (E). 2010. Vol. 66. P. o424. doi
10.1107/S1600536810002035
Работа выполнена при финансовой поддерж-
7. Xie M.-H., Liu Y.-L., Zou P., He Y.-J., Huang B. // Acta
ке Российского научного фонда (грант № 18-13-
Crystallogr. (E). 2010. Vol. 66. P. o5. doi 10.1107/
00365).
S1600536809051071
8. Sopková-de Oliveira Santos J., Verhaeghe P.,
КОНФЛИКТ ИНТЕРЕСОВ
Lohier J.-F., Rathelot P., Vanelle P., Rault S. // Acta
Crystallogr. (C). 2008. Vol. 64. P. o441. doi 10.1107/
Авторы заявляют об отсутствии конфликта
S0108270108020374
интересов.
9. Kaluski Z., Golankiewicz K. // Bull. Acad. Pol. Sci. Ser.
Sci. Chim. 1965. Vol. 13. P. 93.
СПИСОК ЛИТЕРАТУРЫ
10. Fun H.-K., Chantrapromma S., Maity A.C., Goswami S. //
1. Primas N., Suzanne P., Verhaeghe P., Hutter S., Kieffer C.,
Acta Crystallogr. (E). 2010. Vol. 66. P. o622. doi
Laget M., Cohen A., Broggi J., Lancelot J.-C., Les-
10.1107/S1600536810005234
nard A., Dallemagne P., Rathelot P., Rault S., Vanelle P.,
11. Iaroshenko V.O., Mkrtchyan S., Ghazaryan G.,
Azas N. // Eur. J. Med. Chem. 2014. Vol. 83. P. 26. doi
Hakobyan A., Maalik A., Supe L., Villinger A.,
10.1016/j.ejmech.2014.06.014
Tolmachev A., Ostrovskyi D., Sosnovskikh V.Ya.,
2. Song W., Wan M., Li S., Zhang L., Wang X., Jia Z. Pat.
Ghochikyan T.V., Langer P. // Synthesis. 2011. P. 469.
CN 108727397 A (2018).
doi 10.1055/s-0030-1258364
3. Zhou Y., Wu C., Dong X., Qu J. // J. Org. Chem. 2016.
12. Сипягин А.М., Алиев З.Г. // ХГС. 1993. № 11. С. 1495;
Vol. 81. P. 5202. doi 10.1021/acs.joc.6b00885
Sipyagin A.M., Aliev Z.G. // Chem. Heterocycl. Compd.
4. Никонов И.Л., Слепухин П.А., Копчук Д.С., Кова-
1993. Vol. 29. N 11. Р. 1287. doi 10.1007/BF00532026
лев И.С., Зырянов Г.В., Суворова А.И., Ельцов О.С.,
13. Mercury CSD, ver. 3.10.3, release 2018.
Русинов В.Л., Чупахин О.Н. // ХГС. 2019. Т. 55.
14. Bondi A. // J. Phys. Chem. 1964. Vol. 68. P. 441. doi
№ 11. С. 1124; Nikonov I.L., Slepukhin P.A., Kop-
10.1021/j100785a001
chuk D.S., Kovalev I.S., Zyryanov G.V., Suvorova A.I.,
15. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Eltsov O.S., Rusinov V.L., Chupakhin O.N. // Chem.
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Heterocycl. Compds. 2019. Vol. 55. N 11. P. 1124. doi
Vol. 42. P. 339. doi 10.1107/S0021889808042726
10.1007/s10593-019-02588-1
5. Кожевников Д.Н., Катаева Н.Н., Русинов В.Л.,
16. Sheldrick G.M. // Acta Cryst. 2008. Vol. 64. P. 112. doi
Чупахин О.Н. // Изв. АН. Cер. хим. 2004. № 6.
10.1107/S0108767307043930
X-Ray Diffraction Structural Studies in the Series
of 4-Aryl-1-di- and 4-Aryl-1-trichloromethylisoquinolines
and Their 1,2,4-Triazine Precursors
P. A. Slepukhina,b, I. L. Nikonova,b, D. S. Kopchuka,b, I. S. Kovalevb, G. V. Zyryanova,b,*,
V. L. Rusinova,b, and O. N. Chupakhina,b
a I.Ya. Postovsky Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences, Yekaterinburg, 620990 Russia
b Ural Federal University, Yekaterinburg, 620002 Russia
*e-mail: gvzyryanov@gmail.com
Received February 20, 2020; revised February 20, 2020; accepted February 27, 2020
Structure of two 4-aryl-1-trichloromethylisoquinolines, as well as 3-dichloromethyl-6-phenyl-1,2,4-triazine (a
synthetic precursor of the corresponding isoquinolines), was studied by single crystal X-ray diffraction analysis.
The effect of the nature of substituents in the heterocycles on their crystal structure was shown. The effect of
acceptor di- and trichloromethyl groups on the nature of intermolecular interactions realized in crystals was
demonstrated.
Keywords: 1-trichloromethylisoquinolines, 3-dichloromethyl-1,2,4-triazines, X-ray diffraction analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020