ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 1004-1009
УДК 547.785.5
РЕАКЦИИ 4,5-ДИМЕТИЛИМИДАЗОЛ-2-
ТИОНА И БЕНЗИМИДАЗОЛ-2-ТИОНА С
ДИАЛКИЛХЛОРЭТИНФОСФОНАТАМИ В
ПРИСУТСТВИИ КАРБОНАТА КАЛИЯ
© 2020 г. А. А. Бабушкинаa,*, Д. М. Егоровa, Д. Д. Карцевb,
Ю. Л. Питерскаяa, В. С. Завгороднийa
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: babushkina.nastya@yandex.ru
Поступило в Редакцию 7 марта 2020 г.
После доработки 7 марта 2020 г.
Принято к печати 15 марта 2020 г.
Взаимодействие диалкилхлорэтинфосфонатов с замещенными имидазол-2-тионами и бензимида-
зол-2-тионом в среде безводного ацетонитрила протекает селективно с образованием алкенфосфонатов.
Проведение реакции в аналогичных условиях с использованием эквимолярного количества безводного
K2CO3 неожиданно приводит к образованию конденсированных циклических фосфонатов, а именно
диалкил-{5,6-диметил(бензо)имидазо[2,1-b]тиазол-3-ил}фосфонатов с высокими выходами.
Ключевые слова: диалкилхлорэтинфосфонат, имидазо[2,1-b]тиазол, фосфорилирование, 1,3-тиазо-
ло[3,2-a]бензимидазол
DOI: 10.31857/S0044460X20070045
Многие гетероциклические соединения облада-
к различным активным центрам головного мозга
ют высокой биологической активностью, что обу-
[6, 7]. Модификация данных гетероциклических
словливает их широкое применение в качестве ба-
структур фосфонатным фрагментом может рас-
зовых структур для создания новых лекарственных
ширить спектр их биологической активности [8],
препаратов. Имидазольное и бензимидазольное
а также увеличить их гидрофильность, тем самым
ядра являются одними из основных фармакофор-
увеличивая растворимость в воде.
ных структур, модификации которых в послед-
Существуют несколько методов получения
нее время уделяется большое внимание. Одним
имидазо[2,1-b]тиазолов и [1,3]тиазоло[3,2-a]бенз-
из направлений подобной модификации является
имидазолов. Наиболее распространенным являет-
получение на их основе конденсированных тиазо-
ся взаимодействие имидазол-2-тионов с α-галоген-
лиевых производных. Замещенные имидазо[2,1-b]-
кетонами (α-галогенальдегидами) с последующей
тиазолы и [1,3]тиазоло[3,2-a]бензимидазолы про-
дегидратацией [9, 10]. В последнее время все чаще
являют широкий спектр биологической активно-
прибегают к синтезу подобных структур взаимо-
сти: противогельминтной [1], противогрибковой
действием имидазол-2-тионов с ацетиленовыми
[2], антибактериальной [2], противоопухолевой
производными. В качестве катализаторов высту-
[3, 4], жаропонижающей [4, 5] и иммуномодули-
пают соединения меди или палладия [11-13].
рующей [4]. Кроме того, некоторые соединения
Ранее в ходе систематических исследований
этого ряда обладают выраженным действием на
нами были изучены реакции диалкилхлорэтин-
высшую нервную деятельность за счет сродства
фосфонатов с имидазол-2-тионами [14-16] и бен-
1004
РЕАКЦИИ 4,5-ДИМЕТИЛИМИДАЗОЛ-2-ТИОНА
1005
Схема 1.
Схема 2.
зимидазол-2-тионом [17]. Было установлено, что
В настоящей работе изучено взаимодействие
реакции проходят преимущественно с образова-
далкилхлорэтинфосфонатов 1а-в с 4,5-димети-
нием продуктов двойного присоединения - линей-
лимидазол-2-тионом 2а и бензимидазол-2-тионом
2б в абсолютном ацетонитриле в присутствии
ных алкенфосфонатов (схема 1).
эквмолярного количества K2CO3 при комнатной
Реакции
1-замещенных бензимидазол-2-тио-
температуре. Установлено, что реакции протека-
нов с диалкилхлорэтинфосфонатами протекают с
ют хемо- и региоселективно с образованием ди-
другой хемонаправленностью в аналогичных ус-
алкил-(5,6-диметил-5,6-дигидроимидазо[2,1-b]-
ловиях [17], приводя к образованию циклических
тиазол-3-ил)фосфонатов 3а-в и диалкилбензо[4,5]-
диалкоксифосфорил-(9Н-бензо[4,5]имидазо[2,1-b]-
имидазо[2,1-b]тиазол-3-илфосфонатов 3г-е соот-
тиазол-3-ил-4-ия) хлоридов (схема 2).
ветственно (схема 3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1006
БАБУШКИНА и др.
Схема 3.
Химический сдвиг ядра фосфора полученных
КССВ, 2JCP = 19.0-19.7 Гц. В самом слабом поле
соединений находится в интервале от -0.26 до
(147.32-156.95 м. д.) регистрируется дублетный
6.25 м. д. (см. таблицу). В спектрах ЯМР 1H со-
сигнал малой интенсивности с КССВ 3JCP = 11.3-
единений 3а-е присутствует дублетный сигнал
11.9 Гц, относящийся к атому углерода фрагмента
протона второго положения ароматической си-
SC=N. Стоит отметить, что константа 3JCP не на-
стемы с химическим сдвигом в интервале от 7.49
блюдалась в спектрах линейных алкенфосфонатов
до 7.71 м. д. и характерной для циклических со-
[18].
единений константой спин-спинового взаимодей-
Образование конденсированной системы так-
ствия с ядром фосфора 3JHP = 7.3-7.4 Гц. Наибо-
же подтверждают данные гетероядерной кор-
лее информативны для доказательства строения
реляционной спектроскопии 1H-15N HMBC. На
полученных соединений спектры ЯМР 13С. Так,
атомы углерода тиазольного кольца резонируют
примере соединения 3в было установлено, что
дублетными сигналами в области 120.63-123.61 м.
сигналы атомов азота N1 и N2 регистрируются
д. с большой КССВ с ядром фосфора 1JCP = 214.2-
в областях 233.94 и 199.42 м. д. соответственно.
220.8 Гц и при 124.75-126.33 м. д. с меньшей
Причем наблюдается взаимодействие только одно-
Основные параметры спектров ЯМР 1Н, 13С, 31Р соединений 3а-е
δH, м. д. (J, Гц)
δC, м. д. (J, Гц)
№
δР, м. д.
РС=СН
РС=СН
РС=СН
N=CS
3а
7.71
121.69
126.04
156.98
5.63
(3JHP = 7.4)
(1JCP = 216.2)
(2JCP = 19.2)
(3JCP = 11.9)
3б
7.71
123.24
125.59
156.95
2.24
(3JHP = 7.3)
(1JCP = 214.2)
(2JCP = 19.0)
(3JCP = 11.3)
3в
7.68
122.30
124.75
156.80
-0.26
(3JHP = 7.3)
(1JCP = 220.8)
(2JCP = 19.2)
(3JCP = 11.3)
3г
7.49
120.63
126.78
147.32
6.25
(3JHP = 7.3)
(1JCP = 218.9)
(2JCP = 19.5)
(3JCP = 11.6)
3д
7.59
122.14
126.33
147.60
3.52
(3JHP = 7.4)
(1JCP = 216.6)
(2JCP = 19.6)
(3JCP = 11.3)
3е
7.52
123.61
125.62
147.61
0.87
(3JHP = 7.4)
(1JCP = 216.0)
(2JCP = 19.7)
(3JCP = 11.4)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
РЕАКЦИИ 4,5-ДИМЕТИЛИМИДАЗОЛ-2-ТИОНА
1007
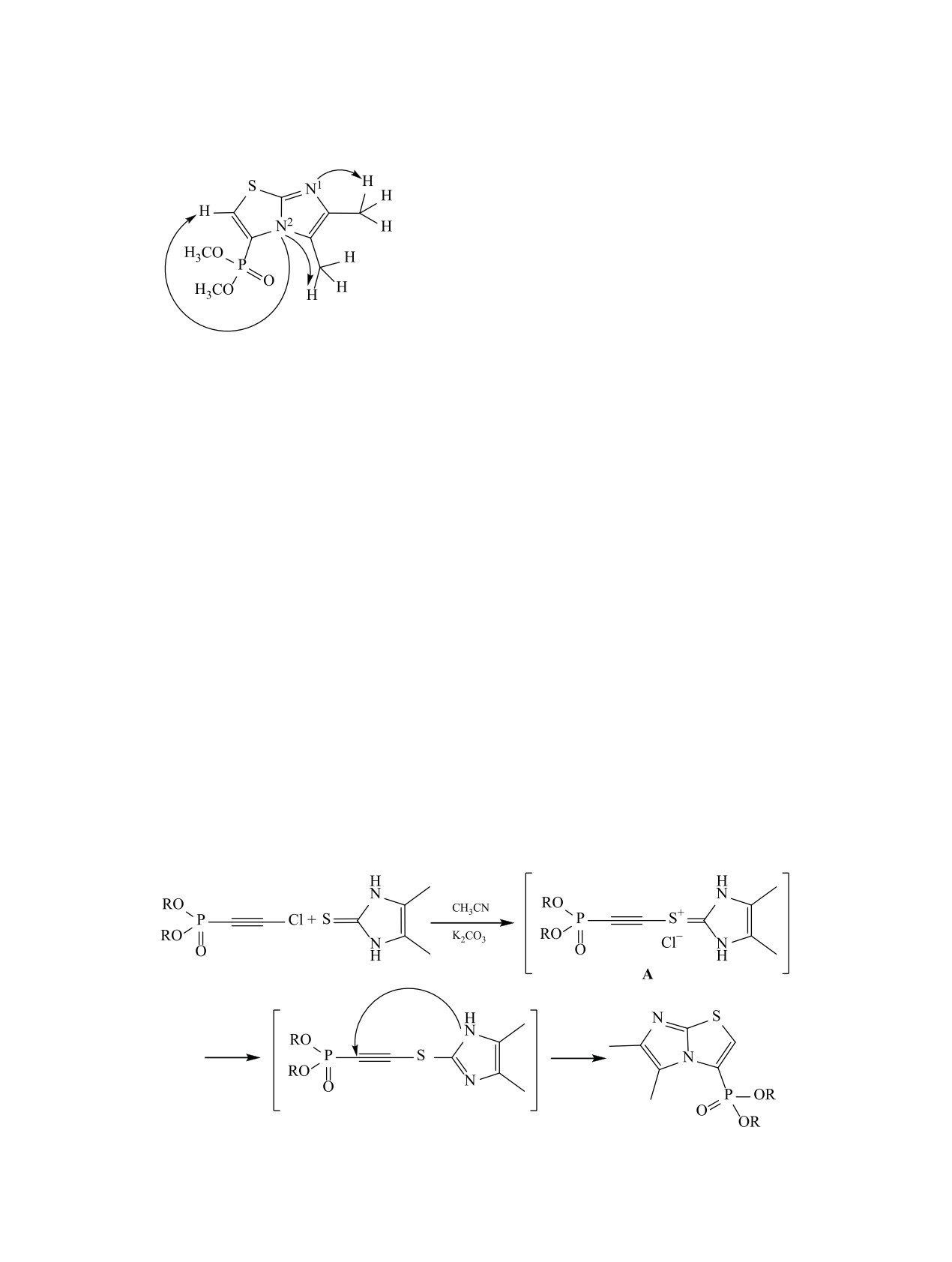
дазол-2-тионом в присутствии эквимолярного
Схема 4.
количества безводного K2CO3 приводит к образо-
ванию новых диалкил-{5,6-диметил(бензо)имида-
зо[2,1-b]тиазол-3-ил}фосфонатов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н, 13С, 31Р сняты на спектроме-
тре Bruker Avance III HD 400 NanoBay на частотах
400.17 (1H), 100.62 (13C) и 161.98 МГц (31P).
Общая методика получения соединений
3а-е. Смесь 0.001 моль соответствующего ди-
го атома азота N2 с протоном тиазольного цикла H1
алкилхлорэтинфосфоната
1a-в,
0.001
моль
(схема 4). Следует отметить, что подобные взаимо-
4,5-диметилимидазол-2-тиона 2a или бензимида-
действия не наблюдались в случае ранее исследо-
зол-2-тиона 2б и 0.0012 моль карбоната калия в
ванных продуктов линейного строения.
10 мл абсолютного ацетонитрила перемешивали
Нами предложен вероятный механизм протека-
при комнатной температуре в течение 7-10 ч. Ход
ния реакций в присутствии карбоната калия в ка-
реакции контролировали методом ЯМР 31P. После
честве основания (схема 5). Вероятно, на первом
завершения реакции осадок отфильтровывали,
этапе происходит взаимодействие диалкилхлорэ-
из фильтрата удаляли растворитель, полученный
тинфосфоната с атомом серы имидазол-2-тиона
остаток перекристаллизовывали из этилового
(бензимидазол-2-тиона), приводящее к образова-
спирта.
нию соответствующего сульфениевого катиона A,
стабилизация которого происходит путем отще-
Диметилбензо[4,5]имидазо[2,1-b]тиазол-
пления хлористого водорода. K2CO3 выступает в
3-илфосфонат (3а). Выход 81%, бесцветные кри-
роли акцептора выделяющегося хлористого водо-
сталлы, т. пл. 117-118°С. Спектр ЯМР 1H (CDCl3),
рода. На следующей стадии протекает внутримо-
δ, м. д.: 3.92 д (6H, POCH3, 3JНP =11.6 Гц), 7.34 м (1H,
лекулярная 5-эндо-диг-циклизация, приводящая к
Hбенз), 7.43 м (1H, Hбенз), 7.71 д (1H, CH=CP, 3JHP =
образованию целевых продуктов. В соответствии
7.4 Гц), 7.84 м (1H, Hбенз), 8.08 м (1H, Hбенз). Спектр
с правилом Болдуина [19], данный тип циклизаций
ЯМР 13C (CDCl3), δС, м. д.: 53.72 д (POCH3, 2JCP =
является выгодным с энергетической точки зрения
5.2 Гц), 112.29 (Cбенз), 119.39 (Cбенз), 121.69 д
и проходит с высокой скоростью.
(РС=СH, 1JCP = 216.2 Гц), 121.76 (Cбенз), 123.92
Таким образом, показано, что взаимодействие
(Cбенз), 126.04 д (РС=СH, 2JCP = 19.2 Гц), 130.00
диалкилхлорэтинфосфонатов с
4,5-диметили-
(CбензN), 148.34 (CбензN), 156.98 д (N=CS, 3JCP =
мидазол-2-тионом и незамещенным бензими-
11.9 Гц). Спектр ЯМР 31Р (CDCl3): δР 5.63 м. д.
Схема 5.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1008
БАБУШКИНА и др.
Диэтилбензо[4,5]имидазо[2,1-b]тиазол-3-ил-
3JHH = 7.1 Гц), 7.59 д (1H, CH=CP, 3JHP = 7.4 Гц).
фосфонат (3б). Выход 79%, бесцветные кристал-
Спектр ЯМР 13C (CDCl3), δС, м. д.: 9.78 (CH3C=N),
лы, т. пл. 112°С. Спектр ЯМР 1H (CDCl3), δ, м. д.:
13.51 (CH3C=N),
16.23 д (POCH2CH3, 3JCP =
1.37 т (6H, POCH2CH3, 3JHH = 7.1 Гц), 4.19-4.26 д.
6.5 Гц), 63.34 д (POCH2CH3, 2JCP = 5.4 Гц), 119.86
к (2H, POCH2CH3, 3JHP = 9.4, 3JHH = 7.3 Гц), 4.36
(CH3C-N), 122.14 д (РС=СH, 1JCP = 216.6 Гц),
д. к (2H, POCH2CH3, 3JHP = 9.4, 3JHH = 7.7 Гц),
126.33 д (РС=СH, 2JCP = 19.6 Гц), 140.56 (CH3C-N),
7.34 м (1H, Hбенз), 7.44 м (1H, Hбенз), 7.71 д (1H,
147.60 д (N=CS, 3JCP = 11.3 Гц). Спектр ЯМР 31Р
CH=CP, 3JHP = 7.3 Гц), 7.84 м (1H, Hбенз), 8.15 м
(CDCl3): δР 3.52 м. д.
(1H, Hбенз). Спектр ЯМР 13C (CDCl3), δС, м. д.:
Диизопропил-(5,6-диметил-5,6-дигидрои-
16.26 д (POCH2CH3, 3JCP = 6.4 Гц), 63.80 д (POCH2,
мидазо[2,1-b]тиазол-3-ил)фосфонат (3е). Выход
2JCP = 5.2 Гц), 112.69 (Cбенз), 119.08 (Cбенз), 121.77
92%, бесцветные кристаллы, т. пл. 145-146°С.
(Cбенз), 123.24 д (РС=СH, 1JCP = 214.2 Гц), 125.59
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.21 д [6H,
д (РС=СH, 2JCP = 19.0 Гц), 129.90 (CбензN), 147.60
POCH(CH3)2, 3JHH = 6.2], 1.34 д [6H, POCH(CH3)2,
(CбензN), 156.95 д (N=CS, 3JCP = 11.3 Гц). Спектр
3JHH = 6.2 Гц], 2.21 с (3H, CH3C-N), 2.44 с (3H,
ЯМР 31Р (CDCl3): δР 2.24 м. д.
CH3C-N), 4.73 д. септетов [2H, POCH(CH3)2, 3JHP =
Диизопропилбензо[4,5]имидазо[2,1-b]ти-
7.8, 3JHH = 6.2 Гц), 7.52 д (1H, CH=CP, 3JHP = 7.4 Гц).
азол-3-илфосфонат (3в). Выход 87%, бесцвет-
Спектр ЯМР 13C (CDCl3), δ, м. д.: 9.91 (CH3C-N),
ные кристаллы, т. пл. 110-111°С. Спектр ЯМР 1H
13.48 (CH3C-N), 23.65 д [POCH(CH3)2, 3JCP =
(CDCl3), δ, м. д.: 1.21 д [6H, POCH(CH3)2, 3JHH =
5.1 Гц], 24.02 д [POCH(CH3)2, 3JCP = 4.2 Гц], 72.70
6.2 Гц], 1.47 д [6H, POCH(CH3)2, 3JHH = 6.2 Гц],
д [POCH(CH3)2, 2JCP = 5.5 Гц], 119.81 (CH3C-N),
4.87 д. септетов [2H, POCH(CH3)2, 3JHP = 7.4 Гц,
123.61 д (РС=СH, 1JCP = 216.0 Гц), 125.62 д
3JHH = 6.2 Гц], 7.34 м (1H, Hбенз), 7.42 м (1H, Hбенз),
(РС=СH, 2JCP = 19.7 Гц), 140.40 (CH3C-N), 147.61 д
7.68 д (1H, CH=CP, 3JHP = 7.3 Гц), 7.83 м (1H, Hбенз),
(N=CS, 3JCP = 11.4 Гц). Спектр ЯМР 31Р (CDCl3): δР
8.16 м (1H, Hбенз). Спектр ЯМР 13C (CDCl3), δC,
0.87 м. д.
м. д.: 23.67 д [6H, POCH(CH3)2, 3JCP = 4.7 Гц],
ФОНДОВАЯ ПОДДЕРЖКА
24.14 д [6H, POCH(CH3)2, 3JCP = 4.7 Гц], 73.26 д
[2H, POCH(CH3)2, 2JCP = 5.4 Гц), 112.97 (Cбенз),
Работа выполнена в рамках базовой части го-
119.20 (Cбенз), 121.34 (Cбенз),
122.30 д (РС=СH,
сударственного задания Министерства науки и
1JCP = 220.8 Гц), 123.77 (Cбенз), 124.75 д (РС=СH,
высшего образования (№ 785.00.Х6019) с исполь-
2JCP = 19.2 Гц), 130.02 (CбензN), 148.29 (CбензN),
зованием оборудования Инжинирингового центра
156.80 д (N=CS, 3JCP = 11.3 Гц). Спектр ЯМР 31Р
Санкт-Петербургского государственного техноло-
(CDCl3): δР -0.26 м. д.
гического института при финансовой поддержке
Российского фонда фундаментальных исследова-
Диметил-(5,6-диметил-5,6-дигидроимида-
ний (грант № 18-33-00430).
зо[2,1-b]тиазол-3-ил)фосфонат (3г). Выход 88%,
бесцветные кристаллы, т. пл. 153-154°С. Спектр
КОНФЛИКТ ИНТЕРЕСОВ
ЯМР 1H (CDCl3), δ, м. д.: 2.12 с (3H, CH3C=N), 2.30
Авторы заявляют об отсутствии конфликта
с (3H, CH3C=N), 3.71 д (6H, POCH3, 3JНP = 11.5 Гц),
интересов.
7.49 д (1H, CH=CP, 3JHP = 7.4 Гц). Спектр ЯМР 13C
(CDCl3), δ, м. д.: 9.45 (CH3C=N), 13.34 (CH3C=N),
СПИСОК ЛИТЕРАТУРЫ
53.35 д (POCH3, 2JCP = 5.7 Гц), 119.72 (CH3C-N),
1. Raeymaekers A.H.M., Allewijn F.T.N., Demoen P.J.A.,
120.63 д (РС=СH, 1JCP = 218.9 Гц), 126.78 д
Van Offenwert T.T.T., Janssen P.A.J. // J. Med. Chem.
(РС=СH, 2JCP = 19.5 Гц), 140.42 (CH3C=N), 147.32 д
1966. Vol. 9. P. 545. doi 10.1021/jm00322a023
(N=CS, 3JCP = 11.6 Гц). Спектр ЯМР 31Р (CDCl3): δР
2. Güzeldemirci N.U., Küҫükbasmacı Ö. // Eur. J.
6.25 м. д.
Med. Chem. 2010. Vol. 45. P. 63. doi 10.1016/j.
ejmech.2009.09.024
Диэтил-(5,6-диметил-5,6-дигидроимида-
3. Ali A.R., El-Bendary E.R., Ghaly M.A., Shehata I.A. //
зо[2,1-b]тиазол-3-ил)фосфонат (3д). Выход 82%,
Eur. J. Med. Chem. 2014. Vol. 75. P. 492. doi 10.1016/j.
бесцветные кристаллы, т. пл. 157-158°С. Спектр
ejmech.2013.12.010
ЯМР 1H (CDCl3), δ, м. д.: 1.35 т (6H, POCH2CH3,
4. Abdel-Aziz H.A., Gamal-Eldeen A.M., Hamdy N.A.,
3JHH = 7.1), 2.27 с
(3H, CH3C=N), 2.47 с (3H,
Fakhr I.M.I. // Arch. Pharm. Chem. Life Sci. 2009.
CH3C=N), 4.20 д. к (4H, POCH2CH3, 3JНP = 7.4,
Vol. 342. P. 230. doi 10.1002/ardp.200800189
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
РЕАКЦИИ 4,5-ДИМЕТИЛИМИДАЗОЛ-2-ТИОНА
1009
5.
Lantos I., Bender P.E., Razgaitis K.A., Sutton B.M.,
13. Xia Y., Kuang J., Yang A., Zhang H., Su C., Lee D. //
DiMartino M.J., Griswold D.E // J. Med. Chem. 1984.
Chem. Commun. 2019. P. 1. doi 10.1039/c8cc09122f.
Vol. 27. P. 72. doi 10.1021/jm00367a014
14. Egorov D.M., Piterskaya Y.L., Dogadina A.V.,
6.
Knӧpfel T. // Br. J. Pharmacol. 2007. Vol. 151. P. 723.
Svintsitskaya N.I. // Tetrahedron Lett. 2015. Vol. 56.
doi 10.1038/sj.bjp.0707289
P. 1552. doi 10.1016/j.tetlet.2015.02.027
7.
Jin J., Wang Y., Shi D., Wang F., Davis R.S., Jin Q.,
15. Егоров Д.M., Питерская Ю.Л., Догадина A.В. //
Fu W., Foley J.J., Webb E.F., Dehaas C.J., Berlanga M.,
ЖОХ. 2015. Т. 85. Вып. 2. С. 333; Egorov D.M., Piter-
Burman M., Sarau H.M., Morrow D.M., Rao P., Kal-
skaya Y.L., Dogadina A.V. // Russ. J. Gen. Chem. 2015.
lal L.A., Moore M.L., Rivero R.A., Palovich M., Sal-
Vol. 85. N 2. P. 502. doi 10.1134/s1070363215020255
mon M., Belmonte K.E., Busch-Petersen J. // J. Med.
16. Егоров Д.М., Бабушкина А.А., Питерская Ю.Л., До-
Chem. 2008. Vol. 51. P. 4866. doi 10.1021/jm800634k
8.
Dang, Q., Brown, B.S., Liu, Y., Rydzewski, R.M.,
гадина А.В. // ЖОХ. 2020. Т. 90. Вып. 6. С. 975.
Robinson, E.D., Poelje, P.D. van, Erion, M.D. // J. Med.
17. Егоров Д.М., Питерская Ю.Л., Миронов В.Ф., Дога-
Chem. 2009. Vol. 52. P. 2880. doi 10.1021/jm900078f
дина А.В. // ЖОХ. 2015. Т. 85. Вып. 9. С. 1564; Ego-
9.
Beresneva, T., Belyakov, S., Abele, E., Lukevics, E. //
rov D.M., Piterskaya Yu.L., Mironov V.F., Dogadina A.V. //
Chem. Heterocycl. Compd. 2011.Vol. 46. P. 1400. doi
Russ. J. Gen. Chem. 2015. Vol. 85. N 9. P. 2203. doi
10.1007/s10593-011-0678-3
10.1134/S1070363215090273
10.
Roussel, C., Andreoli, F., Roman, M., Hristova, M.,
18. Егоров Д.М., Питерская Ю.Л., Карцев Д.Д., Полуке-
Vanthuyne, N. // Molecules. 2005. Vol. 10. P. 327. doi
ев В.А., Кривчун М.Н., Догадина А.В. // ЖОХ. 2018.
10.3390/10020327
Т. 88. Вып. 9. С. 1478; Egorov D.M., Piterskaya Yu.L.,
11.
Veltri L., Mancuso R., Altomare A., Gabriele B. //
Kartsev D.D., Polukeev V.A., Krivchun M.N., Dogadi-
ChemCatChem. 2015. Vol. 7. P. 2206. doi 10.1002/
na A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 9.
cctc.201500213.
P. 1824. doi 10.1134/S1070363218090104
12.
Jana S., Chakraborty A., Shirinian V.Z., Hajra A. //
Adv. Synth. Catal. 2018. Vol. 360. P. 2402. doi 10.1002/
19. Baldwin J.E. // J. Chem. Soc. 1976.Vol. 18. P. 705. doi
adsc.201800393
10.1039/c39760000734
Reactions of 4,5-Dimethylimidazole-2-thione
and Benzimidazole-2-thione with Dialkyl
Chloroethynylphosphonates in the Presence
of Potassium Carbonate
A. A. Babushkinaa,*, D. M. Egorova, D. D. Kartsevb, Yu. L. Piterskayaa, and V. S. Zavgorodniia
a St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: babushkina.nastya@yandex.ru
Received March 7, 2020; revised March 7, 2020; accepted March 15, 2020
The reactions of dialkyl chloroethynylphosphonates with substituted imidazole-2-thiones and benzimidazole-2-
thione in anhydrous acetonitrile occurs selectively with the formation of alkenephosphonates. Similar reactions
in the presence of an equimolar amount of anhydrous K2CO3 unexpectedly leads to the formation of fused cyclic
phosphonates, namely dialkyl {5,6-dimethyl(benzo)imidazo[2,1-b]thiazol-3-yl}phosphonates in high yields.
Keywords: dialkyl chloroethynylphosphonate, imidazo[2,1-b]thiazole, phosphorylation, 1,3-thiazolo[3,2-a]-
benzimidazole
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020