ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 1026-1032
УДК 547.831.3;547.814
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА 3-АЦИЛ-
6,8,8,9-ТЕТРАМЕТИЛ-8,9-ДИ(6,7,8,9-ТЕТРА)ГИДРО-2H-
ПИРАНО[3,2-g]ХИНОЛИН-2-ОНОВ
© 2020 г. А. Ю. Потапов*, Д. Ю. Вандышев, Я. Рефки, И. В. Леденева, О. В. Овчинников,
М. С. Смирнов, Х. С. Шихалиев
Воронежский государственный университет, Университетская пл. 1, Воронеж, 394006 Россия
*e-mail: pistones@mail.ru
Поступило в Редакцию 3 марта 2020 г.
После доработки 3 марта 2020 г.
Принято к печати 10 марта 2020 г.
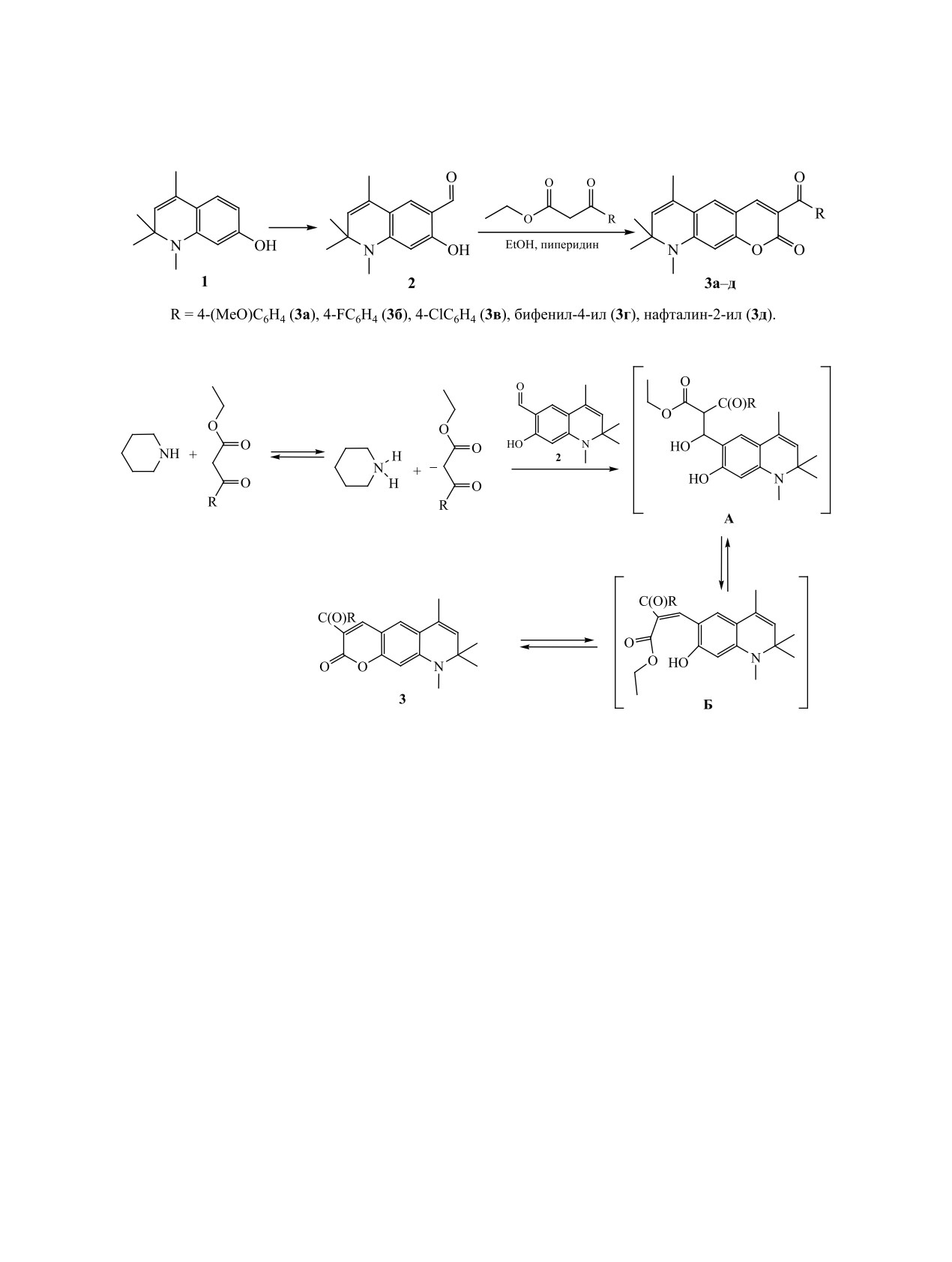
Конденсацией 7-гидрокси-1,2,2,4-тетраметил-1,2-ди(1,2,3,4-тетра)гидрохинолин-6-карбальдегидов с
ароилуксусными эфирами синтезирован ряд 3-ацил-6,8,8,9-тетраметил-2H-пирано[3,2-g]хинолин-2-онов
различной степени гидрированности. Исследована зависимость спектров поглощения и фотолюминес-
ценции от структуры полученных соединений.
Ключевые слова: люминесценция, конденсация Кнёвенагеля, 1,2,2,4-тетраметил-1,2-дигидрохино-
лин-7-ол, 3-ацил-6,8,8,9-тетраметил-8,9-дигидро(6,7,8,9-тетрагидро)-2H-пирано[3,2-g]хинолин-2-он
DOI: 10.31857/S0044460X20070070
Разработка новых органических красителей
Нами разработан синтез новых кумариновых
с заданными характеристиками люминесценции
красителей на основе доступных 1,2,2,4-тетра-
(высокий квантовый выход, значительный стоксов
метилхинолин-7-олов различной степени гидри-
сдвиг, полуширина полосы излучения, фотоста-
рованности. Формилирование по Вильсмейеру-
бильность люминесценции и т. п.) крайне актуаль-
Хааку
1,2,2,4-тетраметил-1,2-дигидрохинолин-7-
на для решения задач люминесцентной сенсорики
ола 1 протекает с образованием исключительно
в различных приложениях. Значительный стоксов
7-гидрокси-1,2,2,4-тетраметил-1,2-дигидро-
сдвиг полосы люминесценции относительно поло-
хинолин-6-карбальдегида
2
[22]. Конденсация
сы поглощения определяет высокий уровень цве-
Кнёвенагеля с использованием комбинации са-
тового контраста при нанесении люминесцентных
меток и визуализации биообъектов [1, 2]. Управ-
лицилового альдегида и метиленактивных кар-
ление указанными параметрами возможно преи-
бонильных соединений приводит к кумаринам
мущественно на уровне молекулярного дизайна
(2H-хромен-2-онам) [23-26].
красителей.
В тандемной конденсации
7-гидрокси-
Многие известные яркие фотостабильные флу-
1,2,2,4-тетраметил-1,2-дигидрохинолин-6-кар-
оресцентные красители имеют в своей структуре
бальдегида 2 мы использовали различные ароил-
кумариновый флуорофорный фрагмент
[3-16].
уксусные эфиры. Наилучшие результаты получе-
К соединениям этого ряда относятся 2H-пира-
ны при кипячении эквимольной смеси реагентов
но[3,2-g]хинолин-2-оны, предложенные в качестве
в спирте в присутствии каталитических коли-
красителей с большими стоксовыми сдвигами для
честв пиперидина. С применением данной мето-
биологической флуоресцентной оптической ми-
кроскопии высокого разрешения и эффективных
дики синтезирован ряд
3-ацил-6,8,8,9-тетраме-
фотосенсибилизаторов для солнечных элементов
тил-8,9-дигидро-2H-пирано[3,2-g]хинолин-2-онов
[17-21].
3a-д с выходами 69-89% (схема 1).
1026
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1027
Схема 1.
Схема 2.
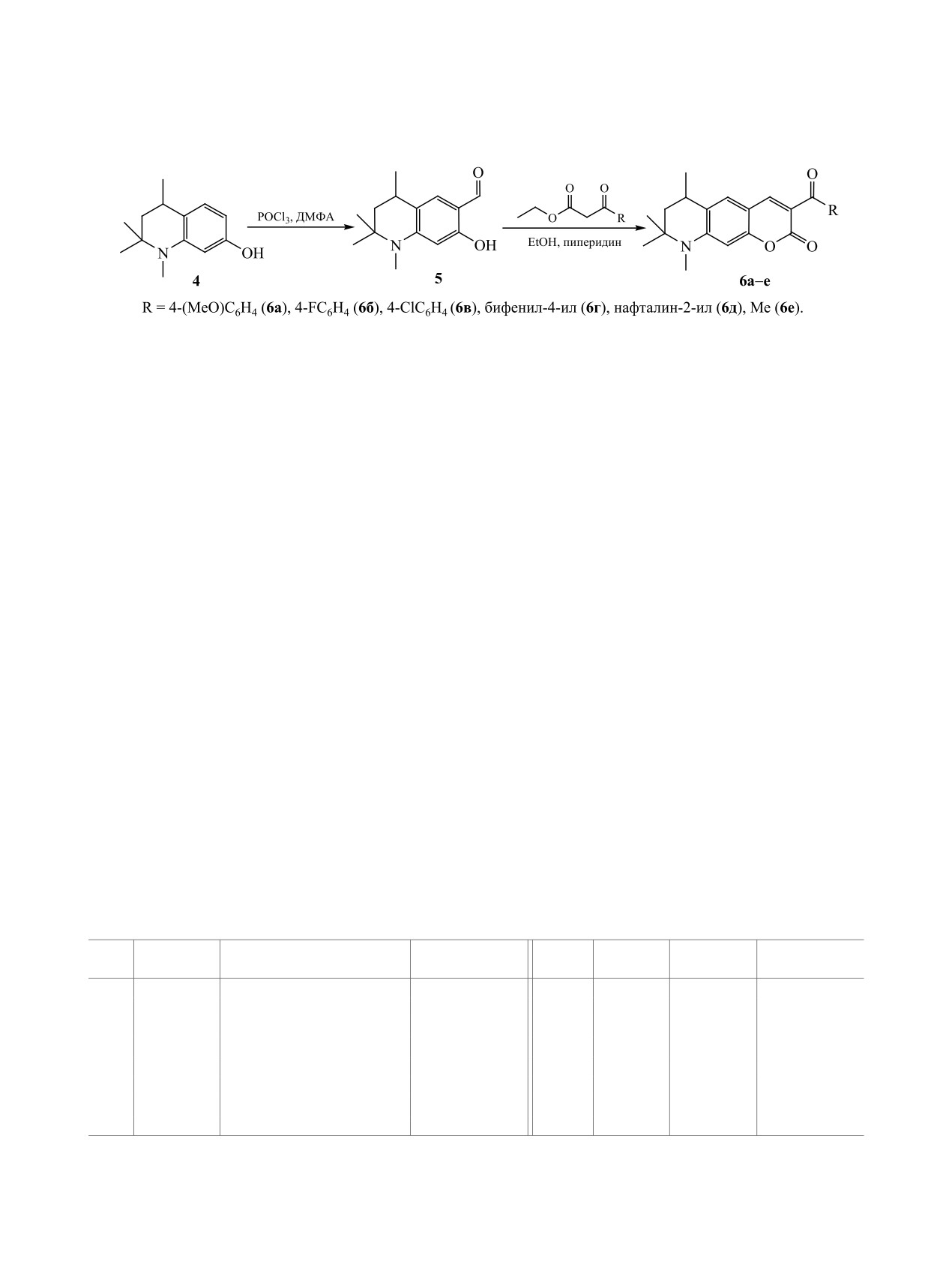
По-видимому, вначале с участием пиперидина
который был получен с выходом 67% формили-
образуется аддукт Кнёвенагеля A, дегидратирую-
рованием
1,2,2,4-тетраметил-1,2,3,4-тетрагидро-
щийся в арилиденовое производное Б, которое да-
хинолин-7-ола
4 комплексом Вильсмейера-Ха-
лее внутримолекулярно циклизуется в конечный
ака (схема 3). В спектре ЯМР 1Н альдегида 5 в
продукт реакции 3 (схема 2).
ДМСО-d6 наблюдаются сигналы ароматиче-
ских протонов в виде синглета (5.95 м. д.) и
В спектрах ЯМР 1Н соединений 3a-д наблю-
дублета (7.25 м. д., J = 1.4 Гц); протон формильной
даются синглетные сигналы протонов 8,9-диги-
группы проявляется при 9.62 м. д., протон группы
дро-2H-пирано[3,2-g]хинолиновой основы в обла-
ОН - при 11.20 м. д.
стях 6.44-6.47 (Н10), 7.38-7.42 (Н5), 8.16-8.41 м. д.
Реакции Кнёвенагеля альдегида 5 в с β-кето-
(Н4), дублет протона Н7 при ~5.5 м. д. (J = 1.2 Гц),
эфирами в присутствии каталитических ко-
а также наборы сигналов ароматических протонов
личеств пиперидина приводила к образова-
заместителей в положении 3. В масс-спектрах вы-
нию
3-ацил-6,8,8,9-тетраметил-6,7,8,9-тетра-
сокого разрешения соединений 3a-д присутству-
гидро-2H-пирано[3,2-g]хинолин-2-онов
6a-е с
ют характерные молекулярные ионы [М + Н]+.
выходами 73-88%. Строение соединений 6a-е до-
С целью расширения набора люминесцирующих
казано спектральными методами. В масс-спектрах
2Н-пирано[3,2-g]хинолин-2-онов вышеописанная
(ВЭЖХ-МС) присутствуют пики молекулярных
методика была распространена на тетрагидри-
ионов [М + Н]+. В спектрах ЯМР 1Н соединений
рованный аналог
-
7-гидрокси-1,2,2,4-тетраме-
6a-е в отличие от спектра исходного альдегида 5
тил-1,2,3,4-тетрагидрохинолин-6-карбальдегид 5,
отсутствует сигнал протона формильной группы,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1028
ПОТАПОВ и др.
Схема 3.
а сигналы ароматических протонов находятся в
степени (метил, фенил, нафтил, метоксигруппа),
областях 6.45-6.50 (Н10), 7.46-7.52 (Н5), 8.17-
приводит во всех случаях к батохромному сдви-
8.50 м. д. (Н4). Сигналы протонов группы СН2 те-
гу полосы поглощения к 430-450 нм. Эта законо-
трагидропиридинового цикла наблюдаются в виде
мерность связана с формированием кумаринового
триплета при ~1.42 м. д. (J = 13.2 Гц) и дублета
фрагмента и с существенным удлинением цепи
дублетов при 1.89 м. д. (J = 13.2 и 4.0 Гц).
π-сопряжения. Значительная локализация π-элек-
трона, участвующего в переходах 430-450 нм в
Соединения 3a-д и 6a-е - ярко-желтые веще-
2Н-пиранохинолин-2-оне, обусловливает слабую
ства, обладающие в растворах интенсивной флу-
чувствительность полос поглощения к заместите-
оресценцией, соответствующие спектрально-лю-
лям в пирановом цикле.
минесцентные характеристики представлены в
таблице.
Изменение кратности связей в молекулах про-
Максимумы спектров поглощения соедине-
изводных тетрагидрохинолина 4-6 по сравнению
с производными дигидрохинолина 1-3 приводит
ний 3a-д находятся в пределах 430-450 нм, сое-
к синему сдвигу полос поглощения. Молярный
динений 6a-е - в пределах 431-441 нм; значения
коэффициентов молярной экстинкции составля-
коэффициент поглощения в спектрах ряда сое-
динений 1-3 уменьшается до 2500 л∙моль-1∙см-1,
ют около (3-4)×104 л∙моль-1∙см-1. Отмечена зако-
в спектрах соединений 4-6 - увеличивается до
номерная трансформация спектров поглощения
красителей 3a-д относительно спектра исходного
25500 л∙моль-1∙см-1.
дигидрохинолина 1. Две полосы с максимумами
Как и в случае дигидрохинолина 1, введение
при 280 и 340 нм в спектре соединения 1 обуслов-
альдегидной группы в положение 3 молекулы те-
лены переходами, характерными для пиридиново-
трагидрохинолина приводит к длинноволновому
го и фенольного фрагментов. Введение формиль-
сдвигу полосы π-π*-переходов от 305 к 355 нм.
ной группы приводит к длинноволновому сдвигу
Полоса σ-σ*-переходов для дигидрохинолинового
полосы π-π*-переходов от 340 к 372 нм. Полоса
фрагмента при 264 нм смещается к 268 нм. Введе-
σ-σ*-переходов для пиридинового фрагмента
ние заместителей R приводит в спектрах соедине-
осталась при 280 нм. Введение заместителей,
ний 6a-е к батохромному сдвигу полосы поглоще-
обладающих донорными свойствами различной
ния в область 428-441 нм. Влияние заместителей
Спектральные данные производных дигидрохинолина 1-6
Стоксов сдвиг,
Стоксов сдвиг,
№
λmax, нм
λem, (Iотн)
№
λmax, нм
λem, (Iотн)
нм
нм
1
280, 340
520 (о. о. сл), 390 (о. сл)
50
5
2
280, 372
424 (ср)
52
6a
268, 355
396 (с)
41
3а
430
511 (с)
81
6б
431
489 (с)
68
3б
450
531 (с)
81
6в
431
507 (о. с)
76
3в
446
512 (с)
66
6г
439
510 (с)
71
3г
450
524 (с)
74
6д
441
508 (ср)
67
3д
450
535 (ср)
85
6е
439
510 (ср)
71
4
264, 305
346 (с)
41
439
512 (с)
73
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1029
на положение максимума полосы поглощения за
ний, качественный анализ реакционных смесей
счет удлинения цепи π-сопряжения проявляется
проводили методом ТСХ на пластинах Merck TLC
заметно слабее.
Silica gel 60 F254; элюент - метанол-хлороформ,
1:20. Проявление хроматограмм проводили в УФ
Для растворов исследуемых соединений в ди-
свете и парах иода. Спектры оптического поглоще-
метилформамиде наблюдали заметные сигналы
ния и люминесценции записывали с помощью во-
люминесценции (см. таблицу). Максимумы спек-
локонного спектрометра USB2000+ (Ocean optics,
тров люминесценции образцов соединений 3a-д
США). Источником непрерывного излучения для
располагались в пределах 511-535 нм, а соеди-
записи спектров поглощения служил USB DT
нений 6a-е - в пределах 489-512 нм. Изменения
(Ocean Optics, США). Для возбуждения спектров
положений максимумов спектров люминесценции
люминесценции использовали дуговую ртутную
при изменении заместителей симбатны изменени-
лампу ДРШ-250 (250 Вт) совместно с дифракци-
ям спектров поглощения. Для всех исследуемых
онным монохроматором МДР-41 (ЛОМО, Россия)
красителей величина стоксова сдвига максимума
для выделения линий ртути 313 и 365 нм.
люминесценции не превышает 85 нм, что не по-
зволяет отнести рассматриваемые красители к
7-Гидрокси-1,2,2,4-тетраметил-1,2-дигидро-
соединениям с аномально большим стоксовым
хинолин-6-карбальдегид 2 получали по методике
сдвигом, обусловленным исключительно безызлу-
[21], 1,2,2,4-тетраметил-1,2-ди- и 1,2,3,4-тетраги-
чательными потерями при изомерных трансфор-
дрохинолин-7-олы 1 и 4 - коммерческие продукты
мациях хромофоров. Величина стоксова сдвига
(Alinda Chemical Ltd).
наиболее чувствительна к строению заместителей.
7-Гидрокси-1,2,2,4-тетраметил-1,2,3,4-тетра-
Наименьшим стоксовым сдвигом (66 нм) облада-
гидрохинолин-6-карбальдегид (5). К раствору
ют красители с 4-хлорфенильной группой (3в, 6в),
0.03 моль 1,2,2,4-тетраметил-1,2,3,4-тетрагидро-
наибольшим - красители с 2-нафтил- (3д и 6д) и
хинолин-7-ола 4 в 15 мл безводного ДМФА при
4-метоксифенильными (3а и 6a) заместителями,
0°С по каплям прибавляли при перемешивании
обладающими в существенной степени донорны-
0.042 моль POCl3. Смесь нагревали до 80°С до
ми свойствами.
завершения реакции (~ 0.5 ч). После охлаждения
реакционную массу выливали в 200 г льда, ней-
Таким образом, нами получены новые перспек-
трализовали 2 М. раствором гидроксида натрия до
тивные красители на основе 2H-пирано[3,2-g]хи-
pH = 6. Осадок отфильтровывали, промывали
нолин-2-она, содержащие в своем составе люми-
водой, сушили и перекристаллизовывали из изо-
нофорный кумариновый фрагмент.
пропилового спирта. Выход 4.68 г (67%), т. пл.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
101-103°С. Спектр ЯМР 1Н, δ, м. д.: 1.22 с (3H,
Спектры ЯМР 1Н регистрировали на спектро-
2-CH3), 1.27 д (3Н, 4-CH3, J = 6.6 Гц), 1.29 с (3H,
метре Bruker DRX-500 (500 МГц) в ДМСО-d6,
2-CH3), 1.37 т (1Н, СН2, J = 13.1 Гц), 1.83 д. д (1Н,
внутренний стандарт - ТМС. Хроматографиче-
СН2, J = 13.1, 4.0 Гц), 2.67-2.72 м (1Н, СН), 2.85
ский анализ проводили на жидкостном хромато-
с (3Н, NСН3), 5.95 с (1Н, H8), 7.25 д (1Н, Н5, J =
графе Agilent 1260 Infinity с масс-детектирова-
1.4 Гц), 9.62 с (1Н, СHО), 11.20 уш. с (1Н, OH).
нием (времяпролетный детектор масс высокого
Масс-спектр, m/z: 234.1484 [М + Н]+ (вычислено
разрешения Agilent 6230 TOF LC/MS, ионизация
для C14H19NO2: 234.1490).
электрораспылением; колонка Gemini C18, 4.6 ×
3-Ацил-6,8,8,9-тетраметил-8,9-дигидро-
50 мм, диаметр частиц сорбента 5 мкм, линейное
2H-пирано[3,2-g]хинолин-2-оны
(3a-д) и
3-
градиентное элюирование, элюент А - MeCN-
ацил-6,8,8,9-тетраметил-6,7,8,9-тетрагидро-
Н2О, 2.5:97.5, 0.1% CF3COOH, элюент Б - MeCN,
2H-пирано[3,2-g]хинолин-2-оны
(6a-е).
0.1% CF3COOH, скорость потока подвижной фазы
Смесь
0.002 моль
7-гидрокси-1,2,2,4-тетраме-
3.75 мл/мин; температура колонки 40°С, объем
тил-1,2-ди(1,2,3,4-тетра)гидрохинолин-6-карбаль-
введения 1.5 мкл). Температуры плавления опре-
дегида 2 (5), 0.002 моль β-кетоэфира и несколько
деляли на аппарате Stuart SMP30. Контроль инди-
капель пиперидина в 5 мл этилового спирта кипя-
видуальности реагентов и полученных соедине-
тили до окончания реакции (2-4 ч), после чего
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1030
ПОТАПОВ и др.
реакционную смесь охлаждали до комнатной тем-
7.59-7.62 м (HAr), 7.65-7.68 м (HAr), 7.85 д. д (1HAr,
пературы и выливали в 15 мл охлажденной воды.
J = 8.6, 1.8 Гц), 8.00-8.03 м (2HAr), 8.09 д (1HAr,
Образующийся осадок отфильтровывали, сушили
J = 1.4 Гц), 8.41 д (1HAr, J = 1.4 Гц), 8.41 с (1Н, H4).
и перекристаллизовывали из этилового спирта.
Масс-спектр, m/z: 410.1754 [М + Н]+ (вычислено
для C27H23NO3: 410.1752).
3-(4-Метоксибензоил)-6,8,8,9-тетраметил-
8,9-дигидро-2H-пирано[3,2-g]хинолин-2-он (3a).
3-(4-Метоксибензоил)-6,8,8,9-тетраметил-
Выход 0.63 г (81%), т. пл. 164-166°С. Спектр ЯМР
6,7,8,9-тетрагидро-2H-пирано[3,2-g]хинолин-
1Н, δ, м. д.: 1.37 с [6H, 8-(CH3)2], 1.94 д (3Н, 6-CH3,
2-он (6a). Выход 0.57 г (73%), т. пл. 177-179°С.
J = 1.1 Гц), 2.92 с (3Н, NСН3), 3.85 с (3H, OCH3),
Спектр ЯМР 1Н, δ, м. д.: 1.26 с (3H, 8-CH3),
5.50 д (1Н, H7, J = 1.1 Гц), 6.44 с (1Н, Н10), 7.02-7.05
1.30-1.33 м (6Н, 8-CH3 + 6-CH3), 1.42 т (1Н, СН2,
м (2HAr), 7.38 с (1Н, Н5), 7.77-7.80 м (2HAr), 8.16 с
J = 13.2 Гц), 1.89 д. д (1Н, СН2, J = 13.2, 4.0 Гц),
(1Н, H4). Масс-спектр, m/z: 390.1702 [М + Н]+ (вы-
2.77-2.82 м (1Н, СН), 2.92 с (3Н, NСН3), 3.85 с (3H,
числено для C24H23NO4: 390.1701).
OCH3), 6.47 с (1Н, Н10), 7.03 д (2НAr, J = 8.8 Гц),
6,8,8,9-Тетраметил-3-(4-фторбензоил)-
7.46 с (1Н, Н5), 7.77 д (2НAr, J = 8.8 Гц), 8.17 с (1Н,
8,9-дигидро-2H-пирано[3,2-g]хинолин-2-он (3б).
H4). Масс-спектр, m/z: 392.1855 [М + Н]+ (вычис-
Выход 0.52 г (69%), т. пл. 160-162°С. Спектр ЯМР
лено для C24H25NO4: 392.1858).
1Н, δ, м. д.: 1.38 с [6 H, 8-(CH3)2], 1.94 д (3Н, 6-CH3,
6,8,8,9-Тетраметил-3-(4-фторбензоил)-
J = 1.2 Гц), 2.93 с (3Н, NСН3), 5.50 д (1Н, H7, J =
6,7,8,9-тетрагидро-2H-пирано[3,2-g]хинолин-
1.2 Гц), 6.44 с (1Н, Н10), 7.30-7.34 м (2HAr), 7.40 с
2-он (6б). Выход 0.64 г (84%), т. пл. 157-159°С.
(1Н, Н5), 7.84-7.87 м (2HAr), 8.25 с (1Н, H4). Масс-
Спектр ЯМР 1Н, δ, м. д.: 1.27 с (3H, 8-CH3),
спектр, m/z: 378.1501 [М + Н]+ (вычислено для
1.30-1.33 м (6Н, 8-CH3 + 6-CH3), 1.42 т (1Н, СН2,
C23H20FNO3: 378.1501).
J = 13.2 Гц), 1.90 д. д (1Н, СН2, J = 13.2, 4.0 Гц),
6,8,8,9-Тетраметил-3-(4-хлорбензоил)-8,9-ди-
2.77-2.82 м (1Н, СН), 2.93 с (3Н, NСН3), 6.48 с (1Н,
гидро-2H-пирано[3,2-g]хинолин-2-он (3в). Вы-
Н10), 7.30-7.34 м (2НAr), 7.49 с (1Н, Н5), 7.83-7.87 м
ход 0.58 г (74%), т. пл. 199-201°С. Спектр ЯМР 1Н,
(2НAr), 8.23 с (1Н, H4). Масс-спектр, m/z: 380.1657
δ, м. д.: 1.38 с [6 H, 8-(CH3)2], 1.94 д (3Н, 6-CH3,
[М + Н]+ (вычислено для C23H22FNO3: 380.1658).
J = 1.2 Гц), 2.93 с (3Н, NСН3), 5.51 д (1Н, H7, J =
6,8,8,9-Тетраметил-3-(4-хлорбензоил)-
1.2 Гц), 6.44 с (1Н, Н10), 7.41 с (1Н, Н5), 7.54-7.57
6,7,8,9-тетрагидро-2H-пирано[3,2-g]хинолин-
м (2HAr), 7.76-7.79 м (2HAr), 8.28 с (1Н, H4). Масс-
2-он (6в). Выход 0.70 г (88%), т. пл. 188-190°С.
спектр, m/z: 394.1203 [М + Н]+ (вычислено для
Спектр ЯМР 1Н, δ, м. д.: 1.27 с (3H, 8-CH3),
C23H20ClNO3: 394.1206).
1.31-1.34 м (6Н, 8-CH3 + 6-CH3), 1.42 т (1Н, СН2,
3-(Бифенил-4-илкарбонил)-6,8,8,9-тетраме-
J = 13.2 Гц), 1.90 д. д (1Н, СН2, J = 13.2, 4.0 Гц),
тил-8,9-дигидро-2H-пирано[3,2-g]хинолин-2-он
2.77-2.82 м (1Н, СН), 2.94 с (3Н, NСН3), 6.48 с
(3г). Выход 0.70 г (80%), т. пл. 207-209°С. Спектр
(1Н, Н10), 7.50 д (1Н, Н5, J = 1.5 Гц), 7.34-7.37 м
ЯМР 1Н, δ, м. д.: 1.38 с [6 H, 8-(CH3)2], 1.95 д
(2НAr), 7.75-7.78 м (2НAr), 8.30 с (1Н, H4). Масс-
(3Н, 6-CH3, J = 1.2 Гц), 2.93 с (3Н, NСН3), 5.51 д
спектр, m/z: 396.1363 [М + Н]+ (вычислено для
(1Н, H7, J = 1.2 Гц), 6.46 с (1Н, Н10), 7.42-7.45 м
C23H22ClNO3: 396.1362).
(HAr + Н5), 7.50-7.53 м (2HAr), 7.74-7.77 м (2HAr),
3-(Бифенил-4-илкарбонил)-6,8,8,9-тетра-
7.79-7.82 м (2HAr), 7.85-7.87 м (2HAr), 8.28 с (1Н,
метил-6,7,8,9-тетрагидро-2H-пирано[3,2-g]-
H4). Масс-спектр, m/z: 436.1904 [М + Н]+ (вычис-
хинолин-2-он (6г). Выход 0.74 г (85%), т. пл.
лено для C29H25NO3: 436.1909).
188-190°С. Спектр ЯМР 1Н, δ, м. д.: 1.27 с (3H,
6,8,8,9-Тетраметил-3-(нафталин-2-илкарбо-
8-CH3), 1.31-1.34 м (6Н, 8-CH3 + 6-CH3), 1.42 т
нил)-8,9-дигидро-2H-пирано[3,2-g]хинолин-
(1Н, СН2, J = 13.2 Гц), 1.90 д. д (1Н, СН2, J = 13.2,
2-он (3д). Выход 0.73 г (89%), т. пл. 181-183°С.
4.0 Гц), 2.77-2.83 м (1Н, СН), 2.94 с (3Н, NСН3),
Спектр ЯМР 1Н, δ, м. д.: 1.38 с [6 H, 8-(CH3)2], 1.94
6.49 с (1Н, Н10), 7.41-7.43 м (1НAr), 7.49-7.53 м
д (3Н, 6-CH3, J = 1.2 Гц), 2.94 с (3Н, NСН3), 5.51 д
(3Н, Н5 + 2НAr), 7.74-7.77 м (2НAr), 7.78-7.81 м
(1Н, H7, J = 1.2 Гц), 6.47 с (1Н, Н10), 7.41 с (1Н, Н5),
(2НAr), 7.84-7.86 м (2НAr), 8.30 с (1Н, H4). Масс-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1031
спектр, m/z: 438.2060 [М + Н]+ (вычислено для
6.
Murata C., Masuda T., Kamochi Y., Todoroki K.,
C29H27NO3: 438.2065).
Yoshida H., Nohta H., Yamaguchi M., Takadate A. //
Chem. Pharm. Bull. 2005. Vol. 53. P. 750. doi 10.1248/
6,8,8,9-Тетраметил-3-(нафталин-2-илкар-
cpb.53.750
бонил)-6,7,8,9-тетрагидро-2H-пирано[3,2-g]-
7.
Zhang X., Zhang J.-J., Xia Y.-Y. // J. Photochem.
хинолин-2-он (6д). Выход 0.66 г (80%), т. пл.
Photobiol. (A). 2008. Vol. 194. P. 167. doi 10.1016/j.
175-177°С. Спектр ЯМР 1Н, δ, м. д.: 1.27 с (3H,
jphotochem.2007.08.004
8-CH3), 1.31-1.34 м (6Н, 8-CH3 + 6-CH3), 1.42 т
8.
Lin Q., Bao C., Fan G., Cheng S., Liu H., Liu Z., Zhu L. //
(1Н, СН2, J = 13.2 Гц), 1.90 д. д (1Н, СН2, J = 13.2,
J. Mater. Chem. 2012. Vol. 22. P. 6680. doi 10.1039/
4.0 Гц), 2.77-2.82 м (1Н, СН), 2.94 с (3Н, NСН3),
c2jm33364c
6.50 с (1Н, Н10), 7.50 д (1Н, Н5, J = 1.5 Гц), 7.58-7.62
9.
Ni X., Guo Y., Bu H., An J., En D. // J. Chin. Chem. Soc.
м (1НAr), 7.65-7.68 м (1НAr), 7.85 д. д (1НAr, J =
2012. Vol. 59. P. 1439. doi 10.1002/jccs.201200010
8.5, 1.7 Гц), 7.99-8.03 м (2НAr), 7.85 д (1НAr, J =
10.
Schiedel M.-S., Briehn C.A., Bauerle P. / /
8.1 Гц), 8.32 с (1Н, H4), 8.39 д (1НAr, J = 1.2 Гц).
Angew. Chem. 2001. Bd 113. S. 4813. doi
Масс-спектр, m/z: 412.1908 [М + Н]+ (вычислено
10.1002/1521-3757(20011217)113:24<4813:AID-
для C27H25NO3: 412.1909).
ANGE4813>3.0.CO;2-T
3-Ацетил-6,8,8,9-тетраметил-6,7,8,9-тетра-
11.
Nagy K., Orban E., Bзsze S., Kele P. // Chem. Asian J.
гидро-2H-пирано[3,2-g]хинолин-2-он
(6е).
2010. Vol. 5. P. 773. doi 10.1002/asia.200900477
Выход 0.60 г (80%), т. пл. 193-195°С. Спектр ЯМР
12.
Sun Y.-Q., Liu J., Zhang J., Yang T., Guo W. // Chem.
1Н, δ, м. д.: 1.37 с (3H, 8-CH3), 1.31-1.33 м (6Н,
Commun. 2013. Vol. 49. P. 2637. doi 10.1039/
8-CH3 + 6-CH3), 1.41 т (1Н, СН2, J = 13.2 Гц), 1.89
C3CC39161B
д. д (1Н, СН2, J = 13.2, 4.0 Гц), 1.51 с (3H, CH3CO +
13.
Richard J.-A., Massonneau M., Renard P.-Y., Romieu A. //
ДМСО), 2.76-2.80 м (1Н, СН), 2.93 с (3Н, NСН3),
Org. Lett. 2008. Vol. 10. P. 4175. doi 10.1021/
6.45 с (1Н, Н10), 7.52 д (1Н, Н5, J = 1.5 Гц), 8.50 с
ol801582w
(1Н, H4). Масс-спектр, m/z: 300.1597 [М + Н]+ (вы-
14.
Huang H.-C., Wang K.-L., Huang S.-T., Lin H.-Y.,
числено для C18H21NO3: 300.1595).
Lin C.-M. // Biosens. Bioelectron. 2011. Vol. 26.
P. 3511. doi 10.1016/j.bios.2011.01.036
ФОНДОВАЯ ПОДДЕРЖКА
15.
Cao X., Lin W., Yu Q., Wang J. // Org. Lett. 2011.
Работа выполнена при финансовой поддержке
Vol. 13. P. 6098. doi 10.1021/ol202595t
Российского научного фонда (проект № 18-74-
16.
Hara K., Sato T., Katoh R., Furube A., Ohga Y., Shinpo A.,
10097).
Suga S., Sayama K., Sugihara H., Arakawa H. // J.
Phys. Chem. (B). 2003. Vol. 107. P. 597. doi 10.1021/
КОНФЛИКТ ИНТЕРЕСОВ
jp026963x
Авторы заявляют об отсутствии конфликта
17.
Hara K., Dan-oh Y., Kasada C., Ohga Y., Shinpo A.,
интересов.
Suga S., Sayama K., Arakawa H. // Langmuir 2004.
Vol. 20. P. 4205. doi 10.1021/la0357615
СПИСОК ЛИТЕРАТУРЫ
18.
Wang Z.-S., Cui Y., Dan-oh Y., Kasada C., Shinpo A.,
1. Li C. // Nature Materials. 2014. Vol. 13. P. 110. doi
Hara K. // J. Phys. Chem. (C). 2007. Vol. 111. P. 7224.
10.1038/nmat3877
doi org/10.1021/jp067872t
2. Kooreman N.G., Ransohoff J.D., Wu J.C. // Nature
19.
Wang Z.-S., Dan-oh Y.C.Y., Kasada C., Shinpo A.,
Materials. 2014. Vol. 13. P. 106. doi 10.1038/nmat3868
Hara K. // J. Phys. Chem. (C). 2008. Vol. 112. P. 17011.
3. Reynolds G.A., Drexhage K.-H. // Opt. Commun. 1975.
doi 10.1021/jp067872t
Vol. 13. P. 222. doi 10.1016/0030-4018(75)90085-1
20.
Nizamov S., Willig K.I., Sednev M.V., Belov V.N.,
4. Jones G. II, Jackson W.R., Halpern A.M. // Chem.
Hell S.W. // Chem. Eur. J. 2012. Vol. 18. P. 16339. doi
Phys. Lett. 1980. Vol. 72. P. 391. doi 10.1016/0009-
10.1002/chem.201202382
2614(80)80314-9
21.
Schill H., Nizamov S., Bottanelli F., Bierwagen J.,
5. Corrie J.E.T., Munasinghe V.R.N., Rettig W. // J.
Belov V.N., Hell S.W. // Chem. Eur. J. 2013. Vol. 19.
Heterocycl. Chem. 2000. Vol. 37. P. 1447. doi 10.1002/
P. 16556. doi 10.1002/chem.201302037
jhet.5570370608
22.
Манахелохе Г.М., Потапов А.Ю., Шихалиев Х.С. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1032
ПОТАПОВ и др.
Изв. А.Н. Сер. хим. 2016. № 4. С. 1145; Manahe-
24. Ranjith Ch., Paul N., Vijayan. // Asian J. Chem. 2011.
lohe G.M., Potapov A.Yu., Shikhaliev Kh.S. // Russ.
Vol. 23. P. 235.
Chem. Bull. 2016. N 4. P. 1145. doi 10.1007/s11172-
25. Verdia P., Santamarta F., Tojo E. // Molecules. 2011.
016-1427-7
Vol. 16. P. 4379. doi 10.3390/molecules16064379
23. Danish Kh., Sayeed M., Meshari A.A., Mohammed I.A. //
26. He X., Shang Y., Zhou Y., Yu Zh., Han G., Jin W.,
Tetrahedron Lett. 2017. Vol. 58. P. 3183. doi 10.1016/j.
Chen J. // Tetrahedron. 2015. Vol. 71. P. 863. doi
tetlet.2017.07.018
10.1016/j.tet.2014.12.042
Synthesis and Luminescent Properties of 3-Acyl-6,8,8,9-
tetramethyl-2H-pyrano[3,2-g]hydroquinolin-2-ones
A. Yu. Potapov, D. Yu. Vandyshev, Y. Refki, I. V. Ledenyova, O. V. Ovchinnikov,
M. S. Smirnov, and Kh. S. Shikhaliev
Voronezh State University, Voronezh, 394006 Russia
*e-mail: pistones@mail.ru
Received March 3, 2020; revised March 3, 2020; accepted March 10, 2020
A series of 3-R-6,8,8,9-tetramethyl-2H-pyrano[3,2-g]quinolin-2-ones was obtained by condensation of 7-hy-
droxy-1,2,2,4-tetramethylhydroquinoline-6-carbaldehydes with aroyl acetic acid esters. The dependence of UV
and photoluminescence spectra on the structure of the obtained compounds was revealed.
Keywords: luminescence, Knoevenagel condensation, 7-hydroxy-1,2,2,4-tetramethylhydroquinolines,
3-R-6,8,8,9-tetramethyl-2H-pyrano[3,2-g]quinolin-2-ones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020