ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 1070-1101
ОБЗОРНАЯ
СТАТЬЯ
УДК 547.022;541.49;547.7
АКСИАЛЬНО-ХИРАЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ,
КАРБО- И ГЕТЕРОЦИКЛЫ: СОВРЕМЕННЫЕ
СТРАТЕГИИ СИНТЕЗА, ПРИМЕРЫ ВЛИЯНИЯ
АТРОПОИЗОМЕРИИ НА СТРУКТУРУ ПРОДУКТОВ
РЕАКЦИИ
А. Р. Гатауллинаa, Р. Р. Гатауллинb,*
a Уфимский государственный нефтяной технический университет, Уфа, 450062 Россия
b Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: gataullin@anrb.ru
Поступило в Редакцию 12 мая 2020 г.
После доработки 12 мая 2020 г.
Принято к печати 22 мая 2020 г.
В обзоре обобщены данные о синтезе новых аксиально-хиральных или других типов комплексов пла-
тины, иридия, молибдена, производных порфирина, субфталоцианин-тетрацианобутадиеновых конъ-
югатов, обладающих уникальными фотофизическими свойствами, малых карбо(гетеро)циклических и
ациклических молекул, фосфабарелленов. Рассмотрены подходы к синтезу некоторых атропоизомерных
представителей макроциклов и циклофанов. Представлены новые примеры циклизаций, наведение хи-
ральных центров в которых контролируется стереоизомерией или аксиальной хиральностью, которые
существуют в исходных молекулах субстрата, когда они взаимодействуют с электрофильными, нукле-
офильными, радикал-образующими реагентами, комплексами металлов, вступают в реакции меж- или
внутримолекулярного циклоприсоединения. Обращается также внимание на атропоселективное пре-
вращение мюнхнонов, генерируемых из орто-(алкенил)фенилзамещенных N-ацилглицинов, в которых
заторможено вращение вдоль связи N-Ar.
Ключевые слова: аксиально-хиральные металлокомплексы, циклофаны, атропоизомер, металлодимер,
внутримолекулярное циклоприсоединение мюнхнонов
DOI: 10.31857/S0044460X20070136
1. Введение
1070
2. Металлокомплексы с аксиально-хиральным или иным типом стереоизомерии
1072
3. Аксиальная изомерия по связи Cspx-Cspy и Cspx-гетероатом
1078
4. Новые примеры влияния стереоизомерии на структуру продуктов реакции
1090
5. Заключение
1095
1. ВВЕДЕНИЕ
С=N связи (имины, цис/транс-оксимы, E/Z-изо-
мерия олефинового или N=C-фрагмента в цикло-
Значительный вклад в расширение разнообра-
фане, в ациклической молекуле), существованием
зия органических соединений вносит стереоизо-
мерия, обусловленная различным расположением
молекул с центром хиральности (σ-диастереоме-
заместителей относительно олефиновой, N=N или
ры [1], P-хиральных соединений [2]), существо-
1070
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1071
вание хиральных алленов и других систем [3-5].
использовали катализаторы на основе меди [39].
Отклонение от планарности π-системы конден-
В этой области достигнуты значительные успехи,
сированных ароматических колец или наличие
получен широкий спектр новых соединений. В то
оси хиральности в молекуле [6-9] приводит к
же время есть примеры, где использование неко-
образованию планарных или аксиальных стерео-
торых методов ограничено отдельными специфи-
изомеров. Значение энергетических затрат на их
ческими субстратами. Поэтому вышеизложенное
взаимопревращение зависит от количества кон-
и важная роль аксиально-хиральных молекул при
денсированных колец и стерических параметров
осуществлении асимметрических трансформаций
заместителей этой системы, длины цепи циклофа-
стимулируют разработку новых и эффективных
на, объема заместителей при обоих осеобразую-
подходов к синтезу соединений, атропоизомерных
щих атомах аксиально-хиральной молекулы. Нако-
по связи углерод-углерод или углерод-гетероатом.
плена обширная библиотека примеров, в которых
При образовании стереоизомеров органических
соединения с аксиальной изомерией представляют
соединений во многих случаях непосредственно
собой орто-моно- или орто-орто-дизамещенные
участвуют различные катализаторы, варьирование
ароматические субстанции. В этих изомерах аро-
структуры комплексов металлов и их лигандного
матическое кольцо может быть связано как с sp2,
окружения способствует образованию того или
sp3-гибридизированным атомом углерода, так и
иного продукта реакции. В этом контексте в этом
sp3-гибридизированным атомом азота, при кото-
аналитическом обзоре логично упоминание и о но-
ром присутствуют неравноценные заместители.
вых достижениях в получении аналогичных изо-
Аксиально-хиральные представители с другим ти-
меров комплексов металлов.
пом гибридизации встречаются реже.
2. МЕТАЛЛОКОМПЛЕКСЫ С АКСИАЛЬНО-
Стереоизомерные молекулы можно обнару-
ХИРАЛЬНЫМ ИЛИ ИНЫМ ТИПОМ
жить в некоторых природных соединениях [10-
СТЕРЕОИЗОМЕРИИ
12], лекарствах [13], лигандах для катализаторов
Химия координационных соединений является
[14]. История развития исследований атропоизо-
важнейшей областью современной общей, неор-
мерных молекул подробно описана в публикации
ганической, органической, медицинской химии.
[15]. Особое внимание привлекают аксиально-хи-
Продолжающиеся исследования в этом направ-
ральные анилиды, амиды и имиды [16-20], среди
лении выявляют новые открытия, которые значи-
которых ограничение вращения в значительной
тельно расширяют границы знаний о свойствах
степени затруднено в замещенных третичных ами-
элементов. Комплексные соединения металлов
дах [21, 22]. Это свойство успешно используется
очень разнообразны по структуре и составу, ши-
для переноса стереоцентров в стереоконтролируе-
роко распространены, повсеместно используются
мых реакциях [23-26], в том числе с применением
в химической промышленности, находят меди-
металлокомплексов [26] и органических катализа-
ко-биологическое применение, методики с их уча-
торов [28-30].
стием входят в некоторые прописи лабораторных
Имеются примеры образования соединений,
анализов. Благодаря этому область химии коорди-
атопоизомерных вдоль связей C-N, при индук-
национных соединений привлекает повышенное
ции хиральной сульфоксидной группы [31, 32];
внимание широкого круга исследователей [40-52].
реакции асимметричного аминирования нафтолов
2.1. Новые азотсодержащие представители.
[33], катализируемое атропоселективное бромиро-
Электронодонорные свойства атома азота различ-
вание арильного кольца [34, 35], N-алкилирование
ной гибридизации создают уникальные возможно-
орто-иодоанилидов, энантиоселективное гидрок-
сти для использования аминов, азо- и азагетеро-
сиаминирование карбонильных соединений [36,
циклов для получения их комплексов с металлами
37] также эффективны при получении аксиаль-
[53, 54], в том числе фосфоресцирующих атропои-
но-хиральных представителей. Атропоизомерные
зомерных [55], многочисленных атропохиральных
биарильные соединения были получены катализи-
представителей
[56], имино-пиридиновых ком-
руемой палладием функционализацией CH-связи
плексов, используемых в качестве катализаторов
[38], также в синтезе атропоизомерных анилидов
полимеризации [57]. Первый пример получения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1072
ГАТАУЛЛИНА, ГАТАУЛЛИН
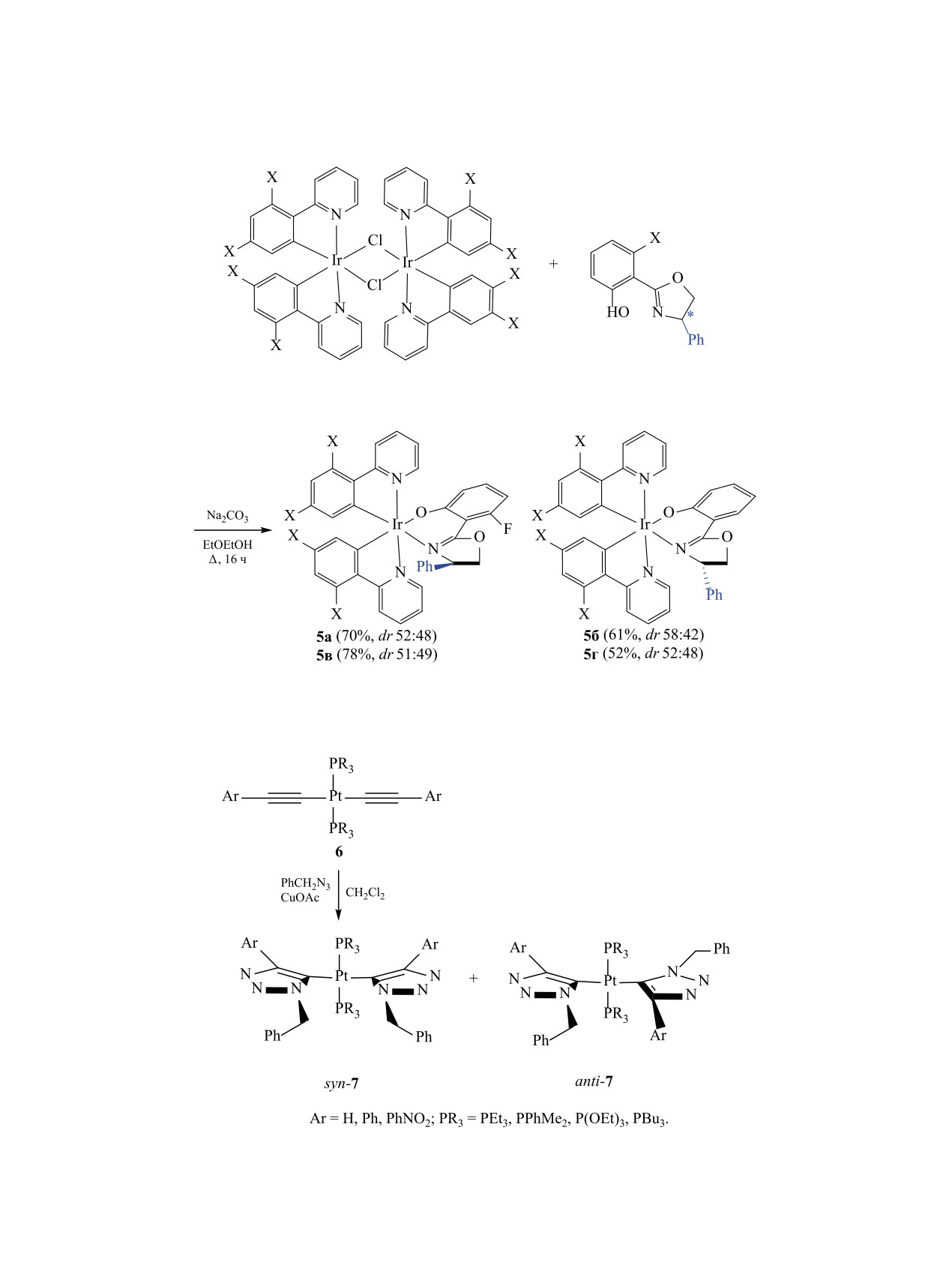
Схема 1.
металлосодержащих атропоизомеров 1 и 2, в кото-
комплексов 5a и 5б в дегазированном MeCN на-
рых ось вращения не находится между хелатными
блюдается очень высокий квантовый выход синей
атомами, приведен в работе [58]. Эти металлоор-
люминесценции (Φem ≈ 0.80). В случае негалогени-
ганические соединения синтезируют нагревани-
рованных ppy-лигандных комплексов 5в и 5г кван-
ем фенилпиразолиевого (ppz) комплекса иридия
товый выход ниже (Φem ≈ 0.52). Кислород сильно
3 c шиффовым основанием, полученным из пи-
гасит эмиссию (около 70 раз).
ренамина и ацетопиридина (схема 1). Разная рас-
Развитие методологии катализируемой солями
творимость изомеров 1 и 2 в метаноле позволяет
одновалентной меди реакций
[3+2]-циклопри-
выделить их в виде индивидуальных кристалличе-
соединения азидов с алкинами [CuAAC, Cu(I)-
ских соединений. При нагревании выше 90°С на-
catalyzed azide-alkyne cycloaddition] открыло до-
блюдается превращение изомеров друг в друга. В
ступ к получению различных представителей
гомологичном иридиевом комплексе, полученном
триазолов, в том числе и их комплексов с метал-
из пиридинальдегида и аминопирена (в этом ком-
лами. В клик-реакции комплекса ацетиленида пла-
плексе заместитель CH3 отсутствует), из-за низ-
тины trans-(R3P)2PtII(C≡CAr)2 6 с бензилазидом
кого энергетического барьера взаимного перехода
получены син- и анти-изомеры триазолилплатины
изомеров друг в друга атропоизомеры выделить не
7 (схема 3), при этом наблюдается умеренная атро-
удается.
поселективность. Соотношение син- и анти-изо-
Повышенное внимание к азотсодержащим ком-
меров в случае Ar = H, PR3 = PEt3 составляет 65:35,
плексам иридия связано также с потенциалом их
PPhMe2 - 72:28, общий выход равен 89 и 82% со-
использования в качестве люминесцентных мате-
ответственно. При изменении природы арильной
риалов [59, 60]. При обработке комплексов 3a и
группы (Ar = Ph, PhNO2) в ацетиленовом фрагмен-
3б небольшим избытком 2-(2-гидроксиарил)-4-фе-
те или природы заместителей R при атоме фосфо-
нилоксазолов 4a, б в присутствии Na2CO3 обра-
ра (R = OEt или Bu) наблюдается увеличение доли
зуются ярко-желтые кристаллические комплексы
син-изомера (в случае Ar = PhNO2, PR3 = PPhMe2
5a-г с хорошими выходами (схема 2). Абсолютная
соотношение син/анти достигает 88:12). Наличие
конфигурация металлоцентров определена с по-
более объемных заместителей при атоме фосфора
мощью рентгеновской кристаллографии как Δ для
(R = Ph или Bn) препятствует образованию про-
комплексов 5a и Λ для комплексов 5б и 5г соот-
дуктов двойного циклоприсоединения, в этом слу-
ветственно. С учетом энантиомеров (2-гидрокси)
чае реакция завершается образованием монотриа-
фенилоксазолов 4a, б, конфигурации комплексов
золзамещенных комплексов [61].
определены как ΔR, ΛS и ΛS для исследованных
Производные порфиринов являются привле-
изомеров 5a, б и г соответственно [60] (схема 2).
кательными объектами для получения их атропо-
Примечательно, что у дифторфенилпиридиновых
изомерных представителей, растущий интерес к
(F2ppy) и фторфенилоксазолидиновых (Fphox)
которым обусловлен потенциалом их применения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1073
Схема 2.
3a, б
(S)-4a, (S)-4б
X = H (3a, 4a, 5в, 5г), F (3б, 4б, 5а, 5б).
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1074
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 4.
в биологии, медицине, технологии химических
Полимеры умеренно стабильны и растворимы в
сенсоров, катализаторов и искусственных све-
CH2Cl2, CHCl3, ТГФ и MeCN, но разлагаются в
тособирающих антенн [62-69]. Имеются также
воде, ДМФА и ДМСО. Полимеры, несущие ани-
примеры получения комплексов металлов из атро-
оны F3CSO3¯ растворимы лучше, чем перхлорат-
поизомеров замещенных порфиринов. Реакция
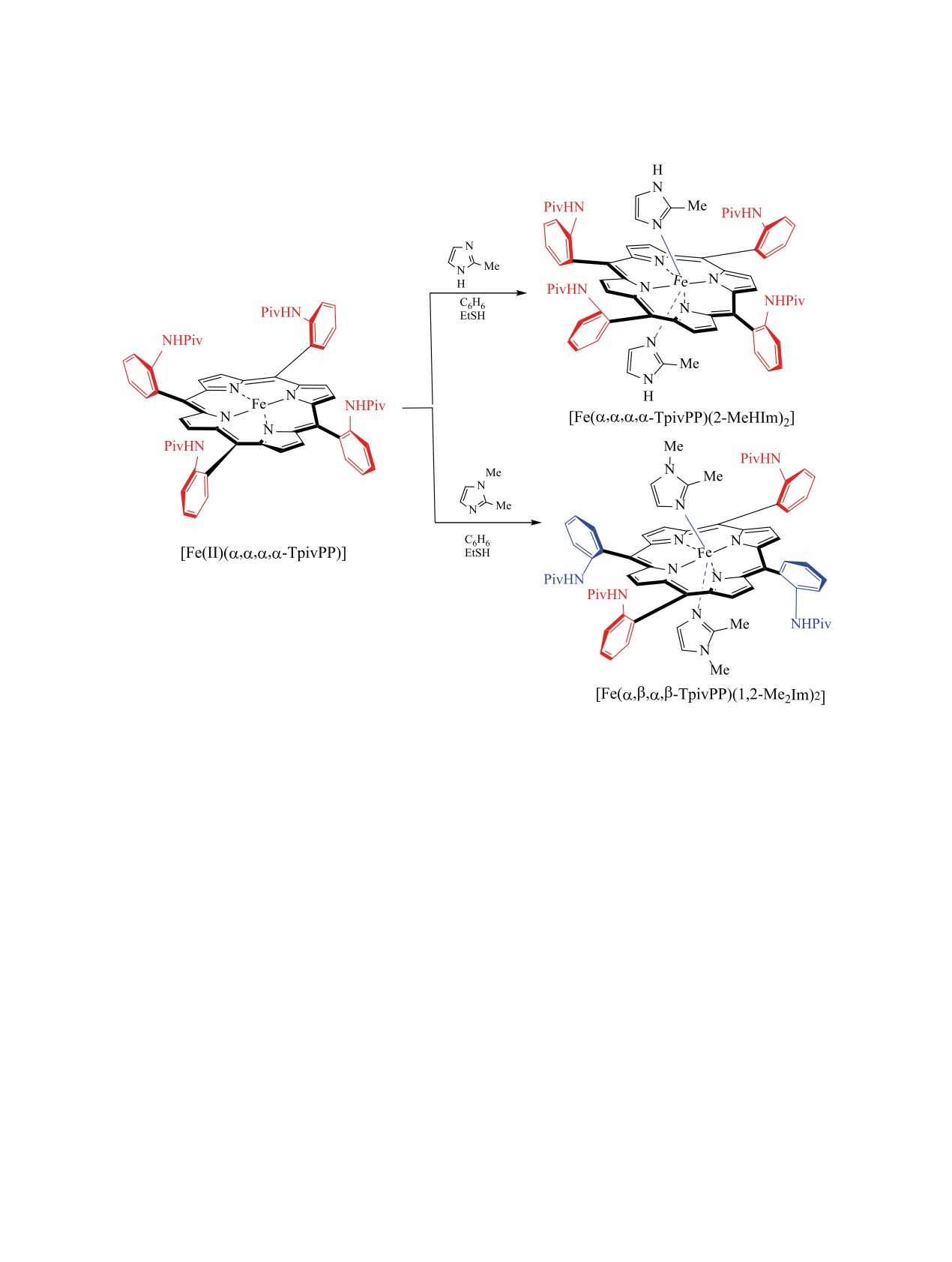
ные аналоги. Также выявлено, что фенилзаме-
комплекса железа [Fe(II)(α,α,α,α-TPivPP)] с 2-ме-
щенные полимеры 9а показывают более высокую
тилимидазолом приводит к бис(имидазолу), в слу-
стабильность, чем бензилзамещенные 9б [70]. При
чае [Fe(α,α,α,α-TpivPP)(2-MeHIm)2] - к ожидаемо-
титровании лигандов 8a, б перхлоратом цинка в
му α,α,α,α-атропоизомеру (схема 4). В то же время
хлороформном растворе максимумы эмиссии (λem)
при взаимодействии с
1,2-диметилимидазолом
значительно смещаются в красную область и за-
происходит изменение пространственной ориен-
метно расширяются.
тации двух заместителей при порфирине. В этом
1.2. Примеры стереоизомерных металлоо-
случае выделен α,β,α,β-атропоизомер [Fe(α,β,α,β-
рганических соединений, не содержащих атом
TpivPP)(1,2-Me2Im)2]. Все реакции проходят в
азота. Анализ данных физико-химического ис-
мягких условиях [63].
следования комплекса [Pt(2-MeC6H4)2(μ-SEt2)]2 10
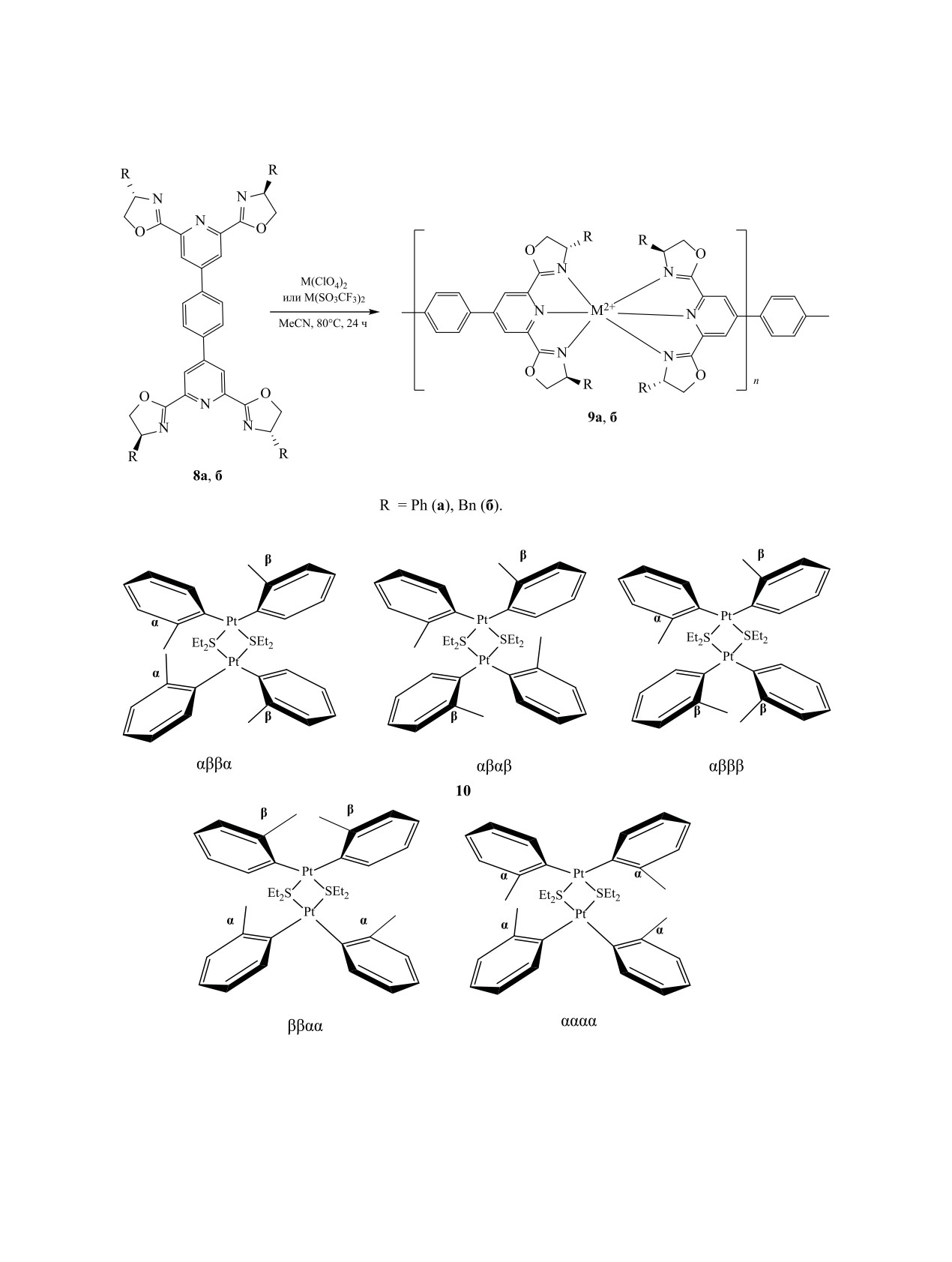
Комплексообразованием двух энантиочистых
(схема 6), получаемого взаимодействием двух мо-
биспиридиндиоксазоловых лигандов 8 с ионами
лекул cis-[PtCl2(SEt2)2] с 4 экв. литийорганическо-
3d-элементов (Zn2+ и Fe2+) получены два типа оп-
го соединения Li(2-MeC6H4), показал существен-
тически активных металло-супрамолекулярных
ные различия в спектральных характеристиках
полимеров в органическом растворе (схема 5).
этого соединения с характеристиками аналогов,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1075
Схема 5.
Схема 6.
в которых в качестве ароматических фрагментов
зомерных формах: αββα, αβαβ, αβββ, ββαα и αααα.
представлены группы 4-MeC6H4 или 4-FC6H4. На
Общий выход изомеров соединения 10 составля-
основании этих данных авторы [71] предположи-
ет около 88%. Для возникновения этих изомеров
ли, что комплекс 10 существует в пяти атропои-
энергетический барьер, необходимый для тормо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1076
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 7.
Схема 8.
жения вращения вокруг связи ароматический атом
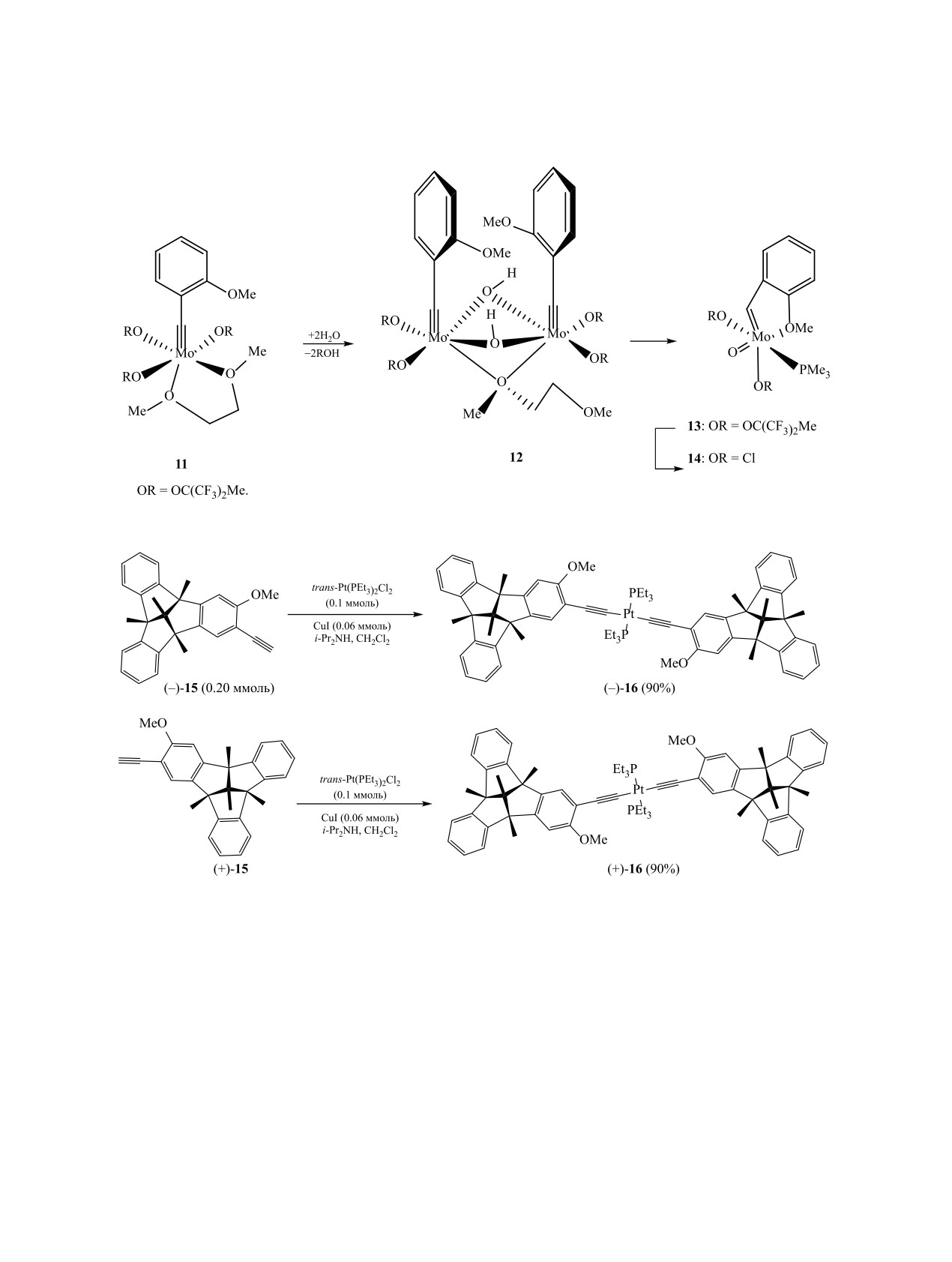
соединение 13 (95% по данным ЯМР, выделен с
углерода-платина, достаточен.
выходом 66%) [72].
Неожиданная удачная трансформация молибде-
Синтез пары энантиомерно чистых металло-
нового комплекса 11 при добавлении 2 экв. воды
димеров 16, содержащих два фрагмента трибен-
приводит к комплексу 12 (схема 7), в котором ме-
зотрихинацена (TBTQ), связанных через платино-
токсильные заместители ароматических колец
вое диацетиленовое звено, описан в работе [73].
имеют анти-расположение. Такая ориентация
Конденсация изомера (+)-15 с trans-Pt(PEt3)2Cl2 в
этих заместителей не имеет значения для даль-
присутствии CuI дает энантиомерно чистый ме-
нейших превращений этого конгломерата. При
таллодимер TBTQ (+)-16 с выходом 90% (схема 8).
добавлении 10 экв. триметилфосфина к раствору
Энантиомерный металлодимер TBTQ (-)-16 был
комплекса 12 в смеси толуол-пентан образуется
получен аналогично из энантиомера (-)-15.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1077
Схема 9.
Схема 10.
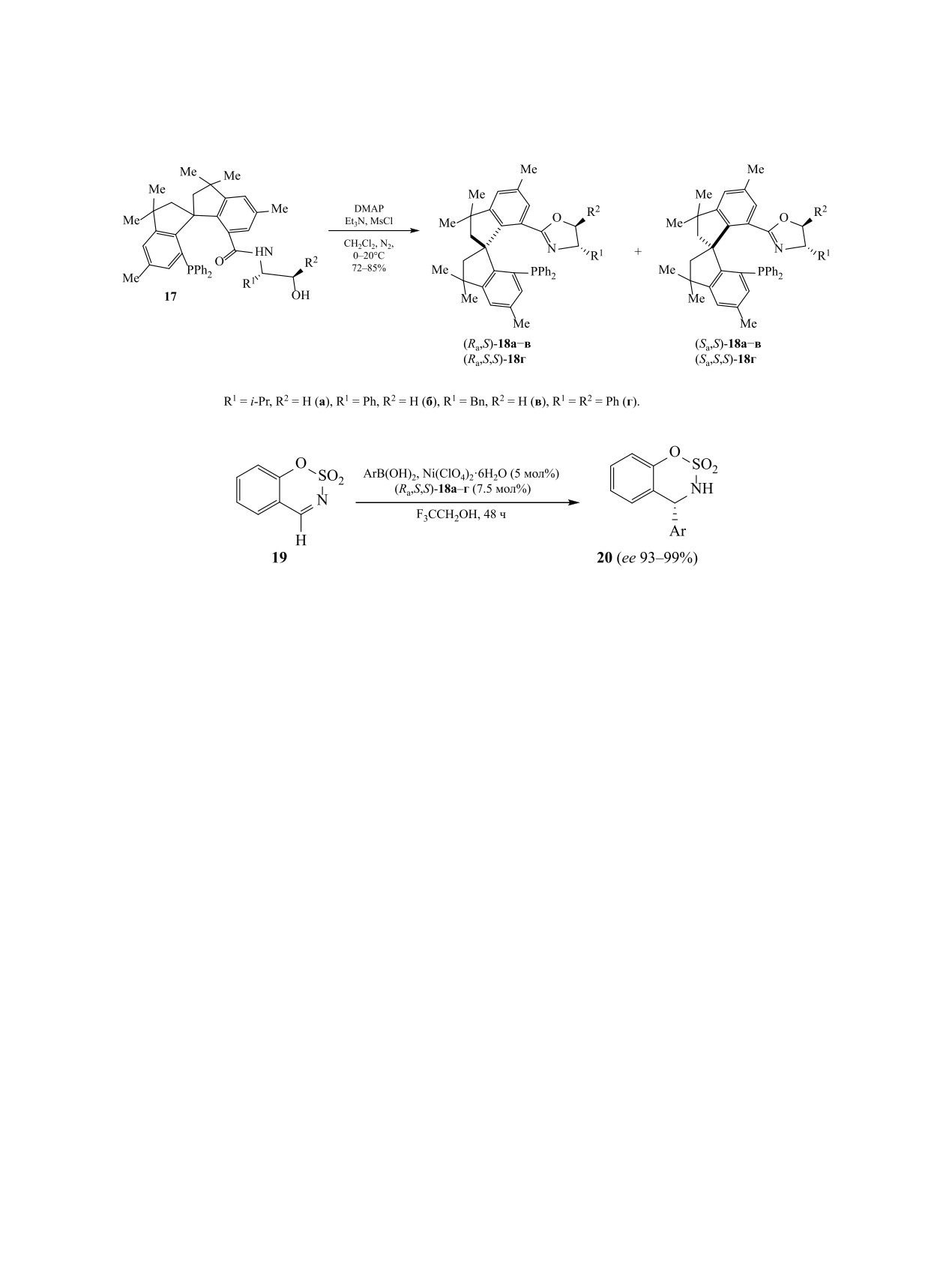
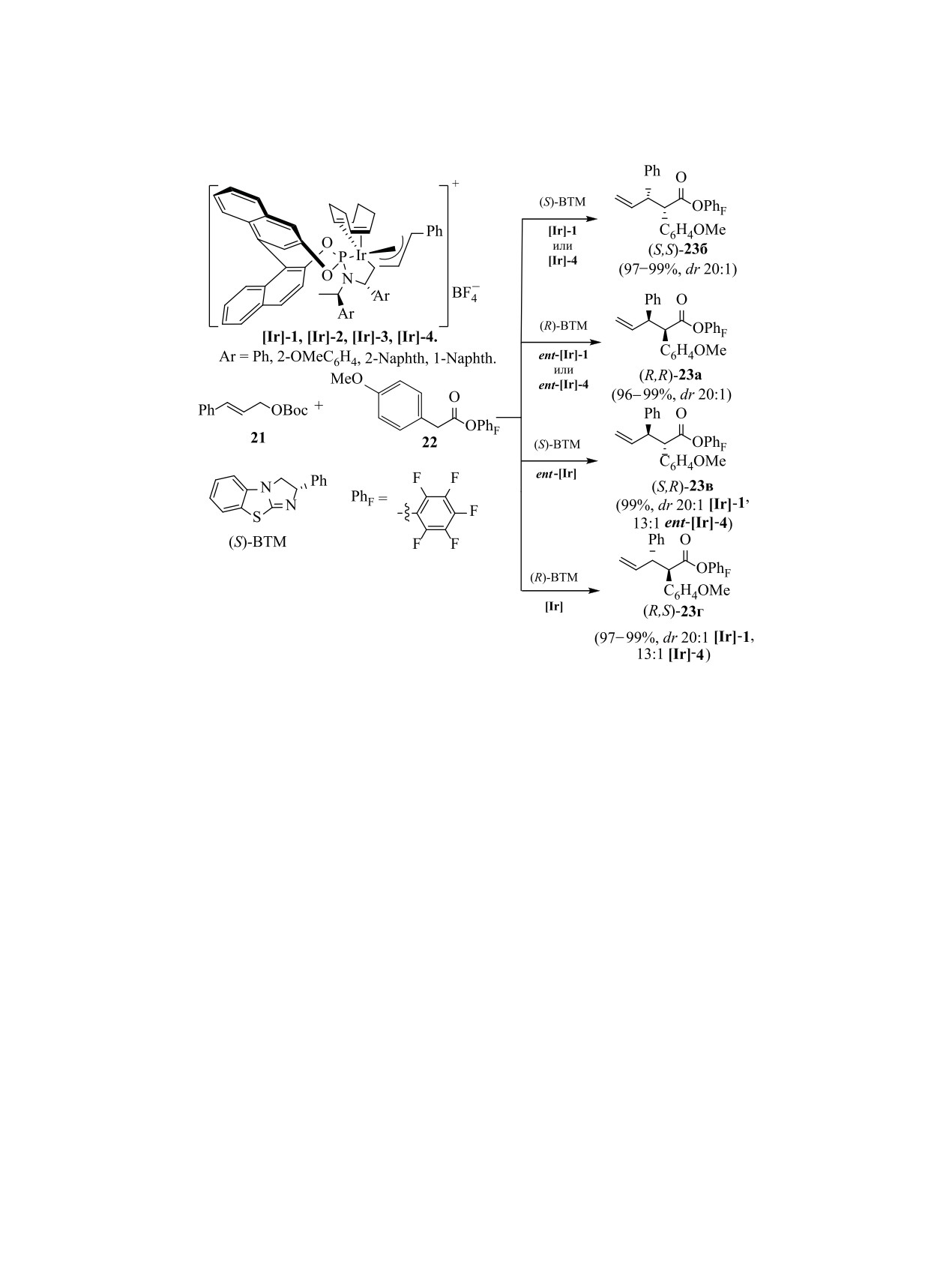
2.3. Новые стереоизомерные карбо- и гете-
стве лиганда 7.5 мол% оксазолидина (Ra,S,S)-18г.
роциклические лиганды и примеры исполь-
Растворитель оказывает значительное влияние на
зования стереоизомерных металлокомплексов
выход продуктов реакции. При арилировании в
в энантиоселективных синтезах. Металлоком-
CH2Cl2, толуоле, CHCl3, ацетонитриле или EtOH
плексы представляют собой уникальную конструк-
выход продукта и энантиоселективность реакции
цию, сочетание в которой природы металла и ли-
были ниже, чем в трифторэтаноле [75, 76].
ганда придают им свойства, присущие только этой
Хиральные бензотетрамизолы (BTM), содержа-
целостной системе. Они широко применяются как
щие изотиомочевинную группу, применяются при
катализаторы, в последние годы их используют так-
наведении связи углерод-углерод или углерод-ге-
же при получении наночастиц требуемого размера
тероатом в катализируемых переходными метал-
[74]. Учитывая ограниченный набор металлов,
лами реакциях аллилирования. Стереоизомерия в
важную роль в этой системе играет органическое
металлокомплексе и используемом азотсодержа-
лигандное окружение, синтез которых находится в
щем гетероциклическом основании существенно
фокусе пристального внимания. Из промышленно
влияет на структуру продукта реакции при взаимо-
доступного бисфенола С синтезировали фосфин
действии производного стирола 21 с эфирами ари-
17, циклизация которого дает диастереомерные
луксусной кислоты 22 в присутствии комплексов
оксазолидины 18 (схема 9). Гетероциклы 18 выде-
иридия и BTM (схема 11). Использование в каче-
ляли с помощью флеш-хроматографии с умерен-
стве предшественника нуклеофила пентафторфе-
ным выходом (36-44%, в зависимости от природы
нилового эфира 22 более продуктивно. Реакции,
заместителей R1 и R2). Индивидуализированные
проведенные со сложными эфирами, полученны-
изомеры гексаметилспироинданзамещенных окса-
золидинфосфинов (HMSI-PHOX) 18 использовали
ми из других электронодефицитных фенолов, та-
в качестве лигандов гексагидрата Ni(ClO4)2·6H2O,
ких как 4-нитрофенол и 2,4,6-трихлорфенол, дали
катализатора арилирования циклических N-суль-
соответствующие продукты с низким выходом.
фонилиминов
19
арилборными кислотами
При проведении реакции в присутствии (R)-ВТМ
(схема 10). Лучшие выходы (51-99%) соединений
вместо (S)-ВТМ полностью меняется диастереосе-
20 были достигнуты при использовании в каче-
лективность реакции [77].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1078
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 11.
3. АКСИАЛЬНАЯ ИЗОМЕРИЯ ПО СВЯЗИ
ходной молекулы винильные звенья в полученном
Cspx-Cspy И Cspx-ГЕТЕРОАТОМ
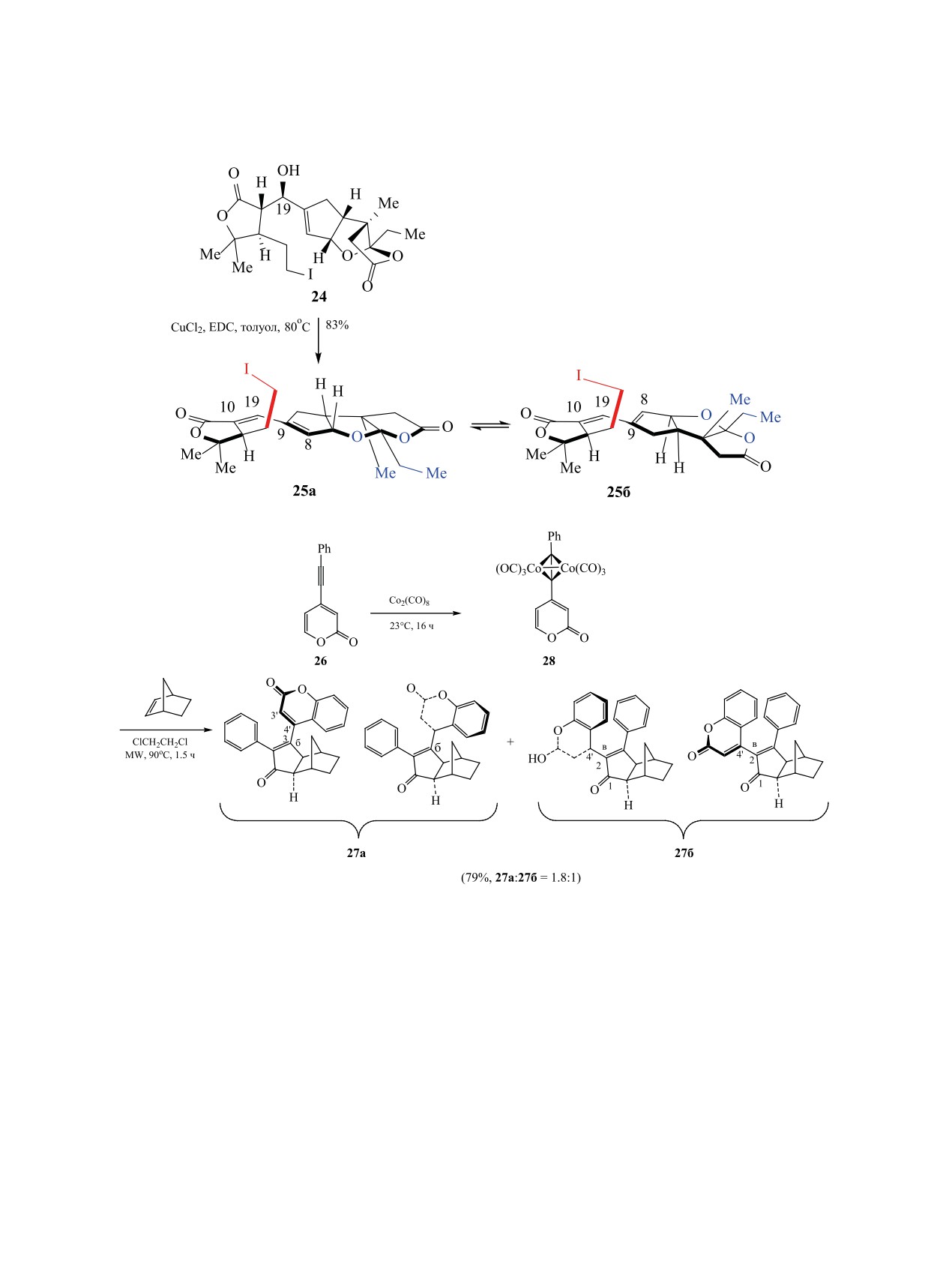
атропоизомере приобретают взаимную транс-ори-
ентацию. Обработка спирта 24 1-этил-3-(3-диме-
Известны как синтетические [78], так и при-
тиламинопропил)карбодиимидом (EDC) и CuCl2 в
родные аксиально-хиральные по связи Cspx-Cspy и
толуоле при 80°C приводит к диенам 25 с выходом
Cspx-гетероатом соединения [79, 80]. Существова-
83% (схема 12). Анализ спектров ЯМР показал,
ние стереоизомеров, аксиально-хиральных вдоль
что 1,3-диены 25 представляют смесь двух трудно
такой оси [81] при условии наличия неоднознач-
разделимых изомеров 25a и 25б. Структура изоме-
ных заместителей при атоме углерода Csp2, Csp3
ра 25б была подтверждена рентгеноструктурным
или азота Nsp3 в большинстве случаев легко обна-
анализом [85].
руживаются спектральными методами. Следует
также отметить, что при исследовании атропои-
В реакции Паусона-Ханда фенилэтинилпиро-
зомерии в органических соединениях наряду со
на 26, Co2(CO)8 и норборнена при микроволно-
спектральными методами, разделением методом
вом облучении получены два соединения, которые
ВЭЖХ и рентгеноструктурным анализом часто
попарно являются атропоизомерами 27a и 27б
используются компьютерные расчеты [82-84].
(схема 13). Первоначально из фенилэтинилкума-
2.1. Аксиально-хиральные по связи Csp2-Csp2
рина и Co2(CO)8 образуется комплекс 28. В синте-
молекулы. Описан уникальный случай аксиаль-
зированных соединениях существует затруднение
ной атропоизомерии по связи Csp2-Csp2, когда про-
вращения вокруг связи С3-С4’ (27a) и С2-С4’ (27б).
странственные изменения сопровождаются изме-
Расчетные значения энергетических барьеров ∆G
нением геометрической изомерии. При изменении
взаимного перехода атропоизомеров составляют
геометрии цис-ориентированного дивинильного
4.7 и 7.6 кДж/моль для изомеров 27б и 27a соот-
фрагмента сопряженной олефиновой системы ис-
ветственно [86].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1079
Схема 12.
Схема 13.
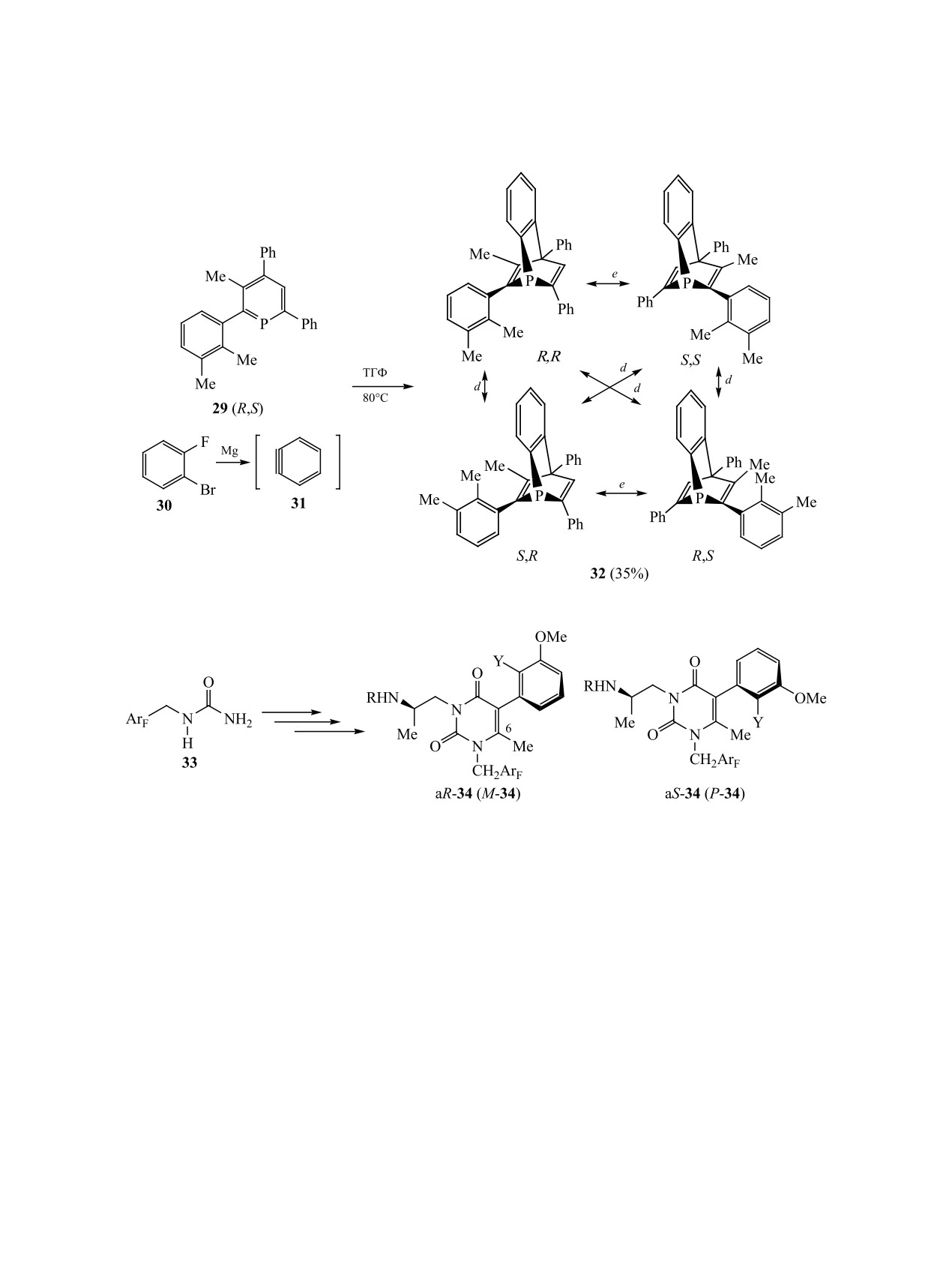
Реакция рацемической смеси фосфинина 29,
31P двух энантиомерных пар регистрируются при
полученного кипячением бортетрафторида три-
-65.0 и -66.4 м. д. соответственно (dr 2:3) [87].
арилпириллия с P(SiMe3)3 в ацетонитриле или с
Есть предположения, что объемные представители
P(СH2OH)3 в пиридине, с генерируемым из ди-
фосфабарелленов могут оказаться новыми лиган-
галогенида 30 бензином 31 приводит к четырем
дами для катализируемых металлокомплексами
стереоизомерам гетероцикла
32, выделенным
реакций кросс-сочетания [88].
хроматографированием с невысоким общим вы-
Биологически
активные
производные
ходом (схема 14). Существование изомеров до-
5-арил-6-метилурацила, которые в силу простран-
казано данными хиральной ВЭЖХ и спектроско-
ственных факторов являются атропоизомерами,
пией ЯМР. Разница в химических сдвигах атомов
могут быть получены исходя из N-(2,6-дифтор-
фосфора незначительна: сигналы в спектре ЯМР
или 2-фтор-6-трифторфенил)метилмочевины
33.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1080
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 14.
Схема 15.
Первой стадией в этой схеме синтеза является об-
с помощью хиральной ВЭЖХ выделены индиви-
разование 1-(ArF)метил-6-метилурацила, последу-
дуальные представители [89]. Если при атоме С6
ющими реакциями бромирования по положению
урацильного ядра метильная группа отсутствует,
С5, алкилирования по атому азота оптически ак-
атропоизомерия не наблюдается [90].
тивными N-Boc-замещенными производными эта-
3.2. Атропоизомерия по связи Csp2-Csp3. Изо-
ноламина, замещения брома на 2-Y-3-MeOC6H3-
мерия по связи Csp2-Csp3 возникает, когда при цен-
группу (где Y = F, Cl), удаления Boc-группы и
тре хиральности (sp3-гибридизированный атом
алкилирования по атому азота (R=циклопентил)
углерода) находятся достаточно объемные за-
синтезируют смесь изомерных гетероциклов 34
местители (например, трет-бутильная [91] или
(схема
15). Фторзамещенные производные
34
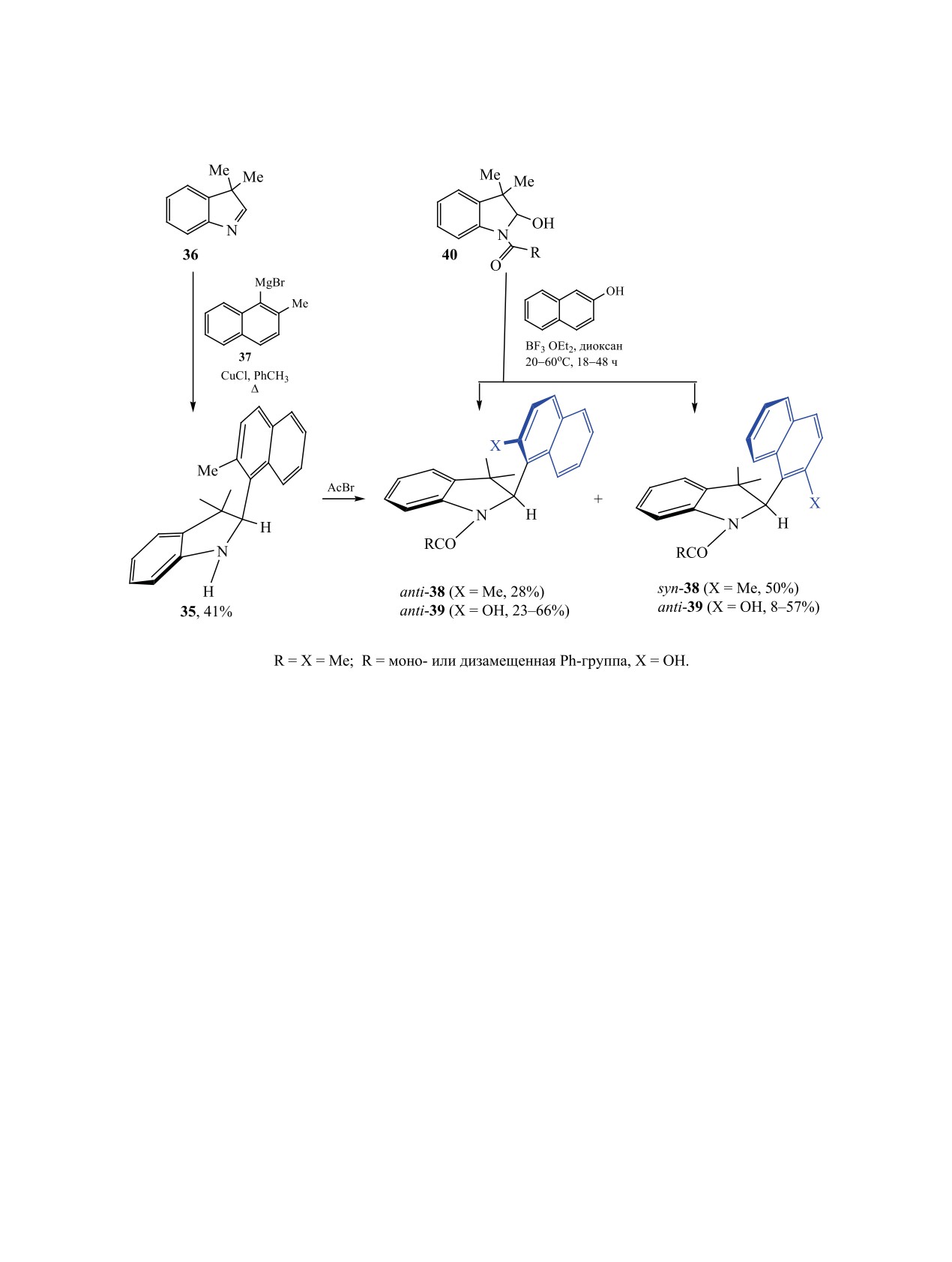
другая группа [92]). В индолине 35, синтезиро-
(Y=F), сигналы атомов которых в спектрах ЯМР
ванном из 3,3-диметилиндоленина 36 и реакти-
хотя и удваиваются, при комнатной температу-
ва Гриньяра 37 (свежеприготовленный из Mg и
ре подвержены быстрому взаимопревращению.
1-бром-2-метилнафталина в Et2O) в присутствии
Если заменить галоген (Y=Cl), то устойчивость к
CuCl в толуоле, авторы не обнаружили никаких
взаимопревращению повышается. В этом случае
признаков атропоизомерии [93]. Ацетилировани-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1081
Схема 16.
ем этого соединения синтезировали разделяемые
Конденсация нафтолов 41 с 2-хлор-2-нитрости-
хроматографией на силикагеле аксиальные вдоль
ролом 42 при участии органического катализатора
связи Csp2-Csp3 изомеры 38. Компьютерные расче-
43 в мягких условиях приводит к нафтофуранам
ты барьера энергии вращения вокруг оси Csp2-Csp3
44 (схема 17), из которых индивидуализировано
стабильных в обычных условиях гетероциклов 38
бромпроизводное (R1 = R2 = R3 = R5 = H, R4 = Br).
показал значения ≈30 ккал/моль (схема 16) [93].
На примере этого образца проанализирован меха-
Обращает на себя внимание изомерный состав ра-
низм реакции последующего окисления соедине-
нее синтезированных N-ароильных аналогов 39.
ния 44. Предполагается, что в этом случае атропо-
В этом случае, независимо от природы заместите-
изомеры быстро переходят друг в друга.
лей у бензоильного фрагмента, а также в случае
Вероятно, в случае син-конформера 44 подход
N-пропионильных и N-бутирильных произво-
к атому водорода при (R)-стереоцентре доступен
дных, преобладают анти-изомеры. В реакции N-
для окислителя, а в случае анти-изомера экрани-
ацетил-2-гидрокси-3,3-диметилиндолина с β-наф-
руется объемным атомом брома. Поэтому окис-
толом в присутствии BF3 образуется соединение
ление анти-изомера 44 диоксидом марганца про-
39 с преобладающим син-изомером. Для четырех
исходит намного медленнее. Главным продуктом
изомеров из 14 пар синтезированных соединений
окисления является (aS)-аксиально-хиральный
приведены данные рентгеноструктурного анализа
изомер 45, время полупревращения которого со-
[94]. Производные N-бензоил-3,3-диметил-2-ги-
ставляет от 12 дней до 1 млн лет в зависимости
дроксииндолина 40 обычно синтезируют путем
от природы заместителей в ароматических ядрах
добавления воды к N-ацил-2-хлор-3,3-димети-
линдолину. Этот гетероцикл легко образуется при
(схема 17) [96].
взаимодействии 2-хлор-3,3-диметилиндоленина с
Поворотные изомеры 46, получаемые анало-
соответствующим ацилхлоридом (cхема 16) [95].
гично реакцией
4,4-диметилциклогексан-1,3-,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1082
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 17.
Схема 18.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1083
Схема 19.
Схема 20.
циклогексан-1,3- (X = CH2), дигидропиран-2,4-
ставляют собой смеси сопоставимых количеств
(X = O), хромен-2,4- (X = O) и хинолин-2,4-дио-
конфигурационно-стабильных атропоизомеров,
на (X = NCH3) 47 с производным винилнафталина
возникновение которых связано с затрудненным
48, окисляют [PhI(OAc)2]. Использование Cs2CO3
вращением вокруг связи Csp3-Csp2 (анти/син-и-
при этом в качестве основания эффективнее, чем
зомеры 54 получены в соотношении 3:2 при R3 =
третичных аминов (Et3N, DMAP). Предполагает-
H или 2:3 при R3 = Alk). В то же время реакция с
ся, что окисление соединений 48 проходит через
енаминами ацетоуксусного эфира (R4 = OEt) дает
стадии образования вначале нитроната 49, затем
практически один анти-атропоизомер 54 [97].
двух конформеров 50. Поскольку существование
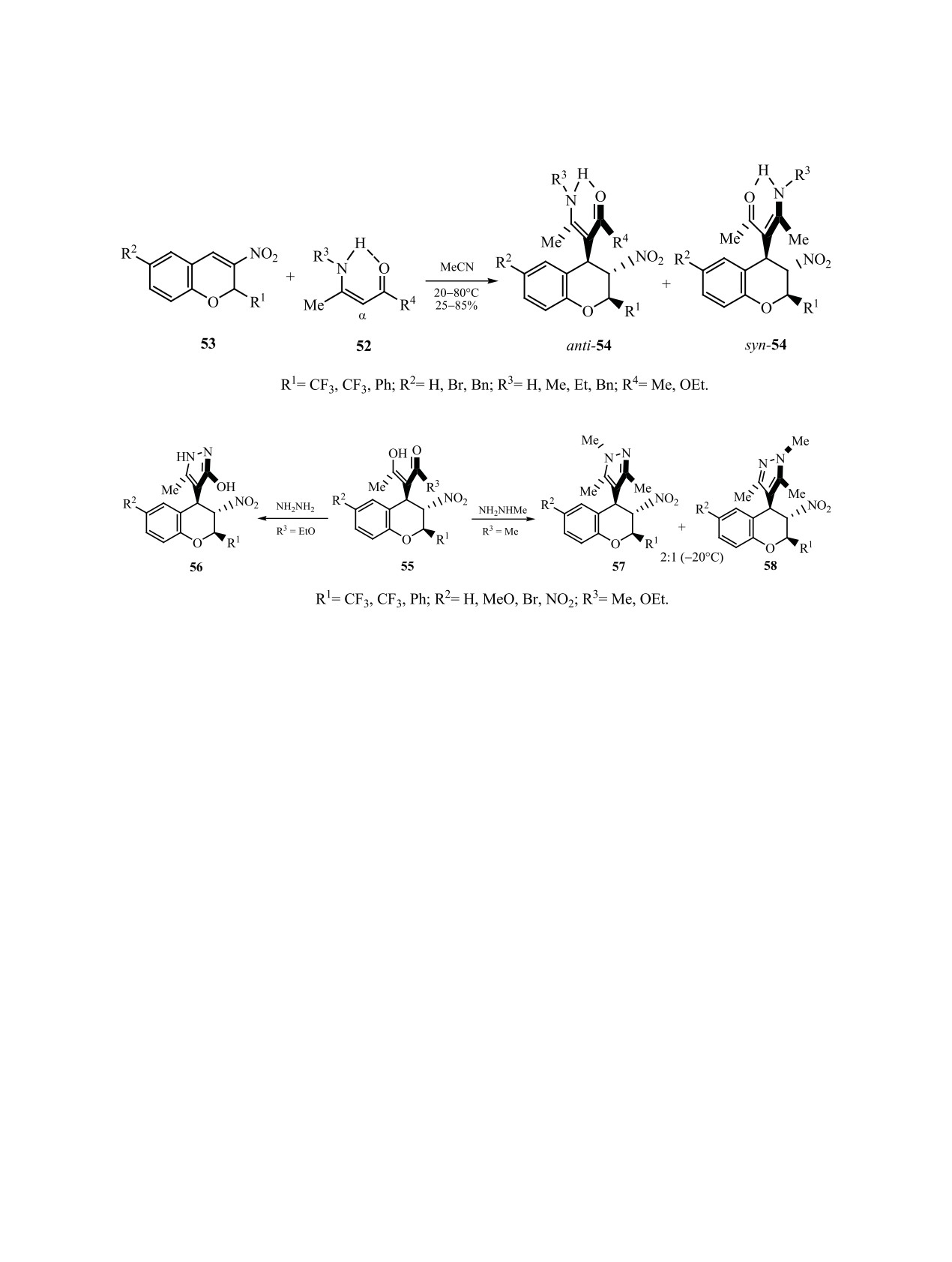
Реакцией 2-замещенных 3-нитро-2H-хроменов
син-изомера 50а менее предпочтительно из-за сте-
с ацетоуксусным эфиром или ацетилацетоном по-
рического эффекта более объемного, чем метокси-
лучены аддукты 55. При обработке этих соедине-
группа, нафталинового кольца, равновесие прак-
ний гидразином или метилгидразином образуют-
тически смещено в сторону анти-изомера 50б.
ся 2-R-3-нитро-4-(пиразол-4-ил)хроманы 56-58 с
Это и обеспечивает преимущественное наведение
all-trans-конфигурацией заместителей при пира-
(aS)-аксиальной хиральности при последующем
новом цикле (схема 20) [98, 99].
элиминировании в гетероцикл 51. Направление
3.3. Новые молекулы, атропоизомерные по
элиминирования с образованием (aR)-аналога ме-
связи Csp2-Nsp3. В катализируемой ариловыми
нее предпочтительно (схема 18) [96].
эфирами фосфорной кислоты (CPAs) 63 асимме-
Енамины 52 ацетоуксусного эфира или ацети-
тричной реакции аминирования N-арил-2-наф-
лацетона α-углеродным атомом присоединяются
тиламинов 59 азодикарбоксилатами 60 получены
по активированной двойной связи
2-R-3-ни-
аксиально-хиральные арилгидразины 61 с выхо-
тро-2Н-хроменов 53 (R = CF3, CCl3, Ph) с обра-
дами 85-95% (R3 = Boc, ee ≈94%) (схема 21). В
зованием
транс,транс-2,3,4-тризамещенных
случае заместителей R3 = EtO2C, i-PrO2C, Cbz у
хроманов 54 (схема 19). В случае енаминов аце-
атомов азота в азодикарбоксилате 65 выходы так-
тилацетона (R4 = Me) полученные аддукты пред-
же высокие (93-96%), но снижается энантиоселек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1084
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 21.
Схема 22.
тивность (ее 20-23% при R3 = EtO2C, i-PrO2C; ее
собой H или F], легко вступает в реакцию с тетра-
67% при R3 = Cbz). После оптимизации условий
цианоэтиленом в ТГФ с образованием двух атро-
реакции хиральная 2,6-ди(9-фенантрил)динафто-
поизомерных конъюгатов Ra-64 и Sa-64 с хорошим
фосфорная кислота (Ar = 9-фенантрил) признана
выходом (схема 22). По данным РСА, в обоих изо-
лучшим катализатором. В случае R2 = p-CN реак-
мерах фрагмент TCBD (тетрацианобутадиен) - не
ция аминирования не идет [100].
плоский, и торсионный угол (φ) между четырьмя
атомами углерода остова бутадиена, близок к 85°.
3.4. Атропоизомерные по связи Csp2-Csp2
Вследствие такой геометрии двух дициановиниль-
борсодержащие соединения. Наряду с атропои-
ных (DCV) фрагментов образуются два атропоизо-
зомерными по связи Bsp3-Ar соединениями [101],
мера Ra-64 и Sa-64 (схема 22) [102].
известны также представители, в которых есть
торможение вращения по связи Csp2-Csp2. Гетеро-
2.5. Молекулы с двумя аксиально-хиральны-
цикл 62, полученный при взаимодействии фени-
ми фрагментами. Известно несколько примеров
лацетилена с субфталоцианином 63 [(H12SubPc)
синтеза соединений с двумя аксиально-хираль-
или (F12SubPc), где периферические атомы фтало-
ными фрагментами через металлирование ами-
цианиновых ароматических колец представляют
дов ароматических карбоновых кислот [103, 104].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1085
Схема 23.
Схема 24.
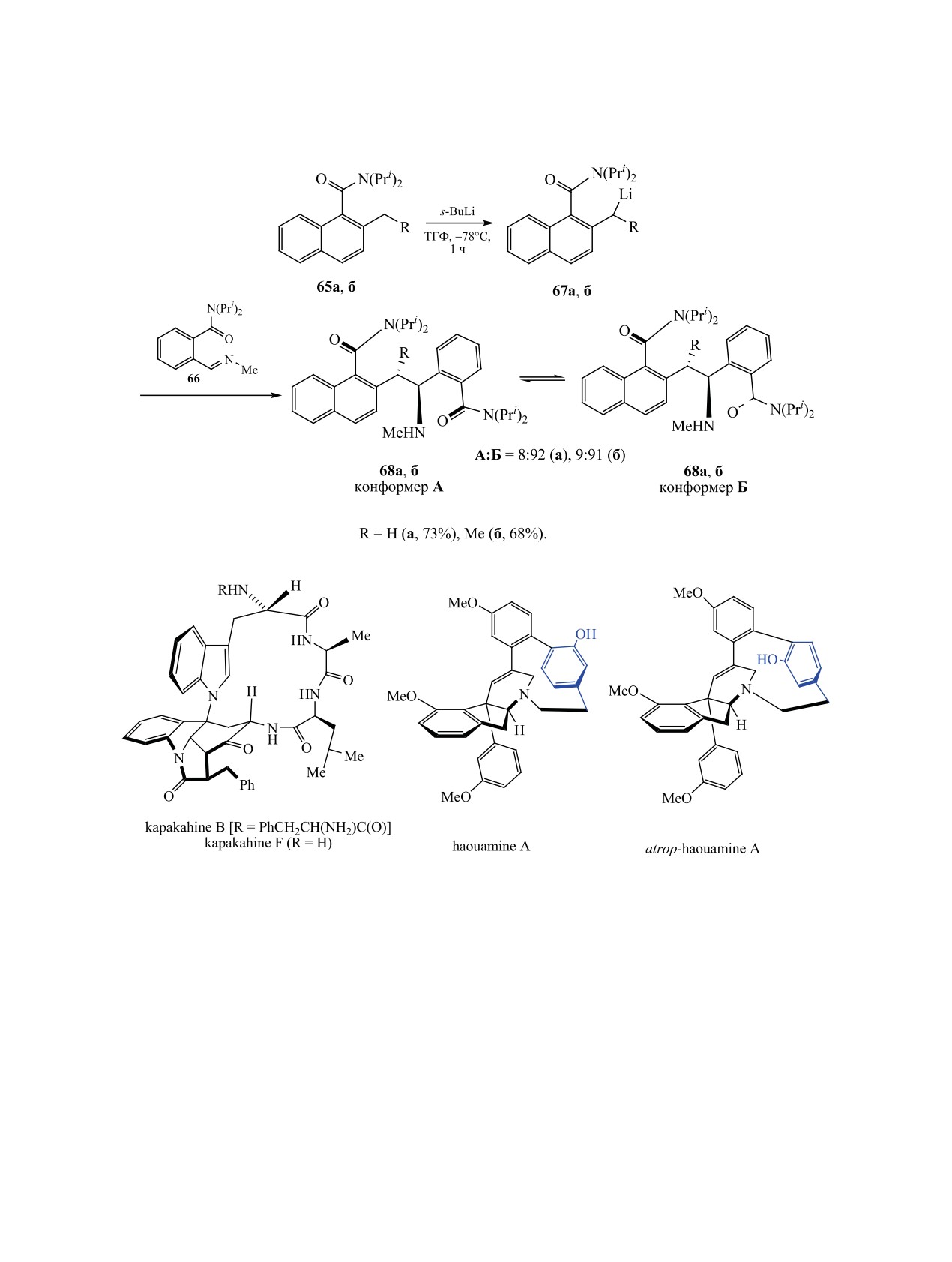
Литиирование 2-алкилнафтилкарбамидов 65a, б и
рия [105-107]. Например, в алкалоидах kapakahine
последующее добавление основания Шиффа 66 к
B и F [108], complestatin и isocomplestatin [109],
продукту металлирования 67 приводит к соедине-
haouamine A (схема 24), а также в гликопептидных
ниям 68, в которых индуцируются две оси и два
антибиотиках наблюдается ограничение вращения
центра хиральности (в случае нафтиламида 65a
некоторых фрагментов [110].
один, в случае амида 65б два центра). Авторы обо-
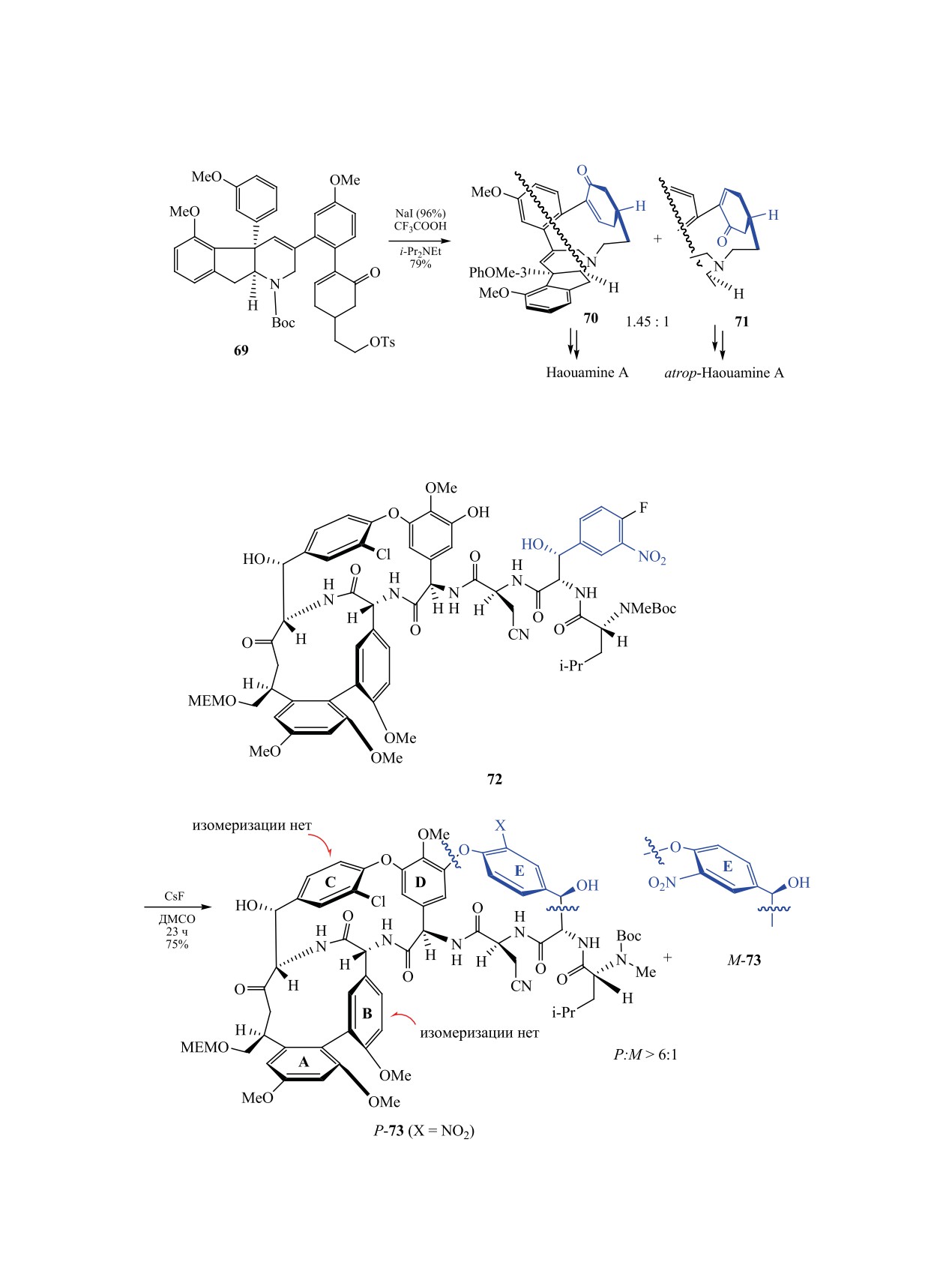
При получении алкалоида haouamine A и его
значили их как «конформер A» и «конформер Б»,
изомера atrop-haouamine A из соединения 69 обра-
их соотношение колеблется около 1:9 (схема 23)
зуются легко разделяемые атропоизомерные пред-
[104].
шественники 70 и 71 с хорошим общим выходом
3.6. Атропоизомерия в циклофанах. Из-за сте-
(схема 25).
рического препятствия, создаваемого в некоторых
Реакция макроциклизации индана 69 прохо-
частях молекулы вращению фрагмента относи-
дит в три этапа. Сначала индан 69 обрабатывают
тельно плоскости цикла, возникает атропоизоме-
иодидом натрия при комнатной температуре, после
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1086
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 25.
Схема 26.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1087
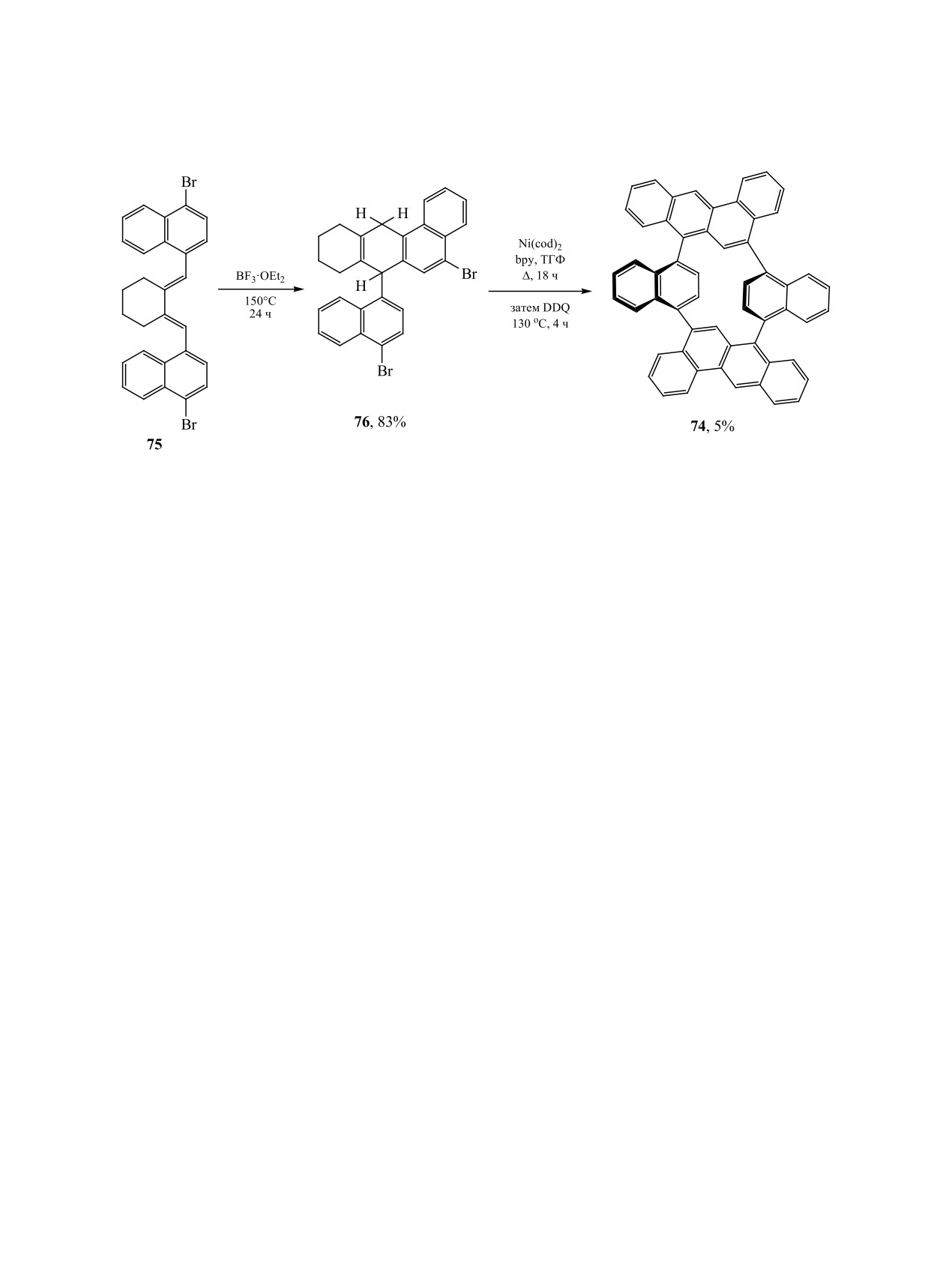
Схема 27.
чего Boc-защитную группу удаляют действием
сом Ni(cod)2 конденсация двух молекул дибромида
CF3COOH при 5°С, затем выдерживают в кипя-
76 происходит при кипении в ТГФ. Продукт кон-
щем ацетонитриле в течение 24-26 ч [111]. Полу-
денсации окисляется 2,3-дихлор-5,6-дицианохино-
ченные соединения 70 и 71 превращают в алкало-
ном при 130°С до соединения 74. Продуктивность
иды haouamine A и atrop-haouamine A (схема 25).
последней стадии в этой схеме низкая, происходит
почти 20-кратная потеря атомов, макроцикл 74 по-
Антибиотик ванкомицин привлекает внимание
лучен с выходом 5% (схема 27) [115].
исследователей в течение нескольких десятилетий
[112-114]. Ранее было показано, что применение
Энантиомеры диметокситриптицена 77 выде-
избытка CsF (6 экв.) эффективно для создания
ляют хроматографированием рацемата на хираль-
новой C-O-связи между атомом ароматического
ных ВЭЖХ-колонках. Индивидуальные изомеры
углерода и атомом кислорода фенольного звена
(+)-77 и (-)-77 при нагревании в орто-дихлорбен-
соединения 72 для получения третьего макро-
золе в присутствии 0.1 экв. FeCl3 конденсируется в
циклического фрагмента [114]. В образующейся
продукты циклотримеризации - (O-метил)6-2,6-ге-
равновесной смеси макроциклов 73 (X = NO2) пре-
лиц[6]арены (+)-P-78 (41%) и (-)-M-78
(43%)
обладает P-изомер (DE-атропоизомер) (схема 26).
(схема 28) [116].
Проведение последующих реакций введения ато-
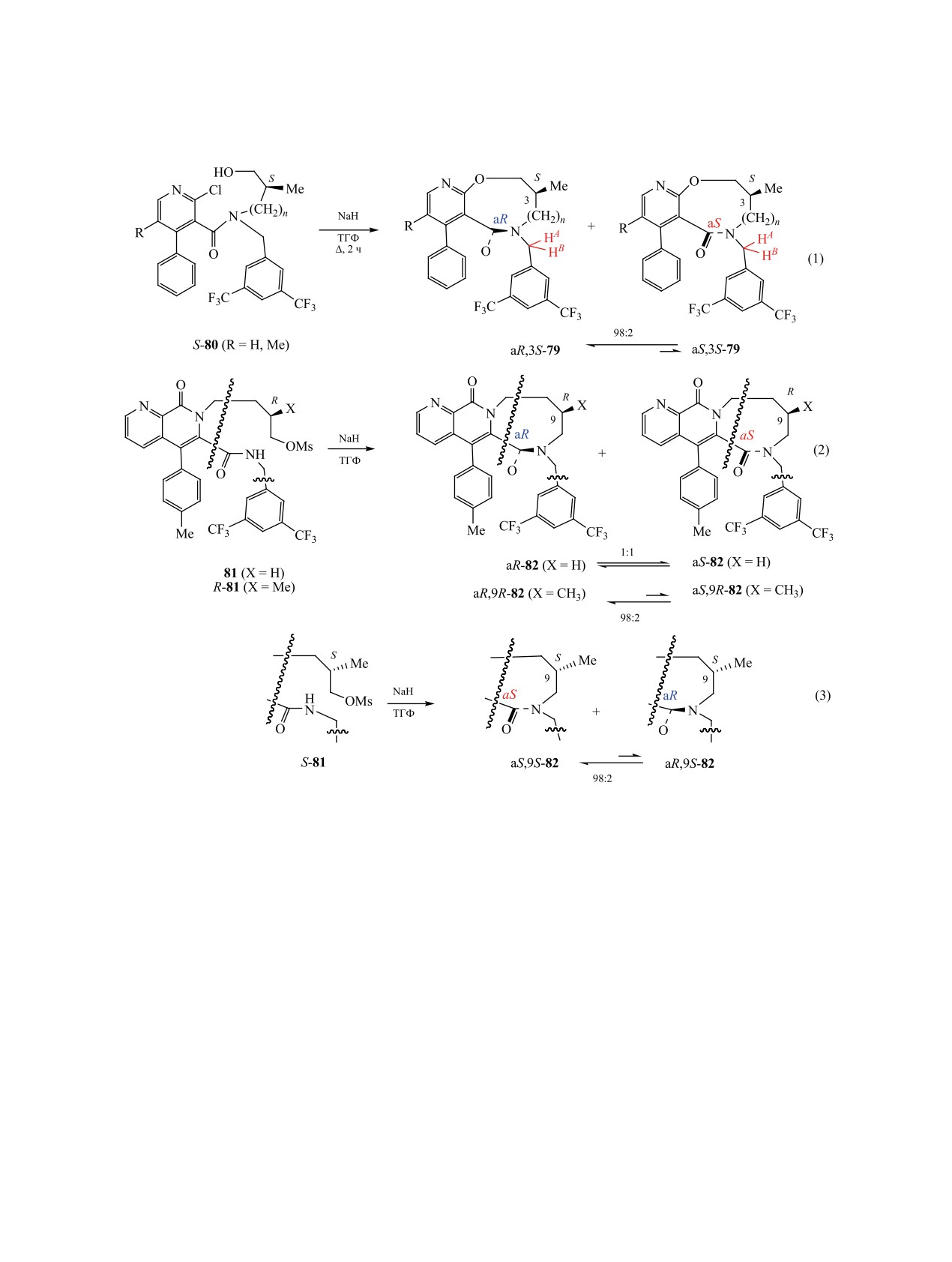
Смесь атропоизомерных производных пири-
ма хлора вместо нитрогруппы (X = Cl) через ста-
доксазепана и пиридоксазоцина 79 (n = 0, 1) полу-
дии восстановления нитрогруппы до аминогруп-
чают нагреванием замещенных 2-хлорпиридинов
пы (H2, Pd/C), диазотирования полученного амина
80 с гидридом натрия в ТГФ. В спектрах ЯМР ге-
действием t-BuONO в присутствии HBF4 и заме-
тероциклов при n = 0 последствия атропоизомерии
щения диазогруппы на хлор при взаимодействии
выражены слабо и пики метиленовых протонов
с CuCl2-CuCl не влияют на DE-атропоизомерию.
ди(трифторметил)бензильного фрагмента соеди-
Наряду с успешными подходами в некоторых
нения 79 регистрируются в виде синглета. При уд-
случаях при получении циклических представи-
линении цепи насыщенного гетероциклического
телей атропоизомерных молекул из-за специфич-
кольца эффекты торможения взаимопревращения
ности используемых исходных соединений наблю-
преобладающего (aR,3S)-конформера и минор-
дается низкий выход целевого продукта реакции.
ного (aS,3S)-аналога в спектрах ЯМР становятся
Первая реакция в схеме синтеза соединения 74 -
более заметными. Кипячение этих конформеров в
внутримолекулярная реакция Фриделя-Крафтса
течение 2 ч в толуоле не приводит к изменению
1,2-ди(нафтилметилиден)циклогексана 75 - про-
соотношения [схема 29, реакция (1)] [117]. При
текает в жестких условиях при катализе трифтори-
взаимодействии мезилатов 81 с гидридом натрия в
дом бора. Последующая катализируемая комплек-
кипящем ТГФ получают атропоизомерные гетеро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1088
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 28.
циклы 82. Равновесное соотношение конформеров
Реакцией [2+2+2]-циклоприсоединения диина
в случае заместителя X = CH3 смещено в сторо-
83 с симметричными и несимметричными аце-
ну гетероцикла (aR,9R)-82 [схема 29, реакция (2)].
тиленами 84 в присутствии CpCo(CO)2 при ос-
вещении электрической лампой синтезируют ал-
Для проведения биологического скрининга кипя-
локолхицин (R1=H, R2=CO2Me) и его аналоги 85.
чением из энантиомера S-81 аналогично получают
Карбоциклы представляют собой смесь быстро
атропоизомеры (aS,9S)-82 и минорный (aR,9S)-82
превращающихся друг в друга атропоизомеров. В
[схема 29, реакция (3)]. Во всех случаях энантио-
случае несимметричных замещенных ацетиленов
меры выделены кристаллизацией из этанола или
получены два неразделимых продукта реакции.
с помощью хиральной ВЭЖХ (время полупре-
После удаления пара-метоксибензильной груп-
вращения в зависимости от температуры среды
пы (PMB) в случае метилового эфира гептиновой
37-50°С составляет от 60 до 15 ч). Исследование
кислоты CH3(CH2)3C≡CCO2Me 84 были получены
биологической активности показали, что in vitro
изомеры 85, 86 с метоксикарбонильной группой
ингибирующая активность некоторых клеточных
(R1 = C4H9, R2 = CO2Me) при углеродном атоме
процессов у (aR,9R)-изомера в 750 раз выше, чем у
С10 (33%) и бутильной группой (R1 = CO2Me, R2 =
(aS,9S)-энантиомера [118, 119].
C4H9) при этом же атоме С10 (49%). В случае
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1089
Схема 29.
2-фенилпропаргилового эфира PhC≡CCO2Me 84
новного продукта реакции (схема 31) [122]. Кроме
удалось выделить только один изомер (62%). На-
гетероциклов 89, в реакционной смеси содержится
греванием метанольного раствора колхицина 87
до 4% пары аксиально-хиральных aR- и aS-изомер-
и свежеприготовленного MeONa получали алло-
ных сульфонов, продуктов окисления до SO2.
колхициновую кислоту 85 (R1 = H, R2 = COOH)
Известен довольно большой ряд парацикло-
(схема 30) [120, 121].
фанов, состоящих из двух бензольных колец, па-
Окислением 1,5-бензотиазепин-4-она 88 дей-
ра-положения которых связаны звеньями CH2CH2,
ствием м-хлорпербензойной кислотой (m-CPBA)
вращение вокруг углерод-углеродной связи в та-
получена смесь диастереомерных S-оксидов 89а
ких соединениях практически отсутствует. Об-
(aS*,1S*) и 89б (aS*,1R*) (анализ на нехиральном
ласть их применения достаточно широка, поэтому
адсорбенте показал равновесное соотношение
разработка новых подходов для получения функ-
≈ 5:1). Удалось разделить все энантиомеры 89аа,
ционализированных производных также при-
89аб, 89ба и 89бб этой диастереомерной пары.
влекает внимание специалистов, работающих в
Окисление при -78°C привело к аналогичному ре-
области синтетической органической химии
зультату: был получен изомер 89а в качестве ос-
[123-127].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1090
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 30.
Схема 31.
4. НОВЫЕ ПРИМЕРЫ ВЛИЯНИЯ
Стереоизомерия в исходных субстратах в боль-
СТЕРЕОИЗОМЕРИИ НА СТРУКТУРУ
шинстве случаев также определяет направление
ПРОДУКТОВ РЕАКЦИИ
реакций конденсации, циклизации, присоедине-
ния или замещения под действием кислот, осно-
При получении асимметричных представите-
ваний, комплексов металлов или радикалобразую-
лей гетеро-, карбо- и ациклических молекул часто
щих реагентов.
используются аксиально- или планарно-хираль-
ные лиганды комплексов металлов, гелицены,
4.1. Эффект аксиальной хиральности в ре-
аминные основания, карбоновые кислоты, фос-
акции внутримолекулярной конденсации. Ци-
фор-, сероорганические соединения
[128-133].
клоконденсация амида 89 под действием 1 экв.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1091
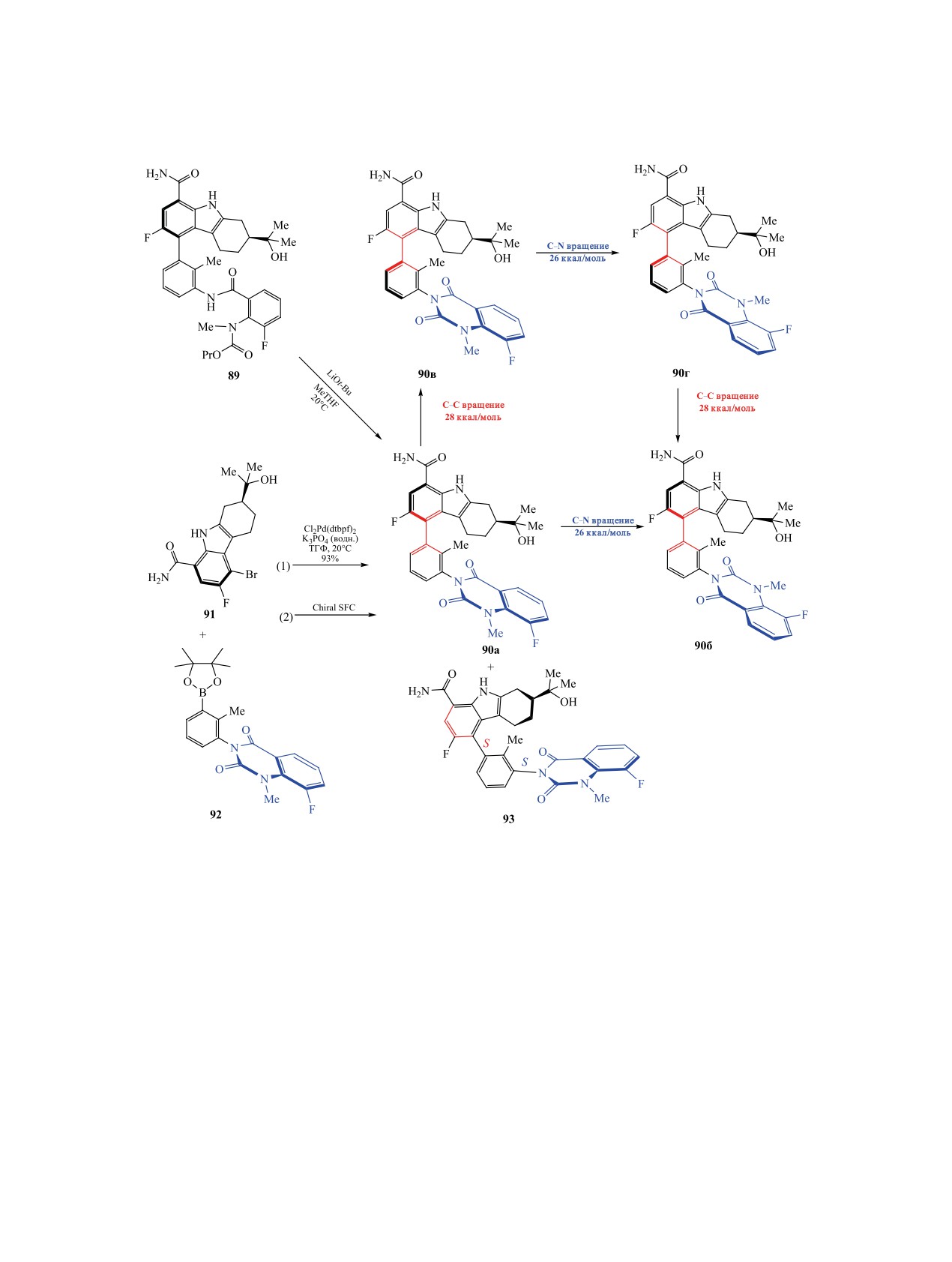
Схема 32.
KOt-Bu в ТГФ приводит к диастереомерам 90а и
да палладия с 1,1′-бис(ди-трет-бутилфосфино)
90б с низкой диастереоселективностью (dr 6:1 при
ферроценом (dtbpf) (стадия 1). Выделяли хрома-
R = Pr, dr 1:1.5 при R = Ph) (схема 32). Исполь-
тографированием на хиральном адсорбенте в виде
зование каталитических количеств LiOt-Bu в ди-
одного стабильного атропоизомера с выходом 54%
оксане способствует повышению диастереоселек-
из смеси, содержащей (5S,3S)-аналог 93 (стадия 2)
тивности до 40:1. Атропоизомер 90б отсутствует
[134-136] (схема 32).
и через 24 ч при низких температурах (<10°C).
4.2. Атропоизомерные молекулы в реакциях
При повышении температуры до 35°С происхо-
циклоприсоединения. Реакции циклоприсоеди-
дит небольшая изомеризация. Растворитель прак-
нения широко используются в синтетической ор-
тически не влияет на изомеризацию, корреляция
ганической химии для получения различных кар-
между концентрацией и скоростью изомеризации
бо- и гетероциклических соединений [137-141].
отсутствует. Соединение 90а (5R,3S-изомер) ранее
Эффективным методом при образовании новых
был получен реакцией тетрагидрокарбазола 91 и
связей углерод-углерод или углерод-гетероатом
соединения 92 в присутствии комплекса дихлори-
служит
[3+2]-циклоприсоединение дипольных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1092
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 33.
Схема 34.
частиц к диполярофилам [142-148], в том числе и
изводное пирролидина
95a с количественным
протекающие с атропоизомерной индукцией.
выходом, но с низкой диастереоселективностью
В реакции циклоприсоединения 3-метилиден-
(dr 65:35, схема 33). Усиление стерического за-
индолона 94 с in situ генерируемым из N-бен-
труднения при группе R = CHPh2 азометинилида
зил-N-метоксиметил-N-триметилсилилметила-
не влияет на стереоселективность реакции (95б dr
мина [149] азометинилидом (R = CHPh), в смеси
66:34). В реакции Дильса-Альдера индолона 94
трифторуксусная кислота-толуол получено про-
с избытком 2,3-диметил-1,3-бутадиена в присут-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1093
Схема 35.
Схема 36.
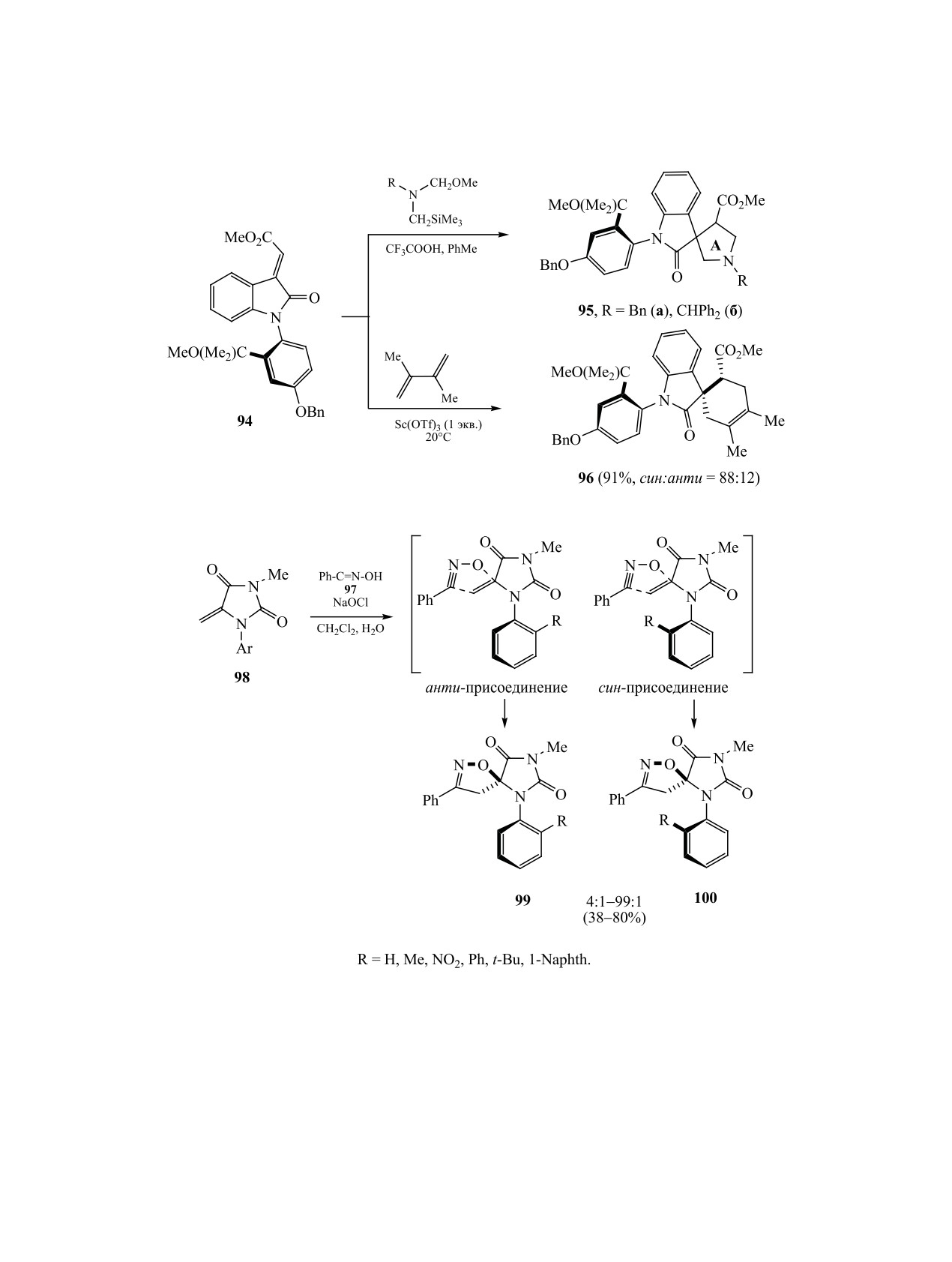
ствии Sc(OTf)3 образуется аддукт 96 (соотноше-
цина 101 представляет собой смесь двух атропои-
ние син:анти = 88:12) (схема 33) [150].
зомеров. Тем не менее, это не влияет на структуру
Заслуживают внимания эффекты атропоизо-
продуктов трансформации мюнхнона 102, генери-
руемого при нагревании соединения 101 в уксус-
мерной индукции при взаимодействии смеси энан-
ном или трифторуксусном ангидридах при 55°С.
тиомеров аксиально-хирального диполярофила с
активной дипольной молекулой. Так, бензонитри-
Обусловлено это тем, что стереоцентр на α-угле-
родном атоме аминокислоты при образовании
оксид, генерируемый из N-фенилгидроксилимина
мюнхнона теряется. Последующяя вторая стадия -
97 действием гипохлорита натрия, вступает в ре-
внутримолекулярное
[3+2]-циклоприсоединение
акцию [3+2]-циклоприсоединения с N-арил-5-ме-
тилиденимидазол-2,4-дионом 98 с образованием
мюнхнона к олефиновой группе - приводит к сме-
си региоизомеров оксазолохинолинов 103,
104
имидазолизоксазол-спиросочлененных соедине-
(схема 35).
ний 99 и 100, во всех случаях анти-изомеры пре-
обладают (схема 34). Существует некоторая зави-
При образовании единственных оксадиазо-
симость соотношения анти- и син-аддитивных
ло[3,2-а]циннолинов 105 [156, 157] при внутри-
продуктов от природы заместителя R в арильной
молекулярном диполярном циклоприсоедине-
группе гидантоина 98. Наибольший вклад в атро-
нии сиднонов 106, на стадии их генерирования
поизомерную индукцию при циклоприсоединении
из атропоизомеров нитрозоаминокислот 107 при
вносят 2-нитро-, 2-фенильная и 2-трет-бутильная
обработке их уксусным ангидридом, стереоцентр
группы в арильном фрагменте, благоприятствую-
при α-углеродном атоме аминокислоты также ис-
щие предпочтительному анти-[3+2]-циклоприсо-
чезает (схема 36).
единению [151, 152].
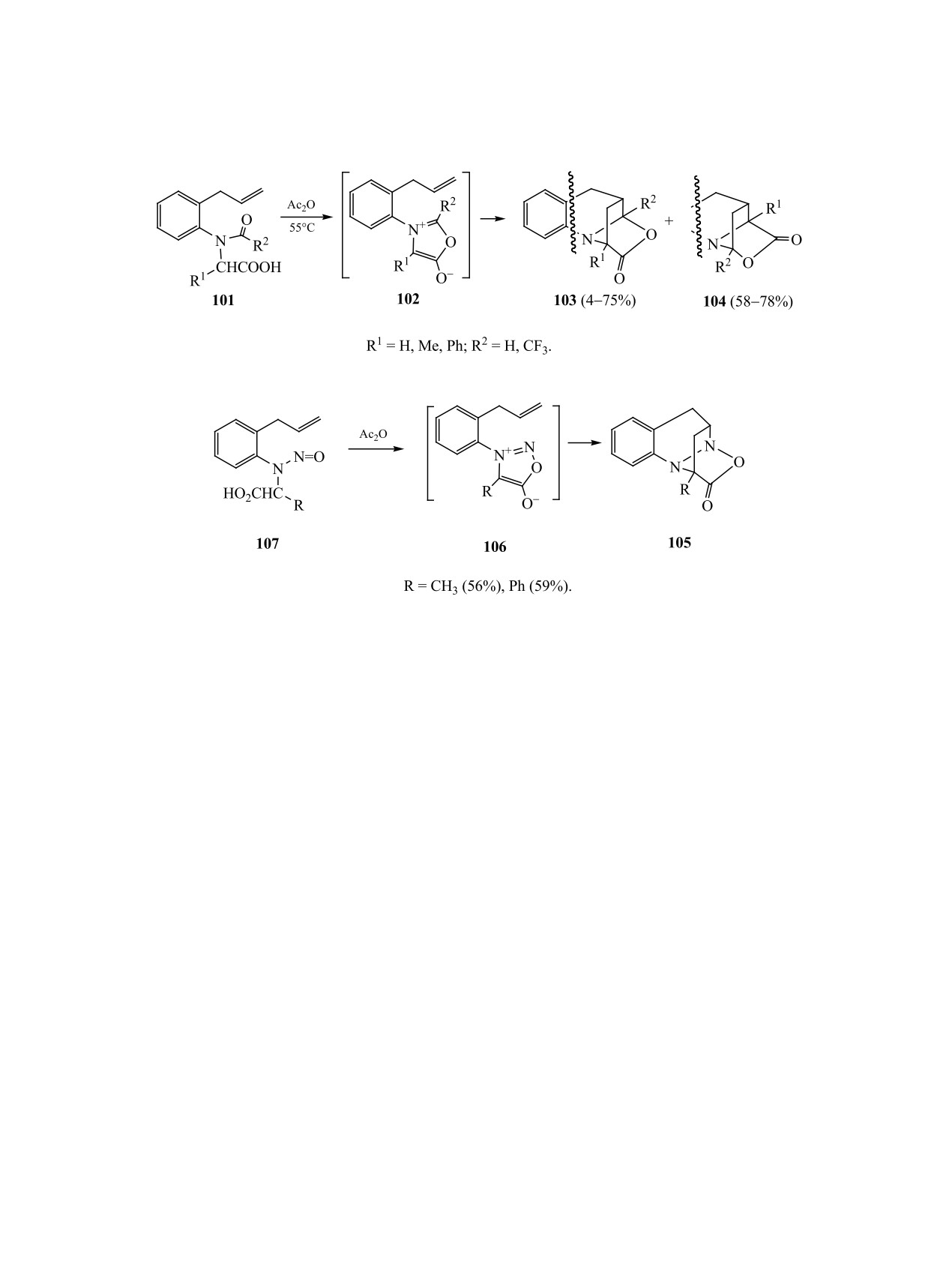
В более поздних работах были исследованы
Впервые на реакции циклоприсоединения
атропоизомеры, у которых кроме оси хиральности
мюнхнонов, генерируемых из N-ацил-N-(2-аллил-
существует центр хиральности при орто-алке-
фенил)глицинов, обратил внимание А. Падва с
нильном заместителе. В таких системах в случае
коллегами [153-155]. Молекула аллилфенилгли-
аналогов, у которых при втором орто-положении
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1094
ГАТАУЛЛИНА, ГАТАУЛЛИН
Схема 37.
Схема 38.
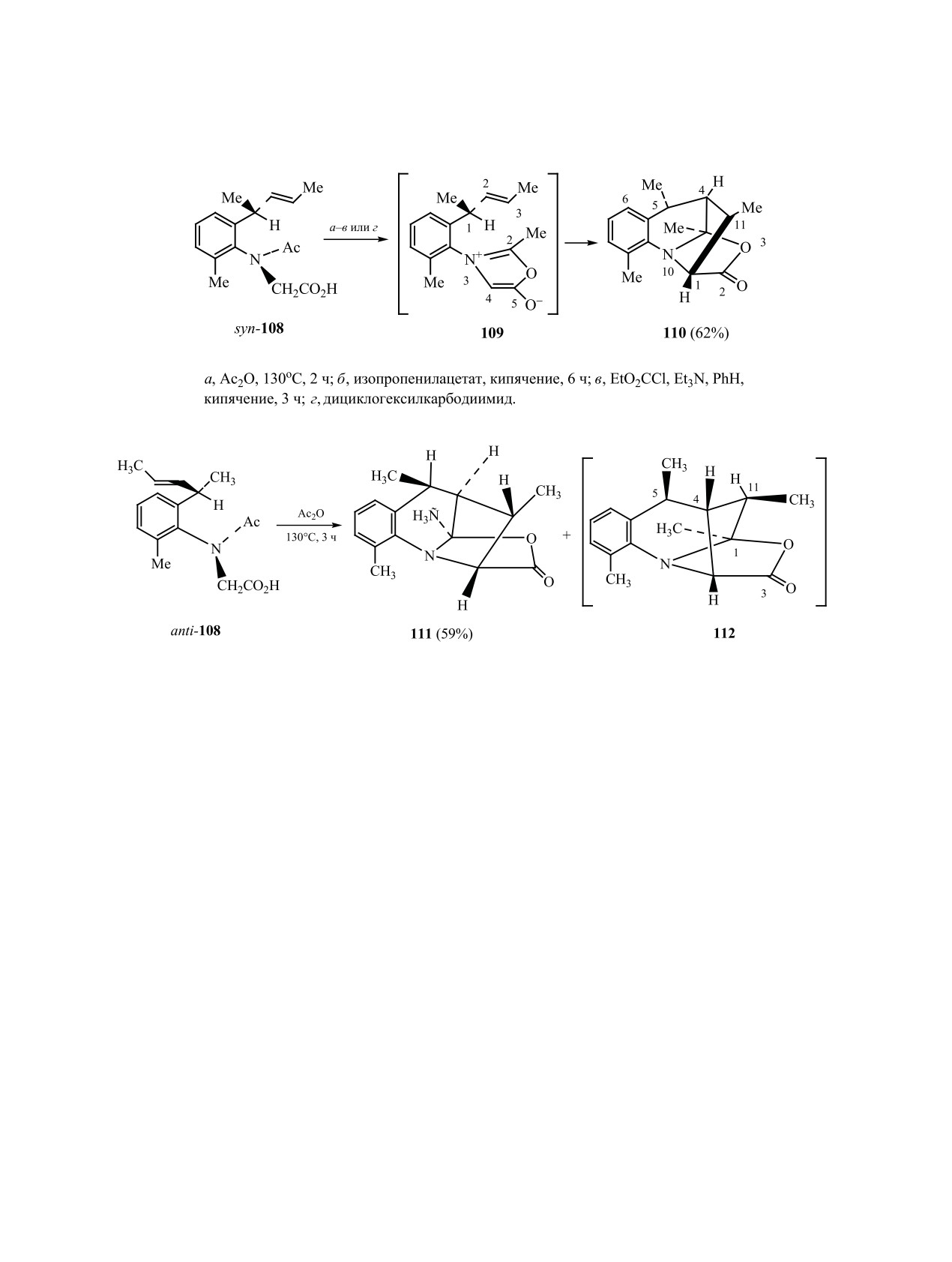
нет метильного заместителя, взаимопревращение
б в Ac2O анти-изомер исчезает из реакционной
изомеров происходит при низких температурах
смеси с образованием гетероциклов 114a, б. В от-
[158, 159]. При появлении метильной группы при
личие от аналога 115 мюнхон 116, полученный из
втором орто-углеродном атоме ароматического
син-изомеров, не вступает в реакцию циклоприсо-
кольца взаимные переходы этих изомеров стано-
единения, поэтому кислоты syn-113a, б после обра-
вятся практически невозможными и при более
ботки реакционной смеси водой возвращаются без
жестких условиях реакции. Устойчивые атропои-
изменений. Кипячение индивидуальных образцов
зомерные производные глицина могут быть выде-
syn-113a, б кислоты в уксусном ангидриде с увели-
лены в чистом виде. При нагревании изомера кис-
чением времени реакции до 10 ч приводит к появ-
лоты syn-108 с ангидридами карбоновых кислот,
лению минорных гетероциклов 117a, б (схема 39).
алкилкарбодиимидом или изопропенилацетатом,
Основными продуктами циклоприсоединения и в
в качестве главного продукта реакции внутримо-
этом случае являются изомеры 114а, б [161, 162].
лекулярного циклоприсоединения мюнхнона 109,
Наблюдаемое в спектрах ЯМР некоторых ами-
генерируемого в этих условиях, образуется гетеро-
дов динамическое равновесие удвоенных сигна-
цикл 110 (схема 37) [160].
лов протонов и атомов углерода обусловлено ро-
Метаноксазолохинолин 111 образуется из изо-
тамерией по оси атом азота—ацильный фрагмент
мера anti-108 в качестве основного продукта ре-
[163, 164]. В редких случаях торможение враще-
акции (содержание неиндивидуализированного
ния по этой связи достаточно жесткое, что может
предполагаемого изомера, 112 по данным ЯМР 1Н,
отразиться на структуре продуктов реакции. Есть
достигает ≈12%) (схема 38).
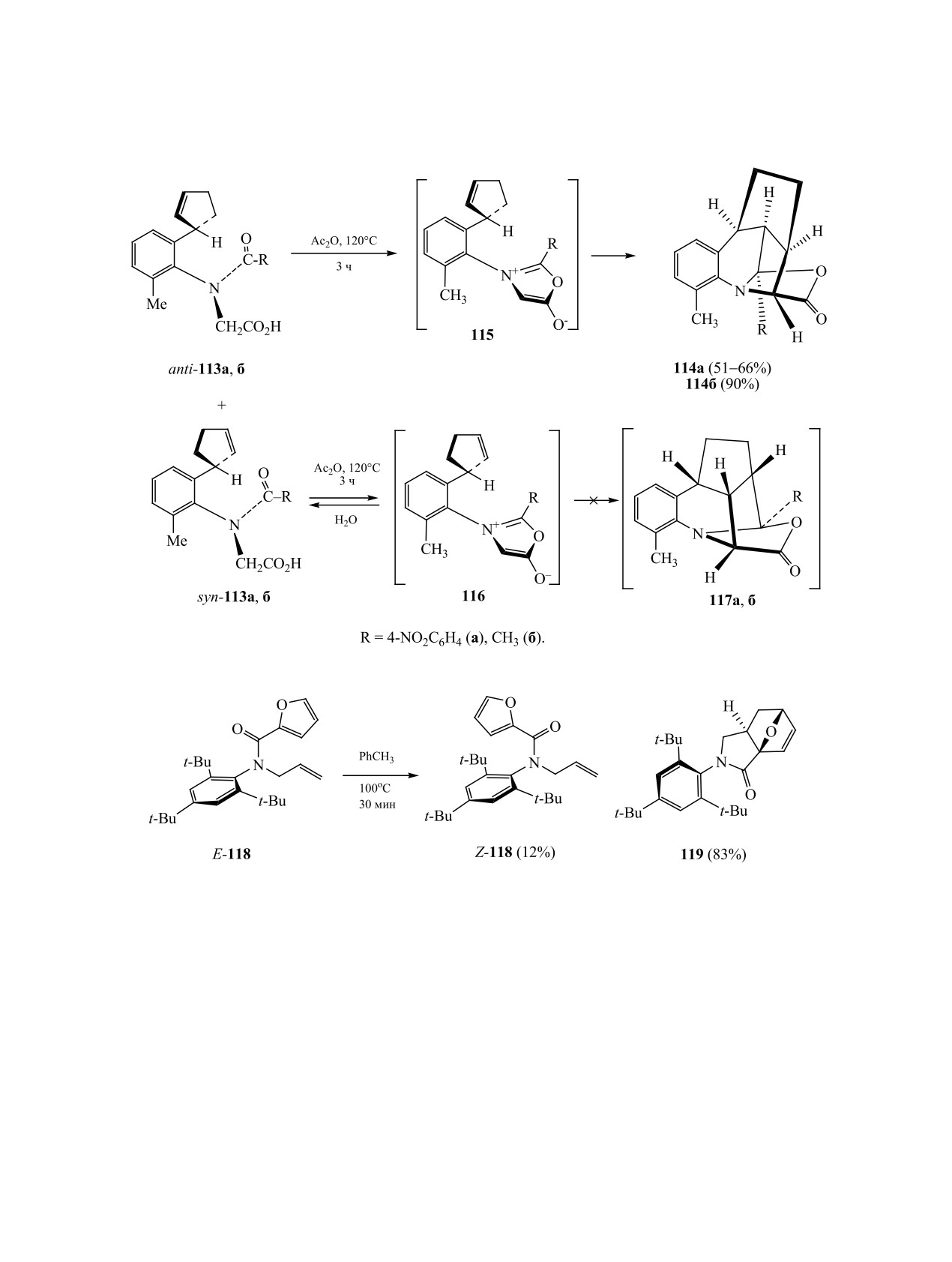
пример влияния этой изомерии на направление
Эффекты атропоизомерии
2-(2-циклопен-
внутримолекулярного [3+2]-циклоприсоединения.
тен-1-ил)аналогов не менее драматичны. При на-
Было показано, что при нагревании амида Е-118
гревании смеси атропоизомеров соединений 113a,
образуется трицикл 119 с хорошим выходом. В то
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1095
Схема 39.
Схема 40.
же время при аналогичных условиях продукт вну-
и природы растворителя. В этой области достиг-
тримолекулярной циклизации не может быть по-
нуты определенные успехи в разработке методов
лучен из транс-ротамера Z-118 (схема 40) [165].
получения некоторых ранее известных, а также
новых представителей стереоизомерных соеди-
5. ЗАКЛЮЧЕНИЕ
нений, изучена биологическая активность, в том
Таким образом, синтез и изучение свойств сте-
числе изомеров, имеющих незначительное время
реоизомерных молекул является одним из важ-
полупревращения. В представленном обзоре про-
нейших направлений исследований в области ор-
анализированы современные стратегии констру-
ганической химии. В подавляющем большинстве
ирования и выделения новых стереоизомерных
известных случаев конформационные особенно-
металлоорганических комплексов, приведены
сти полученных соединений зависят от комби-
примеры индукции их хиральности в структуре
нации различных структурных, кинетических,
продукта катализируемой ими реакции, новые
термодинамических факторов, условий реакции
подходы к синтезу атропоизомерных гетероци-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1096
ГАТАУЛЛИНА, ГАТАУЛЛИН
клов, карбоаналогов и циклофанов. Рассмотрены
Dispos. 2019. Vol. 47. N 2. P. 104. doi 10.1124/
реакции переноса аксиальной изомерии исходного
dmd.118.084905
8.
Гатауллин Р. Р. // ЖОРХ. 2019. Т. 55. Вып. 9. С.
субстрата в центр хиральности в структуре аддукта
1321; Gataullin R.R. // Russ. J. Org. Chem. 2019. Vol.
меж(внутри)молекулярного циклоприсоединения,
55. N 9. P. 1247. doi 10.1134/S107042801909001X
циклоконденсации и других типов циклизации.
9.
Sebastian R., Ayyavu T., Perumal R. // J. Heterocycl.
Предполагается, что обнаруженные необычные
Chem. 2016. Vol. 53. N 3. P. 993. doi 10.1002/jhet.2308
превращения таких соединений, новые разработки
10.
Bringmann G., Gulder T., Gulder T.A.M., Breuning M. //
по индукции аксиальной хиральности могут быть
Chem. Rev. 2011. Vol. 111. N 2. P. 563. doi 10.1021/
полезны в асимметрическом синтезе природных и
cr100155e
биологически активных соединений, а также ли-
11.
Kozlowski M.C., Morgan B.J., Linton E.C. // Chem.
гандов.
Soc. Rev. 2009. Vol. 38. N 11. P. 3193. doi 10.1039/
B821092F
ФОНДОВАЯ ПОДДЕРЖКА
12.
Hamad Elgazwy A.-S.S. // J. Heterocycl. Chem. 2006.
Работа выполнена рамках программы «Раз-
Vol. 43. N 5. P. 1151. doi 10.1002/jhet.5570430503
работка, направленный синтез и исследо-
13.
Glunz P.W. // Bioorg. Med. Chem. Lett. 2018. Vol. 28.
вание биологической активности функци-
N 2. P. 53. doi 10.1016/j.bmcl.2017.11.050
14.
Zimmer R., Dekaris V., Knauer M., Schefzig L.,
онализированных
бензоконденсированных
Reissig H.-U. // Synth. Commun. 2009. Vol. 39. N 6.
гетероциклов, полигетеромоно-, бициклических
P. 1012. doi 10.1080/00397910802455080
N,N-, N,O-, S,O-содержащих систем и произво-
15.
Siegel J.S. // Synlett. 2018. Vol. 29. N 16. P. 2120. doi
дных урацила» правительственного задания (тема
10.1055/s-0037-1610998
№ AAAA-A19-119011790021-4).
16.
Kumarasamy E., Raghunathan R., Sibi M.P., Sivaguru J. //
КОНФЛИКТ ИНТЕРЕСОВ
Chem. Rev. 2015. Vol. 115. N 20. P. 11239. doi 10.1021/
acs.chemrev.5b00136
Авторы заявляют об отсутствии конфликта
17.
Clayden J., Moran W.A., Edwards P.J., LaPlante S.R. //
интересов.
Angew. Chem. Int. Ed. 2009. Vol. 48. N 35. P. 6398. doi
10.1002/anie.200901719
СПИСОК ЛИТЕРАТУРЫ
18.
LaPlante S.R., Fader L.D., Fandrick H.R., Fandrick D.R.,
1. Ковальская С.С., Козлов Н.Г., Дикусар Е.А. // ЖОрХ.
Hucke O., Kemper R., Miller S.P.F., Edwards P.J. // J.
2009. Т. 45. Вып. 2. С. 197; Koval’skaya S.S., Koz-
Med. Chem. 2011. Vol. 54. N 20. P. 7005. doi 10.1021/
lov N.G., Dikusar E.A. // Russ. J. Org. Chem. 2009.
jm200584g
Vol. 45. N 2. P. 185. doi 10.1134/S1070428009020067
19.
LaPlante S.R., Edwards P.J., Fader L.D., Jakalian A.,
2. Колодяжный О.И. // ЖОХ. 2017. Т. 87. Вып. 3.
Hucke O. // ChemMedChem. 2011. Vol. 6. N 3. P. 505.
С. 416.; Kolodiazhnyi O. I. // Russ. J. Gen. Chem. 2017.
doi 10.1002/cmdc.201000485
Vol. 87. N 3. P. 425. doi 10.1134/S1070363217030112
20.
Clayden J., Johnson P., Pink J.H., Helliwell M. // J.
3. Li Z.-M., Li Y.-W., Cao X.-P., Chow H.-F., Kuck D. // J.
Org. Chem. 2000. Vol. 65. N 21. P. 7033. doi 10.1021/
Org. Chem. 2018. Vol. 83. N 7. P. 3433. doi 10.1021/
jo0007074
acs.joc.8b00375
21.
Ates A., Curran D.P. // J. Am. Chem. Soc. 2001.
4. Harris T., dos Passos Gomes G., Ayad S., Clark R.J.,
Vol. 123. N 21. P. 5130. doi 10.1021/ja010467p
Lobodin V.V., Tuscan M., Hanson K., Alabugin I.V. //
22.
Ahmed A., Bragg R.A., Clayden J., Lal L.W., McCarthy C.,
Chem. 2017. Vol. 3. N 4. P. 629. doi 10.1016/j.
Pink J.H., Westlund N., Yasin S.A. // Tetrahedron.
chempr.2017.07.011
1998. Vol. 54. N 43. P. 13277. doi 10.1016/S0040-
5. Гатауллин Р.Р., Лихачёва Н.А., Супоницкий К.Ю.,
4020(98)00814-X
Абдрахманов И.Б. // ЖОрХ. 2007. Т. 43. Вып. 9. С.
23.
Thayumanavan S., Beak P., Curran D.P. // Tetrahedron
1316; Gataullin R.R., Likhacheva N.A., Suponitskii
Lett. 1996. Vol. 37. N 17. P. 2899. doi 10.1016/0040-
K.Yu., Abdrakhmanov I.B. // Russ. J. Org. Chem. 2007.
4039(96)00439-X
Vol. 43. N 9. P. 1310. doi 10.1134/S1070428007090096
24.
Clayden J., Johnson P., Pink J.H. // J. Chem Soc. Perkin
6. Ranasinghe P., Olivares C., Champion W., Jr., Lee
Trans. 1. 2001. P. 371. doi 10.1039/B008678I
C. // Science J. Chem. 2019. Vol. 7. N 2. P. 39. doi
25.
Clayden J., Lai L.W., Helliwell M. // Tetrahedron. 2004.
10.11648/j.sjc.20190702.12
Vol. 60. N 20. P. 4399. doi 10.1016/j.tet.2004.01.101
7. Yang C., Zhou D., Shen Z., Wilson D.M., Renner M.,
26.
Clayden J., Lund A., Vallverdffl L., Helliwell M. //
Miner J.N., Girardet J.-L., Lee C.A. // Drug. Metab.
Nature. 2004. Vol. 431. P. 966. doi 10.1038/nature02933
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1097
27.
Hirata T., Takahashi I., Suzuki Y., Yoshida H., Hasega-
0037-1611736
wa H., Kitagawa O. // J. Org. Chem. 2016. Vol. 81. N 1.
47.
Nguyen Q.T., Lam Q.H., Thi P.N.P., Nguyen V.T. //
P. 318. doi 10.1021/acs.joc.5b02387
Sci. J. Chem. 2019. Vol. 7. N 2. P. 49. doi 10.11648/j.
28.
Fugard A.J., Lahdenperä A.S.K., Tan J.S.J., Mekareeya
sjc.20190702.13
A., Paton R.S., Smith M.D. // Angew. Chem. Int. Ed.
48.
Yoshino T., Matsunaga S. // Synlett. 2019. Vol. 30. N 12.
2019. Vol. 58. N 9. 2795. doi 10.1002/anie.201814362
P. 1384. doi 10.1055/s-0037-1611814
29.
Barrett K.T., Miller S.J. // J. Am. Chem. Soc. 2013.
49.
Akinyele O.F., Akinnusi T.O., Ajayeoba T.A., Ayeni A.O.,
Vol. 135. N 8. 2963. doi 10.1021/ja400082x
Durosinmi L.M. // Sci. J. Chem. 2019. Vol. 7. N 3. P. 67.
30.
Di Iorio N., Champavert F., Erice A., Righi P., Mazzan-
doi 10.11648/j.sjc.20190703.13
ti A., Bencivenni G. // Tetrahedron. 2016. Vol. 72, N 34.
50.
Ehnbom A., Ghosh S.K., Lewis K.G., Gladysz J.A. //
P. 5191. doi 10.1016/j.tet.2016.02.052
Chem. Soc. Rev. 2016. Vol. 45. N 24. P. 6799. doi
31.
Hasegawa F., Yasukawa Y., Kawamura K., Tsuchika-
10.1039/C6CS00604C
wa H., Murata M. // Asian J. Org. Chem. 2018. Vol. 7.
51.
Распопова Е.А., Морозов А.Н., Буланов А.О., По-
N 8. P. 1648. doi 10.1002/ajoc.201800247
пов Л.Д., Щербаков И.Н., Левченков С.И., Ко-
32.
Kinoshita S., Kamikawa K. // Tetrahedron. 2016.
ган В.А. // ЖОХ. 2012. Т. 82. Вып. 8. С. 1396;
Vol. 72. N 34. P. 5202. doi 10.1016/j.tet.2015.11.053
Raspopova E.A., Morozov A.N., Bulanov A.O., Po-
33.
Brandes S., Bella M., Kjærsgaard A., Jørgensen K.A. //
pov L.D., Shcherbakov I.N., Levchenkov S.I., Kogan V.A. //
Angew. Chem. Int. Ed. 2006. Vol. 45. N 7. P. 1147. doi
Russ. J. Gen. Chem. 2012. Vol. 82. N 8. P. 1457. doi
10.1002/anie.200503042
10.1134/S1070363212080233
34.
Crawford J.M., Stone E.A., Metrano A.J., Miller S.J.,
52.
Попов Л.Д., Зайченко Н.И., Венедиктова О.В., Ва-
Sigman M.S. / J. Am. Chem. Soc. 2018. Vol. 140. N 3.
лова Т.М., Баращевский В.А., Шиенок А.И., Кольцо-
P. 868. doi 10.1021/jacs.7b11303
ва Л.С., Левченков С.И., Коган В.А. // ЖОХ. 2014.
35.
Diener M.E., Metrano A.J., Kusano S., Miller S.J. // J.
Т. 84. Вып. 5. С. 843; Popov L.D., Zaichenko N.L.,
Am. Chem. Soc. 2015. Vol. 137. N 38. P. 12369. doi
Venidiktova O.V., Valova T.M., Barachevskii V.A.,
10.1021/jacs.5b07726
Shienok A.I., Kol’tsova L.S., Levchenkov S.I., Ko-
36.
Li S.-L., Yang C., Wu Q., Zheng H.-L., Li X., Cheng J.-P.
gan V.A. // Russ. J. Gen. Chem. 2014. Vol. 84. N 5.
// J. Am. Chem. Soc. 2018. Vol. 140. N 40. P. 12836. doi
P. 934. doi 10.1134/S1070363214050259
10.1021/jacs.8b06014
53.
Curtis N.F., Coles M.P. // Polyhedron. 2017. Vol. 127.
37.
Shirakawa S., Liu K., Maruoka K. // J. Am. Chem. Soc.
P. 369. doi 10.1016/j.poly.2017.02.014
2012. Vol. 134. N 2. P. 916. doi 10.1021/ja211069f
54.
Криушкина М.А., Борисов А.В., Пахомов Г.Л.,
38.
He C., Hou M., Zhu Z., Gu Z. // ACS Catal. 2017.
Шапошников Г.П. // ЖОХ. 2010. Т. 80. Вып. 12.
Vol. 7. N 8. P. 5316. doi 10.1021/acscatal.7b01855
С. 2034; Kriushkina M.A., Borisov A.V., Pakhomov G.L.,
39.
Fan V., Zhang X., Li C., Z. Gu Z. // ACS Catal. 2019.
Shaposhnikov G.P. // Russ. J. Gen. Chem. 2010. Vol. 80.
Vol. 9. N 3. P. 2286. doi 10.1021/acscatal.8b04789
N 12. P. 2495. doi 10.1134/S1070363210120169
40.
Reznikov A.N., Klimochkin Yu.N. // Synthesis. 2020.
55.
Feldman J., Vo G.D., McLaren C.D., Gehret T.C.,
Vol. 52. N 6. P. 781. doi 10.1055/s-0039-1690044
Park K.-H., Meth J.S., Marshall W.J., Buriak J.,
41.
Mudi P.K., Mahato R.K., Joshi M., Paul S., Choud-
Bryman L.M., Dobbs K.D., Scholz T.H., Zane S.G. //
hury A.R., Biswas B. // J. Mol. Struct. 2020. Vol. 1200. P.
Organometallics. 2015. Vol. 34. N 15. P. 3665. doi
127083. doi 10.1016/j.molstruc.2019.127083
10.1021/acs.organomet.5b00198
42.
Francos J., Elorriaga D., Crochet P., Cadierno V. //
56.
Canac Y., Chauvin R. // Eur. J. Inorg. Chem. 2010. N 16.
Coord. Chem. Rev. 2019. Vol. 387. P. 199. doi 10.1016/j.
P. 2325. doi 10.1002/ejic.201000190.
ccr.2019.02.014
57.
Lovett D.M., Thierer L.M., Santos E.E.P., Hardie R.L.,
43.
Liu X., Hamon J.-R. // Coord. Chem. Rev. 2019.
Dougherty W.G., Piro N.A., Kassel W.S., Cromer B.M.,
Vol. 389. P. 94. doi 10.1016/j.ccr.2019.03.010
Coughlin E.B., Zubris D.L. // J. Organometal.
44.
Nardis S., Mandoj F., Stefanelli M., Paolesse R. //
Chem. 2018. Vol. 863. P. 44. doi 10.1016/j.
Coord. Chem. Rev. 2019. Vol. 388. P. 360. doi 10.1016/j.
jorganchem.2018.03.012
ccr.2019.02.034
58.
Howarth A.J., Davies D.L., Lelj F., Wolf M.O., Pat-
45.
Sabuzi F., Pomarico G., Floris B., Valentini F., Galloni
rick B.O. // Dalton Trans. 2012. Vol. 41. N 34. P. 10150.
P., Conte V. // Coord. Chem. Rev. 2019. Vol. 385. P. 100.
doi 10.1039/C2DT31120H
doi 10.1016/j.ccr.2019.01.013
59.
Njogu R.E.N., Fodran P., Njenga L.W., Kariuki D.K.,
46.
Baumgartner J., Bergman R.G., Kayser B., Klupin-
Yusuf A.O., Scheblykin I., Wendt O.F., Wallentin C.-J. //
ski T.P., Park Y.K., Vollhardt K.P.C., West M.J., Zhu B. //
Synlett. 2019. Vol. 30. N 7. P. 792. doi 10.1055/s-0037-
Synthesis. 2019. Vol. 51. N 11. P. 2409. doi 10.1055/s-
1611716
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1098
ГАТАУЛЛИНА, ГАТАУЛЛИН
60.
Marchi E., Sinisi R., Bergamini G., Tragni M., Mo-
74.
Ohyama J., Hitomi Y., Higuchi Y., Tanaka T. // Top.
nari M., Bandini M., Ceroni P. // Chem. Eur. J. 2012.
Catal. 2009. Vol. 52. N 6-7. P. 852. doi 10.1007/s11244-
Vol. 18. N 28. P. 8765. doi 1002/chem.201200709
009-9229-x
61.
Yang X., VenkatRamani S., Beto C.C., Del Castillo T.J.,
75.
Sun W., Gu H., Lin X. // J. Org. Chem. 2018. Vol. 83.
Ghiviriga I., Abboud K.A., Veige A.S. // Organometallics.
N 7. P. 4034. doi 10.1021/acs.joc.8b00422
2017. Vol. 36. N 7. P. 1352. doi 10.1021/acs.
76.
Zhao Z.-B., Shi L., Li Y., Meng F.-J., Zhou Y.-G. //
organomet.7b00067
Org. Biomol. Chem. 2019. Vol. 17. N 26. P. 6364. doi
62.
Liulkovich L.S., Pukhovskaya S.G., Ivanova Yu.B.,
10.1039/C9OB01158G
Gladkov L.L., Kruk M.M. // J. Appl. Spectrosc. 2020.
77.
Jiang X., Beiger J.J., Hartwig J.F. // J. Am. Chem. Soc.
Vol. 86. N 6. P. 1014. doi 10.1007/s10812-020-00933-3.
2017. Vol. 139. P. 87. doi 10.1021/jacs.6b11692
63.
Wang H., Li J., Scheidt W.R. // J. Porph. Phthal. 2018.
78.
Rae J., Frey J., Jerhaoui S., Choppin S., Wencel-Delord J.,
Vol. 22. N 11. P. 981. doi 10.1142/S1088424618500943
Colobert F. // ACS Catal. 2018. Vol. 8. N 4. P. 2805. doi
64.
Белых Д.В., Худаева И.С., Буравлев Е.В., Чукиче-
1021/acscatal.7b04343
79.
Liu Z., Qiu P., Li J., Chen G., Chen Y., Liu H., She Z. //
ва И.Ю., Шевченко О.Г., Кучин А.В. // ЖОрХ. 2017.
Tetrahedron. 2018. Vol. 74. N 7. P. 746. doi 10.1016/j.
Т. 53. Вып. 4. С. 603; Belykh D.V., Khudyaeva I.S.,
tet.2017.12.057
Buravlev E.V., Chukicheva I.Yu., Shevchenko O.G.,
80.
Hou J.-Q., Wang B.-L., Han C., Xu J., Wang Z.,
Kutchin A.V. // Russ. J. Org. Chem. 2017. Vol. 53. N 4.
He Q.-W., Zhang P.-L., Zhao S.-M., Pei X., Wang H. //
P. 610. doi 10.1134/S1070428017040182
Org. Biomol. Chem. 2018. Vol. 16. N 44. P. 8513. doi
65.
Белых Д.В., Тарабукина И.С., Груздев И.В., Ку-
10.1039/C8OB02433B.
чин А.В. // ЖОрХ. 2009. Т. 45. Вып. 3. С. 461; Be-
81.
Guo T., Yuan B.-H., Liu W.-J. // Org. Biomol. Chem.
lykh D.V., Tarabukina I.S., Gruzdev I.V., Kuchin A.V. //
2018. Vol. 16. N 1. P. 57. doi 10.1039/C7OB02891A
Russ. J. Org. Chem. 2009. Vol. 45. N 3. P. 452. doi
82.
Kanase Y., Kitada T., Tabata H., Makino K., Oshitari T.,
10.1134/S1070428009030191
Ohashi H., Yoshinaga T., Natsugari H., Takahashi H. //
66.
Гусева Г.Б., Дудина Н.А., Антина Е.В., Вьюгин А.И.,
Bioorg. Med. Chem. 2018. Vol. 26. N 9. P. 2508. doi
Семейкин А.С. // ЖОХ. 2008. Т. 78. Вып. 6. С. 987;
10.1016/j.bmc.2018.04.013
Guseva G.B., Dudina N.A., Antina E.V., V’yugin A.I.,
83.
He X.-L., Zhao H.-R., Song X., Jiang B., Du W.,
Semeikin A.S. // Russ. J. Gen. Chem. 2008. Vol. 78.
Chen Y.-C. // ACS Catal. 2019. Vol. 9. N 5. P. 4374. doi
N 6. P. 1215. doi 10.1134/S1070363208060200
10.1021/acscatal.9b00767
67.
Симонов О.Р., Зайцева С.В., Койфман О.И. // ЖОХ.
84.
Li X., Parkin S.R., Lehmler H.-J. // Environ Sci. Pollut.
2008. Т. 78. Вып. 6. С. 1033; Simonov O.R., Zaitse-
Res. 2018. Vo l. 25. N 17. P. 16402. doi 10.1007/s11356-
va S.V., Koifman O.I. // Russ. J. Gen. Chem. 2008.
017-9259-z
Vol. 78. N 6. P. 1260. doi 10.1134/S1070363208060285
85.
Wang H., Wang L., Li Y., Zhang X., Tang P. // Chin.
68.
Иванова Ю.Б., Толдина О.В., Шейнин В.Б., Ма-
J. Chem. 2019. Vol. 37. N 3. P. 255. doi 10.1002/
мардашвили Н.Ж. // ЖОрХ. 2007. Т. 43. Вып. 9.
cjoc.201800557
С. 1401; Ivanova Yu.B., Toldina O.V., Shei-
86.
Moulton B.E., Lynam J.M., Duhme-Klair A.-K., Zheng W.,
nin V.B., Mamardashvili N.Zh. // Russ. J. Org.
Lin Z., Fairlamb I.J.S. // Org. Biomol. Chem. 2010.
Chem. 2007. Vol. 43. N 9. P. 1397. doi 10.1134/
S1070428007090230
C0OB00264J
69.
Amaravathi M., Rajitha B., Rao M.K., Sitadevi P. //
87.
Muller C., Pidko E.A., Totev D., Lutz M., Spek A.L., van
J. Heterocycl. Chem. 2007. Vol. 44. N 4. P. 821. doi
Santena R.A., Vogta D. // Dalton Trans. 2007. P. 5372.
10.1002/jhet.5570440411
doi 10.1039/B715197G
70.
Wang Y.-Q., Pan Y., Gao W.-Q., Wu Y., Liu C.-H.,
88.
Blug M., Guibert C., Le Goff X.-F., Mézailles N., Le
Zhu Y.-Y. // Tetrahedron. 2019. Vol. 75. N 28. P. 3809.
Floch P. // Chem. Commun. 2008. N 2. P. 201. doi
doi 10.1016/j.tet.2019.04.023
10.1039/b814886d
71.
Bosque R., Crespo M., Escola A., Font-Bardia M. //
89.
Zhao L., Guo Z., Chen Y., Hu T., Wu D., Zhu Y.-F.,
J. Organometallic Chem. 2018. Vol. 854, P. 122. doi
Rowbottom M., Gross T.D., Tucci F.C., Struthers R.S.,
10.1016/j.jorganchem.2017.11.020.
Xiec Q., Chen C. // Bioorg. Med. Chem. Lett. 2008.
72.
Bukhryakov K.V., Schrock R.R., Hoveyda A.H., Tsay
Vol. 18. N 11. P. 3344. doi 10.1016/j.bmcl.2008.04.029
C., Müller P. // J. Am. Chem. Soc. 2018. Vol. 140. N 8.
90.
Guo Z., Chen Y., Huang C.Q., Gross T.D., Pontillo J.,
P. 2797. doi 10.1021/jacs.8b00499
Rowbottom M.W., Saunders J., Struthers S., Tucci F.C.,
73.
Xu W.-R., Wang X.-R., Chow H.-F., Kuck D. // Synthesis.
Xie Q., Wade W., Zhu Y.-F., Wu D., Chen C. // Bioorg.
2019. Vol. 51. N 10. P. 2116. doi 10.1055/s-0037-
Med. Chem. Lett. 2005. Vol. 15. N 10. P. 2519. doi
1612122
10.1016/j.bmcl.2005.03.057
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1099
91.
Boiadjiev S.E., Lightner D.A. // Monatsh. Chem. 2002.
10.1039/B514561A
Vol. 133. N 11. P. 1469. doi 10.1007/s00706-002-
105.
Kitajima M., Yamaguchi Y., Yanagisawa T., Ko-
gure N., Ogata J., Kikura-Hanajiri R., Takayama H. //
0512-9
Tetrahedron. 2019. Vol. 75. N 27. P. 3733. doi
92.
Zheng S.-C., Wang Q., Zhu J. // Angew. Chem. Int. Ed.
10.1016/j.tet.2019.05.045
2019. Vol. 58. N 27. P. 9215. 10. 1002/anie.201903589
106.
Tabata H. // Yakugaku Zasshi. 2013. Vol. 133. N 8.
93.
Eto M., Yamaguchi K., Watanabe A., Harano K. //
P. 857. doi 10.1248/yakushi.13-00169
Tetrahedron. 2014. Vol. 70. N 9. P. 1811. doi 10.1016/j.
107.
Burke E.W.D., Morris G.A., Vincent M.A., Hillier I.H.,
tet.2014.01.031
Clayden J. // Org. Biomol. Chem. 2012. Vol. 10. N 4.
94.
Ito F., Moriguchi T., Yoshitake Y., Eto M., Yahara S.,
P. 716. doi 10.1039/c1ob06490h
Harano K. // Chem. Pharm. Bull. 2003. Vol. 51. N 6.
108.
Newhouse T., Lewis C.A., Baran P.S. // J. Am. Chem.
Soc. 2009. Vol. 131. N 18. P. 6360. doi 10.1021/
P. 688. doi 10.1248/cpb.51.688
ja901573x
95.
Kitamura T., Harano K., Hizano T. // Chem. Pharm.
109.
Shinohara T., Deng H., Snapper M.L., Hoveyda A.H. //
Bull. 1992. Vol. 40. N 9. P. 2255. doi 10.1248/
J. Am. Chem. Soc. 2005. Vol. 127. N 20. P. 7334. doi
cpb.40.2255
10.1021/ja051790l
96.
Raut V.S., Jean M., Vanthuyne N., Roussel C, Constan-
110.
Williams D.H., Bardsley B. // Angew. Chem. Int.
tieux T., Bressy C., Bugaut X., Bonne D., Rodriguez J. //
Ed. 1999. Vol. 38. N 9. P. 1172. doi 10.1002/(SI-
J. Am. Chem. Soc. 2017. Vol. 139. N 6. P. 2140. doi
CI)1521-3773(19990503)38:9<1172
10.1021/jacs.6b11079
111.
Burns N.Z., Krylova I.N., Hannoush R.N., Baran P.S. //
J. Am. Chem. Soc. 2009. Vol. 131. N 26. P. 9172. doi
97.
Коротаев В.Ю., Барков А.Ю., Ежикова М.А.,
10.1021/ja903745s
Кодесc М.И., Сосновских В.Я. // ХГС. 2015. Т. 51.
112.
Pang Y., Wan N., Shi L., Wang C., Sun Z., Xiao R.,
№ 6. C. 531; Korotaev V.Yu., Barkov A.Yu., Ezhiko-
Wang S. // Anal. Chim. Acta. 2019. Vol. 1077. P. 288.
va M.A., Kodess M.I., Sosnovskikh V.Ya. // Chem.
doi 10.1016/j.aca.2019.05.059
Heterocycl. Compd. 2015. Vol. 51. N 6. P. 531. doi
113.
Okano A., Isley N.A., Boger D.L. // Proc. Nat. Acad.
10.1007/s10593-015-1733-2
Sci. USA. 2017. Vol. 114. N 26. P. E5052. doi 10.1073/
98.
Коротаев В.Ю., Сосновских В.Я., Кутяшев И.Б.,
pnas.1704125114.
Кодесc М.И. // Изв. АН. Сер. хим. 2006. № 11. 1945;
114.
Boger D.L., Miyazaki S., Kim S.H., Wu J.H., Loiseleur O.,
Korotaev V.Yu., Sosnovskikh V.Ya., Kutyashev I.B.,
Castle S.L. // J. Am. Chem. Soc. 1999. Vol. 121. N 13.
Kodess M.I. // Russ. Chem. Bull. 2006. Vol. 55. N 11.
P. 3226. doi 10.1021/ja990189i
P. 2020. doi 10.1007/s11172-006-0546-y
115.
Thakellapalli H., Farajidizaji B., Li S., Heller J.C.,
99.
Коротаев В.Ю., Кутяшев И.Б., Ежикова М.А.,
Zhang Y., Akhmedov N.G., Milsmann C., Peter-
Кодесc М.И., Сосновских В.Я. // ХГС. 2015. Т. 51.
sen J.L., Wang K.K. // J. Org. Chem. 2018. Vol. 83.
№ 8. C. 704; Korotaev V.Yu., Kutyashev I.B., Bar-
N 4. P. 2455. doi 10.1021/acs.joc.7b03081
kov A.Yu., Ezhikova M.A., Kodess M.I., Sosnov-
116.
Wang J.-Q., Li J., Zhang G.-W., Chen C.-F. // J. Org.
skikh V.Ya. // Chem. Heterocycl. Compd. 2015. Vol. 51.
Chem. 2018. Vol. 83. N 19. P. 11532. doi 10.1021/acs.
N 8. P. 704. doi 10.1007/s10593-015-1762-x
joc.8b01437
100.
Bai H.-Y., Tan F.-X., Liu T.-Q., Zhu G.-D., Tian J.-M.,
117.
Ishichi Y., Ikeura Y., Natsugari H. // Tetrahedron. 2004.
Ding T.-M., Chen Z.-M., Zhang S.-Y. // Nat. Commun.
Vol. 60. N 20. P. 4481. doi 10.1016/j.tet.2004.01.097
2019. Vol. 10. N 3063. P. 1. doi 10.1038/s41467-019-
118.
Ikeura Y., Ishimaru T., Doi T., Kawada M., Fujishima A.,
10858-x
Natsugari H. // Chem. Commun. 1998. N 19. P. 2141.
101.
Birepinte M., Robert F., Pinet S., Chabaud L., Pu-
doi 10.1039/A805333B
cheault M. // Org. Biomol. Chem. 2020. Vol. 18. N 16.
119.
Natsugari H., Ikeura Y., Kamo I., Ishimaru T., Ishichi Y.,
P. 3007. doi10.1039/d0ob00421a
Fujishima A., Tanaka T., Kasahara F., Kawada M.,
102.
Winterfeld K.A., Lavarda G., Guilleme J., Sekita M.,
Doi T. // J. Med. Chem. 1999. Vol. 42. N 19. P. 3982.
Guldi D.M., Torres T., Bottari G. // J. Am. Chem.
doi 10.1021/jm990220r
Soc. 2017. Vol. 139. N 15. P. 5520. doi 10.1021/
120.
Paymode D.J., Ramana C.V. // ACS Omega. 2017.
jacs.7b01460
Vol. 2. N 9. P. 5591. doi 10.1021/acsomega.7b00980
103.
Clayden J., Lund A., Youssef L.H. // Org. Lett. 2011.
121.
Shchegravina E.S., Svirshchevskaya E.V.,
Vol. 3. N 15. P. 4133. doi 10.1021/ol0167457
Schmalz H.-G., Fedorov A.Yu. // Synthesis. 2019.
104.
Clayden J., Westlund N., Frampton C.S., Helliwell M. //
Vol. 51. N 7. P. 1611. doi 10.1055/s-0037-1610673
Org. Biomol. Chem. 2006. Vol. 4. N 3. P. 455. doi
122.
Tabata H., Yoneda T., Oshitari T., Takahashi H., Nat-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1100
ГАТАУЛЛИНА, ГАТАУЛЛИН
sugari H. // J. Org. Chem. 2013. Vol. 78. N 12. P. 6264.
Джемилев У.М. // ЖОрХ. 2018. Т. 54. Вып. 6.
doi 10.1021/jo401020y
С. 833; D’yakonov V.A., Kadikova G.N., Khali-
123.
Brown C.J., Farthing A.C. // Nature. 1949. Vol. 164.
lov L.M., Dzhemilev U.M. // Russ. J. Org. Chem. 2018.
P. 915. doi 10.1038/164915b0.
Vol. 54. N 6. P. 832. doi 10.1134/S1070428018060027
124.
Xie E., Huang S., Lin X. // Org. Lett. 2019. Vol. 21.
138.
Amador A.G., Sherbrook E.M., Lu Z., Yoon T.P. //
N 10. P. 3682. doi 10.1021/acs.orglett.9b01127
Synthesis. 2018. Vol. 50. N 3. P. 539. doi 10.1055/s-
125.
Mitra N.K., Meudom R., Gorden J.D., Merner B.L. //
0036-1591500
Org. Lett. 2015. Vol. 17. N 11. P. 2700. doi 10.1021/
139.
Шевелев С.А., Старосотников А.М. // ХГС. 2013.
acs.orglett.5b01102
№ 1. С. 102; Shevelev S.A., Starosotnikov A.M. //
126.
Wang Y., Yuan H., Lu H., Zheng W.H. // Org. Lett.
Chem. Heterocycl. Compd. 2013. Vol. 49. N 1. P. 92.
2018. Vol. 20. N 9. P. 2555. doi 10.1021/acs.or-
doi 10.1007/s10593-013-1233-1
glett.8b00711
140.
Chang X.-P., Zheng Y., Cui G., Fanga W.-H., Thiel W. //
127.
Jayasundera K.P., Engels T.G.W., Lun D.J., Mungalpa-
Phys. Chem. Chem. Phys. 2016. Vol. 18. N 35.
ra M.N., Plieger P.G., Rowlands G.J. // Org. Biomol.
P. 24713. doi 10.1039/c6cp04919b
Chem. 2017. Vol. 15. N 42. P. 8975. doi 10.1039/
141.
Anderson L.L. // Asian J. Org. Chem. 2016. Vol. 5.
c7ob02393f
N 1. P. 9. doi 10.1002/ajoc.201500211
128.
Milhau L., Guiry P.J. // Top. Organomet. Chem. 2012.
142.
Jovanović J.P., Bogdanović G.A., Damljanović I. //
Vol. 38. P. 95. doi 10.1007/3418_2011_9
Synlett. 2017. Vol. 28. N 5. P. 664. doi 10.1055/s-
129.
Giuliano M.W., Miller S.J. // Top. Curr. Chem. 2015.
0036-1588678
Vol. 372. P. 157. doi 10.1007/128_2015_653
143.
Великородов А.В., Имашева А.К., Куанчалиева А.К.,
130.
Cunillera A., Godard C., Ruiz A. // Top. Organomet.
Поддубный О.Ю. // ЖОрХ. 2010. Т. 46. Вып. 7.
Chem. 2018. Vol. 61. P. 99. doi 10.1007/
С. 975; Velikorodov A.V., Imasheva N.M., Kuanchalie-
3418_2017_176
va A.K., Poddubnyi O.Yu. // Russ. J. Org. Chem. 2010.
131.
Zhao K., Duan L., Xu S., Jiang J., Fu Y., Gu Z. //
Vol. 46. N 7. P. 971. doi 10.1134/S1070428010070031
Chem. 2018. Vol. 4. N 3. P. 599. doi 10.1016/j.chem-
144.
Носачев С.Б., Поддубный О.Ю., Великородов А.В.,
pr.2018.01.017
Тырков А.Г. // ЖОрХ. 2010. Т. 46. Вып. 5. С. 683;
132.
Gataullin R.R., Mescheryakova E.S., Sultanov R.M.,
Nosachev S.B., Poddubnyi O.Yu., Velikorodov A.V.,
Fatykhov A.A., Khalilov L.M. // Synthesis. 2019.
Tyrkov A.G. // Russ. J. Org. Chem. 2010. Vol. 46.
Vol. 51. N 18. P. 3485. doi 10.1055/s-0039-1689971
N 5. P. 674. doi 10.1134/S1070428010050131
133.
Wada Y., Matsumoto A., Asano K., Matsubara S. //
145.
Великородов А.В., Поддубный О.Ю., Кривоше-
RSC Adv. 2019. Vol. 9. N 54. P. 31654. doi 10.1039/
ев О.О., Титова О.Л. // ЖОрХ. 2011. Т. 47. Вып. 3.
c9ra05532k
С. 409; Velikorodov A.V., Poddubnyi O.Yu., Krivoshe-
134.
Watterson S.H., De Lucca G.V., Shi Q., Lange-
ev O.O., Titova O.L. // Russ. J. Org. Chem. 2011.
vine C.M., Liu Q., Batt D.G., Bertrand M.B., Gong
Vol. 47. N 3. P. 402. doi 10.1134/S1070428011030122
H., Dai J., Yip S., Li P., Sun D., Wu D.-R., Wang C.,
146.
Великородов А.В., Поддубный О.Ю., Куанчалие-
Zhang Y., Traeger S.C., Pattoli M.A., Skala S., Cheng
ва А.К., Кривошеев О.О. // ЖОрХ. 2010. Т. 46.
L., Obermeier M.T., Vickery R., Discenza L.N., D‘Ari-
Вып. 12. С. 1816; Velikorodov A.V., Poddubnyi O.Yu.,
enzo C.J., Zhang Y., Heimrich E., Gillooly K.M., Tay-
Kuanchalieva A.K., Krivosheev O.O. // Russ. J. Org.
lor T.L., Pulicicchio C., McIntyre K.W., Galella M.A.,
Chem. 2010. Vol. 46. N 12. P. 1826. doi 10.1134/
Tebben A.J., Muckelbauer J.K., Chang C., Rampul-
S1070428010120067
la R., Mathur A., Salter-Cid L., Barrish J.C., Carter
147.
Великородов А.В., Поддубный О.Ю., Ионова В.А.,
P.H., Fura A., Burke J.R., Tino J.A. // J. Med. Chem.
Титова О.Л. // ЖОрХ. 2011. Т. 47. Вып. 10. С. 1566;
2016. Vol. 59. N 19. P. 9173. doi 10.1021/acs.jmed-
Velikorodov A.V., Poddubnyi O.Yu., Ionova V.A., Tito-
chem.6b01088
va O.L. // Russ. J. Org. Chem. 2011. Vol. 47. N 10.
135.
Wisniewski S.R., Carrasquillo-Flores R., Lora Gon-
P. 1596. doi 10.1134/S1070428011100265
zalez F., Ramirez A., Casey M., Soumeillant M.C.,
148.
Wang K.-K., Li Y.-L., Wang Z.-Y., Ma X., Mei Y.-L.,
Razler T.M., Mack B. // Org. Proc. Res. Dev. 2018.
Zhang S.-S., Chen R. // J. Heterocycl. Chem. 2020.
Vol. 22. N 10. P. 1426. doi 10.1021/acs.oprd.8b00246
Vol. 57. N 3. P. 1456. doi 10.1002/jhet.3878
136.
Gonzalez F.L., Wisniewski S.R., Katipally K., Ste-
149.
Carey J.S. // J. Org. Chem. 2001. Vol. 66. N 7. P. 2526.
vens J.M., Rosso V., Mack B., Razler T.M. // Org. Proc.
doi 10.1021/jo001797f
Res. Dev. 2019. Vol. 23. N 6. P. 1143. doi 10.1021/acs.
150.
Nakazaki A., Mori A., Kobayashi S., Nishikawa T. //
oprd.8b00398.
Tetrahedron Lett. 2012. Vol. 53. N 52. P. 7131. doi
137.
Дьяконов В.А., Кадикова Г.Н., Халилов Л.М.,
10.1016/j.tetlet.2012.10.092
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
АКСИАЛЬНО-ХИР
АЛЬНЫЕ МЕТАЛЛОКОМПЛЕКСЫ, КАРБО- И ГЕТЕРОЦИКЛЫ
1101
151. Said A.M., Savage G.P. // J. Org. Chem. 2011. Vol. 76.
161. Гатауллин Р.Р., Ибатуллина З.А., Мещеряко-
N 16. P. 6946. doi 10.1021/jo2011818
ва Е.С., Фатыхов А.А., Халилов Л.М. // ЖОрХ. 2017.
152. Harding S.L., Savage G.P. // Org. Biomol. Chem.
Т. 53. Вып. 5. С. 688; Gataullin R.R., Ibatullina Z.A.,
2012. Vol. 10. N 24. P. 4759. doi 10.1039/c2ob25271f
Mesherjakova E.S., Fatykhov A.A., Khalilov L.M. //
153. Padwa A., Gingrich H.L., Lim R. // Tetrahedron Lett.
Russ. J. Org. Chem. 2017. Vol. 53. N 5. P. 697. doi
1980. Vol. 21. N 36. P. 3419. doi 10.1016/S0040-
10.1134/S1070428017050098
4039(00)78704-1
162. Александрова Л.А., Фатыхов А.А., Гатауллина А.Р.,
154. Padwa A., Gingrich H.L., Lim R. // J. Org. Chem.
Кантор Е.А., Гатауллин Р.Р. // ЖОрХ. 2018. Т. 54.
1982. Vol. 47. N 12. P. 2447. doi 10.1021/jo00133a041
Вып. 10. С. 1507; Alexandrova L.A., Fatykhov A.A.,
155. Padwa A., R.Lim, MacDonald J.G. // J. Org. Chem.
Gataullina A.R., Kantor E.A., Gataullin R.R. // Russ. J.
1985. Vol. 50. N 20. P. 3816. doi 10.1021/jo00220a027
Org. Chem. 2018. Vol. 54. N 10. P. 1519. doi 10.1134/
156. Meier H., Heimgartner H. // Helv. Chim. Acta. 1977.
Vol. 60. N 3. P. 1087. doi 10.1002/hlca.19770600333
S1070428018100147
157. Meier H., Heimgartner H., Schmid H. // Helv.
163. Складчиков Д.А., Буранбаева Р.С., Фатыхов А.А.,
Chim. Acta. 1986. Vol. 69. N 4. P. 927. doi 10.1002/
Иванов С.П., Гатауллин Р.Р. // ЖОрХ. 2012. Т. 48.
hlca.19860690421
Вып. 12. С. 1579; Skladchikov D.A., Buranbaeva R.S.,
158. Мазгарова Г.Г., Фатыхов А.А., Гатауллин Р.Р. //
Fatykhov A.A., Ivanov S.P., Gataullin R.R. // Russ. J.
ЖОрХ. 2014. Т. 50. Вып. 8. С. 1172; Mazgaro-
Org. Chem. 2012. Vol. 48. N 12. P. 1550. doi 10.1134/
va G.G., Fatykhov A.A., Gataullin R.R. // Russ. J.
S1070428012120093
Org. Chem. 2014. Vol. 50. N 8. P. 1155. doi 10.1134/
164. Складчиков Д.А., Супоницуий К.Ю., Абдрахма-
S1070428014080144
нов И.Б., Гатауллин Р.Р. // ЖОрХ. 2012. Т. 48.
159. Мазгарова Г.Г., Фатыхов А.А., Гатауллин Р.Р. //
Вып. 7. С. 962; Skladchikov D.A., Suponitskii K.Yu.,
ЖОрХ. 2014. Т. 50. Вып. 9. С. 1361; Mazgaro-
Abdrakhmanov I.B., Gataullin R.R. // Russ. J. Org.
va G.G., Fatykhov A.A., Gataullin R.R. // Russ. J.
Chem. 2012. Vol. 48. N 7. P. 957. doi 10.1134/
Org. Chem. 2014. Vol. 50. N 9. P. 1346. doi 10.1134/
S1070428012070123
S1070428014090188
160. Bizhanova G.G., Suponitsky K.Yu., Vakhitova Yu.V.,
165. Nakamura M., Takahashi I., Yamada S., Dobashi Y.,
Gataullin R.R. // Tetrahedron. 2017. Vol. 73. N 2.
Kitagawa O. // Tetrahedron Lett. 2011. Vol. 52. N 1.
P. 109. doi 10.1016/j.tet.2016.11.038
P. 53. doi 10.1016/j.tetlet.2010.10.139
Axial-Chiral Metal Complexes, Carbo,- and Heterocycles:
Modern Synthesis Strategies, Examples of Atropoisomerism
Influence on the Reaction Product Structure
A. R. Gataullinaa and R. R. Gataullinb,*
a Ufa State Petroleum Technical University, Ufa, 450062 Russia
b Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: gataullin@anrb.ru
Received May 12, 2020; revised May 12, 2020; accepted May 22, 2020
This review summarizes the data on the synthesis of new axially chiral or other types of complexes of platinum,
iridium, molybdenum, porphyrin derivatives, subphthalocyanine-tetracyanobutadiene conjugates with unique
photophysical properties, small carbo(hetero)cyclic and acyclic molecules, phosphabarrelenes. Approaches
to the synthesis of some atropisomeric representatives of macrocycles and cyclophanes are considered. New
examples of cyclizations are presented, the occurence of chiral sites in which is controlled by stereoisomerism
or axial chirality, which exist in the substrate molecules when they react with electrophilic, nucleophilic, radi-
calforming reagents, metal complexes, and enter into inter- or intramolecular cycloaddition reactions. Attention
is also paid to the atroposelective conversion of münchnones generated from ortho-(alkenyl)phenyl substituted
N-acylglycines, in which the rotation along the N-Ar bond is hindered.
Keywords: axial-chiral metal complexes, cyclophanes, atropisomer, metallodimer, intramolecular cycloaddition
of münchnones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020