ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 1110-1116
УДК 535.37;539.19;543.42.062
КООРДИНАЦИОННЫЕ И КИСЛОТНО-
ОСНОВНЫЕ СВОЙСТВА ОКСАПРОИЗВОДНЫХ
5,10,15,20-ТЕТРАФЕНИЛПОРФИНА
© 2020 г. С. Г. Пуховскаяa,*, Ю. Б. Ивановаb, А. О. Плотниковаa, Д.А. Шелеховаa,
А. Н. Киселёва,b, С. А. Сырбуb
a Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
b Институт химии растворов имени Г. А. Крестова Российской академии наук, Иваново, 153045 Россия
*e-mail: svetlana.puhovskaya@mail.ru
Поступило в Редакцию 17 февраля 2020 г.
После доработки 17 февраля 2020 г.
Принято к печати 27 февраля 2020 г.
Методом спектрофотометрического титрования изучены кислотно-основные свойства 5,10,15,20-
тетрафенил-21-оксапорфирина и 5,10,15,20-тетрафенил-21,23-диоксапорфирина, определены параметры
электронных спектров поглощения и концентрационные интервалы существования полученных форм.
Исследована кинетика образования комплексов оксапроизводных 5,10,15,20-тетрафенилпорфина с медью
при 288-308 K.
Ключевые слова: порфирины, кислотно-основные свойства, металлопорфирины, координационные
свойства
DOI: 10.31857/S0044460X2007015X
Тетрапиррольные макроциклы, к которым от-
различных металлопроизводных, исследованием
носятся соединения класса порфиринов и их ме-
их структурных, спектроскопических и электро-
таллопроизводные, широко распространены в
химических свойств [13-27]. Единичные работы
природе и играют огромную биологическую роль
Схема 1.
[1]. Успешное решение задач фундаментальных
исследований, а также практическое применение
соединений данного класса напрямую зависит от
оптимизации методов синтеза порфиринов и воз-
можности химической модификации как перифе-
рии макроцикла [2-10], так и его основы путем
замены внутрициклических атомов азота атомами
О, С, S, Sе и Tе [11]. Такая модификация оказы-
вает большое влияние на электронную структуру
макроцикла и приводит к структурам, существен-
но отличающимся по свойствам от классических
порфиринов [12, 13].
В последние годы получены гетерозамещенные
аналоги порфирина и его производные (хлорины,
корролы, тетрабензопорфирины), изучены неко-
торые области их потенциального использования.
Большая часть работ по химии гетероатомных ма-
кроциклов ограничивается синтезом лигандов и
1110
КООРДИНАЦИОННЫЕ И КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОКСАПРОИЗВОДНЫХ
1111
Таблица 1. Показатели констант ионизации (основности) и спектральные характеристики молекулярных и протони-
рованных форм соединений 1-3 в системе ацетонитрил-HClO4 при 298 K
Порфирин
λmax, нм (lgε)
рK1
рK2
∑рK
Н2TPP (1)
413 (5.02)
512 (3.56)
546 (3.12)
589 (2.92)
646 (2.96)
-
-
18.67 [30]
H4TPP2+
441 (5.04)
-
-
-
661 (4.17)
HOTPP (2)
311 пл (3.66)
414 (4.34)
504 (3.31)
569 (3.16)
669 (2.73)
11.40
9.46
20.86
H2OTPP+
411 пл (4.09)
435 (4.29)
572 (3.14)
628 (3.12)
665 (3.05)
H3OTPP2+
-
436 (4.35)
-
627 (3.23)
664 (3.19)
O2TPP (3)
413 (4.45)
511 (3.46)
544 (3.25)
591 (3.05)
646 (2.88)
11.82
10.18
22.00
HO2 TPP +
414 (4.19)
445 (3.88)
512 (3.31)
547 (3.12)
647 (3.26)
H2O2TPP 2+
414 пл (3.77)
444 (4.08)
-
604 (3.14)
663 (3.52)
описывают кислотно-основные взаимодействия
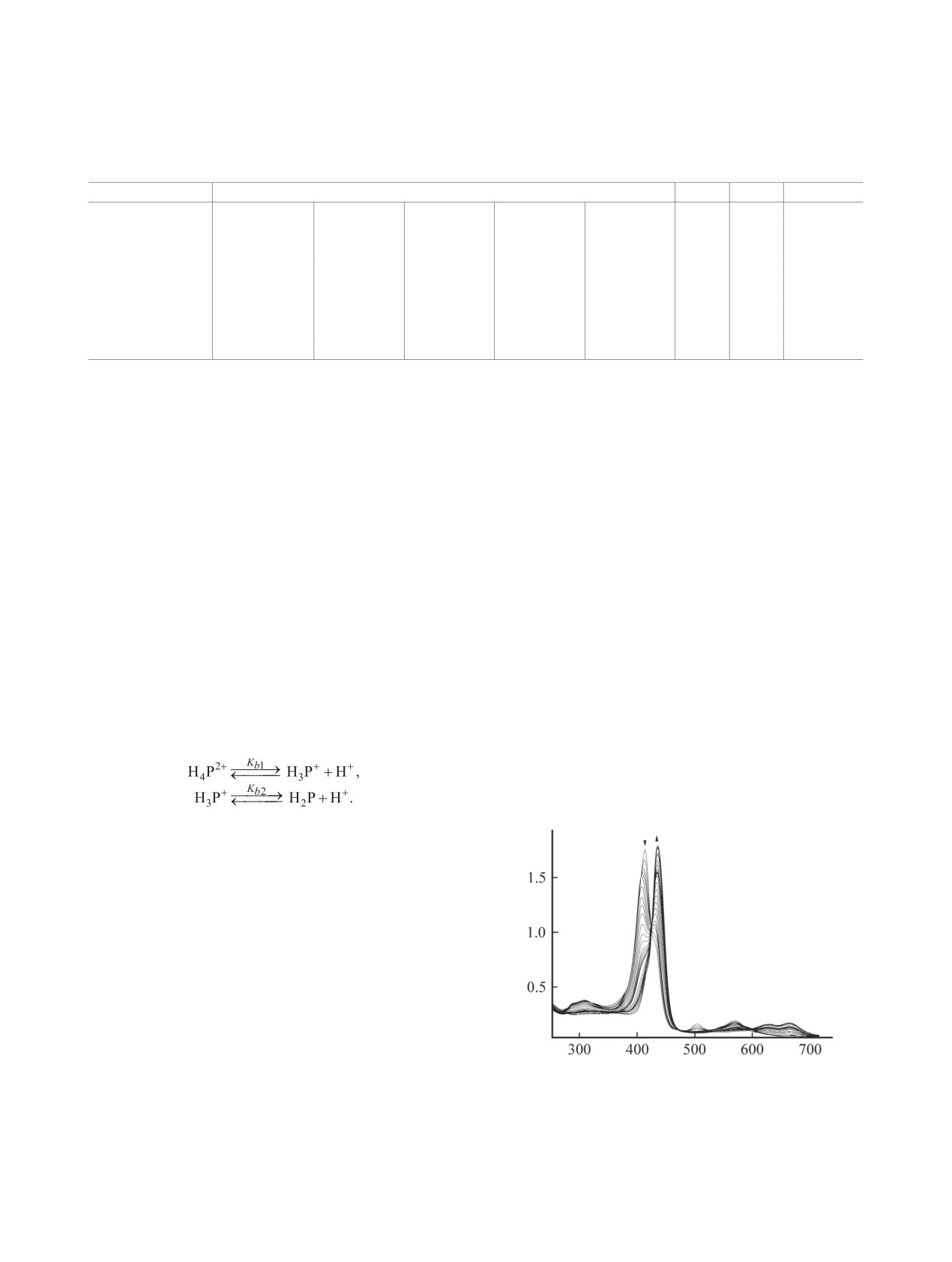
Спектрофотометрические исследования окса-
[28], данные по координационным свойствам этих
производных тетрафенилпорфина показали, что
соединений отсутствуют.
с увеличением концентрации хлорной кислоты
в ЭСП наблюдалось образование двух семейств
В сравнении со структурным аналогом - тетра-
спектральных кривых, каждому из которых со-
фенилпорфином 1 - нами исследованы спектраль-
ответствовал свой набор изосбестических точек
ные, кислотно-основные и координационные свой-
(рис. 1). Кривые спектрофотометрического титро-
ства 5,10,15,20-тетрафенил-21-оксапорфирина 2 и
5,10,15,20-тетрафенил-21,23-диоксапорфирина
3
вания соединений 2 и 3 имеют гладкий монотон-
ный характер без четкого разрешения ступеней
(схема 1).
протонирования. Двухступенчатые и монотонные
Порфирины (H2P) и их гетерозамещенные ана-
кривые титрования при наличии двух семейств
логи в органических растворителях проявляют ам-
изосбестических точек в ЭСП свидетельствуют о
фотерные свойства, а в присутствии кислот могут
последовательном протонировании, однако кон-
протонироваться по внутрициклическим атомам
станты образования моно- и дипротонированных
азота [29, 30]. В первом приближении (без участия
форм, очевидно, близки и разница между их зна-
растворителя и стабилизации образующихся ча-
чениями составляет менее трех порядков. Количе-
стиц противоионами) кислотно-основные взаимо-
ственные величины суммарных констант основной
действия порфиринов в кислых средах могут быть
ионизации протонированных форм соединений 2 и
описаны уравнениями (1), (2) [29].
3 в сравнении с их классическим аналогом Н2TPP
в системе ацетонитрил-HClO4 при 298 K вычисле-
(1)
(2)
Здесь Н2Р, H3P+, H4P2+ - молекулярная, моно- и
A
дипротонированные формы макроцикла соответ-
ственно.
Основные свойства соединений 1-3 исследо-
вали методом спектрофотометрического титрова-
ния в бинарном растворителе HClO4-CH3CN при
298 K. При спектрофотометрическом титровании
ацетонитрильных растворов соединений 1-3 хлор-
ной кислотой характерный для свободных основа-
ний четырехполосный (в видимой части) ЭСП пре-
вращается в трех-, а затем в двухполосный спектр
поглощения дикатионов. Удалось зафиксировать
λ, нм
устойчивые протонированные формы соединений
2, 3. Спектральные характеристики свободных ос-
Рис. 1. Изменение электронных спектров поглощения сое-
нований и их протонированных форм приведены
динения 2 (с = 7.96×10-5 моль/л) в системе CH3CN-HClO4
(0-5.86×10-4 моль/л), λ = 436 нм.
в табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1112
ПУХОВСКАЯ и др.
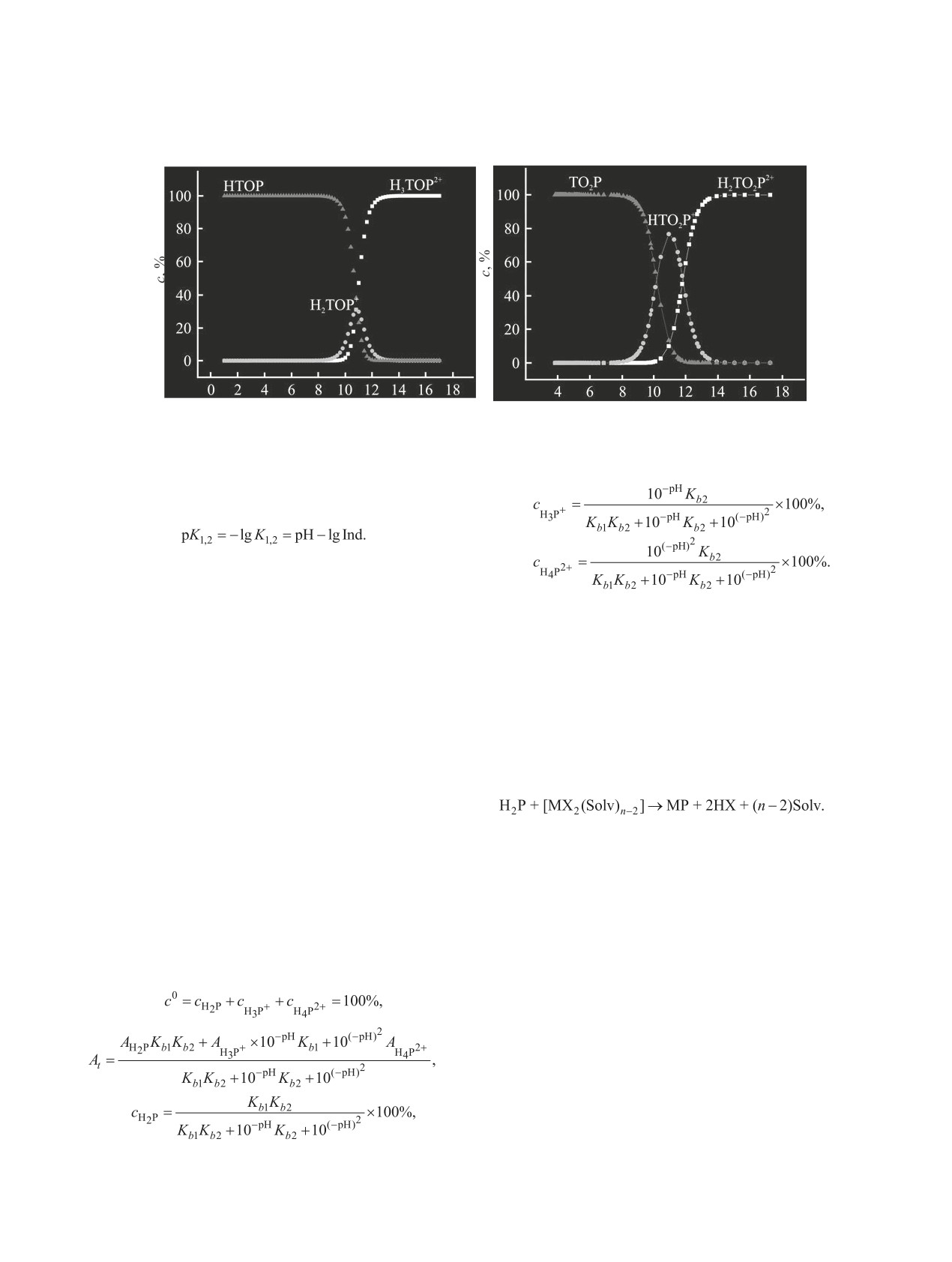
(а)
(б)
pH
pH
Рис. 2. Распределение концентраций молекулярных, моно- и дипротонированных форм соединений 2 (а) и 3 (б) в ходе титрования в си-
стеме CH3CN-H2P-HClO4.
ны по уравнению (3), их соответствующие значе-
(7)
ния представлены в табл. 1.
(3)
Здесь K - константа основности по первой и вто-
(8)
рой ступеням, Ind - индикаторное отношение со-
P2+],
ответственно для соединений 1-3: [H2P]/[H4
Здесь [H2P], [H3P+], [H4P2+] - концентрации ней-
значения рН рассчитывали согласно методике [31]
тральной и ионизированных форм соединений
). Погреш-
по формуле: pH = -2.48 - 2.65lgc(HClO4
1-3; Kb1 и Kb2 константы равновесия реакций (1),
ность измерения констант в ходе эксперимента не
(2); At, AH
, AH
+, AH
2+ - оптические плотности
2P
3P
4P
превышала 3-5%.
растворов, соответствующих нейтральной и иони-
По мере увеличения числа атомов кислорода в
зированным формам порфиринов.
реакционном центре макроцикла происходит зако-
Образование комплексов порфиринов с двухза-
номерное увеличение основных свойств соедине-
рядными катионами металлов в неводных раство-
ний: Н2TPP < HOTPP < O2TPP, что, по-видимому,
рах (9) хорошо изучено [1].
связано с увеличением электронной плотности и
(9)
ее делокализацией в макроциклической системе. С
учетом реакций диссоциации (1, 2) протонирова-
Реакция (9) с порфиринами протекает в срав-
ных форм, уравнения материального баланса (4), а
нении с другими известными реакциями комплек-
также пропорциональности оптической плотности
сообразования в 100 и более раз медленнее. Это
растворенного вещества его концентрации соглас-
позволяет контролировать комплексообразование
но закону Ламбера-Бугера-Бера было получено
обычными методами химической кинетики, напри-
распределение концентраций молекулярной и про-
мер, спектрофотометрическим. Низкие скорости
тонированных форм для соединений 2 и 3 при ти-
образования металлопорфиринов обусловлены
тровании (4)-(8) (рис. 2).
бимолекулярным многоцентровым механизмом
(4)
реакции [1]. Образование металлопорфиринов ха-
рактеризуется значительной величиной энергии
активации и отрицательной энтропией активации.
(5)
Нами впервые измерены кинетические параме-
тры образования комплексов гетерозамещенных
(6)
порфиринов 2 и 3 с медью в сравнении с тетра-
фенилпорфирином 1 в уксусной кислоте и ДМФА
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
КООРДИНАЦИОННЫЕ И КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОКСАПРОИЗВОДНЫХ
1113
Таблица 2. Кинетические параметры образования медных комплексов соединений 1-3 в уксусной кислоте и ДМФА
Порфирин
cCuAcO2×10-3, моль/л
k2э9ф8×103
kv298, л0.5∙моль-0.5∙с-1
Ea, кДж/моль
ΔS≠, Дж/(моль·K)
Уксусная кислота
O2TPP (3)
0.937
14.6±0.10
0.34±0.02
92±5
-47±10
HOTPP (2)
Реакция протекает мгновенно
Н2ТРР (1)
1.81
28.5±0.10
0.67±0.02
81±4
-29±6
ДМФА
O2TPP (3)
0.11
Измерить не удалось
HOTPP (2)
0.11
5.99±0.02
0.54±0.02
8± 1
-230±10
Н2ТРР (1)
0.11
0.02±0.002
0.0019±0.002
20± 1
-238±20
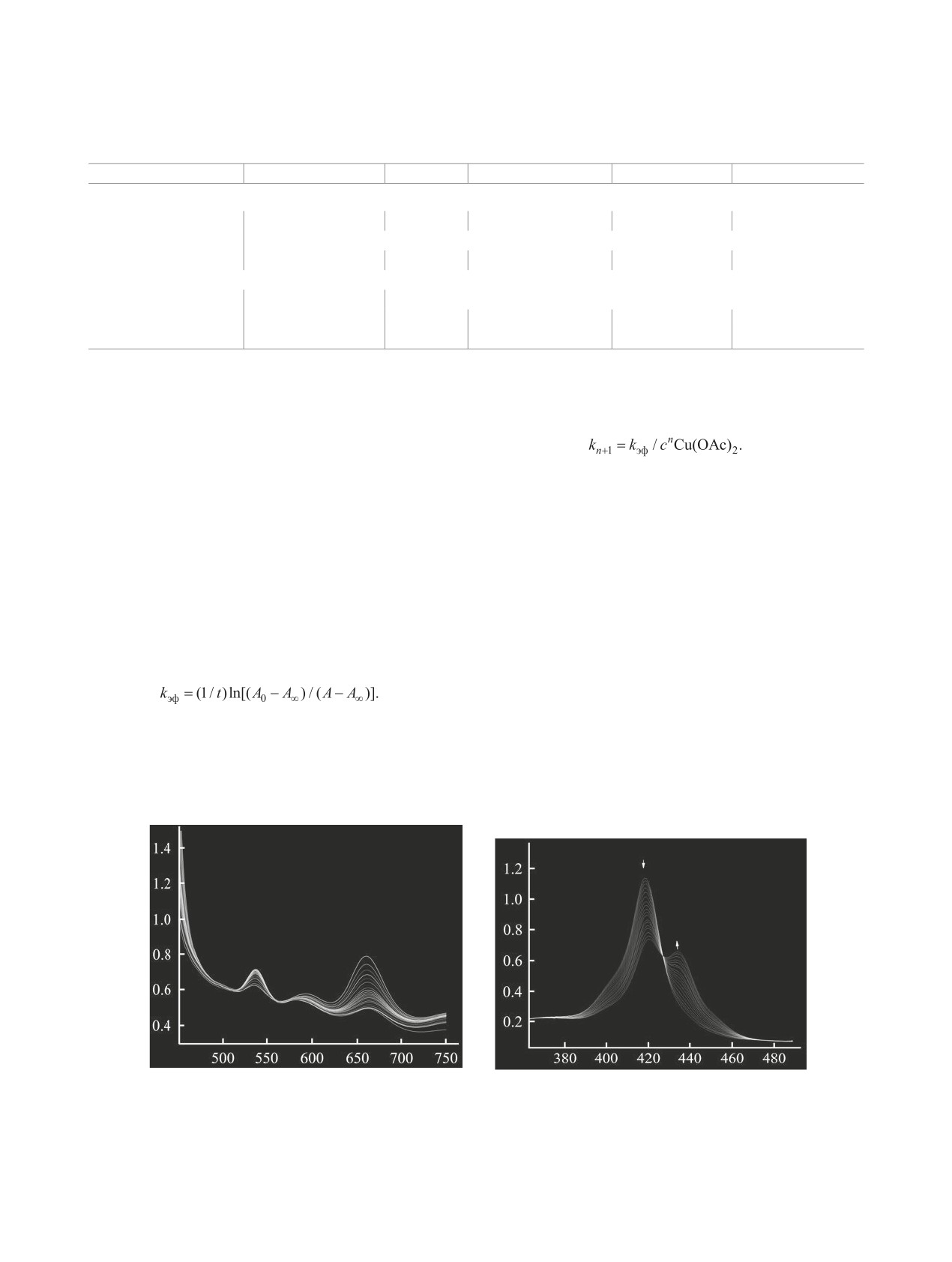
(табл. 2). В спектрах реагирующих систем наблю-
уравнению (11), где n - порядок реакции (2) по аце-
дались четкие изосбестические точки (рис. 3).
тату меди, который равен 0.5 в ДМФА и в уксусной
кислоте [32].
Для всех изученных реакций образования ме-
таллопорфиринов был найден первый кинетиче-
(11)
ский порядок, что подтверждается прямолинейно-
Как указано выше, замена одного из атомов
стью зависимостей в координатах lg(c0H2P/cH2P)-t
азота пиррольного фрагмента макроциклического
(9), где c0H2P и cH2P - начальная и текущая концен-
соединения на атом кислорода приводит увеличе-
трации порфирина. Концентрацию порфиринов в
нию его основных свойств примерно на 2 порядка.
ходе эксперимента контролировали по изменению
Увеличение частичного отрицательного заряда на
оптической плотности раствора. Кинетические
атомах реакционного центра способствует упроч-
опыты проводили в условиях ~100-50-кратного
нению связей металла с третичными атомами азо-
избытка Cu(OAc)2 по отношению к порфирину,
та N→M в переходном состоянии и тем самым
что позволило рассчитать эффективные константы
обусловливает увеличение скорости комплексо-
скорости (kэф) комплексообразования по уравне-
образования по сравнению с классическим анало-
нию (10).
гом. В координирующем слабоосновном раство-
(10)
рителе ДМФА константа скорости соединения 2
Здесь А0, А, А∞ - оптические плотности раствора
возрастает в ~280 раз, а энергия активации снижа-
порфирина в начальный момент, в момент време-
ется на ~10 кДж/моль по сравнению с порфири-
ни t и по окончании реакции соответственно. Кон-
ном 1. Введение второго атома кислорода, а, сле-
станты скорости n + 1 порядка рассчитывали по
довательно, увеличение основности соединения
А
(а)
(б)
А
λ, нм
λ, нм
Рис. 3. Изменение электронных спектров поглощения соединения 3 (a) в системе CH3COOH-Cu(OAc)2 ([3] = 2.66×10-4 моль/л; [Cu(OAc)2] =
0.937×10-4 моль/л) и соединения 2 (б) в системе ДМФА-Cu(OAc)2 ([2] = 1.62×10-5 моль/л; [Cu(OAc)2] = 1.11×10-4 моль/л) при 288-308 K.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1114
ПУХОВСКАЯ и др.
(табл. 1), приводит к мгновенному протеканию ре-
изложены [36-38]. Ошибка в определении соот-
акции O2TPP 3 с ацетатом меди. При переходе от
ветствующих констант ±3-5%.
ДМФА к уксусной кислоте, как и следовало ожи-
Соединения 1-3 синтезировали по известным
дать для классических порфиринов [1], скорость
методикам [16, 39]. Спектральные характеристи-
ки, полученных соединений, соответствовали ли-
комплексообразования с Н2TPP 1 увеличивается
тературным данным [16, 39].
более чем на 2 порядка. Увеличение основности
5,10,15,2-Тетрафенилпорфин (1). ЭСП (хло-
соединения 3, по-видимому, приводит к образо-
роформ), λmax, нм (lgε): 413 (5.60), 513 (4.26),
ванию более прочных водородных связей с мо-
546 (3.90), 590 (3.70), 650 (3.73). Спектр ЯМР 1H
лекулами уксусной кислоты, блокирующими ко-
(500 MГц, CDCl3), δ, м. д.: -3.75 с (2H, NH), 7.80
ординационный центр. Это и вызывает снижение
м (12Hм,п, Ph), 8.30 м (8Hо, Ph), 8.75 м (8H, β-CН).
скорости комплексообразования с соединением 3
Масс-спектр (FAB), m/z:
613 (вычислено для
в уксусной кислоте (табл. 2).
C44H29N4: 613.24). Найдено, %: C 87.15; H 4.91; N
Таким образом, методом спектрофотометриче-
7.91. C44H30N4. Вычислено, %: C 87.12; H 4.95; N
7.92.
ского титрования определены константы основно-
сти, параметры электронных спектров поглощения
5,10,15,20-Тетрафенил-21-оксапорфирин (2).
ЭСП (хлороформ), λmax, нм (lgε): 418 (5.41), 514
и интервалы существования ионизированных и
(4.36), 548 (3.81), 617 (3.48), 678 (3.69). Спектр
молекулярных форм 5,10,15,20-тетрафенил-21-ок-
ЯМР 1H (500 МГц, CDCl3), δ, м. д.: -1.64 с (1Н,
сопорфирина и
5,10,15,20-тетрафенил-21,23-ди-
NH), 7.67 м (12Нм,п, Ph) 8.09 м (8Но, Ph), 9.08 м
оксопорфирина. Впервые исследована кинетика
(4Н, β-H, фуран), 9.36 м (4Н, β-H, пиррол). Масс-
реакций образования медных комплексов оксоза-
спектр (FAB), m/z: 615 (вычислено для C44H29N3O:
мещенных производных
5,10,15,20-тетрафенил-
615.73). Найдено, %: C 87.15; H 4.91; N 7.91.
порфина в растворителях различной природы.
C44H30N3O. Вычислено, %: C 87.12; H 4.95; N 7.92.
Проведен сравнительный анализ полученных ки-
5,10,15,20-Тетрафенил-21,23-диоксапорфи-
нетических параметров реакции комплексообра-
рин (3). ЭСП (ДМФА), λmax, нм (lgε): 417 (4.93),
зования в сравнении со структурным аналогом -
512 (3.91), 547 (3.72), 587 (3.53), 646 (3.41). Спектр
ЯМР 1H (500 МГц, CDCl3), δ, м. д.: 7.71-7.76
тетрафенилпорфином.
, Ph), 9.38 с (4H, β-H,
м (12Нм,п, Ph), 8.16 м (8Hо
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
пиррол), 9.55 с (4H, β-H, фуран). Масс-спектр
(FAB), m/z: 619.23 (вычислено для C44H28N2O2: m/z
Использованные в работе растворители (уксус-
616.71).
ная кислота, хлорная кислота, ацетонитрил) и аце-
ФОНДОВАЯ ПОДДЕРЖКА
тат меди (ЧДА) очищали стандартными методами
[33-35].
Работа выполнена при финансовой поддержке
Российского фонда фундаментальных исследо-
Cпектры ЯМР 1Н записаны на спектрометре
ваний (грант № 19-03-00214 А) с привлечением
Bruker-500 c рабочей частотой 500 МГц в CDCl3.
оборудования центра коллективного пользования
Масс-спектры зарегистрированы на время-
«Верхневолжский региональный центр физи-
пролетном масс-спектрометре Shimadzu Axima
ко-химических исследований».
Confidence (MALDI-TOF). Электронные спектры
КОНФЛИКТ ИНТЕРЕСОВ
поглощения (ЭСП) и скорость образования ком-
плексов порфиринов 1-3 измеряли на спектро-
Авторы заявляют об отсутствии конфликта
фотометрах Shimadzu UV-1800 и Hitachi U-2000.
интересов.
Кинетические измерения проводили в термостати-
СПИСОК ЛИТЕРАТУРЫ
руемых кюветах в интервале температур от 288 до
1. Berezin B.D. Coordination compounds of porphyrins
348 K. Колебание температуры не превышало ±0.1
and phthalocyanines. John Wiley & Sons: New York,
град. Исследование кислотно-основных свойств
1981. P. 323.
порфиринов проводили методом спектрофотоме-
2. Buchler J.W. In: Porphyrins / Ed. D. Dolphin. New
трического титрования. Методики эксперимента и
York: Academic Press, 1978. Vol. 1. P. 389.
обработки экспериментальных данных подробно
3. Тарасевич М.Р., Радюшкина М.Р. Катализ и элек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
КООРДИНАЦИОННЫЕ И КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОКСАПРОИЗВОДНЫХ
1115
трокатализ металлопорфиринами. М.: Мир, 1982.
23.
Latos-Grażyński L., Lisowski J., Olmstead M.M.,
C. 168.
Balch A.L. // J. Am. Chem. Soc. 1987. Vol. 109. P. 4428.
4.
Senge M.O. In: The porphyrin handbook / Eds K.M.
doi 10.1021/ja00248a067
Kadish, K.M. Smith, R. Guilard. San Diego: Academic
24.
Latos-Grażyński L., Lisowski J., Olmstead M.M.,
Press, 1999. Vol. 1. P. 239.
Balch A.L. // Inorg. Chem. 1989. Vol. 28. N 22. P. 4065.
5.
da G.H. Vicente M., Smith K. M. // Curr.
doi 10.1021/ic00321a005
Org. Synth. 2014. Vol. 11. N 1. P. 3. doi
25.
Latos-Gra˙zy´nski L., Lisowski J., Olmstead M.M.,
10.2174/15701794113106660083
Balch A.L. // Inorg. Chem.. 1989. Vol. 28. P. 1183. doi
6.
Syrbu S.A., Ageeva T.A., Kolodina E.A., Semeykin A.S.,
10.1021/ic00305a032
Koifman O.I. // J. Porph. Phthal. 2006. Vol. 10. N 4-6.
26.
Latos-Grażyński L., Lisowski J., Chmielewski M.,
P. 885. doi 10.1142/S1088424606000235
Grzeszczuk M., Olmstead M.M., Balch A.L. // Inorg.
7.
Syrbu S.A., Pukhovskaya S.G., Nam T.D., Ivanova Yu.B.,
Chem. 1994. Vol. 33. P. 192. doi 10.1021/ic00080a004
Razumov M.I. // Macroheterocycles. 2019. Vol. 12. N 2.
27.
Latos-Grażyński L., Pacholska E., Chmielewski M.,
P. 135. doi 10.6060/mhc190557s
Grzeszczuk M., Olmstead M.M., Balch A.L. // Inorg.
8.
Rocheva T.K., Shevchenko O.G., Mazaletskaya L.I.,
Chem. 1996. Vol. 35. P. 556. doi 10.1021/ic950329z
Sheludchenko N.I., Belykh D.V. // Macroheterocycles.
28.
Gross Z., Saltsman I., Pandian R.P., Barzilay C. //
2018. Vol. 11. N 1. P. 95. doi 10.6060/mhc170302b
Tetrahedron Lett. 1997. Vol. 38. P. 2383. doi 10.1016/
9.
Функциональные материалы на основе тетрапир-
S0040-4039(97)00357-2
рольных макрогетероциклических соединений / Под
29.
Andrianov V.G., Malkova O.V. // Macroheterocycles.
ред. О.И. Койфмана. М.: ЛЕНАНД, 2019. 848 с.
2009. Vol. 2. N 2. P. 130. doi 10.6060/mhc2009.2.130
10.
Ivanova Yu.B., Pukhovskaya S.G., Mamardashvili N.Zh.,
30.
Tagawa K., Mori S., Okujima T., Takas M. //
Koifman O.I., Kruk M.M. // J. Mol. Liq. 2019 Vol. 275.
Tetrahedron. 2017. Vol. 73 P. 794. doi 10.1016/j.
P. 491. doi 10.1016/j.molliq.2018.11.107
tet.2016.12.067
11.
Latos-Grażyński L. In: The Porphyrin Handbook /
31.
Пуховская С.Г., Иванова Ю.Б., Дао Тхе Нам, Ва-
Eds K.M. Kadish, K.M. Smith, R. Guilard. New York:
шурин А.С. // ЖФХ. 2014. Т. 88. № 10. С. 1487;
Academic Press, 2000. Vol. 2. P. 36.
Pukhovskaya S.G., Ivanova Yu.B., Nam D.T., Vashu-
12.
Сырбу С.А., Пуховская С.Г., Иванова Ю.Б., Вашу-
рин А.С. // ЖОХ. 2019. Т. 89. Вып. 2. С. 258;
rin A.S. // Russ. J. Phys. Chem. 2014. Vol. 88. N 10.
P. 1670. doi 10.1134/S0036024414100288
Syrbu S.A., Pukhovskaya S.G., Ivanova Yu.B., Vashu-
rin A.S. // Russ. J. Gen. Chem. 2019. Vol. 89. N. 2.
32.
Кувшинова Е.М., Пуховская С.Г., Голубчиков О.А.,
P. 255. doi 10.1134/S1070363219020142
Березин Б.Д. // Коорд. хим. 1993. Т. 19. № 8. С. 630.
13.
Lisowski J., Grzeszczuk M., Latos-Grażyński L. // Inorg.
33.
Гордон А., Форд Р. // Спутник химика. М. : Мир,
Chim. Acta. 1989. Vol. 161. N 153. doi 10.1016/S0020-
1976. С. 541.
1693(00)83086-8
34.
Вайсбергер А., Проскауэр Э., Риддик Дж. Органиче-
14.
Pandian R.P., Chandrashekar T.K. // Inorg. Chem. 1994.
ские растворители. Физические свойства и методы
Vol. 33. P. 3317. doi 10.1021/ic00093a020
очистки. М.: ИЛ, 1958. С. 518.
15.
Pandian R.P., Chandrashekar T.K // J. Chem. Soc.
35.
Карякин Ю.В., Ангелов И.И. Чистые химические
Dalton Trans. 1993. Vol 1. P. 119. doi 10.1039/
реактивы. М.: Химия, 1974. С. 407.
dt9930000119
36.
Иванова Ю.Б., Шейнин В.Б., Мамардашвили Н.Ж. //
16.
Chmielewski P.J., Latos-Grażyński L., Olmstead M.M.,
ЖОХ. 2007. Т. 77. Вып. 8. С. 1380; Ivanova Yu.B.,
Balch A.L. // Chem. Eur. J. 1997. Vol. 3. P. 268. doi
Sheinin V.B., Mamardashvili N.Zh. // Russ. J. Gen.
10.1002/chem.19970030216
Chem. 2007. Vol. 77. N 8. P. 1458. doi 10.1134/
17.
Chmielewski P.J., Latos-Grażyński L. // Inorg. Chem.
S1070363207080270
1998. Vol. 37. P. 4179. doi 10.1021/ic971387i
37.
Nam D.T., Pukhovskaya S.G., Ivanova Y.B., Liulko-
18.
Sridevi B., Narayanan S.J., Srinivasan A.,
vich L.S., Semeikin A.S., Syrbu S.A., Kruk M.M. // J.
Chandrashekar T.K., Subramanian J. // J. Chem. Soc.
Incl. Phenom. Macrocycl. Chem. 2017. Vol. 89. N 3-4.
Dalton Trans. 1998. Vol. 12. P. 1979. doi 10.1039/
P. 325. doi 10.1007/s10847-017-0758-9
a801934g
38.
Иванова Ю.Б., Чурахина Ю.И., Мамардашвили Н.Ж. //
19.
Pawlicki M., Kańska I., Latos-Grażyński L. // Inorg.
ЖОХ. 2008. Т. 78. Вып. 4. С. 691; Ivanova Yu.B.,
Chem. 2007. Vol. 46. N 16. P. 6575. doi 10.1021/
Churakhina Yu.I., Mamardashvili N.Zh. // Russ. J.
ic700631t
Gen. Chem. 2008. Vol. 78. N 4. P. 673. doi 10.1134/
20.
Broadhurst M.J., Grigg R., Johnson A.W. // J. Chem.
S1070363208040269
Soc. (D). 1969. Vol. 1480. doi 10.1039/C29690001480
39.
Buchler J.W. In: Synthesis and properties of
21.
Broadhurst M.J., Grigg R., Johnson A.W. // J. Chem.
Soc. (D). 1970. Vol. 807. doi 10.1039/C29700000807
metalloporphyrins. Porphyrins / Ed. D. Dolphin. New
22.
Broadhurst M.J., Grigg R. // J. Chem. Soc. (С). 1971.
York: Academic Press, 1978. Vol. 1. P. 389. doi 10.1016/
P. 3681. doi 10.1039/J3971000368.1
B978-0-12-220101-1.50017-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1116
ПУХОВСКАЯ и др.
Complexing and Acid-Base Properties
of 5,10,15,20-Tetraphenylporphine Oxa-Derivatives
S. G. Pukhovskayaa,*, Yu. B. Ivanovab, A. O. Plotnikovaa, D. A. Shelekhovaa,
A. N. Kiseleva,b, and S. A. Syrbub
a Ivanovo State University of Chemical Technology, Ivanovo, 153000 Russia
b G.A. Krestov Institute of Solution Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
*e-mail: svetlana.puhovskaya@mail.ru
Received February 17, 2020; revised February 17, 2020; accepted February 27, 2020
The acid-base properties of 5,10,15,20-tetraphenyl-21-oxaporphyrin and 5,10,15,20-tetraphenyl-21,23-
dioxaporphyrin were studied by spectrophotometric titration. The parameters of electronic absorption spectra and
the concentration intervals of the existence of the obtained forms were determined. The kinetics of the formation
of complexes of oxa derivatives of 5,10,15,20-tetraphenylporphin with copper at 288-308 K was studied.
Keywords: porphyrins, acid-base properties, metalloporphyrins, coordination properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020