ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 7, с. 1124-1132
УДК 632.938.2:602
НАНОЧАСТИЦЫ ХИТОЗАН-ТРИПОЛИФОСФАТ:
СИНТЕЗ МЕТОДОМ ИОННОГО ГЕЛЕОБРАЗОВАНИЯ,
СВОЙСТВА И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
© 2020 г. Э. В. Поповаa,*, И. М. Зоринb, Н. С. Домнинаb,
И. И. Новиковаa, И. Л. Краснобаеваa
a Всероссийский научно-исследовательский институт защиты растений,
Подбельского шоссе 3, Пушкин, 196608 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: elzavpopova@mail.ru
Поступило в Редакцию 3 февраля 2020 г.
После доработки 3 февраля 2020 г.
Принято к печати 6 февраля 2020 г.
Методом ионного гелеобразования хитозана (M 6.5×103 и 60×103 Да) в присутствии триполифосфата
получены наночастицы со средним размером около 100 нм. Дисперсии наночастиц проявили высокую
антимикробную активность против патогенных организмов - бактерии C. michiganensis (штамм 101) и
грибов F. graminearum и A. solani.
Ключевые слова: хитозан, ионное гелеобразование, наночастицы, антимикробная активность
DOI: 10.31857/S0044460X20070173
Хитозан с его уникальными свойствами - не-
кулярных масс. Существенным ограничением ис-
токсичностью, биосовместимостью, способно-
пользования хитозана в растениеводстве является
стью к биодеградации, поликатионной структу-
его нерастворимость в воде при рН ≥ 6 [2, 5].
рой - широко используется в медицине, пищевой
Использование хитозана в сельском хозяйстве в
промышленности, сельском хозяйстве [1-9]. Ши-
форме наночастиц наиболее перспективно [13-17],
рокий спектр биологической активности хитозана
может повысить его эффективность независимо
обусловливает его применение в растениеводстве
от величины М и создать преимущества в борьбе
в качестве средств, стимулирующих рост и разви-
с различными болезнями [15]. Среди разнообраз-
тие растений, а также в препаратах, защищающих
ных методов получения наночастиц хитозана наи-
многие сельскохозяйственные культуры от грибко-
более известен метод ионного гелеобразования
вых, вирусных и бактериальных заболеваний [2, 5].
[18-21]. Он заключается в формировании ионного
Основной критерий применимости хитозана
комплекса в результате электростатического вза-
для этих целей - величина его молекулярной мас-
имодействия положительно заряженных амино-
сы, во многом определяющая его биологические
групп хитозана, протонированных в растворах при
свойства. Однако до сих пор не выявлено одно-
рН = 4.0-6.5, с трехвалентным анионом триполи-
значной корреляции между величиной М хитозана
фосфата. К преимуществам этого метода относят-
и его биологическими свойствами [10-13]. Изме-
ся возможность контролировать свойства наноча-
нение молекулярной массы полимера влечет за со-
стиц, отсутствие побочных химических реакций и
бой изменение механизма и локуса его биологиче-
нетоксичность триполифосфата.
ского действия, а конечный эффект определяется
свойствами изучаемой системы в целом. Поэтому
Нами изучены физико-химические свойства
поиск максимальной биологической активности
нано- и микрочастиц, полученных из образцов хи-
хитозана проводится в широком диапазоне моле-
тозана с различной молекулярной массой, и иссле-
1124
НАНОЧАСТИЦЫ ХИТОЗАН-ТРИПОЛИФОСФАТ
1125
Таблица 1. Условия окислительной деструкции хитозана (M 150∙103 Да) и характеристика полученных образцов по
молекулярной массе (М) и по размерам (R) в ацетатном буфере при рН = 5
(NaNO2),
№
Время
Выход
М образца,
г/на 5 г
R, нм
R, нм а
образца
реакции, мин
реакции, %
×10-3
хитозана
1
0.043
150
47
6.5
6, 46
6, 46
2
0.024
120
80
60
8, 50, 277
7, 153
Исходный образец
-
-
-
150
9, 41, 503
9, 416
а После ультразвукового воздействия в течение 30 мин.
Таблица 2. Влияние концентрации хитозана в реакции с триполифосфатом, скорости (3200, 6200, 15000 об/мин) и
времени (1, 2 ч) центрифугирования дисперсий, полученных в буфере при рН = 5, на размеры частиц
Хитозан,
3200
6200
15000
№
с, мг/мл
Rисх, нм
М×10-3
1
2
1
2
1
2
1
6.5
0.5
115
2, 3, 4
2, 2а, 2б
130, 118, 90
104
102
-
-
45
22
5
6
240
6
60
2
61, 210
38, 166
30, 128
93
16, 84
59
55
7
150
2
59, 323
135
28, 160
-
-
23, 93
83
а После воздействия ультразвуком в течение 30 мин.
б После хранения 5 сут при 4°С и воздействия ультразвуком в течение 30 мин.
дована их антимикробная и фунгицидная актив-
радиусом от 50 нм и более. Агрегаты представля-
ность в сравнении с исходным полимером.
ют собой достаточно рыхлые образования, разме-
ры которых могут изменяться при ультразвуковом
Для получения образцов хитозана с различной
молекулярной массой была выбрана окислитель-
воздействии, а также при хранении [23]. Слабое
ная деструкция хитозана [22], протекающая в до-
ультразвуковое воздействие разрушает агрегаты,
статочно мягких условиях при действии нитрита
преобразуя их в стабильную моду с усредненным
натрия. Варьируя количество NaNO2 и время реак-
размером, однако в образце хитозана с М 6.5×
ции, мы получили 2 образца хитозана с М 6.5×103
103 Да при действии ультразвука распределение
и 60×103 Да (табл. 1). Получение образцов из одно-
агегатов по размерам не изменяется. Исходный хи-
го исходного хитозана (М 150×103 Да) позволило в
тозан и полученные при его деструкции образцы
дальнейшем провести сравнительное изучение их
были использованы для получения наночастиц.
свойств. Выбор исходного хитозана с высоким со-
На основании литературных данных [18, 19, 23]
держанием звеньев с аминогруппами (степень деа-
и предварительных экспериментов были опреде-
цетилирования 85%) обусловлен потенциальными
лены оптимальные условия получения наночастиц
биоцидными свойствами такого хитозана [5].
методом ионного гелеобразования, изучено влия-
В водных растворах макромолекулы полисаха-
ние способа выделения, хранения и воздействия
ридов, в том числе и хитозана, способны к агре-
ультразвука на размеры частиц в образующихся
гации [2, 18]. Такие растворы представляют собой
дисперсиях (табл. 2). Выбор условий синтеза и
смесь частиц различных размеров, что отражает-
обработки ультразвуком дисперсии наночастиц
ся в полимодальном распределении по размерам.
представлено на примере образца с М 6.5×103 Да.
Исходный хитозан и полученные из него образ-
Синтез проводили в ацетатном буфере при различ-
цы были охарактеризованы по размерам методом
ных концентрациях хитозана и при постоянной
динамического рассеяния света. Образцы неод-
концентрации триполифосфата (0.84 мг/мл), со-
нородны (табл. 1), в распределении присутствует
отношение хитозан (аминогруппы)-триполифос-
мода собственно макромолекул хитозана с гидро-
фат не менее 5:1 (моль). После формирования на-
динамическим радиусом до 10 нм и моды агрега-
ночастц реакционную смесь подвергали диализу
тов макромолекул хитозана с гидродинамическим
против воды.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1126
ПОПОВА и др.
Таблица 3. Параметры дисперсий, полученных из свежевыделенных наночастиц хитозана (М 60×103 Да)
Концентрация
Среда для
Среда для
Параметры
№
наночастиц в
триполифосфата
хитозана
R, нм
PDI
ζ-потенциал, мВ
дисперсии, мг/мл
1
Буфер, рН = 5
Буфер, рН = 5
47
0.45
26.8±3
1.85
2
Буфер, рН = 4.5
Буфер, рН = 4.5
211
0.25
19.8±2
0.89
3
Вода
Вода, рН = 5
185
0.32
11.2±1
0.91
4а
Вода
Вода, рН = 5
300, 1200
-
-
0.91
5б
Буфер, рН = 5
Буфер, рН = 5
210
0.51
21.4±0.5
1.04
а Через 5 дней хранения при 4°С.
б М 6.5×103.
Из хитозана с М 6.5×103 Да (с = 2 мг/мл) получе-
стиц, водную дисперсию можно хранить в холо-
ны наночастицы с размером 130 нм, а при увеличе-
дильнике (4°С) несколько дней [25]. После тща-
нии концентрации хитозана в 3 раза образовались
тельного промывания осадков деионизированной
более крупные частицы (табл. 2). К уменьшению
водой и повторного их суспендирования с добав-
размеров частиц приводит обработка полученной
кой Твин-80 образовавшиеся дисперсии подверга-
дисперсии ультразвуком. При хранения диспер-
ли воздействию ультразвука в течение 30 мин и за-
сии в холодильнике (4°С, 5 сут) выпадал осадок,
тем фильтровали для удаления визуально видимых
но при действии ультразвука происходило его дис-
агрегированных частиц.
пергирование и формирование дисперсии со сред-
Для изучения влияния изменения среды при
ним размером частиц ~90 нм.
синтезе на размеры свежевыделенных вышеука-
Для извлечения наночастиц полученные дис-
занным способом частиц, повторно суспендиро-
персии центрифугировали, варьируя скорость и
ванных в воде с добавлением Твин-80, образцы
продолжительность. Центрифугирование позво-
хитозана растворяли в ацетатном буфере (рН = 4.5,
ляет последовательно удалять из дисперсии ча-
5.0) или в воде (рН = 5) (табл. 3).
стицы крупной фракции, и средний размер частиц,
Снижение рН буфера до 4.5 при получении
оставшихся в супернатанте, снижается. На приме-
дисперсий приводит к увеличению размеров нано-
ре образца с М 60×103 Да видно как изменяются во
частиц, а их концентрация уменьшается в 2 раза.
времени размеры частиц в супернатанте по ходу
При синтезе в водной среде при рН = 5 размеры
центрифугирования.
наночастиц также увеличиваются, как и при рН =
Полученные
при
центрифугировании
4.5 происходит снижение ζ-потенциала и выхода
(15000 об/мин, 2 ч) осадки с выходом до 10% ли-
наночастиц. Если в свежеприготовленной диспер-
офильно сушили и затем суспендировали в де-
сии (табл. 3, оп. № 3) присутствуют частицы од-
ионизированной воде. Воду добавляли с таким
ного размера, то после хранения в течение 5 сут
расчетом, чтобы концентрация комплекса хито-
(табл. 3, оп. № 4) в образце появляется осадок, при
зан-триполифосфат в дисперсии была ~1.5 мг/мл.
перемешивании которого в распределении по раз-
Однако только для образца с М 6.5×103 Да удалось
мерам обнаружены агрегаты микронного размера.
получить стабильную дисперсию наночастиц,
Взаимодействие между хитозаном и трипо-
причем для этого потребовалось добавление 5%-
лифосфатом было подтверждено сравнением ИК
ного неионногенного стабилизатора Твин-80. Рас-
спектров исходного хитозана и полученных на-
пределение по размерам частиц для этого образца
ночастиц. Полоса в области 3500-3300 см-1, об-
характеризовалось двумя модами: 43±4 и 147±13 нм.
условленная валентными колебаниями связей
Лиофилизация дисперсий - общепринятая тех-
функциональных групп N-H и O-H хитозана, ста-
нология, обеспечивающая долгосрочное хранение
новится шире, что свидетельствует об усилении
полимерных наночастиц [18, 24]. Если лиофили-
водородной связи при образовании наночастиц.
зация не позволяет достичь полного повторного
При образовании ионного комплекса хитозан-
диспергирования осадка, что обычно обусловлено
триполифосфата максимумы поглощения валент-
агрегацией или необратимым слиянием наноча-
ных и деформационных колебаний связей N-H
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
НАНОЧАСТИЦЫ ХИТОЗАН-ТРИПОЛИФОСФАТ
1127
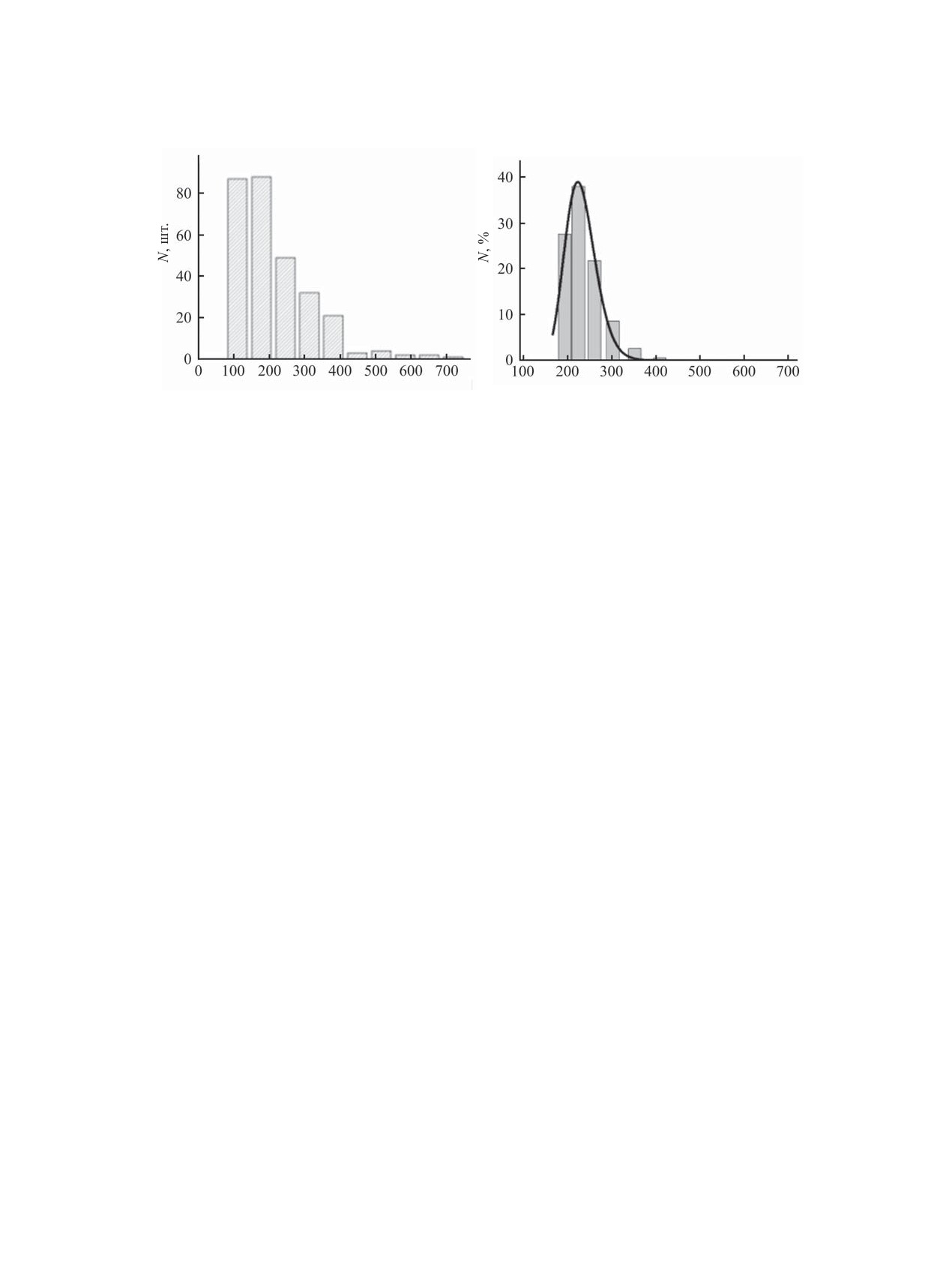
ɚ
ɛ
d ɧɦ
d ɧɦ
Рис. 1. Распределение частиц по диаметрам по данным атомно-силовой микроскопии (а) и распределение наночастиц в
дисперсии по гидродинамическим диаметрам (б) из данных динамического рассеяния света для образца хитозана с М
60×103 Да (образец № 6, табл. 2).
смещаются в сторону низких частот. Полоса при
V = πh(3r2+h2)/6,
(1)
1599 см-1, наблюдающаяся в спектре исходного хи-
V = 4πR3/3.
(2)
тозана, сдвигается к 1561 см-1. Вместо полосы при
Можно трактовать данные атомно-силовой
1650 см-1 в спектре наночастиц появляется полоса
микроскопии иначе: в предположении быстрой и
при 1630 см-1, соответствующая деформационным
сильной адсорбции на слюду контакт частицы со
колебаниям связи N-H в ионе NH3+. Указанные из-
слюдой приводит к формированию на поверхно-
менения в ИК спектрах наночастиц обусловлены
сти пятна из материала частицы, форма и размер
взаимодействием аминогруппы и фосфат-аниона и
которого соответствуют проекции частицы на по-
образованием комплекса хитозан-триполифосфат
верхность (т. е. диаметр объекта атомно-силовой
[26, 27].
микроскопии может соответствовать диаметру
Некоторые образцы, представляющие собой
частицы в дисперсии). Частица при этом разру-
дисперсии наногелей сшитого хитозана, охаракте-
шается и ее объем более не соответствует объему
ризованы распределением частиц по размерам ме-
исходной частицы.
тодом динамического рассеяния света в дисперсии
Методами атомно-силовой микроскопии и ди-
и визуализированы с помощью атомно-силовой
намического рассеяния света получены результа-
микроскопии после адсорбции на слюду. Метод
ты, не противоречащие друг другу. Образец хито-
атомно-силовой микроскопии позволяет получить
зана с М 60×103 Да (табл. 2, оп. № 6), очищенный
информацию о размерах частиц после их адсо-
диализом и подвергнутый обработке ультразвуком
рбции на слюду и высушивания. Эти процессы
в течение 30 мин, состоял из частиц разных разме-
приводят к деформации частиц, на поверхности
ров, образовавшихся при взаимодействии хитоза-
слюды они имеют форму сегмента шара. Можно
на и триполифосфата, а также из частиц хитозана
приближенно вычислить диаметр исходной части-
в виде агрегатов. На изображении атомно-силовой
цы в растворе, предполагая, что объем вещества
микроскопии визуализировано множество адсор-
частицы в дисперсии и на поверхности слюды
бированных частиц неопределенной формы с ши-
после адсорбции сохраняется. Для этого по фор-
роким распределением по размерам: присутству-
муле для вычисления объема сегмента шара (1) из
ют большие частицы (агрегаты), средний диаметр
данных атомно-силовой микроскопии получаем
которых 281±55 нм, а средняя высота 13±3 нм, при
радиус основания r и высоту h, а затем вычисляем
этом видны и более мелкие частицы (рис. 1).
радиус R сферической частицы в дисперсии по со-
Эти параметры адсорбированных частиц могут
отношению (2).
соответствовать диаметру ~90 нм частиц в дис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1128
ПОПОВА и др.
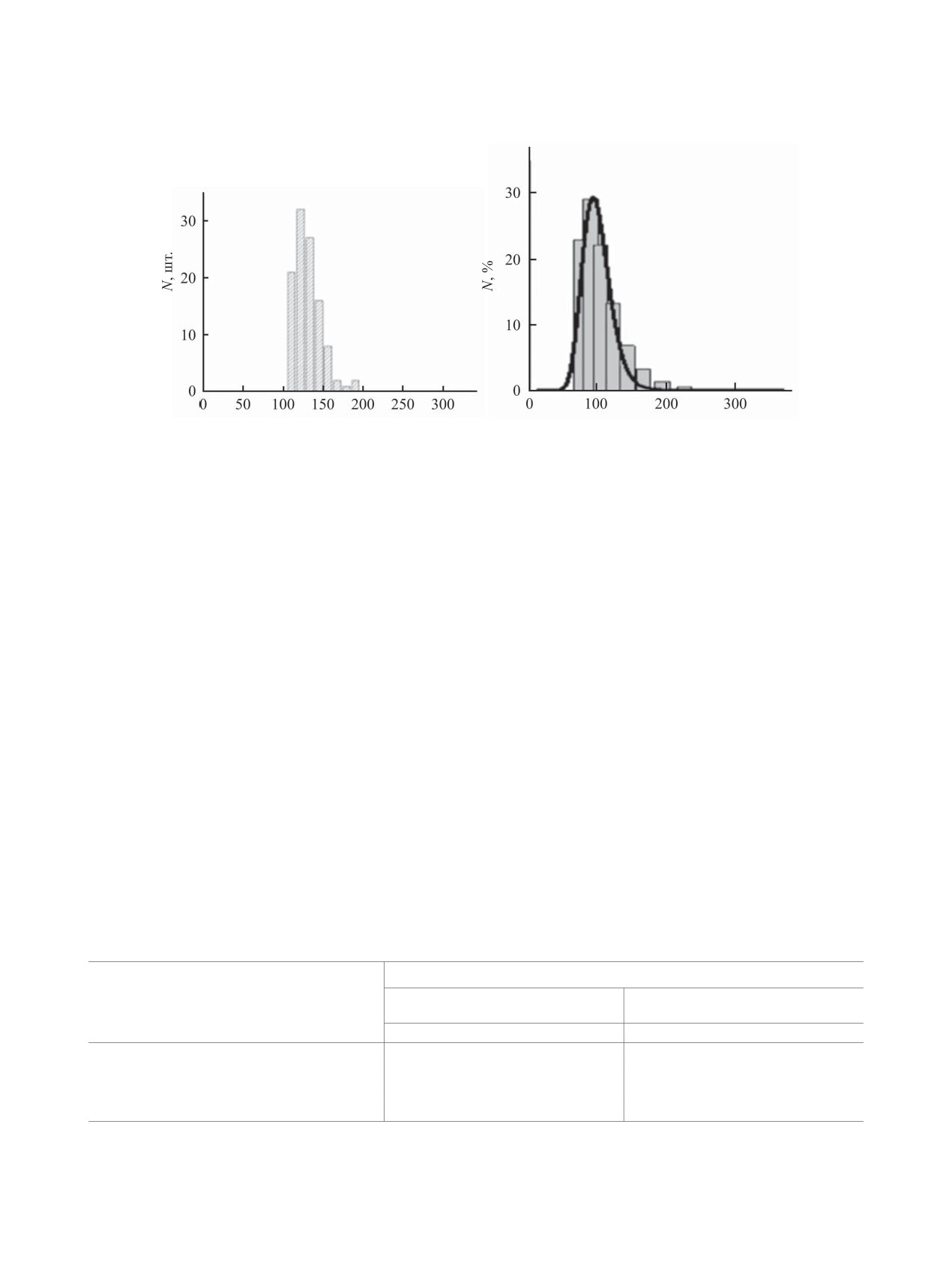
ɚ
ɛ
d ɧɦ
d ɧɦ
Рис. 2. Распределение частиц по диаметрам по данным атомно-силовой микроскопии (а) и распределение наночастиц в дис-
персии по гидродинамическим диаметрам (б) из данных динамического рассеяния света для образца хитозана № 1, табл. 3.
персии. Необходимо учесть, что метод атомно-
ванной воде с добавлением Твин-80, присутствуют
силовой микроскопии дает информацию о высу-
частицы округлой формы с узким распределением
шенных на воздухе частицах, а метод динамиче-
по размеру (рис. 2). Средний диаметр частиц со-
ского рассеяния света - о набухших частицах в
ставляет 130±17 нм, средняя высота - 6±2 нм. Ди-
воде. Поскольку гидродинамический радиус вы-
аметр частицы, рассчитанный через объем сегмен-
числяется по формуле Стокса из данных о коэф-
та шара, равен 42 нм. Из данных динамического
фициентах поступательной диффузии, наличие
рассеяния света диаметр частиц составляет 94 нм.
гидратной «шубы» приводит к увеличению ка-
Для данного образца оба метода демонстрируют
жущегося гидродинамического радиуса. Размеры
узкое мономодальное распределение по размеру
частиц (диаметр), полученные методом атомно-си-
частиц, а изображение атомно-силовой микро-
ловой микроскопии (диаметр в плоскости 281±
скопии подтверждает сферическою форму частиц
55 нм, расчет через объем сегмента шара 90 нм)
и отсутствие их слипания. Таким образом, метод
и динамического рассеяния света (420±28 нм,
ионного гелеобразования в подобранных условиях
120±10 нм), можно считать приблизительно соот-
дает возможность получать стабильные дисперсии
ветствующими друг другу с учетом особенностей
сферических частиц хитозана диаметром около
метода измерения и расчета.
100 нм.
На изображении атомно-силовой микроскопии
Оценку бактерицидной и фунгицидной актив-
образца (табл. 3, образец 1), который сразу после
ности полученных дисперсий наночастиц в отно-
получения был ресуспендирован в деионизиро-
шении фитопатогенных видов проводили в срав-
Таблица 4. Антагонистическая активность образцов (с = 140 мкг/мл по хитозану) в отношении тест-культур
фитопатогенных бактерий Clavibacter michiganensis (штамм 101) и гриба Fusarium graminearum
Диаметр зоны лизиса, мм
Образец
C. michiganensis
F. graminearum
3 сут
6 сут
Контроль (вода)
0
0
Ацетатный буфер
18.0±0.2
13.5±0.2
Хитозан в ацетатном буфере, рН = 5
22.5±0.2
18.0±0.1
Дисперсия наночастиц (табл. 2, оп. № 2)
29.5±0.1
20.0±0.1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
НАНОЧАСТИЦЫ ХИТОЗАН-ТРИПОЛИФОСФАТ
1129
Таблица 5. Фунгистатическая активность раствора хитозана в ацетатном буфере (рН = 5) и дисперсии наночастиц
по отношению к грибу Alternaria solani
Диаметр зоны угнетения
роста мицелия гриба
Ингибирование роста гриба
Образец
с, мкг/мл
A. solani в процессе
A. solani, %
культивирования, мм
3 сут
5 сут
3 сут
5 сут
Хитозан в ацетатном буфере
300
11.0±0.1
0
0
0
450
13.5±0.15
0
0
0
Дисперсия наночастиц (табл. 3, оп. № 1)
300
13.0±0.1
0
10.0
23.0
450
17.0±0.2
12.0±0.1
65.0
70.0
нении с раствором хитозана в ацетатном буфере
Таким образом, методам ионного гелеобразо-
методом бумажных фильтров (табл. 4) и метода-
вания из образцов хитозана различной молеку-
ми лунок и агаровых блоков (табл. 5). Сравнение
лярной массы получены стабильные дисперсии
диаметров лизиса тест-культур C. michiganensis и
наночастиц. С помощью атомно-силовой микро-
гриба F. graminearum показало, что дисперсия на-
скопии и методом динамического рассеяния света
ночастиц обладает большей антибактериальной и
визуализированы наночастицы с диаметром около
фунгицидной активностью, чем исходный хитозан
100 нм. Первичные испытания антагонистической
(табл. 4).
активности образцов в отношении тест-культур
Оценка прямого антагонистического действия
фитопатогенных бактерий и грибов (штаммов C.
раствора хитозана и дисперсии наночастиц на рост
michiganensis, F, graminearum и A. solani) показа-
мицелия гриба A. solani методами диффузии в агар
ли, что, независимо от молекулярной массы хито-
и агаровых блоков подтвердила более сильную ак-
зана, более высокую активность имеют дисперсии
тивность дисперсии наночастиц по сравнению с
с наночастицами хитозана по сравнению с раство-
раствором хитозана, а также выявила зависимость
ром того же полимера.
фунгистатической активности исследуемых сое-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
динений от их концентрации (табл. 5).
В работе использовали хитозан (Биопрогресс)
Если хитозан и дисперсия наночастиц в кон-
с М 150×103 Да и степенью деацетилирования
центрации 300 мкг/мл обладают слабой фунгиста-
85%. Окислительной деструкцией при действии
тической активностью, то увеличение концентра-
нитрита натрия [22] получены образцы хитозана
ции наночастиц до 450 мкг/мл ведет к повышению
с молекулярной массой 6.5×103 и 60×103 Да, опре-
активности. В отличие от исходного хитозана,
деляемой вискозиметрическим методом [31]. Три-
дисперсия наночастиц в концентрации 450 мкг/мл
полифосфат и нитрит натрия (Вектон) использова-
ингибирует рост мицелия гриба A. solani в тече-
ли без дополнительной очистки.
ние 5 сут культивирования, причем уже на тре-
тьи сутки диаметр зоны угнетения роста гриба
Ионное гелеобразование проводили с исполь-
под действием дисперсии наночастиц составляет
зованием образцов хитозана с разными молекуляр-
17.0 мм, что существенно превышает зону лизи-
ными массами. Хитозан (30 мг) растворяли в 15 мл
са исходного хитозана (13.5 мм). Преимущество
0.2 М. ацетатного буфера (рН = 4.5 или 5) в тече-
в фунгистатической активности дисперсии на-
ние 3 ч при постоянном перемешивании. Для про-
ночастиц и ее зависимость от концентрации под-
ведения синтеза в водной среде хитозан в течение
тверждены методом агаровых блоков. Полученные
3 ч при постоянном перемешивании растворяли в
данные биологических испытаний согласуются с
приготовленном растворе, рН = 5 (2%-ная уксус-
исследованиями [28-30], в которых для несколь-
ная кислота с добавлением раствора KОН). Полу-
ких видов фитопатогенных бактерий и грибов
ченный раствор фильтровали через фильтр Шотта
продемонстрирована более высокая антибактери-
(размер пор - 40 мкм). К фильтрату добавляли при
альная и фунгистатическая активность дисперсий
постоянном перемешивании в течение 5 мин по
наночастиц по сравнению с хитозаном.
каплям раствор триполифосфата, приготовленный
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1130
ПОПОВА и др.
в деионизированной воде или в ацетатном буфере
стиц снимали на Фурье-спектрометре Spectrum
(с = 0.84 мг/мл). Дисперсию наночастиц пере-
BX в таблетках KBr.
мешивали 30 мин, затем облучали ультразвуком
Для изучения антигрибной и антибактериаль-
60 мин. В дальнейшем дисперсию наночастиц
ной активности исследуемых образцов в отноше-
подвергали в течение 4 ч диализу против деио-
нии фитопатогенных грибов и бактерий различные
низованной воды [19], при этом объем дисперсии
концентрации хитозана готовили растворением в
нормировался и составлял 21 мл.
0.2 М. ацетатном буфере, рН = 5.0. Оценку антибак-
Дисперсию наночастиц центрифугировали 1 ч
териальной активности образцов по отношению к
при скорости 6200 об/мин. Полученный осадок
тест-культуре C. michiganensis (штамм 101) (воз-
наночастиц подвергали либо лиофильной сушке,
будитель бактериального рака томата) и антигриб-
либо сразу суспендировали в деионизированной
ной активности по отношению к F. graminearum
воде с добавкой Твин-80 (15 мас%) и затем 30 мин
(возбудитель фузариоза колоса и корневой гнили
обрабатывали ультразвуком. Концентрацию нано-
зерновых культур) проводили методом бумажных
частиц в полученной дисперсии определяли весо-
дисков [32]. Оценивали диаметр (мм) зоны лизиса
вым методом. Для лиофильно высушенного осадка
тест-культур на агаризованной питательной среде.
процедура суспендирования в деионизированной
Тест-культуры фитопатогенных микроорганиз-
воде с добавкой Твин-80 (15 мас%) и обработки
мов выращивали 5 сут в пробирках на скошенной
ультразвуком в течение 30 мин оказалась успеш-
питательной среде C. michiganensis (штамм 101)
ной только при использовании образца хитозана с
и Чапека (F. graminearum и A.solani) в термоста-
М 6.5×103 Да.
те при 22-25°С. Для тестирования суспензии
Исследование образцов хитозана с разными
фитопатогенных культур готовили, смывая сте-
молекулярными массами и дисперсий частиц, по-
рильной водой с поверхности скошенного агара.
лученных методом гелеобразования, проведены
Поверхность агаризованной среды Чапека в чаш-
в Ресурсном центре Санкт-Петербургского госу-
ках Петри сплошным газоном засевали суспен-
дарственного университета «Центр диагностики
зиями тест-культур патогенов. Титры жизнеспо-
функциональных материалов для медицины, фар-
собных клеток посевного материала составляли
макологии и наноэлектроники». На спектрометре
105 КОЕ/мл для C. michiganensis (штамм
101)
Photocor Complex (298.00±0.05 K, длина волны
по стандарту мутности и 103 КОЕ/мл для F.
источника света λо = 445 нм) получены гидроди-
graminearum и A. solani (подсчет в камере Горяева).
намические радиусы наночастиц (погрешность
Затем на поверхность засеянной среды помеща-
метода динамического рассеяния света 10%). Дзе-
ли стерильные бумажные фильтры диаметром
та-потенциал и диаметры частиц получены на ана-
10 мм, на которые пипеткой наносили растворы
лизаторе размеров частиц Photocor Compact-Z и на
образцов разной концентрации, чашки с культура-
приборе Zetasizer Malvern Nano ZS ZEN 3500.
ми помещали в термостат при 22-25°С. Через 2-
Анализ методом атомно-силовой микроскопии
3 сут для бактерий и 4-5 сут для грибов измеряли
выполнен на микроскопе VEECO diNanoScope V в
диаметр зоны отсутствия роста тест-культур во-
полуконтактном режиме с использованием зондов
круг фильтра.
HA_NA (NT-MDT). Для приготовления образцов
использовали свежесколотую поверхность слюды.
Определение фунгистатической активности
На слюду размером 5×5 мм, наклеенную предвари-
образцов по отношению к тест-культуре фитопа-
тельно на металлическую пластину, горизонталь-
тогенного гриба A. solani (возбудитель листовых
но установленную на торцевом срезе вала элект-
пятнистостей широкого спектра сельскохозяй-
родвигателя, наносили 20 мкл исследуемой дис-
ственных культур) проводили методом диффузии в
персии, выдерживали 1 мин, после чего удаляли
агар (метод лунок) и методом агаровых блоков, ос-
раствор со слюды, включая вращение электродви-
нованных на способности угнетать рост мицелия
гателя 3000 об/мин на 1 мин. Образцы сушили на
возбудителя [33]. Поверхность питательной среды
воздухе не менее 1 сут. Полученные изображения
Чапека засевали тест-культурой гриба, как было
обрабатывали в программе NanoScope Analysis.
описано выше. При тестировании методом лунок
ИК спектры хитозана и дисперсий его наноча-
в агаре стерильным пробочным сверлом вырезали
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
НАНОЧАСТИЦЫ ХИТОЗАН-ТРИПОЛИФОСФАТ
1131
лунки диаметром 7 мм, и в них пипеткой помещали
8. Tikhonov V.E., Stepnova E.A, Babak V.G., Yamskov I.A.,
растворы наночастиц образцов хитозана с разными
Palma-Guerrero J., Jansson H-B, Lopez-Llorca L.V.,
концентрациями. Через 4-5 сут выращивания куль-
Salinas J., Gerasimenko D.V., Avdienko I.D., Varla-
mov V.P. // Carbohydr. Polym. 2006. Vol. 64. P. 66. doi
туры в термостате при 22-25°С измеряли диаметр
10.1016/j.carbpol.2005.10.021
зоны отсутствия роста тест-культуры гриба вокруг
9. Fernandes J.C., Eaton P., Gomes A.M., Pintado M.E.,
лунки.
Malcata F.X. // Ultramicroscopy. 2009. Vol. 109. P. 854.
При тестировании методом блоков в теплую
doi 10.1016/j.ultramic.2009.03.015
агаризованную среду Чапека вносили растворы
10. Kumar A.B., Varadaraj M.C., Tharanathan R.N. //
наночастиц определенного объема, рассчитывая
Biomacromolecules. 2007. Vol. 2. P. 566. doi 10.1021/
конечную концентрацию в среде в зависимости от
bm060753z
исходной концентрации наночастиц. После засты-
11. Попова Э.В. Домнина Н.С., Коваленко Н.М., Бори-
вания среды на ее поверхности устанавливали ага-
сова Е.А., Колесников Л.Е., Тютерев С.Л. // Вестн.
ровые блоки 5-суточной тест-культуры A. solani,
защиты растений. 2017. Т. 93. С. 28.
вырезанные стерильным пробочным сверлом, и
12. Куликов С.Н., Оберемок Д.Р., Безродных Е.А., Ти-
помещали чашки Петри в термостат при 22-25°С.
хонов В.Е., Варламов В.П. // Уч. зап. Казанск. унив.
Фунгистатическую активность оценивали по диа-
2013. Т. 155. Вып. 3. С. 27
метру подавления роста тест-культуры через 3 и
13. Kashyapa P.L., Xiang X., Heiden P. // Int. J. Biol.
5 сут выращивания.
Macromol. 2014. Vol. 77. P. 36. doi 10.1016/j.
Работа выполнена при технической поддерж-
ijbiomac.2015.02.039
ке научного парка Санкт-Петербургского госу-
14. Jampilek J., Kralova K. // Ecol. Chem. Eng. S. 2015.
дарственного университета, Ресурсного образо-
Vol. 22. P.321. doi 10.1515/eces-2015-0018
вательного центра по направлению «Химия» и
15. Nair R., Varghese S.H., Nair B.G., Maekawa T., Yoshi-
Центра диагностики функциональных материалов
da Y., Kumar D.S. // Plant Sci. 2010. Vol. 179. P. 154.
для медицины, фармакологии и наноэлектроники.
doi 10.1016/j.plantsci.2010.04.012
16. Agnihotri S.A., Mallikarjuna N.N, Aminabhavi T.M. //
КОНФЛИКТ ИНТЕРЕСОВ
J. Control. Release. 2004. Vol. 100. P. 5. doi 10.1016/j.
Авторы заявляют об отсутствии конфликта
jconrel.2004.08.010
интересов.
17. Khot L.R., Sankaran S, Maja J. // Crop Protection (C).
2012. Vol. 35. P. 64. doi 10.1016/i.cropro.2012.01.007
СПИСОК ЛИТЕРАТУРЫ
18. Rampino A., Borgogna M.. Blasi P., Bellich B., Cesaro A. //
1. Saharan V., Pal A. Chitosan based nanomaterials in
Int. J. Pharm. 2013. Vol. 455. P. 219. doi 10.1016/j.
plant growth and protection. Springer: Briefs in Plant
ijpharm.2013.07.034
Science. 2016. 55 р.
19. Fabragas A., Minarro M., Garcia-Montoya E., Perez-
2. Хитин и хитозан: получение, свойства и приме-
Lozano P., Carrillo C., Sarrate R., Sanchez N., Tico J.R,,
нение / Под ред. К.Г. Скрябина, Г.А. Вихоревой,
Sune-Negre J.M. // Int. J. Pharm.. 2013. Vol. 446. P. 199.
В.П. Варламова. М.: Наука. 2002. 368 с.
doi 10.1016/j.ijpharm.2013.02.015
3. Younes I., Rinaudo M. // Marine Drugs 2015. Vol. 13.
20. Mazancová P., Némethová V., Treľová D,. Kleščíková L.,
P. 1133. doi 10.3390/md13031133
Lacík I., Rázg F. // Carbohydr. Polym. 2018. Vol. 192.
4. Hadrami E., Lorne R. // Marine Drugs. 2010. Vol. 10.
P.104. doi 10.1016/j.carbpol.2018.03.030
P. 968. doi 10.3390/md8040968
21. Sawtariea N., Cai Y., Lapitsky Y. // Colloids and Surfaces:
5. Тютерев С.Л. Природные и синтетические индукто-
Biointerfaces. 2017. Vol. 157. P. 110. doi 10.1016/j.
ры устойчивости растений к болезням. СПб: ВИЗР,
colsurfb.2017.05.055
2014. 212 с.
22. Власов П.С., Киселев А.А., Домнина Н.С., Попова Э.В.,
6. El H.A., Adam L.R., Dayf F. // Marine Drugs. 2010.
Тютерев С.Л. // ЖПХ. 2009. Вып. 9. C. 1571; Vla-
Vol. 8. P. 968. doi 10.3390/md8040968
sov P.S., Kiselev A.A., Domnina N.S., Popova E.V.,
7. Wang J., Wang L., Yu H., Zain-Ul-Abdin, Chen Y.,
Tyuterev S.L. // Russ. J. Appl. Chem. 2009. Vol. 82.
P. 1675 doi 10.1134/S1070427209090298
Chen Q., Zhou W., Zhang H., Chen X. // Int. J. Biol.
Macromol. 2016. Vol. 88. P. 333. doi 10.1016/j.
23. Vauthier C., Cabane B., Labarre D. // Pharm. Biopharm.
ijbiomac.2016.04.002
2008. Vol. 69. P. 466. doi 10.1016/j.ejpb.2008.01.025
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020
1132
ПОПОВА и др.
24. Agarwal M., Agarwal M.K., Shrivastav N., Pandey S.,
29. Abdeltwab W.M., AbdelaliemY.F., MetryW.A., Eldeghe-
Das R., Gaur P. // Int. J. Life Sci. Sci. Res. 2018. Vol. 4.
dy M. // J. Adv. Lab. Res. Biol. 2019. Vol. 10. P. 8.
P. 1713. doi 10.21276/ijlssr.2018.4.2.17
30. Oh J.-W., Chun S.C., Chandrasekaran M. // Agronomy.
25. Hussain Z., Sahudin S. // Int. J. Pharm. Pharm. Sci.
2019. Vol. 9. P. 1. doi 10.3390/agronomy9010021
2016. Vol. 8. P. 297.
31. Погореленко А.Б., Домнина Н.С., Попова Э.В., Тюте-
26. Antoniou J., Liu F., Majeed H., Qi J., Yokoyama W.,
рев С.Л. // Вестн. СПбГУ. Сер. 4. 2003. Т. 20. С. 97.
Zhong F. // Colloids and Surfaces (A). 2015. Vol. 465.
32. Билай В.И. Методы экспериментальной микологии.
P. 137. doi: 10.1016/j.colsurfa.2014.10.040
Киев: Наукова думка, 1982. 275 c.
27. Hejjajia E.M.A., Smith A.M., Morris G.A. // Int. J.
Biol. Macromol. 2017. Vol. 95. P. 564. doi 10.1016/j.
33. Методические рекомендации по испытанию хими-
ijbiomac.2016.11.092
ческих веществ на фунгицидную активность /
28. Ing L.Y., Zin N.M., A., Katas H. // Int. J. Biomaterials.
Под ред. Е.И. Андреевой, В.С. Картомышева.
2012. Article ID 632698. doi 10.1155/2012/632698
НИИТЭХИМ. 1990. 52 с.
Chitosan-Tripolyphosphate Nanoparticles: Synthesis
by Ion Gelation Method, Properties, and Biological Activity
E. V. Popovaa,*, I. M. Zorinb, N. S. Domninab, I. I. Novikovaa, and I. L. Krasnobaevaa
a All-Russian Research Institute for Plant Protection, Pushkin, 196608 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: elzavpopova@mail.ru
Received February 3, 2020; revised February 3, 2020; accepted February 6, 2020
Nanoparticles with an average size of about 100 nm were obtained by ion gelation of chitosan (M 6.5×103 and
60×103 Da) in the presence of tripolyphosphate. Dispersion of nanoparticles showed high antimicrobial activity
against pathogenic organisms such as C. michiganensis bacteria (strain 101), F. graminearum and A. solani fungi.
Keywords: chitosan, ion gelation, nanoparticles, antimicrobial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 7 2020