ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1153-1172
ОБЗОРНАЯ
СТАТЬЯ
К 80-летию со дня рождения В.М. Берестовицкой
УДК 547.732
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
НА ОСНОВЕ СУЛЬФОЛЕНОВ
© 2020 г. И. Е. Ефремоваa,*, Л. В. Лапшинаb, Р. И. Байчуринa,
А. В. Серебрянниковаc, И. И. Савельевa
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
b Военно-медицинская академия имени С. М. Кирова, Санкт-Петербург, 194044 Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 5 мая 2020 г.
После доработки 5 мая 2020 г.
Принято к печати 16 мая 2020 г.
В обзоре проанализированы и обобщены методы синтеза полициклических производных сульфолана
(сульфолена). Рассмотрены реакции полиалкилирования, превращения функциональных групп суль-
фоленового кольца, а также реакции присоединения по его эндо- и экзоциклическим кратным связям.
Ключевые слова: сульфолены, дигидротиофен-1,1-диоксиды, полициклические структуры, алкилиро-
вание, бинуклеофилы
DOI: 10.31857/S0044460X20080028
1. Введение
1153
2. Полиалкилирование производных 2,5-дигидротиофен-1,1-диоксида
1154
3. Реакции с участием заместителей в сульфоленовом цикле
1157
4. Реакции присоединения
1163
5. Заключение
1169
1. ВВЕДЕНИЕ
были представлены в обзоре 1998 г. [10]. В после-
дующие десятилетия появилось значительное чис-
Сульфолены (дигидротиофен-1,1-диоксиды)
ло публикаций, посвященных данной теме; часть
и их производные активно используются в син-
из них рассмотрена в обзорной статье [1].
тезе разнообразных циклических соединений [1,
С целью систематизации используемых синте-
2], среди которых найдены биологически актив-
тических схем на основе дигидротиофен-1,1-ди-
ные вещества: ингибиторы нейраминидазы виру-
оксидов и выявления тенденций их развития нами
са гриппа [3], антипсихотические вещества [4],
проведен анализ методов получения полицикличе-
блокаторы калиевых каналов [5], фотоактивные
ских систем, включающих сульфолан или сульфо-
вещества [6], аналоги антибиотиков ряда гидриро-
лен, по литературным данным с 1972 г. Представ-
ванного антрахинона [7], а также прекурсоры при-
лялось важным оценить синтетический потенциал
родных соединений [8, 9].
сульфолена и его производных в построении по-
Впервые данные о методах получения поли-
лициклических структур, обусловленный СН-кис-
циклов, включающих сульфолан (сульфолен),
лотностью метиленовых групп дигидротиофен-
1153
1154
ЕФРЕМОВА и др.
Схема 1.
Схема 2.
1,1-диоксида (реакции полиалкилирования), при-
2,5-дигидротиофен-1,1-диоксида. Депротониро-
сутствием эндо- и экзоциклических кратных свя-
вание атома С2 на следующей стадии обусловли-
зей, а также реакционноспособных функциональ-
вает возможность формирования спироциклов. В
ных групп (реакции присоединения, замещения и
случае депротонирования атома С5 тиолендиок-
др.). В обзоре не рассматриваются реакции дие-
сидный анион может алкилироваться по атомам
нового синтеза, приводящие к утрате сульфолано-
С3 или С5, что создает возможность синтеза мо-
вого цикла [10-12], а также методы, при которых
стиковых бициклов с кольцом Δ3-сульфолена или
дигидротиофен-1,1-диоксидная система формиру-
конденсированных производных Δ2-сульфолена
ется на заключительных стадиях и не участвует в
(схема 1).
формировании полициклов [10, 13-16].
Предпочтительность указанных направлений
2. ПОЛИАЛКИЛИРОВАНИЕ ПРОИЗВОДНЫХ
определяется особенностями строения алкилиру-
2,5-ДИГИДРОТИОФЕН-1,1-ДИОКСИДА
ющего агента, а также природой и положением за-
местителей в сульфоленовом цикле [17-24].
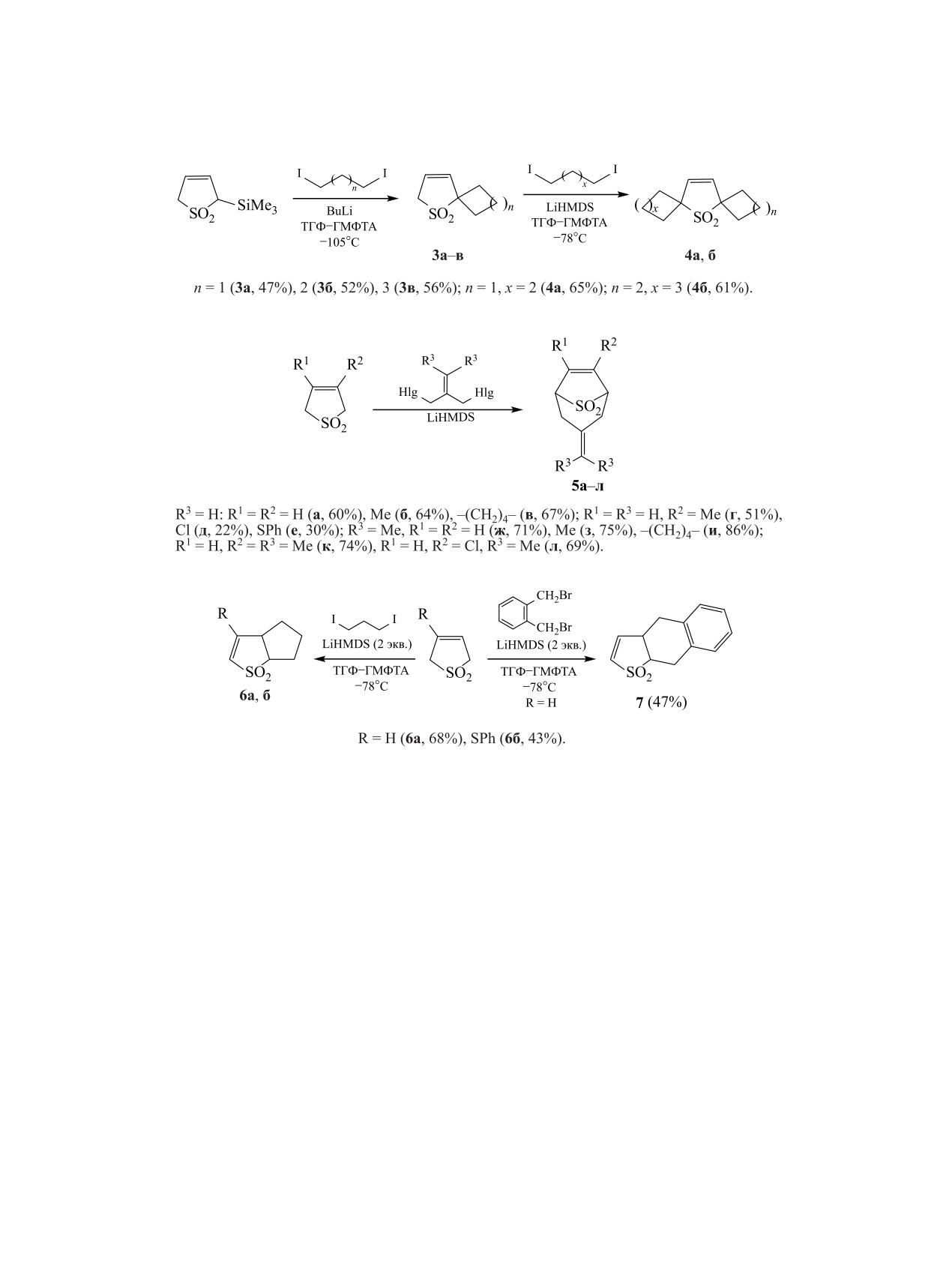
Реакции полиалкилирования производных
Селективное образование спироструктур 1a-г
2,5-дигидротиофен-1,1-диоксида, впервые пред-
наблюдается при взаимодействии производных
ложенные тайваньскими химиками, оказались
Δ3-сульфолена с 1,4-дииодбутаном и 1,5-дииод-
весьма перспективными для конструирования
пентаном [18, 19, 22] (схема 2). При действии на
полициклов, сочетающих сульфоленовое кольцо
незамещенный Δ3-сульфолен 2 экв. дииодалкана в
с карбоциклическими структурами [17-24]. В ос-
присутствии 4 экв. LiHMDS легко формируются
нову данного метода заложено чередование стадий
бис(спиропроизводные) 2a, б [18].
депротонирования метиленовых групп тиоленди-
оксидов при действии сильных оснований, на-
Присутствие триметилсилильной группы при
пример, гексаметилдисилазида лития (LiHMDS),
атоме С2 Δ3-сульфолена способствует региоселек-
и алкилирования образующихся гетероцикличе-
тивному формированию спироциклических струк-
ских анионов дигалогеналканами [17]. Сначала
тур 3a-в даже в реакции с 1,3-дииодпропаном [24]
протекает алкилирование по метиленовой группе
(схема 3). Дальнейшее алкилирование соединений
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1155
Схема 3.
Схема 4.
Схема 5.
3a-в позволяет получать несимметричные бис-
смеси конденсированных и мостиковых структур
(спиропроизводные) 4a, б.
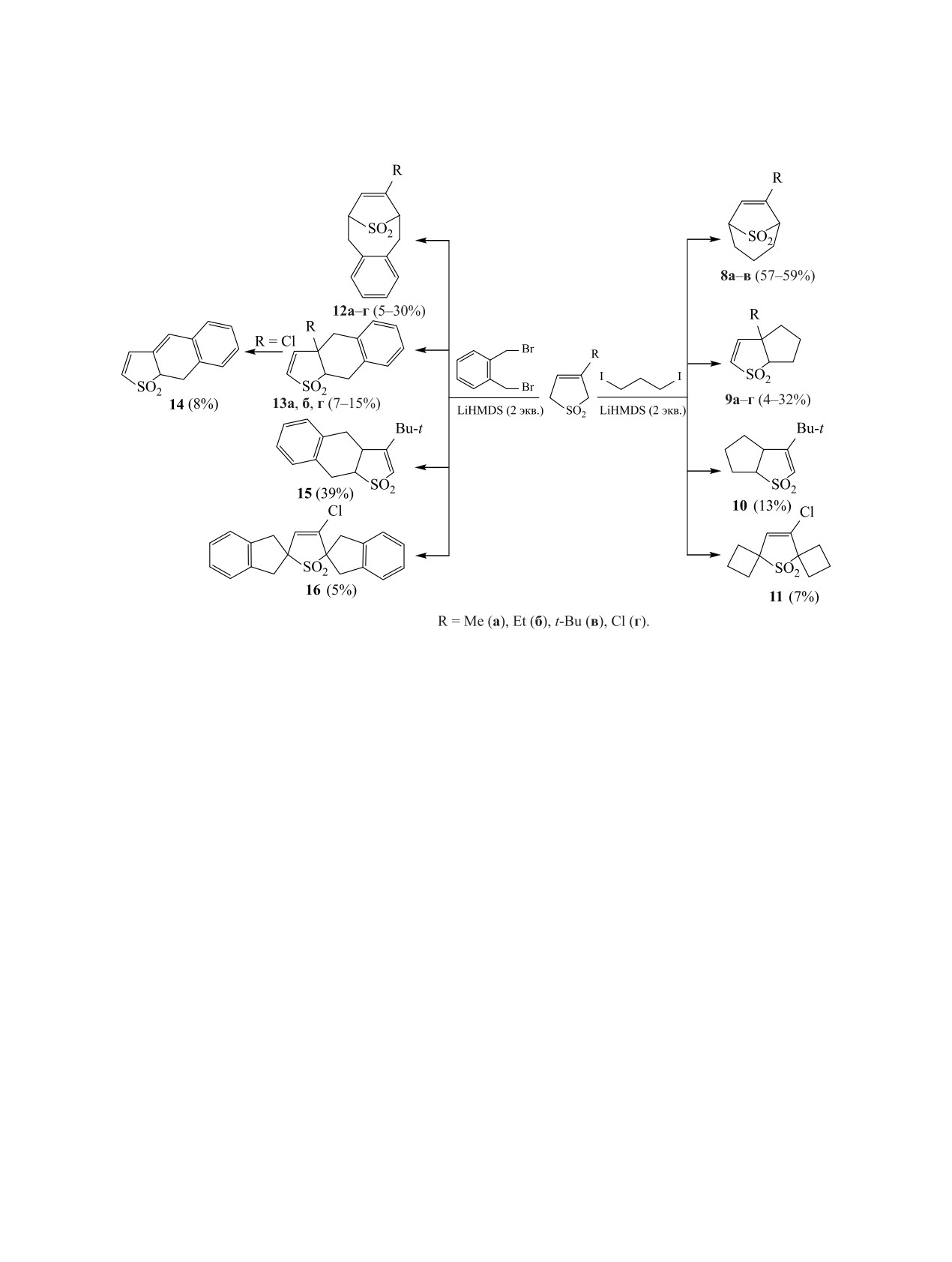
8-10 (схема 6). Конденсированные бициклические
соединения с объемным трет-бутильным заме-
Мостиковые соединения 5a-л с синтетически
значимыми выходами были получены при алки-
стителем выделяются в виде двух региоизомеров
лировании Δ3-сульфолена и его замещенных ре-
9в, 10 с преобладанием последнего, в котором пер-
агентами с жесткофиксированной структурой -
воначальное алкилирование происходит по более
3-иод-2-(иодметил)проп-1-еном и
1-бром-2-
доступному атому С5. В присутствии атома хлора
(бромметил)-3-метилбут-2-еном [18, 23] (схема 4).
у атома С3 наряду с образованием конденсиро-
ванного соединения 9г (выход 30%) формирует-
Конденсированные бициклические соедине-
ся бис(спиропроизводное) 11 (7%). Аналогичная
ния легко получаются при взаимодействии неза-
картина наблюдается и в реакции 3-замещенных
мещенного Δ3-сульфолена [20, 21] и его 3-фенил-
сульфанилпроизводного [18] с 1,3-дииодпропаном
Δ3-сульфоленов с
1,2-бис(бромметил)бензолом
и 1,2-бис(бромметил)бензолом (схема 5).
[21] (схема 6).
Алкильный заместитель у атома С3, как пра-
Важный вклад в развитие метода полиал-
вило, снижает селективность алкилирования [21].
килирования сульфоленов внесли J.E. Wulff и
При действии 1,3-дииодпропана на 3-алкил(метил,
M.G. Brant с сотр., которые для стереоселективного
этил, трет-бутил)-2,5-дигидротиофен-1,1-диок-
конструирования циклоалканосульфоланов пред-
сиды в присутствии 2 экв. LiHMDS образуются
ложили использовать бис(винил)кетоны [1, 3, 25,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1156
ЕФРЕМОВА и др.
Схема 6.
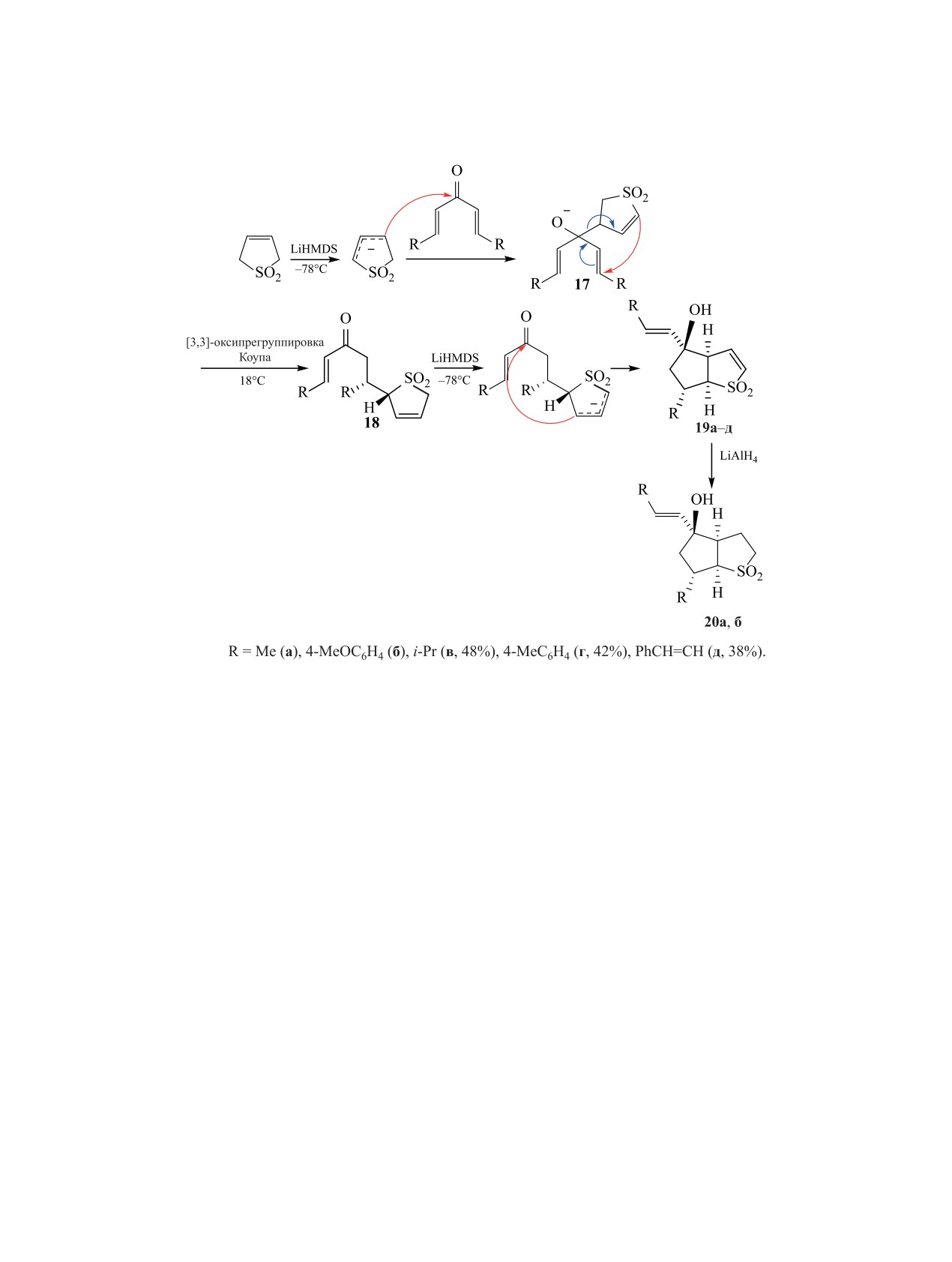
26]. Начальная стадия этой синтетической схемы -
замещенных сульфоленов возможно образование
селективное присоединение дигидротиофенди-
региоизомеров 21в, вꞌ. Присутствие в молекуле
оксид-аниона по карбонильной группе исходного
сульфолена электроноакцепторного заместителя
бис(винил)кетона с образованием алкоголят-ио-
(R1 = CO2Me, CN, R2 = H) способствует селектив-
на 17, который претерпевает анионную оксипе-
ному образованию спиросоединений 23д, ж в ус-
регруппировку Коупа [25]. Последующая стадия
ловиях однореакторного процесса.
депротонирования соединения 18 также приводит
В качестве варианта конденсированной струк-
к избирательному алкилированию по атому С3
туры 21 при использовании циклических кетонов
с образованием бициклического соединения 19
получены оригинальные трициклические соедине-
(схема 7). Соединения 19 могут быть селективно
ния 24а, б (схема 9) [26]. Применение бис(винил)-
восстановлены (LiAlH4, ТГФ) по эндоцикличе-
кетонов для алкилирования сульфоленов позволи-
ской кратной связи до структур 20а (R = Me, 50%),
ло канадским ученым синтезировать обширный
20б (R = 4-MeOC6H4, 26%) [3, 25].
ряд их производных и осуществить целенаправ-
Варьирование заместителей в молекулах исход-
ленный поиск практически значимых соединений.
ных сульфоленов в реакциях с дианизальацетоном
Они установили, что амино- и гуанидинзамещен-
позволило синтезировать конденсированные (21),
ные соединения 25a, б (схема 9) проявляют наи-
мостиковые (22) и спиросочлененные (23) поли-
большую активность как ингибиторы нейрамини-
циклы с сульфоленовым фрагментом [26] (схема
дазы вируса гриппа [3].
8), структурно подобных продуктам полиалки-
Исследования тайваньской и канадской науч-
лирования терминальными дигалогенидами [17,
ных школ демонстрируют общие закономерности
21]. В большинстве случаев преобладают конден-
полиалкилирования сульфоленов независимо от
сированные структуры 21, а в реакциях 3-моно-
природы алкилирующего агента.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1157
Схема 7.
3. РЕАКЦИИ С УЧАСТИЕМ ЗАМЕСТИТЕЛЕЙ
ализован на основе 3-гидрокси-5-пентил-2,3-диги-
В СУЛЬФОЛЕНОВОМ ЦИКЛЕ
дротиофен-1,1-диоксида [29] (схема 11).
Для формирования конденсированных бици-
Методы формирования циклических систем за
клических соединений активно используются
счет синтетических возможностей функциональ-
3-бром-2,3-дигидротиофен-1,1-диоксиды в ка-
ных групп в большинстве случаев основаны на
честве субстратов нуклеофильного замещения и
взаимодействиях производных сульфоленов c ну-
присоединения [30-36]. При взаимодействии этих
клеофильными реагентами, которые дополняются
сульфоленов с N,S-бинуклеофилами украинскими
элиминированием или окислением.
химиками под руководством Т.Э. Безменовой по-
При действии пуриновых тиолов на 3,4-ди-
лучены конденсированные структуры 28-30 с тиа-
бромсульфолан, полученный из незамещенного
золидиновым циклом [30, 31] (схема 12). Исполь-
зование в качестве субстратов замещенных Δ2- и
Δ3-сульфолена, образуются тетрагидротиеноти-
Δ3-сульфоленов позволило получить аннелиро-
азинопуриндиоксиды 26a, б с выходами до 80%
ванные бициклические структуры с фрагментами
[27] (схема 10).
дитиолиминов 31 [37, 38] и имидазолидинтионов
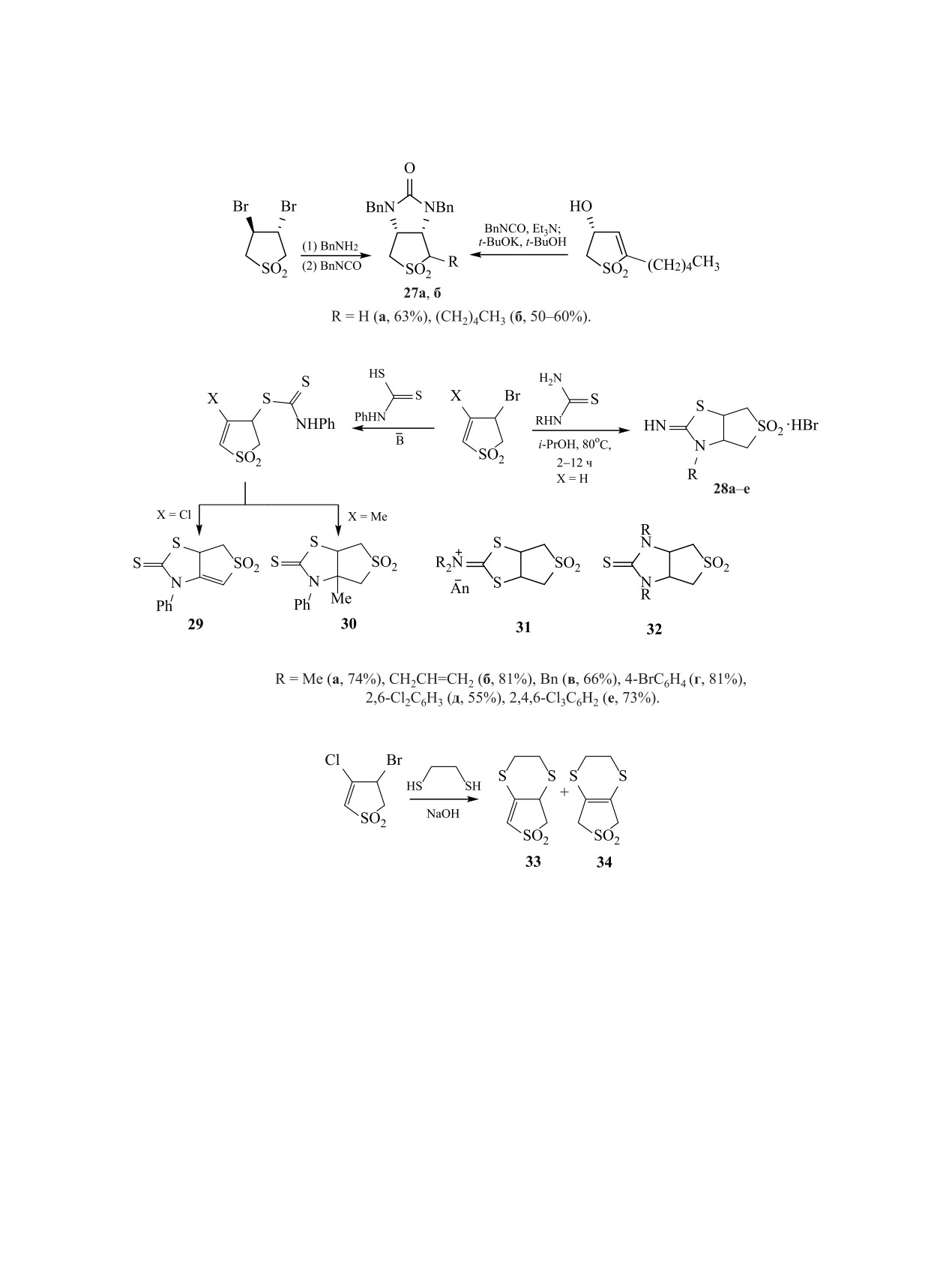
3,4-Дибромсульфолан был использован для
32 [39].
получения бициклического скелета биотина 27a,
Смесь изомерных тетрагидротиено[3,4-b][1,4]-
б при последовательном взаимодействии с бен-
дитиин-6,6-диоксидов 33, 34 с общим выходом
зиламином и бензилизоцианатом [28]. Однореак-
50% была получена в две стадии нуклеофильно-
торный синтез биотинового ядра, включающий
го замещения из 3-бром-4-хлор-2,3-дигидротио-
реакцию аза-Михаэля, фрагментацию и еще одну
фен-1,1-диоксида при действии натриевой соли
стадию конденсации аза-Михаэля, был позднее ре-
этан-1,2-дитиола [32] (схема 13).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1158
ЕФРЕМОВА и др.
Схема 8.
Схема 9.
Схема 10.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1159
Схема 11.
Схема 12.
Схема 13.
Взаимодействие 3-бром-4-хлор-2,3-дигидроти-
тиазолиндиоксиды 39a, б при взаимодействии
офен-1,1-диоксида с функционализированными
3-метил-4-нитро-2-[нитро(арил)метилен]-2,5-ди-
альдегидами было использовано для конструиро-
гидротиофен-1,1-диоксидов 38 с тиомочевиной
вания бициклических структур с конденсирован-
(схема 15) [2].
ными пятичленными гетероароматическими коль-
Японские исследователи предложили простой
цами 35-37 [33-36]. Стадия гетероциклизации в
способ синтеза 4Н,6Н-тиено[3,4-c]фуран-5,5-ди-
результате нуклеофильного замещения происхо-
оксида 40 с выходом 72% окислением 3,4-бис-
дила после снятия защиты с нуклеофильных груп-
(гидроксиметил)-2,5-дигидротиофен-1,1-диок-
пировок, а дегидратация завершала формирование
сида хлорхроматом пиридиния (РСС) [11, 40,
бициклических систем 35-37 (схема 14).
41]. Близкий по структуре субстрат - 3,4-бис-
Сочетание реакций замещения-присоедине-
(бромметил)-2,5-дигидротиофен-1,1-диоксид
-
ния (SN-AdN) позволило синтезировать тиено-
был использован в реакциях SN с аминами [42] и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1160
ЕФРЕМОВА и др.
Схема 14.
Схема 15.
Схема 16.
сульфидом натрия [43] для получения аннелиро-
44], в частности, порфириновых и фуллереновых
ванных бициклических соединений 41a, б и 42
структур [45-47].
(схема 16).
Некоторые авторы предлагают в качестве син-
Cоединения 41 легко окисляются до дигидро-
тона полициклических систем использовать эпок-
тиенопирролдиоксидов 43, которые используют-
сид
2,5-дигидротиофен-1,1-диоксида, который
ся как строительные блоки при конструировании
легко трансформируется в гетерофункциональные
более сложных полициклических систем [11, 12,
производные [48, 49]. При взаимодействии эпок-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1161
Схема 17.
Схема 18.
Схема 19.
сида с аммиаком был получен аминоспирт 44, спо-
щенного морфолин-2-она в структуре соединения
собный вступать в реакции циклизации с электро-
46 [48] (схема 17).
филами. Действие бис(трихлорметил)карбоната
Превращение эпоксида
2,5-дигидротиофен-
на цис-изомер аминоспирта 44 привело к форми-
1,1-диоксида в N-бензиламинокетон 47 открыло
рованию оксазолидинового цикла в соединении
45, а в реакции с диметиловым эфиром ацетилен-
легкий путь замыкания оксазольного цикла с об-
дикарбоновой кислоты замыкалось кольцо заме-
разованием соединения 48 [49].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1162
ЕФРЕМОВА и др.
Схема 20.
Схема 21.
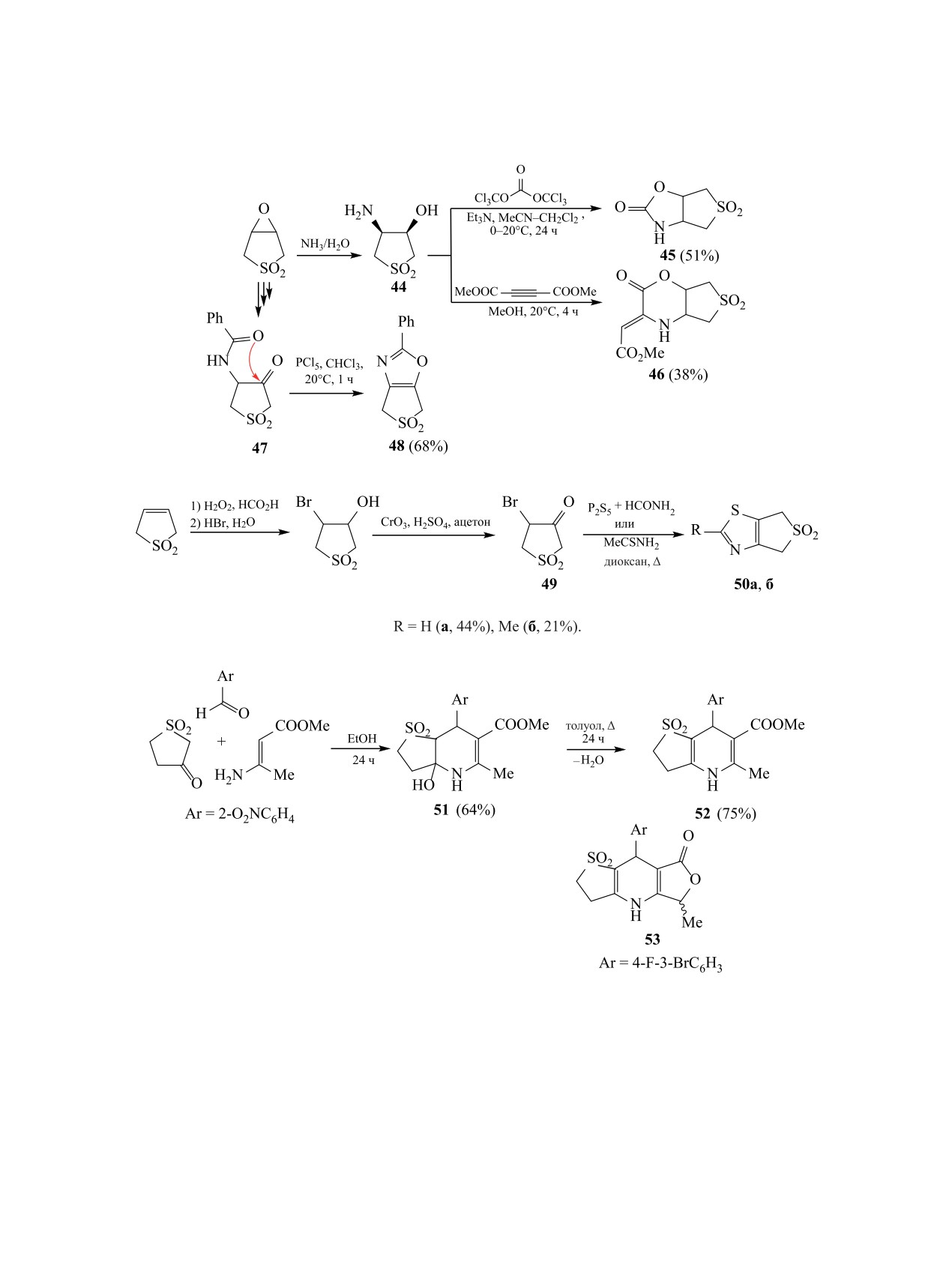
Синтетические возможности карбонильной
Реакции
3-ацил-4-хлор-(4-фенилсульфа-
группы в сульфолановом цикле были использо-
нил)-2,5-дигидротиофен-1,1-диоксидов с бинукле-
ваны в ряде реакций [50-52]. Например, при дей-
офилами были использованы для синтеза ряда би-
циклических структур 54-56 с аннелированными
ствии тиоацетамида или смеси сульфида фосфо-
кольцами тиофена, пиразола или изоксазола [53,
ра и формамида на 4-бром-3-оксосульфолан 49,
54] (схема 20).
получаемый из Δ3-сульфолена, синтезированы
Описана оригинальная методика получения
аннелированные производные тиазола 50a, б [50]
азиридиносульфоланов 58-60, основанная на фо-
(схема 18).
толизе
3-азидо-2,5-дигидротиофен-1,1-диоксида
Конденсацией Ганча с участием 3-оксосуль-
[55]. Стабилизация промежуточных азиринов 57а,
фолана, о-нитробензальдегида и метил-3-ами-
б путем присоединения HCN приводит к азири-
нобут-2-еноата получено гидроксизамещенное
динам 58a, б, при этом соединение 58a (R = H)
бициклическое соединение 51 [51], дегидратация
превращается в бис(азиридин) 59 (выход до 86%)
которого при кипячении в толуоле привела к об-
(схема 21). Будучи активным диенофилом, соеди-
разованию аннелированной структуры 52 с коль-
нение 57a (R = H) улавливается циклопентадие-
цом 1,4-дигидропиридина (схема 19). Аналогично
ном с образованием полициклического аддукта 60
была получена трициклическая структура 53 [52].
(выход 90-100%).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1163
Схема 22.
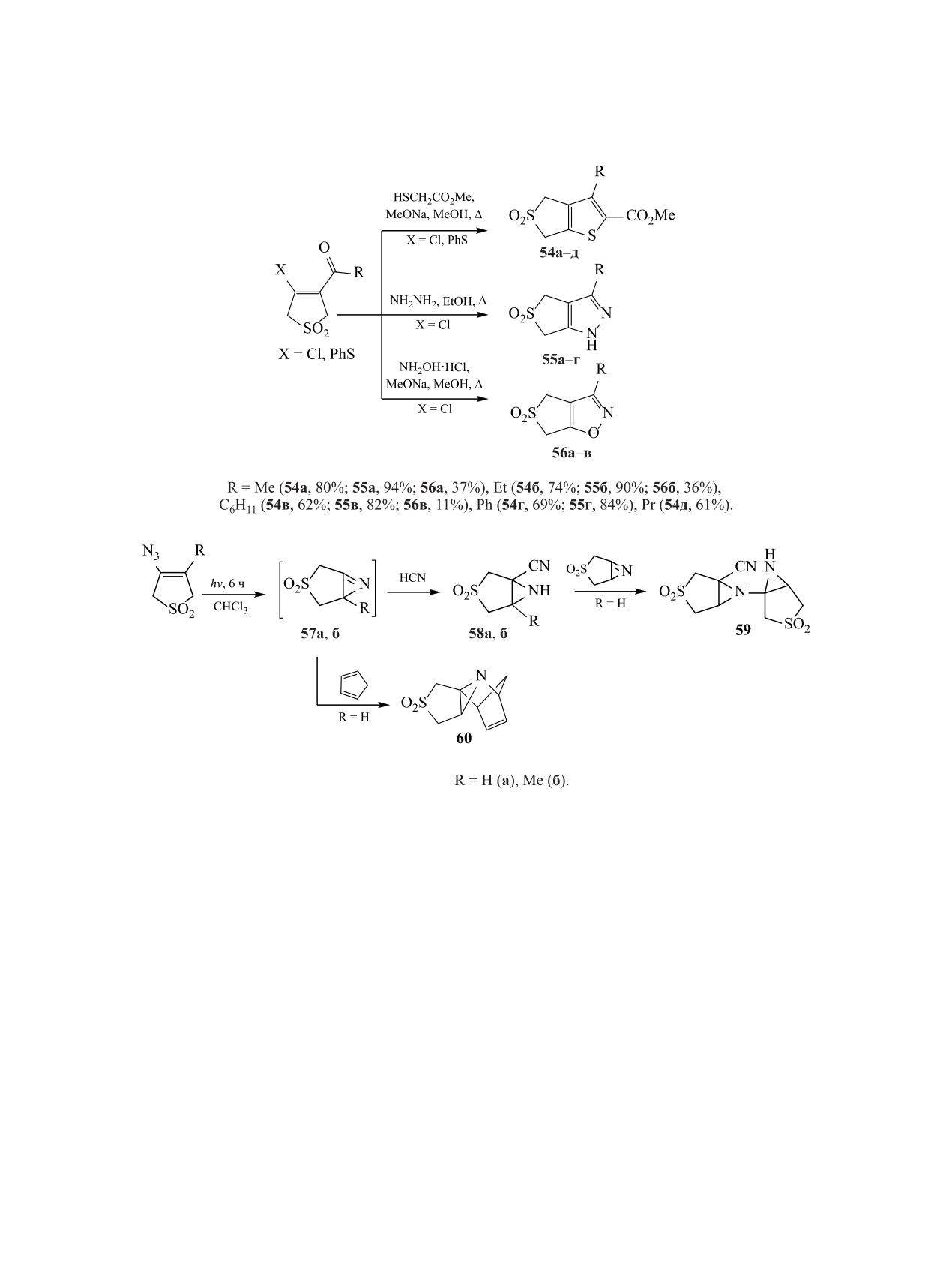
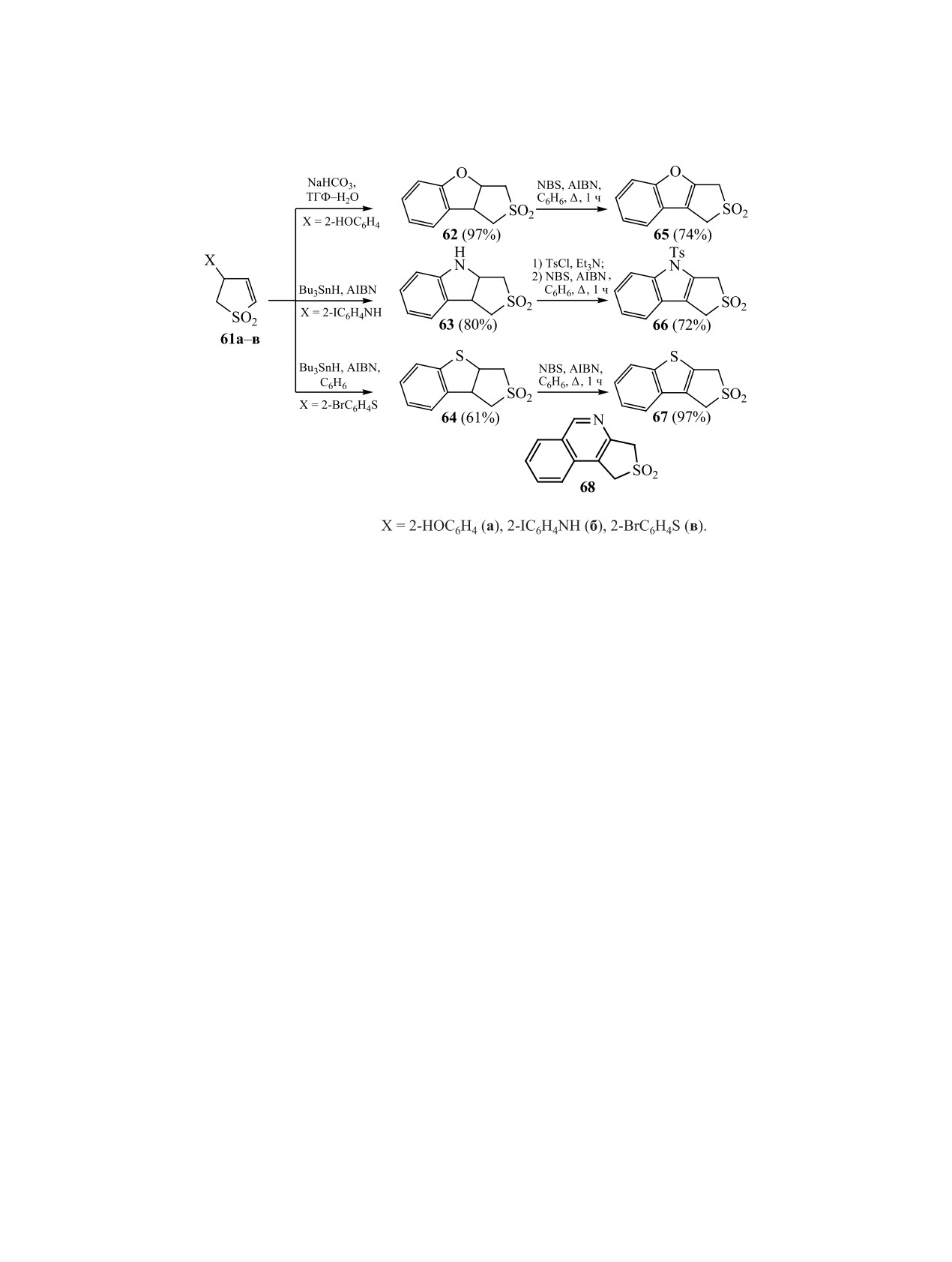
Предложена нетривиальная схема синте-
струировать разные типы гетероциклов и варьиро-
за трициклических производных сульфоленов,
вать способы их сочетания с тиолан- или тиолен-
аннелированных с бензофураном
65, индолом
диоксидом. Большинство предложенных методик
66 или бензотиофеном 67. Полученные соеди-
характеризуется высокой эффективностью и пре-
нения рассматриваются как прекурсоры гете-
паративной доступностью.
роароматических о-хинодиметанов
[56,
57]. В
4. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
качестве ключевых предшественников этих три-
циклов использовались
3-замещенные
2,3-ди-
Присоединение 1,3-диполей, диенофилов или
гидротиофен-1,1-диоксиды
61a-в, полученные
бинуклеофилов по экзо- или эндоциклическим
по разным схемам из незамещенного 2,5-диги-
кратным связям дигидротиофен-1,1-диоксида по-
дротиофен-1,1-диоксида.
Внутримолекулярная
зволяет легко формировать конденсированные с
циклизация сульфоленов 61a-в в результате ну-
сульфоланом структуры. В реакциях 1,3-диполяр-
клеофильного присоединения (X = 2-HOC6H4)
ного присоединения к сульфоленам в качестве ди-
или кросс-сочетания (X = 2-IC6H4NH, 2-BrC6H4S)
полей использовали диазометан, нитрилоксиды,
завершается образованием трициклических струк-
азометинимины, альдазины и илиды.
тур 62-64. Ароматизация последних проводится
На примере реакций с диазометаном было по-
путем радикального бромирования бромсукцини-
казано, что эффективность циклоприсоединения
мидом в присутствии AIBN [57] (схема 22). Ана-
зависит от положения кратной связи в дигидроти-
логичная схема была использована для синтеза
офен-1,1-диоксиде и наличия при ней заместите-
1,3-дигидротиено[3,4-c]изохинолин-2,2-диоксида
ля. Образование тетрагидротиенопиразолиндиок-
68 [58].
сида 69a (выход 90%) на основе незамещенного
Приведенные примеры показывают, что при
Δ3-сульфолена протекало активнее синтеза соеди-
участии реакционноспособных функциональных
нения 70 (выход 34%) из 4-метил-2,3-дигидроти-
групп сульфоланового (сульфоленового) кольца
офен-1,1-диоксида, а 3-метил-2,5-дигидротиофен-
возможно формирование разнообразных полиге-
1,1-диоксид с диазометаном вообще не реагиро-
тероциклических систем. Методы синтеза таких
вал [59] (схема 23). Тетрагидротиенопиразолин-
структур включают широкий набор общих син-
диоксиды 69б, в получены при действии диа-
тетических подходов, а также ряд специфических
зометана на алкилзамещенные 2,5-дигидротио-
решений, позволяющих целенаправленно кон-
фен-1,1-диоксиды [60].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1164
ЕФРЕМОВА и др.
Схема 23.
Схема 24.
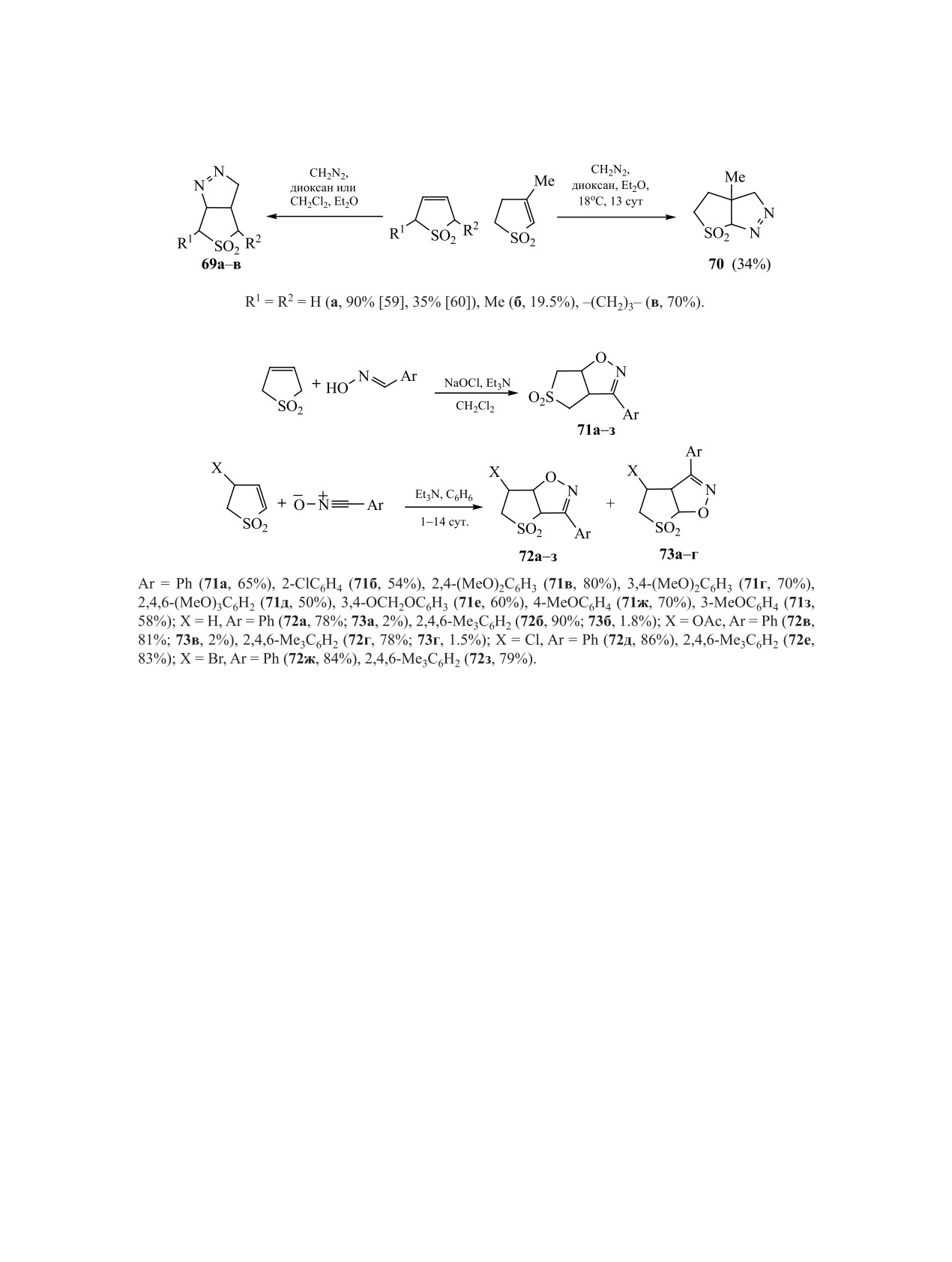
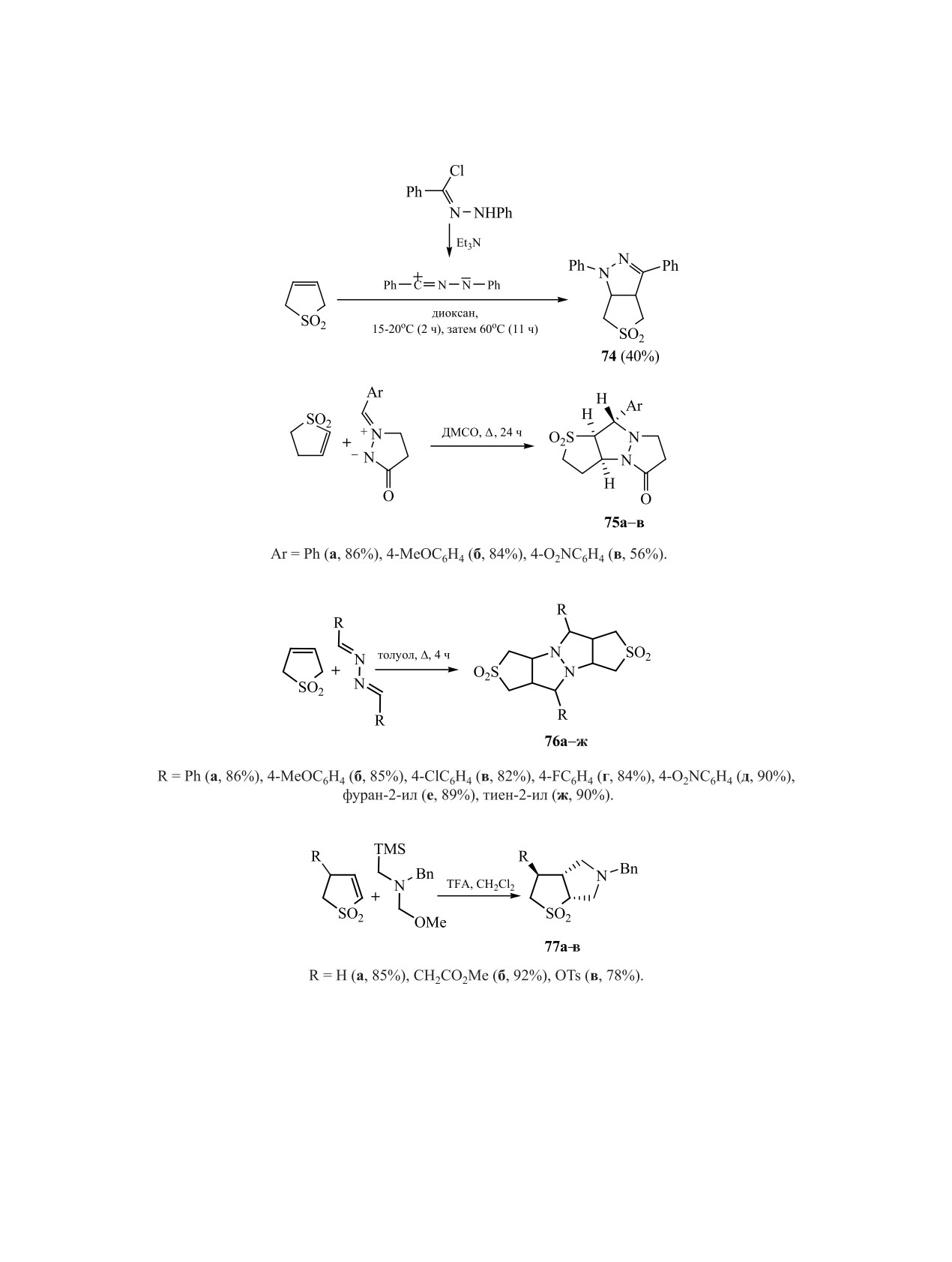
Незамещенный Δ3-сульфолен легко реагирует
для взаимодействия 2,3-дигидротиофен-1,1-диок-
с нитрилоксидами, генерируемыми из оксимов
сида с циклическим диполем, в результате которо-
ароматических альдегидов; выходы тетрагидроти-
го происходит регио- и стереоселективный синтез
трициклических соединений 75a-в [65] (схема 25).
еноизоксазолин диоксидов 71a-е достигают 80%
[61] (схема 24). Следует отметить, что для данной
В реакции симметричных альдазинов с 2,5-ди-
реакции были разработаны различные варианты
гидротиофен-1,1-диоксидом
создается
воз-
условий, в том числе использование ультразвука
можность циклоприсоединения двух молекул
[62, 63], что позволило получить достаточно ши-
сульфолена, приводящего к формированию тетра-
циклической структуры 76 [66] (схема 26).
рокий ряд тетрагидротиеноизоксазолиндиоксидов
71a-з.
Диполярное циклоприсоединение при участии
илидов, генерируемых in situ, используется для
Взаимодействие 4-замещенных 2,3-дигидроти-
синтеза тетрагидротиенопирролидиндиоксидов
офен-1,1-диоксидов с бензонитрилоксидом, полу-
[67, 68]. 2,3-Дигидротиофен-1,1-диоксиды вступа-
чаемым in situ из хлорангидрида гидроксамовой
ют в данную реакцию независимо от присутствия и
кислоты, и его мезитильным аналогом приводит к
природы заместителя в цикле с образованием гек-
образованию смеси региоизомеров 72, 73 с суще-
сагидротиено[2,3-с]пирролдиоксидов 77а-в [67]
ственным преобладанием первых (выход до 90%)
(схема 27). В случае 2,5-дигидротиофен-1,1-ди-
[64] (схема 24).
оксида кратная связь должна быть активирована
Получение тетрагидротиенопиразолиндиок-
электроноакцепторным заместителем, например,
сида 74 в результате диполярного присоедине-
сложноэфирной группой [68], и, таким образом,
ния 1,3-дифенилнитрилимина по кратной связи
были получены диастереомеры 78А, Б (схема 28).
2,5-дигидротиофен-1,1-диоксида описано в работе
В присутствии легко уходящего заместителя
[59] (схема 25). Более жесткие условия требуются
при кратной связи сульфолена реакция циклопри-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1165
Схема 25.
Схема 26.
Схема 27.
соединения дополняется стадией ароматизации,
[13]. Синтез конденсированного с пирролом суль-
что видно на примере реакций при участии 3-фе-
фолана 81 протекал однореакторно [69]. Аромати-
нилсульфонил-2,5-дигидротиофен-1,1-диоксида
зация в обоих случаях стимулировалась действием
[13, 69-71]. Формирование бициклического произ-
оснований (схема 29).
водного пиразола 80 протекало в две стадии с вы-
делением промежуточного продукта циклоприсое-
Аналогичная схема, сочетающая циклоприсое-
динения - тетрагидротиенопиразолиндиоксида 79
динение и элиминирование, реализуется при вза-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1166
ЕФРЕМОВА и др.
Схема 28.
Схема 29.
Схема 30.
Схема 31.
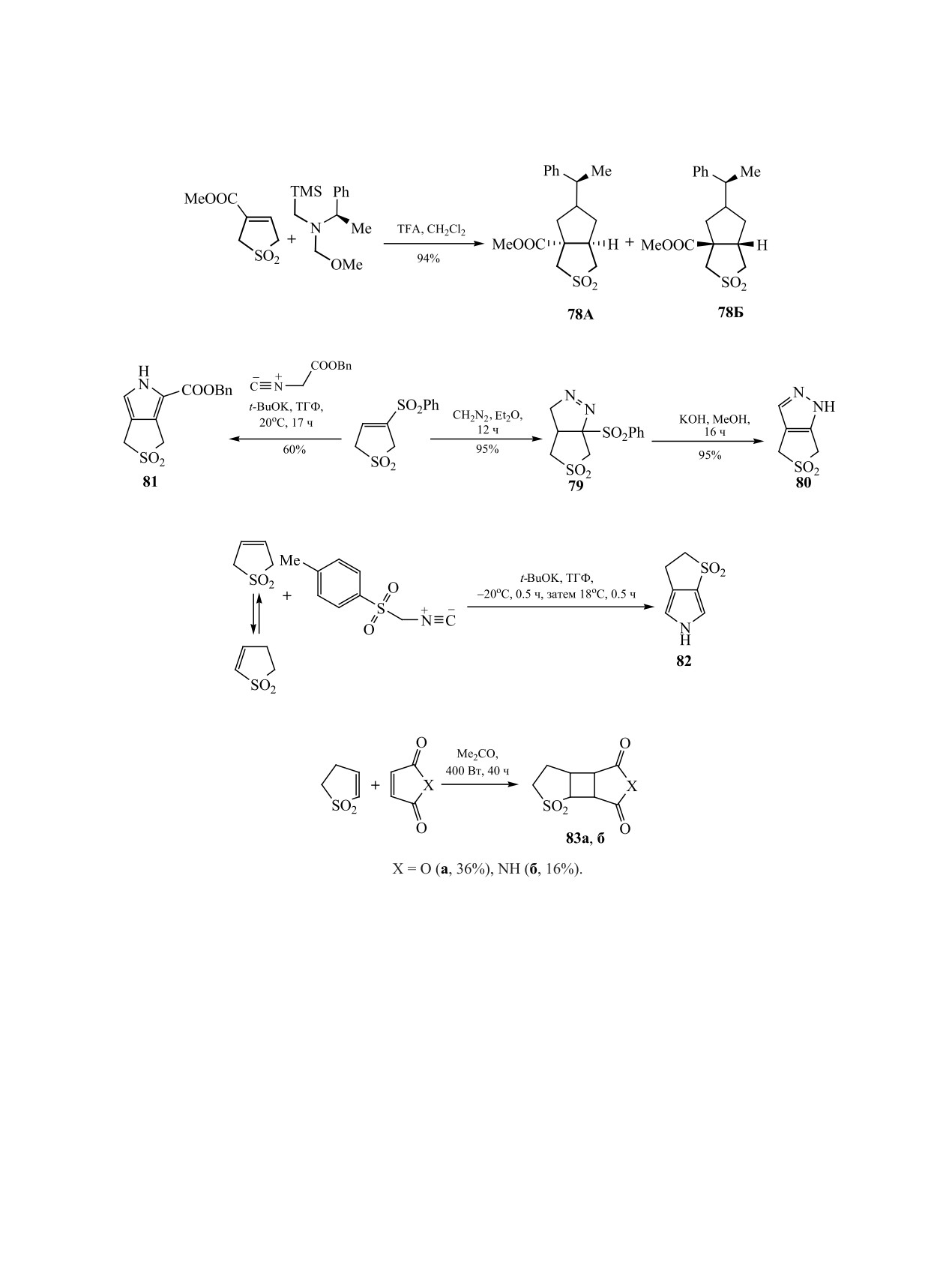
имодействии незамещенного сульфолена с този-
Аналогичные циклоаддукты были получены
лизоцианидом в присутствии основания, действие
при взаимодействии N-бензилмалеимида с 2,5-
которого способствовало протеканию аллил-ви-
или
2,3-дигидротиофен-1,1-диоксидом (выходы
нильной изомеризации сульфолена [72] (схема 30).
67 и 27% соответственно) при облучении (366 нм)
Существенно, что и в данном случае более актив-
раствора реагентов в ацетонитриле [74].
ным субстратом в реакции циклоприсоединения
В реакциях Дильса-Альдера производные
является 2,3-дигидротиофен-1,1-диоксид.
2,5-дигидротиофен-1,1-диоксида чаще исполь-
В качестве способа конструирования би- и три-
зуются как прекурсоры 1,3-диенов для формиро-
циклических систем с сульфолановым фрагментом
вания полициклов, не содержащих сульфолано-
применяется [2+2]-фотохимическое межмолеку-
вого кольца. Однако [4+2]-циклоприсоединение
лярное циклоприсоединение при участии малеи-
с участием диеновой системы заместителей по-
нового ангидрида или малеимида [73] (схема 31).
зволяет конструировать сульфолансодержащие
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1167
Схема 32.
Схема 33.
полициклические производные. Описан диено-
ством Г.А. Толстикова на основе реакций Дильса-
вый синтез при участии s-цис-фиксированной
Альдера при участии экзоциклического 5-изопро-
экзоциклической диеновой структуры 3,4-диме-
пенил-2,3-дигидротиофен-1,1-диоксида и хинонов
тилидентиолан-1,1-диоксида, который приводит
или гетероциклических ендионов [76-79] (схема 33).
к трициклическому соединению 84, способному
При s-транс-фиксации кратных связей в про-
к дальнейшей трансформации [75]. Его модифи-
изводных сульфоленов открываются перспективы
кация в диенофил 85 позволила получить пента-
формирования полициклических соединений в
циклическую структуру 86 в результате повторно-
результате реакций нуклеофильного присоедине-
го диенового синтеза (схема 32).
ния. Примеры подобных превращений описаны
Широкий ряд разнообразных полицикличе-
в работах В.М. Берестовицкой с сотрудниками
ских структур, включающих сульфолановый
[80-87], в которых в качестве субстратов использу-
цикл, синтезирован научной группой под руковод-
ются
2-(арилметилиден)-4-нитро-2,5-дигидроти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1168
ЕФРЕМОВА и др.
Схема 34.
Схема 35.
X
NO2
NO2
Me
Me
Me
NO2
N
O
H2NNHX
YNHOH
HN
Y
N
EtOH ɢɥɢ
EtOH ɢɥɢ
SO2
SO
SO2
2
ȾɆɋɈ, 18oC
ȾɆɋɈ, 18oC
H
H
Ar
Ar
Ar
95a ɡ
94a ɥ
91
Br2
MeOH, 18°C, 1 ɱ
X = H
NO2
Me
H
N
N
SO2
H
Ar
96a ɝ
94, 96: X = H, Ar = Ph ( ɚ, 77%, ɚ, 72%), 4-MeC6H4 ( ɛ, 47%, ɛ, 60%), 4-BrC6H4 ( ɜ, 60%, ɜ, 67%),
4-O2NC6H4 ( ɝ, 90%, ɝ, 45%); X = Ph, Ar = Ph (ɞ, 40%), 4-MeC6H4 (ɟ, 38%), 4-BrC6H4 (ɠ, 31%); X =
C(O)NH2, Ar = Ph (ɡ, 32%), 4-MeC6H4 (ɢ, 40%), 4-BrC6H4 (ɤ, 82%), 4-O2NC6H4 (ɥ, 84%); 95: Y = H, Ar = Ph
(a, 70%), 4-MeC6H4 (ɛ, 55%), 4-BrC6H4 (ɜ, 70%), 4-O2NC6H4 (ɝ, 75%); Y = Me, Ar = Ph (ɞ, 52%), 4-MeC6H4
(ɟ, 41%), 4-BrC6H4 (ɠ, 40%), 4-O2NC6H4 (ɡ, 56%).
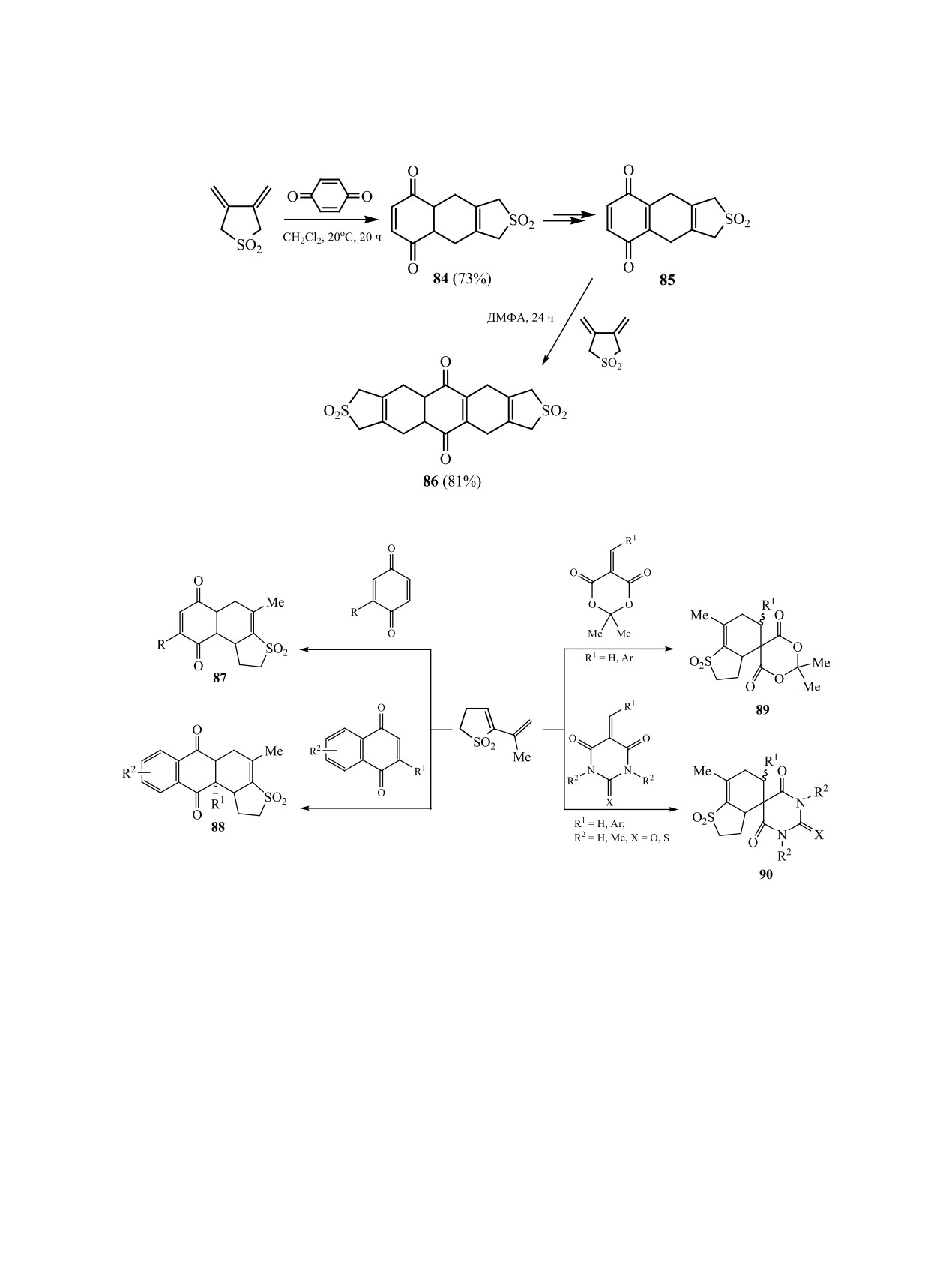
офен-1,1-диоксиды 91 [80]. Направленное сопря-
диенов 91, - трициклические конденсированные
жение создает высокую электронодефицитность
производные гидрированного хромана 92a-в, 93
нитросульфодиеновой системы в этих соединени-
[81, 82]. В качестве реагентов в этих тандемных
ях, вследствие чего взаимодействие с бинуклеофи-
реакциях использованы легко енолизирующиеся
лами протекает в мягких условиях с эффективным
циклические β-дикетоны - димедон и дигидро-
образованием продуктов циклизации.
резорцин, активируемые основанием (схема 34).
Первые представители полициклических
Синтез соединений 92a-в протекает в две ста-
структур, полученные на основе нитросульфо-
дии нуклеофильного присоединения при участии
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1169
Схема 36.
СН-кислотного центра и енольного гидроксила.
можностях полифункциональных тиолендиоксид-
При Х = Cl дополнительная стадия элиминирова-
ных систем.
ния HCl завершается образованием хроменовой
ФИНАНСОВАЯ ПОДДЕРЖКА
системы 93 [81].
Работа выполнена при финансовой поддержке
В развитие данного направления системати-
Министерства просвещения России в рамках госу-
чески исследованы возможности формирования
дарственного задания (проект № FSZN-2020-0026).
полициклических структур в реакциях нитро-
сульфодиенов 91 с N,N- и N,O-бинуклеофилами.
КОНФЛИКТ ИНТЕРЕСОВ
Гидразингидрат, фенилгидразин, семикарбазид,
Авторы заявляют об отсутствии конфликта
гидроксиламин и N-метилгидроксиламин взаимо-
интересов.
действуют с 2-(арилметилиден)-3-метил-4-нитро-
2,5-дигидротиофен-1,1-диоксидами с образовани-
СПИСОК ЛИТЕРАТУРЫ
ем конденсированных бициклических произво-
1. Brant M.G., Wulff J.E. // Synthesis. 2016. Vol. 48. N 1.
дных сульфолана с пиразолидином 94a-л и изокса-
P. 1. doi 10.1055/s-0035-1560351
золидином 95a-з, причем в большинстве случаев
2. Ефремова И.Е., Берестовицкая В.М. Функционали-
условия реакций обеспечивают высокую диасте-
зированные производные нитротиолен-1,1-диоксида.
реоселективность реакций (схема 35) [83-86].
СПб: РГПУ им. А.И. Герцена, 2004. 104 с.
3. Brant M.G., Wulff J.E. // Org. Lett. 2012. Vol. 14. N 23.
Соединения 94a-е с пиразолидиновым циклом
P. 5876. doi 10.1021/ol3027939
при окислении бромом превращены в тетрагидро-
4. Patil S.T., Zhang L., Martenyi F., Lowe S.L., Jackson K.A.,
тиенопиразолиндиоксиды 96а-г с выходами до
Andreev B.V., Avedisova A.S., Bardenstein L.M.,
72% [87].
Gurovich I.Y., Morozova M.A., Mosolov S.N., Nezna-
Образование бициклических соединений 94a-
nov N.G., Reznik A.M., Smulevich A.B., Tochilov V.A.,
л, 95a-з рассматривается как результат тандемно-
Johnson B.G., Monn J.A., Schoepp D.D. // Nature
го процесса, включающего реакцию аза-Михаэля
Medicine. 2007. Vol. 13. N 9. P. 1102. doi 10.1038/
по 1,4-положениям диеновой системы, изомери-
nm1632
зацию промежуточного аза-аддукта 97 в Δ3-фор-
5. Gopalakrishnan M., Buckner S.A., Whiteaker K.L.,
Shieh C.-C., Molinari E.J., Milicic I., Daza A.V., Davis-
му 98 и внутримолекулярное присоединение при
Taber R., Scott V.E., Sellers D., Chess-Williams R.,
участии второго нуклеофильного центра реагента
Chapple C.R., Liu Y., Liu D., Brioni J.D., Sullivan J.P.,
(схема 36) [83-86]. Аналогичный механизм пред-
Williams M., Carroll W.A., Coghlan M.J. // J. Pharmacol.
полагался и для синтеза трициклических структур
Exp. Ther. 2002. Vol. 303. N 1. P. 379. doi 10.1124/
92a-в, 93 [81, 82].
jpet.102.034538
5. ЗАКЛЮЧЕНИЕ
6. Nandakumar M., Karunakaran J., Mohanakrish-
nan A.K. // Org. Lett. 2014. Vol. 16. N 11. P. 3068. doi
Проведенный анализ литературных данных по-
10.1021/ol501175q
казал возможность успешного конструирования
7. Толстиков Г.А., Шульц Э.Э., Вафина Г.Ф., Толсти-
разнообразных типов полициклических произво-
кова Т.Г., Давыдова В.А., Исмагилова А.Ф., Спири-
дных сульфолана (сульфолена) путем постоянно
хин Л.В., Зарудий Ф.А., Лазарева Д.Н. // Хим.-фарм.
совершенствующихся препаративных решений,
ж. 1991. Т. 25. №. 11. С. 39; Tolstikov G.A., Shul’ts E.E.,
основанных на многогранных синтетических воз-
Vafina G.F., Tolstikova T.G., Davydova V.A., Ismagilo-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1170
ЕФРЕМОВА и др.
va A.F., Spirikhin L.V., Zarudii F.A., Lazareva D.N. //
J. Org. Chem. 2008. Vol. 44. N 4. P. 629. doi 10.1134/
Pharm. Chem. J. 1991. Vol. 25. N 11. P 800. doi
S1070428008040301
10.1007/BF00767263
28. Bates H.A., Smilowitz L., Rosenblum S.B. // Chem.
8. Chou T.-S., Lee S.-J., Yao N.-K. // Tetrahedron.
Commun. 1985. N 6. P. 353. doi 10.1039/C39850000353
1989. Vol. 45. N 13. P. 4113. doi 10.1016/S0040-
29. Oh K. // Org. Lett. 2007. Vol. 9. N 16. P. 2973. doi
4020(01)81307-7
10.1021/ol0710663
9. Shing T.K.M., Tang Y. // J. Chem. Soc. Perkin Trans. 1.
30. Безуглый Ю.В., Тухарь А.А., Безменова Т.Э., Фо-
1994. N 12. P. 1625. doi 10.1039/P19940001625
ремная В.П., Братунец А.Г., Шахворост A.M. //
10. Leonard J., Haque A.B., Knight J.A. // Organosulfur
ХГС. 1988. № 1. С. 110; Bezuglyi Yu.V., Tukhar’ A.A.,
Chem. 1998. Vol. 2. P. 229. doi 10.1016/S1099-
Bezmenova T.E., Foremnaya V.P., Bratunets A.G.,
8268(98)80009-7
Shakhvorost A.M. // Chem. Heterocycl. Compd. 1988.
11. Ando K., Takayama H. // Heterocycles. 1994. Vol. 37.
Vol. 24. N 1. P. 92. doi 10.1007/BF00475578
N 2. P. 1417. doi 10.3987/REV-93-SR18
31. Макаренко А.Г., Пархоменко И.И., Рыбакова М.В.,
12. Ando K., Kankake M., Suzuki T., Takayama H. // Synlett.
Роженко А.Б., Григорьев А.А. // Укр. хим. ж. 1994.
1994. N 9. P. 741. doi 10.1055/s-1994-22993
Т. 60. № 8. С. 588.
13. Chaloner L.M., Crew A.P.A., Storr R.C., Yelland M. //
32. Lee S.-J., Lee J.-C., Peng M.-L., Chou T.-S. //
Tetrahedron Lett. 1991. Vol. 32. N 51. P. 7609. doi
Chem. Commun. 1989. N 15. P. 1020. doi 10.1039/
10.1016/0040-4039(91)80547-J
C39890001020
14. Chaloner L.M., Crew A.P.A., O’Neill P.M., Storr R.C.,
33. Chou T.-S., Tsai C.-Y. // Chem. Commun. 1991. N 18.
Yelland M. // Tetrahedron. 1992. Vol. 48. N 37. P. 8101.
P. 1287. doi 10.1039/C39910001287
doi 10.1016/S0040-4020(01)80480-4
34. Chou T.-S., Tsai C.-Y. // Heterocycles. 1992. Vol. 34. N 4.
15. Lu L., Luo C., Peng H., Jiang H., Lei M., Yin B. // Org.
P. 663. doi 10.3987/COM-92-5973
Lett. 2019. Vol. 21. N 8. P. 2602. doi 10.1021/acs.
35. Chou T.-S., Tsai C.-Y. // J. Chin. Chem. Soc. 1993. Vol.
orglett.9b00573
40. N 6. P. 581. doi 10.1002/jccs.199300093
16. Gordivska O., Listunov D., Popov K., Volovnenko T.,
36. Chou T.-S., Tsai C.-Y., Lee S.-J. // J. Chin. Chem. Soc.
Volovenko Yu. // Tetrahedron Lett. 2013. Vol. 54. N 32.
1997. Vol. 44. N 3. P. 299. doi 10.1002/jccs.199700045
P. 4171. doi 10.1016/j.tetlet.2013.05.107
37. Слуцкий В.И., Безменова Т.Э. // ХГС. 1983. № 12. С.
17. Chou T.-S., Chou S.-S. P. // J. Chin. Chem. Soc. 1992.
1633; Slutskii V.I., Bezmenova T.E. // Chem. Heterocycl.
Vol. 39. N 6. P. 625. doi 10.1002/jccs.199200097
Compd. 1983. Vol. 19. N 12. P. 1289. doi 10.1007/
18. Chou S.-S.P., Sung C.-C., Sun D.-J. // J. Chin.
BF00842832
Chem. Soc. 1992. Vol. 39. N 4. P. 333. doi 10.1002/
38. Слуцкий В.И., Безуглый Ю.В. // ХГС. 1993. № 1.
jccs.199200057
С. 40; Slutskii V.I., Bezuglyi Yu.B. // Chem. Heterocycl.
19. Chou S.-S.P., Sung C.-C. // J. Chin. Chem. Soc. 1989.
Compd. 1993. Vol. 29. N 1. P. 33. doi 10.1007/
Vol. 36. N. 6. P. 601. doi 10.1002/jccs.198900079
BF00528633
20. Chou T.-S., Chang L.-J., Tso H.-H. // J. Chem.
39. Хаскин Г.И., Безменова Т.Э. Дульнев П.Г. // ХГС.
Soc. Perkin Trans. 1. 1986. P. 1039. doi 10.1039/
1982. № 3. С. 328; Khaskin G.I., Bezmenova T.E.,
P19860001039
Dul’nev P.G. // Chem. Heterocycl. Compd. 1982.
21. Chou T.-S., Chang С.-Y. // J. Org. Chem. 1991. Vol. 56.
Vol. 18. N 3. P. 246. doi 10.1007/BF00522120
N 14. P. 4560. doi 10.1021/jo00014a048
40. Suzuki T., Kubomura K., Fuchii H., Takayama H. //
22. Tao Y.-T., Chen M.-L. // J. Org. Chem. 1988. Vol. 53.
Chem. Commun. 1990. N 23. P. 1687. doi 10.1039/
N 1. P. 69. doi 10.1021/jo00236a014
23. Chou T.-S., Lee S.-J., Tso H.-H. // J. Org. Chem. 1987.
C39900001687
Vol. 52. N 23. P. 5082. doi 10.1021/jo00232a003
41. Ando K., Akadegawa N., Takayama H. // J. Chem.
24. Tso H.-H., Chou T.-S., Lee W.-C. // Chem. Commun.
Soc. Perkin Trans. 1. 1993. N 19. P. 2263. doi 10.1039/
1987. N 12. P. 934. doi 10.1039/C39870000934
P19930002263
25. Brant M.G., Bromba C.M., Wulff J.E. // J. Org. Chem.
42. Gshwend H.W., Haider H. // J. Org. Chem. 1972.
2010. Vol. 75. N 18. P. 6312. doi 10.1021/jo101389c
Vol. 37. N 1. P. 59. doi 10.1021/jo00966a016
26. Brant M.G., Friedmann J.N., Bohlken C.G., Oliver A.G.,
43. Chou T.-S., Hung S.C. // Heterocycles. 1986. Vol. 24.
Wulff J.E. // Org. Biomol. Chem. 2015. Vol. 13. N 15.
N 8. P. 2303. doi 10.3987/R-1986-08-2303
P. 4581. doi 10.1039/C5OB00387C
44. Ando K., Kankake M., Suzuki T., Takayama H. //
27. Яковлев В.В., Шкляренко А.А. // ЖОрХ. 2008. Т. 44.
Chem. Commun. 1992. N 16. P. 1100. doi 10.1039/
Вып. 4. С. 633; Yakovlev V.V., Shklyarenko A.A. // Russ.
C39920001100
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ ПОЛИЦИКЛИЧЕСКИХ СИСТЕМ
1171
45. Kräutler B., Sheehan C.S., Reider A. // Helv. Chim. Acta.
63. Bougrin K., Lamiri M., Soufiaoni M. // Tetrahedron
2000. Vol. 83. N 3. P. 583. doi 10.1002/(SICI)1522-
Lett. 1998. Vol. 39. N 25. P. 4455. doi 10.1016/S0040-
2675(20000315)83:3<583::AID-HLCA583>3.0.CO;2-A
4039(98)00815-6
46. Gunter M.J., Tang H. // Chem. Commun. 1999. N 9.
64. Albini F.M., Ceva P., Mascherpa A., Albini E.,
P. 803. doi 10.1039/A901446B
Caramella P. // Tetrahedron. 1982. Vol. 38. N 24.
47. Banala S., Wurst K., Kräutler B. // J. Porph. Phthal. 2014.
P. 3629. doi 10.1016/0040-4020(82)80071-9
Vol. 18. N 1-2. P. 115. doi 10.1142/S1088424613501204
65. Wong S.S.Y., Brant M.G., Barr C., Oliver A.G.,
48. Пальчиков В.А., Заровная И.С., Дульнев П.Г. //
Wulff J.E. // Beilstein J. Org. Chem. 2013. Vol. 9.
ЖОрХ. 2018. Т. 54. Вып. 7. С. 1055; Pal’chikov V.A.,
P. 1419. doi 10.3762/bjoc.9.159
Zarovnaya I.S., Dul’nev P.G. // Russ. J. Org. Chem.
66. Ghabrial S.S. // Phosphorus, Sulffur, Silicon, Relat.
2018. Vol. 54. N 7. P. 1061. doi 10.1134/
Elem. 1993. Vol. 84. N 1-4. P. 17. doi 10.1080/
10426509308034311
S1070428018070151
67. Yarmolchuk V.S., Mukan I.L., Grygorenko O.O.,
49. Chou T.-S., Chen H.-C., Tsai C.-Y. // J. Org. Chem.
Tolmachev A.A., Shishkina S.V., Shishkin O.V., Koma-
1994. Vol. 59. N 8. P. 2241. doi 10.1021/jo00087a049
rov I.V. // J. Org. Chem. 2011. Vol. 76. N 17. P. 7010.
50. Chou T.-S., Tsai C.-Y. // Tetrahedron Lett. 1992. Vol. 33.
doi 10.1021/jo200878t
N 29. P. 4201. doi 10.1016/S0040-4039(00)74689-2
68. Karlsson S., Högberg H.-E. // Eur. J. Org. Chem. 2003.
51. Dodd J.H., Schwender C.F., Gray-Nunez Y. // J.
N 15. P. 2782. doi 10.1002/ejoc.200300172
Heterocycl. Chem. 1990. Vol. 27. N 5. P. 1453. doi
69. Abel Y., Haake E., Haake G., Schmidt W. Struve D.,
10.1002/jhet.5570270550
Walter A., Montforts F.-P. // Helv. Chim. Acta.
52. Altenbach R.J., Brune M.E., Buckner S.A., Coghlan M.J.,
1998. Vol. 81. N 11. P. 1978. doi 10.1002/
Daza A.V., Fabiyi A., Gopalakrishnan M., Henry R.F.,
(SICI)1522-2675(19981111)81:11<1978::AID-
Khilevich A., Kort M.E., Milicic I., Scott V.E.,
HLCA1978>3.0.CO;2-T
Smith J.C., Whiteaker K.L., Carroll W.A. // J. Med.
70. Vicente M.G.H, Tomé A.C., Walter A., Cavaleiro J.A.S. //
Chem. 2006. Vol. 49. N 23. P. 6869. doi 10.1021/
Tetrahedron Lett. 1997. Vol. 38. N 20. P. 3639. doi
jm060549u
10.1016/S0040-4039(97)00689-8
53. Tso H.-H., Yang N.-C., Chang Y.-M. // Chem. Commun.
71. Cheng W.-C., Olmstead M.M., Kurth M.J. // J. Org.
1995. N 13. P. 1349. doi 10.1039/C39950001349
Chem. 2001. Vol. 66. N 16. P. 5528. doi 10.1021/
54. Tso H.-H., Tsay H., Li J.-H. // Synth. Commun. 1995.
jo0156823
Vol. 25. N 21. P. 3435. doi 10.1080/00397919508013867
72. Banala S., Wurst K., Kräutler B. // Helv. chim. acta.
55. Banert K., Ihle A., Kuhtz A., Penk E., Saha B.,
2010. Vol. 93. N 6. P. 1192. doi 10.1002/hlca.200900362
Würthwein E.-U. // Tetrahedron. 2013. Vol. 69. N 11.
73. Aitken R.A., Cadogan J.I.G., Gosney I. // J. Chem.
P. 2501. doi 10.1016/j.tet.2012.12.054
Soc. Perkin Trans. 1. 1994. N 14. P. 1983. doi 10.1039/
56. Ko C.-W., Chou T.-S. // // Tetrahedron Lett. 1997. Vol. 38.
P19940001983
N 30. P. 5315. doi 10.1016/S0040-4039(97)01183-0
74. Skalenko Y.A., Druzhenko T.V., Denisenko A.V.,
57. Ko C.-W., Chou T.-S. // J. Org. Chem. 1998. Vol. 63. N
Samoilenko M.V., Dacenko O.P., Trofymchuk S.A.,
14. P. 4645. doi 10.1021/jo980044e
Grygorenko O.O., Tolmachev A.A., Mykhailiuk P.K. //
58. Chen H.-C., Chou T.-S. // Tetrahedron. 1998. Vol. 54.
J. Org. Chem. 2018. Vol. 83. N 12. P. 6275. doi 10.1021/
N 41. P. 12609. doi 10.1016/S0040-4020(98)00739-X
acs.joc.8b00077
59. Мухамедова Л.А., Коноплев М.В., Махмутова С.Ф.,
75. Alder R.W., Allen P.R., Edwards L.S., Fray G.I., Ful-
Бузыкин Б.И., Хайруллин В.К. // ХГС. 1976. № 10.
ler K.E., Gore P.M., Hext N.M., Perry M.H., Tho-
С. 1426; Mukhamedova L.A., Konoplev M.V.,
mas A.R., Turner K.S. // J. Chem. Soc. Perkin Trans. 1.
Makhmutova S.F., Buzykin B.I., Khairullin V.K. // Chem.
1994. N 21. P. 3071. doi 10.1039/P19940003071
Heterocycl. Compd. 1976. Vol. 12. N 10. P. 1182. doi
76. Толстикова Т.Г., Давыдова В.А., Шульц Э.Э., Ва-
10.1007/BF00945615
фина Г.Ф., Сафарова Г.М., Зарудий Ф.А., Лазаре-
60. Mock W.L. // J. Am. Chem. Soc. 1970. Vol. 92. N 23.
ва Д.Н., Толстиков Г.А. // Хим.-фарм. ж. 1990.
P. 6918. doi 10.1021/ja00726a032
Т. 24. №. 7. С. 27; Tolstikova T.G., Davydova V.A.,
61. Subramanian T., Meenakshi S., Dange S.Y., Bhat S.V. //
Shul’ts E.E., Vafina G.F., Safarova G.M., Zurudii F.A.,
Synth. Commun. 1997. Vol. 27. N 15. P. 2557. doi
Lazareva D.N., Tolstikov G.A. // Pharm. Chem. J. 1990.
10.1080/00397919708004123
Vol. 24. N 7. P 465. doi 10.1007/BF00764992
62. Ермолаева Н.А., Цыпышева И.П., Дорогая Е.С.,
77. Андреев Г.Н., Шульц Э.Э., Волков А.А., Шаки-
Гайлюнас И.А., Спирихин Л.В., Байкова И.П., Юну-
ров М.М., Багрянская И.Ю., Гатилов Ю.В., Тол-
сов М.С. // Баш. хим. ж. 2009. Т. 16. № 2. С. 104.
стиков Г.А. // ЖОрХ. 2004. Т. 40. Вып. 6. С. 892;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1172
ЕФРЕМОВА и др.
Andreev G.N., Shul’ts E.E., Volkov A.A., Shakirov M.M.,
83. Berestovitskaya V.M., Efremova I.E., Lapshina L.V.,
Bagryanskaya I.Yu., Gatilov Yu.V., Tolstikov G.A. //
Serebryannikova A.V., Gurzhiy V.V., Abzianidze V.V. //
Russ. J. Org. Chem. 2004. Vol. 40. N 6. P. 854. doi
Mendeleev Commun. 2015. Vol. 25. N 3. P. 191. doi
10.1023/B:RUJO.0000044549.81561.4f
10.1016/j.mencom.2015.05.010
78. Шульц Э.Э., Андреев Г.Н., Шакиров М.М., Кома-
84. Ефремова И.Е., Серебрянникова А.В., Лапшина Л.В.,
рова Н.И., Багрянская И.Ю., Гатилов Ю.В., Тол-
Гуржий В.В., Берестовицкая В.М. // ЖОХ. 2016.
стиков Г.А. // ЖОрХ. 2009. Т. 45. Вып. 1. С. 94;
Т. 86. Вып. 3. С. 481; Efremova I.E., Serebryanniko-
Shul’ts E.E., Andreev G.N., Shakirov M.M., Komaro-
va A.V., Lapshina L.V., Gurzhiy V.V., Berestovits-
va N.I., Bagryanskaya I.Yu., Gatilov Yu.V., Tolsti-
kaya V.M. // Russ. J. Gen. Chem. 2016. Vol. 86. N 3.
kov G.A. // Russ. J. Org. Chem. 2009. Vol. 45. N 1.
P. 622. doi 10.1134/S1070363216030191
P. 87. doi 10.1134/S1070428009010126
85. Ефремова И.Е., Серебрянникова А.В., Беляков А.В.,
79. Шульц Э.Э., Олейников Д.С., Нечепуренко И.В.,
Шакиров М.М., Толстиков Г.А. // ЖОрХ. 2009.
Лапшина Л.В. // ЖОХ. 2019. Т. 89. Вып. 3. С. 468.
Т. 45. Вып. 1. С. 108; Shul’ts E.E., Oleinikov D.S.,
doi 10.1134/S0044460X19030211; Efremova I.E.,
Nechepurenko I.V., Shakirov M.M., Tolstikov G.A. //
Serebryannikova A.V., Belyakov A.V., Lapshina L.V. //
Russ. J. Org. Chem. 2009. Vol. 45. N 1. P. 102. doi
Russ. J. Gen. Chem. 2018. Vol. 89. N 3. P. 536. doi
10.1134/S1070428009010138
10.1134/S1070363219030277
80. Берестовицкая В.М. // ЖОХ. 2000. Т.70. Вып. 9.
86. Берестовицкая В.М., Ефремова И.Е., Серебрянни-
С. 1512; Berestovitskaya V.M. // Russ. J. Gen. Chem.
кова А.В., Лапшина Л.В., Гуржий В.В. // ХГС. 2018.
2000. Vol. 70. N 9. P. 1419.
Т. 54. № 1. С. 76; Berestovitskaya V.M., Efremova I.E.,
81. Васильева М.В., Берестовицкая В.М., Перекалин В.В. //
Serebryannikova A.V., Lapshina L.V., Gurzhiy V.V. //
ЖОрХ. 1985. Т. 21. Вып. 7. С 1580; Vasil’eva M.V.,
Chem. Heterocycl. Compd. 2018. Vol. 54. N 1. P. 76.
Berestovitskaya V.M., Perekalin V.V. // J. Org. Chem.
doi 10.1007/s10593-018-2233-y
USSR. 1985. Vol. 21. N 7. P. 1439.
87. Ефремова И.Е., Серебрянникова А.В., Лапшина Л.В.,
82. Берестовицкая В.М., Селиванова М.В., Вакулен-
Гуржий В.В., Рябинин А.Е. // ХГС. 2019. Т. 55. № 9.
ко М.И., Ефремова И.Е., Беркова Г.А. // ЖОрХ.
С. 902; Efremova I.E., Serebryannikova A.V., Lapshi-
2009. Т. 45. Вып. 12. С. 1818; Berestovitskaya V.M.,
Selivanova M.V., Vakulenko M.I., Efremova I.E.,
na L.V., Gurzhiy V.V., Ryabin A.E. // Chem. Heterocycl.
Berkova G.A. // Russ. J. Org. Chem. 2009. Vol. 45.
Compd. 2019. Vol. 55. N 9. P. 902. doi 10.1007/s10593-
N 12. P. 1814. doi 10.1134/S1070428009120100
019-02556-9
Synthesis of Polycyclic Systems Based on Sulfolenes
I. E. Efremovaa,*, L. V. Lapshinab, R. I. Baichurina,
A. V. Serebryannikovac, and I. I. Savel’eva
a Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
b Kirov Military Medical Academy, St. Petersburg, 194044 Russia
с St. Petersburg State University, St. Petersburg, 199034, Russia
*e-mail: kohrgpu@yandex.ru
Received May 5, 2020; revised May 5, 2020; accepted May 16, 2020
The review analyzes and summarizes methods for the synthesis of polycyclic derivatives of sulfolane (sulfolene).
The reactions of polyalkylation, transformations due to the functional groups of the sulfolene ring, as well as
the addition reaction at its endo- and exocyclic multiple bonds are considered.
Keywords: sulfolenes, dihydrothiophene-1,1-dioxides, polycyclic structures, alkylation, binucleophiles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020