ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1173-1183
К 80-летию со дня рождения В.М. Берестовицкой
УДК 547.33;547.34
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ-
И 1-НИТРО-1,3,3,3-ТЕТРАБРОМПРОП-1-ЕНОВ С
АЛИФАТИЧЕСКИМИ ДИЕНАМИ
© 2020 г. Н. А. Анисимоваa,b,*, Е. К. Слободчиковаa, М. Е. Ивановаc, Т. В. Рыбаловаd,e
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
b Санкт-Петербургский государственный университет промышленных технологий и дизайна,
Санкт-Петербург, 191186 Россия
c Алтайский государственный аграрный университет, Барнаул, 656049 Россия
d Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, Новосибирск, 630090 Россия
e Новосибирский национальный исследовательский государственный университет, Новосибирск, 630090 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 11 мая 2020 г.
После доработки 11 мая 2020 г.
Принято к печати 20 мая 2020 г.
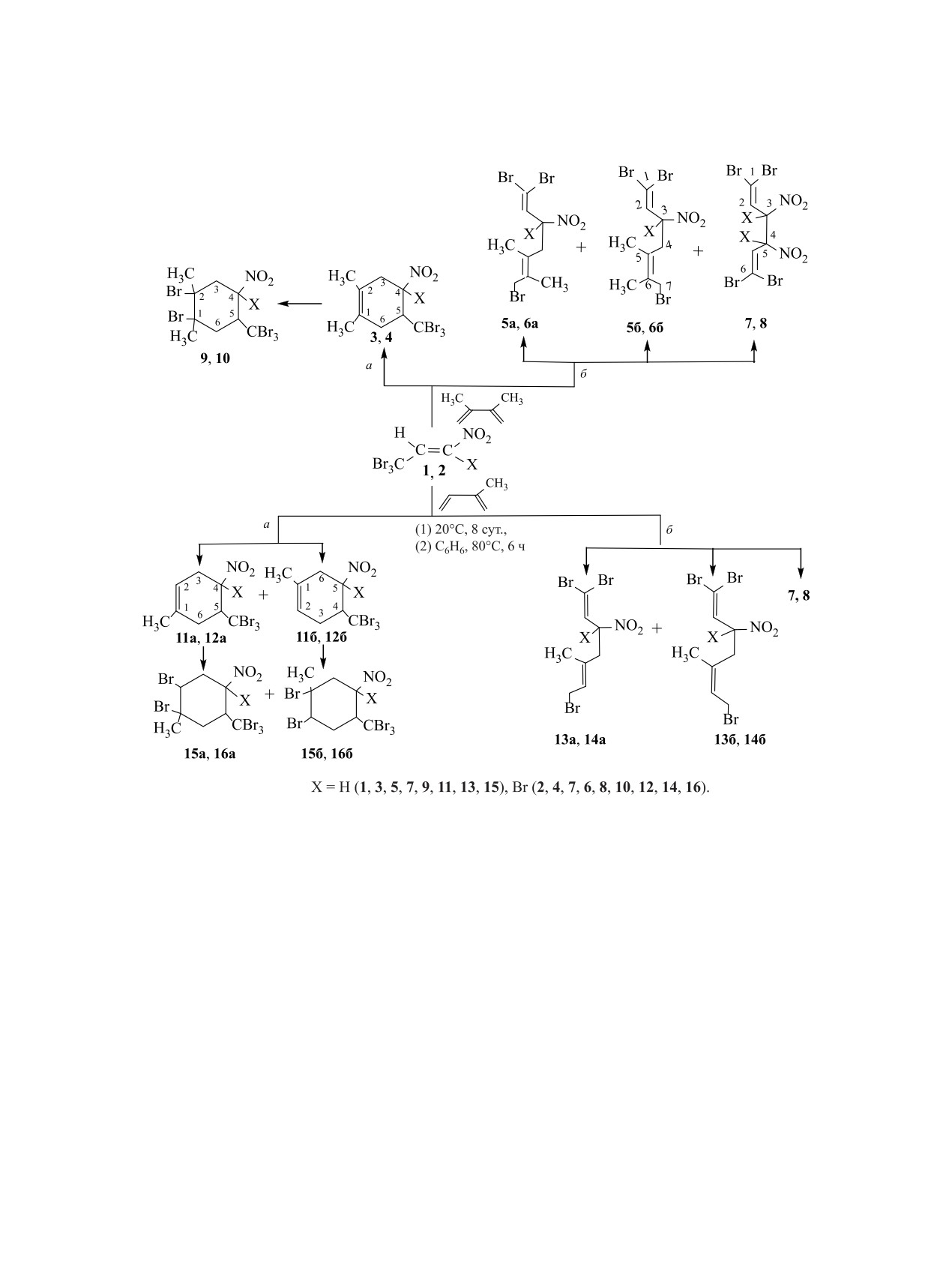
Взаимодействием 1-нитро-3,3,3-трибром- и 1-нитро-1,3,3,3-тетрабромпроп-1-енов с 2-метил- и 2,3-ди-
метилбута-1,3-диенами получены производные циклогексена, циклогексана и гепта-1,5-диена с нитро- и
трибромметильной группами. Их строение охарактеризовано методами ИК, ЯМР 1Н, 13С спектроскопии
и рентгеноструктурного анализа.
Ключевые слова: 1-нитро-3,3,3-трибромпроп-1-ен, производные циклогексена, гепта-1,5-диен, реакция
Дильса-Альдера, 1,4-присоединение
DOI: 10.31857/S0044460X2008003X
Циклогексановое кольцо - структурный фраг-
нофилы применяются для синтеза природных био-
мент многих природных соединений (витаминов,
логически активных соединений, в том числе для
терпенов, гормонов, алкалоидов, шикимовой кис-
получения природного анальгетика эпибатидина
лоты и других практически значимых веществ)
[13, 14], производных морфина [15], кондуритолов
[1, 2], проявляющих важные биологические свой-
[10].
ства (например, ингибирование энзимов [3, 4]) и
Получение в реакции диенового синтеза нитро-
выступающих в качестве ключевых прекурсоров
циклогексена, замещенного тригалогенметильной
для получения лекарственных препаратов с проти-
группой, открывает возможность для дополни-
вораковым [5], наркотическим [6, 7] и противови-
тельной модификации циклической структуры и
русным [8, 9] действием, перспективных в борьбе
приводит к усилению фармакологической актив-
с ВИЧ-инфекцией [10].
ности [14].
Одним из удобных и доступных методов синте-
Согласно литературным данным,
1-нитро-
за функциональных производных циклогексена -
это реакция Дильса-Альдера, в которой в каче-
3,3,3-трихлорпроп-1-ен вступает в диеновую кон-
стве диенофилов используются вицинально за-
денсацию с алкадиенами (бута-1,3-диен, 2,3-диме-
мещенные нитроалкены с легко модифицируемой
тилбута-1,3-диен, изопрен, пиперилен) в жестких
группой (CO2R, SO2Ph, СHlg3) [11, 12]. Такие дие-
условиях (многочасовое нагревание в ампуле в
1173
1174
АНИСИМОВА и др.
Схема 1.
среде высококипящего растворителя) [16-18]. Ра-
1,4-присоединения нитроалкена к 1,3-диену (путь
нее нами было показано, что вицинально замещен-
б). Такое неоднозначное протекание реакции обу-
ные нитро- и гем-бромнитроалкены с группами
словлено возможностью нитроалкенов 1 и 2 в ука-
СF3 и CСl3 в своем составе способны реагировать
занных условиях, в отличие от β-нитроалкенов с
с алифатическими диенами без нагревания [19].
группами СF3 и CCl3 [19], выступать не только в
роли диенофилов, но и источников свободных ра-
В настоящей работе нами изучено поведение
дикалов (за счет СBr3 группы). Первые приводят к
нитро- и гем-бромнитроалкенов, имеющих в сво-
ем составе группу СBr3, в реакциях с алифатиче-
образованию нитроциклогексенов 3 и 4, а вторые -
к изомерным 1,5-гептадиенам 5 и 6, 1,5-гексадие-
скими диенами, которые до настоящего времени
нам 7 и 8, а также к дибромнитроциклогексанам 9
в такие реакции не вовлекались. Реакции 1-ни-
и 10 (схема 1).
тро-3,3,3-трибром- и
1-нитро-1,3,3,3-тетрабром-
проп-1-енов 1, 2 с 2,3-диметилбута-1,3-диеном
По аналогичной схеме с нитроалкенами 1 и 2
протекают при комнатной температуре (бензол,
реагирует изопрен, однако взаимодействие с ним
8 сут) по двум конкурирующим направлениям: ди-
закономерно приводит к образованию более слож-
енового синтеза (схема 1, путь а) и радикального
ной смеси соединений - изомерных циклогексенов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ- И 1-НИТРО-1,3,3,3-ТЕТР
АБРОМПРОП-1-ЕНОВ
1175
Таблица 1. Условия взаимодействия нитроалкенов 1, 2 с алифатическими диенами в бензоле
Условия
Соотношение, %a
Нитроалкен
циклогексены
циклогексаны
1,5-гепта- и гексадиены
2,3-Диметилбута-1,3-диен
1
20°С, 8 сут
10
55
25
1
80°С, 6 ч
5
20
60
1
20°С, 7 ч, hν
-
-
100
2
20°С, 8 сут
5
25
65
2-Метилбута-1,3-диен
1
20°С, 8 сут
10
45
35
2
20°С, 8 сут
5
15
75
а По данным спектроскопии ЯМР 1Н до хроматографирования.
11 и 12, гепта-1,5-диенов 13 и 14, гекса-1,5-диенов
и 12 в виде региоизомеров свидетельствует удвое-
7 и 8, а также дибромциклогексанов 15 и 16. Ва-
ние сигналов метильного заместителя и протонов
рьирование условий реакции (табл. 1) позволило
Н4, Н5 цикла. Сигналы метиленовых протонов Н6ʹ,
изменить соотношение циклических и ацикличе-
Н6ʹʹ в спектрах соединений 3, 4, 11а, 12а и ато-
ских продуктов реакции. При взаимодействии ни-
мов Н3ʹ, Н3ʹʹ в соединениях 11б, 12б проявляются
троалкена 1 с 2-метил- и 2,3-диметилбута-1,3-ди-
в виде мультиплетов в диапазоне 2.28-3.22 м. д.
енами при
20°С общий выход циклических
с геминальными константами 14.3-18.3 Гц. Под
аддуктов 3, 9 и 11, 15 составил 55-65%. Кипячение
влиянием группы NO2 сигналы метиленовых про-
реакционной смеси или использование в реакции
тонов Н3ʹ, Н3ʹʹ в спектрах соединений 3, 4, 11а, 12а
гем-бромнитроалкена 2 приводит к снижению вы-
и атомов Н6ʹ, Н6ʹʹ соединений 11б, 12б закономерно
хода циклоаддуктов до 20-30% с одновременным
проявляются в более слабом поле при 2.78-3.88 м. д.
увеличением доли 1,5-диенов до 60-75%. При УФ
Сигналы нитрометиновых протонов Н4 в спек-
облучении реакционной смеси нитроалкена 1 и
трах соединениий 3, 11а и Н5 (11б) расположены в
2,3-диметилбута-1,3-диена получены исключи-
более слабом поле при 4.99-5.10 м. д. по сравне-
тельно 1,5-диены 5 и 7, что подтверждает проте-
нию с протонами Н5 в спектрах соединений 3, 4,
кание реакции по радикальному механизму AdR
11а, 12а и Н4 (11б, 12б), соседствующими с груп-
(схема 1, путь б). Образование радикала брома из
пой СBr3 (3.92-4.02 м. д.). Взаимное расположе-
группы СBr3 в нитроалкенах 1 и 2, по-видимому,
ние групп СBr3 и NO2 в молекулах циклогексенов
можно объяснить природой связи C-Br, имеющей
определяли по константам спин-спинового вза-
значительно бóльшую длину и меньшую энергию
имодействия вицинальных протонов Н4, Н5 друг
по сравнению со связями С-F и C-Cl. Получение
с другом и с протонами соседних метиленовых
радикала галогена (Cl∙, Br∙) и дигалогенвинилиде-
групп (Н3ʹ, Н3ʹʹ и Н6ʹ, Н6ʹʹ). Анализ КССВ (табл. 2)
нового фрагмента (=СHlg2, Hlg = Cl, Br) с участи-
этих протонов показал, что в спектрах циклогек-
ем группы CHlg3 описано в работах [20-24].
сенов 3, 11а, 12а они одинаковы (3JН5Н6ʹ = 3JН5Н6ʹʹ;
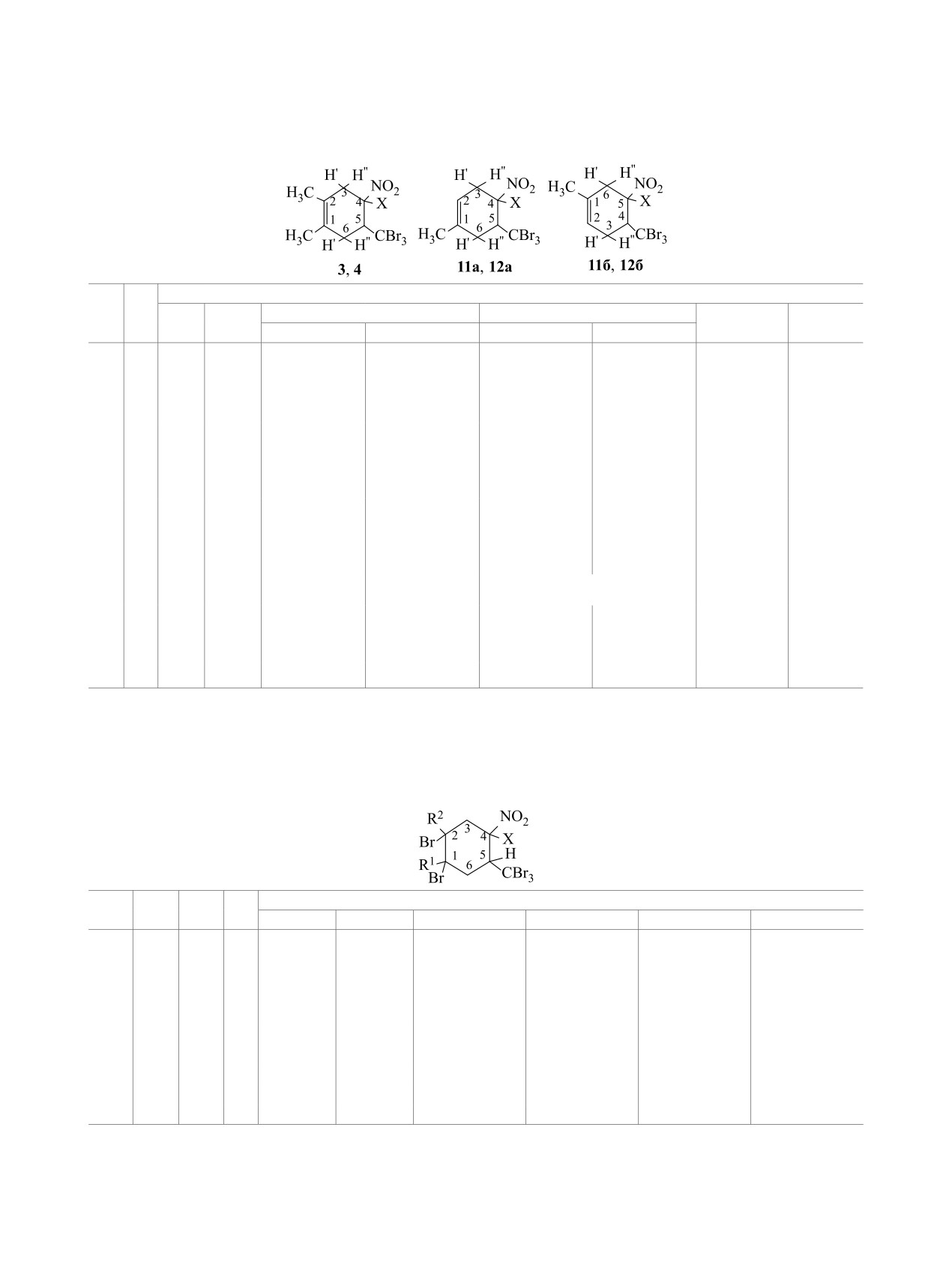
Строение нитроциклогексенов 3, 4, 11 и 12
3JН4Н3ʹ
= 3JН4Н3ʹʹ) и находятся в диапазоне 5.80-
установлено методами ЯМР 1Н и ИК спектроско-
7.9 Гц, что свидетельствует об аксиальной ориен-
пии, а также сопоставлением их спектральных
тации указанных групп (схема 2). Это подтвержда-
характеристик со спектрами структурно однотип-
ется и значением вицинальной константы 3JН4Н5 =
ных соединений, имеющих в своем составе групы
5.5 Гц для соединения 3 [27].
CO2R, P(O)(OR)2, ССl3 и CF3 [19, 25, 26]. В ИК
Схема 2.
спектрах нитроциклогексенов 3, 4, 11 и 12 наблю-
даются полосы поглощения несопряженной груп-
пы NO2 в областях 1320-1375 и 1560-1575 см-1.
Спектры ЯМР 1Н нитроциклогексенов 3, 4, 11 и
12 указывают на стереооднородность этих соеди-
нений (табл. 2). Об образовании циклогексенов 11
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1176
АНИСИМОВА и др.
Таблица 2. Данные спектроскопии ЯМР 1Н (CDCl3) для нитроциклогексенов 3, 4, 11 и 12
δ, м. д. (J, Гц)
№
Х
CH3
С3Н
С6Н
CH3
Н4
Н5
(C2H)
Н3'
H3''
H6'
H6''
3
Н
1.76 с
1.73 с
2.82 д. д
2.78 д. д
2.67 д. д
2.28 д. д
4.99 д. т
3.97 д. д
(3JH3ʹH4 = 5.8,
(3JH3ʹʹH4 = 5.8,
(3JH6ʹH5 = 7.2,
(3JH6ʹʹH5 = 7.2,
(3JH3ʹH4 =
(3J H5H6ʹ =
2JH3ʹH3ʹʹ = 16.2)
2JH3ʹH3ʹʹ =16.2)
2JH6ʹH6ʹʹ = 16.3)
2JH6ʹH6ʹʹ = 16.3)
3JH3ʹʹH4 = 5.8,
3J H5H6ʹʹ = 7.2,
3JH4H5 = 5.5)
3J H4H5 = 5.5)
4
Br
1.83 с
1.82 с
3.38 д
3.26 д
2.96 д. д
2.64 д. д
-
3.92 м
(2JH3ʹH3ʹʹ =
(2JH3ʹH3ʹʹ = 18.0)
(2JH6ʹH6ʹʹ = 14.3,
(2JH6ʹH6ʹʹ =
18.0)
3JJH6ʹH5 = 6.2)
14.3, 3JH6ʹʹH5 =
10.3)
11а
Н
1.76 с
(5.46 м)
2.92 д. д
2.80 д. д
2.67 д. д
2.38 д. д
5.10 м
3.98 м
(3JH3ʹH4 = 7.9,
(3JH3ʹʹH4 = 7.9,
(3JH6ʹʹH5 = 6.1,
(3JH6ʹʹH5 = 6.1,
2JH3ʹH3ʹʹ = 16.8)
2JH3ʹH3ʹʹ = 16.8)
2JH6ʹH6ʹʹ = 17.1)
2JH6ʹH6ʹʹ = 17.1)
11б
1.81 с
(5.63 м)
2.90 м
2.80 м
3.20-3.65 м
3.94 м
5.02 м
12а
Br
1.76 с
(5.48 м)
3.12 д. д
3.08 д. д
2.67 д. д
2.84 д. д
-
3.94 м
(3JH3ʹH4 = 5.8,
(3JH3ʹʹH4 = 5.8,
(3JH6ʹH5 = 6.4,
(3JH6ʹʹH5 = 6.4,
2JH3ʹH3ʹʹ = 15.3)
2JH3ʹH3ʹʹ = 15.3)
2JH6ʹH6ʹʹ = 18.3)
2JH6ʹH6ʹʹ = 18.3)
12б
1.86 с
(5.30 м)
3.22 м
2.94 м
3.82 м
2.88 м
4.02 м
-
Таблица 3. Данные спектроскопии ЯМР 1Н для дибромнитроциклогексанов 9, 10, 15, 16
δ, м. д. (J, Гц)
№
R1
R2
X
H1 (СН3)
H2 (СН3)
H3
H4
H5
H6
9
СН3
СН3
Н
(2.06 с)
(2.13 с)
2.95 д. д,
5.32 д. т
3.92 д. т
2.66 д. д
3.15 д. д
(3JH4H5 = 4.9,
(3JH4H5 = 4.9,
(2JH6ʹH6ʹʹ = 15.6,
(2JH3ʹH3ʹʹ = 15.6,
3JH4H3ʹ = 6.2,
3JH5H6ʹ = 7.1,
3JH6ʹH5 = 7.1,
3JH3ʹH4 = 6.2,
3JH4H3ʹʹ = 6.2)
3JH5H6ʹʹ = 7.1)
3JH6ʹʹH5 = 7.1)
3JH3ʹʹH4 = 6.2)
10
СН3
СН3
Br
(2.13 с)
(2.15 с)
3.86 м
-
3.98 м
3.20 м
15а
Н
СН3
3.90 м
(2.08)
3.00 м
5.00 м
3.90 м
2.60 м
15б
СН3
Н
H
(2.10 с)
3.90 м
3.00 м
5.10 м
3.92 м
2.60 м
16а
Н
СН3
3.90 м
(2.26 с)
3.25 м
-
3.90 м
2.92 м
16б
СН3
Н
Br
(2.25 с)
3.90 м
3.11 м
-
3.95 м
2.61 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ- И 1-НИТРО-1,3,3,3-ТЕТР
АБРОМПРОП-1-ЕНОВ
1177
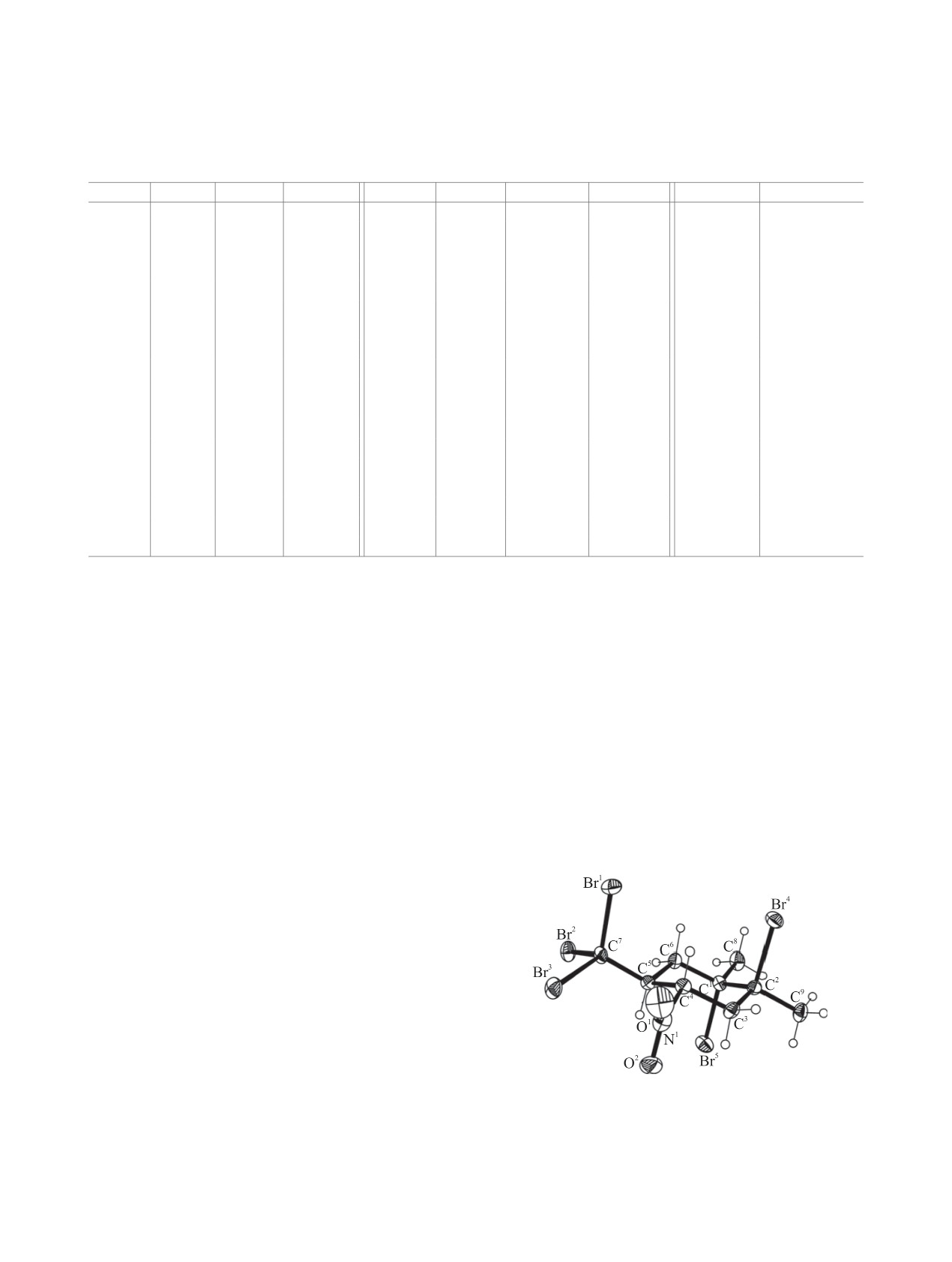
Таблица 4. Длины связей, валентные и торсионные углы в молекуле в молекуле 1,2-дибром-5-(трибромметил)-1,2-ди-
метил-4-нитроциклогексана 9
Связь
d
Угол
ω
Угол
ω
Угол
τ
Угол
τ
Br1-C7
1.952(7)
O1N1O2
124.7(7)
Br1C7Br3
107.3(4)
C1C2C3C4
-50.4(8)
C6C5C7Br3
171.8(5)
Br2-C7
1.956(7)
O1N1C4
117.1(7)
Br1C7C5
112.0(5)
C2C3C4C5
53.2(8)
Br5C1C6C5
63.6(7)
Br3-C7
1.939(6)
O2N1C4
118.1(6)
Br4C2C1
106.7(4)
C3C4C5C6
-51.2(7)
C8C1C6C5
178.5(6)
Br4-C2
2.010(7)
C4C5C6
108.0(5)
C3C2C9
111.5(6)
C4C5C6C1
51.9(8)
C3C2C1Br5
-67.2(6)
Br5-С1
2.003(7)
C4C5C7
114.6(5)
C1C2C3
111.0(6)
C2C1C6C5
-52.9(8)
C3C2C1C8
175.6(6)
O1-N1
1.224(9)
C6C5C7
111.3(5)
Br5C1C2
106.8(5)
C3C2C1C6
49.1(8)
C9C2C1Br5
60.7(7)
O2-N1
1.214(9)
Br5C1C8
106.3(5)
Br5C1C6
106.4(5)
C4C3C2Br4
65.1(7)
C9C2C1C6
177.0(6)
N1-C4
1.527(9)
C2C1C6
112.6(6)
Br2C7Br3
105.2(4)
C4C3C2C9
179.6(6)
C9C2C1C8
-56.5(9)
C4-C5
1.546(9)
C2C1C8
114.3(6)
Br2C7C5
111.0(5)
N1C4C3C2
175.3(6)
Br4C2C1Br5
177.7(3)
C5-C6
1.545(9)
C6C1C8
110.2(6)
Br3C7C5
113.2(5)
C6C5C4N1
-168.1(6)
Br4C2C1C6
-66.1(6)
C5-C7
1.53(1)
N1C4C5
112.3(6)
C1C2C9
115.2(6)
C7C5C4N1
67.3(7)
Br4C2C1C8
60.4(7)
C3-C4
1.50(1)
N1C4C3
103.1(5)
C7C5C4C3
-175.8(6)
C5C4N1O1
57.8(8)
C2-C3
1.53(1)
C3C4C5
114.0(6)
C7C5C6C1
178.4(6)
C5C4N1O2
-126.1(7)
C2 - C9
1.54(1)
C2C3C4
114.7(6)
C4C5C7Br1
56.1(6)
C3C4N1O1
-65.4(8)
C1-С2
1.53(1)
Br4C2C3
106.1(5)
C4C5C7Br2
176.4(4)
C3C4N1O2
110.7(8)
C1-С8
1.516(9)
Br4C2C9
105.7(5)
C4C5C7Br3
-65.4(7)
C1-С6
1.53(1)
C1C6C5
115.3(5)
C6C5C7Br1
-66.7(6)
C2-C3
1.53(1)
Br1C7Br2
107.8(4)
C6C5C7Br2
53.6(7)
В спектрах ЯМР 1Н циклогексенов 11 и 12
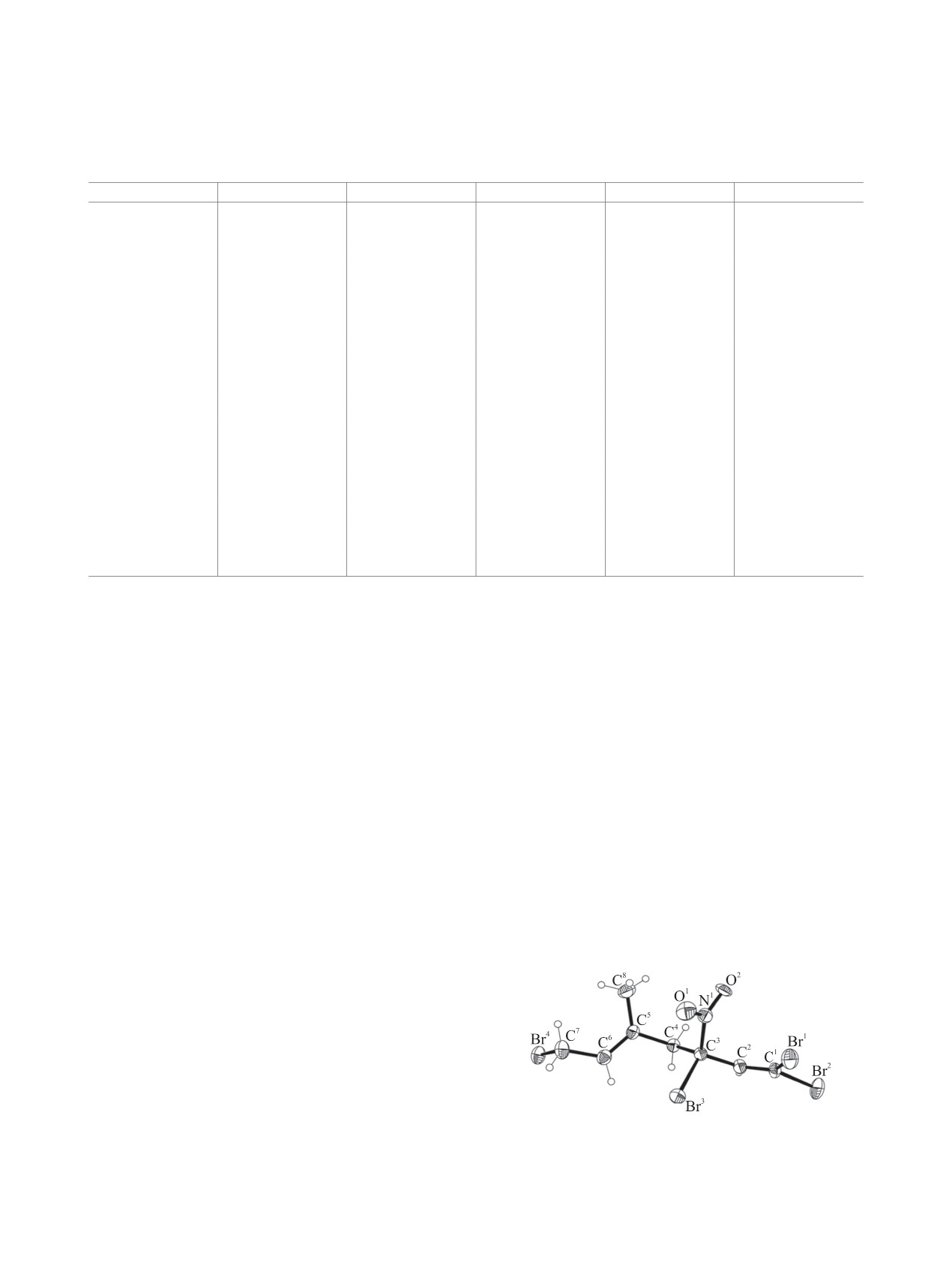
Молекулярная структура соединения 9 под-
олефиновые протоны проявляются в диапазоне
тверждена методом рентгеноструктурного ана-
5.30-5.63 м. д. По положению сигнала метиль-
лиза (табл. 4). В молекуле соединения 9 ше-
ных групп идентифицировали региоизомеры а и б
стичленный цикл принимает конформацию
циклогесенов 11 и 12. Сигнал группы СН3 в изо-
уплощенного кресла (рис. 1), абсолютные значе-
мере б закономерно проявляется в более слабом
ния внутрициклических торсионных углов лежат
поле (1.81 и 1.86 м. д.) по сравнению с сигналом
в пределах 49.1(8)-53.2(8)° (табл. 4). Вицинальные
(1.76 м. д.) изомера а.
атомы брома у атомов С1, С2 находятся в аксиаль-
ном положении (анти-конформация), торсионный
В спектрах ЯМР 1Н нитроциклогексанов 9, 10,
угол Br4С2С5Br5 равен 177.7(3)°. Группы NO2 и
15 и 16 (табл. 3), как и в спектрах соответствую-
CBr3 при атомах С4, С5 лежат в экваториальной
щих нитроциклогексенов 3, 4, 11 и 12 (табл. 2),
плоскости в гош-конформациии, торсионный угол
сигналы метиновых Н4, Н5 и метиленовых Н3ʹ,
N1C4C5C7 67.3(7)°. гош-Конформациия заторможе-
Н3ʹʹ, Н6ʹ, Н6ʹʹ протонов проявляются в виде муль-
типлетов. Протоны метиленовых групп этих сое-
динений резонируют в диапазоне 2.60-3.86 м. д.
с геминальной константой 14.3-15.6 Гц. Сигналы
нитрометиновых протонов Н4 в циклогексанах 9,
15 резонируют в более слабом поле 5.00-5.32 м. д.
по сравнению с сигналами метиновых протонов
Н5 при 3.90-3.92 м. д. Значение вицинальной кон-
станты 3JН4Н5 = 4.9 Гц в спектре соединения 9 сви-
детельствует об анти-расположении групп NO2 и
CBr3 относительно связи С4-С5 и об их аксиаль-
ной ориентации. Сигналы геминальных к атомам
Br метильных групп находятся в слабом поле
(2.06-2.26 м. д.), как и сигналы метильных групп в
Рис. 1. Общий вид молекулы 1,2-дибром-5-(трибромме-
тил)-1,2-диметил-4-нитроциклогексана 9 в кристалле.
ароматических соединениях [27].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1178
АНИСИМОВА и др.
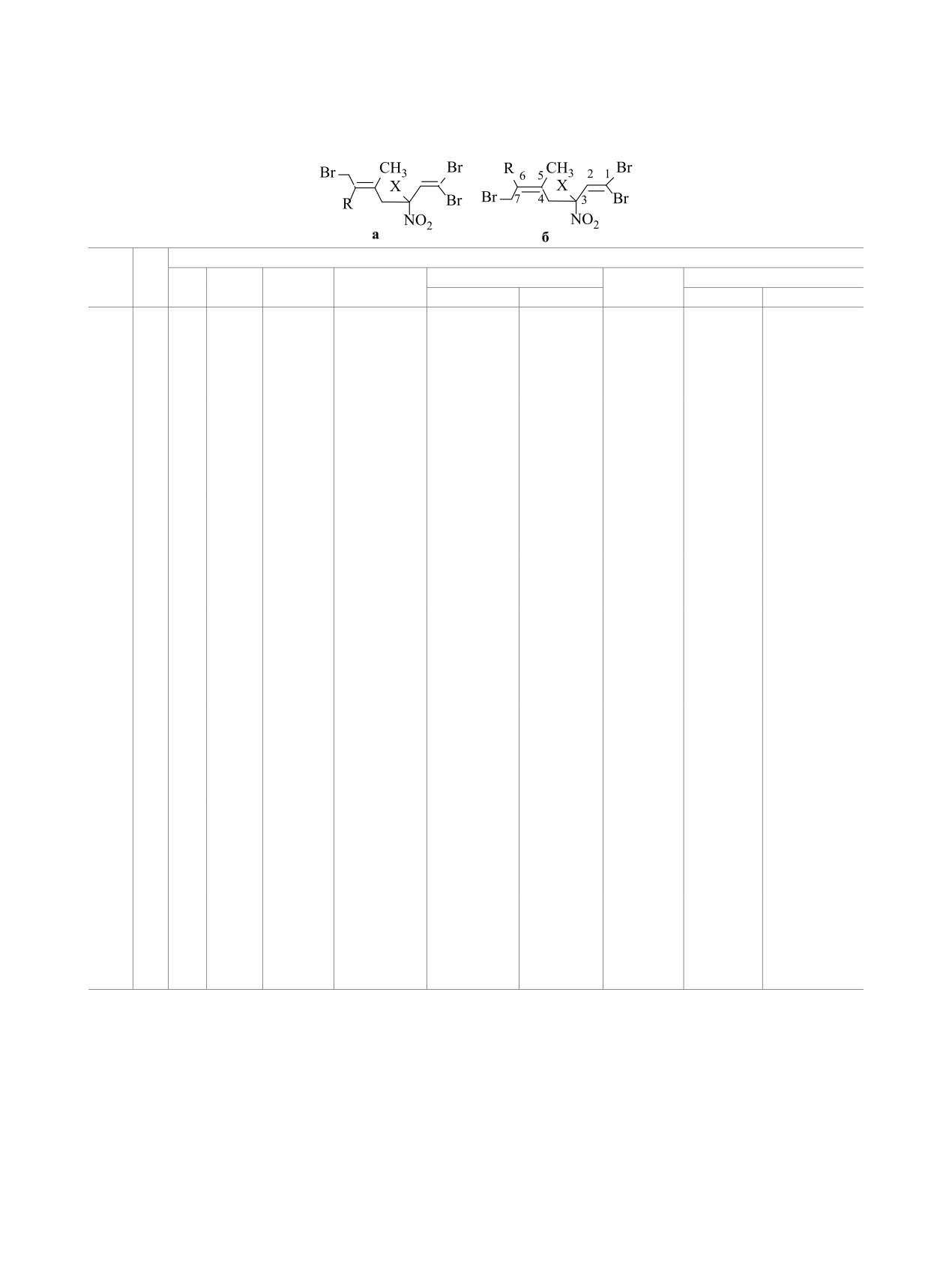
Tаблица 5. Данные спектроскопии ЯМР 1Н для гептадиенов 5, 6, 13, 14
δ, м. д. (J, Гц)
6
№
Х
Н4
Н
Н7
R
СН
3
Н2
Н3
Нʹ
Нʹʹ
(СН3)
Нʹ
Нʹʹ
5а
Н
СН3
1.81 с
6.71 д
5.24 д. д
2.94 д. д
2.65 д. д
(1.70 с)
3.95 д
3.82 д
(
3JH2H3 =
(3JH3H4ʹ =
(3JH3H4ʹ =
(
3JH3H4ʹʹ =
(
2JH7H7ʹʹ =
(2JH7H7ʹʹ =
9.2)
16.8,
16.8,
7.3,
9.8)
9.8)
3JH2H3 = 9.2)
2JH4ʹH4ʹʹ =
2JH4ʹH4ʹʹ =
13.7)
13.7)
5б
1.76 с
6.80 д
5.30 д. д
2.94 д. д
2.65 д. д
(1.80 с)
4.01 д
3.80 д
(
3JH2H3 =
(3JH3H4ʹ =
(3JH3H4ʹ =
(
3JH3H4ʹʹ =
(
2JH7H7ʹʹ =
(2JH7H7ʹʹ =
9.2)
16.8,
16.8,
6.9,
10.4)
10.4)
3JH2H3 = 9.2)
2JH4ʹH4ʹʹ =
2JH4ʹH4ʹʹ =
13.7)
14.4)
6а
Br
CH3
1.83 с
7.34 с
-
3.58 д
3.37 д
(1.85 с)
3.95 м
3.85 м
(
2JH4ʹH4ʹʹ =
(
2JH4ʹH4ʹʹ =
16.6
16.6)
6б
1.80 с
7.32 с
-
3.46 д
3.29 д
(1.83 с)
3.95 м
3.85 м
(
2JH4ʹH4ʹʹ =
(
2JH4ʹH4ʹʹ =
17.9)
17.9)
13а
Н
Н
1.81 с
6.68 д
5.24 д. д
2.84 д. д
2.61 д. д
5.63 д. д
3.81 д. д
3.88 д. д
(
3JH2H3 =
(3JH3H4ʹ =
3JH3H4ʹ =
(
3JH3H4ʹʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹʹ = 8.9,
9.2)
15.3,
15.3,
8.2,
8.5,
8.5,
2JH7H7ʹʹ =
3JH2H3 = 9.2
2JH4ʹH4ʹʹ =
2JH4ʹH4ʹʹ =
3JH6H7ʹʹ =
2JH7H7ʹʹ =
10.4)
14.2)
14.2)
8.9
11.4)
13б
1.77 с
6.70 д
5.50 д. д
2.84 д. д
2.72 д. д
5.36 д. д
3.94 д. д
3.88 д. д
(
3JH2H3 =
(3JH3H4ʹ =
(3JH3H4ʹ =
(
3JH3H4ʹʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹʹ = 8.9,
9.2)
15.7,
15.3,
6.7,
9.2,
9.2,
2JH7H7ʹʹ =
3JH2H3 = 9.2)
2JH4ʹH4ʹʹ =
2JH4ʹH4ʹʹ =
3JH6H7ʹ =
2JH7H7ʹʹ =
12.5)
14.3)
14.3)
8.9)
12.5)
14а
Br
Н
1.78 с
7.29 с
-
3.55 д
3.36 д
5.66 д. д
3.90 д
3.88 д
(
2JH4ʹH4ʹʹ =
(
2JH4ʹH4ʹʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹ =
(3JH6H7ʹʹ =
14.5)
14.5)
8.4,
8.4)
8.4)
3JH6H7ʹʹ =
8.4)
14б
1.81 с
7.09 с
-
3.20 д
2.92 д
5.60 д. д
3.90 д
3.80 д
(
2JH4ʹH4ʹʹ =
(
2JH4ʹH4ʹʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹ =
(
3JH6H7ʹ = 8.7)
14.3)
14.5)
8.5,
8.5)
3JH6H7ʹ =
8.7)
на благодаря сокращенным внутримолекулярным
В спектрах ЯМР 1Н, 13С гепта-1,5-диенов 5, 6,
контактам Br3∙∙∙O1 3.262(7) Å и Br3∙∙∙O2 3.366(7) Å.
13 и 14 (табл. 5) проявляются сигналы всех про-
В кристаллической структуре наблюдаются со-
тонов и ядер атомов углерода. В спектрах соеди-
кращенные контакты Br4∙∙∙Br5 3.604(1) Å и Br1∙∙∙О1
нений 5 и 13 cигналы метильных групп проявля-
3.249(7) Å. Суммы ван-дер-ваальсовых радиусов
ются в виде синглета в диапазоне 1.76-1.83 м. д.,
Br∙∙∙Br и Br∙∙∙О составляют 3.74 и 3.45 Å [28].
нитрометиновые протоны Н3 резонируют в обла-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ- И 1-НИТРО-1,3,3,3-ТЕТР
АБРОМПРОП-1-ЕНОВ
1179
Таблица 6. Длины связей, валентные и торсионные углы в молекуле 1,1,3,7-тетрабром-5-метил-3-нитрогеп-
та-1,5-диена 14а
Связь
d
Угол
ω
Угол
τ
Br1-C1
1.868(5)
O1N1O2
125.9(4)
O1N1C3Br3
170.9(3)
Br2-C1
1.890(5)
O1N1C3
113.9(4)
O1N1C3C2
51.7(5)
Br3-C3
1.956(5)
O2N1C3
119.8(4)
O1N1C3C4
-69.6(5)
Br4-C7
1.972(7)
Br1C1Br2
113.5(3)
O2N1C3Br3
-16.0(5)
O1-N1
1.237(5)
C4C5C6
118.3(5)
O2N1C3C2
-135.2(5)
O2-N1
1.219(5)
C4C5C8
117.5(4)
O2N1C3C4
103.5(5)
N1-C3
1.550(6)
C6C5C8
124.1(5)
Br1C1C2C3
-0.6(8)
C1-C2
1.305(7)
Br1C1C2
125.6(4)
Br2C1C2C3
177.4(4)
C3- C4
1.533(8)
Br2C1C2
120.9(4)
C1C2C3Br3
-72.1(6)
C2-C3
1.490(7)
Br3C3C2
109.0(3)
C1C2C3N1
46.4(7)
C4-C5
1.511(7)
C5C6C7
126.0(5)
C1C2C3C4
165.7(5)
C5-C6
1.338(7)
Br4C7C6
110.5(4)
Br3C3C4C5
59.2(5)
C5-C13
1.490(8)
C1C2C3
129.3(5)
N1C3C4C5
-58.3(5)
C6-C7
1.468(7)
Br3C3N1
107.7(3)
C2C3C4C5
-179.7(4)
Br3C3C4
110.8(3)
C3C4C5C6
-95.6(5))
N1C3C2
110.9(4)
C3C4C5C8
85.7(6)
N1C3C4
107.6(4)
C4C5C6C7
178.5(5)
C2C3C4
110.7(4)
C8C5C6C7
-3.0(8)
C3C4C5
117.4(4)
C5C6C7Br4
110.7(6)
сти 5.24-5.50 м. д. с характерными вицинальными
находятся в цис-положении относительно связи
константами с соседними протонами 3JН3Н2 = 9.2,
С5=С6, о чем свидетельствует величина торсион-
3JН3Н4ʹ = 15.3-16.8, 3JН3Н4ʹʹ = 6.7-8.4 Гц; сигналы
ного угла С7С6С5С8 -3.0(8)°. Кратная связь С1=С2
метиленовых протонов Н4ʹ, Н4ʹʹ проявляются в об-
несколько укорочена [1.305(7) Å] по сравнению со
ласти 2.61-2.94 м. д.
связью С5=С6 [1.340(7) Å].
В спектрах соединений 6 и 14 сигналы мети-
В спектрах ЯМР 13С гептадиенов 5а, б, 6а сиг-
леновых протонов Н4ʹ, Н4ʹʹ закономерно претер-
налы sp3-гибридизованных атомов имеют ши-
певают слабопольное смещение до 2.92-3.58 м. д.
рокий диапазон проявления. Cигналы атомов
Сигналы протонов группы СН2Br под влиянием
углерода метильных групп наодятся в диапазоне
соседнего атома брома проявлются в более слабом
16.73-18.54 м. д., атомов С7 - при 26.62-36.16 м. д.,
атомов С4 - при 38.29-51.16 м. д., атомов С3 - при
поле в области 3.80-4.01 м. д. с геминальной и ви-
85.85-92.70 м. д. Атомы углерода в sp2-гибридиза-
цинальной константами 2JНʹНʹʹ = 9.8-12.5 и 3JН6Н7 =
ции имеют более слабопольные сигналы в диапа-
8.4-9.2 Гц соответственно. Сигналы олефиновых
зоне 126.07-131.43 м. д.
протонов у атома С6 в спектрах соединений 13 и
14 проявляются в области 5.36-5.66 м. д., а сиг-
В спектрах ЯМР 1Н гекса-1,5-диенов 7 и 8 при-
налы протонов у атома углерода С2 под влиянием
сутствуют сигналы всех структурных фрагментов
NO2-группы cмещаются в область 6.68-6.80 м. д.
(3JН2Н3 = 9.2 Гц) в спектрах соединений 5 и 13.
В спектрах бромзамещенных диенов 6 и 14 эти
протоны проявляются синглетами в области 7.09-
7.34 м. д. В спектре соединения 14а диастерео-
топные протоны метиленовой группы закономер-
но проявляются в виде двух дублетов при 3.36 и
3.55 м. д. с геминальной константой 14.5 Гц.
По данным рентгеноструктурного анализа, сое-
Рис. 2. Общий вид молекулы 14а в кристалле.
динения 14а (рис. 2, табл. 6) группы СН3 и СН2Br
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1180
АНИСИМОВА и др.
молекул. В спектре соединения 7 наблюдается удво-
дов рассчитаны геометрически, параметры атомов
ение сигналов олефиновых (Н2, Н5) и нитрометино-
Н уточняли в изотропном приближении в модели
вых (Н3, Н4) протонов, резонирующих в виде муль-
наездника.
типлетов в диапазоне 7.20-7.50 и 4.10-4.40 м. д.
Монокристаллы соединения 9 моноклинные,
соответственно с вицинальными константами
C9H12Br5NO2, M 565.75, пространственная группа
JН2Н3 = 7.3 и JН4Н5 = 7.2 Гц. Константа 3JН3Н4 =
P21/n, a = 9.0138(3), b = 12.2436(4), c = 13.8035(6) Å,
15.0 Гц свидетельствует об анти-конформации
β = 104.149(2)°, V = 1477.16(9) Å3, Z = 4, dвыч =
этиленовых фрагментов относительно связи С3-С4.
2.544 г/cм3, μ(MoKα) = 13.592 мм-1, размер образца
Таким образом, вицинально замещенные ни-
0.56 × 0.28 × 0.12 мм3, трансмиссия 0.0303 0.0941,
тро- и гем-бромнитроалкены с группой CBr3 в
F(000) = 1056, измерено 14758 отражений в интер-
своем составе реагируют с алифатическими дие-
вале θ 2.3-27.0°, -11 ≤ h ≤ 11, -15 ≤ k ≤ 15, -17 ≤
нами (2,3-диметилбута-1,3-диеном и изопреном),
l ≤ 17, полнота 99.6%, 3235 независимых отраже-
в отличие от 1-нитро- и 1-бром-1-нитро-3,3,3-три-
ний (Rint = 0.072, 156 параметров), 2424 наблюдае-
фтор(трихлор)проп-1-енa, по двум конкурирую-
мых отражений [R = 0.0516, I > 2σ(I)], wR2 = 0.1371
щим направлениям и образуют продукты диено-
для всех независимых отражений, GOOF 1.074,
вого синтеза и радикального 1,4-присоединения
остаточная электронная плотность 1.32 /-1.08 e/A3.
нитроалкена к 1,3-диенам.
Монокристаллы соединения 14а моноклинные,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
C8H9Br4NO2, M 470.76, пространственная группа
P21/с, a = 13.498(1), b = 6.1309(4), c = 16.641(1)
Спектры ЯМР1Н,
13С{1Н},
1Н-13С HMQC,
Å, β = 106.464(3)°, V = 1320.7(2) Å3, Z = 4, dвыч =
1Н-13С HMBC регистрировали на спектрометре
2.368 г/cм3, μ(MoKα) = 12.170 мм-1, размер образ-
Jeol ECX400A с рабочими частотами 100.52 (13С) и
ца 0.23 × 0.11 × 0.10, трансмиссия 0.1279 0.2597,
399.78 МГц (1Н) в дейтерохлороформе-d с исполь-
F(000) = 880, измерено 24189 отражений в интер-
зованием остаточного сигнала недейтерированно-
вале θ = 1.6-26.0°, -16 ≤ h ≤ 16, -7 ≤ k ≤ 7, -20 ≤
го растворителя в качестве внутреннего стандар-
l ≤ 20, полнота 99.7%, 2613 независимых отраже-
та. ИК спектры получали на Фурье-спектрометре
ний (Rint = 0.058, 145 параметров, 9 ограничений),
Shimadzu IR Prestige-21 для растворов образцов в
1933 наблюдаемых отражений [R = 0.0335, I >
хлороформе. Индивидуальные соединения выде-
2σ(I)], wR2 = 0.1143 для всех независимых отраже-
ляли методом колоночной хроматографии на сили-
ний, GOOF 1.127, остаточная электронная плот-
кагеле марки Сhemapol 100/200 c использованием
ность 0.70/-0.80 e/A3.
растворителей по методике [29]. Анализ методом
Атомные координаты, длины связей и углы мо-
ТСХ проводили на пластинах Silufol-254 в смеси
лекул соединений 9 и 14а депонированы в Кем-
гексан-ацетон (3:2), проявитель - УФ лампа. Со-
бриджскую базу структурных данных [32] [CCDC
отношение изомеров определяли с помощью спек-
1996964 (14а) и 1996965 (9)].
троскопии ЯМР 1Н до проведения колоночного
хроматографирования.
Нитроалкены 1, 2 получали по известным ли-
тературным методикам [33-35].
Рентгеноструктурный анализ монокристаллов
соединений 9 и 14а, выращенных из гексана, вы-
1,2-Диметил-5-(трибромметил)-4-нитро-
полнен в группе рентгеноструктурного анализа
циклогекс-1-ен
(3),
1,1,7-трибром-5,6-ди-
Центра спектральной информации Новосибир-
метил-3-нитрогепта-1,5-диены
(5а,
б),
ского института органической химии им. Н.Н.
1,2-дибром-5-(трибромметил)-1,2-диметил-
Ворожцова СО РАН при 296(2) K на дифрактоме-
4-нитроциклогексан
(9),
1,1,6,6-тетрабром-
тре Bruker Kappa APEX II (MoKα-излучение, гра-
3,4-динитрогекса-1,5-диен (7). a. К раствору 1.00 г
фитовый монохроматор, CCD-детектор). Введена
(0.003 моль)
1-нитро-3,3,3-трибромпроп-1-eна
поправка на поглощение по программе SADABS
1 в 5 мл абсолютного бензола прибавляли 0.38 г
[30]. Cтруктуры расшифровывали прямым мето-
(0.0045 моль) 2,3-диметилбута-1,3-диена. Полу-
дом по программе SHELXS-97 [31] и уточняли в
ченную смесь выдерживали при 20°С в течение
анизотропно-изотропном (для Н) приближении
8 сут. Образовавшиеся кристаллы отфильтровы-
по программе SHELXL-97 [31]. Позиции водоро-
вали и получали 0.86 г (51%) соединения 9, т. пл.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ- И 1-НИТРО-1,3,3,3-ТЕТР
АБРОМПРОП-1-ЕНОВ
1181
128-129°С (разл.). Найдено, %: С 19.13; Н 2.14; N
%: C 11.18; H 0.33; N 4.36. C6H2Br6N2O4. Вычисле-
2.50. С9Н12Br5NO2. Вычислено, %: С 19.11; Н 2.14;
но, %: C 11.16; H 0.31; N 4.34.
N 2.48.
Повторным хроматографированием смеси сое-
Фильтрат упаривали, остаток хроматографиро-
динений 6а, б и 4 из гексановой фракции получали
вали на силикагеле, элюенты - гексан, ССl4, бензол.
0.54 г (45%) гептадиенов 6а и 6б в соотношении
Из раствора в гексане выделяли 0.14 г (11%) геп-
3:1, Rf 0.78, 0.65. Найдено, %: С 22.32; Н 2.31; N
тадиенов 5а и 5б в соотношении 4:1, Rf 0.85, 0.74.
2.87. С9Н11Br4NO2. Вычислено, %: С 22.30; Н 2.29;
Найдено, %: С 26.61; Н 2.98; N 3.43. С9Н12Br3NO2.
N 2.89.
Вычислено, %: С 26.63; Н 2.98; N 3.45.
1-Метил-5(4)-трибромметил-4(5)-ни-
Из раствора в ССl4 выделяли 0.07 г смеси гепта-
троциклогекс-1-ены
(11а,
б),
1,1,7-три-
диенов 5а, б и гексадиена 7. Из раствора в бензоле
бром-5-метил-3-нитрогепта-1,5-диены
(13а,
выделяли 0.1 г (8%) cоединения 3, Rf 0.62. Найде-
б),
1,2-дибром-1-метил-4(5)-нитро-5(4)-три-
но, %: С 26.63; Н 2.95; N 3.42. С9Н12Br3NO2. Вы-
бромметилциклогексаны
(15а, б),
1,1,6,6-те-
числено, %: С 26.63; Н 2.98; N 3.45.
трабром-3,4-динитрогекса-1,5-диен
(7). Реак-
б. К раствору
1.00 г
(0.003 моль)
1-ни-
цию 1.00 г (0.003 моль) нитроалкена 1 и 0.31 г
ро-3,3,3-трибромпроп-1-ена 1 в 5 мл абсолютного
(0.0045 моль) 2-метилбута-1,3-диена проводили
бензола прибавляли 0.38 г (0.0045 моль) 2,3-диме-
аналогично. Из первой гексановой фракции
тилбута-1,3-диена и облучали 7 ч УФ лампой (λ =
выделяли 0.75 г смеси соединений 11а, б и 15а, б.
365 нм) при 20°С. Реакционную смесь упарива-
Четыреххлористым углеродом элюировали 0.20 г
ли, остаток хроматографировали на силикагеле.
(17%) диенов 13а и 13б, 1:1, Rf 0.56, 0.41. Найдено,
Элюировали гексаном, ССl4, CHCl3. Из раствора
%: C 24.54; Н 2.57; N 3.59. С8Н10Br3NO2. Вычисле-
в гексане выделяли 0.60 г (48%) гепта-1,5-диенов
но, %: C 24.52; H 2.57; N 3.57.
5а и 5б в соотношении 5:1, Rf 0.85, 0.74. Из раство-
Из бензольной фракции выделяли 0.11 г смеси
ра в ССl4 выделяли 0.22 г смеси соединений 5а,
гепта-1,5- и гекса-1,5-диенов 13а, б и 7.
б и 7. Из раствора в CHCl3 получали 0.12 г (23%)
Повторным хроматографированием смеси со-
гекса-1,5-диена 7, Rf 0.68. Найдено, %: С 14.80; H
единений 11а, б и 15а, б из гексановой фракции
0.84; N 5.74. C6H4Br4N2O4. Вычислено, %: C 14.78;
получали 0.63 г (38%) циклогексанов 15а, б, Rf
H 0.83; N 5.74.
0.70, 0.65. Найдено, %: С 17.44; Н 1.80; N 2.57.
Повторным хроматографированием смеси сое-
С8Н10Br5NO2. Вычислено, %: С 17.42; Н 1.83; N 2.54.
динений 5а, б получили 0.42 г (33%) гептадиена
4(5)-Бром-1-метил-5(4)-трибромметил-
5а, Rf 0.85. Найдено, %: С 26.60; Н 3.00; N 3.48.
4(5)-нитроциклогекс-1-ены
(12а, б),
1,1,3,7-
С9Н12Br3NO2. Вычислено, %: С 26.63; Н 2.98; N
тетрабром-5-метил-3-нитрогепта-1,5-дие-
3.45.
ны
(14а, б),
1,2,5-трибром-4-(бромметил)-
4-Бром-1,2-диметил-4-нитро-5-трибром-
1-метил-5-нитроциклогексаны
(16а,
б),
метилциклогекс-1-ен
(4),
1,1,3,7-тетра-
1,1,3,4,6,6-гексабром-3,4-динитрогекса-1,5-ди-
бром-5,6-диметил-3-нитрогепта-1,5-диены
(6а,
ен (8). Реакцию 1.00 г (0.0025 моль) нитроалкена
б),
1,2,4-трибром-5-(трибромметил)-1,2-диме-
2 и 0.31 г (0.0045 моль) 2-метилбута-1,3-диена
тил-4-нитроциклогексан
(10),
1,1,3,4,6,6-гек-
проводили аналогично. Реакционную смесь хро-
сабром-3,4-динитрогекса-1,5-диен
(8).
Реак-
матографировали на силикагеле, элюенты - гек-
цию 1.00 г (0.0025 моль) нитроалкена 2 и 0.38 г
сан, ССl4, бензол. Из раствора в гексане выделяли
(0.0045 моль) 2,3-диметилбута-1,3-диена проводи-
0.25 г смеси соединений 12а, б и 16а, б. Из рас-
ли по вышеописанной методике. Из раствора в гек-
твора в ССl4 выделяли 0.74 г (63%) смеси диенов
сане выделяли 0.29 г (18%) соединения 10, Rf 0.81.
14а и 14б, 10:1. Бензолом элюировали 0.08 г (5%)
Найдено, %: С 16.79; Н 1.70; N 2.16. С9Н11Br6NO2.
гексадиена 8. Повторным хроматографировани-
Вычислено, %: С 16.77; Н 1.72; N 2.17.
ем смеси соединений 14а, б получали 0.5 г (42%)
Из раствора в ССl4 выделяли 0.72 г смеси сое-
диена 14а, т. пл. 70-72°С. Найдено, %: С 20.43; Н
динений 6а, б и 4. Из бензольной фракции получа-
1.93; N 2.99. С8Н9Br4NO2. Вычислено, %: С 20.41;
ли 0.08 г (16%) гекса-1,5-диена 8, Rf 0.61. Найдено,
Н 1.93; N 2.98.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1182
АНИСИМОВА и др.
Повторным хроматографированием смеси со-
S0040-4020 (00)00011-9
единений 14а, б и 16а, б получали 0.16 г (10%)
11. Burkett H., Wright W. // J. Org. Chem. 1960. Vol. 25.
циклогексанов 16а, б, Rf 0.64, 0.57. Найдено, %: С
N 2. P. 276. doi 10.1021/jo01072a614
12. Ono N., Kamimura A., Kaji A. // J. Org. Chem. 1988.
15.28; Н 1.42; N 2.24. С8Н9Br6NO2. Вычислено, %:
Vol. 53. N 2. P. 251. doi 10.1021/jo00237a005
С 15.24; Н 1.44; N 2.22.
13. Albertini E., Barco S., Benetti S., De Risi C., Pol-
БЛАГОДАРНОСТЬ
lini G.P., Romagnoli R., Zanirato V. // Tetrahedron
Lett. 1994. Vol. 35. N 49. P. 9297. doi 10.1016/0040-
Спектры ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC,
4039(94)88492-7
1Н-13С HMBC и ИК спектры получены в Центре
14. Habermann J., Ley S.V., Scott J.S. // J. Chem. Soc.
коллективного пользования спектроаналитическо-
Perkin Trans. 1. 1999. N 10. P. 1253. doi 10.1039/
го центра Российского государственного педаго-
A901802F
гического университета им. А.И. Герцена. Авторы
15. Barltrop J.A., Nicholson J.S. // J. Chem. Soc. 1951.
выражают благодарность Химическому исследо-
P. 2524. doi 10.1039/ JR9510002524.
вательскому центру коллективного пользования
16. Дудинская А.А., Швехгеймер Г.А., Новиков С.С., Сло-
СО РАН за проведение спектральных и аналити-
вецкий В.И. // Изв. АН СССР. Сер. хим. 1961. № 3.
ческих измерений.
С. 524; Dudinskaya A.A., Shvekhgeimer G.A., Novi-
kov S.S. // Russ. Chem. Bull. 1961. Vol. 10. N 3. P. 484.
КОНФЛИКТ ИНТЕРЕСОВ
doi 10.1007/ BF01131073
Авторы заявляют об отсутствии конфликта
17. Дудинская А.А., Швехгеймер Г.А., Новиков С.С. //
Изв. АН СССР. Сер. хим. 1961. № 3. С. 522;
интересов.
Dudinskaya A.A., Shvekhgeimer G.A., Novikov S.S. //
СПИСОК ЛИТЕРАТУРЫ
Russ. Chem. Bull. 1961. Vol. 10. N 3. P. 482. doi
10.1007/BF01131072
1. Ono N. The Nitro Group in organic synthesis. Organic
18. Дудинская А.А., Новиков С.С., Швехгеймер Г.А. //
Nitro Chem. Ser. New York: VCH, 2001. P. 372.
Изв. АН СССР. Сер. хим. 1965. С. 2024; Dudin-
2. Perekalin V.V., Lipina E.S., Berestovitskaya V.M.,
skaya A.A., Novikov S.S., Shvekhgeimer G.A. // Russ.
Efremov D.A. Nitroalkenes. Conjugated Nitro
Chem. Bull. 1965. Vol. 14. N 11. P 1988. doi 10.1007/
Compounds. Chichester: John Wiley and Sons, 1994.
BF00845896
256 p.
3. Nakai K., Kamoshita M., Doi T., Yamada H., Taka-
19. Анисимова Н.А., Слободчикова Е.К., Берестовиц-
hashi T. // Tetrahedron Lett. 2001. Vol. 42. N 44.
кая В.М., Иванова М.Е., Кужаева А.А., Рыбало-
P. 7855. doi 10.1016/ S0040-4039(01)01655-0
ва Т.В. // ЖОХ. 2018. Т. 88. Вып. 5. С. 738; Anisimo-
4. Poigny S., Nouri S., Chiaroni A., Guyot M., Samadi M. //
va N.A., Slobodchikova E. K., Berestovitskaya V.M.,
J. Org. Chem. 2001. Vol. 66. N 22. P. 7263. doi 10.1021/
Ivanova M.E., Kuzhaeva A.A., Rybalova T.V. // Russ.
jo010154c
J. Gen. Chem. 2018. Vol. 88. N 5. P. 738. doi 10.1134/
5. Carballares S., Craig D., Lane C.A.L., MacKenzie A.R.,
S1070363218050079
Mitchell W.P., Wood A. // Chem. Commun. 2000. N 18.
20. Васильева Т.Т., Достовалова В.И., Германова Л.Ф.,
Р. 1767. doi 10.1039/B005533F
Нелюбин Б.В. // Изв. АН СССР. Сер. хим. 1984.
6. Jwamatsu S., Matsubara K., Nagashima H. // J. Org.
N. 8. С. 1810.
Chem. 1999. Vol. 64. N 26. P. 9625. doi 10.1021/
21. Васильева Т.Т., Кочеткова В.А., Достовалова В.И.,
jo9912146
Нелюбин Б.В., Фрейдлина Р.Х. // Изв. АН СССР. Сер.
7. Arce E., Carreno M.C., Cid M.B., Ruano J.L. // J.
хим. 1989. N. 11. С. 2558.
Org. Chem. 1994. Vol. 59. N 12. P. 3421. doi 10.1021/
22. Menezes F.G., Zucco H.G. // Quim. Nova. 2010. Vol.
jo00091a035
33. N 10. P. 2233.
8. Node M., Jmazato H., Kurosaki R., Kawano Y., Inoue T.,
23. Sahu B., Gururaja G.N., Mobin S.M., Namboothi-
Nishide K., Fuji K. // Heterocycles. 1996. Vol. 42. N 2.
ri I.N.N. // J. Org. Chem. 2009. Vol. 74. P. 2601.
P. 811. doi 10.3987/COM-95-S88
24. Brigmann G., Feineis D., Brückner R., Blank M.,
9. Chandler M., Conroy R., Cooper A.W.J., Lamont R.B.,
Peters K., Peters E.-M., Reichmann H., Janetzky B.,
Scicinski J.J., Smart J.E., Storer R., Weir N.G., Wil-
Grote C., Clement H.-W., Wesenmann W // Bioorg. Med.
son R.D., Wyatt P.G. // J. Chem. Soc., Perkin Trans. 1.
Chem. 2000. Vol. 8. P. 1467.
1995. N 9. P. 1189. doi 10.1039/ P19950001189
25. Кужаева А.А., Берестовицкая В.М., Дейко Л.И.,
10. Cere V., Montovani G., Peri F., Pollicino S., Ricci A. //
Анисимова Н.А., Беркова Г.А. // ЖОХ. 2002. Т. 72.
Tetrahedron. 2000. Vol. 56. N 9. P. 1225. doi 10.1016/
Вып. 10. С. 1752; Kuzhaeva A.A., Berestovits-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ВЗАИМОДЕЙСТВИЕ 1-НИТРО-3,3,3-ТРИБРОМ- И 1-НИТРО-1,3,3,3-ТЕТР
1183
АБРОМПРОП-1-ЕНОВ
kaya V.M., Deiko L.I., Anisimova N.A., Berkova G.A. //
University of Göttingen, Germany, 1996.
Russ. J. Gen. Chem. 2002. Vol. 72. N 10. P. 1652. doi
31. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
10.1023/A:1023360322616
P. 112. doi 10.1107/S0108767307043930
26. Берестовицкая В.М., Анисимова Н.А., Кужаева А.А.,
32. Allen F.H. // Acta Crystallogr. (B). 2002. Vol. 58. P. 380.
Беркова Г.А., Дейко Л.И. // ЖОХ. 2007. Т. 77. Вып. 1.
doi 10.1107/S0108768102003890
С. 29; Berestovitskaya V.M., Anisimova N.A.,
33. Durden J.A., Heywood D.L., Sousa A.A., Spurr H.W. // J.
Kuzhaeva A.A., Berkova G.A., Deiko L.I. // Russ. J.
Agr. Food Chem. 1970. Vol. 18. N 1. P. 50. doi 10.1021/
Gen. Chem. 2007. Vol. 77. N 1. P. 25. doi 10.1134/
jf60167a011
S1070363207010045
34. Dornow A., Muller A. // Chem. Ber. 1960. Bd 93. H. 1.
27. Преч Э., Бюльманн Ф., Аффольтер К. Определение
P. 32. doi 10.1002/cber.19600930108
строения органических соединений. М.: БИНОМ.
35. Анисимова Н.А., Слободчикова Е.К., Кужаева А.А.,
Лаборатория знаний, 2013. C. 438.
Стукань Е.В., Багрянская И.Ю., Берестовицкая В.М. //
28. Rowland R.S., Taylor R. // J. Phys. Chem. 1996.
ЖОрХ. 2016. Т. 52. Вып. 10. С. 1391; Anisimo-
Vol. 100. P. 7384.
29. Гордон А., Форд Р. Спутник химика. М.: Мир, 1978.
va N.A., Slobodchikova E.K., Kuzhaeva A.A., Stu-
С. 437.
kan’ E.V., Bagryanskaya I.Yu., Berestovitskaya V.M. //
30. Sheldrick G.M. SADABS, Program for area detector
Russ. J. Org. Chem. 2016. Vol. 52. N 10. P. 1379. doi
adsorption correction, Institute for Inorganic Chemistry,
10.1134/S1070428016100018
Reactions of 1-Nitro-3,3,3-tribromomethyl-
and 1-Nitro-1,3,3,3-tetrabromomethylpropenes
with Aliphatic Dienes
N. A. Anisimovaa,b,*, E. K. Slobodchikovaa, M. E. Ivanovac, T. V. Rybalovad,e
a Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
b St. Petersburg State University of Industrial Technologies and Design, St. Petersburg, 191186 Russia
c Altai State Agricultural University, Barnaul, 656049 Russia
d Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
e Novosibirsk State University, Novosibirsk, 630090 Russia
*e-mail: kohrgpu@yandex.ru
Received May 11, 2020; revised May 11, 2020; accepted May 20, 2020
The reaction of 1-nitro-3,3,3,-tribromomethyl- and 1-nitro-1,3,3,3-tetrabromomethylpropenes with 2,3-dimethyl-
and 2,3- dimethyl-1,3-butadienes afforded cyclohexenes, cyclohexanes and 1,5-heptadienes functionalized with
the nitro- and tribrommehyl groups. Structure of the resulting compounds was characterized by IR, NMR 1H, 13C
spectroscopy and X-ray diffraction analysis methods.
Keywords: 1-nitro-3,3,3-tribromoropropenes, cyclohexenes, cyclohexanes, 1,5-heptadienes, Diels-Alder re-
action, 1,4-addition
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020