ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1184-1189
К 80-летию со дня рождения В.М. Берестовицкой
УДК 547.332;547.391.1;547.8
АЛКИЛ-3-НИТРОАКРИЛАТЫ В РЕАКЦИЯХ С
ГЕТЕРОЦИКЛИЧЕСКИМИ СН-КИСЛОТАМИ
© 2020 г. В. В. Пелипко, М. А. Курицына, Р. И. Байчурин, С. В. Макаренко*
Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 6 мая 2020 г.
После доработки 6 мая 2020 г.
Принято к печати 16 мая 2020 г.
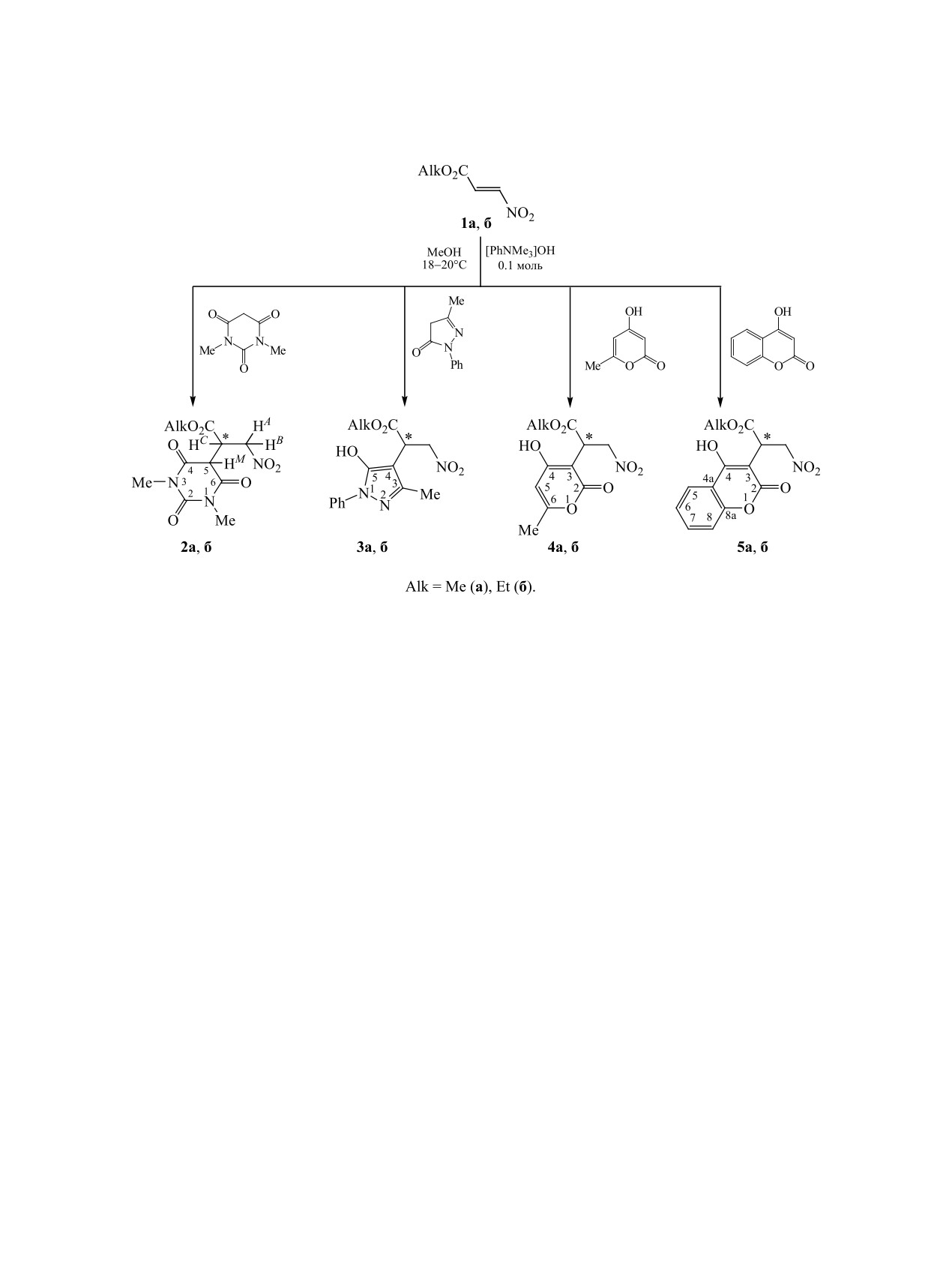
Взаимодействие алкил-3-нитроакрилатов с гетероциклическими СН-кислотами - 1,3-диметилпирими-
дин-2,4,6(1Н,3Н,5Н)-трионом, 5-метил-2-фенил-2,4-дигидро-3Н-пиразол-3-оном, 4-гидрокси-5-метил-
2Н-пиран-2-оном, 4-гидрокси-2Н-хромен-2-оном протекает в присутствии катализатора Родионова и
приводит к образованию аддуктов Михаэля, строение которых охарактеризовано методами спектроско-
пии ИК, ЯМР 1Н, 13С{1H}, 15N.
Ключевые слова: нитроакрилат, CH-кислота, катализатор Родионова, нуклеофильное присоединение,
аддукт Михаэля
DOI: 10.31857/S0044460X20080041
Продолжающиеся исследования непредельных
кислотой Мельдрума [17]. Катализатор Родионова
нитросоединений демонстрируют высокую зна-
(спиртовый раствор гидроксида триметилфени-
чимость этого класса веществ для развития тео-
ламмония [16]), как и другие четвертичные ана-
ретической органической химии и ее прикладных
логи [18-21], активно использовался в реакциях
аспектов [1-6]. Алкил-3-нитроакрилаты - ориги-
Михаэля в середине XX века. Представлялось це-
нальные представители сопряженных нитроал-
лесообразным изучить применение этого коммер-
кенов [6, 7]. Высокая электрофильность кратной
чески доступного катализатора в реакциях алкил-
связи С=С позволяет использовать их в качестве
3-нитроакрилатов с более широким рядом цикли-
эффективных субстратов в реакциях с нуклео-
ческих СН-кислот.
фильными реагентами [8-10].
Использование катализатора Родионова (0.1 моль)
Сведения о взаимодействии алкил-3-нитро-
в реакции алкил-3-нитроакрилатов 1a, б с 1,3-ди-
акрилатов с СН-кислотами носят фрагментарный
метилпиримидин-2,4,6(1Н,3Н,5Н)-трионом, 5-ме-
характер. 2-Фенилиндан-1,3-дион [11], трет-бу-
тил-2-фенил-2,4-дигидро-3Н-пиразол-3-оном,
тил-1-метил-3,5-диоксоциклогексан-1-карбокси-
4-гидрокси-5-метил-2Н-пиран-2-оном,
4-гидрок-
лат [12] и дигидрорезорцин [13] присоединяются к
си-2Н-хромен-2-оном в безводном метанолe по-
алкил-3-нитроакрилатам в присутствии триэтила-
зволяет при комнатной температуре получать ад-
мина. Гексагидро-1H-инден-1,3(2H)-дион [14] ре-
дукты Михаэля 2-5 с выходами 58-93% (схема 1).
агирует в присутствии метилата натрия, а 3,6-ди-
Регионаправленность нуклеофильного присоеди-
метокси-2-(пропан-2-ил)-2,5-дигидропиразин [15]
нения по кратной связи C=C предопределяется
взаимодействует в присутствии бутиллития.
сильными электроноакцепторными свойствами
нитрогруппы.
Нами показана возможность использования
катализатора Родионова [16] в реакциях алкил-
Спектры ЯМР 1Н аддуктов 2а, б, в которых про-
3-нитроакрилатов с циклогексан-1,3-дионами и
тоны группы CH2NO2 (4.75-5.08 м. д.) и два ме-
1184
АЛКИЛ-3-НИТРОАКРИЛАТЫ
1185
Схема 1.
тиновых протона HC (4.39-4.45 м. д.) и HМ (4.02-
ноэфирной группы (в спектрах аддуктов 2-5б)
4.24 м. д.) образуют спиновую систему АВСМ
диастереотопны и образуют сигналы в виде двух
(2JAB = 15.0-15.3, 3JAC = 5.3-5.5, 3JBC = 7.2-7.8,
дублетов дублетов (2JAB = 13.8-15.0, 3JAC = 5.3-6.1
3JCM = 2.1-2.3 Гц), доказывают существование
и 3JBC = 7.8-8.8 Гц) и двух дублетов квартетов
остатка СН-кислоты в кетонной форме.
(2J = 10.8, 3J = 7.1 Гц) соответственно. В спектрaх
Судя по литературным данным для близких
1H-15N HMBC соединений 2а, 3а в СD3CN атому
структур [22-24], в молекулах аддуктов 3-5 в рас-
азота нитрометильной группы принадлежат сигна-
творе и в твердой фазе остатoк СН-кислоты дол-
лы при 4.9 и 7.1 м. д. соответственно, что согласу-
жен находиться в енольной форме. Действительно,
ется с литературными данными [17, 27, 28].
данные ИК, ЯМР 1Н и 13С{1H} спектров соедине-
Таким образом, использование катализатора
ний 3-5 подтверждают енольную структуру в их
Родионова в реакциях алкил-3-нитроакрилатов с
молекулах. В ИК спектрах этих соединений на-
гетероциклическими СН-кислотами позволяет по-
блюдается широкая полоса поглощения енольной
лучать аддукты Михаэля в достаточно мягких ус-
группы OH в области 2639-3085 см-1, а также от-
ловиях и с высокими выходами.
дельная сильная полоса сопряженной карбониль-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ной группы кето-енольного фрагмента (cоедине-
ния 4, 5) в области 1670-1692 см-1, что характерно
Спектры ЯМР 1Н,
13С{1H}, 1Н-15N HMBC
для такого рода структур [22, 25, 26].
образцов в CD3CN регистрировали на спек-
В спектрах ЯМР 1Н соединений 3 и 4 протон
трометре Jeol ECX400A с рабочими частота-
енольной группы ОН образует слабоинтенсивный
ми: 399.78 (1H), 100.53 (13С) и 40.52 (15N) МГц.
широкий сигнал (9.08-9.52 м. д.), вероятно, вслед-
В качестве стандарта использовали остаточ-
ствие обменных процессов [26], a в спектрах ЯМР
ные сигналы недейтерированного раствори-
1Н соединений 5а, б сигнал протона группы ОН
теля. Химические сдвиги
15N определяли от-
отсутствует, что закономернo [26].
носительно CH3NO2. Колебательные спектры
Протоны метиленовых групп CH2NO2 (в спек-
записывали на ИК Фурье-спектрометре Shimadzu
трах аддуктов 2-5) и этильного заместителя слож-
IRPrestige-21 в таблетках KBr (разрешение 2 см-1)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1186
ПЕЛИПКО и др.
и в растворе в СHCl3 (с = 40 мг/мл). Элемент-
д. д (1H, HB, 2JAB = 15.0, 3JBC = 7.8 Гц). Спектр
ный анализ проводили на анализаторе EuroVector
ЯМР 13С{1H}, δC, м. д.: 13.18 (СН3СН2О), 28.10
EA3000 (CHN Dual).
(СН3), 28.36 (СН3), 41.28 (CHC), 48.89 (С5), 62.20
(СН3CH2O), 73.97 (CH2NO2), 151.45 (С2), 166.49
Алкил-3-нитроакрилаты 1a, б получали по ме-
(С4/С6), 167.50 (С4/С6), 169.56 (O-C=O). Найдено,
тодике [17].
%: С 43.94; H 4.93; N 13.67. C11H15N3O7. Вычисле-
Метил-2-(1,3-диметил-2,4,6-триоксогек-
но, %: С 43.86; H 5.02; N 13.95.
сагидропиримидин-5-ил)-3-нитропропаноат
(2a). К раствору 0.253 г (1.62 ммоль) 1,3-диме-
Метил-2-(5-гидрокси-3-метил-1-фенил-1Н-
пиразол-4-ил)-3-нитропропаноат
(3а) получа-
тилпиримидин-2,4,6(1Н,3Н,5Н)-триона и 0.13 мл
(0.162 ммоль) катализатора Родионова (гидрокси-
ли аналогично из 0.305 г (1.75 ммоль) 5-метил-
да триметилфениламмония) в 4 мл безводного ме-
2-фенил-2,4-дигидро-3Н-пиразол-3-она,
0.15 мл
танола при комнатной температуре добавляли по
(0.175 ммоль) катализатора Родионова и 0.23 г
каплям раствор 0.212 г (1.62 ммоль) метилнитро-
(1.75 ммоль) метилнитроакрилата 1а. Реакцион-
акрилата 1а в 4 мл безводного метанола. Реакци-
ную массу перемешивали 2 ч, затем выливали в из-
онную массу перемешивали 3 ч, затем выливали
мельченный лед. Осадок отфильтровывали и суши-
в измельченный лед. Продукты реакции экстраги-
ли. Выход 0.321 г (61%), т. пл. 147-149°С (C6H6). ИК
ровали 30 мл EtOAc, экстракт упаривали, остаток
спектр (KBr), ν, см-1: 3045 сл. ш, 2688 ср. ш (ОН),
очищали методом колоночной хроматографии на
1731 с (О-С=О), 1560 с [νas(NO2)], 1381 с [νs(NO2)].
силикагеле (элюент - EtOAc). Выход 0.32 г (69%),
Спектр ЯМР 1Н, δ, м. д.: 2.16 с (3H, СН3), 3.64 c (3H,
т. пл. 71-74°С. ИК спектр (CHCl3), ν, см-1: 1737 с
СН3O), 4.32 д. д (1H, HC, 3JAC = 6.3, 3JBC = 8.7 Гц),
(О-С=О), 1686 с (С-С=О), 1558 с [νas(NO2)], 1380
4.64 д. д (1H, HA, 2JAB = 14.5, 3JAC = 6.3 Гц), 5.10
с [νs(NO2)]. Спектр ЯМР 1Н, δ, м. д.: 3.17 с (3H,
д. д (1H, HB, 2JAB = 14.5, 3JBC = 8.7 Гц), 7.19 т
СН3), 3.20 с (3H, СН3), 3.61 c (3H, СН3O), 4.06 д
(1H, Ph, J = 7.5 Гц), 7.37 д. д (2H, Ph, J = 7.5, J =
(1H, HМ, 3JCМ = 2.3 Гц), 4.45 д. д. д (1H, HC, 3JAC =
8.5 Гц), 7.57 д (2H, Ph, J = 8.5 Гц), 9.38 уш. с (1Н,
5.3, 3JBC = 7.8, 3JCM = 2.3 Гц), 4.75 д. д (1H, HA,
ОН). Спектр ЯМР 13С{1H}, δC, м. д.: 10.57 (СН3),
2JAB = 15.1, 3JAC = 5.3 Гц), 5.05 д. д (1H, HB, 2JAB =
37.85 (CHC), 52.34 (CH3O), 73.28 (CH2NO2), 99.87
15.1, 3JBC = 7.8 Гц). Спектр ЯМР 13С{1H}, δC, м. д.:
(С4), 119.31 (Ph), 125.44 (Ph), 129.12 (Ph), 136.93
28.13 (СН3), 28.36 (СН3), 40.93 (CHC), 49.04 (С5),
(Ph), 149.19 (С3), 160.94 (С5), 170.81 (O-C=O).
52.79 (CH3O), 73.79 (CH2NO2), 151.46 (С2), 166.37
Спектр ЯМР 15N, δN, м. д.: -52.5 (N1), 7.1 (NO2).
(С4/С6), 167.34 (С4/С6), 170.27 (O-C=O). Спектр
Найдено, %: С 55.22; H 5.03; N 13.81. C14H15N3O5.
ЯМР 15N, δN, м. д.: -229.8 (NCH3), 4.9 (NO2). Най-
Вычислено, %: С 55.08; H 4.95; N 13.76.
дено, %: С 42.52; H 4.41; N 14.07. C10H13N3O7. Вы-
Этил-2-(5-гидрокси-3-метил-1-фенил-1Н-
числено, %: С 41.82; H 4.56; N 14.63.
пиразол-4-ил)-3-нитропропаноат (3б) получали
Этил-2-(1,3-диметил-2,4,6-триоксогексаги-
аналогично соединению 3а из 0.425 г (2.44 ммоль)
дропиримидин-5-ил)-3-нитропропаноат (2б) по-
5-метил-2-фенил-2,4-дигидро-3Н-пиразол-3-онa,
лучали аналогично из 0.218 г (1.4 ммоль) 1,3-ди-
0.2 мл (0.244 ммоль) катализатора Родионова и
метилпиримидин-2,4,6(1Н,3Н,5Н)-триона,
0.12
0.354 г (2.44 ммоль) этилнитроакрилата 1б. Выход
мл (0.14 ммоль) катализатора Родионова и 0.2 г
0.726 г (93%), т. пл. 89-92°С (C6H6). ИК спектр
(1.4 ммоль) этилнитроакрилата 1б. Время реакции -
(KBr), ν, см-1: 3060 ср. уш, 2799 ср. уш (ОН), 1726
24 ч. Выход 0.243 г (58%). ИК спектр (CHCl3), ν,
о. с (О-С=О), 1560 о. с [νas(NO2)], 1378 с [νs(NO2)].
см-1: 1733 ср (О-С=О), 1685 с (С-С=О), 1559 с
Спектр ЯМР 1Н, δ, м. д.: 1.16 т (3Н, СН3СН2О, 3J =
[νas(NO2)], 1380 с [νs(NO2)]. Спектр ЯМР 1Н, δ, м. д.:
7.1 Гц), 2.16 с (3H, СН3), 4.09 д. к (1Н, СН3СН2О,
1.09 т (3Н, СН3СН2О, 3J = 7.1 Гц), 3.17 с (3H, СН3),
2J = 10.9, 3J = 7.1 Гц), 4.13 д. к (1Н, СН3СН2О, 2J =
3.21 с (3H, СН3), 4.04 д. к (1Н, СН3СН2О, 2J = 10.8,
10.9, 3J = 7.1 Гц), 4.30 д. д (1H, HC, 3JAC = 6.1, 3JBC =
3J = 7.1 Гц), 4.10 д. к (1Н, СН3СН2О, 2J = 10.8, 3J =
8.8 Гц), 4.63 д. д (1H, HA, 2JAB = 14.5, 3JAC = 6.1 Гц),
7.1 Гц), 4.02 д (1H, HМ, 3JCМ = 2.2 Гц), 4.44 д. д.
5.11 д. д (1H, HB, 2JAB = 14.5, 3JBC = 8.8 Гц), 7.18
д (1H, HC, 3JAC = 5.3, 3JBC = 7.8, 3JCM = 2.2 Гц),
т (1H, Ph, J = 7.5 Гц), 7.37 т (2H, Ph, J = 7.5 Гц),
4.77 д. д (1H, HA, 2JAB = 15.0, 3JAC = 5.3 Гц), 5.07
7.57 д (2H, Ph, J = 7.5 Гц), 9.52 уш. с (1Н, ОН).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛ-3-НИТРОАКРИЛАТЫ
1187
Спектр ЯМР 13С{1H}, δC, м. д.: 10.62 (СН3), 13.47
9.08 уш. с (1Н, ОН). Спектр ЯМР 13С{1H}, δC, м. д.:
(СН3СН2О), 38.04 (CHC), 61.62 (СН3CH2O), 73.29
13.41 (СН3СН2О), 19.05 (СН3), 38.12 (CHC), 61.45
(CH2NO2), 99.91 (С4), 119.37 (Ph), 125.46 (Ph),
(СН3CH2O), 73.06 (CH2NO2), 96.60 (С3),
99.36
129.11 (Ph), 136.94 (Ph), 149.17 (С3), 162.42 (С5),
(С5), 163.36 (С6), 164.07 (С4), 166.67 (С2), 170.17
170.32 (O-C=O). Найдено, %: С 56.04; H 4.87; N
(O-C=O). Найдено, %: С 48.32; H 4.55; N 4.90.
12.66. C15H17N3O5. Вычислено, %: С 56.42; H 5.37;
C11H13NO7. Вычислено, %: С 48.71; H 4.83; N 5.16.
N 13.16.
Метил-2-(4-гидрокси-2-оксо-2H-хромен-3-
Метил-2-(4-гидрокси-6-метил-2-оксо-2H-пи-
ил)-3-нитропропаноат (5а) получали аналогично
ран-3-ил)-3-нитропропаноат (4а) получали ана-
соединению 3а из 0.256 г (1.6 ммоль) 4-гидрок-
логично соединению 2а из 0.203 г (1.61 ммоль)
си-2H-хромен-2-она, 0.13 мл (0.16 ммоль) катали-
4-гидрокси-6-метил-2H-пиран-2-она,
0.13
мл
затора Родионова и 0.21 г (1.6 ммоль) метилнитро-
(0.161 ммоль) катализатора Родионова и 0.211 г
акрилата 1а. Выход 0.35 г (75%), т.пл. 153-154°С
(1.61 ммоль) метилнитроакрилата 1а. Реакцион-
(H2О). ИК спектр (KBr), ν, см-1: 3245 ср. ш (ОН,
ную массу перемешивали 24 ч, затем выливали в
перекрывается c полосой поглощения Н2О), 1745
измельченный лед. Осадок отфильтровывали. Из
с (О-С=О), 1670 с (С=С-С=О), 1556 с [νas(NO2)],
маточного раствора продукт реакции экстрагиро-
1382 ср [νs(NO2)]. Спектр ЯМР 1Н, δ, м. д.: 3.63 c
вали 30 мл EtOAc, экстракт упаривали, кристал-
(3H, СН3O), 4.61 д. д (1H, HA, 2JAB = 14.4, 3JAC =
лический остаток объединяли с отфильтрованным
5.7 Гц), 4.85 д. д (1H, HC, 3JAC = 5.7, 3JBC = 8.3 Гц),
осадком. Выход 0.342 г (83%), т. пл. 165-168°С
5.12 д. д (1H, HB, 2JAB = 14.4, 3JBC = 8.3 Гц),
(H2О). ИК спектр (KBr), ν, см-1: 3085 ср. уш, 2639
7.33-7.40 м (2НAr), 7.64 т. д (1НAr, J = 1.5, J = 8.0 Гц),
ср. ш (ОН), 1735 с (О-С=О), 1680 с (С=С-С=О),
7.87 д. д (1НAr, J = 1.5, J = 8.0 Гц). Спектр ЯМР
1561 с [νas(NO2)], 1381 с [νs(NO2)]. Спектр ЯМР 1Н,
13С{1H}, δC, м. д.: 38.87 (CHC), 52.45 (CH3O), 73.04
δ, м. д.: 2.17 д (3H, СН3, 4J = 0.8), 3.60 c (3H, СН3O),
(CH2NO2), 100.59 (С3), 115.36 (Ar), 116.82 (Ar),
4.51 д. д (1H, HA, 2JAB = 13.8, 3JAC = 6.1 Гц), 4.64 д.
123.24 (Ar), 124.48 (Ar), 133.05 (Ar), 152.76 (Ar),
д (1H, HC, 3JAC = 6.1, 3JBC = 8.3 Гц), 4.99 д. д (1H,
162.12 (С4), 162.26 (С2), 170.58 (O-C=O). Найдено,
HB, 2JAB = 13.8, 3JBC = 8.3 Гц), 6.01 к (1H, С5Н, 4J =
%: С 52.43; H 3.43; N 4.41. C13H11NO7. Вычислено,
0.8 Гц), 9.13 уш. с (1Н, ОН). Спектр ЯМР 13С{1H},
%: С 53.25; H 3.78; N 4.78.
δC, м. д.: 19.05 (СН3), 37.94 (CHC), 52.23 (CH3O),
Этил-2-(4-гидрокси-2-оксо-2H-хромен-3-ил)-
73.04 (CH2NO2), 96.48 (С3), 99.41 (С5), 163.13 (С6),
3-нитропропаноат
(5б) получали аналогично
163.43 (С4), 166.77 (С2), 170.72 (O-C=O). Найдено,
соединению 2а из 0.273 г (1.68 ммоль) 4-гидрок-
%: С 46.33; H 4.05; N 5.20. C10H11NO7. Вычислено,
си-2H-хромен-2-она, 0.14 мл (0.168 ммоль) ката-
%: С 46.70; H 4.31; N 5.45.
лизатора Родионова и 0.244 г (1.68 ммоль) нитроа-
Этил-2-(4-гидрокси-6-метил-2-оксо-2H-пи-
крилата 1б. Выход 0.39 г (75%), т.пл. 97-100°С. ИК
ран-3-ил)-3-нитропропаноат (4б) получали ана-
спектр (CHCl3), ν, см-1: 3085 сл. ш (ОН), 1734 ср
логично соединению 4а из 0.204 г (1.62 ммоль)
(О-С=О), 1692 с (О-С=С-С=О), 1559 с [νas(NO2)],
4-гидрокси-6-метил-2H-пиран-2-она,
0.13
мл
1380 ср
[νs(NO2)]. Спектр ЯМР 1Н, δ, м. д.:
(0.162 ммоль) катализатора Родионова и 0.235 г
1.13 т (3Н, СН3СН2О, 3J = 7.1 Гц), 4.09 д. к (1Н,
(1.62 ммоль) этилнитроакрилата 1б. Выход 0.381 г
СН3СН2О, 2J = 10.8, 3J = 7.1 Гц), 4.12 д. к (1Н,
(87%), т. пл. 150-153°С (H2О). ИК спектр (KBr),
СН3СН2О, 2J = 10.8, 3J = 7.1 Гц), 4.60 д. д (1H, HA,
ν, см-1: 3085 ср. уш, 2643 ср. ш (ОН), 1726 с
2JAB = 14.4, 3JAC = 5.7 Гц), 4.84 д. д (1H, HC, 3JAC =
(О-С=О), 1681 с (С=С-С=О), 1560 с [νas-(NO2)],
5.7, 3JBC = 8.3 Гц), 5.13 д. д (1H, HB, 2JAB = 14.4,
1382 ср [νs(NO2)]. Спектр ЯМР 1Н, δ, м. д.: 1.12 т
3JBC = 8.3 Гц), 7.32-7.38 м (2НAr), 7.62 т. д (1НAr,
(3Н, СН3СН2О, 3J = 7.1 Гц), 2.17 д (3H, СН3, 4J =
J = 1.5, J = 8.0 Гц), 7.88 д. д (1НAr, J = 1.5, J = 8.0 Гц).
0.8), 4.06 д. к (1Н, СН3СН2О, 2J = 10.8, 3J = 7.1 Гц),
Спектр ЯМР 13С{1H}, δC, м. д.: 13.37 (СН3СН2О),
4.09 д. к (1Н, СН3СН2О, 2J = 10.8, 3J = 7.1 Гц), 4.49
39.09 (CHC), 61.75 (СН3CH2O), 73.09 (CH2NO2),
д. д (1H, HA, 2JAB = 13.8, 3JAC = 6.1 Гц), 4.62 д. д (1H,
100.54 (С3), 115.51 (Ar), 116.78 (Ar), 123.20 (Ar),
HC, 3JAC = 6.1, 3JBC = 8.3 Гц), 4.98 д. д (1H, HB, 2JAB =
123.29 (Ar), 124.43 (Ar), 132.98 (Ar), 152.79 (С4),
13.8, 3JBC = 8.3 Гц), 6.00 к (1H, С5Н, 4J = 0.8 Гц),
162.31 (С2), 170.15 (O-C=O). Найдено, %: С 54.37;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1188
ПЕЛИПКО и др.
H 4.37; N 4.52. C14H13NO7. Вычислено, %: С 54.73;
J. Org. Chem. 2006. Vol. 42. N 8. P. 1242. doi 10.1134/
H 4.26; N 4.56.
S1070428006080264
12.
Austin R.E., Maplestone R.A., Sefler A.M., Liu K.,
Физико-химические исследования выполнены
Hruzewicz W.N., Liu C.W., Cho H.S., Wemmer D.E.,
с использованием оборудования Центра коллек-
Bartlett P.A. // J. Am. Chem. Soc. 1997. Vol. 119. N 28.
тивного пользования факультета химии Россий-
P. 6461. doi 10.1021/ja964231a
ского государственного педагогического универ-
13.
Anderson J.C., Kalogirou A.S., Tizzard G.J. //
ситета им. А. И. Герцена.
Tetrahedron. 2014. Vol. 70. N 49. P. 9337. doi 10.1016/j.
tet.2014.10.042
ФОНДОВАЯ ПОДДЕРЖКА
14.
Северина Т.А., Иванова А.Н., Кучеров В.Ф. // Изв. АН
СССР. Сер. Хим. 1967. № 5. С. 1111.
Работа выполнена при финансовой поддерж-
15.
Busch K., Groth U.M., Kühnle W., Schöllkopf U. //
ке Министерства просвещения России (проект
Tetrahedron. 1992. Vol. 48. N 27. P. 5607. doi
№ FSZN-2020-0026).
10.1016/0040-4020(92)80011-4
16.
Родионов В.М., Ярцева Н.Г. // Изв. АН СССР. 1948.
КОНФЛИКТ ИНТЕРЕСОВ
№. 2. С. 251.
Авторы заявляют об отсутствии конфликта
17.
Пелипко В.В., Макаренко С.В., Байчурин Р.И., Бе-
интересов.
рестовицкая В.М., Коваленко К.С. // ЖОХ. 2017.
Т. 53. Вып. 12. С. 1765; Pelipko V.V., Makarenko S.V.,
СПИСОК ЛИТЕРАТУРЫ
Baichurin R.I., Berestovitskaya V.M., Kovalenko K.S. //
Russ. J. Org. Chem. 2017. Vol. 53. N 12. P. 1799. doi
1.
Halimehjani A.Z., Namboothiri I.N.N., Hooshman-
10.1134/S107042801712003X.
da S.E. // RSC Adv. 2014. Vol. 4. N 59. P. 31261. doi
18.
Wieland P., Ueberwasser H., Anner G., Miescher K. //
10.1039/C4RA04069D
Helv. сhim. аcta. 1953. Vol. 36. Р. 1231. doi 10.1002/
2.
Halimehjani A.Z., Namboothiri I.N.N., Hooshman-
hlca.19530360603
da S.E. // RSC Adv. 2014. Vol. 4. N 89. P. 48022. doi
19.
Leonard N.J., Shoemaker G.L. // J. Am. Chem. Soc.
10.1039/C4RA08828J
1949. Vol. 71. P. 1762. doi 10.1021/ja01173a064
3.
Halimehjani A.Z., Namboothiri I.N.N., Hooshman-
da S.E. // RSC Adv. 2014. Vol. 4. N 93. P. 51794. doi
20.
Leonard N.J., Felley D.L. // J. Am. Chem. Soc. 1950.
Vol. 72. P. 2537. doi 10.1021/ja01162a057
10.1039/C4RA08830A
4.
Sukhorukov A.Yu., Sukhanova A.A., Zlotin S.G.//
21.
Leonard N.J., Shoemaker G.L. // J. Am. Chem. Soc.
1949. Vol. 71. P. 1876. doi 10.1021/ja01173a518
Tetrahedron. 2016. Vol. 72. N 41. P. 6191. doi 10.1016/j.
tet.2016.07.067
22.
Циклические β-дикетоны / Под ред. Г. Ванага. Рига:
5.
Mieriņa I., Jure M. // ХГС. 2016. Т. 52. № 1. С. 10;
Изд. АН Латв. ССР. 1961. C. 41.
Mieriņa I., Jure M. // Chem. Heterocycl. Comp. 2016.
23.
Трухин Е.В., Шеремет Е.А., Берестовицкая В.М. //
Vol. 68. Vol. 52. N 1. P. 10. doi 10.1007/s10593-016-
Изв. АН. Сер. хим. 2009. №. 10. С. 1973; Trukhin E.V.,
1823-9
Sheremet E.A., Berestovitskaya V.M. // Russ. Chem.
6.
Łapczuk-Krygier A., Kącka-Zych A., Kula K. // Curr.
Bull. 2009. Vol. 58. N 10. P. 2035. doi 10.1007/s11172-
Chem. Lett. 2019. Vol. 8. N 1. P. 13. doi 10.5267/j.
009-0278-x
ccl.2018.12.002
24.
Берестовицкая В.М., Байчурин Р.И., Байчурина Л.В.,
7.
Ono N. The Nitro Group in organic synthesis. New-
Фельгендлер А.В., Абоскалова Н.И. // ЖОХ. 2013.
York: John Wiley and Sons, 2001. 373 p.
Т. 83. Вып. 9. С. 1538; Berestovitskaya V.M., Baichu-
8.
Пелипко В.В., Байчурин Р.И., Макаренко С.В. // Изв.
rin R.I., Baichurina L.V., Fel’gendler A.V., Aboskalo-
АН. Сер. хим. 2019. № 10. С. 1821; Pelipko V.V.,
va N.I. // Russ. J. Gen. Chem. 2013. Vol. 83. N 9.
Baichurin R.I., Makarenko S.V. // Russ. Chem. Bull.
P. 1755. doi 10.1134/S1070363213090211
2019. Vol. 68. N 10. P. 1821. doi 10.1007/s11172-019-
25.
Казицына Л.А., Куплетская Н.Б. Применение УФ-,
2631-z
ИК-, ЯМР- и масс-спектроскопии в органической
9.
Ballini R., Gabrielli S., Palmieri A. // Curr. Org.
химии. М.: Изд. Московск. унив., 1979.
Chem. 2010. Vol. 14. N 1. P. 65. doi 10.2174/
26.
Преч Э., Бюльманн Ф., Аффольтер К. Определение
138527210790226429
строения органических соединений. Таблицы спек-
10.
Gabrielli S., Chiurchiù E., Palmieri A. // Adv. Synth.
тральных данных. М.: Мир; БИНОМ. Лаборатория
Catal. 2019. Vol. 361. N 4. P. 630. doi 10.1002/
знаний, 2006. 438 с.
adsc.201800709
27.
Martin G.J., Martin M.L., Gouesnard J.-P. 15N-NMR
11.
Смирнов А.С., Макаренко С.В, Берестовцкая В.М.,
Spectroscopy. Book serie: NMR Basic Principles and
Пекки А.И., Коваленко К.С. // ЖОрХ. 2006. Т. 42.
Progress. Berlin: Springer-Verlag, 1981. Vol. 18.
Вып. 8. С. 1259; Smirnov A.S., Makarenko S.V.,
28.
Klapötke T.M., Krumm B., Moll R. // Chem. Eur. J. 2013.
Berestovitskaya V.M., Pekki A.I., Kovalenko K.S. // Russ.
Vol. 19. N 36. P. 12113. doi 10.1002/chem.201300964
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛ-3-НИТРОАКРИЛАТЫ
1189
Alkyl 3-Nitroacrylates in Reactions
with Heterocyclic CH Acids
V. V. Pelipko, M. A. Kuritsynа, R. I. Baichurin, and S. V. Makarenko*
Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
*e-mail: kohrgpu@yandex.ru
Received May 6, 2020; revised May 6, 2020; accepted May 16, 2020
The reactions of alkyl 3-nitroacrylates with some hetereocyclic CH acids such as 1,3-dimethylpyrimidine-
2,4,6(1Н,3Н,5Н)-trione, 5-methyl-2-phenyl-2,4-dihydro-3H-pyrazol-3-one, 4-hydroxy-5-methyl-2H-pyran-2-
one, and 4-hydroxy-2H-chromen-2-one proceeds in the presence of the Rodionov catalyst to form the Michael
adducts. Their structure was proved by 1H, 13C{1H}, 1Н-15N HMBC NMR and IR spectroscopy methods.
Keywords: nitroacrylate, CH-acid, Rodionov catalyst, nucleophilic addition, Michael adduct
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020