ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1190-1195
К 80-летию со дня рождения В.М. Берестовицкой
УДК 547.495.9;547.792.1
СИНТЕЗ 5-ЗАМЕЩЕННЫХ
N-НИТРО-2,4-ДИГИДРО-(3Н)-1,2,4-ТРИАЗОЛ-3-ИМИНОВ
© 2020 г. О. Ю. Озерова*, Т. П. Ефимова, Т. А. Новикова
Российский государственный педагогический университет имени А. И. Герцена, наб. р. Мойки 48, Санкт-
Петербург, 19186 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 6 мая 2020 г.
После доработки 6 мая 2020 г.
Принято к печати 16 мая 2020 г.
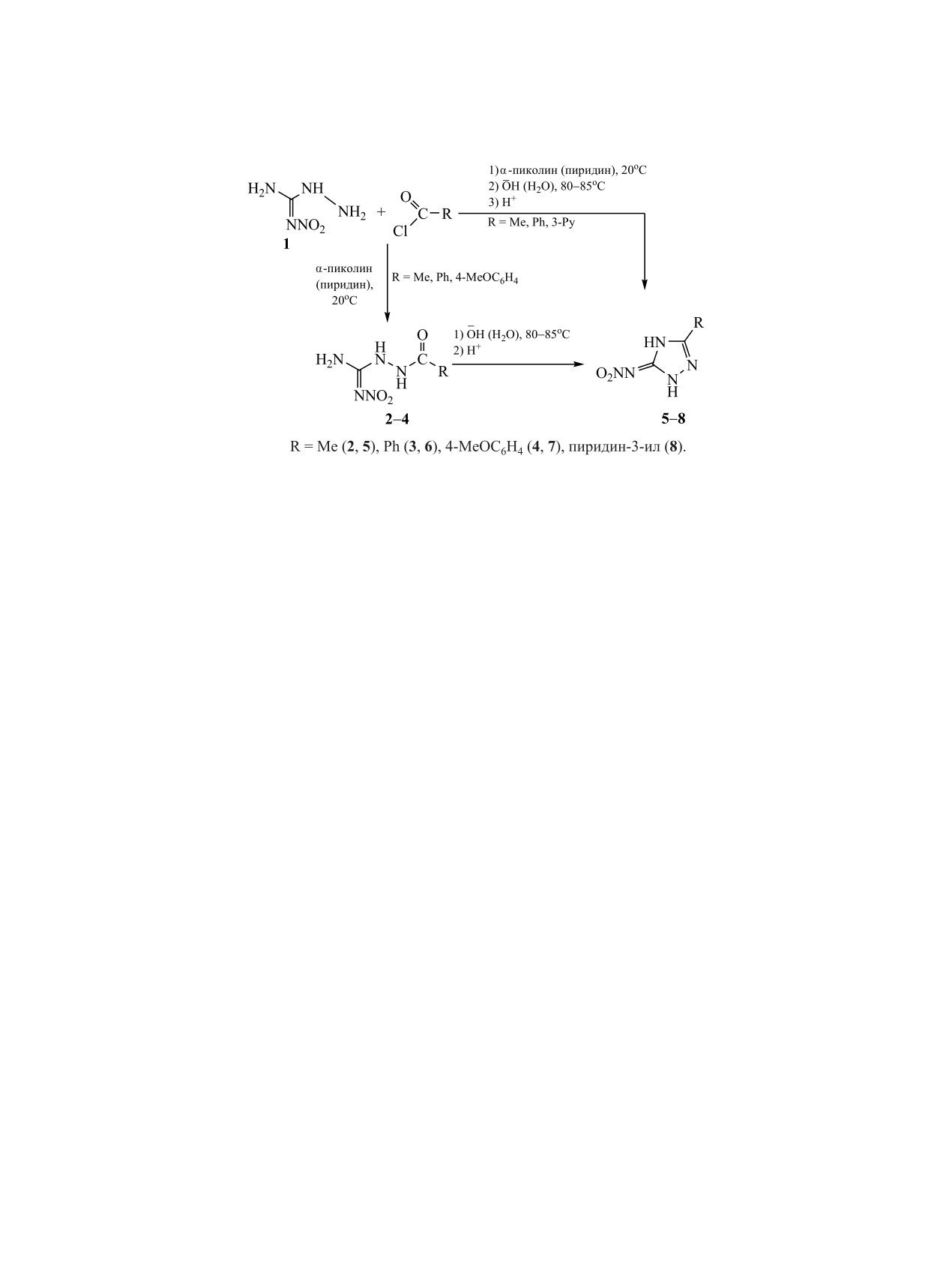
Изучено взаимодействие 1-амино-2-нитрогуанидина с хлорангидридами карбоновых кислот при ком-
натной температуре. Полученные N-(2-нитрогуанидино)амиды карбоновых кислот при нагревании в
водно-щелочной среде циклизуются в N-нитро-1,2,4-триазолимины, которые были также получены
одностадийным методом. Строение синтезированных соединений охарактеризовано методами ЯМР 1Н,
13С{1H}, ИК и УФ спектроскопии.
Ключевые слова: 1-амино-2-нитрогуанидин, хлорангидриды карбоновых кислот, N-(2-нитрогуанидино)-
амиды карбоновых кислот, N-нитро-1,2,4-триазолимины
DOI: 10.31857/S0044460X20080053
Проблемы поиска легкодоступных полифунк-
выделены с выходами до 69%. Их последующее
циональных субстратов, позволяющих проводить
кипячение в водно-щелочной среде сопровождает-
направленный синтез разнообразных линейных
ся внутримолекулярной гетероциклизацией с уча-
и гетероциклических структур, актуальны. В ка-
стием амино- и карбонильной групп и завершается
честве таких субстратов перспективны органи-
образованием
5-замещенных N-нитро-2,4-диги-
ческие производные гуанидина, выступающие в
дро-(3Н)-1,2,4-триазол-3-иминов 5-7.
большинстве случаев в роли нуклеофилов и харак-
При замене пиридина на α-пиколин упрощалась
теризующиеся высокой реакционной способно-
методика выделения продуктов конденсации 2-4:
стью. 1-Амино-2-нитрогуанидин проявил себя как
в этом случае отсутствовала необходимость отго-
активный нуклеофил в реакциях с карбонильными
нять избыток растворителя, так как растворяющая
соединениями [1-4], карбоновыми кислотами и их
способность α-пиколина ниже, чем пиридина.
производными [5-8], c функционализированными
N-Нитро-1,2,4-триазолимины
5,
6,
8 были
нитроалкенами [9-12] и дикарбонильными соеди-
успешно получены и однореакторным способом
нениями [13-17].
без выделения промежуточных линейных соеди-
Продолжая исследования реакционной спо-
нений.
собности 1-амино-2-нитрогуанидина 1 в качестве
Строение соединений 2-4 подтверждено со-
нуклеофила, мы провели его взаимодействие с
вокупностью данных ЯМР 1Н 13С{1H}, ИК и УФ
хлорангидридами карбоновых кислот (схема 1).
спектроскопии, а также совпадением спектраль-
Реакции соединения 1 с хлорангидридами уксус-
ных характеристик и температур плавления соеди-
ной, бензойной и 4-метоксибензойной кислот про-
нения 2 с литературными данными [18]. В спектрах
текают легко при комнатной температуре в среде
ЯМР 1Н соединений 2-4 в слабом поле наблю-
безводного пиридина или α-пиколина. N-(2-Ни-
даются характерные для нитрогуанидинаминов
трогуанидино)амиды карбоновых кислот
2-4
уширенные сигналы магнитно-неэквивалентных
1190
СИНТЕЗ 5-ЗАМЕЩЕННЫХ N-НИТРО-2,4-ДИГИДРО-(3Н)-1,2,4-ТРИАЗОЛ-3-ИМИНОВ
1191
Схема 1.
протонов первичной (8.19-8.40, 8.59-8.64 м. д.)
В спектрах ЯМР 1Н производных триазола 5-8
и вторичных (9.57-10.49, 9.79-10.38 м. д.) амино-
проявляется лишь слабопольный уширенный син-
групп, сигналы протонов в группах R проявляются
глет в области 13.40-14.31 м. д., принадлежащий
в соответствующих для них областях. Магнитная
группе NH триазольного цикла; отсутствие в этих
неэквивалентность протонов первичной амино-
спектрах сигнала протона второй группы NH свя-
группы нитрогуанидинового фрагмента связана с
зано, по-видимому, с возможностью его быстрого
возможностью одного из протонов образовывать
обмена [25, 26] с примесью воды в ДМСО-d6 [24].
водородную связь с кислородом нитрогруппы [19].
Величины химических сдвигов протонов алкиль-
ных и арильных заместителей в спектрах соедине-
В спектрах ЯМР 13С{1Н} соединений 2-4 при-
ний 5-8 близки к значениям, наблюдаемым в спек-
сутствуют сигналы атомов углерода всех структур-
ных фрагментов. Отнесение сигналов выполнено
трах соединений 2-4. Спектр ЯМР 1Н соединения
5 согласуется с приведенным для ранее получен-
с помощью методов спектроскопии ЯМР 1Н-13С
ного образца [24].
HMQC и 1Н-13С HMBC.
В ИК спектрах производных
1,2,4-триазо-
В ИК спектрах соединений 2-4 полосы в об-
ла 5-8 интенсивные полосы в области 1616-
ласти 1669-1704 см-1 относятся, вероятно, к ва-
лентным колебаниям карбонильной группы, а ин-
1617 см-1 можно отнести к валентным колебаниям
связи С=N и деформационным колебаниям связей
тенсивные полосы в области 1611-1635 см-1 - к
N-H, полосы при1296-1322 и 1410-1433 см-1 - к
валентным колебаниям связи С=N и деформаци-
валентным колебаниям нитрогруппы фрагмен-
онным колебаниям N-H [20], полосы при 1300-
та С=NNO2 [20-22]. В высокочастотной области
1306 и 1420-1428 см-1 - к валентным колебаниям
связей в группе NO2, что согласуется с литератур-
спектра 3222-3459 см-1 присутствуют полосы ва-
лентных колебаний связей N-H.
ными данными для однотипных по структуре сое-
динений с нитроиминным фрагментом [20-22]. В
В электронных спектрах соединений 2-4 и 5-8
высокочастотной области спектра 3239-3404 см-1
наблюдаются длинноволновые полосы поглоще-
присутствуют полосы валентных колебаний
ния в областях 267.5-268.5 нм (ε 16900-21250) и
связей N-H.
287-296 нм (ε 9550-32400) соответственно, что со-
гласуется с данными для однотипных по структуре
Строение 5-R-N-нитро-2,4-дигидро-(3Н)-1,2,4-
соединений [24, 27].
триазол-3-иминов
5-8 подтверждено методами
ЯМР 1Н, ИК и УФ спектроскопии, а также совпа-
Ранее был разработан метод синтеза нитрои-
дением температур плавления соединений 5, 6
минопроизводных
1,2,4-триазола конденсацией
и образцов, полученных другими способами
1-метил-1-нитрозо-2-нитрогуанидина с гидрази-
[18, 23, 24].
дами алифатических и ароматических карбоновых
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1192
ОЗЕРОВА и др.
кислот [18]. 1-Метил-1-нитрозо-2-нитрогуанидин
13С, δC, м. д.: 21.41 (СН3), 161.65 (C=NNO2), 169.96
проявляет канцерогенную и мутагенную актив-
(С=О). Найдено, %: С 22.15; Н 4.44; N 43.31.
ность [28], некоторые N-нитрозососединения спо-
C3H7N5O3. Вычислено, %: С 22.36; Н 4.35; N 43.48.
собны вызывать кожные заболевания, ряд нитро-
N-(2-Нитрогуанидино)бензамид (3) получа-
зосоединений относится к классу супермутагенов
ли аналогично из 0.6 г (5 ммоль) соединения 1 и
для млекопитающих [29]. Некоторые гербициды,
0.8 мл (d = 1.21 г/см3) (5 ммоль) хлорангидрида
полученные в ходе синтеза из нитрозосоедине-
бензойной кислоты; время реакции - 20 ч. Выход
ний, могут представлять онкогенную опасность
0.71 г (64%), т. пл. 196-198ºС (EtOH, разл.). ИК
при употреблении продукции растениеводства,
спектр, ν, см-1: 3382, 3340 (NH), 1669 (С=О),
выращенной с использованием таких средств [28].
1619 (С=N), 1428, 1300 (С=NNO2). УФ спектр
1-Амино-2-нитрогуанидин более безопасен по
(EtOH), λmax, нм [ε, л/(моль·см)]: 268.5 [21250].
сравнению с нитрозопроизводным в синтезе 5-R-N-
Спектр ЯМР 1Н, δ, м. д.: 7.47-7.89 м (3Н, С6Н3),
нитро-2,4-дигидро-(3Н)-1,2,4-триазоло-3-иминов,
8.39 уш. с и 8.61 уш. с (2Н, NН2), 9.79 уш. с (1Н,
что позволяет рассматривать предлагаемый метод
NНС=NNO2), 10.49 с (1Н, NНС=O). Спектр ЯМР
как более предпочтительный.
13С, δС, м. д.: 128.44, 128.82, 132.58 (С6Н5), 161.90
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(C=NNO2), 166.81 (С=О). Найдено, %: С 43.19; Н
4.06; N 31.42. C8H9N5O3. Вычислено, %: С 43.05; Н
Спектры ЯМР
1Н,
13С{1H}, 1Н13С HMQC,
4.03; N 31.39.
HMBC регистрировали на спектрометре Jeol
ECX400A [399.78 (1Н), 100.52 (13С) МГц] в ДМ-
4-Метокси-N-(2-нитрогуанидино)бензамид
СО-d6. ИК спектры снимали на Фурье-спектро-
(4) получали аналогично из 0.245 г (2 ммоль) со-
метре IRPrestige-21 в таблетках KВr. Электрон-
единения 1, 0.35 г (2 ммоль) хлорангидрида 4-ме-
ные спектры записывали на спектрофотометре
токсибензойной кислоты и 20 мл пиридина; время
Shimadzu UV-2401 РС в кварцевых кюветах (l =
реакции - 20 ч. Образовавшийся осадок отфиль-
0.1 см, с ~0.0003 моль/л), растворитель - С2Н5ОН.
тровывали, промывали этанолом, диэтиловым
Элементный анализ выполняли на анализаторе
эфиром, сушили на воздухе и перекристалли-
EuroVector EA 3000 (CHN Dual mode).
зовывали из смеси H2O-EtOH, 1:1. Выход 0.16 г
(32%), т. пл. 178-180оС (разл.). ИК спектр, ν, см-1:
В работе использовали коммерчески доступные
3404, 3332 (NH), 1669 (С=О), 1611 (С=N, 1420),
реагенты: ацетилхлорид, бензоилхлорид, 4-меток-
1306 (С=NNO2). УФ спектр (EtOH), λmax, нм [ε,
си-бензоилхлорид - без дополнительной очистки.
л/(моль·см)]: 268 [19000]. Спектр ЯМР 1Н, δ, м. д.:
1-Амино-2-нитрогуанидин 1 [30] и пиридин-3-кар-
3.82 с (3Н, ОСН3), 7.03 д (2H, С6Н4, 3JНН = 7.9 Гц),
бонилхлорид [31] получали по указанным методи-
7.90 д (2Н, С6Н4, 3JНН = 7.9 Гц), 8.40 уш. с и 8.64
кам.
уш. с (2Н, NН2), 9.77 уш. с (1Н, NНС=NNO2), 10.38
N-(2-Нитрогуанидино)ацетамид
(2). К су-
с (1Н, NНС=O). Спектр ЯМР 13С, δC, м. д.: 56.01
спензии 2.38 г (20 ммоль) соединения 1 в 30 мл
(СН3О), 114.10 (С3,5), 124.80 (С1), 130.43 (С2,6),
α-пиколина, охлажденной до 0÷-5°С, прибавляли
162.79 (С4), 162.00 (C=NNO2), 166.38 (С=О). Най-
по каплям 1.57 мл (20 ммоль) хлорангидрида ук-
дено, %: 42.64; Н 4.42; N 27.73. C9H11N5O4. Вычис-
сусной кислоты. Реакционную смесь выдерживали
лено, %: С 42.69; Н 4.35; N 27.67.
при перемешивании при комнатной температуре
16 ч. Образовавшийся осадок отфильтровывали,
5-Метил-N-нитро-2,4-дигидро-(3Н)-1,2,4-
промывали этанолом, сушили на воздухе и пере-
триазол-3-имин
(5). а. К раствору
1.61 г
кристаллизовывали из воды. Выход 2.24 г (69%),
(10 ммоль) соединения 2 в 30 мл воды прибавляли
т. пл. 191-192ºС (разл.) {т. пл. 191-192°С (разл.)
раствор 0.4 г (10 ммоль) гидроксида натрия в 5 мл
[18]}. ИК спектр, ν, см-1: 3388, 3239 (NH),1704
воды. Реакционную смесь выдерживали 2.5 ч при
(С=О), 1635 (С=N), 1425, 1300 (С=NNO2). УФ
80-85°С до обесцвечивания раствора, затем охла-
спектр (EtOH), λmax, нм [ε, л/(моль·см)]:
267.5
ждали до комнатной температуры и подкисляли
[16900]. Спектр ЯМР 1Н, δ, м. д.: 1.84 с (3Н, СН3),
конц. НСl до рH ~5 (по универсальному индика-
8.19 уш. с и 8.59 уш. с (2Н, NН2), 9.57 уш. с (1Н,
тору). Образовавшийся осадок отфильтровывали,
NНС=NNO2), 9.84 с (1Н, NНС=O). Спектр ЯМР
промывали водой, сушили и перекристаллизовы-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ 5-ЗАМЕЩЕННЫХ N-НИТРО-2,4-ДИГИДРО-(3Н)-1,2,4-ТРИАЗОЛ-3-ИМИНОВ
1193
вали из воды. Выход 1.14 г (80%), т. пл. 208-209°С
до обесцвечивания раствора, затем реакционную
(разл.) {т. пл. 208-209°С (разл.) [18], 208°С (разл.)
массу охлаждали до комнатной температуры и
[23]}. ИК спектр, ν, см-1: 3459, 3222 (NH), 1616
подкисляли конц. НСl до рH ~5 (по универсально-
(С=N), 1433, 1297 (С=NNO2). УФ спектр (EtOH),
му индикатору), образовавшийся осадок отфиль-
λmax, нм [ε, л/(моль·см)]: 287 [12550]. Спектр ЯМР
тровывали, промывали водой, сушили на воздухе
1Н, δ, м. д.: 2.26 с (3Н, СН3), 13.78 уш. с (1Н, NН).
и перекристаллизовывали из смеси H2O-EtOH,
Найдено %: С 25.17; Н 3.49; N 48.95. C3H5N5O2.
1:2. Выход 0.11 г (78%), т. пл. 193-194°С (разл.).
Вычислено %: С 25.46; Н 3.96; N 47.87.
ИК спектр, ν, см-1: 3296, 3223 (NH), 1616 (С=N),
б. К суспензии 2.38 г (20 ммоль) соединения 1 в
1410, 1296 (С=NNO2). УФ спектр (С2H5OH), λmax,
30 мл пиридина, охлажденной до 0÷-5°С, прибав-
нм [ε, л/(моль·см)]: 291.5 [9550]. Спектр ЯМР 1Н,
ляли по каплям 1.43 мл (20 ммоль) хлорангидрида
δ, м. д.: 3.79 с (3Н, ОСН3), 7.06 д (2Н, С6Н4, 3JНН =
уксусной кислоты. Смесь выдерживали 12 ч при
8.9 Гц), 7.90 д (2Н, С6Н4, 3JНН = 8.9 Гц), 14.19 уш. с
18-20°С, затем прибавляли раствор 0.8 г (2 ммоль)
(1Н, NН). Найдено, %: С 45.78; Н 3.98; N 29.74.
гидроксида натрия в 5 мл воды и кипятили 8 ч до
C9H9N5O3. Вычислено, %: С 45.96; Н 3.83; N 29.79.
обесцвечивания раствора. После охлаждения до
N-Нитро-5-(пиридин-3-ил)-2,4-дигидро-
комнатной температуры и подкисления конц. НСl
(3Н)-1,2,4-триазол-3-имин (8) получали анало-
до рH ~5 (по универсальному индикатору) обра-
гично соединению 2 из 0.35 г (3 ммоль) соединения
зовавшийся осадок отфильтровывали, промывали
1, 0.42 г (3 ммоль) пиридин-3-карбонилхлорида
водой, сушили на воздухе и перекристаллизовыва-
и 20 мл пиридина; время реакции - 20 ч. Выход
ли из воды. Выход 2.57 г (90%), т. пл. 207-208°С
0.27 г (40%), т. пл. 224-228°С (EtOH). ИК спектр,
(разл.) {т. пл. 208-209°С (разл.) [18], 208°С (разл.)
ν, см-1: 3397, 3308, 3219 (NH), 1617 (С=N), 1417,
[23]}. Пробы смешения образцов, полученных в
1322 (С=NNO2). УФ спектр (С2H5OH), λmax, нм
опытах а и б, депрессии температуры плавления
[ε, л/(моль·см)]: 262.5 [10860]. Спектр ЯМР 1Н, δ,
не давали.
м. д.: 3.79 с (3Н, ОСН3), 7.50-7.53 м, 8.22-8.25 м,
N-Нитро-5-фенил-2,4-дигидро-(3Н)-1,2,4-
8.74-8.76 м, 9.03-9.04 м (4Н, С5H4N). Найдено, %:
триазол-3-имин (6). а. Получали аналогично со-
С 38.94; Н 2.73; N 39.02. C7H6N6O2. Вычислено, %:
единению 5 из 1.025 г (5 ммоль) соединения 3.
С 38.89; Н 2.77; N 38.89.
Выход 0.46 г (45%), т. пл. 207-209°С (EtOH, разл.)
Физико-химические исследования проведены
{т. пл. 210°С (вода, разл.) [23]}. ИК спектр, ν, см-1:
в Центре коллективного пользования Российского
3437, 3320 (NH), 1617 (С=N), 1428, 1304 (С=NNO2).
государственного педагогического университета
УФ спектр (С2H5OH), λmax, нм [ε, л/(моль·см)]: 296
им. А. И. Герцена.
[32400]. Спектр ЯМР 1Н, δ, м. д.: 7.52-7.91 м (3Н,
С6Н3), 14.31 уш. с (1Н, NН). Найдено, %: С 46.83;
КОНФЛИКТ ИНТЕРЕСОВ
Н 3.41; N 33.87. C8H7N5O2. Вычислено, %: С 46.98;
Авторы заявляют об отсутствии конфликта
Н 3.32; N 34.15.
интересов.
б. Получали аналогично соединению 5 из 1.19 г
СПИСОК ЛИТЕРАТУРЫ
(10 ммоль) соединения 1 и 1.54 мл
(10 ммоль)
хлорангидрида бензойной кислоты. Выход 1.32 г
1. McKay A.F. // Chem. Rev. 1952. N 51. P. 301. doi
10.1021/cr60159a003
(64%), т. пл. 210-212°С (EtOH, разл.) {т. пл. 210°С
2. Метелкина Э.Л., Новикова Т.А. // ЖОрХ. 1999.
(вода, разл.) [23]}. Пробы смешения образцов, по-
Т. 35. Вып. 11. С. 1619; Metelkina E.L., Novikova T.A.,
лученных в опытах а и б, депрессии температуры
Telenyuk S.E. // Russ. J. Org. Chem. 1999. Vol. 35.
плавления не давали.
P. 1587.
5-(4-Метоксифенил)-N-нитро-2,4-дигидро-
3. Whitmore W.F., Revukas A.J., Smith G.B.L. // J. Am.
(3Н)-1,2,4-триазол-3-имин (7). К раствору 0.16 г
Chem. Soc. 1935. Vol. 57. N. 4. P. 706. doi 10.1021/
(0.6 ммоль) соединения 4 в 5 мл этанола прибав-
ja01307a032
ляли раствор 0.035 г (0.6 ммоль) гидроксида калия
4. Kumler W.D., Sah P. // J. Am. Pharm. Assoc. 1952.
в 10 мл воды, смесь выдерживали 2 ч при 80-85°С
Vol. 41. N. 7. P. 375. doi 10.1002/jps.3030410712
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1194
ОЗЕРОВА и др.
5. Henry R.A. // J. Am. Chem. Soc. 1950. Vol. 72. N 11.
Вып. 7. С. 1099; Ozerova O.Y., Efimova T.P., Noviko-
P. 5343. doi 10.1021/ja01167a602
va T.A., Gurzhii V.V., Berestovitskaya V.M. // Russ. J.
6. Чипен Г.И., Гринштейн Р.П., Прейман В.Я. // ЖОХ.
Gen. Chem. 2015. Vol. 85. N 7. P. 1623. doi 10.1134/
1962. Т. 32. Вып. 2. С. 454.
S1070363215070087
7. McKay A.F., Milks J.E. // J. Am. Chem. Soc. 1950.
18. Ефимова Т.П., Озерова О.Ю., Новикова Т.А., Бе-
Vol. 72. N 4. P. 1616. doi 10.1021/ja01160a052
лик И.В., Берестовицкая В.М. // ЖОХ. 2013.
8. Озерова О.Ю., Ефимова Т.П., Новикова Т.А. // ХГС.
Т. 83. Вып. 9. С. 1564; Efimova T.P., Ozerova O.Yu.,
2020. Т. 56. № 2. С. 233; Ozerova O.Yu., Efimova T.P.,
Novikova T.A., Belik I.V., Berestovitskaya V.M. // Russ.
Novikova T.A. // Chem. Heterocycl. Compd. 2020.
J. Gen. Chem. 2013. Vol. 83. N 9. P. 1779. doi 10.1134/
Vol. 56. N 2. P. 233. doi 10.1007/s10593-020-02649-w
S1070363213090259
9. Ефимова Т.П., Озерова О.Ю., Белик И.В., Новико-
19. Метелкина Э.Л., Новикова Т.А. // ЖОрХ. 1993. Т. 29.
ва Т.А., Берестовицкая В.М. // ЖОХ. 2012. Т. 82.
Вып. 12. С. 2386.
Вып. 8. С. 1330; Efimova T.P., Ozerova O.Yu., Belik I.V.,
20. Морозова Н.С., Метелкина Э.Л., Новикова Т.А.,
Novikova T.A., Berestovitskaya V.M. // Russ. J. Gen.
Шляпочников В.А., Сергиенко О.И., Перекалин В.В. //
Chem. 2012. Vol. 82. N 8. P. 1409. doi 10.1134/
ЖОрХ. 1983. Т. 19. Вып. 6. С. 1228.
S1070363212080129
21. Астахов А.М., Бука Э.С., Ревенко В.А. // Изв. вузов.
10. Ефимова Т.П., Озерова О.Ю., Новикова Т.А., Байчу-
Сер. хим. и хим. технол. 2008. Т. 51. Вып. 10. С. 26.
рин Р.И., Берестовицкая В.М. // ЖОХ. 2014. Т. 84.
22. Певзнер М.С., Гладкова Н.В., Кравченко Т.А. //
Вып. 8. С. 1268; Efimova T.P., Ozerova O.Yu., Noviko-
ЖОрХ. 1996. Т. 32. Вып. 8. С. 1230.
va T.A., Baichurin R.I., Berestovitskaya V.M. // Russ. J.
23. Метелкина Э. Л., Новикова Т. А. // ЖОрХ. 2004.
Gen. Chem. 2014. Vol. 84. N 8. P.1496. doi 10.1134/
Т. 40. Вып. 4. C. 619; Metelkina E.L., Novikova T.A. //
S107036321240800088
Russ. J. Org. Chem. 2004. Vol. 40. N 4. P. 593. doi
11. Berestovitskaya V.M., Ozerova O.Y., Efimova T.P.,
10.1023/B:RUJO.0000036089.08617.1c
Novikova T.A., Gurzhiy V.V.
// Mendeleev
24. Астахов А.М., Васильев А.Д., Молокеев М.С., Ревен-
Commun. 2016. Vol. 26. N 4. P. 323. doi 10.1016/j.
ко В.А., Степанов Р.С. // ЖОрХ. 2005. Т. 41. Вып. 6.
mencom.2016.07.019
С. 928; Astakhov A.M., Vasil’ev A.D., Molokeev M.S.,
12. Берестовицкая В.М., Озерова О.Ю., Ефимова Т.П.,
Revenko V.A., Stepanov R.S. // Russ. J. Org. Chem.
Новикова Т.А. // ЖOрХ. 2015. Т. 51. Вып. 12.
2005. Vol. 41. N 6. P. 910. doi 10.1007/s11178-005-
С. 1830; Berestovitskaya V.M., Ozerova O.Yu., Efimo-
0265-0
va T.P., Novikova T.A. // Russ. J. Org. Chem. 2015. Vol. 12.
25. Сильверстейн Р., Вебстер Ф., Кимл Д. Спектроме-
N 51. P. 1797. doi 10.1134/S1070428015120258
трическая идентификация органических соедине-
13. Метелкина Э.Л. // ЖОрХ. 2008. Т. 44. Вып. 4. С. 500;
ний. М.: БИНОМ. Лаборатория знаний, 2011. 557 с.
Metelkina E.L. // Russ. J. Org. Chem. 2008. Vol. 44.
26. Воловенко Ю.М. Спектроскопия ядерного магнитно-
N 4. P. 450. doi 10.1134/S1070428-008040040
го резонанса для химиков. М.: Научное Партнерство,
14. Astrat’ev A., Dushko D., Stepanov A. // New Trends Res.
2011. 704 с.
Energ. Mater. 2011. Vol. 2. P. 469.
27. Теленюк С.Е., Метелкина Э.Л., Шляпочников В.А.,
15. Озерова О.Ю., Ефимова Т.П., Новикова Т.А. // ЖОХ.
Резчикова К.И. // ЖОХ. 1994. Т. 64. Вып. 7. С. 1186.
2018. Т. 88. Вып. 7. С. 1088; Ozerova O.Yu., Efimo-
28. Ketkar M., Reznik G., Green U. // Cancer Lett. 1978.
va T.P., Novikova T.A. // Russ. J. Gen. Chem. 2018.
Vol. 4. P. 241. doi 10.1016/S0304-3835(78)94842-5
Vol. 88. N 7. P. 1381. doi 10.1134/S1070363218070058
29. Kidwai M., Misra P., Bhushan K. R., Dave B. //
16. Озерова О.Ю., Ефимова Т.П., Новикова Т.А., Бе-
Synth. Commun. 2000. Vol. 30. N 16. P. 3031. doi
рестовицкая В.М. // ЖОХ. 2015. Т. 85. N 11.
10.1080/00397910008087451
С. 1842; Ozerova O.Y., Efimova T.P., Novikova T.A.
30. Henry R.A., Makovsky R.C., Smith G.B.L. // J. Am.
Berestovitskaya V.M. // Russ. J. Gen. Chem. 2015.
Chem. Soc. 1951. Vol. 73. N 1. P. 474. doi 10.1021/
Vol. 85. N 11. P. 2583. doi 10.1134/S1070363215110134
ja01145a513
17. Озерова О.Ю., Ефимова Т.П., Новикова Т.А., Гур-
31. Григоровский А.М., Кимен З.М. // ЖОХ. 1948. Т. 18.
жий В.В., Берестовицкая В.М. // ЖОХ. 2015. Т. 85.
С. 171.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ 5-ЗАМЕЩЕННЫХ N-НИТРО-2,4-ДИГИДРО-(3Н)-1,2,4-ТРИАЗОЛ-3-ИМИНОВ
1195
Synthesis of 5-Substituted N-Nitro-2,4-dihydro-(3H)-
1,2,4-triazole-3-imines
O. Yu. Ozerova*, T. P. Efimova, and T. A. Novikova
Herzen State Pedagogical University of Russia, St. Petersburg, 19186 Russia
* e-mail: kohrgpu@yandex.ru
Received May 6, 2020; revised May 6, 2020; accepted May 16, 2020
The reactions of 1-amino-2-nitroguanidine with carboxylic acid chlorides at room temperature were studied. The
resulting N-(2-nitroguanidino)carboxylic acid amides underwent cyclization to N-nitro-1,2,4-triazolimines when
heated in an aqueous alkaline medium. N-Nitro-1,2,4-triazolimines were also obtained by a one-pot method.
Structure of the synthesized compounds was characterized by 1H, 13C{1H} NMR, IR, and UV spectroscopy
methods.
Keywords: 1-amino-2-nitroguanidine, carboxylic acid chlorides, N-(2-nitroguanidino)carboxylic amides,
N-nitro-1,2,4-triazolimines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020