ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1199-1206
УДК 547.281.1:547.299:547.435.43
N-ГИДРОКСИМЕТИЛИРОВАНИЕ
3-АРИЛ-2-ЦИАНОПРОП-2-ЕНТИОАМИДОВ
© 2020 г. В. В. Доценкоa,b*, Е. А. Чигоринаc,d, С. Г. Кривоколыскоa
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
c Национальный исследовательский центр «Курчатовский институт» - ИРЕА, Москва, 107076 Россия
d Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 4 апреля 2020 г.
После доработки 4 апреля 2020 г.
Принято к печати 14 апреля 2020 г.
(Е)-3-Арил-2-цианопроп-2-ентиоамиды легко гидроксиметилируются при нагревании с водно-спиртовым
раствором формальдегида с образованием (E)-3-арил-N-(гидроксиметил)-2-цианопроп-2-ентиоамидов.
Проведен прогнозный анализ биологической активности полученных соединений in silico.
Ключевые слова: 2-цианоэтантиоамид, (Е)-3-арил-2-цианопроп-2-ентиоамиды, N-гидроксиметилиро-
вание, N-(гидроксиметил)тиоамиды, реакция Манниха
DOI: 10.31857/S0044460X20080077
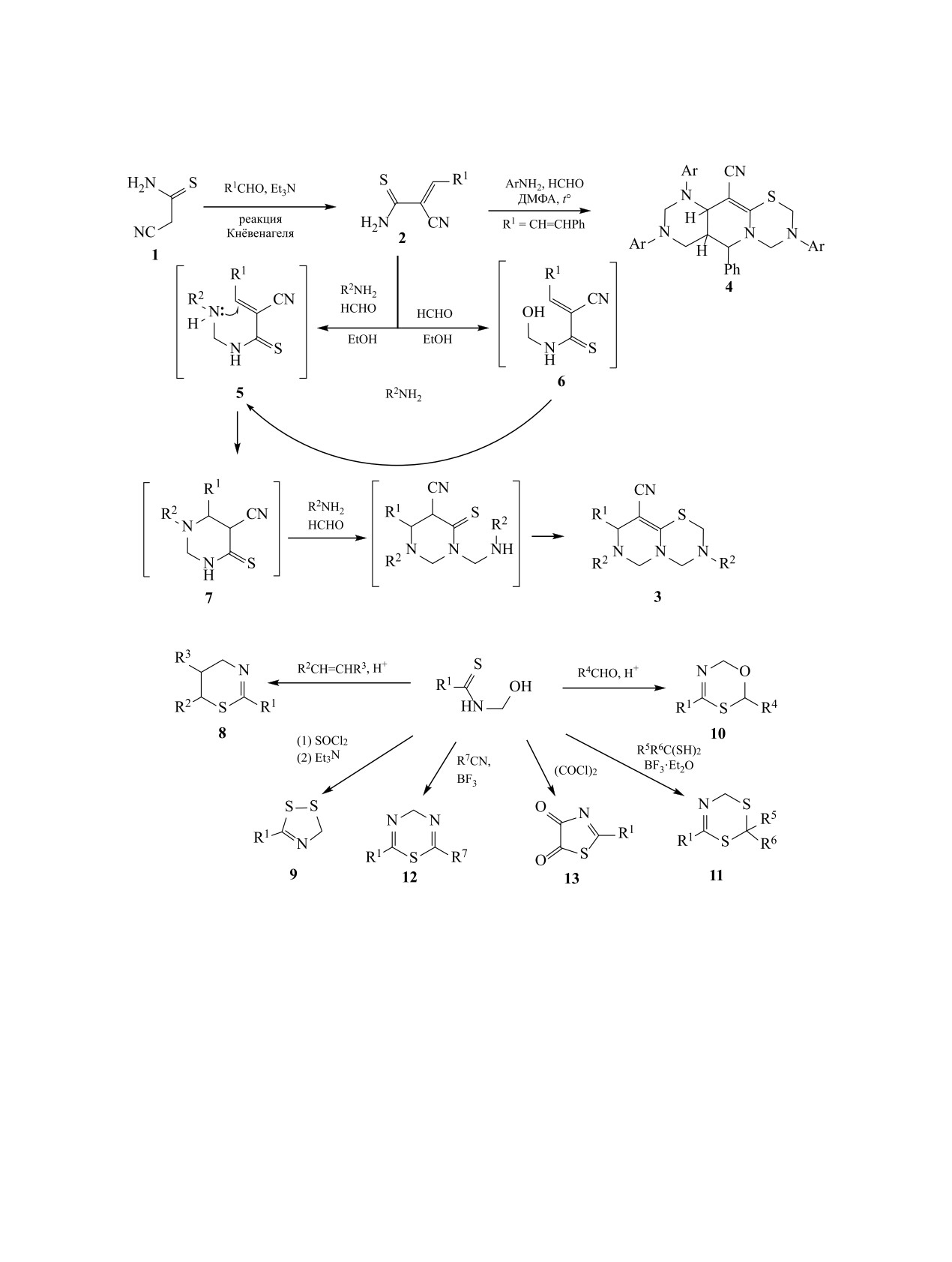
Продукты конденсации 2-цианоэтантиоамида
первоначального N-гидроксиметилирования с об-
1 с альдегидами - (Е)-3-арил-2-цианоакрилтиоа-
разованием N-(гидроксиметил)тиоамидов 6. Ни
миды 2 (3-арил-2-цианопроп-2-ентиоамиды) - за-
один из интермедиатов 5-7 не был выделен в ин-
рекомендовали себя в качестве легкодоступных
дивидуальном виде.
и многофункциональных исходных реагентов в
Нами изучено взаимодействие формальдегида с
химии S,N-соединений [1-3], в первую очередь,
3-арил-2-цианоакрилтиоамидами 2 в качестве воз-
гетероциклического ряда - производных тиофена,
можного способа получения N-(гидроксиметил)-
тиеноазинов, 1,3,5-тиадиазина и др. [4-11].
тиоамидов 6 - перспективных тиоамидоалкилиру-
Непредельные тиоамиды 2 в условиях реакции
ющих агентов и возможных интермедиатов в син-
Манниха в результате каскадных превращений
тезе конденсированных гетероциклов 1,3,5-тиа-
легко образуют производные гексагидропирими-
диазинового ряда.
до[4,3-b][1,3,5]тиадиазина 3 [12–15] или декаги-
N-(Гидроксиметил)тиоамиды достаточно легко
дропиримидо[4ʹ,5ʹ:4,5]пиримидо[2,1-b][1,3,5]-
образуются из формальдегида и тиоамидов с пер-
тиадиазина 4 [16] (схема 1). Производные 1,3,5-ти-
вичными либо вторичными аминогруппами часто в
адиазина обладают широким спектром биологиче-
присутствии основания [20-28]. Такие соединения
ской активности и практически полезных свойств
обладают повышенной гидрофильностью (в срав-
[10, 11, 17-19], в связи с чем разработка простых
нении с тиоамидами), могут использоваться как
методов получения конденсированных 1,3,5-тиа-
бидентатные лиганды для создания селективных
диазинов является актуальной задачей.
сорбентов для ионов тяжелых металлов [29-31],
На первой стадии, вероятно, протекает N-амино-
как тиоамидоалкилирующие агенты [20, 24-25,
метилирование тиоамидов 2, на второй - цикли-
32-34], а также как реагенты в синтезе произво-
зация N-(аминометил)тиоамидов 5 в пергидропи-
дных 1,3-тиазина 8 [26, 35, 36], 1,2,4-дитиазола 9
римидины 7, на третьей - замыкание 1,3,5-тиа-
с выраженным фунгицидным действием [37-39],
диазинового цикла. Однако нельзя исключать и
6H-1,3,5-оксатиазина 10 [27, 40], 4H-1,3,5-дити-
1199
1200
ДОЦЕНКО и др.
Схема 1.
Схема 2.
азина
11 [41, 42], 4H-1,3,5-тиадиазина 12 [43],
тил)тиоамиды 6 обладают чуть более интенсивной
тиазолидина 13 [44] (схема 2). Кроме того, N-(ги-
окраской, чем исходные соединения 2. Умерен-
дроксиметил)тиоамиды обнаруживают антибакте-
ные выходы (46-60%) можно объяснить заметно
риальные [22, 45, 46], антилепрозные свойства [47]
большей (в сравнении с исходными тиоамидами
и являются ключевыми интермедиатами в синтезе
2) растворимостью соединений в водно-спирто-
ряда биологически активных веществ [23, 48-50].
вой среде, а также протеканием побочной реакции
сольволиза (ретро-Кнёвенагеля) исходных акрил-
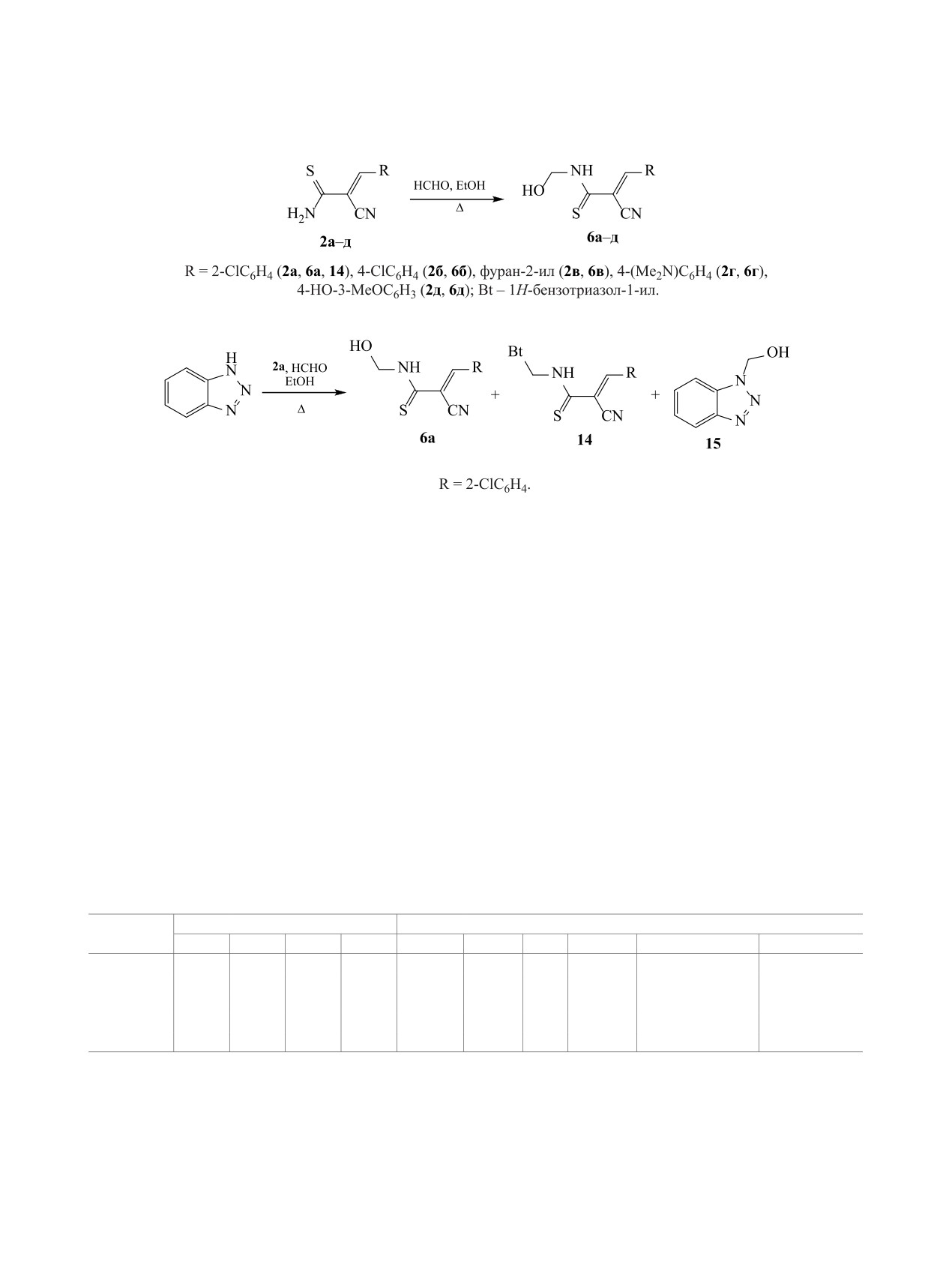
Нами установлено, что непредельные тиоа-
тиоамидов 2. Добавление как основных (K2CO3),
миды 2a-д легко реагируют с избытком водного
так и кислотных (водн. HCl) катализаторов приво-
37%-ного формалина при нагревании в EtOH в
дит к осмолению реакционной массы.
отсутствие катализаторов с образованием ранее
не описанных в литературе продуктов N-гидрок-
Строение полученных соединений подтверж-
симетилирования 6a-д (схема 3). N-(Гидроксиме-
дено данными ЯМР, ИК спектроскопии и ВЭЖХ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
N-ГИДРОКСИМЕТИЛИРОВАНИЕ
1201
Схема 3.
Схема 4.
МС. В спектрах ЯМР 1H соединений 6 наблюдают-
согласно данным ВЭЖХ-МС и ЯМР, труднораз-
ся характерные сигналы: синглет протона Ar-CH=
делимую смесь исходного соединения 2а, N-(ги-
при 7.90-8.09 м. д., уширенный сигнал протона
дроксиметил)тиоамида 6а, тиоамида 14 и 1Н-бен-
NH при 10.22-10.99 м. д., мультиплет протонов
зотриазол-1-илметанола 15 (схема 4) [56].
группы СН2 (5.00-5.07 м. д.) и триплет протона
С целью первичной оценки перспектив прак-
группы OH (5.87-6.33 м. д.). В ИК спектрах об-
тического использования соединения 6a-д были
наруживаются полосы поглощения, соответству-
подвергнуты анализу in silico на сходство с ле-
ющие валентным колебаниям связей N-H, O-H и
карственными препаратами (drug-likeness). Были
сопряженной связи C≡N.
спрогнозированы параметры ADMET (Absorption,
Получение и использование N-(1Н-бензотриа-
Distribution, Metabolism, Excretion, Toxicity) и
зол-1-илметил)тиоамидов как эффективных тио-
предполагаемая биологическая активность. Для
амидоалкилирующих агентов описано в работах
расчетов использовали программные продукты:
[51-55]. При попытке получить N-(1Н-бензотри-
OSIRIS Property Explorer [57], SwissADME [58],
азол-1-илметил)-3-(2-хлорфенил)проп-2-ентиоа-
admetSAR [59], Molinspiration Property Calculation
мид 14 при кратковременном кипячении 1Н-бен-
Service [60], AntiBac-Pred [61] и PASS Online [62,
зотриазола, тиоамида 2а и HCHO в EtOH нами
63]. Сервис OSIRIS Property Explorer был исполь-
получен продукт реакции, представляющий,
зован для оценки сLogP (меры липофильности),
Таблица 1. Риски токсичности и физико-химические параметры соединений 6а-д, вычисленные с помощью сервиса
OSIRIS Property Explorer
Риск токсичностиa
Физико-химические параметры
№
А
В
С
D
сLogP
LogS
M
TPSAб
drug likenessв
drug Scoreг
6a
±
+
+
+
1.86
-4.26
252
88.14
-3.25
0.071
6б
±
+
+
+
1.86
-4.26
252
88.14
-3.03
0.072
6в
+
+
+
+
0.44
-3.2
208
101.2
-4.32
0.059
6г
+
+
+
+
1.15
-3.56
261
91.38
-8.22
0.056
6д
±
+
+
+
0.84
-3.24
264
117.6
-3.26
0.08
a Знак «±» указывает на прогнозируемую умеренно-высокую токсичность, «+» - высокий риск токсичности. A - Мутагенность,
B - канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
б Topological Polar Surface Area, площадь топологической полярной поверхности.
в Сходство с лекарственными препаратами.
г Фармакологический потенциал соединения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1202
ДОЦЕНКО и др.
Таблица 2. Расчетные параметры ADMET (Absorption, Distribution, Metabolism, Excretion, Toxicity) для соединений
6а-д
Ингибирование цитохромов Р450*
Острая
Проник-
Тест
токсичность
№
новение через
Эймсаa
(крысы) LD50,
CYP1A2
CYP2C19
CYP2C9
CYP2D6
CYP3A4
ГЭБa
log[1/(моль/кг)]
6a
+
+
+
+
+
-
-
+
2.4684
0.8544
0.8122
0.5363
6б
+
+
+
+
+
-
+
+
2.5466
0.8624
0.8406
0.5128
6в
+
+
+
-
-
-
-
-
2.6156
0.8999
0.8577
0.5790
6г
+
+
+
-
-
-
-
+
2.5859
0.7173
0.6971
0.5214
6д
+
-
+
-
-
-
-
-
2.5286
0.8789
0.7855
0.5061
a Знаки «+» или «-» означают наличие или отсутствие эффекта, число - вероятность эффекта в долях от единицы.
logS (растворимости), TPSA (Topological Polar
барьер (ГЭБ) (кроме соединения 6д, табл. 2). Со-
Surface Area, площади топологической полярной
гласно расчету с использованием admetSAR [59],
поверхности), рисков побочных эффектов (мута-
все соединения относятся к III категории по кри-
генные, онкогенные, репродуктивные эффекты),
териям острой пероральной токсичности US EPA
параметра drug-likeness, а также общей оценки
(500 мг/кг < LD50 < 5000 мг/кг). Расчеты также по-
фармакологического потенциала соединения (drug
казывают незначительную вероятность мутаген-
score) [57]. Был проведен первичный анализ струк-
ного/канцерогенного эффекта в тесте Эймса (кро-
туры на соответствие «правилу пяти» К. Липински
ме соединений 6в, д). Расчет с использованием
(сLogP ≤ 5.0, молекулярная масса (M) ≤ 500, TPSA ≤
сервиса Molinspiration Property Calculation Service
140, число акцепторов водородных связей ≤ 10,
указывают на наиболее вероятную активность со-
доноров ≤ 5) [64-66]. Расчетные данные, получен-
единений 6г, д в качестве ингибиторов киназ (ин-
ные с помощью сервиса OSIRIS Property Explorer,
декс Molinspiration bioactivity score -0.24).
представлены в табл. 1.
Расчет вероятной антибактериальной активно-
Как видно из представленных результатов, со-
сти с помощью сервиса AntiBac-Pred [61] указыва-
единения 6a-д демонстрируют соответствие кри-
ет на вероятную активность соединения 6г в отно-
териям «правила пяти» Липински по параметрам
шении патогенных грамположительных бактерий
растворимости, липофильности, TPSA и молеку-
Nocardia transvalensis [показатель confidence (С)
лярной массы. Однако для всех соединений рас-
0.34, рассчитывается как превышение вероятно-
четы дают низкие оценки фармакологического
сти активности над вероятностью неактивности,
PA > PI]. По данным, полученным с использовани-
потенциала соединения (drug score) и сходства с
известными лекарственными препаратами (drug-
ем сервиса PASS Online [62, 63], для соединений
likeness); кроме того, прогнозируются высокие
6а, б, г, д ожидается противоопухолевое действие
риски токсичности. Расчет параметров ADMET
(ингибирование тирозинкиназ с вероятностью
[58, 59] дает для всех соединений прогноз хоро-
0.77-0.87).
шей гастроэнтеральной абсорбции и возможно-
Таким образом, (Е)-3-арил-2-цианопроп-2-ен-
сти проникновения через гематоэнцефалический
тиоамиды легко реагируют с формальдегидом
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
N-ГИДРОКСИМЕТИЛИРОВАНИЕ
1203
с образованием (E)-3-арил-N-(гидроксиметил)-
10.98-10.99 м (1H, NH). Масс-спектр, m/z (Iотн, %):
2-цианопроп-2-ентиоамидов. Прогноз биологиче-
235.1 [M - H2O + H]+, 331.1 [M + ДМСО + H]+,
ской активности показал невысокие перспекти-
487.3 [2M -H2O + H]+, 522.5 [2M + NH4]+, 741.5
вы включения синтезированных соединений в их
[3M - H2O + H]+. Найдено, %: С 52.17; H 3.71; N
дальнейший биоскрининг. Реакции тиоамидоалки-
11.16. С11Н9ClN2ОS. Вычислено, %: С 52.28; H
лирования с участием полученных соединений и
3.59; N 11.08. Mвыч 252.72.
перспективы их использования в агрохимии в на-
(E)-N-(Гидроксиметил)-3-(4-хлорфенил)-2-
стоящее время изучаются.
цианопроп-2-ентиоамид (6б). Выход 46%, оран-
жевый порошок. ИК спектр, ν, см-1: 3390, 3325
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(O-H, N-H), 2222 (C≡N). Спектр ЯМР 1Н (200 МГц,
Спектры ЯМР 1Н записаны на спектрометрах
ДМСО-d6), δ, м. д.: 5.00-5.06 м (2H, СH2), 6.32
Bruker DPX-400 (400.40 MГц) и Bruker WP200
т (1H, OH, 3J = 7.1 Гц), 7.64 д (2H, H3,5Ar, 3J =
(199.97 МГц) в ДМСО-d6 или в CDCl3. Внутрен-
8.6 Гц), 7.90 с (1H, CH=), 7.92 д (2H, H2,6Ar, 3J =
ний стандарт - ТМС или остаточные сигналы рас-
8.6 Гц), 10.90-10.92 м (1H, NH). Спектр ЯМР 1Н
творителя. ИК спектры записаны на спектрометре
(400 МГц, CDCl3), δ, м. д.: 4.29 т (1H, OH, 3J =
ИКС-29 в вазелиновом масле. ВЭЖХ-МС анализ
8.4 Гц), 5.22-5.26 м (2H, СH2), 7.49 д (2H, H3,5Ar,
проведен на жидкостном хроматографе Shimadzu
3J = 8.6 Гц), 7.93 д (2H, H2,6Ar, 3J = 8.6 Гц), 8.59-8.62
LC-10AD с детекторами Shimadzu SP D-10A UV-
м (1H, NH), 8.72 с (1H, CH=). Масс-спектр, m/z
Vis (254 нм) и Sedex 75 ELSD, совмещенном с
(Iотн, %): 235.3 [M - H2O + H]+, 253.1 [M + H]+,
масс-спектрометром PE SCIEX API 150EX, метод
331.1 [M + ДМСО + H]+, 487.3 [2M - H2O + H]+,
ионизации - ES-API. Элементный анализ выпол-
522.3 [2M + NH4]+. Найдено, %: С 52.26; H 3.63;
нен на C,H,N-анализаторе Carlo Erba 1106. Чи-
N 11.05. С11Н9ClN2ОS. Вычислено, %: С 52.28; H
стоту полученных соединений контролировали
3.59; N 11.08. Mвыч 252.72.
методом ТСХ на пластинах Silufol UV254, элюент -
(E)-N-(Гидроксиметил)-3-(фуран-2-ил)-2-ци-
ацетон-гексан (1:1), проявитель - пары иода, УФ
анопроп-2-ентиоамид (6в). Выход 54%, оран-
детектор.
жево-коричневый порошок. ИК спектр, ν, см-1:
Исходные (Е)-3-арил-2-цианопроп-2-ентиоами-
3420, 3210 (O-H, N-H), 2215 (C≡N). Спектр ЯМР
ды 2 получали при взаимодействии 2-цианоэтан-
1Н (200 МГц, ДМСО-d6), δ, м. д.: 5.00-5.04 м (2H,
тиоамида 1 [67] с ароматическими альдегидами в
СH2), 6.20 т (1H, OH, 3J = 7.2 Гц), 6.83-6.84 м (1H,
присутствии каталитических количеств Et3N [68].
H4фурил), 7.41 д (1H, H3фурил, 3J = 3.7 Гц), 7.90 с (1H,
Общая методика получения (E)-3-арил-N-
CH=), 8.13-8.14 м (1H, H5фурил), 10.63-10.64 м (1H,
(гидроксиметил)-2-цианопроп-2-ентиоамидов
NH). Масс-спектр, m/z (Iотн, %): 209.1 [M + H]+,
6а-д. К суспензии 0.5 г непредельного тиоамида
269.3 [M -H2O + ДМСО + H]+, 287.1 [M + ДМСО +
2а-д в 3-4 мл EtOH добавляли равный объем 37%-
H]+, 399.1 [2M - H2O + H]+, 434.4 [2M + NH4]+,
ного водного раствора НСНО. Смесь кипятили 3-
607.5 [3M - H2O + H]+. Найдено, %: С 51.87; H
5 мин. При охлаждении из образовавшегося свет-
3.93; N 13.46. С9Н8N2О2S. Вычислено, %: С 51.91;
ло-красного раствора кристаллизовался продукт
H 3.87; N 13.45. Mвыч 208.24.
реакции, который отфильтровывали на фильтре
(E)-N-(Гидроксиметил)-3-[(4-диметиламино)-
Шотта, промывали охлажденным EtOH и сушили.
фенил]-2-цианопроп-2-ентиоамид
(6г).
Вы-
Получали аналитически чистые образцы соедине-
ход 60%, красные кристаллы. Спектр ЯМР 1Н
ний 6а-д.
(400 МГц, ДМСО-d6), δ, м. д.: 5.02-5.05 м (2H,
(E)-N-(Гидроксиметил)-3-(2-хлорфенил)-
СH2), 6.07 т (1H, OH, 3J = 7.1 Гц), 6.82 д (2H,
2-цианопроп-2-ентиоамид
(6а). Выход
49%,
H3,5Ar, 3J = 8.8 Гц), 7.87 д (2H, H2,6Ar, 3J = 8.8 Гц),
оранжевые кристаллы. ИК спектр, ν, см-1: 3415,
7.96 с (1H, CH=), 10.31-10.32 м (1H, NH). Масс-
3300-3210 (O-H, N-H), 2222 (C≡N). Спектр ЯМР
спектр, m/z (Iотн, %): 262.3 [M + H]+, 379.5 [M +
1Н (200 МГц, ДМСО-d6), δ, м. д.: 5.02-5.07 м (2H,
ДМСО + K]+, 397.3 [M + H2O + ДМСО + K]+, 523.3
СH2), 6.33 т (1H, OH, 3J = 7.0 Гц), 7.49-7.67 м
[2M + H]+. Найдено, %: С 59.70; H 5.83; N 16.11.
(3H, HAr), 7.96-7.99 м (1H, HAr), 8.09 с (1H, CH=),
С13Н15N3ОS. Вычислено, %: С 59.74; H 5.79; N
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1204
ДОЦЕНКО и др.
16.08. Mвыч 261.34.
КОНФЛИКТ ИНТЕРЕСОВ
(E)-3-(4-Гидрокси-3-метоксифенил)-N-(ги-
Авторы заявляют об отсутствии конфликта
дроксиметил)-2-цианопроп-2-ентиоамид
(6д).
интересов.
Выход 51%, желтый порошок. Спектр ЯМР 1Н
СПИСОК ЛИТЕРАТУРЫ
(400 МГц, ДМСО-d6), δ, м. д.: 5.06-5.07 м (2H,
СH2), 5.87 т (1H, OH, 3J = 7.0 Гц), 6.89 д (1H, H5Ar,
1. Литвинов В.П. // Усп. хим. 1999. Т. 68. № 9. С. 817;
3J = 8.4 Гц), 7.40 д (1H, H6Ar, 3J = 8.4 Гц), 7.71 с (1H,
Litvinov V.P. // Russ. Chem. Rev. 1999. Vol. 68. N 9.
H3Ar), 8.03 с (1H, CH=), 10.02 уш. с (1Н, ArOH),
P. 737. doi 10.1070/RC1999v068n09ABEH000533
2. Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. //
10.22-10.23 м (1H, NH). Масс-спектр, m/z (Iотн,
Усп. хим. 2018. Т. 87. № 9. С. 1; Dyachenko V.D.,
%): 265.3 [M + H]+, 382.3 [M + NH4]+, 546.3 [2M +
Dyachenko I.V., Nenajdenko V.G. // Russ. Chem. Rev.
NH4]+. Найдено, %: С 54.61; H 4.55; N 10.66.
2018. Vol. 87. N 1. P. 1. doi 10.1070/RCR4760
С12Н12N2О3S. Вычислено, %: С 54.53; H 4.58; N
3. Магеррамов А.М., Шихалиев Н.Г., Дяченко В.Д., Дя-
10.60. Mвыч 264.30.
ченко И.В., Ненайденко В.Г. α-Цианотиоацетамид.
Взаимодействие
3-(2-хлорфенил)-2-циано-
М.: Техносфера, 2018. 224 с.
проп-2-ентиоамида
2а с формальдегидом
4. Литвинов В.П. // Изв. АН. Сер. хим. 1998. № 11.
и
1Н-бензотриазолом. К суспензии
500 мг
С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998.
(2.25 ммоль) соединения 2а и 270 мг (2.27 ммоль)
Vol. 47. N 11. P. 2053. doi 10.1007/BF02494257
1H-бензотриазола в 5 мл 96%-ного этанола при
5. Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. //
перемешивании добавляли избыток (1.0 мл) 37%-
ХГС. 1999. № 5. С. 579; Litvinov V.P., Krivokolys-
ko S.G., Dyachenko V.D. // Chem. Heterocycl. Compd.
ного водного раствора формальдегида. Смесь
1999. Vol. 35. N 5. P. 509. doi 10.1007/BF02324634
кипятили 5 мин, из образовавшегося светло-крас-
6. Литвинов В.П., Доценко В.В., Кривоколыско С.Г. //
ного раствора при охлаждении через ~15 мин
Изв. АН. Сер. хим. 2005. № 4. С. 847; Litvinov V.P.,
выпадал осадок, который отфильтровывали, про-
Dotsenko V.V., Krivokolysko S.G. // Russ. Chem. Bull.
мывали этанолом и сушили. Получили 379 мг
2005. Vol. 54. N 4. P. 864. doi 10.1007/s11172-005-
оранжевого порошка, который, по данным ЯМР
0333-1
1Н, представляет собой смесь N-(гидроксиметил)
7. Литвинов В.П. // Рос. хим. ж. 2005. Т. 49. № 6. С. 11.
тиоамида 6а (~ 37 мол%), 1-Н-бензотриазол-1-ил-
8. Litvinov V.P., Dotsenko V.V., Krivokolysko S.G. // Adv.
метанола 15 (~ 40 мол%), исходного тиоамида 2а
Heterocycl. Chem. 2007. Vol. 93. P. 117. doi 10.1016/
(~ 14 мол%) и продукта аминометилирования 14
S0065-2725(06)93003-7
(~ 9 мол%). Идентифицированные сигналы компо-
9. Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7. С. 645;
нентов смеси в спектре ЯМР 1Н (400 МГц, ДМ-
Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75. N 7.
СО-d6), δ, м. д.: соединение 2а, 8.27 с (1Н, CH=),
P. 577. doi 10.1070/RC2006v075n07ABEH003619
9.73 уш. с (CSNH2), 10.25 уш. с (CSNH2); соедине-
10. Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
ние 6а, 5.03-5.07 м (2H, СH2), 6.32 м (1H, OH), 8.10 с
ХГС. 2015. Т. 51. № 2. С. 109; Dotsenko V.V., Fro-
(1H,CH=), 10.98-10.99 м (1H, NH); 1-Н-бензотриа-
lov K.A., Krivokolysko S.G. // Chem. Heterocycl.
зол-1-илметанол 15, 6.02 д (2H, CH2OH, 3J = 7.0 Гц),
Compd. 2015. Vol. 51. N 2. P. 109. doi 10.1007/s10593-
015-1668-7
7.19 т (1H, OH, 3J = 7.0 Гц), 8.06 д (1H, H4Ar, 3J =
11. Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
8.6 Гц); соединение 14, 6.60 д (2H, CH2NH, 3J =
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв.
5.1 Гц), 8.17 с (1H, CH=), 11.66 (1H, CH2NH, 3J =
АН. Сер. хим. 2019. № 4. С. 691; Dotsenko V.V., Fro-
5.1 Гц). Масс-спектр, m/z: 120.4 [M (BtH) + H]+,
lov K.A., Chigorina E.A., Khrustaleva A.N., Bibik E.Yu.,
150.1 [M (15) + H]+, 223.3 [M (2а) + H]+, 331.1
Krivokolysko S.G. // Russ. Chem. Bull. 2019. Vol. 68.
[M (6a) +ДМСО + H]+, 354.1 [M (14) + H]+, 487.0
N 4. P. 691. doi 10.1007/s11172-019-2476-5
[2M (6а) - H2O + H]+, 522.2 [2M (6а) + NH4]+, 709.2
12. Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
[2M (14) + H]+, 1062.2 [3M (14) + H]+.
ХГС. 2012. № 4. С. 689; Dotsenko V.V., Frolov K.A.,
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2012.
ФОНДОВАЯ ПОДДЕРЖА
Vol. 48. N 4. P. 642. doi 10.1007/s10593-012-1038-7
Работа выполнена при финансовой поддержке
13. Доценко В.В., Фролов К.А., Кривоколыско С.Г.,
Министерства образования и науки Российской
Литвинов В.П. // Изв. АН. Сер. хим. 2009. № 7.
Федерации (тема 0795-2020-0031).
С. 1436; Dotsenko V.V., Frolov K.A., Krivokolysko S.G.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
N-ГИДРОКСИМЕТИЛИРОВАНИЕ
1205
Litvinov V.P., // Russ. Chem. Bull. 2009. Vol. 58. N 7.
P. 305. doi 10.1134/S1070363216020171
P. 1479. doi 10.1007/s11172-009-0199-8
29. Liu C.Y., Hu C.C., Yeh K.Y., Chen M.J. // Fresenius J.
14. Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
Anal. Chem. 1991. Vol. 339. N 12. P. 877. doi 10.1007/
Изв. АН. Сер. хим. 2007. № 7. С. 1420; Dotsen-
BF00321669
ko V.V., Krivokolysko S.G., Litvinov V.P. // Russ. Chem.
30. Liu C.Y., Chang H.T., Hu C.C. // Inorg. Chim. Acta.
Bull. 2007. Vol. 56. N 7. P. 1474. doi 10.1007/s11172-
1990. Vol. 172. N 2. P. 151. doi 10.1016/S0020-
007-0226-6
1693(00)80850-6
15. Dotsenko V.V., Frolov K.A., Krivokolysko S.G.,
31. Liu C.Y., Chen M.J., Chai T.J. // J. Chromatogr. (A).
Chernega A.N., Litvinov V.P. // Monatsh. Chem. 2006.
1991. Vol. 555. N 1-2. P. 291. doi 10.1016/S0021-
Bd 137. N 8. S. 1089. doi 10.1007/s00706-006-0512-2
9673(01)87192-2
16. Фролов К.А., Доценко В.В., Кривоколыско С.Г. //
32. Мартинович Ю.А., Рамш С.М., Хамуд Ф., Фунда-
ХГС. 2012. № 10. С. 1668; Frolov K.A., Dotsenko V.V.,
менский В.С., Гуржий В.В., Захаров В.И., Храбро-
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2013.
ва Е.С. // ЖОрХ. 2018. Т. 54. Вып. 6. С. 876;
Vol. 48. N 10. P. 1555. doi 10.1007/s10593-013-1173-9
Martinovich Y.A., Ramsh S.M., Hamoud F., Funda-
17. Shobana N., Farid P. // Compr. Heterocycl. Chem. III.
menskii V.S., Gurzhii V.V., Zakharov V.I., Khrabrova E.S. //
2008. Vol. 9. P. 457. doi 10.1016/B978-008044992-
Russ. J. Org. Chem. 2018. Vol. 54. N 6. P. 878. doi
0.00809-9
10.1134/S107042801806009X
18. Bermello J.C., Piñeiro R.P., Fidalgo L.M., Cabrera H.R.,
33. Драч Б.С., Броварец В.С., Смолий О.Б. Синтезы
Navarro M.S. // The Open Med. Chem. J. 2011. Vol. 5.
азотсодержащих гетероциклических соединений на
P. 51. doi 10.2174/1874104501105010051
основе амидоалкилирующих агентов. Киев: Наукова
19. Rodríguez H., Suárez M., Albericio F. // Molecules.
думка, 1992. 176с.
2012. Vol. 17. N 7. P. 7612. doi 10.3390/
34. Лазарев Д.Б., Рамш С.М., Иваненко А.Г. // ЖОХ.
molecules17077612
2000. Т. 70. Вып. 3. С. 475; Lazarev D.B., Ramsh S.M.,
20. Хамуд Ф., Рамш С.М., Фундаменский В.С., Гур-
Ivanenko A.G. // Russ. J. Gen. Chem. 2000. Vol. 70.
жий В.В., Брусина М.А., Архипова Н.Г., Седуно-
N 3. P. 442.
ва П.А., Медведский Н.Л., Храброва Е.С. // ЖОрХ.
35. Simon L., Talpas G.S., Fülöp F., Bernáth G., Sohár P. //
2016. Т. 52. Вып. 1. С. 127; Hamoud F., Ramsh S.M.,
Acta Chim. Hung. 1985. Vol. 118. N 1. P. 37.
Fundamenskii V.S., Gurzhii V.V., Brusina M.A.,
36. Giordano C. // Synthesis. 1972. Vol. 1972. N 1. P. 34.
Arkhipova N.G., Sedunova P.A., Medvedskii N.L.,
doi 10.1055/s-1972-21822
Khrabrova E.S. // Russ. J. Org. Chem. 2016. Vol. 52.
37. Böhme H., Ahrens K.H. // Tetrahedron Lett. 1971.
N 1. P. 121. doi 10.1134/S1070428016010231
Vol. 12. N 2. P. 149. doi 10.1016/S0040-4039(01)96382-8
21. Yamada T., Nobuhara Y., Yamaguchi A., Ohki M. // J.
38. Böhme H., Ahrens K.H. // Arch. Pharm. 1974. Vol. 307.
Med. Chem. 1982. Vol. 25. N 8. P. 975. doi 10.1021/
N 11. P. 828. doi 10.1002/ardp.19743071104
jm00350a018
39. Böhme H., Ahrens K.H. US Pat. 3718659 (1973).
22. Yamamoto S., Toida I., Watanabe N., Ura T. //
40. Giordano C., Belli A., Erbea R., Panossian S. //
Antimicrob. Agents Сhemother. 1995. Vol. 39. N 9.
Synthesis. 1979. Vol. 1979. N 10. P. 801. doi 10.1055/s-
P. 2088. doi 10.1128/AAC.39.9.2088
1979-28836
23. Pastor A., Machelart A., Li X., Willand N., Baulard A.,
41. Giordano C., Belli A. // Synthesis. 1977. Vol. 1977. N 3.
Brodin P., Gref R., Desmaёle D. // Org. Biomol. Chem.
P. 193. doi 10.1055/s-1977-24319
2019. Vol. 17. N 20. P. 5129. doi 10.1039/C9OB00680J
42. Giordano C., Belli A., Bellotti V. // Synthesis. 1978.
24. Böhme H., Hotzel H.-H. // Arch. Pharm. 1967. Vol. 300.
Vol. 1978. N 6. P. 443. doi 10.1055/s-1978-24774
N 3. P. 241. doi 10.1002/ardp.19673000309
43. Giordano C., Belli A., Bellotti V. // Synthesis. 1975.
25. Böhme H., Ahrens K.H., Hotzel H.-H. // Arch.
Vol. 1975. N 4. P. 266. doi 10.1055/s-1975-23728
Pharm. 1974. Vol. 307. N 10. P. 748. doi 10.1002/
44. Böhme H., Matusch R., Tippmann E. // Arch.
ardp.19743071004
Pharm. 1976. Vol. 309. N 9. P. 761. doi 10.1002/
26. Trivedi J.P., Sanghvi J.S. // J. Ind. Chem. Soc. 1978.
ardp.19763090914
Vol. 55. N 2. P. 195.
45. Plech T., Wujec M., Kosikowska U., Malm A.,
27. Giordano C., Belli A. // Synthesis. 1975. Vol. 1975.
Barylka M., Chalas A., Kapron B. // Lett. Drug
N 12. P. 789. doi 10.1055/s-1975-23928
Design Discovery. 2012. Vol. 9. N 6. P. 633. doi
28. Калдрикян М.А., Минасян Н.С., Мелик-Оганджа-
10.2174/157018012800673056
нян Р.Г. // ЖОХ. 2016. Т. 86. Вып. 2. С. 277;
46. Mazzone G., Bonina F., Blandino G. // Farmaco. 1981.
Kaldrikyan M.A., Minasyan N.S., Melik-Ogandza-
Vol. 36. N 12. P. 1004
nyan R.G. // Russ. J. Gen. Chem. 2016. Vol. 86. N 2.
47. Shepard C.C., Jenner P.J., Ellard G.A., Lancaster R.D. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1206
ДОЦЕНКО и др.
Int. J. Lepr. 1985. Vol. 53. N 4. P. 587.
Molinspiration Cheminformatics, Slovak Republic,
48. Chaturvedi S.C., Bhatia A., Sharma A., Mishra S.H. //
Ind. J. Pharm. Sci. 1984. Vol. 46. N 1. P. 10.
61. Way2Drug, AntiBac-Pred. Avail. Laboratory for
49. Wijma J., Van Daalen J.J., Daams J., Van Deursen F.W. //
Structure-Function Based Drug Design, Institute of
J. Agric. Food Chem. 1970. Vol. 18. N 4. P. 674. doi
Biomedical Chemistry (IBMC), Moscow, Russia. http://
10.1021/jf60170a013
way2drug.com/antibac/
50. El Barbary A.A., Hammouda H.A. // Arch. Pharm. 1984.
62. Филимонов Д.А., Лагунин А.А., Глориозова Т.А., Ру-
Vol. 317. N 6. P. 547. doi 10.1002/ardp.19843170611
дик А.В., Дружиловский Д.С., Погодин П.В., Порой-
51. Katritzky A. R., Denisko O., Lang H. // Tetrahedron.
ков В.В. // ХГС. 2014. № 3. С. 483; Filimonov D.A.,
1995. Vol. 51. N 32. P. 8703. doi 10.1016/0040-
Lagunin A.A., Gloriozova T.A., Rudik A.V., Druzhilovskii
4020(95)00483-O
D.S., Pogodin P.V., Poroikov V.V. // Chem. Heterocycl.
52. Katritzky A.R., Huang T.B., Voronkov M.V., Wang M.,
Compd. 2014. Vol. 50. N 3. P. 444. doi 10.1007/s10593-
Kolb H. // J. Org. Chem. 2000. Vol. 65. N 25. P. 8819.
014-1496-1
doi 10.1021/jo001160w
63. PASS Online. Laboratory for Structure-Function
53. Katritzky A.R., Celik I., Abdel-Fattah A.A.A. //
Based Drug Design, Institute of Biomedical Chemistry
Synthesis. 2007. Vol. 2007. N 11. P. 1655. doi 10.1055/
s-2007-966064
passonline/predict.php
54. Katritzky A.R., Drewniak M. // Tetrahedron Lett.
64. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
1988. Vol. 29. N 15. P. 1755. doi 10.1016/S0040-
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
4039(00)82034-1
10.1016/S0169-409X(96)00423-1
55. Katritzky A.R., Drewniak M., Lue P. // J. Org. Chem.
65. Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
1988. Vol. 53. N 25. P. 5854. doi 10.1021/jo00260a011
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
56. Denisko O.V., Bischoff L., Wang M., Lu P., Zakarian A.
66. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
In: Encyclopedia of Reagents for Organic Synthesis.
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
2018. doi 10.1002/047084289X.rn00357.pub3
10.1016/j.addr.2012.09.019
57. Sander T. OSIRIS Property Explorer. Idorsia
67. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
chemistry.org/prog/peo/
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
58. Daina A., Michielin O., Zoete V. // Sci. Reports. 2017.
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
Vol. 7. Article N 42717. doi doi 10.1038/srep42717
Chem. Heterocycl. Compd. 2012. Vol. 48. P. 309. doi
59. Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
10.1007/s10593-012-0991-5
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
68. Brunskill J.S.A., De A., Ewing D.F. // J. Chem. Soc.
N 11. P. 3099-3105. doi 10.1021/ci300367a
Perkin Trans. 1. 1978. N 6. P. 629. doi 10.1039/
60. Molinspiration Property Calculation Service.
P19780000629
N-Hydroxymethylation of 3-Aryl-2-cyanoprop-2-enethioamides
V. V. Dotsenkoa,b,*, E. A. Chigorinac,d, and S. G. Krivokolyskoa
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
c National Research Center “Kurchatov Institute” - IREA, Moscow, 107076 Russia
d National Research Center “Kurchatov Institute”, Moscow, 123182 Russia
*e-mail: victor_dotsenko_@mail.ru
Received April 4, 2020; revised April 4, 2020; accepted April 14, 2020
Hydroxymethylation of (E)-3-aryl-2-cyanoprop-2-enethioamides with an aqueous alcohol solution of
formaldehyde afforded (E)-3-aryl-N-(hydroxymethyl)-2-cyanoprop-2-enethioamides. The predictive analysis
of the biological activity of the obtained compounds in silico was carried out.
Keywords: 2-cyanoethanethioamide, (E)-3-aryl-2-cyanoprop-2-enethioamides, N-hydroxymethylation, N-(hy-
droxymethyl)thioamides, Mannich reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020