ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1207-1215
УДК 547.461.3:547.518:547.724.1
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
ДИЭТИЛОВЫХ ЭФИРОВ 8-(ДИАЛКИЛАМИНО)-3-АРИЛ-
6-ОКСО-2,4-ДИЦИАНОБИЦИКЛО[3.2.1]ОКТАН-2,4-
ДИКАРБОНОВОЙ КИСЛОТЫ
© 2020 г. А. И. Исмиевa,*, М. Шоаибa, В. В. Доценкоb,c, Х. Г. Ганбаровa,
А. А. Исраиловаa, А. М. Магеррамовa
a Бакинский государственный университет, ул. Академика З. Халилова 23, Баку, AZ1148 Азербайджан
b Кубанский государственный университет, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
*e-mail: arif_ismiev@mail.ru
Поступило в Редакцию 3 января 2020 г.
После доработки 25 февраля 2020 г.
Принято к печати 28 февраля 2020 г.
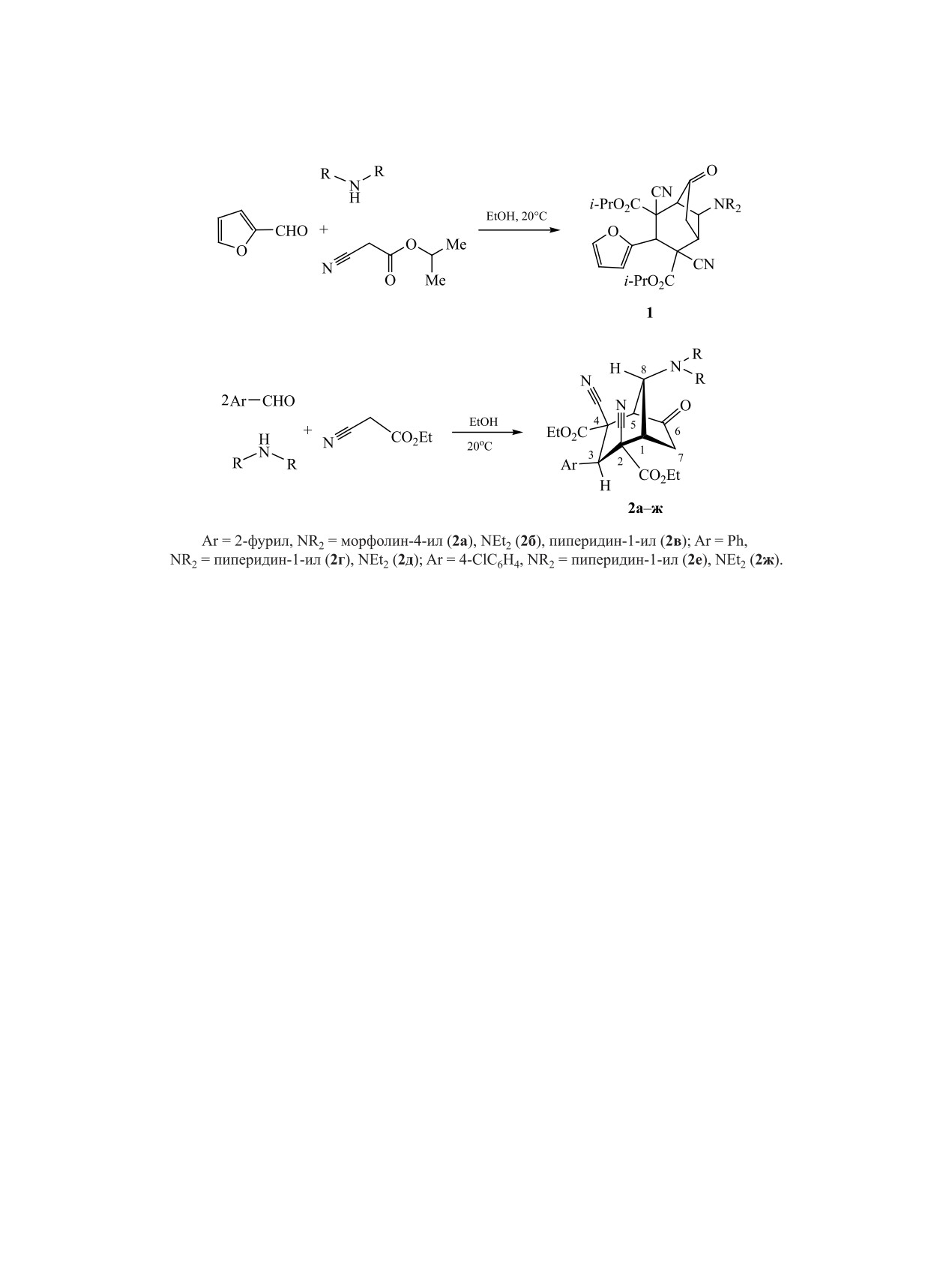
Каскадным взаимодействием 2 экв. фурфурола (либо эквимольных количеств фурфурола и ароматиче-
ского альдегида) со вторичными аминами и этилцианоацетатом получены диэтиловые эфиры 8-(диалки-
ламино)-3-арил-6-оксо-2,4-дицианобицикло[3.2.1]октан-2,4-дикарбоновой кислоты с выходами 37-54%.
Изучена противомикробная активность ряда полученных соединений in vitro, проведен анализ биологи-
ческой активности in silico. Полученные производные бицикло[3.2.1]октана неактивны или проявляют
слабую фунгицидную активность, но обнаруживают заметный бактерицидный эффект.
Ключевые слова: фурфурол, соли Стенхауза, реакция Назарова, перегруппировка аза-Пианкателли,
бицикло[3.2.1]октан
DOI: 10.31857/S0044460X20080089
Соединения с бицикло[3.2.1]октановым фраг-
соединений [14-18], мы решили изучить возмож-
ментом являются объектом постоянного внимания
ность получения функциональных производных
исследователей [1, 2]. За последние 5 лет появил-
бицикло[3.2.1]октана последовательным взаимо-
ся ряд работ (см., например, [3–7]), посвященных
действием фурфурола с вторичными аминами и
разработке новых подходов к синтезу замещенных
циануксусным эфиром, а также исследовать био-
производных бицикло[3.2.1]октана. Такое внима-
логическую активность полученных соединений.
ние обусловлено, в первую очередь, интересным
Ранее нами было показано, что аналогичная реак-
и достаточно обширным профилем биологической
ция с участием изопропилцианоацетата приводит
активности. Так, среди бицикло[3.2.1]октанов об-
к образованию бициклооктанов 1 с умеренными
наружены ингибиторы переносчиков дофамина
выходами (схема 1) [17].
и серотонина [8, 9], вещества с противораковым
Установлено, что циануксусный эфир вступа-
действием [10]. Бициклооктановый скелет явля-
ет в реакцию с фурфуролом (2 экв.) и вторичны-
ется структурной основой ряда природных био-
ми аминами аналогично изопропилцианоацетату
активных терпенов, неолигнанов, алкалоидов,
с образованием ранее не описанных в литерату-
сесквитерпеноидов и их синтетических аналогов
ре диэтиловых эфиров
8-(R2N)-6-оксо-3-(2-фу-
[2, 11-13].
рил)-2,4-дицианобицикло[3.2.1]октан-2,4-дикар-
В продолжение цикла исследований реакций
боновой кислоты 2а-в с умеренными выходами
карбо- и гетероциклизациии метиленактивных
(37-45%, схема 2). При последовательном введе-
1207
1208
ИСМИЕВ и др.
Схема 1.
Схема 2.
нии в реакцию фурфурола и вторичного амина, и
ка вторичного амина и образованием бициклоок-
далее циануксусного эфира и ароматического аль-
танов 2.
дегида удалось синтезировать соединения 2г-ж с
Нами была изучена антибактериальная и фунги-
выходами 43-54%. Строение соединений 2 под-
цидная активность новых соединений 2а-в, а также
тверждается данными ИК и ЯМР спектроскопии, а
полученного ранее диизопропилового эфира 8-мор-
также результатами элементного анализа.
фолин-4-ил-6-оксо-3-(2-фурил)-2,4-дициано-
Возможный механизм этой каскадной реакции
бицикло[3.2.1]октан-2,4-дикарбоновой кислоты
предполагает на первой стадии процесса взаимо-
1а [17] (схема 1, NR2 = морфолин-4-ил). Противо-
действие фурфурола со вторичными аминами по
микробная активность бициклооктанов 1а, 2а-в
типу перегруппировки аза-Пианкателли [19-21] -
была изучена в отношении четырех штаммов
через образование соли Стенхауза 3, с последу-
грамположительных и четырех штаммов грамо-
ющей конротаторной 4π-электроциклизацией по
трицательных бактерий, а также трех штаммов
Назарову [22], приводящей к 4,5-диаминоцикло-
дрожжевых грибов. Для определения активно-
пентенонам 4 (схема 3). Возможность образова-
сти использовали стандартный метод диффузии
ния подобных соединений из аминов и фурфурола
в агар с дальнейшим сравнением диаметров зон
подтверждается литературными данными [21, 23].
угнетения роста патогенов. Полученные результа-
Как правило, перегруппировка аза-Пианкателли
ты представлены в табл. 1. Как можно заметить,
требует кислотного катализа (см., например, [24-
соединения обнаруживают активность при кон-
26]), однако известны и примеры перегруппиров-
центрации 0.3%, некоторые активны и при более
ки в отсутствие катализаторов [27]. Дальнейшая
низких концентрациях (1 мг/мл). Ни одно из тести-
тандемная реакция Кнёвенагеля-Михаэля этил-
руемых соединений не обнаруживает активности
цианоацетата с ароматическим альдегидом дает
при концентрации 0.05%. Соединение 2а более ак-
аддукт 5, который в присутствии аминов может
тивно в отношении грамотрицательных организ-
выступать как мягкий 1,3-бинуклеофил и реаги-
мов, тогда как соединения 2б, в оказались более
ровать с 4,5-диаминоциклопентеноном 4 - через
активными в отношении грамположительных бак-
последовательное присоединение по Михаэлю с
терий. Наиболее чувствительными среди грампо-
дальнейшим нуклеофильным вытеснением остат-
ложительных бактерий оказались Staphylococcus
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ДИЭТИЛОВЫХ ЭФИРОВ
1209
Таблица 1. Противомикробная активность соединений 1а, 2а-в
Средние значения зоны ингибирования при концентрациях 0.3 и 0.1%, мма
Микроорганизм
1a
2a
2б
2в
0.3%
0.1%
0.3%
0.1%
0.3%
0.1%
0.3%
0.1%
E. coli
-
-
16.5±0.2
13.4±0.3
13±0.2
-
16.7±0.2
-
K. pneumoniae
-
-
17.7±0.3
12.7±0.6
-
-
-
-
A. baumannii
25±0.8
14±0.3
22.3±0.5
-
20.3±0.4
-
19±0.6
-
P. aeruginosa
-
-
15.7±0.3
12.7±0.2
-
-
-
-
S. aureus
15.3±0.3
12.3±0.3
-
-
15.3±0.1
13.3±0.4
15±0.2
13.3±0.5
B. subtilis
-
-
-
-
-
-
-
-
B. megaterium
14.7±0.1
12.5±0.1
-
-
12±0.2
-
12.7±0.1
12±0.1
B. mesentericus
-
-
-
-
19±0.2
-
22.5±0.5
13.7±0.2
C. tropicalis
-
-
-
-
-
-
-
-
C. pelliculosa
-
-
-
-
-
-
-
-
C. pseudotropicalis
18.7±0.2
12.7±0.1
-
-
-
-
16.3±0.6
12.5±0.2
a «-» - Cоединение неактивно.
aureus и Bacillus megaterium, в отношении которых
оказались активными в отношении Acinetobacter
активность обнаружена у всех образцов, кроме
baumannii, особенно бициклооктан 1а. Среди гра-
соединения 2а. Соединения 2б, в обнаруживают
мотрицательных бактерий наиболее устойчивой
выраженный противомикробный эффект в отно-
к действию препаратов оказалась Pseudomonas
шении Bacillus mesentericus, тогда как соединения
aeruginosa (только соединение 2а проявляет уме-
1а и 2а оказались неактивны. Ни одно из соеди-
ренную бактерицидную активность). Escherichia
нений не проявило активности в отношении па-
coli и Klebsiella pneumoniae чувствительны ко
тогена Bacillus subtilis. Напротив, все соединения
всем соединениям, кроме бициклооктана 1а. При
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1210
ИСМИЕВ и др.
Таблица 2. Расчетные параметры ADMET для бициклооктанов 1а, 2a-ва
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug-likeness
drug score
1а
-
-
+
+
1.39
-3.95
497
142.8
-4.28
0.12
2a
-
-
+
+
0.67
-3.2
469
142.8
-5.52
0.13
2б
-
-
+
+
1.51
-3.73
455
133.6
-4.87
0.13
2в
-
-
+
+
1.83
-4.09
467
133.6
-6.48
0.12
2г
-
-
+
+
2.64
-4.4
477
120.4
-6.00
0.11
2д
-
-
+
+
2.32
-4.05
465
120.4
-4.43
0.12
2е
-
-
+
+
3.25
-5.14
511
120.4
-5.04
0.09
2ж
-
-
+
+
2.93
-4.78
499
120.4
-3.40
0.10
а Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности. A - Мутагенность, B -
канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
оценке активности в отношении дрожжевых гри-
(logS), площади топологической полярной поверх-
бов рода Candida установлено, что ни одно из со-
ности (Topological Polar Surface Area, TPSA), ток-
единений не оказывает фунгицидного действия
сикологических параметров - рисков побочных
на Candida tropicalis и Candida pelliculosa. Только
эффектов (мутагенные, онкогенные, репродуктив-
соединения 1а и 2в обнаруживают умеренную ак-
ные эффекты), сходства с известными лекарствен-
тивность в отношении Candida pseudotropicalis.
ными препаратами (drug-likeness), а также общей
оценки фармакологического потенциала соедине-
Параллельный анализ противомикробной ак-
тивности, проведенный с использованием сервиса
ния (drug score). Полученные расчетные данные
представлены в табл. 2.
Way2Drug antiBac-Pred [28, 29], показал, что для
соединений 1а и 2а наиболее ожидаема актив-
Как можно заметить, во всех случаях значение
ность в отношении грамотрицательных бактерий
сLogP не превышает 3.25, что указывает на ве-
Prevotella disiens (Р = 0.41 и 0.43 соответственно;
роятную хорошую абсорбцию и проницаемость
Р > 0, если вероятность активности больше веро-
[30-32]. Значение показателя logS и молекулярной
ятности неактивности Pa > Pi) и Parabacteroides
массы всех соединений (кроме 2е) соответствует
merdae (0.38 и 0.39); с достоверностью 0.38 и 0.36
критериям пероральной биодоступности. Однако
прогнозируется резистентность микобактерий
все соединения демонстрируют риск раздражаю-
Mycobacterium ulcerans к действию соединений.
щего действия и возможного влияния на репро-
Для соединения 2б прогнозируется активность
дуктивную систему, а также невысокие значения
в отношении анаэробов Bacteroides stercoris (Р =
параметра сходства с лекарством (drug-likeness)
0.22), для соединения 2в ожидается активность
и показателя фармакологического потенциала со-
в отношении возбудителя бычьего туберкулеза
единения (drug score). Как показывает расчет, все
Mycobacterium bovis (Р = 0.39).
соединения имеют пограничные значения показа-
теля TPSA, близкие к 140 Å2. Увеличение значения
Нами также был проведен сравнительный ана-
TPSA обычно сопряжено с уменьшением прони-
лиз in silico биологической активности и пара-
кающей способности при прохождении через кле-
метров биодоступности для бициклооктанов 1а,
точную мембрану или гематоэнцефалический ба-
2a-ж. Первичный анализ структур на соответ-
рьер (ГЭБ), и в целом более низкое значение TPSA
ствие «правилу пяти» К. Липински (сLogP ≤ 5.0,
(≤ 140) более благоприятно с позиций сходства с
молекулярная масса (MW) ≤ 500, TPSA ≤ 140, чис-
ло акцепторов водородных связей ≤ 10, доноров ≤
известными лекарственными препаратами.
5) [30-32] проведен с использованием программ-
Для прогнозирования биологической активно-
ного сервиса OSIRIS Property Explorer [33]. Были
сти также использовались открытые программные
рассчитаны параметры сLogP (рассчитанный ло-
продукты PASS Online [29, 34] и Molinspiration
гарифм коэффициента распределения между н-ок-
Property Calculation Service [35]. По данным, по-
танолом и водой log(coctanol/cwater), растворимости
лученным с использованием сервиса PASS Online,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ДИЭТИЛОВЫХ ЭФИРОВ
1211
Таблица 3. Расчетные параметры ADMET для бициклооктанов 1а, 2a-ва
Ингибирование цитохромов Р450
Проник-
Острая
Гастроинтес-
новение
Тест
токсичность
№
тинальная
через
Эймса
(крысы) LD50,
абсорбция
CYP1A2
CYP2C19
CYP2C9
CYP2D6
CYP3A4
ГЭБ
[1/(моль/кг)]
1а
+
-
-
-
-
-
-
-
2.5270
0.9258
0.5615
0.78
2а
+
+
-
-
-
-
-
-
2.7027
0.9358
0.7350
0.79
2б
+
+
-
-
-
-
+
-
2.7098
0.9382
0.5935
0.64
2в
+
+
-
-
-
-
-
-
2.7807
0.9178
0.8436
0.79
2г
+
+
-
-
-
+
+
-
3.677
0.9871
0.9786
0.85
2д
+
+
-
-
-
+
+
-
3.505
0.9894
0.9619
0.78
2е
+
+
-
-
-
+
+
-
3.518
0.9859
0.9815
0.83
2ж
+
+
-
-
-
+
+
-
3.637
0.9873
0.9695
0.77
а Знаком «+» или «-» показано наличие или отсутствие эффекта, число означает вероятность эффекта в долях от единицы.
для всех соединений с вероятностью 0.74-0.80
трий-зависимые белки-транспортеры, кодируемые
ожидается кардиотоническое действие. Расчет
генами семейства SLC6A.
с использованием пакета Molinspiration Property
Таким образом, каскадной реакцией фурфу-
Calculation Service указывает на наиболее ве-
рола со вторичными аминами, ароматическими
роятную активность бициклооктанов 1а, 2а-ж
альдегидами и этилцианоацетатом получены ра-
в качестве лигандов рецепторов, сопряженных
нее не описанные диэтиловые эфиры 8-(диалкил-
с G-белком (GPCR-ligands, значения индекса
амино)-3-арил-6-оксо-2,4-дицианобицикло[3.2.1]-
Molinspiration bioactivity score в диапазоне 0.02-
октан-2,4-дикарбоновой кислоты. Полученные
0.15) и в качестве ингибиторов протеаз (значе-
соединения практически неактивны в отношении
ния индекса в диапазоне 0.06-0.18). Для про-
дрожжевых грибов Candida. В то же время, обна-
гнозирования параметров ADMET (Absorption,
руженное сильное бактерицидное действие новых
Distribution, Metabolism, Excretion, Toxicity) и ве-
соединений в совокупности с оценкой потенциала
роятных мишеней использовали программные па-
биологической активности in silico позволяют рас-
кеты SwissADME [36], SwissTargetPrediction [37] и
сматривать соединения данного типа как перспек-
admetSAR [38]. Для всех соединений прогнозиру-
тивные объекты для дальнейшего биоскрининга.
ется хорошая гастроинтестинальная абсорбция и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
возможность проникновения через гематоэнцефа-
лический барьер (кроме соединения 1а, табл. 3).
Спектры ЯМР 1Н, 13С регистрировали на при-
Также для всех соединений прогнозируется от-
боре Bruker AC-300 (300.13 и 75.47 МГц соответ-
сутствие мутагенного/канцерогенного эффекта
ственно) и на приборе Varian Unity Plus 400 MHz
в тесте Эймса и отсутствие острой пероральной
(400.08 МГц) в растворе ДМСО-d6 или CDCl3, в
токсичности. По данным расчетов с использовани-
качестве стандарта использовали остаточные сиг-
ем сервиса SwissTargetPrediction, наиболее веро-
налы растворителя. ИК спектры регистрирова-
ятными мишенями для соединений являются на-
ли на ИК Фурье-спектрометре Varian 3600 FT-IR
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1212
ИСМИЕВ и др.
Excalibur Series в таблетках KBr. Элементный ана-
2,4-дикарбоновой кислоты (2б). Выход 37%, кре-
лиз на C, H, N проводили на приборе Carlo Erba
мовые кристаллы, т. пл. 147°С (EtOH). ИК спектр,
1106. Температуры плавления определяли на сто-
ν, см-1: 2240 (C≡N), 1750 (С=О), 1654 (CO2Et).
лике Кофлера и не корректировали. Контроль за
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м. д.: 1.03 т
чистотой полученных соединений осуществляли
(6Н, 2 NСН2СН3, 3J = 7.1 Гц), 1.28 т (6Н, OСН2СН3,
методом ТСХ на пластинах Silufol UV-254, элюент -
3J = 7.1 Гц), 2.52-2.55 м (2Н, Н7), 2.69 квартет (4Н,
ацетон-гексан (1:1), проявитель - пары иода, УФ
NСН2СН3, 3J = 7.1 Гц), 2.94-2.95 м (1Н, Н8), 3.15-
детектор.
3.17 м (1Н, Н1), 3.98-3.99 м (1Н, Н5), 4.25-4.32 м
(5Н, Н3 + 2OСН2СН3), 6.34-6.35 м (1Н, Н4фурил),
Получение и характеристики диизопропило-
6.64 д (1Н, Н3фурил, 3JН4Н3 = 3.0 Гц), 7.37-7.38 м
вого эфира 8-морфолин-4-ил-6-оксо-3-(2-фурил)-
(1Н, Н5фурил). Спектр ЯМР 13С (76 МГц, CDCl3),
2,4-дицианобицикло[3.2.1]октан-2,4-дикарбоно-
δС, м. д.: 11.0 (NСН2СН3), 13.8 (OСН2СН3), 35.7
вой кислоты 1а описаны в работе [17].
(C3), 38.0 (C1), 42.1 (NСН2СН3), 42.5 (C7), 50.1 (С8),
Общая методика синтеза диэтиловых эфиров
51.5 (C2), 54.5 (С4), 63.1 (С5), 64.2 (OСН2СН3), 64.3
8-(диалкиламино)-3-арил-6-оксо-2,4-дициано-
(OСН2СН3), 110.8 (C4фурил), 110.9 (C3фурил), 115.3
бицикло[3.2.1]октан-2,4-дикарбоновой кисло-
(C≡N), 116.2 (C≡N), 143.1 (C5фурил), 146.4 (C1фурил),
ты 2a-ж. Смесь 0.41 мл (0.48 г, 0.005 моль) фур-
163.8 (CO2Et), 165.6 (CO2Et), 206.9 (C6). Найдено,
фурола и 0.01 моль соответствующего вторичного
%: C 63.32; H 6.57; N 9.21. C24H29N3О6. Вычисле-
амина (Et2NH, пиперидина или морфолина) в 10 мл
но, %: C 63.28; H 6.42; N 9.23.
96%-ного EtOH перемешивали 2 ч. К полученно-
Диэтиловый эфир
6-оксо-8-(пиперидин-
му раствору при перемешивании добавляли смесь
1-ил)-3-(2-фурил)-2,4-дицианобицикло[3.2.1]-
0.005 моль ароматического альдегида (фурфурола,
октан-2,4-дикарбоновой кислоты (2в). Выход
PhCHO, 4-ClC6H4CHO) и 1.13 г (0.01 моль) этил-
45%, кремовые кристаллы, т. пл. 161°С (EtOH).
цианоацетата. Реакционную массу выдерживали
ИК спектр, ν, см-1: 2246 (C≡N), 1749 (С=О), 1654
24 ч при комнатной температуре. Кристаллы от-
(CO2Et). Спектр ЯМР 1Н (300 МГц, CDCl3), δ,
фильтровывали и очищали перекристаллизацией
м. д.: 1.28 т (6Н, OСН2СН3, 3J = 7.1 Гц), 1.45-1.53
из этанола.
м [6Н, (СН2)3], 2.49-2.50 м (2Н, Н7), 2.52-2.55 м
Диэтиловый эфир 8-морфолин-4-ил-6-оксо-
[4Н, N(СН2)2], 3.01-3.03 м (1Н, Н8), 3.26-3.28 м
3-(2-фурил)-2,4-дицианобицикло[3.2.1]октан-
(1Н, Н1), 3.62-3.64 м (1Н, Н5), 4.23-4.31 м (5Н,
2,4-дикарбоновой кислоты (2а). Выход 42%, кре-
Н3 + 2OСН2СН3), 6.32-6.33 м (1Н, Н4фурил), 6.63
мовые кристаллы, т. пл. 215°С (EtOH). ИК спектр,
д (1Н, Н3фурил, 3JН4Н3 = 3.2 Гц), 7.35-7.36 м (1Н,
ν, см-1: 2246 (C≡N), 1749 (С=О), 1654 (CO2Et).
Н5фурил). Спектр ЯМР 13С (76 МГц, CDCl3), δC,
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м. д.:
м. д.: 13.7 (OСН2СН3), 24.0 (СН2СН2СН2), 25.5
1.24-1.32 м (6Н, OСН2СН3), 2.53-2.54 м (2Н,
(СН2СН2СН2), 35.5 (C3), 37.9 (C1), 42.1 (C7), 50.1
Н7), 2.58-2.61 м (4Н, СН2NCH2), 2.99-3.00 м (1Н,
(С8), 50.6 (СН2NCH2), 51.7 (С2), 53.9 (C4), 64.1
Н8), 3.23-3.25 м (1Н, Н1), 3.64-3.68 м (5Н, Н5 +
(OСН2СН3),
64.2 (OСН2СН3),
66.6 (C5),
110.8
СН2OCH2), 4.24-4.32 м (5Н, Н3 + 2OСН2СН3), 6.34–
(C4фурил), 110.9 (C3фурил), 115.3 (C≡N), 116.2 (C≡N),
6.35 м (1Н, Н4фурил), 6.63 д (1Н, Н3фурил, 3JН4Н3 =
143.0 (C5фурил), 146.4 (C1фурил), 163.7 (CO2Et), 165.5
3.0 Гц), 7.37-7.38 м (1Н, Н5фурил). Спектр ЯМР 13С
(CO2Et), 206.7 (C6). Найдено, %: C 64.29; H 6.37; N
(76 МГц, CDCl3), δС, м. д.: 13.7 (OСН2СН3), 35.5
8.96. C25H29N3О6. Вычислено, %: C 64.23; H 6.25;
(C3), 38.0 (C1), 41.6 (C7), 50.0 (С8 + СН2NCH2), 51.5
N 8.99.
(С2), 53.3 (C4), 64.3 (OСН2СН3), 64.4 (OСН2СН3),
Диэтиловый эфир
6-оксо-8-(пиперидин-
66.5 (СН2ОCH2), 66.7 (C5), 110.8 (C4фурил), 111.0
1-ил)-3-фенил-2,4-дицианобицикло[3.2.1]-
(C3фурил), 115.1 (C≡N), 116.1 (C≡N), 143.1 (C5фурил),
октан-2,4-дикарбоновой кислоты (2г). Выход
146.2 (C1фурил),
163.6 (CO2Et),
165.3 (CO2Et),
54%, бежевый мелкокристаллический порошок,
206.1 (C6). Найдено, %: C 61.39; H 5.97; N 9.01.
т. пл. 194°С (EtOH). Спектр ЯМР 1Н (300 МГц,
C24H27N3О7. Вычислено, %: C 61.40; H 5.80; N 8.95.
CDCl3), δ, м. д.: 1.00 т (3Н, OСН2СН3, 3J = 7.2 Гц),
Диэтиловый эфир 6-оксо-3-(2-фурил)-2,4-ди-
1.07 т (3Н, OСН2СН3, 3J = 7.2 Гц), 1.43-1.48 м [6Н,
циано-8-(диэтиламино)бицикло[3.2.1]октан-
(СН2)3], 2.52-2.55 м [6Н, Н7, N(СН2)2], 3.17-3.18 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ДИЭТИЛОВЫХ ЭФИРОВ
1213
(1Н, Н8), 3.52-3.54 м (2Н, Н1, Н3), 3.84-3.85 м (1Н,
(1Н, Н5, 3J = 5.4 Гц), 3.85-3.86 м (1Н, Н1), 3.89 уш. с
Н5), 4.03-4.10 м (4Н, OСН2СН3), 7.38-7.40 м (3Н,
(1Н, Н3), 4.09-4.15 м (4Н, OСН2СН3), 7.54 д (2Н,
Ph), 7.63-7.66 м (2Н, Ph). Спектр ЯМР 13С (76 МГц,
Ar, 3J = 8.3 Гц), 7.67 д (2Н, Ar, 3J = 8.3 Гц). Найдено,
ДМСО-d6), δС, м. д.: 13.48 и 13.52 (OСН2СН3), 23.9
%: C 62.39; H 6.12; N 8.37. C26H30ClN3О5. Вычис-
(СН2СН2СН2), 25.2 (СН2СН2СН2), 35.9 (C3), 41.6
лено, %: C 62.46; H 6.05; N 8.40.
(C1), 42.5 (C7), 50.3 (СН2NCH2), 51.2 (С8), 52.7 (С2),
Исследование противомикробного действия.
53.7 (C4), 63.9 (OСН2СН3), 67.2 (C5), 116.3 (C≡N),
В качестве растворителя для соединений использо-
117.4 (C≡N), 128.6 (С3, С5 Ph), 129.6 (С4 Ph), 130.6
вали ДМСО. Тесты показали отсутствие действия
(С2, С6 Ph), 131.9 (С1 Ph), 163.5 (CO2Et), 165.1
ДМСО в отношении культур микроорганизмов.
(CO2Et), 207.5 (C6). Найдено, %: C 67.89; H 6.67; N
Растворы соединений готовили в трех различных
8.76. C27H31N3О5. Вычислено, %: C 67.91; H 6.54;
концентрациях: 0.3% (3 мг тестируемого соеди-
N 8.80.
нения на 1.0 мл ДМСО), 0.1% (1 мг тестируемого
соединения на 1.0 мл ДМСО) и 0.05% (0.5 мг те-
Диэтиловый эфир
6-оксо-3-фенил-2,4-ди-
стируемого образца на 1.0 мл ДМСО). Для опре-
циано-8-(диэтиламино)бицикло[3.2.1]октан-
деления антибактериальных свойств образцов in
2,4-дикарбоновой кислоты
(2д). Выход
46%,
vitro в отношении штаммов Escherichia coli BDU-
бежевый мелкокристаллический порошок, т. пл.
12, Klebsiella pneumoniae BDU-44, Acinetobacter
207°С (EtOH). Спектр ЯМР
1Н
(400 МГц,
baumannii BDU-32, Pseudomonas aeruginosa BDU-
ДМСО-d6), δ, м. д.: 0.94-1.01 м (9Н, СН2СН3), 1.08
49, Staphylococcus aureus BDU-23, Bacillus Subtilis
т (3Н, OСН2СН3, 3J = 7.1 Гц), 2.60-2.61 м (2Н, Н7),
BDU-50, Bacillus mesentericus BDU-51 и Bacillus
2.68-2.76 м (4Н, NСН2СН3), 3.07-3.08 м (1Н, Н8),
megaterium BDU-N20 использовали стандартный
3.30-3.31 м (1Н, Н1), 3.88-3.89 м (1Н, Н5), 4.07-
метод диффузии в агар [39]. Исследования проти-
4.13 м (4Н, OСН2СН3), 4.26-4.31 м (1Н, Н3), 7.40-
вогрибковой активности проводили в отношении
7.42 м (3Н, Ph), 7.65-7.66 м (2Н, Ph). Найдено, %:
штаммов дрожжевых грибов Candida tropicalis
C 67.05; H 6.82; N 9.00. C26H31N3О5. Вычислено,
BDU LK30, Candida pelliculosa BDU KT55 и
%: C 67.08; H 6.71; N 9.03.
Candida pseudotropicalis BDU MA88. Все тестовые
Диэтиловый эфир
6-оксо-8-(пиперидин-
культуры взяты из собственной коллекции кафе-
1-ил)-3-(4-хлорфенил)-2,4-дицианобицикло-
дры микробиологии Бакинского государственного
[3.2.1]октан-2,4-дикарбоновой кислоты
(2е).
университета. Для тестирования антибактериаль-
Выход
51%, бежевый мелкокристаллический
ной активности использовали агар Мюллера-Хин-
порошок, т. пл. 204°С (EtOH). Спектр ЯМР 1Н
тона, для противогрибкового скрининга - агар
(400 МГц, ДМСО-d6), δ, м. д.: 1.05 т (3Н, OСН2СН3,
Сабуро с декстрозой. Для эксперимента брали
3J = 7.0 Гц), 1.12 т (3Н, OСН2СН3, 3J = 7.1 Гц), 1.42-
100 мкл 24-часовой бульонной культуры тести-
руемого микроорганизма (0.5 ед. мутности по
1.50 м [6Н, (СН2)3], 2.54-2.59 м [6Н, Н7, N(СН2)2],
МакФарланду) и распределяли по всей поверх-
3.19-3.21 м (1Н, Н8), 3.51-3.52 м (1Н, Н1), 3.57 уш. д
ности агара. С помощью стерильного пробкового
(1Н, Н5, 3J = 6.4 Гц), 3.88 уш. с (1Н, Н3), 4.08-4.14
сверла в чашке с агаром пробивали лунки диаме-
м (4Н, OСН2СН3), 7.53 д (2Н, Ar, 3J = 8.3 Гц), 7.67
тром 8 мм, далее в каждую лунку вносили 150 мкл
д (2Н, Ar, 3J = 8.3 Гц). Найдено, %: C 63.29; H 5.98;
раствора испытуемого соединения. Посевы инку-
N 8.16. C27H30ClN3О5. Вычислено, %: C 63.34; H
бировали при 37°С в течение 24 ч для бактерий и
5.91; N 8.21.
при 30°С в течение 72 ч для грибов. После инку-
Диэтиловый эфир
6-оксо-3-(4-хлорфенил)-
бации измеряли средний диаметр зоны ингибиро-
2,4-дициано-8-(диэтиламино)бицикло[3.2.1]-
вания вокруг каждой лунки. В качестве контроля
октан-2,4-дикарбоновой кислоты (2ж). Выход
использовали чистый ДМСО. Все эксперименты
43%, бежевый мелкокристаллический порошок,
проводили троекратно.
т. пл. 198°С (EtOH). Спектр ЯМР 1Н (400 МГц,
ФОНДОВАЯ ПОДДЕРЖКА
ДМСО-d6), δ, м. д.: 1.03 т (3Н, NСН2СН3, 3J =
7.0 Гц),1.10 т (3Н, NСН2СН3, 3J = 7.0 Гц), 1.23-1.28
Работа выполнена при финансовой поддержке
м (6Н, OСН2СН3), 2.52-2.54 м (2Н, Н7), 2.68-2.73
Министерства образования и науки Российской
м (4Н, NСН2СН3), 3.08-3.09 м (1Н, Н8), 3.46 уш. д
Федерации (тема 0795-2020-0031).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1214
ИСМИЕВ и др.
КОНФЛИКТ ИНТЕРЕСОВ
Magerramov A.M. // Chem. Heterocycl. Compd. 2016.
Vol. 52. N 7. P. 473. doi 10.1007/s10593-016-1918-3
Авторы заявляют об отсутствии конфликта
15. Hajiyeva K., Ismiev A., Franz M., Schmidtmann M.,
интересов.
Martens J., Maharramov A. // Synth. Commun.
2017. Vol. 47. N 22. P. 2031. doi 10.1080/
СПИСОК ЛИТЕРАТУРЫ
00397911.2017.1359845
1. Filippini M.H., Rodriguez J. // Chem. Rev. 1999.
16. Dotsenko V.V., Frolov K.A., Pekhtereva T.M., Pa-
Vol. 99. P. 27. doi 10.1021/cr970029u
paianina O.S., Suykov S.Yu., Krivokolysko S.G. // ACS
2. Presset M., Coquerel Y., Rodriguez J. // Chem. Rev.
Comb. Sci. 2014. Vol. 16. N 10. P. 543. doi 10.1021/
2013. Vol. 113. P. 525. doi 10.1021/cr200364p
co5000807
3. Lefranc A., Gremaud L., Alexakis A. // Org. Lett. 2014.
17. Исмиев А.И., Доценко В.В., Аксенов Н.А., Маме-
Vol. 16. N 20. P. 5242. doi 10.1021/ol502171h
дова Г.З.,Магеррамов А.М. // ЖОХ. 2018. Т. 88. №
4. He C., Bai Z., Hu J., Wang B., Xie H., Yu L., Ding H. //
7. С. 1198. doi 10.1134/S0044460X18070223; Ismi-
Chem. Commun. 2017. Vol. 53. P. 8435. doi 10.1039/
ev A.I., Dotsenko V.V., Aksenov N.A., Mamedova G.Z.,
c7cc04292b
Magerramov A.M. // Russ. J. Gen. Chem. 2018. Vol. 88.
5. Takatori K., Ota S., Tendo K., Matsunaga K., Nagasa-
N 7. P. 1533. doi 10.1134/S1070363218070289
wa K., Watanabe S., Kishida A., Kogen H., Nagao-
18. Исмиев А.И., Доценко В.В., Беспалов А.В., Нетре-
ka H. // Org. Lett. 2017. Vol. 19. P. 3763. doi 10.1021/
ба Е.Е.,Магеррамов А.М. // ЖОХ. 2020. Т. 90. № 2.
acs.orglett.7b01604
С. 199. doi 10.31857/S0044460X20020043; Is-
6. Zhao J., Yang S., Xie X., Li X., Liu Y. // J. Org. Chem.
miyev A.I., Dotsenko V.V., Bespalov A.V.., Netre-
ba E.E., Maharramov A.M. // Russ. J. Gen. Chem. 2020.
2018. Vol. 83. N 3. P. 1287. doi 10.1021/acs.joc.7b02816
7. Yuan Z., Feng Z., Zeng Y., Zhao X., Lin A., Yao H. //
Vol. 90. N 2. P. 187. doi 10.1134/S1070363220020048
19. Piutti C., Quartieri F. // Molecules. 2013. Vol. 18. N 10.
Angew. Chem. 2019. Vol. 131. N 9. P. 2910. doi
P. 12290. doi 10.3390/molecules181012290
10.1002/ange.201900059
20. Verrier C., Moebs-Sanchez S., Queneau Y., Popo-
8. Meltzer P.C., Blundell P., Yong Y.F., Chen Z., George C.,
wycz F. // Org. Biomol. Chem. 2018. Vol. 16. N 5.
Gonzalez M.D., Madras B.K. // J. Med. Chem. 2000.
P. 676. doi 10.1039/C7OB02962D
Vol. 43. N 16. P. 2982. doi 10.1021/jm000191g
21. Piancatelli G., D’Auria M., D’Onofrio F. // Synthesis.
9. Meltzer P. C., Blundell P., Chen Z., Yong Y.F., Madras
1994. N 9. P. 867. doi 10.1055/s-1994-25591
B.K. // Bioorg. Med. Chem. Lett. 1999. Vol. 9. P. 857.
22. Tius M. A. // Eur. J. Org. Chem. 2005. P. 2193. doi
doi 10.1016/S0960-894X(99)00098-0
10.1002/ejoc.200500005
10. Зефиров Н.А., Лаврушкина Е.А., Кузнецов С.А., Зе-
23. Gomes R.F., Coelho J.A., Afonso C.A. // Chem.
фирова О.Н. // Биомед. хим. 2019. Т. 65. № 2. С. 86.
Eur. J. 2018. Vol. 24. N 37. P. 9170. doi 10.1002/
doi 10.18097/PBMC20196502086
chem.201705851
11. Santos M.F., Alcântara B.G., Feliciano C.D.R.,
24. Li H., Tong R., Sun J. // Angew. Chem. Int. Ed. 2016.
Silva A.F., Maiolini T.C., Neto A.K., Murgu M., Chagas
Vol. 55. N 48. P. 15125. doi 10.1002/anie.201607714
de Paula D.A.,Soares M.G. // Phytochem. Lett. 2019.
25. Tang W.B., Cao K.S., Meng S.S., Zheng W.H. //
Vol. 30. P. 31. doi 10.1016/j.phytol.2019.01.014
Synthesis. 2017. Vol. 49. N 16. P. 3670. doi 10.1055/s-
12. Liu Y., Liu F., Qiao M.M., Guo L., Chen M.H., Peng C.,
0036-1589040
Xiong L. // Org. Lett. 2019. Vol. 21. N 4. P. 1197. doi
26. Palmer L.I., de Alaniz J.R. // Synlett. 2014. Vol. 25.
10.1021/acs.orglett.9b00149
N 1. P. 8. doi 10.1055/s-0033-1340157
13. Peter C., Geoffroy P., Miesch M. // Org. Biomol. Chem.
27. Nardi M., Costanzo P., De Nino A., Di Gioia M.L.,
2018. Vol. 16. P. 1381. doi 10.1039/c7ob03124f
Olivito F., Sindona G., Procopio A. // Green Chem.
14. Доценко В.В., Исмиев А.И., Хрусталева А.Н., Фро-
2017. Vol. 19. N 22. P. 5403. doi 10.1039/C7GC02303K
лов К.А., Кривоколыско С.Г., Чигорина Е.А., Сниж-
28. Way2Drug. antiBac-Pred. Laboratory for Structure-
ко А.П., Громенко В.М., Бушмаринов И.С., Аске-
Function Based Drug Design, Institute of Biomedical
ров Р.К., Пехтерева Т.М., Суйков С.Ю., Папаяни-
на Е.С., Мазепа А.В., Магеррамов А.М. // ХГС.
com/antibac/
2016. Т. 52. № 7. С. 473; Dotsenko V.V., Ismi-
29. Филимонов Д.А., Лагунин А.А., Глориозова Т.А., Ру-
ev A.I., Khrustaleva A.N., Frolov K.A., Krivokolysko S.G.,
дик А.В., Дружиловский Д.С., Погодин П.В., Порой-
Chigorina E.A., Snizhko A.P., Gromenko V.M.,
ков В.В. // ХГС. 2014. № 3. С. 483; Filimonov D.A.,
Bushmarinov I.S., Askerov R.K., Pekhtereva T.M.,
Lagunin A.A., Gloriozova T.A., Rudik A.V., Druzhilov-
Suykov S.Yu., Papayanina E.S., Mazepa A.V.,
skii D.S., Pogodin P.V., Poroikov V.V. // Chem.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ДИЭТИЛОВЫХ ЭФИРОВ
1215
Heterocycl. Compd. 2014. Vol. 50. N 3. P. 444. doi
10.1007/s10593-014-1496-1
passonline/predict.php
30. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
35. Molinspiration Property Calculation Service.
Adv. Drug. Deliv. Rev. 1997. Vol. 23. N 1-3. P. 4. doi
Molinspiration Cheminformatics, Slovak Republic,
10.1016/S0169-409X(96)00423-1
36. Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
31. Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
Vol. 7. Article N 42717. doi 10.1038/srep42717
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
37. Gfeller D., Grosdidier A., Wirth M., Daina A., Michie-
32. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J.
lin O., Zoete V. // Nucl. Acids Res. 2014. Vol. 42. N W1.
// Adv. Drug. Deliv. Rev. 2012. Vol. 64. Suppl. P. 4. doi
P. W32. doi 10.1093/nar/gku293
10.1016/j.addr.2012.09.019
38. Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
33. Sander T. OSIRIS Property Explorer. Idorsia Pharma-
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
N 11. P. 3099. doi 10.1021/ci300367a
chemistry.org/prog/peo/
39. Balouiri M., Sadiki M., Ibnsouda S.K. // J. Pharm.
34. PASS Online. Laboratory for Structure-Function
Analysis. 2016. Vol. 6. N 2. P. 71. doi 10.1016/j.
Based Drug Design, Institute of Biomedical Chemistry
jpha.2015.11.005
Synthesis and Biological Activity of 8-(Dialkylamino)-3-aryl-
6-oxo-2,4-dicyanobicyclo[3.2.1]octane-2,4-dicarboxylic Acids
Diethyl Esters
A. I. Ismieva,*, M. Shoaiba, V. V. Dotsenkob,c, Kh. G. Ganbarova,
A. A. Israilovaa, and A. M. Magerramova
a Baku State University, Baku, AZ1148 Azerbaijan
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus University, Stavropol, 355009 Russia
*e-mail: arif_ismiev@mail.ru
Received January 3, 2020; revised February 25, 2020; accepted February 28, 2020
Cascade reaction of 2 equiv. of furfural (or equimolar amounts of furfural and aromatic aldehyde) with secondary
amines and ethyl cyanoacetate afforded diethyl esters of 8-(dialkylamino)-3-aryl-6-oxo-2,4-dicyanobicyclo-
[3.2.1]octane-2,4-dicarboxylic acids with yields of 37-54%. Antimicrobial activity of a number of obtained
compounds in vitro was studied, and biological activity in silico was analyzed. The obtained bicyclo[3.2.1]-
octanes are inactive or exhibit weak fungicidal activity, but exhibit moderate bactericidal effect.
Keywords: furfural, Stenhouse salts, Nazarov reaction, aza-Piancatelli rearrangement, bicyclo[3.2.1]octane
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020