ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1231-1239
УДК 541.49;547.779;547.79;547.836
ПРИМЕНЕНИЕ НИКЕЛЕВЫХ КОМПЛЕКСОВ
1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ ДЛЯ
СИНТЕЗА КОНДЕНСИРОВАННЫХ СИСТЕМ С
ЯДРОМ 4-АМИНОПИРИДИНА
© 2020 г. Р. Н. Выджак, С. Я. Панчишин, В. С. Броварец*
Институт биоорганической химии и нефтехимии имени В. П. Кухаря Национальной академии наук Украины,
ул. Мурманская 1, Киев, 02094 Украина
*e-mail: brovarets@bpci.kiev.ua
Поступило в Редакцию 27 марта 2020 г.
После доработки 27 марта 2020 г.
Принято к печати 10 апреля 2020 г.
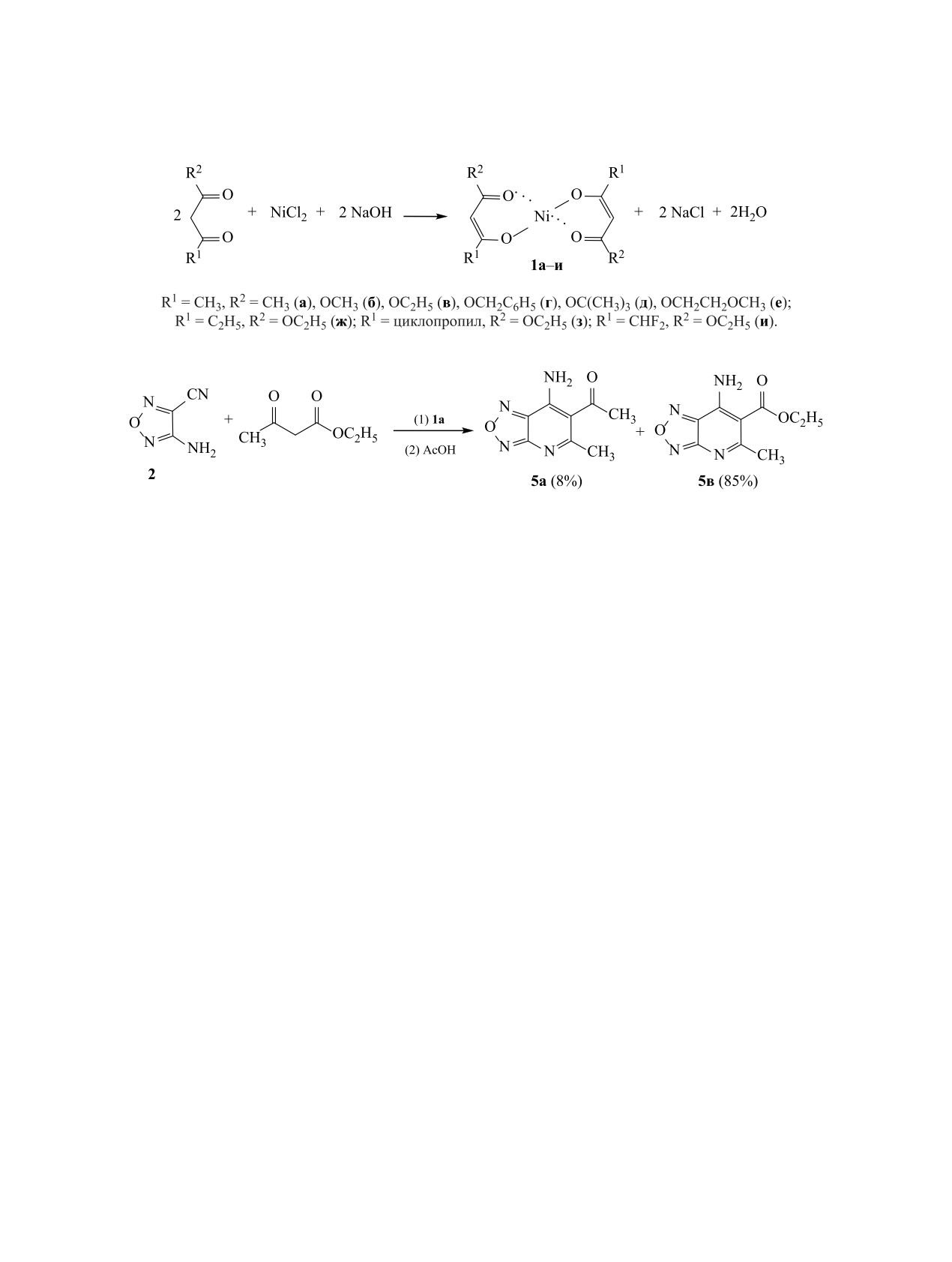
Проведена оценка принципиальной возможности использования никелевых комплексов 1,3-дикарбо-
нильных соединений для превращения гетероциклических аминонитрилов в конденсированные системы
с ядром 4-аминопиридина. Показана возможность введения ацидофобных групп в молекулы конденси-
рованных соединений.
Ключевые слова: никелевые комплексы 1,3-дикарбонильных соединений, оксадиазоло[3,4-b]пиридины,
триазоло[4,5-b]пиридины, пиразоло[3,4-b]пиридины
DOI: 10.31857/S0044460X20080119
На протяжении последних десятилетий особое
- аннелирование азольного фрагмента к заме-
внимание многих исследователей направлено на
щенному 4-аминопиридину используется не ча-
разработку и усовершенствование синтетических
сто, так как требует получения специфически за-
подходов к получению азолоазинов. Среди таких
мещенных 4-аминопиридинов [10-12];
конденсированных азотсодержащих гетероциклов
- взаимодействие гетероциклических амино-
важное место принадлежит производным 4-ами-
нитрилов с карбонильными соединениями в при-
нопиридина, которые являются перспективными
сутствии кислот Люиса (ZnCl2, AlCl3, SnCl4) чаще
структурами для поиска биологически активных
других используется для получения азолопириди-
соединений.
нов [13-19], однако выход конечных продуктов,
В литературе описаны следующие подходы к
как правило, не превышает 50%, а также накла-
синтезу таких соединений:
дываются значительные ограничения на наличие
- восстановление нитропроизводных азолопи-
функциональных групп в молекулах исходных ре-
ридинов, однако этот метод практически не ис-
агентов;
пользуется из-за малой доступности нитропроиз-
водных [1-4];
- присоединение карбонильных соединений к
- замещение атома галогена или алкоксигруп-
нитрильной группе цианоазолов в присутствии ос-
пы на аминогруппу, главным недостатком данного
нований с дальненйшим превращением промежу-
подхода является труднодоступность соответству-
точных продуктов в производные азолопиридина
ющих галоген- и алкоксиазолопиридинов [5-7];
[20-24]. В качестве оснований используют алкого-
- замещение атома галогена на азидогруппу с
ляты щелочных металлов, карбонат калия, амины
последующим восстановлением до аминогруппы
или комплексы 1,3-дикарбонильных соединений с
[8, 9];
переходными металлами.
1231
1232
ВЫДЖАК и др.
Схема 1.
Схема 2.
Известно также, что ацетилацетонат никеля в
Никелевые комплексы 1,3-дикарбонильных со-
мягких условиях присоединяет дициан [25] и дру-
единений получали смешением хлорида никеля,
гие электрофильные гетероциклические нитрилы
соответствующего дикарбонильного соединения и
[24]. Он также является эффективным катализа-
гидроксида натрия в водном этаноле (схема 1). По-
тором для получения аддуктов Михаэля ацетила-
лученный осадок отфильтровывали, растворяли
цетона с непредельными соединениями. Выходы
в хлористом метилене, нерастворившуюся часть
конечных продуктов всегда значительно выше,
отделяли, растворитель удаляли в вакууме и сое-
чем в традиционных синтезах с использованием
динения 1а-и очищали кристаллизацией из водно-
сильных оснований [26].
го этанола в виде гидратов, которые легко теряют
воду при нагревании до 90-100°С в вакууме.
Целью данной работы является оценка воз-
можности использования никелевых комплексов
Использование ацетилацетоната никеля 1а в ка-
1,3-дикарбонильных соединений для аннелиро-
честве катализатора для присоединения этилового
вания пиридинового цикла к азольным систе-
эфира ацетоуксусной кислоты к 4-амино-1,2,5-ок-
мам, а также сравнение полученных результатов
садиазол-3-карбонитрилу 2, как описано в лите-
с описанными в литературе данными по постро-
ратуре [24], показало, что вначале присоединение
ению таких конденсированных систем. В ка-
протекает довольно быстро, но со временем реак-
честве модельных соединений были выбраны:
ция замедляется и приостанавливается. Поэтому
4-амино-1,2,5-оксадиазол-3-карбонитрил (присо-
нужно постоянно контролировать ход процесса
единение к нему никелевого комплекса ацетила-
и добавлять новые порции никелевого комплекса
цетона описано в литературе [24]), 5-амино-1-бен-
1а. После упаривания и обработки реакционной
зил-1Н-1,2,3-триазол-4-карбонитрил (близок по
смеси уксусной кислотой в этаноле получены со-
акцепторным свойствам нитрильной группы к
единения 5а (8%) и 5в (85%) (схема 2), которые
нитрильной группе оксадиазола) и 5-амино-1-фе-
были разделены хроматографически. Образование
нил-1Н-пиразол-4-карбонитрил (аннелированные
смеси продуктов 5а и 5в объясняется присоедине-
производные на его основе описаны в литературе
нием к цианогруппе как ацетоуксусного эфира, так
[17, 18], и акцепторные свойства нитрильной груп-
и ацетилацетона, входящего в состав никелевого
пы отличаются от таковых для нитрильной группы
комплекса. Поэтому нами решено использовать
оксадиазола), а также никелевые комплексы аце-
комплексы никеля с тем дикарбонильнильным со-
тилацетона и коммерчески доступных эфиров аце-
единением, которое нужно ввести в реакцию. Для
тоуксусных кислот.
ускорения процесса мы проводили присоединение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ПРИМЕНЕНИЕ НИКЕЛЕВЫХ КОМПЛЕКСОВ
1233
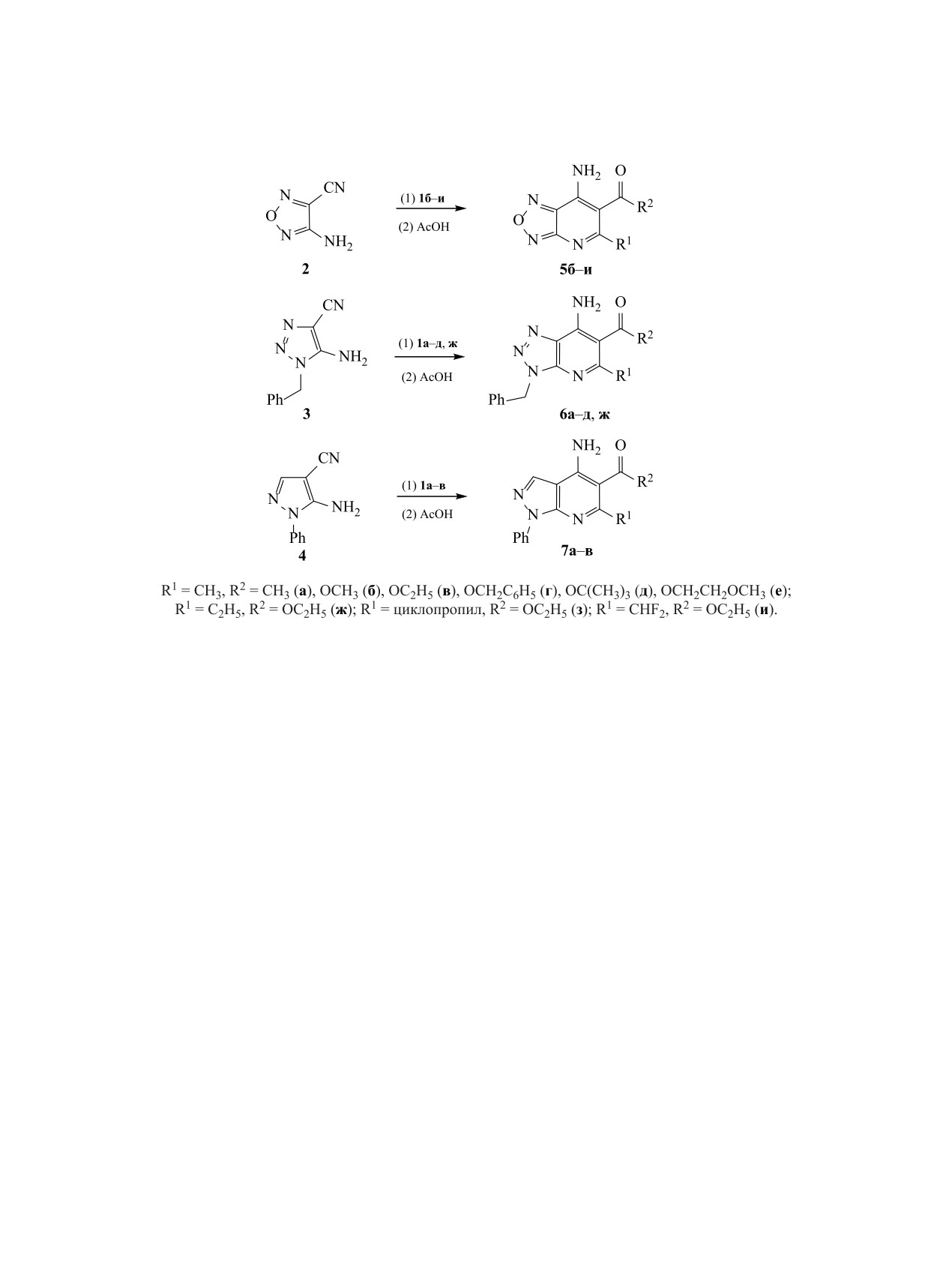
Схема 3.
гетероциклических аминонитрилов 2-4 непосред-
рабатывали уксусной кислотой в этаноле и полу-
ственно к никелевым комплексам при соотноше-
чали конденсированные производные 5-7.
нии 2:1.
Превращение цианофуразана 2 в оксадиазо-
Присоединение оксадиазола 2 к соединениям
ло[3,4-b]пиридины 5б-и протекает легко, эти сое-
1а-и происходит за 30-40 мин в хлористом мети-
динения выделены с высокими выходами в чистом
лене при температуре 35-40°С. К цианотриазолу
виде с помощью кристаллизации. Превращение
3 и цианопиразолу 4 при кипячении в хлористом
цианотриазола 3 в триазоло[4,5-b]пиридины 6 со-
метилене никелевые комплексы не присоединяют-
провождается незначительным осмолением. Сое-
ся. С триазолом 3 реакция происходит в кипящем
динения 6а-в выделены кристаллизацией, соеди-
дихлорэтане, а в случае пиразола 4 - при нагрева-
нения 6г, д, ж выделяли с помощью колоночной
нии в хлорбензоле при 100-110°С (схема 3).
хроматографии на силикагеле. Синтез пиразо-
Способность нитрильной группы присоединять
ло[3,4-b]пиридинов 7 сопровождается значитель-
ным осмолением реакционной смеси, поэтому
никелевые комплексы 1,3-дикарбонильных соеди-
соединения 7а-в возможно очистить только с по-
нений сильно зависит от акцепторных свойств ге-
мощью хроматографии. Данный подход удобен для
тероциклического фрагмента: чем более выраже-
получения соединений 5 и 6, а производные 7 про-
ны акцепторные свойства, тем легче происходит
ще получать взаимодействием цианопиразола 4 с
присоединение. Наличие электроноакцепторной
дикарбонильными соединениями в присутствии
группы в никелевом комплексе уменьшает его ре-
акционную способность: присоединение соедине-
SnCl4, как описано в литературе [17, 18].
ния 1к к оксадиазолу 2 происходит при кипячении
Состав соединений 5-7 подтвержден данны-
в дихлорэтане. Продукты присоединения гетеро-
ми элементного анализа, строение доказано с по-
циклических аминонитрилов к комплексам 1а-к
мощью ИК, ЯМР 1Н и 13С спектроскопии. В ИК
не выделяли в индивидуальном состоянии. Их об-
спектрах соединений 5б-и присутствуют полосы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1234
ВЫДЖАК и др.
поглощения валентных колебаний С=О группы, а
метилене. Полученный раствор фильтровали, упа-
также валентных и деформационных колебаний
ривали в вакууме, остаток кристаллизовали из во-
NH2-группы. В ИК спектрах соединений 6 в обла-
дного этанола, затем сушили в вакууме (1 мм рт.
сти 1700-1580 см-1 присутствуют три характерные
ст.) при 90-100°С в течение 2 ч. Характеристики
полосы поглощения почти одинаковой интенсив-
соединения 1а приведены в работе [24].
ности, а также полосы валентных колебаний ами-
Комплекс 1б. Выход 4.92 г (85.1%). Найдено,
ногруппы. В спектрах ЯМР 1Н синтезированных
%: С 41.05; Н 4.82. C10H14NiO6. Вычислено, %: С
соединений присутствуют сигналы всех атомов
41.57; Н 4.88.
водорода, а в спектрах ЯМР 13С - атомов углерода.
Комплекс 1в. Выход 5.11 г (80.6%). Найдено,
Предложенный подход для аннелирования
%: С 44.96; Н 5.83. C12H18NiO6. Вычислено, %: С
4-аминопиридинового фрагмента к гетероцикли-
45.47; Н 5.72.
ческим аминонитрилам может быть альтернатив-
Комплекс 1г. Выход 7.27 г (82.4%). Найдено,
ным по сравнению с существующими методами
%: С 59.37; Н 5.11. C22H22NiO6. Вычислено, %: С
синтеза. Он отличается простотой исполнения и
59.90; Н 5.03.
его существенным преимуществом является воз-
можность введения лабильных функциональных
Комплекс 1д. Выход 5.08 г (68.1%). Найдено,
групп в молекулы конденсированных систем. Од-
%: С 51.09; Н 6.93. C16H26NiO6. Вычислено, %: С
ним из недостатков предложенного метода являет-
51.51; Н 7.02.
ся сильное влияние природы гетероциклического
Комплекс 1е. Выход 4.96 г (65.8%). Найдено,
фрагмента на способность присоединения никеле-
%: С 44.16; Н 5.72. C14H22NiO8. Вычислено, %: С
вых комплексов к нитрильной группе.
44.60; Н 5.88.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс 1ж. Выход 5.32 г (77.1%). Найдено,
%: С 48.35; Н 6.39. C14H22NiO6. Вычислено, %: С
ИК спектры записывали на спектрометре
48.74; Н 6.43.
Vertex 70 в таблетках с KBr. Спектры ЯМР 1Н и
Комплекс 1з. Выход 5.24 г (71.0%). Найдено,
13С регистрировали на приборе Bruker AVANCE
%: С 51.79; Н 5.94. C16H22NiO6. Вычислено, %: С
DRX-500 (500 и 125 МГц соответственно) в рас-
52.07; Н 6.01.
творе ДМСО-d6, внутренний стандарт - ГМДС.
Элементный анализ проведен в аналитической
Комплекс 1и. Выход 5.09 г (65.4%). Найдено,
лаборатории Института биоорганической химии и
%: С 36.59; Н 3.69. C12H14F4NiO6. Вычислено, %:
нефтехимии им. В.П. Кухаря Национальной акаде-
С 37.06; Н 3.63.
мии наук Украины. Температуры плавления опре-
1-(7-Амино-5-метил[1,2,5]оксадиазоло[3,4-b]-
деляли на приборе Fischer Johns.
пиридин-6-ил)этанон (5а) и этил-7-амино-5-ме-
4-Амино-1,2,5-оксадиазол-3-карбонитрил [27],
тил[1,2,5]оксадиазоло[3,4-b]пиридин-6-карбок-
5-амино-1-бензил-1Н-1,2,3-триазол-4-карбони-
силат (5в). К раствору 5.5 г (0.05 моль) соедине-
трил [28] и 5-амино-1-фенил-1Н-пиразол-4-карбо-
ния 2 в 150 мл хлористого метилена добавляли
нитрил [29] получали по соответствующим мето-
9.75 г (0.075 моль) этилового эфира ацетоуксусной
дикам.
кислоты и 0.39 г (0.0015 моль) никелевого ком-
Общая методика получения никелевых ком-
плекса 1а. Смесь перемешивали при температуре
плексов 1,3-дикарбонильных соединений 1а-и.
35-40°С, через 6 ч добавляли 0.13 г комплекса 1а
К раствору 4.76 г (0.02 моль) гексагидрата хлори-
и через 4 ч еще 0.13 г комплекса 1а и продолжали
да никеля(II) в 50 мл воды добавляли 50 мл этано-
перемешивание еще в течение 12 ч. Растворитель
ла и 0.05 моль дикарбонильного соединения. При
упаривали в вакууме, к остатку добавляли 150 мл
перемешивании и охлаждении до 0-5°С добавля-
этанола и 10 мл уксусной кислоты. Смесь кипяти-
ли раствор 1.6 г (0.04 моль) гидроксида натрия в
ли 2 ч, затем растворитель упаривали в вакууме.
20 мл воды в течение 15 мин. Смесь перемешивали
К остатку добавляли 50 мл воды, осадок отфиль-
2 ч, осадок отфильтровывали, промывали водой,
тровывали и промывали водой. Полученную смесь
сушили на воздухе, затем растворяли в хлористом
продуктов разделяли с помощью колоночной хро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ПРИМЕНЕНИЕ НИКЕЛЕВЫХ КОМПЛЕКСОВ
1235
матографии на силикагеле (элюент - хлороформ-
1078, 1030, 1004. Спектр ЯМР 1Н, δ, м. д.: 2.59 с
этилацетат, 75:15 с градиентом метанола от 5 до
(3Н, СН3), 3.86 с (3Н, ОСН3), 8.67 уш. с (2Н, NH2).
8%). Выделены соединения 5а (0.77 г, 8%) и 5в
Спектр ЯМР 13С, δС, м. д.: 28.0, 52.5, 102.6, 140.3,
(9.44 г, 85%).
145.9, 158.4, 167.3, 170.2. Найдено, %: С 46.31; Н
3.82; N 27.10. C8H8N4O3. Вычислено, %: С46.16; Н
1-(7-Амино-5-метил[1,2,5]оксадиазоло[3,4-b]-
3.87; N 26.91.
пиридин-6-ил)этанон (5а). Светло-желтые кри-
сталлы, т. пл. 194-196°С (этанол) (т. пл. 197-198°С
Бензил-7-амино-5-метил[1,2,5]оксадиазо-
[24]). ИК спектр, ν, см-1: 3277, 3142, 1650, 1622,
ло[3,4-b]пиридин-6-карбоксилат (5г) получали
1597, 1541, 1508, 1449, 1378, 1358, 1308, 1258,
аналогично из 0.55 г (0.005 моль) соединения 2 и
1189, 1088, 1030. Спектр ЯМР 1Н, δ, м. д.: 2.49 с
1.11 г (0.0025 моль) никелевого комплекса 1г. Вы-
( 3Н, СН3), 2.55 с (3Н, СН3), 8.30 уш. с (2Н, NH2).
ход 1.25 г (88%), т. пл. 159-161°С (этанол-вода,
Найдено, %: С 49.75; Н 4.12; N 28.82. C8H8N4O2.
3:1). ИК спектр, ν, см-1: 3348, 3270, 3178, 3035,
Вычислено, %: С 50.00; Н 4.20; N 29.15.
1679, 1626, 1601, 1513, 1438, 1385, 1362, 1307,
1271, 1202, 1077. Спектр ЯМР 1Н, δ, м. д.: 2.60 с
Этил-7-амино-5-метил[1,2,5]оксадиазо-
(3Н, СН3), 5.37 с (2Н, СН2), 7.34-7.48 м (5Н, С6Н5),
ло[3,4-b]пиридин-6-карбоксилат (5в). Бесцвет-
8.52 уш. с (2Н, NH2). Спектр ЯМР 13С, δС, м. д.:
ные кристаллы, т. пл. 178-179°С (этанол) (т. пл.
28.3, 67.1, 102.5, 128.6, 128.9, 130.0, 136.2, 140.3,
179-180°С [24]). ИК спектр, ν, см-1: 3349, 3270,
146.4, 158.5, 166.9, 170.1. Найдено, %: С 58.96; Н
3174, 2991, 1677, 1623, 1515, 1443, 1381, 1361,
4.32; N 20.01. C14H12N4O3. Вычислено, %: С59.15;
1276, 1203, 1098, 1078, 1030, 1004. Спектр ЯМР
Н 4.25; N 19.71.
1Н, δ, м. д.: 1.33 т (3Н, ОСН2СН3, 3JHH = 7.1 Гц),
трет-Бутил-7-амино-5-метил[1,2,5]оксади-
2.61 с (3Н, СН3), 4.35 к (2Н, ОСН2СН3, 3JHH = 7.1
азоло[3,4-b]пиридин-6-карбоксилат (5д) получа-
Гц), 8.57 уш. с (2Н, NH2). Найдено, %: С 48.90; Н
ли аналогично из 0.55 г (0.005 моль) соединения
4.77; N 24.97. C9H10N4O3. Вычислено, %: С 48.65;
2 и 0.94 г (0.0025 моль) никелевого комплекса 1д.
Н 4.54; N 25.21.
Выход 1.03 г (82%), т. пл. 174-175°С (этанол-вода,
Соединение 5в также было получено из 0.55 г
1:1). ИК спектр, ν, см-1: 3378, 3278, 3182, 3145,
(0.005 моль) соединения 2 и 0.79 г (0.0025 моль)
2978, 1683, 1624, 1514, 1442, 1371, 1295, 1252,
никелевого комплекса 1в. Выход 1.03 г (92.8%).
1206, 1163, 1103, 1082, 1031. Спектр ЯМР 1Н, δ,
Проба смешения образцов соединения 5в, полу-
м. д.: 1.58 с [9Н, С(СН3)3], 2.63 с (3Н, СН3), 8.55
ченных разными способами, не давала депрессии
уш. с (2Н, NH2). Спектр ЯМР 13С, δС, м. д.: 28.4,
температуры плавления. Их спектральные данные
28.8, 83.0, 103.8, 140.3, 146.2, 158.3, 166.6, 170.1.
идентичны.
Найдено, %: С 52.64; Н 5.80; N 22.11. C11H14N4O3.
Метил-7-амино-5-метил[1,2,5]оксадиазо-
Вычислено, %: С 52.79; Н 5.64; N 22.39.
ло[3,4-b]пиридин-6-карбоксилат
(5б). К рас-
2-Метоксиэтил-7-амино-5-метил[1,2,5]окса-
твору 1.1 г (0.01 моль) соединения 2 в 50 мл хло-
диазоло[3,4-b]пиридин-6-карбоксилат (5е) полу-
ристого метилена добавляли 1.44 г (0.005 моль)
чали аналогично из 0.55 г (0.005 моль) соединения
никелевого комплекса 1б и две капли метилового
2 и 0.95 г (0.0025 моль) никелевого комплекса 1е.
эфира ацетоуксусной кислоты. Смесь перемеши-
Выход 0.98 г (78%), т. пл. 126-128°С (бензол-эта-
вали 30 мин при температуре 35-40°С, раствори-
нол, 4:1). ИК спектр, ν, см-1: 3372, 3276, 3206, 2998,
тель упаривали в вакууме. К остатку добавляли
2939, 2841, 1679, 1641, 1599, 1538, 1516, 1449, 1381,
20 мл этанола и 3 мл уксусной кислоты. Получен-
1287, 1201, 1108, 1073, 1019. Спектр ЯМР 1Н, δ,
ную смесь кипятили 1 ч, затем часть этанола упа-
м. д.: 2.50 с (3Н, СН3), 3.32 с (3Н, ОСН3), 3.65-3.69
ривали в вакууме, к остатку добавляли 30 мл воды.
м (2Н, ОСН2СН2ОСН3), 4.41-4.45 м (2Н, ОСН2С-
Осадок отфильтровывали, промывали водой и
Н2ОСН3), 8.90 уш. с. (2Н, NH2). Спектр ЯМР 13С,
соединение 5б очищали кристаллизацией. Выход
δС, м. д.: 27.9, 58.4, 64.0, 69.8, 102.5, 140.2, 146.1,
1.91 г (91.8%), т. пл. 193-194°С (этанол-вода, 2:1).
158.4, 166.6, 170.2. Найдено, %: С 46.83; Н 4.72; N
ИК спектр, ν, см-1: 3349, 3270, 3174, 2991, 1677,
22.43. C10H12N4O4. Вычислено, %: С 46.62; Н 4.80;
1623, 1515, 1443, 1381, 1361, 1276, 1203, 1098,
N 22.21.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1236
ВЫДЖАК и др.
Этил-7-амино-5-этил[1,2,5]оксадиазо-
1-(7-Амино-3-бензил-5-метил-3Н[1,2,3]триа-
ло[3,4-b]пиридин-6-карбоксилат (5ж) получали
золо[4,5-b]пиридин-6-ил)этанон (6а). К раствору
аналогично из 0.55 г (0.005 моль) соединения 2 и
0.50 г (0.0025 моль) соединения 3 в 15 мл дихлор-
0.87 г (0.0025 моль) никелевого комплекса 1ж. Вы-
этана добавляли 0.32 г (0.0013 моль) никелевого
ход 1.07 г (90.7%), т. пл. 150-151°С (этанол-вода,
комплекса 1а и две капли ацетилацетона. Смесь
3:1). ИК спектр, ν, см-1: 3373, 3020, 2991, 2970,
кипятили 16 ч, соединение 6а выделяли анало-
1688, 1638, 1598, 1504, 1445, 1382, 1284, 1248,
гично соединению 5б. Выход 0.51 г (72.5%), т. пл.
1206, 1110, 1016. Спектр ЯМР 1Н, δ, м. д.: 1,19 т
158-160°С (этанол). ИК спектр, ν, см-1: 3419, 3293,
3234, 3186, 1629, 1581, 1486, 1448, 1419, 1342,
(3Н, СН2СН3, 3JHH = 7.4 Гц), 1.32 т (3Н, ОСН2СН3,
1273, 1222, 1109. Спектр ЯМР 1Н, δ, м. д.: 2.51 с
3JHH = 7.1 Гц), 2.93 к (2Н, СН2СН3, 3JHH = 7.4 Гц),
(3Н, СН3), 2.54 с (3Н, СН3), 5.76 с (2Н, СН2), 7.27-
4.36 к (2Н, ОСН2СН3, 3JHH = 7.1 Гц), 8.45 уш. с
7.37 м ( 5Н, C6H5), 7.71 уш. с ( 2Н, NH2). Спектр
(2Н, NH2). Спектр ЯМР 13С, δС, м. д.: 13.1, 14.3,
ЯМР 13С, δС, м. д.: 25.9, 32.7, 49.5, 114.9, 127.2,
32.3, 61.6, 103.4, 140.2, 145.4, 158.7, 167.0, 173.9.
128.1, 128.4, 129.2, 136.7, 145.8, 146.1, 159.3, 203.9.
Найдено, %: С 51.05; Н 5.22; N 23.53. C10H12N4O4.
Найдено, %: С 63.81; Н 5.49; N 25.07. C15H15N5O.
Вычислено, %: С 50.84; Н 5.12; N 23.72.
Вычислено, %: С 64.04; Н 5.37; N 24.89.
Этил-7-амино-5-циклопропил[1,2,5]оксади-
Метил-7-амино-3-бензил-5-метил-3Н[1,2,3]-
азоло[3,4-b]пиридин-6-карбоксилат (5з) получа-
триазоло[4,5-b]пиридин-6-карбоксилат (6б) по-
ли аналогично из 0.55 г (0.005 моль) соединения
лучали аналогично из 0.50 г (0.0025 моль) соедине-
2 и 0.93 г (0.0025 моль) никелевого комплекса 1з.
ния 3 и 0.41 г (0.0013 моль) никелевого комплекса
Выход 1.04 г (83.9%), т. пл. 158-160°С (этанол-
1б. Выход 0.51 г (72.5%), т. пл. 167-169°С (мета-
вода, 3:1). ИК спектр, ν, см-1: 3378, 3275, 3184,
нол). ИК спектр, ν, см-1: 3397, 3279, 3229, 3177,
2992, 1681, 1627, 1597, 1535, 1505, 1450, 1400,
1678, 1638, 1583, 1428, 1385, 1364, 1339, 1277,
1270, 1205, 1092, 1011. Спектр ЯМР 1Н, δ, м. д.:
1249, 1102, 1071. Спектр ЯМР 1Н, δ, м. д.: 2.61 с
0.97-1.04 м (2Н, циклопропил), 1.12-1.18 м (2Н,
(3Н, СН3), 3.85 с (3Н, OСН3), 5.75 с (2Н, СН2С6Н5),
циклопропил), 1.32 т (3Н, ОСН2СН3, 3JHH = 7.1
7.27-7.38 м (5Н, C6H5), 7.92 уш. с (2Н, NH2). Най-
Гц), 2.37-2.46 м (1Н, циклопропил), 4.37 к (2Н,
дено, %: С 60.88; Н 5.17; N 23.30. C15H15N5O2. Вы-
ОСН2СН3, 3JHH = 7.1 Гц), 8.31 уш. с (2Н, NH2).
числено, %: С 60.60; Н 5.09; N 23.55.
Спектр ЯМР 13С, δС, м. д.: 12.3, 14.4, 17.5, 61.8,
Этил-7-амино-3-бензил-5-метил-3Н[1,2,3]-
104.9, 140.1, 144.2, 158.9, 167.1, 173.3. Найдено, %:
триазоло[4,5-b]пиридин-6-карбоксилат
(6в)
С 53.01; Н 4.99; N 22.83. C11H12N4O4. Вычислено,
получали аналогично из 0.50 г (0.0025 моль) со-
%: С 53.22; Н 4.87; N 22.57.
единения 3 и 0.36г (0.0013 моль) никелевого ком-
Этил-7-амино-5-(дифторметил)[1,2,5]окса-
плекса 1в. Выход 0.52 г (66.7%), т. пл. 125-127°С
диазоло[3,4-b]пиридин-6-карбоксилат
(5и). К
(этанол). ИК спектр, ν, см-1:3427, 3296, 3244, 3192,
раствору 0.55 г (0.005 моль) соединения 2 в 20 мл
1694, 1640, 1583, 1477, 1364, 1314, 1276, 1245,
дихлорэтана добавляли 0.97 г (0.0025 моль) ни-
1104, 1082, 1017. Спектр ЯМР 1Н, δ, м. д.: 1.33 т
келевого комплекса 1к и две капли этил-4,4-диф-
(3Н, ОСН2СН3, 3JHH = 7.1 Гц), 2.64 с (3Н, СН3),
тор-3-оксобутаноата. Смесь кипятили 8 ч, соеди-
4.35 к (2Н, ОСН2СН3, 3JHH = 7.1 Гц), 5.76 с ( 2Н,
нение 5и выделяли аналогично соединению 5б.
СН2С6Н5), 7.28-7.37 м (5Н, С6Н5), 7.92 уш. с (2Н,
Выход 0.97 г (75.2%), т. пл. 119-120°С (бензол-
NH2). Спектр ЯМР 13С, δС, м. д.: 14.5, 27.4, 49.5,
этанол, 1:1). ИК спектр, ν, см-1: 3395, 3273, 1685,
61.2, 103.3, 127.1, 128.1, 128.4, 129.2, 136.6, 145.9,
1607, 1518, 1408, 1381, 1288, 1208, 1133, 1094,
148.7, 162.4, 168.2. Найдено, %: С 61.58; Н 5.67; N
1066, 1018. Спектр ЯМР 1Н, δ, м. д.: 1.33 т (3Н,
22.64. C16H17N5O2. Вычислено, %: С 61.72; Н 5.50;
ОСН2СН3, 3JHH = 7.2 Гц), 4.38 к (2Н, ОСН2СН3,
N 22.49.
3JHH = 7.2 Гц), 7.30 т (1Н, CHF2, 2JHF = 53.6 Гц),
Бензил-7-амино-3-бензил-5-метил-3Н[1,2,3]-
9.15 д (2Н, NH2). Найдено, %: С 41.61; Н 3.26; N
триазоло[4,5-b]пиридин-6-карбоксилат
(6г)
21.43. C9H8F2N4O3. Вычислено, %: С 41.87; Н 3.12;
получали аналогично из 0.50 г (0.0025 моль) со-
N 21.70.
единения 3 и 0.56г (0.0013 моль) никелевого ком-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ПРИМЕНЕНИЕ НИКЕЛЕВЫХ КОМПЛЕКСОВ
1237
плекса 1г. Соединение 6г выделяли с помощью
бензола добавляли 0.32 г (0.0013 моль) никелевого
колоночной хроматографии на силикагеле (элюент -
комплекса 1а и две капли ацетилацетона. Смесь
гексан-этилацетат, 3:1). Выход 0.76 г (81.7%),
перемешивали 30 ч при температуре 100-110°С.
т. пл. 134-135°С (гексан-этилацетат, 1:1). ИК
Соединение 7а выделяли с помощью колоноч-
спектр, ν, см-1: 3395, 3279, 3232, 3182, 1673, 1631,
ной хроматографии на силикагеле (элюент - гек-
1584, 1492, 1422, 1381, 1336, 1275, 1237, 1104.
сан-этилацетат, 5:2). Выход 0.27 г (40.6%), т. пл.
Спектр ЯМР 1Н, δ, м. д.: 2.76 с (3Н, СН3), 5.36 с
196-198°С (этанол) (т. пл. 166-168°С [18]). Спектр
(2Н, СН2С6Н5), 5.72 с (2Н, СН2С6Н5), 7.23-7.45 м
ЯМР 1Н, δ, м. д.: 2.54 с (3Н, СН3), 2.58 с (3Н, СН3),
(10Н, C6H5), 7.85 уш.с (2Н, NH2). Найдено, %: С
7.29-7.32 м (1Нar), 7.50-7.54 м (2НAr), 7.62 уш. с
67.82; Н 5.21; N 18.49. C21H19N5O2. Вычислено, %:
(2Н, NH2), 8.24-8.28 м (2НAr), 8.48 с (1Н, С3Н).
С 67.55; Н 5.13; N 18.75.
Найдено, %: С 67.91; Н 5.45; N 20.67. C15H14N4O.
трет-Бутил-7-амино-3-бензил-5-ме-
Вычислено, %: С 67.65; Н 5.30; N 21.04.
тил-3Н[1,2,3]триазоло[4,5-b]пиридин-6-кар-
Метил-4-амино-6-метил-1-фенил-1Н-пира-
боксилат (6д) получали аналогично из 0.50 г
золо[3,4-b]пиридин-5-карбоксилат (7б) получа-
(0.0025 моль) соединения 3 и 0.47 г (0.0013 моль)
ли аналогично из 0.46 г (0.0025 моль) соединения
никелевого комплекса 1д. Соединение 6д выде-
4 и 0.41 г (0.0013 моль) никелевого комплекса 1б.
ляли с помощью колоночной хроматографии на
Соединение 7б выделяли с помощью колоночной
силикагеле (элюент - гексан-этилацетат, 4:1). Вы-
хроматографии на силикагеле (элюент - гексан-
ход 0.47 г (55.3%), т. пл. 177-179°С (гексан-эти-
этилацетат, 3:1). Выход 0.15 г (21.3%), т. пл. 128-
лацетат, 2:1). ИК спектр, ν, см-1: 3413, 3285, 3238,
129°С (метанол) (т. пл. 125-126°С [17]). Спектр
3186,1681, 1631, 1588, 1389, 1366, 1340, 1306, 1282,
ЯМР 1Н, δ, м. д.: 2.66 с (3Н, СН3), 3.85 с (3Н, OСН3),
1253, 1164,1112.Спектр ЯМР 1Н, δ, м. д.: 1.60 с [9Н,
7.26-7.30 м (1НAr), 7.51-7.55 м (2НAr), 7.70 уш.
С(СН3)3], 2.68 с (3Н, СН3), 5.71 с ( 2Н, СН2С6Н5),
с (2Н, NH2), 8.24-8.28 м (2НAr), 8.50 с (1Н, С3Н).
7.27-7.37 м (5Н, С6Н5), 7.87 уш. с (2Н, NH2). Най-
дено, %: С 63.91; Н 6.35; N 20.48. C18H21N5O2. Вы-
Найдено, %: С 63.59; Н 5.11; N 20.14. C15H14N4O2.
числено, %: С 63.70; Н 6.24; N 20.63.
Вычислено, %: С 63.82; Н 5.00; N 19.85.
Этил-7-амино-3-бензил-5-этил-3Н[1,2,3]три-
Этил-4-амино-6-метил-1-фенил-1Н-пиразо-
азоло[4,5-b]пиридин-6-карбоксилат (6ж) полу-
ло[3,4-b]пиридин-5-карбоксилат (7в) получали
чали аналогично из 0.50 г (0.0025 моль) соедине-
аналогично из 0.46 г (0.0025 моль) соединения 4 и
ния 3 и 0.36 г (0.0013 моль) никелевого комплекса
0.41 г (0.0013 моль) никелевого комплекса 1в. Сое-
1ж. Соединение 6ж выделяли с помощью колоноч-
динение 7в выделяли с помощью колоночной хро-
ной хроматографии на силикагеле (элюент - гек-
матографии на силикагеле (элюент - гексан-этила-
сан-этилацетат, 7:2). Выход 0.52 г (64.2%), т. пл.
цетат, 3:1). Выход 0.23 г (31.1%), т. пл. 130-131°С
151-152°С (этанол). ИК спектр, ν, см-1:3392, 3275,
(этанол) (т. пл. 130-132°С [18]). Спектр ЯМР 1Н,
3229, 3179,1669, 1632, 1583, 1478, 1443, 1375, 1334,
δ, м. д.: 1.33 т (3Н, ОСН2СН3, 3JHH = 7.2 Гц), 2.66
1248, 1097, 1069. Спектр ЯМР 1Н, δ, м. д.: 1,20 т
с (3Н, СН3), 4.34 к (2Н, ОСН2СН3, 3JHH = 7.2 Гц),
(3Н, СН2СН3, 3JHH = 7.4 Гц), 1.31 т (3Н, ОСН2СН3,
7.26-7.30 м (1НAr), 7.51-7.55 м (2НAr), 7.76 уш. с
3JHH = 7.1 Гц), 2.92 к (2Н, СН2СН3, 3JHH = 7.4 Гц),
(2Н, NH2), 8.23-8.27 м (2НAr), 8.51 с (1Н, С3Н).
4.33 к (2Н, ОСН2СН3, 3JHH = 7.1 Гц), 5.74 с ( 2Н,
Найдено, %: С 65.14; Н 5.59; N 19.17. C16H14N4O2.
СН2С6Н5), 7.26-7.37 м (5Н, С6Н5), 7.75 уш. с (2Н,
Вычислено, %: С 64.85; Н 5.44; N 18.91.
NH2). Спектр ЯМР 13С, δС, м. д.: 14.2, 14.4, 31.6,
49.6, 61.3, 103.7, 126.8, 128.2, 128.4, 129.1, 136.5,
КОНФЛИКТ ИНТЕРЕСОВ
146.0, 148.1, 166.3, 168.1. ). Найдено, %: С 62.59; Н
Авторы заявляют об отсутствии конфликта
6.01; N 21.28. C17H19N5O2. Вычислено, %: С 62.76;
интересов.
Н 5.89; N 21.52.
СПИСОК ЛИТЕРАТУРЫ
1-(4-Амино-6-метил-1-фенил-1Н-пиразо-
ло[3,4-b]пиридин-5-ил)этанон (7а). К раствору
1. Schneller S.W., Luo J.-K. // J. Org. Chem. 1980. Vol. 45.
0.46 г (0.0025 моль) соединения 3 в 15 мл хлор-
N 20. P. 4045. doi 10.1021/jo01308a021
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1238
ВЫДЖАК и др.
2. Klemm L.H., Louris J.N., Boisvert W., Higgins C.,
17. Hu H., Song L., Fang Q., Zheng J., Meng Z. Luo Y. //
Muchiri D. R. // J. Heterocycl. Chem. 1985. Vol. 22.
Molecules. 2011. Vol. 16. N 2. P. 1878. doi 10.3390/
N 5. P. 1249. doi 10.1002/jhet.5570220522
molecules16021878
3. Klemm L.H., Wang J., Sur S.K. // J. Heterocycl. Chem.
18. Потапов А.Ю., Вандышев Д.Ю, Кошелева Е.А.,
1990. Vol. 27. N 6. P. 1537. doi 10.1002/jhet.557027063
Поликарчук В.А., Потапов М.А., Шихалиев Х.С. //
4. Meade E.A., Beauchamp L.M. // J. Heterocycl. Chem.
ХГС. 2017. Т. 53 № 2. С. 207; Potapov A.Yu., Vandy-
1996. Vol. 33. N 2. P. 303. doi 10.1002/jhet.5570330215
shev D.Yu., Kosheleva Y.A., Polikarchuk V.A., Pota-
5. Hohn H., Denzel Th., Janssen W. // J. Heterocycl. Chem.
pov M.A., Shikhaliev V.S. // Chem. Heterocycl. Compв.
1972. Vol. 9. N . P. 235. doi 10.1002/jhet.5570090212
2017. Vol. 53. N 2. P.207. doi 10.1007/s10593-017-
6. Bare T.M., McLaren C.D., Campbell J.B., Firor J.W.,
2041-9
19. Frasson I., Spano V., Di Martino S., Nadai M., Doria F.,
Resch J.F., Walters C.P., Salama A.I., Meiners B.A.,
Parrino B., Carbone A., Cascioferro S.M., Diana P.,
Patel J.B. // J. Med. Chem. 1989. Vol. 32. N 12. P. 2561.
Cirrincione G., Freccero M., Barraja P., Richter S.N.,
doi 10.1021/jm00132a011
Montalbano A. // Eur. J. Med. Chem. 2018. Vol. 162.
7. Hulpia F., Noppen S., Schols D., Andrei G., Snoeck R.,
P. 176. doi 10.1016/j.ejmech.2018.10.071
Liekens S., Vervaeke P., Van Calenbergh S. // Eur. J.
20. Forbes I.T., Johnson G.N., Thompson M. // J. Chem.
Med. Chem. 2018. Vol. 157. P 248. doi 10.1016/j.
Soc. Perkin Trans. 1. 1992. N 2. P. 275. doi 10.1039/
eimech.2018.07.062
P19920000275
8. Kendre D.B., Toche R.B., Jachak M.N. // Tetrahedron.
21. Thomae D., Kirch G., Seck P. // Synthesis. 2007. N 7.
2007. Vol. 63. N 45. P. 11000. doi 10.1016/j.
P. 1027. doi 10.1055/s-2007-965944
tet.2007.08.052
22. Lalezari I. // J. Heterocycl. Chem. 1979. Vol. 16. N 3.
9. Russell R.K., Lever W.O. // Synth. Commun. 1993. Vol. 23.
P. 603. doi 10.1002/jhet.5570160341
N 20. P. 2931. doi 10.1080/00397919308012615
23. Song Y.-H., Seo J. // J. Heterocycl. Chem. 2007. Vol. 44.
10. Rochling H., Buchel K.H. // Chem. Ber. 1971. Vol. 104.
N 12. P. 1439. doi 10.1002/jhet.5570440631
N 1. P. 344. doi 10.1002/cber.19711040140
24. Васильев Л.С., Шереметев А.Б., Хоа Н.К., Демья-
11. Mascal M., Hext N.M., Warmuth R., Arnall-Culi-
нец З.К., Дмитриев Д.Е., Дорохов В.А. // Изв. АН.
ford J.R., Moore M.H., Turkenburg J.R. // J. Org. Chem.
Сер. хим. 2001. Т. 50. № 7. С. 1220. // Vasil’ev L.S.,
1999. Vol. 64. N 23. P. 8479. doi 10.1021/jo990719t
Sheremetev A.V., Khoa N.K., Dem’yanets Z.K., Dmitri-
12. Комарова Е.С., Макаров В.А., Алексеева Л.М., Авра-
ev D.E., Dorokhov V.A. // Russ. Chem. Bull. 2001.
менко Г.В., Граник В.Г. // Изв. АН. Сер. хим. 2007.
Vol. 50. N 7. P. 1280. doi 10.1023/A:1014075327382
Т. 56 № 11. С. 2258; Komarova E.S., Makarov V.A.,
25. Corain B., Basato M., Ballota C., Ahmed M. // Inorg.
Alekseeva L.M., Avramenko G.V., Granik V.G. // Russ.
Chim. Acta. 1984. Vol. 87. N 1. P. 105. doi 10.1016/
Chem. Bull. 2007. Vol. 56. N 11. P. 2337. doi 10.1007/
S0020-1693(00)83629-4
s11172-007-0369-5
26. Nelson J.H., Howells P.N., DeLullo G.C., Landen G.L.,
13. Silva D., Chioua M., Samadi A., Carmo C., Jimero M.-L.,
Henry R.A. // J. Org. Chem. 1980. Vol. 45. N 7. P. 1246.
Mendes E., Rios C., Romero A., Villarroya M., Lopez M.,
doi 10.1021/jo01295a017
Marco-Contelles J. // Eur. J. Med. Chem. 2011. Vol. 46.
27. Яровенко В.Н., Краюшкин М.М., Лысенко
N 9. P. 4676. doi 10.1016/j.ejmech.2011.05.068
О.В., Кустов Л.М., Заварзин И.В. //Изв. АН.
14. Corre L., Tak-Tak L., Guillard A., Prestat G., Gravier-
Сер. хим. 1994. Т. 43 № 3. С. 444; Yaroven-
Delletier C., Busca D. // Org. Biomol. Chem. 2015. Vol.
ko V.N., Krayushkin M.M., Lysenko O.V., Kustov L.M.,
13. N 2. P. 409. doi 10.1039/C4OB01951B
Zavarzin I.V. // Russ. Chem. Bull. 1994. Vol. 43. N 3.
15. Rodrigues L.M., Francisco C.S., Oliveira-Campos A.M.,
P. 402. doi 10.1007/BF01169715
Salaheldin A.M. // Synth. Commun. 2008. Vol. 38. N 24.
28. Cabbe G., Gadts F., Toppet S. // Bull. Soc. Chim.
P. 4369. doi 10.1080/00397910802331638
Belg. 1985. Vol. 94. N 7. P. 441. doi 10.1002/
16. Thomae D., Perspicate E., Hesse S., Kirsch G., Seck P. //
bscb.19850940702
Tetrahedron. 2008. Vol. 64. N 39. P. 9309. doi 10.1016/j.
29. Cheng C.C., Robins R.K. // J. Org. Chem. 1956. Vol. 21.
tet.2008.07.017
N 11. P. 1240. doi 10.1021/jo0117a010
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
ПРИМЕНЕНИЕ НИКЕЛЕВЫХ КОМПЛЕКСОВ
1239
Application of Nickel Complexes with 1,3-Dicarbonyl
Compounds for Synthesis of Fused 4-Aminopyridine-Based
Systems
R. N. Vydzhak, S. Ya. Panchishin, and V. S. Brovarets*
V.P. Kukhar Institute of Bioorganic Chemistry and Petrochemistry of the National Academy of Sciences of Ukraine,
Kiev, 02094 Ukraine
*e-mail: brovarets@bpci.kiev.ua
Received March 27, 2020; revised March 27, 2020; accepted April 10, 2020
A potential of using nickel complexes with 1,3-dicarbonyl compounds for the transformation of heterocyclic
aminonitriles into fused systems with a 4-aminopyridine core was evaluated. A possibility of introducing
acidophobic groups into the molecules of fused compounds was shown.
Keywords: nickel complexes with 1,3-dicarbonyl compounds, oxadiazolo[3,4-b]pyridines, triazolo[4,5-b]-
pyridines, pyrazolo[3,4-b]pyridines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020