ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1247-1261
УДК 547.341
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ
СОЕДИНЕНИЙ И ИХ АНАЛОГОВ
2-ГАЛОГЕНМЕТИЛ(ЭТОКСИКАРБОНИЛ)-
(ДИЭТОКСИФОСФОРИЛМЕТИЛ)ФУРАНАМИ
© 2020 г. Л. М. Певзнер*, А. И. Поняев
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*е-mail: pevzner_lm@list.ru
Поступило в Редакцию 27 февраля 2020 г.
После доработки 27 февраля 2020 г.
Принято к печати 5 марта 2020 г.
2-Галогенметильные производные эфиров фосфонкарбоновых кислот фуранового ряда реагируют с
ацетилацетоном, ацетоуксусным, малоновым и цианоуксусным эфиром в среде абсолютный этанол-
диоксан (1:10) в присутствии этилата натрия с образованием моноалкильных производных. Реакции
3-(фурилметил)ацетилацетона и 2-(фурилметил)ацетоуксусного эфира с гидразингидратом приводят к
образованию фосфорсодержащих (фурил)(пиразолил)метанов и (фурил)(пиразолонил)метанов соответ-
ственно. Последние в растворах существуют исключительно в гидроксиформе.
Ключевые слова: 1,3-дикарбонильные соединения, 2-галогенметилфураны, пиразолы, пиразолоны,
кето-енольная таутомерия
DOI: 10.31857/S0044460X20080132
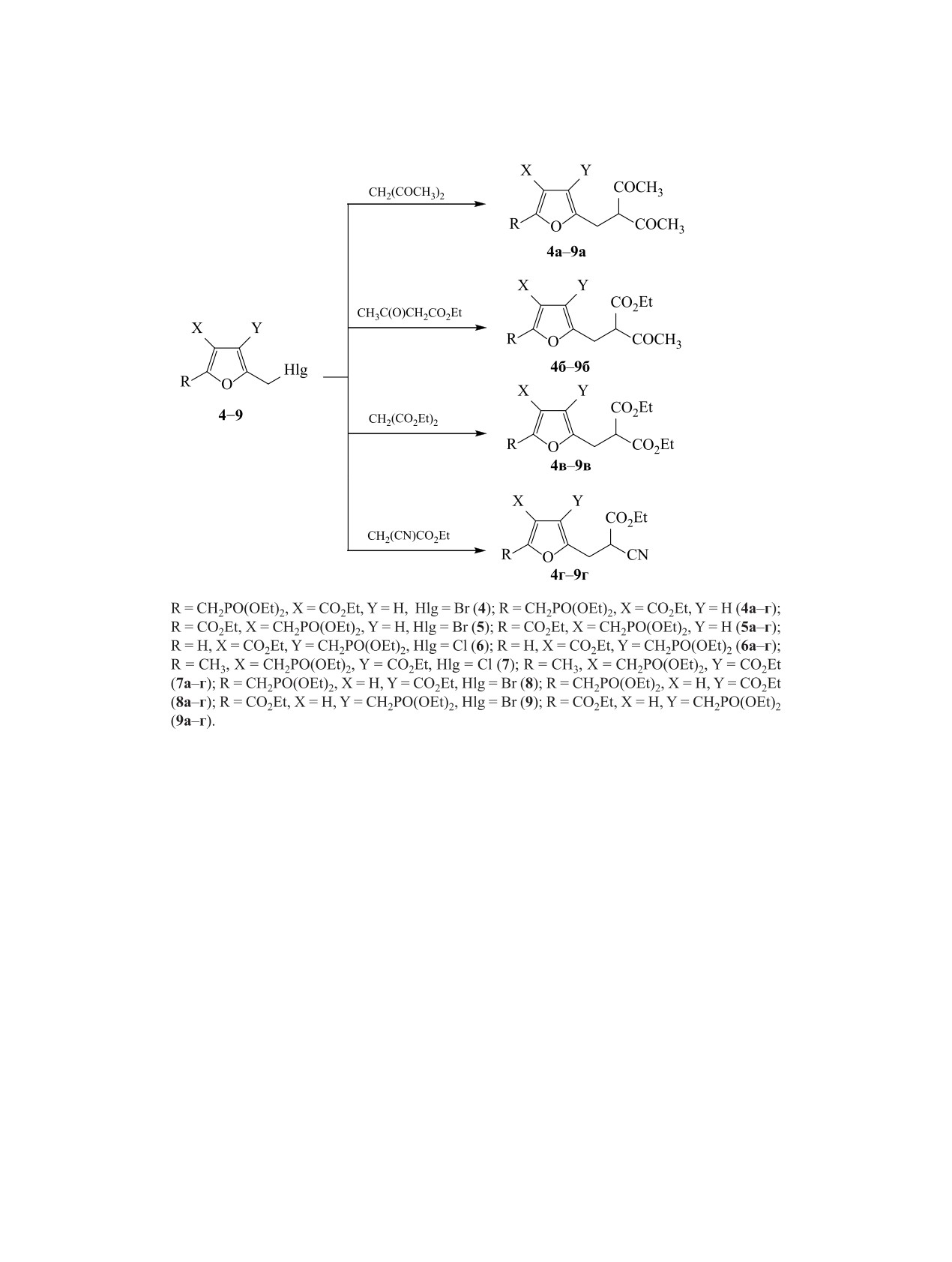
1,3-Дикарбонильные соединения и их аналоги
логенметилфуранов с 1,3-дикарбонильными со-
широко применяются в синтезе самых разнообраз-
единениями, поэтому целью настоящей работы
ных гетероциклических соединений. Введение в
явилось изучение возможности использования
их структуру дополнительного гетероциклическо-
синтезированных нами недавно [2, 3] 2-галогенме-
го фрагмента позволяет использовать соединения
тильных производных эфиров фосфонкарбоновых
такого строения для получения гибридных систем,
кислот фуранового ряда в этой реакции. Предпола-
содержащих гетероциклические остатки различ-
галось также показать возможность использования
ной природы связанные между собой с помощью
полученных соединений в синтезе (фурилметил)-
линкера, что широко используется для создания
пиразолов, легко образующихся в мягких услови-
ингибиторов различных ферментов [1]. В этой свя-
ях при взаимодействии производных ацетилацето-
зи большой интерес представляют бициклические
на и ацетоуксусного эфира с гидразингидратом.
соединения, содержащие фурановый фрагмент и
Первым шагом в нашей работе было установ-
электроноакцепторный гетероциклический оста-
ление последовательности стадий получения
ток, связанные между собой метиленовой группой.
производных
1,3-дикарбонильных соединений,
Наиболее очевидный путь синтеза структур
содержащих функционально-замещенный фура-
подобного строения включает алкилирование
новый фрагмент. Возможными вариантами было
1,3-дикарбонильных соединений и их аналогов
алкилирование 1,3-дикарбонильного соединения
галогенметилфуранами и последующую гетеро-
2-галогенметилфураном с последующим броми-
циклизацию. К нашему удивлению, в литературе
рованием фуранового фрагмента по метильной
не удалось найти ни одного примера реакции га-
группе N-бромсукцинимидом и дополнительной
1247
1248
ПЕВЗНЕР, ПОНЯЕВ
Схема 1.
функционализацией его с помощью реакций ну-
ядра углерода располагался при 13.23 м. д. Прото-
клеофильного замещения, либо использование
ны метиленовой группы боковой цепи проявлялись
уже готовых функционально-замещенных 2-гало-
синглетом в слабом поле (3.98 м. д.). Соответству-
генметилфуранов.
ющий атом углерода регистрировался сигналом
при 34.26 м. д. Сигнал протона метиновой группы
В качестве модельного соединения был исполь-
зован этиловый эфир
2-хлорметил-5-метилфу-
исчезал, а в спектре ЯМР 13С вместо сигнала со-
ран-3-карбоновой кислоты 1, реакцию с ацетила-
ответствующего ядра углерода появлялся сигнал
цетоном проводили в смеси абсолютного этанола
при 72.31 м. д. фрагмента -СBr(СОСН3)2. Таким
и диоксана (1:10) при 90°С при мольном соотноше-
образом, в продукте алкилирования 2 бромирова-
нии фуран 1:ацетилацетон = 1.0:1.1 в присутствии
ние протекает по третичному атому углерода, а не
по метильной группе фуранового кольца. Вполне
1.05 моль этилата натрия в течение 10 ч (схема 1).
возможно, что реакция протекает по ионному ме-
С выходом 82% был выделен продукт моноал-
ханизму. Следовательно, для получения продуктов
килирования 2. Согласно данным ЯМР 1Н и 13С,
алкилирования, имеющих несколько функцио-
в хлороформе он существует в кетонной форме.
нальных групп в фурановом кольце, необходимо
В его спектре ЯМР 1Н наблюдаются дублет при
вводить эти группы в соответствующие алкилиру-
3.47 м. д. (2Н, JHH = 7.2 Гц) и триплет при 4.10 м.
ющие агенты, а затем проводить реакцию с 1,3-ди-
д. (1Н, JHH = 7.2 Гц), принадлежащие фрагменту
карбонильными соединениями.
СН2СН. Сигналы соответствующих ядер углеро-
да располагаются при 23.43 и 60.32 м. д. соответ-
Используя этот подход, мы изучили реакции
ственно. Уширенный сигнал протонов метильной
2-галогенметильных производных эфиров фос-
группы в фурановом кольце отмечается при 2.20
фонкарбоновых кислот 4-9 с ацетилацетоном, аце-
м. д., а ядро соответствующего атома углерода
тоуксусным, малоновым и циануксусным эфиром.
проявляется двумя сигналами при 13.18 и 13.26
Набор алкилирующих агентов включал произво-
м. д. Наблюдается также удвоение сигналов про-
дные дизамещенных 2-галогенметилфуранов со
тона Н4 фуранового кольца (6.20 и 6.21 м. д.), сиг-
всеми возможными вариантами относительного
налов протонов ацетильных групп (2.18 и 2.19 м.
расположения функциональных групп в фурано-
д.), а также всех ядер углерода фуранового цикла,
вом кольце. Предполагалось установить зависи-
сложноэфирной и ацетильных групп. Эти спек-
мость выхода продуктов алкилирования от строе-
тральные данные указывают на то, что соединение
ния галогенопроизводного и природы галогена.
2 существует в виде смеси спектрально различи-
Алкилирование проводили в условиях, анало-
мых конформеров в соотношении 1:1, что следует
гичных описанным выше. При введении в реакцию
из соотношений интенсивностей сигналов однои-
хлоридов 6 и 7 добавляли 15 мол% иодида калия в
менных протонов.
качестве катализатора. Во всех случаях образовы-
Бромирование соединения 2 проводили N-бром-
вались продукты моноалкилирования с выходами
сукцинимидом в присутствии AIBN в четыреххло-
70-90% (схема 2). Значимое снижение выхода до
ристом углероде при кипячении. С выходом 71%
55 и 50% соответственно наблюдалось только в
было выделено соединение 3 (схема 1). В спектре
реакциях бромида 9 с малоновым и циануксусным
ЯМР 1Н этого соединения сохранялся уширенный
эфиром. Природа галогена и стерическая загру-
сигнал протонов метильной группы фуранового
женность фуранового кольца в других случаях не
кольца при 2.21 м. д., сигнал соответствующего
оказывали влияния на выход целевых продуктов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1249
Схема 2.
Методики синтеза, выходы и спектральные харак-
ходными веществами для получения гибридных
теристики полученных соединений приведены в
гетероциклических систем. Мы решили изучить
Экспериментальной части.
реакции производных ацетилацетона
4a-9а и
Соединения 4а-9г представляют собой вязкие
ацетоуксусного эфира 4б-9б с гидразингидратом,
используемые обычно для синтеза пиразолов и
сиропообразные вещества. В растворе они суще-
ствуют в виде устойчивых конформеров или их
пиразолонов соответственно. Процесс проводили
смесей. При этом спектрально различимые кон-
при комнатной температуре в этаноле, мольное
формеры более надежно фиксируются для произ-
соотношение фуран-гидразингидрат составляло
водных ацетилацетона, ацетоуксусного и цианук-
1:1.1. Целевые продукты 4д-9д были получены с
сусного эфира, тогда как малонаты обычно дают
выходом 70-87% (схема 3), определенной зависи-
один набор сигналов в спектрах ЯМР. Возможно,
мости выхода от строения исходного соединения
здесь сказывается как раз наибольший объем за-
не наблюдалось.
местителя в боковой цепи, приводящий к обра-
Диметилпиразолы 4д-9д представляют собой
зованию своеобразного каркаса путем разворота
стеклообразные вещества светло-желтого или
заместителей друг относительно друга вокруг ма-
светло-коричневого цвета. Они не дробятся при
ленького фуранового кольца и формирования си-
растирании, а при нагревании переходят в сиропо-
стемы близких контактов.
образное состояние. В спектрах ЯМР 1Н уширен-
Легкость образования и стабильность соеди-
ный сигнал протона при атоме азота располагается
нений 4а-9г делает их привлекательными ис-
в области 9-10 м. д., протоны метильных групп
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1250
ПЕВЗНЕР, ПОНЯЕВ
Схема 3.
резонируют сигналом около 2 м. д., что указывает
гибридизацию, и амидной карбонильной группы.
на их эквивалентность. В спектрах ЯМР 13С ядра
В спектрах ЯМР 1Н соединений 5е-9е наблюда-
углерода С3,5 резонируют уширенным общим сиг-
ется очень широкий обменный сигнал около 9.6-
налом около 140 м. д., свидетельствующим о бы-
10.0 м. д., общий для ОН- и NH-групп. Хорошо
стрых обменных процессах, протекающих в пира-
различимый сигнал протонов мостиковой мети-
зольном кольце.
леновой группы проявляется синглетом, следова-
В отличие от производных ацетилацетона 4а-
тельно при соседнем атоме углерода протона нет.
9а в реакции производного ацетоуксусного эфира
В спектрах ЯМР 13С присутствуют уширенные
4б с гидразингидратом пиразольное кольцо не за-
сигналы ядер углерода при 137-140 м. д. (фраг-
мыкается. Из реакционной массы было выделено
мент СН3С=N) и 160 м. д. (фрагмент НОС=N).
только исходное вещество в количестве 70% от
Приведенные данные указывают на то, что в рас-
загруженного. Напротив, во всех остальных слу-
творах соединений 5е-9е в равновесии участвуют
чаях с выходом 70-80% образуются пиразолоны
5е, 6е, 8е, 9е. Это стеклообразные вещества, ве-
в основном гидроксиформы, а оксоформа спек-
дущие себя при нагревании аналогично произво-
трально не обнаруживается.
дным диметилпиразола 4д-9д. Пиразолон 7е об-
Таким образом, показано, что 2-галогенме-
разуется в аналогичных условиях с выходом всего
тильные производные эфиров карбоновых кислот
56%. Он представляет собой желтые кристаллы с
фуранового ряда алкилируют 1,3-дикарбонильные
т. пл. 184-185°С. Видимо, сильная стерическая за-
соединения и их аналоги. При этом с высокими
груженность фуранового кольца в данном случае
выходами образуются моноалкильные произво-
способствует образованию жесткой структуры и,
дные, существующие в кетонной форме. Дополни-
соответственно, кристаллизации вещества.
тельные функциональные группы надо вводить в
Как известно, пиразолоны могут существо-
фурановое кольцо перед проведением алкилирова-
вать в виде трех равновесных форм: двух гидрок-
ния. Производные 3-(фурилметил)пентан-2,4-ди-
си- и одной оксоформы. Последняя не обладает
она и 2-(фурилметил)-3-оксобутаноата в реакции
ароматичностью, и в ее спектре ЯМР 1Н должен
с гидразингидратом образуют соответствующие
проявляться сигнал протона при sp3-гибридизо-
ванном атоме углерода в положении 4, а в спектре
пиразолы и пиразолоны, которые в растворах су-
ЯМР 13С - сигналы ядра углерода, имеющего sp3-
ществуют исключительно в виде гидроксиформ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1251
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3-[4-(Этоксикарбонил)-5-(диэтоксифосфо-
рилметил)фур-2-ил]метилпентан-2,4-дион (4а).
Спектры ЯМР 1Н, 13С, и 31Р регистрировали на
Выход 85%, желтое сиропообразное вещество.
приборе Bruker AVANCE-400 [400.13 (1Н), 161.97
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.23-1.27 м (6Н,
(31Р), 100.16 МГц (13С)].
СН3-фосфонат), 1.28-1.34 м (3Н, СН3-эфир), 2.14
Галогенметильные производные эфиров фос-
с (3Н, СН3-ацетил), 2.19 с (3Н, СН3-ацетил), 3.12 д
фонкарбоновых кислот фуранового ряда 1, 4-9 по-
(2Н, СН2СН, JHH = 7.6 Гц), 3.64 д (1Н, СН2Р, JРH =
лучали по методике [2].
22.0 Гц), 3.66 д (1Н, СН2Р, JРH = 21.6 Гц), 4.07 д.
Алкилирование ацетилацетона, ацетоук-
к (4Н, СН2ОР, JHH = 7.2, JРH = 14.4 Гц), 4.22-4.28
сусного, малонового и цианоуксусного эфи-
м (3Н, СН2О-эфир, СН), 6.24 с (0.5 Н, Н3-фуран),
ров галогенметильными производными 1, 4-9
6.31 (0.5 Н, Н3-фуран). Спектр ЯМР 13С (CDCl3),
(общая методика). К раствору 5.2 мг-экв. свеже-
δС, м. д.: 14.27 (СН3-эфир), 14.29 (СН3-эфир), 16.31
приготовленной натриевой фольги в смеси 1 мл
д (СН3-фосфонат, 3JPC = 6.1 Гц), 16.33 д (СН3-фос-
абсолютного этанола и 10 мл безводного диоксана
фонат, 3JPC = 6.0 Гц), 23.13 (СН2СН), 23.39(СН2СН),
прибавляли 5.5 ммоль алкилируемого субстрата.
26.28 д (СН2Р, 1JPC = 139.4 Гц), 26.38 д (СН2Р, 1JPC =
Смесь перемешивали 20 мин, затем прибавляли
139.1 Гц),
29.49 (СН3-ацетил),
29.66 (СН3-
в один прием 5 ммоль галогенметильного произ-
ацетил), 60.41 (СН2О), 62.31 д (СН2ОР, 2JPC = 6.3 Гц),
водного. Полученную смесь нагревали при 90°С
62.36 д (СН2ОР, 2JPC = 6.2 Гц), 66.24 (СН), 106.62 д
в течение 10 ч при интенсивном перемешивании.
(С3-фуран, 4JPC = 2.4 Гц), 107.87 д (С3-фуран, 4JPC =
При использовании хлорметильных производных
2.6 Гц), 116.00 д (С4-фуран, 3JPC = 8.3 Гц), 116.10 д
в качестве алкилирующих агентов в реакционную
(С4-фуран, 3JPC = 8.3 Гц), 151.24 д (С2-фуран, 4JPC =
массу добавляли 0.75 ммоль иодистого калия. По-
2.8 Гц), 151.58 д (С5-фуран, 2JPC = 13.9 Гц), 151.59
сле завершения реакции отгоняли растворители,
д (С5-фуран, 2JPC = 13.8 Гц), 153.28 д (С2-фуран,
остаток растворяли в 30 мл четыреххлористого
4JPC = 2.7 Гц), 163 21 д (С=О, 4JPC = 2.6 Гц), 163.35
углерода, затем промывали 10 мл воды, 10 мл рас-
д (С=О, 4JPC = 2.8 Гц), 191.79 (С=О-кетон), 202.51
твора NaCl и сушили сульфатом натрия. Фильтрат
(С=О-кетон). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
упаривали, остаток выдерживали в вакууме (1 мм
21.58, 21.64. Соотношение конформеров 1:1.
рт. ст.) 1 ч при комнатной температуре.
Этиловый эфир
2-[4-(этоксикарбонил)-5-
3-(3-Этоксикарбонил-5-метилфур-2-ил)ме-
(диэтоксифосфорилметил)фур-2-ил]метил-
тилпентан-2,4-дион (1). Выход 82%, светло-ко-
3-оксобутановой кислоты (4б). Выход 98%, свет-
ричневое сиропообразное вещество. Спектр ЯМР
ло-желтое сиропообразное вещество. Спектр ЯМР
1Н (CDCl3), δ, м. д.: 1.31 т (1.5Н, СН3-эфир, JHH
1Н (CDCl3), δ, м. д.: 1.20-1.27 м (9Н, СН3-ацето-
= 7.0 Гц), 1.32 т (1.5Н, СН3-эфир, JHH = 7.0 Гц),
ацетат, СН3-фосфонат), 1.29 т (3Н, СН3-фуроат,
2.18 с (3Н, СН3-ацетил), 2.19 с (3Н, СН3-ацетил),
JHH = 7.2 Гц), 2.24 с (3Н, СН3-ацетил), 3.08-3.16 м
2.20 уш. с (3Н, СН3-фуран), 3.47 д (2Н, СН2, JHH =
(2Н, СН2СН), 3.62 д (1Н, СН2Р, JРH = 22.0 Гц), 3.63
7.2 Гц), 4.10 т (1Н, СН, JHH = 7.2 Гц), 4.24 к (1Н,
д (1Н, СН2Р, JРH = 22.0 Гц), 3.84 т (1Н, СН, JHH =
СН2О, JHH = 7.0 Гц), 4.26 к (1Н, СН2О, JHH =
7.4 Гц), 4.05 д. к (2Н, СН2ОР, JHH = 7.2, JРH =
7.0 Гц), 6.20 с (0.5Н, Н4-фуран), 6.21 с (0.5Н, Н4-
14.8 Гц), 4.06 д. к (2Н, СН2ОР, JHH = 7.2, JРH =
фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.18
15.2 Гц), 4.17 к (2Н, СН2О-ацетоацетат, JHH =
(СН3-фуран), 13.26 (СН3-фуран), 14.28 (СН3-эфир),
7.2 Гц), 4.23 к (2Н, СН2О-фуроат, JHH = 7.2 Гц),
14.33 (СН3-эфир), 23.43 (СН2-СН), 25.51 (СН3-
6.31 с (1Н, Н3-фуран). Спектр ЯМР 13С (CDCl3),
ацетил), 26.13 (СН3-ацетил), 60.14 (СН2О), 60.23
δС, м. д.: 14.00 (СН3-ацетоацетат), 14.26 (СН3-фу-
(СН2О), 66.33 (СН), 106.18 (С4-фуран), 106.52 (С4-
роат), 16.30 д (СН3-фосфонат, 3JPC = 6.0 Гц), 23.36
фуран),
113.84 (С3-фуран),
115.02 (С3-фуран),
(СН2СН), 26.29 д (СН2Р, 1JPC = 139.2 Гц), 29.54
150.88 (С5-фуран),
150.97 (С5-фуран),
156.59
(СН3-ацетил), 57.65 (СН), 60.32 (СН2О-фуроат),
(С2-фуран), 158.11 (С2-фуран), 163.67 (С=О-эфир),
61.75 (СН2О-ацетоацетат), 62.32 д (СН2ОР, 2JPC =
164.00 (С=О-эфир), 192.12 (С=О-кетон),
203.05
6.4 Гц), 62.34 д (СН2ОР, 2JPC = 6.3 Гц), 107.78 д
(С=О-кетон). Соотношение конформеров 1:1
(С3-фуран, 4JPC = 2.6 Гц), 116.04 д (С4-фуран, 3JPC =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1252
ПЕВЗНЕР, ПОНЯЕВ
8.3 Гц), 151.36 д (С5-фуран, 2JPC = 7.8 Гц), 151.48
(СН3-фуроат),
16.30 д (СН3-фосфонат,
3JPC
=
д (С2-фуран, 4JPC = 3.2 Гц), 163.28 д (С=О, 4JPC =
5.9 Гц), 23.36 (СН2СН), 24.72 (СН2СН),
26.42
2.6 Гц), 168.32 (С=О-ацетоацетат), 201.43 (С=О-
д (СН2Р, 1JPC = 138.9 Гц), 60.49 (СН2О-ацетат,
кетон). Спектр ЯМР 31Р (CDCl3): δР 21.58 м. д. Со-
СН2О-фуроат), 62.42 д (СН2ОР, 2JPC = 6.3 Гц),
отношение конформеров 1:1.
62.92 (СН), 63.48 (СН), 110.83 д (С3-фуран, 4JPC =
2.7 Гц), 113.11 (СN), 116.36 д (С4-фуран, 3JPC =
Диэтиловый эфир
[4-(этоксикарбонил)-5-
8.1 Гц), 117.25 (СN), 147.56 д (С2-фуран, 4JPC = 2.8
(диэтоксифосфорилметил)фур-2-ил]метилма-
Гц), 152.69 д (С5-фуран, 2JPC = 13.8 Гц), 162.97 д
лоновой кислоты (4в). Выход 92%, светло-жел-
(С=О, 4JPC = 2.6 Гц), 166.79 (С=О-ацетат). Спектр
тое сиропообразное вещество. Спектр ЯМР 1Н
ЯМР 31Р (CDCl3): δР 21.20 м. д.
(CDCl3), δ, м. д.: 1.21-1.28 м (12Н, СН3-малонат,
СН3-фосфонат), 1.31 т (3Н, СН3-фуроат, JHH =
3-[4-(Диэтоксифосфорилметил)-5-(этокси-
7.0 Гц), 3.19 д (2Н, СН2СН, JHH = 7.6 Гц, основ-
карбонил)фур-2-ил]метилпентан-2,4-дион (5а).
ной конформер), 3.64 д (2Н, СН2Р, JРH = 22.0 Гц),
Выход 79%, светло-желтое сиропообразное веще-
3.26 д (2Н, СН2СН, JHH = 7.6 Гц, минорный кон-
ство. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.25-1.28
формер), 3.68 уш. т (1Н, СН, JHH = 7.6 Гц), 4.07 д.
м (6Н, СН3-фосфонат), 1.36 т (1.5Н, СН3-фуроат,
к (4Н, СН2ОР, JHH = 7.2, JРH = 15.2 Гц), 4.19 к (4Н,
J
= 7.2 Гц), 1.37 т (1.5Н, СН3-фуроат, JHH =
HH
СН2О-малонат, JHH = 7.0 Гц), 4.25 к (2Н, СН2О-
7.0 Гц), 2.13 с (3Н, СН3-ацетил), 2.21 с (3Н, СН3-а-
фуроат, JHH = 7.0 Гц), 6.35 с (1Н, Н3-фуран, основ-
цетил), 3.19 д (2Н, СН2СН, JHH = 7.2 Гц), 3.39
ной конформер), 6.46 с (1Н, Н3-фуран, минорный
д (1Н, СН2Р, JРH = 22.0 Гц), 3.42 д (1Н, СН2Р,
конформер). Спектр ЯМР 13С (CDCl3), δС, м. д.: об-
J
= 22.0 Гц), 4.06 д. к (4Н, СН2ОР, JHH = 7.2,
РH
щие сигналы, 13.99 (СН3-малонат), 14.02 (СН3-ма-
J
= 14.8 Гц), 4.14 т (1Н, СН, JHH = 7.2 Гц), 4.33
РH
лонат), 14.26 уш. с (СН3-фуроат), 16.39 д (СН3-фос-
к (1Н, СН2О-фуроат, JHH = 7.2 Гц), 4.35 к (1Н,
фонат, 3JPC = 6.0 Гц), 62.32 д (СН2ОР, 2JPC = 6.2 Гц),
СН2О-фуроат, JHH = 7.0 Гц), 6.22 с (0.5Н, Н3-фуран),
107.89 д (С3-фуран, 4JPC = 2.6 Гц), 116.04 д (С4-
6.28 с (0.5Н, Н3-фуран). Спектр ЯМР 13С (CDCl3),
фуран, 3JPC = 8.4 Гц); основной конформер, 26.37 д
δС, м. д.: 14.36 (СН3-фуроат), 16.35 д (СН3-фосфо-
(СН2Р, 1JPC = 140.1 Гц), 27.07 (СН2СН), 50.60 (СН),
нат, 3JPC = 6.0 Гц), 23.14 (СН2СН), 23.41(СН2СН),
60.31 (СН2О-фуроат), 61.45 (СН2О-малонат), 61.72
23.84 д (СН2Р, 1JPC = 139.9 Гц), 23.87 д (СН2Р, 1JPC =
(СН2О-малонат), 151.16 д (С2-фуран, 4JPC = 2.8 Гц),
139.9 Гц),
29.49 (СН3-ацетил),
60.79 (СН2О-
151.58 д (С5-фуран, 2JPC = 13.8 Гц), 163.34 д (С=О,
фуроат), 62.12 д (СН2ОР, 2JPC = 6.3 Гц), 62.17 д
4JPC = 2.6 Гц), 168.65 (С=О-малонат); минорный
(СН2ОР, 2JPC = 6.1 Гц), 65.85 (СН), 111.00 д (С3-
конформер, 23.39 (СН2СН), 26.57 д (СН2Р, 1JPC =
фуран, 3JPC = 3.0 Гц), 112.05 д (С3-фуран, 3JPC =
140.3 Гц), 51.37 (СН), 60.36 (СН2О-фуроат), 61.89
2.8 Гц), 126.34 д (С4-фуран, 2JPC = 9.3 Гц), 148.69 д
(СН2О-малонат), 62.02 (СН2О-малонат), 149.92 д
(С5-фуран, 3JPC = 8.6 Гц), 155.09 д (С2-фуран, 4JPC =
(С2-фуран, 4JPC = 2.6 Гц), 151.98 д (С5-фуран, 2JPC =
2.1 Гц), 157.27 д (С2-фуран, 4JPC = 2.1 Гц), 158.96
13.7 Гц), 163.23 д (С=О, 4JPC = 3.0 Гц), 169.38
д (С=О, 4JPC = 2.2 Гц), 191.85 (С=О-кетон), 202.26
(С=О-малонат). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
(С=О-кетон). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
21.50 (1), 21.53 (0.3).
24.90, 24.96. Соотношение конформеров 1:1.
Этиловый эфир [4-(этоксикарбонил)-5-(ди-
Этиловый эфир
2-[4-(диэтоксифосфорил-
этоксифосфорилметил)фур-2-ил]метилцианук-
метил)-5-(этоксикарбонил)фур-2-ил]метил-3-
сусной кислоты (4г). Выход 85%, красное сиро-
оксобутановой кислоты (5б). Выход 87%, жел-
пообразное вещество. Спектр ЯМР 1Н (CDCl3),
тое сиропообразное вещество. Спектр ЯМР 1Н
δ, м. д.: 1.25 т (6Н, СН3-фосфонат, JHH = 7.2 Гц),
(CDCl3), δ, м. д.: 1.23-1.28 м (9Н, СН3-фосфонат,
1.31 т (6Н, СН3-ацетат, СН3-фуроат, JHH = 7.2 Гц),
СН3-ацетоацетат), 1.35 т (3Н, СН3-фуроат, JHH =
3.18 уш. д (1Н, СН2-СН, НА, JАВ = 15.2 Гц), 3.30
7.2 Гц), 2.27 с (3Н, СН3-ацетил), 3.16 д. д (1Н,
уш. д (1Н, СН2СН, НВ, JАВ = 15.2 Гц), 3.56-3.71 м
СН2СН, НА, JАВ = 8.0, JHH = 7.2 Гц), 3.22 д. д (1Н,
(2Н, СН2Р), 4.06 д. к (4Н, СН2ОР, JHH = 7.2, JРH =
СН2СН, НА, JАВ = 8.0, JHH = 7.2 Гц), 3.39 д (2Н,
14.8 Гц), 4.21-4.29 м (5Н, СН2О-фуроат, СН2О-а-
СН2Р, JРH = 22.0 Гц), 3.91 т (1Н, СН, JHH = 7.2 Гц),
цетат, СН), 6.59 с (1Н, Н3-фуран). Спектр ЯМР
4.04 д. к (4Н, СН2ОР, JHH = 7.2, JРH = 14.8 Гц), 4.18
13С (CDCl3), δС, м. д.: 13.93 (СН3-ацетат), 14.25
к (2Н, СН2О-ацетоацетат, JHH = 7.2 Гц), 4.32 к (2Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1253
СН2О-фуроат, JHH = 7.2 Гц), 6.28 с (1Н, Н3-фуран).
(1Н, СН2СН, НА, JАВ = 15.6, JHH(А) = 8.4 Гц), 3.38 д. д
Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.00 (СН3-аце-
(1Н, СН2СН, НВ, JАВ = 15.6, JHH(В) = 6.0 Гц), 6.54 с
тоацетат), 14.35 (СН3-фуроат), 16.33 д (СН3-фос-
(1Н, Н3-фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.:
фонат, 3JPC = 6.1 Гц), 23.38(СН2СН), 23.95 д (СН2Р,
общие сигналы, 13.95 (СН3-ацетат), 13.99 (СН3-
1JPC = 139.7 Гц), 29.53 (СН3-ацетил), 57.40 (СН),
ацетат), 14.34 (СН3-фуроат), 16.37 д (СН3-фосфо-
60.72 (СН2О-фуроат), 61.84 (СН2О-ацетоацетат),
нат, 3JPC = 6.1 Гц), 23.44 (СН2СН), 23.89 д (СН2Р,
62.14 д (СН2ОР, 2JPC = 6.4 Гц), 112.02 д (С3-фуран,
1JPC
= 139.8 Гц), 24.80 (СН2СН), 60.92 (СН2О-
3JPC = 2.8 Гц), 126.31 д (С4-фуран, 2JPC = 9.6 Гц),
ацетат, СН2О-фуроат),
60.97
(СН2О-ацетат,
139.92 д (С5-фуран, 3JPC = 11.1 Гц), 155.40 д (С2-
СН2О-фуроат), 62.27 д (СН2ОР, 2JPC = 6.3 Гц), 63.02
фуран, 4JPC = 2.1 Гц), 159.01 д (С=О, 4JPC = 2.2 Гц),
(СН), 63.38 (СН), 63.77 (СН), 115.33 (СN), 117.01
168.21 (С=О-ацетоацетат),
201.21 (С=О-кетон).
(СN), 126.28 д (С4-фуран, 2JPC = 9.7 Гц), 141.01 д
Спектр ЯМР 31Р (CDCl3): δР 24.97 м. д.
(С5-фуран, 3JPC = 10.8 Гц), 158.78 д (С=О, 4JPC =
Диэтиловый эфир
[4-(диэтоксифосфорил-
1.4 Гц), 164.65 (С=О-ацетат), 166.55 (С=О-ацетат);
метил)-5-(этоксикарбонил)фур-2-ил]метилма-
основной конформер, 114.62 д (С3-фуран, 3JPC =
лоновой кислоты (5в). Выход 95%, светло-жел-
2.9 Гц), 150.86 д (С2-фуран, 4JPC = 2.1 Гц); минор-
тое сиропообразное вещество. Спектр ЯМР 1Н
ный конформер, 113.47 д (С3-фуран, 3JPC = 3.1 Гц),
(CDCl3), δ, м. д.: 1.23-1.29 м (12Н, СН3-фосфонат,
152.00 д (С2-фуран, 4JPC = 3.4 Гц). Спектр ЯМР 31Р
СН3-малонат), 1.36 т (3Н, СН3-фуроат, JHH = 7.2 Гц),
(CDCl3), δР, м. д.: 24.68 (1.0), 24.71 (0.5).
3.27 д (2Н, СН2СН, JHH = 7.6 Гц), 3.42 д (2Н, СН2Р,
3-[3-(Диэтоксифосфорилметил)-4-(эток-
JРH = 22.0 Гц), 3.75 т (1Н, СН, JHH = 7.6 Гц), 4.06 д.
сикарбонил)фур-2-ил]метилпентан-2,4-дион
к (4Н, СН2ОР, JHH = 7.2, JРH = 14.8 Гц), 4.20 к (4Н,
(6а). Выход 83%, желтое сиропообразное веще-
СН2О-малонат, JHH = 7.2 Гц), 4.34 к (2Н, СН2О-фу-
ство. Спектр ЯМР 1Н (CDCl3), δ, м. д.: общие
роат, JHH = 7.2 Гц), 6.34 с (1Н, Н3-фуран). Спектр
сигналы, 1.18-1.24 м (6Н, СН3-фосфонат), 1.25-
ЯМР 13С (CDCl3), δС, м. д.: 14.00 (СН3-малонат),
1.28 м (3Н, СН3-фуроат), 3.28 д (2Н, СН2Р, JРH =
14.04 (СН3-малонат), 14.36 (СН3-фуроат),
16.34
21.2 Гц), 3.95-4.01 м (4Н, СН2ОР), 4.14 т (1Н, СН,
д (СН3-фосфонат, 3JPC = 6.1 Гц), 23.88 д (СН2Р,
JHH = 7.2 Гц), 4.18-4.25 м (2Н, СН2О-фуроат); ос-
1JPC = 139.4 Гц), 27.42 (СН2СН), 50.45 (СН), 60.72
новной конформер, 2.14 с (3Н, СН3-ацетил), 3.15 д
(СН2О-фуроат),
61.48 (СН2О-малонат),
61.74
(2Н, СН2СН, JHH = 7.2 Гц), 7.79 с (1Н, Н5-фуран);
(СН2О-малонат), 62.14 д (СН2ОР, 2JPC = 6.4 Гц),
минорный конформер, 2.08 с (3Н, СН3-ацетил),
112.11 д (С3-фуран, 3JPC = 3.0 Гц), 126.28 д (С4-
3.14 д (СН2СН, JHH = 7.2 Гц), 7.80 с (1Н, Н5-фуран).
фуран, 2JPC = 9.4 Гц), 140.06 д (С5-фуран, 3JPC =
Спектр ЯМР 13С (CDCl3), δС, м. д.: общие сигна-
11.1 Гц), 155.08 д (С2-фуран, 4JPC = 2.1 Гц), 159.03 д
лы, 14.21 (СН3-фуроат), 60.19 (СН2О-фуроат); ос-
(С=О, 4JPC = 2.5 Гц), 166.62 (С=О-малонат), 168.08
(С=О-малонат). Спектр ЯМР
31Р (CDCl3): δР
новной конформер, 16.30 д (СН3-фосфонат, 3JPC =
25.01 м. д.
6.2 Гц), 20.97 д (СН2Р, 1JPC = 141.5 Гц), 24.64
д (СН2СН, 4JPC = 2.0 Гц), 61.94 д (СН2ОР, 2JPC =
Этиловый эфир
[4-(диэтоксифосфорилме-
6.4 Гц), 65.75 (СН), 111.16 д (С3-фуран, 2JPC =
тил)-5-(этоксикарбонил)фур-2-ил]метилциан-
10.9 Гц), 118.84 д (С4-фуран, 3JPC = 3.0 Гц), 146.87
уксусной кислоты (5г). Выход 91%, красное сиро-
(С5-фуран), 151.44 д (С2-фуран, 3JPC = 10.1 Гц),
пообразное вещество. Спектр ЯМР 1Н (CDCl3), δ,
163.04 (С=О-фуроат), 202.86 (С=О-кетон); минор-
м. д.: общие сигналы, 1.26-1.41 м (12Н, СН3-фос-
ный конформер, 16.32 д (СН3-фосфонат, 3JPC =
фонат, СН3-ацетат, СН3-фуроат), 3.46 д (2Н, СН2Р,
JРH = 22.0 Гц), 3.92 уш. д. д [1Н, СН, JHH(А) = 8.4,
5.8 Гц), 21.17 д (СН2Р, 1JPC = 142.1 Гц), 24.88
JHH(В) = 6.0 Гц], 4.04 д. к (4Н, СН2ОР, JHH = 7.0, JРH =
д (СН2СН, 4JPC = 1.9 Гц), 62.00 д (СН2ОР, 2JPC =
14.0 Гц), 4.29-4.41 м (4Н, СН2О-ацетат, СН2О-
5.7 Гц), 65.72 (СН), 109.40 д (С3-фуран, 2JPC =
фуроат); основной конформер, 3.24 уш. д. д (1Н,
10.6 Гц), 118.69 д (С4-фуран, 3JPC = 2.9 Гц), 146.69
СН2СН, НА, JАВ = 14.8, JHH(А) = 8.4 Гц), 3.40 уш. д.
(С5-фуран), 152.43 д (С2-фуран, 3JPC = 9.3 Гц),
д (1Н, СН2СН, НВ, JАВ = 14.8, JHH(В) = 6.0 Гц), 6.61
163.23 (С=О-фуроат), 191.69 (С=О-кетон). Спектр
с (1Н, Н3-фуран); минорный конформер, 3.28 д. д
ЯМР 31Р (CDCl3), δР, м. д.: 26.41 (1.0), 26.22 (0.5).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1254
ПЕВЗНЕР, ПОНЯЕВ
Этиловый эфир
2-[3-(диэтоксифосфорил-
Этиловый эфир
[3-(диэтоксифосфорилме-
метил)-4-(этоксикарбонил)фур-2-ил]метил-3-
тил)-4-(этоксикарбонил)фур-2-ил]метилциа-
оксобутановой кислоты (6б). Выход 91%, светло-
нуксусной кислоты (6г). Выход 72%, светло-крас-
коричневое сиропообразное вещество. Спектр
ное сиропообразное вещество. Спектр ЯМР 1Н
ЯМР 1Н (CDCl3), δ, м. д.: 1.19-1.24 м (9Н, СН3-фос-
(CDCl3), δ, м. д.: 1.20-1.27 м (6Н, СН3-фосфонат),
фонат, СН3-ацетоацетат), 1.28 т (3Н, СН3-фуроат,
1.29-1.34 м (6Н, СН3-ацетат, СН3-фуроат), 3.24 д.
JHH = 7.2 Гц), 2.21 с (3Н, СН3-ацетил), 3.16 д. д
д (1Н, СН2Р, НА, JАВ = 15.2, JРH = 21.2 Гц), 3.30 д. д
(1Н, СН2СН, JHH = 7.4, JРH = 2.4 Гц), 3.18 д. д (1Н,
(1Н, СН2Р, НВ, JАВ = 15.2, JРH = 21.2 Гц), 3.33-3.41
СН2СН, JHH = 7.2, JРH = 2.4 Гц), 3.28 д. д (1Н, СН2Р,
м (2Н, СН2СН), 4.03 д. к (4Н, СН2ОР, JНН = 7.2,
J
= 14.4 Гц), 4.13 д. д (1Н, СН, JНН = 6.4, JНН =
НА, JАВ = 15.0, JРH = 21.3 Гц), 3.40 д. д (1Н, СН2Р,
РH
8.4 Гц), 4.22-4.30 м (4Н, СН2О-ацетат, СН2О-фу-
НВ, JАВ = 15.0, JРH = 21.3 Гц), 3.94 т (СН, JHH =
роат), 7.91 с (1Н, Н5-фуран, минорный конфор-
7.4 Гц), 4.01 д. к (4Н, СН2ОР, JНН = 7.2, JРH =
мер), 7.92 с (1Н, Н5-фуран, основной конформер).
14.8 Гц), 4.16 к (2Н, СН2О-ацетоацетат, JНН =
Спектр ЯМР 13С (CDCl3), δС, м. д.: общие сигналы,
7.2 Гц), 4.23 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
14.25 (СН3-фуроат), 16.33 д (СН3-фосфонат, 3JPC =
7.80 с (1Н, Н5-фуран). Спектр ЯМР 13С (CDCl3),
6.0 Гц), 26.60 д (СН2СН, 4JPC = 1.9 Гц), 60.35
δС, м. д.: 13.96 (СН3-ацетоацетат), 14.23 (СН3-
(СН2О-ацетат, СН2О-фуроат), 62.08 д (СН2ОР, 2JPC =
фуроат), 16.31 д (СН3-фосфонат, 3JPC = 6.2 Гц),
6.6 Гц), 62.12 д (СН2ОР, 2JPC = 6.6 Гц), 62.27 д
21.02 д (СН2Р, 1JPC = 141.5 Гц), 24.50 д (СН2СН,
(СН2ОР, 2JPC = 6.6 Гц), 115.92 (СN); основной кон-
4JPC = 2.1 Гц), 57.41 д (СН, 5JPC = 3.0 Гц), 60.17
формер, 13.91 (СН3-ацетат), 20.94 д (СН2Р, 1JPC =
(СН2О-фуроат), 61.66 (СН2О-ацетоацетат), 61.89
141.2 Гц), 63.12 (СН), 113.01 д (С3-фуран, 2JPC =
д (СН2ОР, 2JPC = 6.4 Гц), 61.94 д (СН2ОР, 2JPC =
10.6 Гц), 118.85 д (С4-фуран, 3JPC = 3.2 Гц), 147.81
6.5 Гц), 111.26 д (С3-фуран, 2JPC = 10.9 Гц), 118.77 д
(С5-фуран), 149.02 д (С2-фуран, 3JPC = 9.0 Гц),
(С4-фуран, 3JPC = 2.9 Гц), 146.90 (С5-фуран), 151.50
162.94 (С=О-фуроат), 165.14 (С=О-ацетат); минор-
д (С2-фуран, 3JPC = 9.2 Гц), 163.15 (С=О-фуроат),
ный конформер, 13.96 (СН3-ацетат), 20.72 д (СН2Р,
168.62 (С=О-ацетоацетат),
201.65 (С=О-кетон).
1JPC = 140.3 Гц), 62.96 (СН), 114.26 д (С3-фуран,
Спектр ЯМР 31Р (CDCl3): δР 26.20 м. д.
2JPC = 10.8 Гц), 118.91 д (С4-фуран, 3JPC = 3.1 Гц),
Диэтиловый эфир
[3-(диэтоксифосфорил-
147.98 (С5-фуран), 148.20 д (С2-фуран, 3JPC =
метил)-4-(этоксикарбонил)фур-2-ил]метилма-
8.8 Гц), 162.89 (С=О-фуроат), 167.43 (С=О-аце-
лоновой кислоты (6в). Выход 82%, светло-жел-
тат). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 25.82 (1.0),
тое сиропообразное вещество. Спектр ЯМР 1Н
25.84 (0.3).
(CDCl3), δ, м. д.: 1.17-1.30 м (12Н, СН3-фосфонат,
3-[3-(Этоксикарбонил)-4-(диэтоксифос-
СН3-малонат, СН3-фуроат), 3.23 уш. д (2Н, СН2СН,
форилметил)-5-метилфур-2-ил]метилпен-
JHH = 7.2 Гц), 3.32 д (2Н, СН2Р, JРH = 21.6 Гц), 3.75
тан-2,4-дион (7а). Выход 79%, светло-желтое си-
уш. т (1Н, СН, JHH = 7.2 Гц), 4.00 д. к (4Н, СН2ОР,
ропообразное вещество. Спектр ЯМР 1Н (CDCl3),
JНН = 7.2, JРH = 14.4 Гц), 4.13-4.18 м (4Н, СН2О-
δ, м. д.: 1.20 т (3Н, СН3-фосфонат, JНН = 7.2 Гц),
малонат), 4.30 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
1.21 т (3Н, СН3-фосфонат, JНН = 7.2 Гц), 1.28-1.35
7.82 с (1Н, Н5-фуран). Спектр ЯМР 13С (CDCl3),
м (3Н, СН3-фуроат), 2.12 с (3Н, СН3-ацетил), 2.15
δС, м. д.:
13.95 (СН3-малонат),
14.00 (СН3-
с (3Н, СН3-ацетил), 2.17 д (3Н, СН3-фуран, JРH =
малонат), 14.23 (СН3-фуроат), 16.29 д (СН3-фосфо-
4.4 Гц), 3.10-3.21 м (2Н, СН2Р, JАВ = 8.8, JРH =
нат, 3JPC = 6.1 Гц), 20.99 д (СН2Р, 1JPC = 141.4 Гц),
21.2 Гц), 3.42 т (2Н, СН2СН, JНН = 7.2 Гц), 3.94-
25.42 д (СН2СН, 4JPC = 1.7 Гц), 50.35 д (СН, 5JPC =
4.02 м (4Н, СН2ОР), 4.06 т (1Н, СН, JНН = 7.2 Гц),
3.3 Гц), 60.15 (СН2О-фуроат), 61.42 (СН2О-мало-
4.23-4.30 м (2Н, СН2О-фуроат). Спектр ЯМР 13С
нат), 61.62 (СН2О-малонат), 61.90 д (СН2ОР, 2JPC =
(CDCl3), δС, м. д.: 11.59 д (СН3-фуран, 4JРС = 2.5
6.6 Гц), 111.51 д (С3-фуран, 2JPC = 11.0 Гц), 118.69 д
Гц), 11.66 д (СН3-фуран, 4JРС = 2.5 Гц), 14.18 (СН3-
(С4-фуран, 3JPC = 2.8 Гц), 147.05 (С5-фуран), 151.13
фуроат), 14.25 (СН3-фуроат), 16. 36 д (СН3-фос-
д (С2-фуран, 3JPC = 9.1 Гц), 163.16 (С=О-фуроат),
фонат, 3JPC = 6.1 Гц),
21.94 д (СН2Р, 1JPC =
166.57 (С=О-малонат),
168.40 (С=О-малонат).
141.9 Гц), 22.01 д (СН2Р, 1JPC = 142.2 Гц), 22.20
Спектр ЯМР 31Р (CDCl3): δР 26.19 м. д.
д (СН2Р, 1JPC = 142.2 Гц), 23.37 (СН2СН), 25.91
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1255
(СН2СН), 26.52 (СН2СН), 29.14 (СН3-ацетил), 29.64
д (2Н, СН2Р, JРH = 21.2 Гц), 3.49 д (2Н, СН2СН,
(СН3-ацетил), 29.73 (СН3-ацетил), 60.00 (СН2О-
J
= 8.0 Гц), 3.77 т (1Н, СН, JНН = 8.0 Гц), 3.99 д.
НН
фуроат), 60.22 (СН2О-фуроат), 60.26 (СН2О-фуро-
к (4Н, СН2ОР, JНН = 7.0, JРH = 14.0 Гц), 4.13-4.20
ат), 61.73 д (СН2ОР, 2JPC = 5.8 Гц), 61.78 д (СН2ОР,
м (4Н, СН2О-малонат), 4.26 к (2Н, СН2О-фуроат,
2JPC = 6.1 Гц), 66.12 (СН), 109.46 д (С4-фуран, 2JPC =
JНН = 7.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
11.2 Гц), 109.64 д (С4-фуран, 2JPC = 11.1 Гц), 109.93
11.62 д (СН3-фуран, 4JРС = 2.3 Гц), 14.00 (СН3-ма-
д (С4-фуран, 2JPC = 11.1 Гц), 113.30 д (С3-фу-
лонат), 14.16 (СН3-фуроат), 16.35 д (СН3-фосфо-
ран, 3JPC = 2.1 Гц), 114.38 д (С3-фуран, 3JPC =
нат, 3JPC = 6.2 Гц), 21.86 д (СН2Р, 1JPC = 142.1 Гц),
2.1 Гц), 148.63 д (С5-фуран, 3JPC = 10.0 Гц), 149.20 д
27.34 (СН2СН), 50.36 (СН), 60.27 (СН2О-фуроат),
(С5-фуран, 3JPC = 9.9 Гц), 149.29 д (С5-фуран, 3JPC =
61.44 (СН2О-малонат),
61.53 (СН2О-малонат),
9.6 Гц), 156.36 (С2-фуран), 157.78 (С2-фуран),
61.79 д (СН2ОР, 2JPC = 6.6 Гц), 109.90 д (С4-фу-
159.15 (С2-фуран), 163.81 (С=О-фуроат), 164.08
ран, 2JPC = 10.0 Гц), 114.35 д (С3-фуран, 3JPC = 2.6
(С=О-фуроат),
164.16 (С=О-фуроат),
192.01
Гц), 149.25 д (С5-фуран, 3JPC = 9.6 Гц), 156.14 (С2-
(С=О-кетон), 202.90 (С=О-кетон), 206.90 (С=О-ке-
фуран), 163.82 (С=О-фуроат), 166.58 (С=О-ма-
тон). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 26.19 уш. с
лонат), 168.40 (С=О-малонат). Спектр ЯМР 31Р
(0.3), 26.61 уш. с (0.7), 26.78 (1.0).
(CDCl3): δР 26.72 м. д.
Этиловый эфир
2-[3-(этоксикарбонил)-4-
Этиловый эфир
[3-(этоксикарбонил)-4-
(диэтоксифосфорилметил)-5-метилфур-2-ил]-
(диэтоксифосфорилметил)-5-метилфур-2-ил]-
метил-3-оксобутановой кислоты
(7б). Выход
метилциануксусной кислоты (7г). Выход 85%,
81%, светло-коричневое сиропообразное веще-
красное сиропообразное вещество. Спектр ЯМР
ство. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.18 т (9Н,
1Н (CDCl3), δ, м. д.: 1.20-1.25 м (6Н, СН3-фосфо-
СН3-фосфонат, СН3-ацетоацетат, JНН = 7.2 Гц),
нат), 1.29 т (3Н, СН3-ацетат, JНН = 7.2 Гц), 1.35 т
1.29 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.15 д (3Н,
(3Н, СН3-фуроат, JНН = 7.2 Гц), 2.24 д (3Н, СН3-фу-
СН3-фуран, JРH = 4.4 Гц), 2.19 с (3Н, СН3-ацетил),
ран, JРH = 4.4 Гц, основной конформер), 2.30 д
3.15 д (2Н, СН2Р, JРH = 21.2 Гц), 3.37 д. д (1Н,
(3Н, СН3-фуран, JРH = 4.4 Гц, минорный конфор-
СН2СН, НА, JАВ = 15.6, JНН(А) = 8.0 Гц), 3.40 д. д
мер), 3.21 д (2Н, СН2Р, JРH = 21.2 Гц), 3.52 д. д (1Н,
(1Н, СН2СН, НВ, JАВ = 15.6, JНН(В) = 7.2 Гц), 3.86 д.
СН2СН, НА, JАВ = 15.0, JНН(А) = 8.8 Гц), 3.58 д. д
д (1Н, СН, JНН(А) = 8.0, JНН(В) = 7.2 Гц), 3.92-3.99 м
(1Н, СН2СН, НВ, JАВ = 15.0, JНН(В) = 6.6 Гц), 3.96
(4Н, СН2ОР), 4.11 к (2Н, СН2О-ацетоацетат, JНН =
д. д (1Н, СН, JНН(А) = 8.8, JНН(В) = 6.6 Гц), 4.19-4.32
7.2 Гц), 4.22 к (2Н, СН2О-фуроат, JНН = 7.2 Гц).
м (9Н, СН2О-фосфонат, СН2О-ацетат, СН2О-фуро-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 11.56 д
ат, СН). Спектр ЯМР 13С (CDCl3), δС, м. д.: общие
(СН3-фуран, 4JРС = 2.5 Гц), 13.94 (СН3-ацетоаце-
сигналы, 11.70 д (СН3-фуран, 4JРС = 2.3 Гц), 16.38
тат), 14.15 (СН3-фуроат), 16.32 д (СН3-фосфонат,
д (СН3-фосфонат, 3JPC = 6.1 Гц), 60.43 (СН2О-фу-
3JPC = 6.2 Гц), 21.91 д (СН2Р, 1JPC = 142.0 Гц), 26.54
роат), 60.51 (СН2О-ацетат), 61.82 д (СН2ОР, 2JPC =
(СН2-СН), 29.04 (СН3-ацетил), 57.48 (СН), 60.15
6.6 Гц), 61.90 д (СН2ОР, 2JPC = 7.4 Гц), 61.97 д
(СН2О-фуроат), 61.53 (СН2О-ацетоацетат), 61.73
(СН2ОР, 2JPC = 7.1 Гц); основной конформер, 13.91
д (СН2ОР, 2JPC = 6.5 Гц), 61.77 д (СН2ОР, 2JPC =
(СН3-ацетат), 14.15(СН3-фуроат), 22.02 д (СН2Р,
6.2 Гц), 109.86 д (С4-фуран, 2JPC = 11.1 Гц), 114.23 д
1JPC = 142.3 Гц), 28.38 (СН2СН), 63.06 (СН), 110.26
(С3-фуран, 3JPC = 2.1 Гц), 149.12 д (С5-фуран, 3JPC =
д (С4-фуран, 2JPC = 10.9 Гц), 115.57 (СN), 115.74 д
9.7 Гц), 156.47 (С2-фуран), 163.81 (С=О-фуроат),
(С3-фуран, 3JPC = 2.6 Гц), 150.33 д (С5-фуран, 3JPC =
168.65 (С=О-ацетоацетат), 201.57 (С=О-ацетил).
9.6 Гц), 153.40 (С2-фуран), 163.54 (С=О-фуроат),
Спектр ЯМР 31Р (CDCl3): δР 26.66 м. д.
165.03 (С=О-ацетат); минорный конформер, 13.86
Диэтиловый эфир
[3-(этоксикарбонил)-4-
(СН3-ацетат), 14.05(СН3-фуроат), 21.96 д (СН2Р,
(диэтоксифосфорилметил)-5-метилфур-2-ил]-
1JPC = 141.9 Гц), 29.65 (СН2СН), 62.94 (СН), 110.30 д
метилмалоновой кислоты (7в). Выход 83%, свет-
(С4-фуран, 2JPC = 11.1 Гц), 116.73 д (С3-фуран, 3JPC =
ло-желтое сиропообразное вещество. Спектр ЯМР
2.6 Гц), 116.90 (СN), 150.51 д (С5-фуран, 3JPC =
1Н (CDCl3), δ, м. д.: 1.20-1.27 м (12Н, СН3-фосфо-
9.6 Гц), 152.13 (С2-фуран), 163.43 (С=О-фуроат),
нат, СН3-малонат), 1.33 т (3Н, СН3-фуроат, JНН =
167.44 (С=О-ацетат). Спектр ЯМР 31Р (CDCl3),
7.2 Гц), 2.20 д (3Н, СН3-фуран, JРH = 4.0 Гц), 3.20
δР, м. д.: 26.40 (1), 26.43 (0.5).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1256
ПЕВЗНЕР, ПОНЯЕВ
3-[3-(Этоксикарбонил)-5-(диэтоксифосфо-
пообразное вещество. Спектр ЯМР 1Н (CDCl3), δ,
рилметил)фур-2-ил]метилпентан-2,4-дион (8а).
м. д.: 1.19-1.33 м (15Н, СН3-фосфонат, СН3-мало-
Выход 80%, светло-коричневое сиропообразное
нат, СН3-фуроат), 3.13 д (2Н, СН2Р, JРH = 20.8 Гц),
вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.23-
3.54 д (2Н, СН2СН, JНН = 7.2 Гц), 3.82 т (1Н, СН,
1.33 м (9Н, СН3-фосфонат, СН3-фуроат), 2.17 с
J
= 7.2 Гц), 4.07 д. к (4Н, СН2ОР, JНН = 7.2, JРH =
НН
(6Н, СН3-ацетил), 3.12 д (2Н, СН2Р, JРH = 20.8 Гц),
15.2 Гц), 4.18 к (4Н, СН2О-малонат, JНН = 7.2 Гц),
3.49 д (2Н, СН2СН, JНН = 7.2 Гц), 4.02-4.07 м (4Н,
4.25 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.50 д (1Н,
СН2ОР), 4.08 т (1Н, СН, JНН = 7.2 Гц), 4.26 к (2Н,
Н4-фуран, JНН = 3.6 Гц). Спектр ЯМР 13С (CDCl3),
СН2О-фуроат, JНН = 7.0 Гц), 6.47 д (1Н, Н4-фуран,
δС, м. д.: 13.91 (СН3-малонат), 14.02 (СН3-мало-
JНН = 4.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
нат), 14.23 (СН3-фуроат), 16.36 д (СН3-фосфонат,
14.31 (СН3-фуроат), 16.34 д (СН3-фосфонат, 3JPC =
3JPC = 5.8 Гц), 25.41 д (СН2Р, 1JPC = 143.1 Гц), 26.94
5.3 Гц), 23.42 (СН2СН), 26.52 д (СН2Р, 1JPC =
(СН2СН), 50.20 уш. с (СН), 60.35 (СН2О-фуроат),
142.6 Гц),
29.66 (СН3-ацетил),
60.35 (СН2О-
61.45 (СН2О-малонат),
61.58 (СН2О-малонат),
фуроат), 62.35 д (СН2ОР, 2JPC = 7.9 Гц), 66.07
62.42 д (СН2ОР, 2JPC = 6.5 Гц), 109.24 д (С4-фуран,
(СН), 108.97 д (С4-фуран, 3JPC = 7.6 Гц), 114.43 д
3JPC = 7.0 Гц), 115.88 д (С3-фуран, 4JPC = 2.7 Гц),
(С3-фуран, 4JPC = 2.7 Гц), 144.77 д (С5-фуран, 2JPC =
144.75 д (С5-фуран, 2JPC = 8.7 Гц), 157.26 д (С2-фу-
10.0 Гц), 159.08 д (С2-фуран, 4JPC = 2.5 Гц), 163.60
ран, 4JPC = 2.6 Гц), 163.27 (С=О-фуроат), 166.60
(С=О-фуроат), 202.43 (С=О-ацетил). Спектр ЯМР
(С=О-малонат),
168.27 (С=О-малонат). Спектр
31Р (CDCl3): δР 22.24 м. д.
ЯМР 31Р (CDCl3): δР 22.21 м. д.
Этиловый эфир
2-[3-(этоксикарбонил)-5-
Этиловый эфир [3-(этоксикарбонил)-5-(ди-
(диэтоксифосфорилметил)фур-2-ил]метил-
этоксифосфорилметил)фур-2-ил]метилциан-
3-оксобутановой кислоты
(8б). Выход
90%,
уксусной кислоты (8г). Выход 74%, красное си-
светло-коричневое сиропообразное вещество.
ропообразное вещество. Спектр ЯМР 1Н (CDCl3),
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.20-1.32 м (12Н,
δ, м. д.: 1.24-1.35 м (12Н, СН3-фосфонат, СН3-
СН3-фосфонат, СН3-ацетоацетат, СН3-фуроат),
ацетат, СН3-фуроат), 3.16 д (1Н, СН2Р, JРH =
2.25 с (3Н, СН3-ацетил), 3.12 д (2Н, СН2Р, JРH =
20.8 Гц), 3.18 д (1Н, СН2Р, JРH = 21.2 Гц), 3.65-
20.8 Гц), 3.46 д. д [1Н, СН2СН, НА, JАВ = 15.6,
3.79 м (2Н, СН2СН), 4.08 д. к (4Н, СН2ОР, JНН =
JНН(А) = 7.6 Гц], 3.52 д. д [1Н, СН2СН, НВ, JАВ =
7.2, JРH = 15.2 Гц), 4.23-4.28 м (5Н, СН2О-ацетат,
15.6, JНН(В) = 7.6 Гц], 3.95 т [1Н, СН, JНН(А) =
СН2О-фуроат, СН), 6.56 д (1Н, Н4-фуран, JНН =
JНН(В) = 7.6 Гц], 4.07 д. к (4Н, СН2ОР, JНН = 7.2, JРH =
3.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: общие
15.2 Гц), 4.15 к (1Н, СН2О-ацетоацетат, JНН =
сигналы, 16.37 д (СН3-фосфонат, 3JPC = 5.7 Гц),
7.2 Гц), 4.17 к (1Н, СН2О-ацетоацетат, JНН = 7.2 Гц),
23.39 (СН2СН),
24.47(СН2СН),
60.59 (СН2О-
4.24 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.48 д (1Н,
фуроат), 60.68 (СН2О-ацетат), 62.50 д (СН2ОР, 2JPC =
Н4-фуран, JНН = 4.0 Гц). Спектр ЯМР 13С (CDCl3),
6.5 Гц), 115.50 (СN); основной конформер, 13.96
δС, м. д.: 13.98 (СН3-ацетоацетат), 14.06 (СН3-
(СН3-ацетат), 14.17 (СН3-фуроат), 26.43 д (СН2Р,
ацетоацетат),
14.25 (СН3-фуроат),
16.42 д
1JPC = 143.3 Гц), 62.96 (СН), 109.34 д (С4-фуран,
(СН3-фосфонат, 3JPC = 5.8 Гц), 23.38 (СН2СН),
3JPC = 5.4 Гц), 118.24 д (С3-фуран, 4JPC = 2.3 Гц),
26.41 д (СН2Р, 1JPC = 143.2 Гц), 29.17 (СН3-ацетил),
146.21 д (С5-фуран, 2JPC = 8.3 Гц), 153.24 д (С2-фу-
57.34 (СН), 60.36 (СН2О-фуроат), 61.34 (СН2О-
ран, 4JPC = 2.6 Гц), 162.91 (С=О-фуроат), 164.89
ацетоацетат), 61.63 (СН2О-ацетоацетат), 62.42 д
(С=О-ацетат); минорный конформер, 13.93 (СН3-а-
(СН2ОР, 2JPC = 6.9 Гц), 109.24 д (С4-фуран, 3JPC =
цетат), 14.22 (СН3-фуроат), 26.48 д (СН2Р, 1JPC =
7.3 Гц), 115.66 д (С3-фуран, 4JPC = 2.6 Гц), 144.68 д
142.7 Гц), 63.15 (СН), 108.90 д (С4-фуран, 3JPC =
(С5-фуран, 2JPC = 9.0 Гц), 157.72 д (С2-фуран, 4JPC =
7.2 Гц), 118.36 д (С3-фуран, 4JPC = 2.6 Гц), 145.94
2.5 Гц), 163.33 (С=О-фуроат), 168.52 (С=О-аце-
д (С5-фуран, 2JPC = 8.6 Гц), 154.56 д (С2-фуран,
тоацетат), 201.62 (С=О-ацетил). Спектр ЯМР 31Р
4JPC = 2.8 Гц), 163.10 (С=О-фуроат), 166.98 (С=О-а-
(CDCl3): δР 22.21 м. д.
цетат). Спектр ЯМР 31Р (CDCl3): δР 21.90 м. д.
Диэтиловый эфир
[3-(этоксикарбонил)-5-
3-[3-(Диэтоксифосфорилметил)-5-(этокси-
(диэтоксифосфорилметил)фур-2-ил]метилма-
карбонил)фур-2-ил]метилпентан-2,4-дион (9а).
лоновой кислоты (8в). Выход 93%, желтое сиро-
Выход 76%, светло-желтое сиропообразное веще-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1257
ство. Спектр ЯМР 1Н (CDCl3), δ, м. д.: общие сиг-
168.28 (С=О-ацетоацетат), 201.51 (С=О-ацетил).
налы, 1.24 т (6Н, СН3-фосфонат, JНН = 7.2 Гц), 1.29
Спектр ЯМР 31Р (CDCl3): δР 25.66 м. д. Масс-
т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.19 с (6Н, СН3-а-
спектр (ESI), m/z: 455.1438 [M + Na]+ (вычислено
цетил), 2.84 д (2Н, СН2Р, JРH = 20.8 Гц, основ-
для С19Н29NaО9Р: 455.1441).
ной конформер), 2.88 д (2Н, СН2Р, JРH = 20.8 Гц,
Диэтиловый эфир [3-(диэтоксифосфорилме-
минорный конформер), 3.12 д. д (2Н, СН2СН, JНН =
тил)-5-(этоксикарбонил)фур-2-ил]метилмало-
7.2, JРН = 2.0 Гц), 4.03 д. к (4Н, СН2ОР, JНН = 7.2,
новой кислоты (9в). Выход 55%, желтое сиропо-
JРH = 15.2 Гц), 4.24 т (1Н, СН, JНН = 7.2 Гц), 4.25 к
образное вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
(2Н, СН2О-фуроат, JНН = 7.2 Гц), 7.04 с (1Н, Н4-фу-
1.22-1.35 м (15Н, СН3-фосфонат, СН3-малонат,
ран, основной конформер), 7.07 с (1Н, Н4-фуран,
СН3-фуроат), 2.95 д (2Н, СН2Р, JРH = 20.4 Гц), 3.26
минорный конформер). Спектр ЯМР 13С (CDCl3),
д. д (2Н, СН2СН, JНН = 7.6, JРН = 2.0 Гц), 3.84 т
δС, м. д.: общие сигналы, 14.25 (СН3-фуроат), 16.38
(1Н, СН, JНН = 7.6 Гц), 4.06 д. к (4Н, СН2ОР, JНН =
д (СН3-фосфонат, 3JPC = 5.9 Гц), 22.80 д (СН2Р,
7.2, JРH =15.2 Гц), 4.19 к (4Н, СН2О-малонат, JНН =
1JPC = 143.0 Гц), 24.61 д (СН2СН, 4JРС = 1.1 Гц),
7.2 Гц), 4.30 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
29.84 (СН3-ацетил), 60.84 (СН2О-фуроат), 62.23 д
7.10 с (1Н, Н4-фуран). Спектр ЯМР 13С (CDCl3), δС,
(СН2ОР, 2JPC = 6.7 Гц), 65.10 (СН), 202.43 (С=О-
м. д.: 13.97 (СН3-малонат), 14.04 (СН3-малонат),
ацетил); основной конформер, 113.76 д (С3-фуран,
14.30 (СН3-фуроат), 16.41 д (СН3-фосфонат, 3JPC =
2JPC = 9.2 Гц), 120.32 д (С4-фуран, 3JPC = 3.0 Гц),
5.8 Гц), 22.91 д (СН2Р, 1JPC = 143.0 Гц), 25.46 д
143.07 д (С5-фуран, 4JPC = 1.0 Гц), 153.50 д (С2-фу-
(СН2СН, 4JРС = 1.1 Гц), 50.30 д (СН, 5JРС = 2.3 Гц),
ран, 3JPC = 10.8 Гц), 158.42 (С=О-фуроат); минор-
60.83 (СН2О-фуроат), 61.48 (СН2О-малонат), 61.80
ный конформер, 112.11 д (С3-фуран, 2JPC = 9.1 Гц),
(СН2О-малонат), 62.21 д (СН2ОР, 2JPC = 6.8 Гц),
121.39 д (С4-фуран, 3JPC = 3.0 Гц), 142.94 (С5-
114.18 д (С3-фуран, 2JPC = 9.2 Гц), 120.26 д (С4-фу-
фуран), 154.55 д (С2-фуран, 3JPC = 10.8 Гц), 158.40
ран, 3JPC = 2.9 Гц), 143.32 д (С5-фуран, 4JPC = 1.0 Гц),
(С=О-фуроат). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
153.23 д (С2-фуран, 3JPC = 10.8 Гц), 158.51 (С=О-
25.42 (0.3), 25.58 (1.0).
фуроат), 166.62 (С=О-малонат), 168.28 (С=О-мало-
Этиловый эфир 2-[3-(диэтоксифосфорилме-
нат). Спектр ЯМР 31Р (CDCl3): δР 25.61 м. д. Масс-
тил)-5-(этоксикарбонил)фур-2-ил]метил-3-ок-
спектр (ESI), m/z: 485.1552 [M + Na]+ (вычислено
собутановой кислоты (9б). Выход 77%, свет-
для С20Н31NaО10Р: 485.1547).
ло-желтое сиропообразное вещество. Спектр ЯМР
Этиловый эфир
[3-(диэтоксифосфорилме-
1Н (CDCl3), δ, м. д.: 1.20-1.33 м (12Н, СН3-фосфо-
тил)-5-(этоксикарбонил)фур-2-ил]метилциа-
нат, СН3-ацетоацетат, СН3-фуроат), 2.23 с (1.5Н,
нуксусной кислоты (9г). Выход 50%, красное си-
СН3-ацетил), 2.26 с (1.5Н, СН3-ацетил), 2.92 д (2Н,
ропообразное вещество. Спектр ЯМР 1Н (CDCl3),
СН2Р, JРH = 20.4 Гц), 3.13 д. д. д [1Н, СН2СН, НА,
δ, м. д.: 1.25-1.37 м (12Н, СН3-фосфонат, СН3-аце-
JАВ = 15.6, JНН(А) = 7.2, JРH = 2.0 Гц], 3.19 д. д. д [1Н,
тат, СН3-фуроат), 2.97 д (1Н, СН2Р, JРH = 21.2 Гц),
СН2СН, НВ, JАВ = 15.6, JНН(В) = 7.6, JРH = 2.0 Гц],
3.02 д (1Н, СН2Р, JРH = 22.0 Гц), 3.30-3.44 м (2Н,
3.99-4.10 м (5Н, СН2О-фосфонат, СН), 4.16 к
СН2СН), 4.03-4.11 м (5Н, СН2ОР, СН), 4.26-4.31
(2Н, СН2О-ацетоацетат, JНН = 7.2 Гц), 4.27 к (2Н,
СН2О-фуроат, JНН = 7.2 Гц), 7.10 с (1Н, Н4-фуран).
м (4Н, СН2О-ацетат, СН2О-фуроат), 7.12 с (0.5Н,
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.97 (СН3-аце-
Н4-фуран), 7.15 с (0.5Н, Н4-фуран). Спектр ЯМР 13С
тоацетат), 14.04 (СН3-ацетоацетат), 14.20 (СН3-фу-
(CDCl3), δС, м. д.: 13.92 (СН3-ацетат), 14.20 (СН3-а-
роат), 16.40 д (СН3-фосфонат, 3JPC = 5.9 Гц), 22.84
цетат), 14.35 (СН3-фуроат), 16.44 д (СН3-фосфонат,
д (СН2Р, 1JPC = 143.0 Гц), 24.41 д (СН2СН, 4JРС =
3JPC = 5.8 Гц), 23.11 д (СН2Р, 1JPC = 143.1 Гц), 23.25
1.1 Гц), 29.78 (СН3-ацетил), 30.90 (СН3-ацетил),
д (СН2Р, 1JPC = 143.5 Гц), 26.72 д (СН2СН, 4JРС =
57.06 д (СН, 5JРС = 1.9 Гц), 60.80 (СН2О-фуроат),
1.1 Гц), 60.77 (СН2О-фуроат), 61.07 (СН2О-ацетат),
61.32 (СН2О-ацетоацетат),
61.84 (СН2О-ацето-
62.19 д (СН2ОР, 2JPC = 6.7 Гц), 62.35 д (СН2ОР, 2JPC =
ацетат), 62.16 д (СН2ОР, 2JPC = 6.8 Гц), 113.90 д
7.1 Гц), 63.34 (СН), 63.92 (СН), 115.55 д (С3-фуран,
(С3-фуран, 2JPC = 9.4 Гц), 120.31 д (С4-фуран, 3JPC =
2JPC = 9.2 Гц), 115.59 (СN), 116.68 д (С3-фуран, 2JPC =
2.9 Гц), 143.09 д (С5-фуран, 4JPC = 0.8 Гц), 153.65
9.2 Гц), 120.27 (СN), 120.29 д (С4-фуран, 3JPC =
д (С2-фуран, 3JPC = 10.9 Гц), 158.49 (С=О-фуроат),
3.3 Гц), 120.48 д (С4-фуран, 3JPC = 2.8 Гц), 143.98 д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1258
ПЕВЗНЕР, ПОНЯЕВ
(С5-фуран, 4JPC = 0.9 Гц), 144.22 д (С5-фуран, 4JPC =
д. к (4Н, СН2ОР, JНН = 7.2, JРH = 14.8 Гц), 4.25 к
1.1 Гц), 149.57 д (С2-фуран, 3JPC = 10.6 Гц), 150.58
(2Н, СН2О-фуроат, JНН = 7.0 Гц), 6.12 с (1Н, Н4-фу-
д (С2-фуран, 3JPC = 10.2 Гц), 158.12 (С=О-фуроат),
ран), 8.30 уш. с (1Н, NH). Спектр ЯМР 13С (CDCl3),
158.30 (С=О-фуроат), 164.35 (С=О-ацетат), 166.83
δС, м. д.: 10.77 (СН3-пиразол), 14.30 (СН3-фу-
(С=О-ацетат). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
роат),
16.28 д (СН3-фосфонат, 3JPC = 6.1 Гц),
24.99, 25.73. Соотношение конформеров 1:1.
23.42 (СН2-пиразол), 26.37 д (СН2Р, 1JPC = 139.2
Гц), 60.30 (СН2О-фуроат), 62.35 д (СН2ОР, 2JPC =
3-Бром-3-[3-(этоксикарбонил)-5-метил-
6.5 Гц), 106.27 д (С4-фуран, 4JPC = 2.2 Гц), 110.45
фур-2-ил]метилпентан-2,4-дион (3). К раство-
(С4-пиразол), 115.92 д (С3-фуран, 3JPC = 10.4 Гц),
ру 2.8 г (10.5 ммоль) соединения 2 в 30 мл че-
142.64 уш. с (С3,5-пиразол), 151.06 д (С2-фуран,
тыреххлористого углерода прибавляли
2.10 г
2JPC = 13.8 Гц), 154.06 д (С5-фуран, 4JPC = 2.6 Гц),
(11.8 ммоль) N-бромсукцинимида и 0.3 г AIBN. По-
163.59 д (С=О-фуроат, 4JPC = 2.4 Гц). Спектр ЯМР
лученную смесь кипятили при перемешивании 6 ч,
31Р (CDCl3): δР 21.84 м. д.
затем отфильтровывали сукцинимид и упаривали
Этиловый эфир
3-(диэтоксифосфорилме-
фильтрат. Остаток экстрагировали горячим гекса-
тил)-5-(3,5-диметилпиразол-4-ил)метилфу-
ном. Полученный экстракт упаривали, остаток вы-
ран-2-карбоновой кислоты (5д). Выход 72%,
держивали в вакууме (1 мм рт. ст.) при комнатной
светло-желтое стекловидное вещество. Спектр
температуре 1 ч. Выход 2.57 г (71%), красное сиро-
ЯМР 1Н (CDCl3), δ, м. д.: 1.21 т (6Н, СН3-фосфо-
пообразное вещество. Спектр ЯМР 1Н (CDCl3), δ,
нат, JНН = 7.2 Гц), 1.34 т (3Н, СН3-фуроат, JНН =
м. д.: 1.31 т (3Н, СН3-фуроат, JНН = 7.2 Гц), 2.21 уш.
7.2 Гц), 1.96 с (6Н, СН3-пиразол), 3.38 д (2Н, СН2Р,
с (3Н, СН3-фуран), 2.39 с (6Н, СН3-ацетил), 3.98
J
= 22.0 Гц), 3.69 с (2Н, СН2-пиразол), 4.02 д. к
с (2Н, СН2СВr), 4.25 к (2Н, СН2О-фуроат, JНН =
РH
(4Н, СН2ОР, JНН = 7.2, JРH = 14.8 Гц), 4.31 к (2Н,
7.2 Гц), 6.25 уш. с (1Н, Н4-фуран). Спектр ЯМР
СН2О-фуроат, JНН = 7.2 Гц), 6.05 с (1Н, Н4-фуран),
13С (CDCl3), δС, м. д.: 13.23 (СН3-фуран), 14.24
9.06 уш. с (1Н, NH). Спектр ЯМР 13С (CDCl3), δС,
(СН3-фуроат), 27.05 (СН3-ацетил), 34.26 (СН2СВr),
м. д.: 10.72 (СН3-пиразол), 14.35 (СН3-фуроат),
60.36 (СН2О-фуроат), 72.30 (СВr), 106.67 (С4-фу-
16.28 д (СН3-фосфонат, 3JPC = 6.1 Гц),
23.36
ран), 117.35 (С3-фуран), 151.60 (С5-фуран), 153.24
(СН2-пиразол), 23.88 д (СН2Р, 1JPC = 139.6 Гц),
(С2-фуран), 163.50 (С=О-фуроат), 199.48 (С=О-а-
60.63 (СН2О-фуроат), 62.12 д (СН2ОР, 2JPC = 6.5 Гц),
цетил).
109.92 (С4-пиразол), 110.84 д (С4-фуран, 3JPC =
Общая методика синтеза пиразолов 4д-9д и
2.9 Гц), 126.36 д (С3-фуран, 2JPC = 9.6 Гц), 139.55
пиразолонов 5е-9е. К раствору 5 ммоль 1,3-ди-
д (С2-фуран, 3JPC = 11.0 Гц), 142.57 уш. с (С3,5-пи-
карбонильного соединения 4а-9а или 5б-9б в
разол), 158.21 д (С5-фуран, 4JPC = 1.7 Гц), 159.23
15 мл этанола прибавляли 5.5 ммоль гидразинги-
д (С=О-фуроат, 4JPC = 2.3 Гц). Спектр ЯМР 31Р
драта. Полученную смесь перемешивали 15 мин
(CDCl3): δР 25.13 м. д.
и оставляли на 12 ч при комнатной температуре.
Этиловый эфир
3-(диэтоксифосфорилме-
После этого отгоняли этанол, остаток растворяли
тил)-5-(3-метил-5-гидроксипиразол-4-ил)ме-
в 30 мл хлористого метилена, промывали 10 мл
тилфуран-2-карбоновой кислоты (5е). Выход
раствора NaCl, сушили сульфатом натрия, затем
84%, светло-желтое стекловидное вещество.
фильтровали через тонкий слой силикагеля и упа-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.21 т (6Н,
ривали досуха. Остаток выдерживали в вакууме
СН3-фосфонат, JНН = 7.2 Гц), 1.34 т (3Н, СН3-фу-
(1 мм рт. ст.) при комнатной температуре.
роат, JНН = 7.2 Гц), 2.01 с (3Н, СН3-пиразол), 3.38
Этиловый эфир
2-(диэтоксифосфорилме-
д (2Н, СН2Р, JРH = 22.0 Гц), 3.62 с (2Н, СН2-пира-
тил)-5-(3,5-диметилпиразол-4-ил)метилфу-
зол), 4.02 д. к (4Н, СН2ОР, JНН = 7.2, JРH = 14.8 Гц),
ран-3-карбоновой кислоты (4д). Выход 73%,
4.31 к (2Н, СН2О-фуроат, JНН = 7.2 Гц), 6.14 с (1Н,
светло-желтое стекловидное вещество. Спектр
Н4-фуран), 10.09 уш. с (2Н, NH, ОН). Спектр ЯМР
ЯМР 1Н (CDCl3), δ, м. д.: 1.25 т (6Н, СН3-фосфо-
13С (CDCl3), δС, м. д.: 10.10 (СН3-пиразол), 14.34
нат, JНН = 7.2 Гц), 1.31 т (3Н, СН3-фуроат, JНН =
(СН3-фуроат), 16.25 д (СН3-фосфонат, 3JPC = 6.1 Гц),
7.0 Гц), 2.20 с (6Н, СН3-пиразол), 3.65 уш. с (2Н,
23.37 (СН2-пиразол), 23.73 д (СН2Р, 1JPC = 139.2 Гц),
СН2-пиразол), 3.67 д (2Н, СН2Р, JРH = 20.8 Гц), 4.06
60.56 (СН2О-фуроат), 62.34 д (СН2ОР, 2JPC = 6.5 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1259
111.17 д (С4-фуран, 3JPC = 2.7 Гц), 121.42 (С4-пи-
Этиловый эфир2-(3,5-диметилпиразол-4-ил)-
разол), 126.35 д (С3-фуран, 2JPC = 9.5 Гц), 139.22
метил-4-(диэтоксифосфорилметил)-5-метил-
д (С2-фуран, 3JPC = 10.6 Гц), 139.90 уш. с (С3-пи-
фуран-3-карбоновой кислоты (7д). Выход 72%,
разол), 158.50 д (С5-фуран, 4JPC = 2.0 Гц), 159.26 д
светло-желтое стекловидное вещество. Спектр
(С=О-фуроат, 4JPC = 2.5 Гц), 161.57 уш. с (С5-пира-
ЯМР 1Н (CDCl3), δ, м. д.: 1.22 т (6Н, СН3-фосфо-
зол). Спектр ЯМР 31Р (CDCl3): δР 25.30 м. д.
нат, JНН = 7.2 Гц), 1.36 т (3Н, СН3-фуроат, JНН =
7.2 Гц), 2.16 д (3Н, СН3-фуран, JРН = 4.4 Гц),
Этиловый эфир
4-(диэтоксифосфорилме-
2.19 с (6Н, СН3-пиразол), 3.21 д (2Н, СН2Р, JРH =
тил)-5-(3,5-диметилпиразол-4-ил)метилфу-
20.8 Гц), 4.00 д. к (4Н, СН2ОР, JНН = 7.2, JРH =
ран-3-карбоновой кислоты (6д). Выход 73%,
14.4 Гц), 4.01 с (2Н, СН2-пиразол), 4.30 к (2Н,
светло-коричневое
стекловидное
вещество.
СН2О-фуроат, JНН = 7.2 Гц), 9.42 уш. с (1Н, NH).
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.24 т (6Н,
Спектр ЯМР 13С (CDCl3), δС, м. д.: 10.86 (СН3-пи-
СН3-фосфонат, JНН = 7.0 Гц), 1.31 т (3Н, СН3-фу-
разол), 11.63 д (СН3-фуран, 4JРС = 2.3 Гц), 14.30
роат, JНН = 7.0 Гц), 2.15 с (6Н, СН3-пиразол), 3.30 д
(СН3-фуроат), 16.35 д (СН3-фосфонат, 3JPC = 6.1 Гц),
(2Н, СН2Р, JРH = 21.2 Гц), 3.75 уш. с (2Н, СН2-пира-
21.74 (СН2-пиразол), 22.17 д (СН2Р, 1JPC = 142.2 Гц),
зол), 4.04 д. к (4Н, СН2ОР, JНН = 7.0, JРH = 14.4 Гц),
60.08 (СН2О-фуроат), 61.77 д (СН2ОР, 2JPC = 6.7 Гц),
4.26 к (2Н, СН2О-фуроат, JНН = 7.0 Гц), 7.81 с
(1Н, Н2-фуран), 9.33 уш. с (1Н, NH). Спектр ЯМР
109.20 д (С4-фуран, 2JPC = 11.2 Гц), 111.07 (С4-пи-
разол), 112.75 д (С3-фуран, 3JPC = 2.5 Гц), 142.70
13С (CDCl3), δС, м. д.: 10.79 (СН3-пиразол), 14.26
уш. с (С3,5-пиразол), 148.71 д (С5-фуран, 3JPC =
(СН3-фуроат), 16.39 д (СН3-фосфонат, 3JPC = 6.2 Гц),
9.9 Гц), 158.80 (С2-фуран), 164.35 (С=О-фуроат).
20.59 (СН2-пиразол), 21.20 д (СН2Р, 1JPC = 142.0 Гц),
Спектр ЯМР 31Р (CDCl3): δР 26.97 м. д.
60.15 (СН2О-фуроат), 61.99 д (СН2ОР, 2JPC = 6.6 Гц),
109.09 д (С4-фуран, 2JPC = 11.1 Гц), 110.55 (С4-пи-
Этиловый эфир
2-(3-метил-5-гидроксипи-
разол), 118.59 д (С3-фуран, 3JPC = 2.9 Гц), 142.29
разол-4-ил)метил-4-(диэтоксифосфорилме-
уш. с (С3,5-пиразол), 146.45 (С2-фуран), 153.66 д
тил)-5-метилфуран-3-карбоновой кислоты (7е).
(С5-фуран, 3JPC = 9.3 Гц), 163.48 (С=О-фуроат).
Выход 56%, желтые кристаллы, т. пл. 184-185°С.
Спектр ЯМР 31Р (CDCl3): δР 26.52 м. д.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.15 т (6Н,
СН3-фосфонат, JНН = 7.2 Гц), 1.29 т (3Н, СН3-фу-
Этиловый эфир
4-(диэтоксифосфорилме-
роат, JНН = 7.0 Гц), 1.97 с (3Н, СН3-пиразол), 2.15
тил)-5-(3-метил-5-гидроксипиразол-4-ил)ме-
д (3Н, СН3-фуран, JРН = 4.4 Гц), 3.18 д (2Н, СН2Р,
тилфуран-3-карбоновой кислоты (6е). Выход
JРH = 21.2 Гц), 3.87 с (2Н, СН2-пиразол), 3.91 д. к
84%, светло-коричневое стекловидное вещество,
(4Н, СН2ОР, JНН = 7.2, JРH = 14.8 Гц), 4.22 к (2Н,
которое при стоянии в течение месяца кристаллизу-
СН2О-фуроат, JНН = 7.0 Гц), 10.41 уш. с (2Н, NH,
ется, т. пл. 168°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.: 10.26
1.16 т (6Н, СН3-фосфонат, JНН = 7.0 Гц), 1.25 т (3Н,
(СН3-пиразол), 11.78 д (СН3-фуран, 4JРС = 2.5 Гц),
СН3-фуроат, JНН = 7.0 Гц), 2.07 с (3Н, СН3-пиразол),
14.30 (СН3-фуроат), 16.62 д (СН3-фосфонат, 3JPC =
3.36 уш. д (2Н, СН2Р, JРH = 21.2 Гц), 3.70 уш. с (2Н,
СН2-пиразол), 3.97 д. к (4Н, СН2ОР, JНН = 7.0, JРH =
5.8 Гц), 20.54 (СН2-пиразол), 21.74 д (СН2Р, 1JPC =
139.9 Гц), 60.22 (СН2О-фуроат), 61.60 д (СН2ОР,
13.6 Гц), 4.19 к (2Н, СН2О-фуроат, JНН = 7.0 Гц),
2JPC = 6.4 Гц), 96.87 (С4-пиразол), 109.87 д (С4-фу-
7.75 с (Н2-фуран), 10.34 уш. с (2Н, NH, ОН). Спектр
ран, 2JPC = 11.1 Гц), 113.14 д (С3-фуран, 3JPC =
ЯМР 13С (CDCl3), δС, м. д.: 10.39 (СН3-пиразол),
2.3 Гц), 137.70 уш. с (С3-пиразол), 148.43 д (С5-фу-
14.20 (СН3-фуроат), 16.25 д (СН3-фосфонат, 3JPC =
ран, 3JPC = 9.9 Гц), 158.84 (С2-фуран), 160.02 уш.
6.1 Гц), 19.10 (СН2-пиразол), 20.66 д (СН2Р, 1JPC =
с (С5-пиразол), 164.21 (С=О-фуроат). Спектр ЯМР
141.1 Гц), 60.01 (СН2О-фуроат), 62.27 д (СН2ОР,
2JPC = 6.8 Гц), 97.47 (С4-пиразол), 108.50 д (С4-фу-
31Р (CDCl3): δР 26.46 м. д.
ран, 2JPC = 10.8 Гц), 118.44 д (С3-фуран, 3JPC = 2.9 Гц),
Этиловый эфир
2-(3,5-диметилпиразол-
140.60 уш. с (С3-пиразол), 146.41 (С2-фуран),
4-ил)метил-5-(диэтоксифосфорилметил)фу-
154.20 д (С5-фуран, 3JPC = 9.3 Гц), 160.81 уш. с
ран-3-карбоновой кислоты (8д). Выход 70%,
(С5-пиразол), 163.40 (С=О-фуроат). Спектр ЯМР
светло-желтое стекловидное вещество. Спектр
31Р (CDCl3): δР 27.12 м. д.
ЯМР 1Н (CDCl3), δ, м. д.: 1.22 т (6Н, СН3-фосфо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1260
ПЕВЗНЕР, ПОНЯЕВ
нат, JНН = 7.0 Гц), 1.34 т (3Н, СН3-фуроат, JНН =
3JPC = 6.0 Гц), 22.84 д (СН2Р, 1JPC = 143.3 Гц),
7.2 Гц), 2.22 с (6Н, СН3-пиразол), 3.12 д (2Н, СН2Р,
23.36 (СН2-пиразол), 60.72 (СН2О-фуроат), 62.23 д
JРH = 20.8 Гц), 3.97-4.03 м (4Н, СН2ОР), 4.07 с
(СН2ОР, 2JPC = 6.7 Гц), 110.01 (С4-пиразол), 111.91
(2Н, СН2-пиразол), 4.29 к (2Н, СН2О-фуроат, JНН =
д (С4-фуран, 2JPC = 9.3 Гц), 120.48 д (С3-фуран,
7.2 Гц), 6.46 д (1Н, Н4-фуран, JРH = 3.6 Гц), 8.60
3JPC = 1.9 Гц), 142.40 (С2-фуран), 142.42 уш. с
уш. с (1Н, NH). Спектр ЯМР 13С (CDCl3), δС, м. д.:
(С3,5-пиразол), 155.88 д (С5-фуран, 3JPC = 10.9 Гц),
10.86 (СН3-пиразол), 14.38 (СН3-фуроат),
16.28
158.65 (С=О-фуроат). Спектр ЯМР 31Р (CDCl3):
д (СН3-фосфонат, 3JPC = 5.9 Гц), 23.40 (СН2-пи-
δР 25.77 м. д. Масс-спектр (ESI), m/z: 399.1679
разол),
26.48 д (СН2Р, 1JPC = 143.0 Гц),
60.24
[M + Н]+ (вычислено для С18Н27N2О6Р: 399.1679),
(СН2О-фуроат), 62.37 д (СН2ОР, 2JPC = 6.6 Гц),
421.1497 [M + Na]+ (вычислено для С18Н27N2NaО6Р:
108.90 д (С4-фуран, 3JPC = 7.4 Гц), 110.93 (С4-пира-
421.1499).
зол), 113.99 д (С3-фуран, 4JPC = 2.6 Гц), 142.78 уш.
Этиловый эфир
4-(диэтоксифосфорилме-
с (С3,5-пиразол), 144.15 д (С5-фуран, 2JPC = 9.6 Гц),
тил)-5-(3-метил-5-гидроксипиразол-4-ил)ме-
159.99 д (С2-фуран, 4JPC = 2.4 Гц), 163.78 (С=О-фу-
тил-фуран-2-карбоновой кислоты (9е). Выход
роат). Спектр ЯМР 31Р (CDCl3): δР 22.46 м. д.
81%, светло-желтое стекловидное вещество.
Этиловый эфир 2-(3-метил-5-гидроксипира-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.23 т (6Н,
зол-4-ил)метил-5-(диэтоксифосфорилметил)-
СН3-фосфонат, JНН = 7.2 Гц), 1.31 т (3Н, СН3-
фуран-3-карбоновой кислоты (8е). Выход 88%,
фуроат, JНН = 7.2 Гц), 2.30 уш. с (3Н, СН3-пира-
светло-коричевое стекловидное вещество. Спектр
зол), 2.99 д (2Н, СН2Р, JРH = 20.4 Гц), 3.69 с (2Н,
ЯМР 1Н (CDCl3), δ, м. д.: 1.22 т (6Н, СН3-фосфо-
СН2-пиразол), 4.00-4.12 м (4Н, СН2ОР), 4.25-4.32
нат, JНН = 7.0 Гц), 1.32 т (3Н, СН3-фуроат, JНН =
м (2Н, СН2О-фуроат), 7.04 с (1Н, Н3-фуран), 9.23
7.2 Гц), 2.11 с (3Н, СН3-пиразол), 3.13 д (2Н, СН2Р,
уш. с (2Н, NH, ОН). Спектр ЯМР 13С (CDCl3), δС,
JРH = 20.8 Гц), 3.99 с (2Н, СН2-пиразол), 4.01 д. к
м. д.: 12.05 (СН3-пиразол), 12.07 (СН3-пиразол),
(4Н, СН2ОР, JНН = 7.2, JРH = 14.8 Гц), 4.28 к (2Н,
14.16 (СН3-фуроат), 14.28 (СН3-фуроат), 16.32 д
СН2О-фуроат, JНН = 7.2 Гц), 6.44 д (1Н, Н4-фуран,
(СН3-фосфонат, 3JPC = 5.8 Гц), 16.41 д (СН3-фосфо-
JРH = 4.0 Гц), 9.04 уш. с (2Н, NH, ОН). Спектр
нат, 3JPC = 5.9 Гц), 23.19 д (СН2Р, 1JPC = 143.5 Гц),
ЯМР 13С (CDCl3), δС, м. д.: 10.38 (СН3-пиразол),
14.30 (СН3-фуроат), 16.26 д (СН3-фосфонат, 3JPC =
23.38 (СН2-пиразол), 60.38 (СН2О-фуроат), 60.72
6.0 Гц), 23.41 (СН2-пиразол), 26.34 д (СН2Р, 1JPC =
(СН2О-фуроат), 62.26 д (СН2ОР, 2JPC = 6.8 Гц),
142.4 Гц), 60.47 (СН2О-фуроат), 62.53 д (СН2ОР,
62.53 д (СН2ОР, 2JPC = 6.8 Гц), 111.68 д (С4-фуран,
2JPC = 6.5 Гц), 108.85 д (С4-фуран, 3JPC = 7.8 Гц),
2JPC = 9.4 Гц), 120.52 (С3-фуран), 120.54 (С4-пира-
113.86 д (С3-фуран, 4JPC = 2.4 Гц), 121.43 (С4-пира-
зол), 141.37 уш. с (С3-пиразол), 142.35 (С2-фуран),
зол), 140.03 уш. с (С3-пиразол), 144.04 д (С5-фуран,
156.66 д (С5-фуран, 3JPC = 10.7 Гц), 158.60 (С=О-фу-
2JPC = 9.6 Гц), 160.35 д (С2-фуран, 4JPC = 2.5 Гц),
роат), 160.21 уш. с (С5-пиразол). Спектр ЯМР 31Р
161.23 уш. с (С5-пиразол), 164.42 (С=О-фуроат).
(CDCl3): δР 26.44 м. д. Масс-спектр (ESI), m/z:
Спектр ЯМР 31Р (CDCl3): δР 22.58 м. д.
401.1467 [M + Н]+ (вычислено для С17Н25N2О7Р:
Этиловый эфир
4-(диэтоксифосфорилме-
401.1472).
тил)-5-(3,5-диметилпиразол-4-ил)метилфу-
ФОНДОВАЯ ПОДДЕРЖКА
ран-2-карбоновой кислоты (9д). Выход 87%,
светло-желтое стекловидное вещество. Спектр
Работа выполнена в рамках государственно-
ЯМР 1Н (CDCl3), δ, м. д.: 1.25 т (6Н, СН3-фосфо-
го задания Министерства образования и науки
нат, JНН = 7.2 Гц), 1.31 т (3Н, СН3-фуроат, JНН =
России (№ 785.00X6019) с использованием обо-
7.2 Гц), 2.16 с (6Н, СН3-пиразол), 2.78 д (2Н, СН2Р,
рудования Инжинирингового центра Санкт-Пе-
JРH = 20.8 Гц), 3.75 д (2Н, СН2-пиразол, JРH =
тербургского государственного технологического
1.6 Гц), 4.02 д. к (4Н, СН2ОР, JНН = 7.2, JРH =
института (технического университета).
14.4 Гц), 4.28 к (2Н, СН2О-фуроат, JНН = 7.2 Гц),
КОНФЛИКТ ИНТЕРЕСОВ
7.10 с (1Н, Н3-фуран), 9.63 уш. с (1Н, NH). Спектр
ЯМР 13С (CDCl3), δС, м. д.:
10.84 (СН3-пира-
Авторы заявляют об отсутствии конфликта
зол), 14.28 (СН3-фуроат), 16.40 д (СН3-фосфонат,
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
АЛКИЛИРОВАНИЕ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1261
СПИСОК ЛИТЕРАТУРЫ
3. Певзнер Л.М., Завгородний В.С. // ЖОХ 2018. Т. 88.
1. Inhibitor Catalog. 2014. Selleckchem.com
Вып. 3. С. 411; Pevzner L.M., Zavgorodnii V.S. // Russ.
2. Певзнер Л.М. //ЖОХ 2017. Т. 87. Вып. 11. С. 1822;
J. Gen. Chem. 2018. Vol. 88. N 3. P. 439. doi 10.1134/
Pevzner L.M. // Russ. J. Gen. Chem. 2017. Vol. 87. N 11.
P. 2563. doi 10.1134/S1070363217110093
S1070363218030106
Alkylation of 1,3-Dicarbonyl Compounds
and Their Analogs with 2-Halomethyl(ethoxycarbonyl)-
(diethoxyphosphorylmethyl)furanes
L. M. Pevzner* and A. I. Ponyaev
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
* e-mail: pevzner_lm@list.ru
Received February 27, 2020; revised February 27, 2020; accepted March 5, 2020
The 2-halomethyl derivatives of phosphonocarboxylic acid esters of the furan series react with acetylacetone,
acetoacetic, malonic and cyanoacetic esters in anhydrous ethanol-dioxane mixture (1:10) in the presence of
sodium ethylate with the formation of monoalkyl derivatives. Reactions of 3-(furylmethyl)acetylacetone and
2-(furylmethyl)acetoacetic ester with hydrazine hydrate lead to the formation of phosphorus-containing (furyl)-
(pyrazolyl)methanes and (furyl)(pyrazolonyl)methanes, respectively. The latter in solutions exist exclusively
in hydroxy form.
Keywords: 1,3-dicarbonyl compounds, 2-halomethylfurans, pyrazoles, pyrazolones, keto-enol tautomerism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020