ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 8, с. 1304-1308
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.46.052.2
СИНТЕЗ АМИНОФЕНИЛПОЛИКАРБОНИТРИЛОВ В
РЕАКЦИИ МИХАЭЛЯ АРИЛИДЕНМАЛОНОНИТРИЛОВ
© 2020 г. М. А. Марьясовa,*, В. В. Давыдоваa, О. Е. Насакинa,
С. А. Штейнгольцb, О. А. Лодочниковаb
a Чувашский государственный университет имени И. Н. Ульянова, Московский пр. 15, Чебоксары, 428015 Россия
b Институт органической и физической химии имени А. Е. Арбузова Казанского научного центра
Российской академии наук, Казань, 420088 Россия
*e-mail: marsikprovisor@mail.ru
Поступило в Редакцию 20 февраля 2020 г.
Поcле доработки 20 февраля 2020 г.
Принято к печати 27 февраля 2020 г.
Взаимодействием арилиденмалононитрилов с малононитрилом, метилцианоацетатом и цианоацетами-
дом получены аминофенилди- и трикарбонитрилы. Установлено, что образование данных соединений
происходит через стадию дегидроцианирования соответствующих аминогексенполикарбонитрилов.
Ключевые слова: арилиденмалононитрилы, малононитрил, аминофенилкарбонитрилы, 4-аминоцикло-
гекс-4-ен-1,1,3,3,5-пентакарбонитрил, СК-2 ингибиторы
DOI: 10.31857/S0044460X20080193
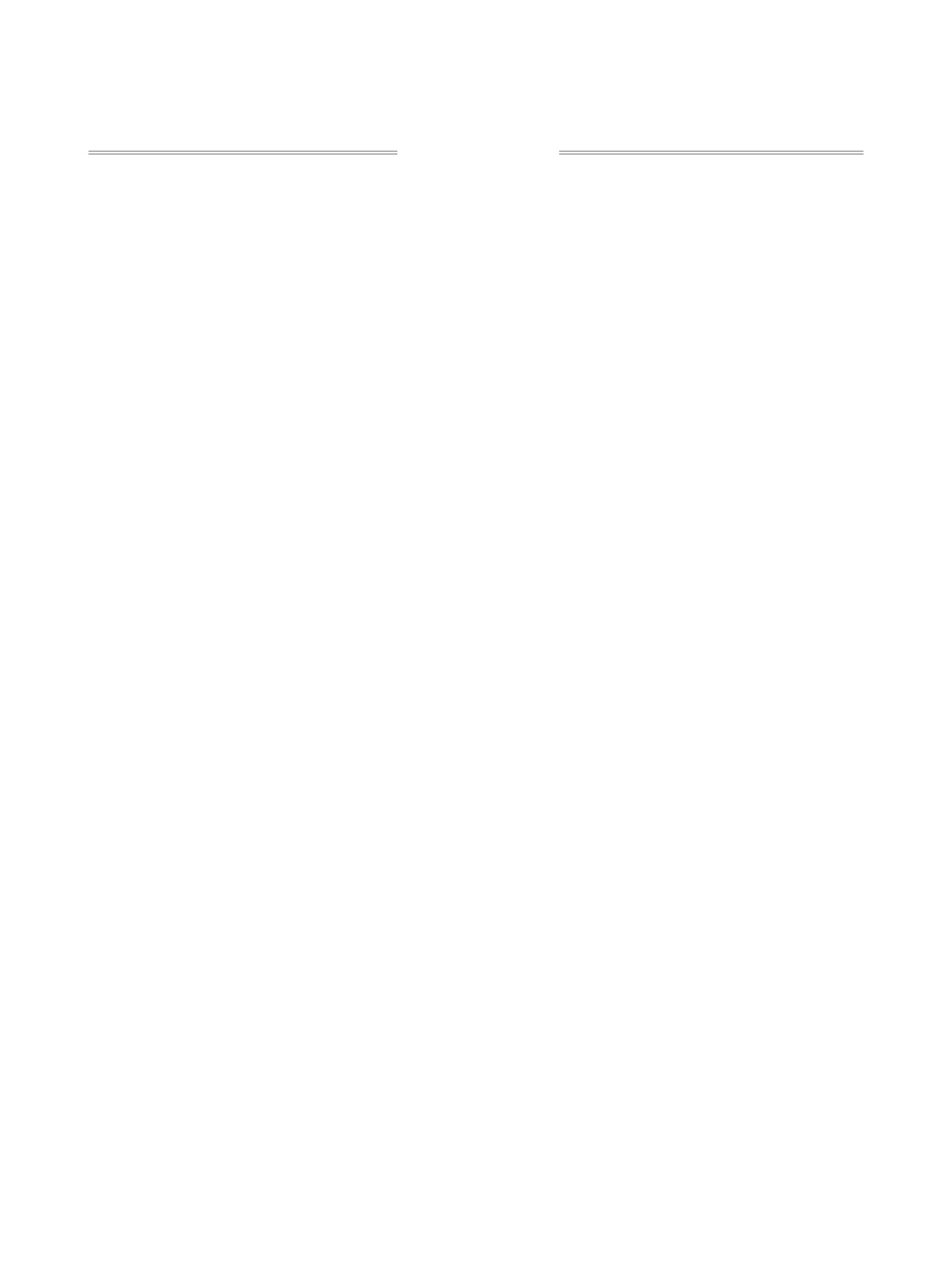
Реакции циклоприсоединения широко приме-
были изучены реакции винилиденцианида 1а и
няются в органическом синтезе. Реакция Михаэля
арилиденмалононитрилов 1б-д с малононитрилом
также может быть использована для получения
2а, цианоацетамидом 2б и метилцианоацетатом 2в
циклических продуктов [1-3]. Ранее было пока-
(схема 1). Реакции проводили в этаноле в присут-
зано, что в результате взаимодействия малонони-
ствии триэтиламина при нагревании (40-50°С) в
трила и двух молекул арилиденмалононитрила
течение 3-4 ч. В результате реакций были получе-
в присутствии основания образуются 4-амино-
ны соответствующие аминофенилди- и трикарбо-
циклогекс-4-ен-1,1,3,3,5-пентакарбонитрилы
[4].
нитрилы 4a-з с выходами 55-84%.
Аналогичные по структуре соединения были так-
В случае реакции винилиденцианида 1а с ма-
же получены взаимодействием малононитрила с
лононитрилом 2а изначально был выделен 4-ами-
левулиновым и янтарным альдегидами [5].
ноциклогекс-4-ен-1,1,3,3,5-пентакарбонитрил
Известно, что аминофенилполицикарбонитри-
3а, который впоследствии легко окислялся до
лы являются предшественниками ингибиторов
2-аминобензо-1,3,5-трикарбонитрила 4а. Это под-
или модуляторов активности протеинкиназы СК-
тверждает тот факт, что и в случае арилиденмало-
2, которые используют для лечения опухолевых за-
нонитрилов 1б-д, взаимодействие протекает через
болеваний, инфекций, дегенеративных процессов
стадию образования аминоциклогексенкарбони-
(болезней Альцгеймера и Паркинсона) [6]. Кроме
трилов с последующим дегидроцианированием.
того, ряд соединений с аминофенилкарбонитриль-
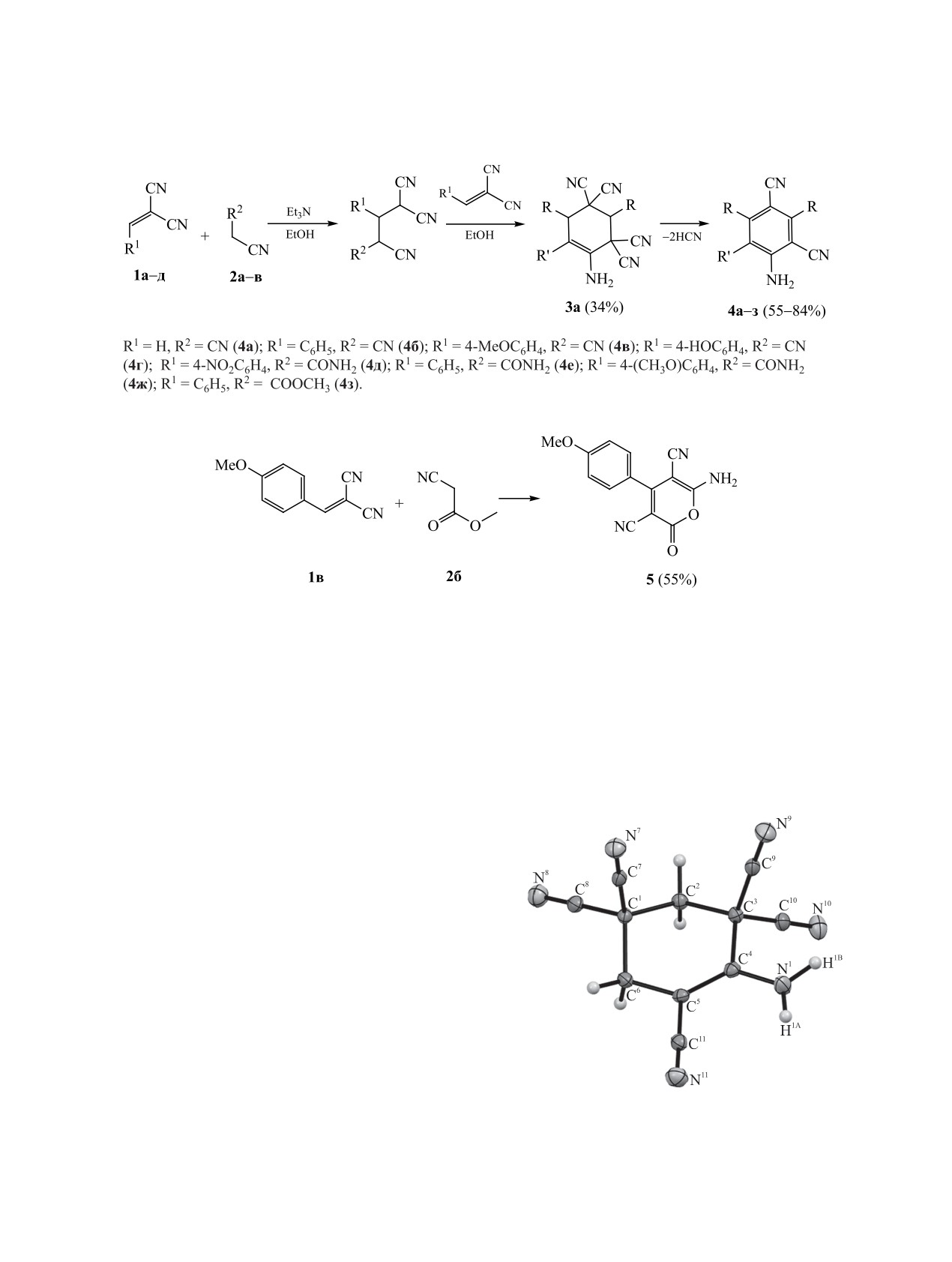
Структура соединения 3а подтверждена данны-
ным фрагментом проявляет противовоспалитель-
ми рентгеноструктурного анализа (см. рисунок).
ную [7, 8] и противомикробную активность [9].
Данные РСА, полученные нами при 150 K, в об-
С целью оптимизации методов синтеза тако-
щем аналогичны таковым, полученным ранее при
го типа поликарбонитрильных соединений нами
293 K [10]. Шестичленный цикл молекулы нахо-
1304
СИНТЕЗ АМИНОФЕНИЛПОЛИКАРБОНИТРИЛОВ
1305
Схема 1.
Схема 2.
дится в кристалле в конформации шестичленный
Строение соединения
5 так же установле-
конверт: атомы С2С3С4С5С6 находятся в одной
но методами ЯМР 1H, 13C, ИК спектроскопии,
плоскости, атом С1 выходит из этой плоскости. В
масс-спектрометрии.
кристалле наблюдаются водородные связи с уча-
Таким образом, разработан простой и удобный
стием атомов водорода аминогруппы и атомов азо-
метод синтеза аминофенилполикарбонитрилов,
та цианогрупп.
потенциальных ингибиторов протеинкиназы СК-2.
Строение соединений 4а-з установлено мето-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дами ЯМР 1H, 13C, ИК спектроскопии и масс-спек-
Контроль за ходом реакции и чистотой син-
трометрии. В ИК спектрах соединений
4а-з
тезированных соединений осуществляли мето-
присутствуют полосы поглощения NH2-групп
(3187-3557 см-1), сопряженных цианогрупп
(2189-2235 см-1), связей С=О (1660-1783 см-1),
NH (1636 см-1) и С=С (1518-1727 см-1). В спектрах
ЯМР 1H сигналы протонов NH2 проявляются при
3.45-5.54 и 7.39-8.04 м. д. (4д, е). Сигналы прото-
нов фрагмента COONH2 регистрируются в обла-
сти 7.71-8.29 м. д., COOCH3 - 3.28 м. д., OCH3 -
3.82 м.д. Спектры ЯМР 13С характеризуются на-
личием сигналов атомов углерода цианогрупп в
области 110.7-118.0 м. д. и сигналами групп С=О
в области 162.1-165.2 м. д.
При взаимодействии арилиденмалононитри-
ла
1в с метилцианоацетатом
2б наблюдалось
альтернативное течение реакции. Так, был полу-
чен
6-амино-4-(4-метоксифенил)-2-оксо-2Н-пи-
Общий вид молекулы соединения 3а в кристалле по
данным РСА (CCDC 1978850).
ран-3,5-дикарбонитрил 5 (схема 2).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1306
МАРЬЯСОВ и др.
дом тонкослойной хроматографии на пластинках
разбавленного и охлажденного триэтиламина. Об-
Sorbfil (элюент - этилацетат, проявление в УФ
разовавшийся осадок сразу отфильтровывали и
свете, парами иода и термическим разложением).
промывали 2 мл охлажденного диэтилового эфира.
Температуры плавления определены на приборе
Осадок отфильтровывали и сушили. При хранении
Optimelt MPA100. ИК спектры зарегистрированы
на воздухе желтеет и частично осмоляется. При
на Фурье-спектрометре ФСМ-1202 в тонком слое
перекристаллизации образуется соединение 4а.
(суспензия в вазелиновом масле). Спектры ЯМР
Выход 34%, т. пл. 110-111°C (EtOH). ИК спектр,
1Н и 13С зарегистрированы на спектрометре Bruker
ν, см-1: 3355 ш (NH), 2268, 2201 с (C≡N), 1647
DRX-500 (500 и 125 МГц соответственно) в ДМ-
ш (NH), 1623 ср (C=С). Спектр ЯМР 1H, δ, м. д.:
СО-d6, внутренний стандарт - ТМС. Масс-спектры
3.63 с (2Н, СН2), 3.24 уш. с (1Н, NH2), 3.19 c (2H,
записаны на приборе Bruker Ultraflex MALDI-TOF.
CH2), 3.14 уш. с (1Н, NH2). Спектр ЯМР 13C, δC, м. д.:
Элементный анализ выполнен на CHN-анализато-
143.9 (C4), 117.4 (C5CN), 113.6 (C3(CN)2), 112.2
ре varioMicrocube.
(C1(CN)2), 69.8 (C5), 34.4 (C2), 32.0 (C6), 31.1 (C3),
28.2 (C1). Масс-спектр, m/z (Iотн, %): 222 (1.3) [M]+.
Рентгеноструктурный анализ кристалла сое-
Найдено, %: C 58.52; H 3.64; N 35.48. C11H6N6. Вы-
динения 3a проведен на автоматическом дифрак-
числено, %: C 59.46; H 2.72; N 37.82.
тометре Bruker Smart APEX II CCD [графитовый
монохроматор, λ(MoKα) = 0.71073 Å, ω-сканиро-
Общая методика получения соединений 4а-з,
вание, 150 K]. Структура расшифрована прямым
5. К суспензии 4 ммоль соответствующего нитрила
методом и уточнена вначале в изотропном, за-
1а-д в 5-7 мл этанола добавляли 2 ммоль малоно-
тем в анизотропном приближении по программе
нитрила 2а-в и 2-3 капли триэтиламина. Получен-
SHELXL-2017/1
[11]. Проведен полуэмпириче-
ную смесь нагревали до 40-50°С и перемешивали
ский учет поглощения с использованием програм-
при данной температуре в течение 3-4 ч. После
мы SADABS. H(C) атомы водорода помещены в
охлаждения до комнатной температуры смесь под-
геометрически рассчитанные положения и вклю-
кисляли разбавленным раствором серной либо со-
чены в уточнение по модели наездника. H(N)
ляной кислоты. Осадок отфильтровывали, промы-
атомы водорода выявлены из разностных рядов
вали 2 мл охлажденного этанола и сушили.
электронной плотности и уточнены изотропно.
2-Аминобензол-1,3,5-трикарбонитрил
(4а).
Все расчеты проведены с помощью программы
Выход 55%, т. пл. 203-205°C (EtOH). ИК спектр,
WinGX [12].
ν, см-1: 3346 ш (NH), 2204 с (C≡N), 1650 ш (NH),
Кристаллы соединения 3a бледно-желтые, при-
1623 ср (C=С). Спектр ЯМР 1H, δ, м. д.: 7.67 с
зматические, моноклинные, C11H6N6, M = 222.22, a =
(2Н, СН), 3.45 уш. с (2Н, NH2). Спектр ЯМР 13C,
14.204(5) Å, b = 6.5700(18) Å, c = 12.157(4) Å, β =
δC, м. д.: 155.1 (C2), 136.3 (С4, С6), 116.1 (С5СN),
115.104(18)°, V = 1027.4(5) Å3, dвыч = 1.437 г/см3,
115.3 (C1CN, C3CN), 88.4 (C5), 85.1 (C1, C3). Масс-
μ(Mo) = 0.096 мм-1, Z = 4, пространственная груп-
спектр, m/z (Iотн, %): 168 (100) [M]+. Найдено, %:
па P21/c. Интервал углов сканирования 3.17° < θ <
C 63.95; H 2.12; N 34.05. C9H4N4. Вычислено, %: C
26.65°. Измерено 8457 отражений, из них 2234
64.28; H 2.40; N 33.32.
независимых, 1693 из которых с I ≥ 2σ. Оконча-
5′-Амино-[1,1′:3′,1′′-терфенил]-2′,4′,6′-три-
тельные значения факторов расходимости: R =
карбонитрил (4б). Выход 62%, т. пл. 305-307°C
0.0427 по наблюдаемым отражениям и Rw = 0.1052
(EtOH). ИК спектр, ν, см-1: 3300, 3212 ш (NH),
(по всем рефлексам), параметр подгонки 1.013.
2213, 2192 с (C≡N), 1650 ш (NH), 1562 ср (C=C).
Максимальный и минимальный пики остаточной
Спектр ЯМР 1H, δ, м. д.: 7.52 т (6Н, СН, JHH =
электронной плотности равны 0.262 и -0.197 е/Å3.
3.3 Гц), 7.44 д (2Н, СН, JHH = 2.2 Гц), 7.43-7.41 м
Структура депонирована в Кембриджской базе
(2Н, СН), 5.54 уш. с (2Н, NH2). Спектр ЯМР 13C, δC,
кристаллоструктурных данных (CCDC 1978850).
м. д.: 161.4 (C5), 157.8 (C1, C3), 156.7 (C1C1′, C3C1′′),
4-Аминоциклогекс-4-ен-1,1,3,3,5-пентакар-
135.0 (C3′, C5′, C3′′, C5′′), 130.2 (C2′, C6′, C2′′, C6′′),
бонитрил (3а). К смеси 4 ммоль винилиденциа-
128.7 (C4′, C4′′), 128.3 (C2), 115.4 (C4CN, C6CN),
нида 1а и 2 ммоль малононитрила 2а в 5 мл ох-
115.2 (C2CN), 85.9 (C4, C6). Масс-спектр, m/z (Iотн,
лажденного диэтилового эфира добавляли 1 каплю
%): 320 (0.5) [M]+, 321 (2.3) [M + H]+. Найдено, %:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
СИНТЕЗ АМИНОФЕНИЛПОЛИКАРБОНИТРИЛОВ
1307
C 79.15; H 3.02; N 16.35. C21H12N4. Вычислено, %:
5′-Амино-2′,6′-дициано-[1,1′:3′,1′′-терфе-
C 78.73; H 3.78; N 17.49.
нил]-4′-карбоксамид (4е). Выход 84%, т. пл.
270-271°C (EtOH). ИК спектр, ν, cм-1: 3452, 3339
5′-Амино-4,4′′-диметокси-[1,1′:3′,1′′-терфе-
ш (NH), 2213 с (C≡N), 1748 с (C=O), 1638 ш (NH),
нил]-2′,4′,6′-трикарбонитрил (4в). Выход 56%,
1606 ср (C=C). Спектр ЯМР 1H, δ, м. д.: 7.76 уш. с
т. пл. 284-285°C (EtOH). ИК спектр, ν, cм-1: 3306,
(2Н, СONH2), 7.53 т (6Н, СН, JHH = 3.2 Гц), 7.49 д
3203 ш (NH), 2216, 2189 с (C≡N), 1727, 1650 ш
(2Н, СН, JHH = 2.4 Гц), 7.47-7.46 м (2Н, СН), 7.39
(NH), 1620 ср (C=C). Спектр ЯМР 1H, δ, м. д.: 7.41
уш. с (2H, NH2). Спектр ЯМР 13C, δC, м. д.: 162.6
д (4Н, СН, JHH = 8.5 Гц), 7.07 д (4Н, СН, JHH =
(CONH2), 159.8 (С5), 156.7 (C1, C3), 156.5 (C1C1′,
8.6 Гц), 5.41 уш. с (2Н, NH2), 3.82 с (6Н, ОСН3).
C3C1′′), 134.7 (C3′, C5′, C3′′, C5′′), 130.3 (C2′, C6′, C2′′,
Спектр ЯМР 13C, δC, м. д.: 161.3 (C4′, C4′′), 160.9
C6′′), 128.7 (C4′, C4′′), 128.0 (С4), 116.2 (C6CN), 115.4
(C5), 157.1 (C1, C3), 156.5 (C1C1′, C3C1′′), 130.2 (C2′,
(C2CN), 88.7 (С2), 74.8 (С6). Масс-спектр, m/z (Iотн,
C6′, C2′′, C6′′), 126.7 (C3′, C5′, C3′′, C5′′), 115.4 (C4CN,
%): 338 (1.2) [M]+, 339 (0.5 [M + H]+. Найдено, %: C
C6CN), 114.0 (C2CN), 86.0 (C2), 81.4 (C4, C6), 55.4
75.32; H 4.74; N 15.12. C21H14N4O. Вычислено, %:
((OCH3)2) . Масс-спектр, m/z (Iотн, %): 380 (1.0)
C 74.54; H 4.17; N 16.56.
[M]+, 381 (3.9) [M + H]+. Найдено, %: C 70.95; H
5′-Амино-2′,6′-дициано-4,4′′-диметокси-
5.44; N 15.82. C23H16N4O2. Вычислено, %: C 72.62;
[1,1′:3′,1′′-терфенил]-4′-карбоксамид
(4ж).
H 4.24; N 14.73.
Выход 65%, т. пл. 180-181°C (EtOH). ИК спектр,
5′-Амино-4,4′′-дигидрокси-[1,1′:3′,1′′-терфе-
ν, cм-1: 3557, 3317, 3187 ш (NH), 2235, 2213 с
нил]-2′,4′,6′-трикарбонитрил (4г). Выход 59%,
(C≡N), 1783 сл (C=O), 1650 ш (NH), 1567 ср (C=C).
т. пл. 310-312°C (EtOH). ИК спектр, ν, cм-1: 3352
Спектр ЯМР 1H, δ, м. д.: 7.71 уш. с (2Н, СONH2),
ш (NH), 3152 сл (OH), 2216 с (C≡N), 1641 (NH),
7.44 д (4Н, СН, JHH = 8.3 Гц), 7.07 д (4Н, СН, JHH =
1605, 1565 ср (C=C). Спектр ЯМР 1H, δ, м. д.: 7.29
8.5 Гц), 3.82 с (6Н, ОСН3), 3.58 уш. с (2H, NH2).
д (4Н, СН, JHH = 8.64 Гц), 6.87 д (4Н, СН, JHH =
Спектр ЯМР 13C, δC, м. д.: 162.3 (CONH2), 160.8
8.6 Гц), 5.23 уш. c (2Н, NH2), 5.23 с (2Н, ОН). Спектр
(C4′, C4′′), 159.9 (С5), 156.7 (C1, C3), 130.2 (C2′, C6′,
ЯМР 13C, δC, м. д.: 161.6 (C4′, C4′′), 159.5 (C5), 157.0
C2′′, C6′′), 129.9 (C1C1′, C3C1′′), 126.6(C3′, C5′, C3′′,
(C1, C3), 156.5 (C1C1′, C3C1′′), 130.4 (C2′, C6′, C2′′,
C5′′), 116.5 (C4), 115.6 (C6CN), 114.0 (C2CN), 88.5
C6′′), 125.0 (C3′, C5′, C3′′, C5′′), 115.5 (C4CN, C6CN),
(С2), 74.7 (С6), 55.4 (OCH3) . Масс-спектр, m/z (Iотн,
115.4 (C2CN), 85.9 (C2), 81.3 (C4, C6). Масс-спектр,
%): 398 (0.5) [M]+. Найдено, %: C 67.84; H 4.02; N
m/z (Iотн, %): 352 (0.5) [M]+, 353 (2.2) [M + H]+. Най-
14.98. C23H18N4O3. Вычислено, %: C 69.34; H 4.55;
дено, %: C 72.03; H 3.82; N 15.04. C21H12N4O2. Вы-
N 14.06.
числено, %: C 71.58; H 3.43; N 15.90.
Метил 5′-амино-2′,6′-дициано-[1,1′:3′,1′′-тер-
5′-Амино-2′,6′-дициано-4,4′′-динитро-
фенил]-4′-карбоксилат (4з). Выход 58%, т. пл.
[1,1′:3′,1′′-терфенил]-4′-карбоксамид (4д). Вы-
144-143°C (EtOH). ИК спектр, ν, cм-1: 3355, 3193
ход 71%, т. пл. 180-181°C (EtOH). ИК спектр, ν,
ш (NH), 2197 с (C≡N), 1745 сл (C=O), 1666 ш (NH),
cм-1: 3440, 3342, 3220 ш (NH), 2223 с (C≡N), 1692
1597 ср (C=C). Спектр ЯМР 1H, δ, м. д.: 7.45-7.35
с (C=O), 1622 ш (NH), 1606, 1518 ср (C=C). Спектр
м (10Н, С6Н5), 6.81 с (2Н, NН2), 3.28 с (3Н, ОCН3).
ЯМР 1H, δ, м. д.: 8.37 д (2H, СН, JHH = 8.9 Гц), 8.29
Спектр ЯМР 13C, δC, м. д.: 165.2 (COOCH3), 162.4
с (2Н, CONH2), 8.11 д (2Н, СН, JHH = 8.9 Гц), 8.04
(C5), 135.8 (C1), 134.3 (C3), 129.5 (C1C1′),
129.2
уш. с (1H, NH2), 7.90 уш. с (1H, NH2). Спектр ЯМР
(C3′, C5′, C3′′, C5′′), 129.0 (C3C1′′), 128.9 (C2′, C6′,
13C, δC, м. д.: 162.1 (CONH2), 148.8 (C5), 148.3 (C1,
C2′′, C6′′), 128.7 (C4′, C4′′), 128.4 (C4), 118.0(C6CN),
C3), 148.2 (C1C1′, C3C1′′), 136.1 (C4′, C4′′), 131.0 (C2′,
117.0 (C2CN), 89.4 (С2), 74.1 (C6), 53.4 (OCH3).
C6′, C2′′, C6′′), 124.2 (C3′, C5′, C3′′, C5′′), 124.1 (C4),
Масс-спектр, m/z (Iотн, %): 353 (1.5) [M]+, 354 (2.4)
115.8 (C6CN), 115.7 (C2CN), 110.7 (С2), 90.7 (С6).
[M + H]+. Найдено, %: C 72.21; H 3.72; N 11.02.
Масс-спектр, m/z (Iотн, %): 428 (2.7) [M]+, 429 (1.0)
C22H15N3O2. Вычислено, %: C 74.78; H 4.28; N
[M + H]+. Найдено, %: C 59.54; H 3.92; N 17.18.
11.89.
C21H12N6O5. Вычислено, %: C 58.88; H 2.82; N
6-Амино-4-(4-метоксифенил)-2-оксо-2H-пи-
19.62.
ран-3,5-дикарбонитрил (5). Выход 55%, т. пл.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020
1308
МАРЬЯСОВ и др.
152-153°C (EtOH). ИК спектр, ν, cм-1: 3301, 3206
4. Нестеров В.Н., Стручков Ю.Т., Хорошилов Г.Е.,
ш (NH), 2220, 2191 с (C≡N), 1638 сл (C=O), 1612
Шаранин Ю.А., Шкловер В.Е. // Изв. АН СССР.
ш (NH), ср 1568 (C=C). Спектр ЯМР 1H, δ, м. д.:
Сер. хим. 1988. Т. 52. № 12. С. 2771; Nesterov V.N.,
7.40 д (2, СН, JHH = 8.8 Гц), 7.06 д (2Н, СН, JHH =
Struchkov Yu.T., Khoroshilov G.E., Sharanin Yu.A.,
8.5 Гц), 4.83 уш. с (2H, NH2), 3.82 с (3Н, ОСН3).
Shklover V.E. // Russ. Chem. Bull. 1989. Vol. 38. N. 12.
P. 2537. doi 10.1007/BF00962440
Спектр ЯМР 13C, δC, м. д.: 161.0 (C4), 160.7 (C6),
5. Hartke K., Matusch R., Fallert M. // Synthesis. 1986.
158.0 (C4′), 156.9 (C2), 130.2 (C2′, C6′), 126.9 (C4C1′),
Vol. 18. N. 8. P. 677. doi 10.1055/s-1986-31747
115.7 (C5CN), 115.4 (C3CN), 114.0 (C3′, C5′), 85.9
6. Webber S.E., Tao X., Brin E. Pat. US 2017/0369489 A1
(C3), 81.3 (C5), 55.4 (OCH3). Масс-спектр, m/z (Iотн,
(2017).
%): 267 (100.0) [M]+. Найдено, %: C 64.02; H 4.64;
7. Dawood K.M., Abdel-Gawad H., Ellithey M., Moha-
N 13.56. C14H9N3O3. Вычислено, %: C 62.92; H
med H.A., Hegazi B. // Arch. Pharm. Chem. Life
3.39; N 15.72.
Sci. 2006. Vol. 339. N. 3. P. 133. doi 10.1002/
КОНФЛИКТ ИНТЕРЕСОВ
ardp.200500176
8. Heilman W.P., Battershell R.D., Pyne W.J., Goble P.H.,
Авторы заявляют об отсутствии конфликта ин-
Magee T.A. // J. Med. Chem. 1978. Vol. 21. N. 9. P. 906.
тересов.
doi 10.1021/jm00207a013
СПИСОК ЛИТЕРАТУРЫ
9. Huang C., Yan S.-J., He N.-Q., Tang Ya-J., Wang X.-H.,
Lin J. // Bioorg. Med. Chem. Lett. 2013. Vol. 23. N 8.
1. Toche R.B., Kazi M.A., Patil S.P. Kanawade S.B.,
P. 2399. doi 10.1016/j.bmcl.2013.02.033
Jachak M.N. // J. Fluoresc. 2010. Vol. 20. N. 5. P. 1129.
10. Bell R.A., Brown B.E., Duarte M., Howard-Lock H.E.,
doi 10.1007/s10895-010-0654-9
2. Safaei-Ghomi J., Bamoniri A.H., Soltanian-Telkaba-
Lock C.J.L. // Can. J. Chem. 1987. Vol. 65. N. 2. P. 261.
di M. // Chem. Heterocycl. Compd. 2006. Vol. 42. N. 7.
doi 10.1139/v87-043
P. 892. doi 10.1007/s10593-006-0176-1
11. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol 71.
3. Varghese B., Al-Busafi S.N., Suliman F.O., Al-Kindy,
N. 1. P. 3. doi 10.1107/S2053229614024218
Salma M.Z. // Spectrochim. Acta (A). 2015. Vol. 136.
12. Farrugia L.J. // J. Appl. Cryst. 2012. Vol. 45. N. 4.
Pt B. P. 661. doi 10.1016/j.saa.2014.09.080
P. 849. doi 10.1107/s0021889812029111
Synthesis of Aminophenylpolycarbonitriles
from Arylidenemalononitriles by the Michael Reaction
M. A. Maryasova,*, V. V. Davydovaa, O. E. Nasakina, S. A. Shteingoltsb, and O. A. Lodochnikovab
a I.N. Ulyanov Chuvash State University, Cheboksary, 428015 Russia
b A.E. Arbuzov Institute of Organic and Physical Chemistry, Kazan Scientific Center of the Russian Academy of Sciences,
Kazan, 420088 Russia
*e-mail: marsikprovisor@mail.ru
Received February 20, 2020; revised February 20, 2020; accepted February 27, 2020
The reactions of arylidenemalononitriles with malononitrile, methyl cyanoacetate and cyanoacetamide yielded
aminophenyldi- and tricarbonitriles. Formation of these compounds occurs through the dehydrocyanation step
of the corresponding aminohexenepolycarbonitriles.
Keywords: arylidenemalononitriles, malononitrile, aminophenylcarbonitriles, 4-aminocyclohex-4-ene-1,1,3,3,5-
pentacarbonitrile, SK2 inhibitors
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 8 2020