ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1326-1336
УДК 547.26’118
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ
ИЗАТИНОВ НА НАПРАВЛЕНИЕ ИХ РЕАКЦИИ С
НЕКОТОРЫМИ АММОНИЕВЫМИ ПРОИЗВОДНЫМИ
АЦЕТОГИДРАЗИДА
© 2020 г. А. В. Богданов*, А. Д. Волошина, А. С. Сапунова, Н. В. Кулик, В. Ф. Миронов
Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
*e-mail: abogdanov@inbox.ru
Поступило в Редакцию 8 апреля 2020 г.
После доработки 8 апреля 2020 г.
Принято к печати 18 апреля 2020 г.
Реакция 1-ацилизатинов с реагентом Жирара Т протекает с отщеплением ацильного заместителя и
образованием изатин-3-гидразона с четвертичным атомом азота в боковой цепи. 1-(Аминометил)иза-
тины в зависимости от строения заместителя в положении 1 взаимодействуют с реагентом Жирара Т c
образованием гидразонов либо с отщеплением аминометильного заместителя, либо с его сохранением.
Производные изатина, не содержащие заместителей в ароматическом фрагменте, проявляют умеренную
активность в отношении грамположительных бактерий S. aureus 209p и B. cereus 8035. Установлена
низкая гемотоксичность полученных соединений.
Ключевые слова: изатин, гидразоны, гетероциклы, антимикробная активность, аммониевые соли
DOI: 10.31857/S0044460X20090024
Изатин (1Н-индол-2,3-дион) и его производные
С учетом многочисленных данных по синтезу и
имеют плоскую циклическую структуру и высо-
исследованию биологической активности основа-
кую степень сопряжения. Они находят широкое
ний Манниха, полученных из изатина [10, 22-24],
применение в конструировании органических
нами предпринята попытка функционализации
функциональных материалов различного назначе-
ряда 1-(аминометил)изатинов ацетилгидразидами
ния [1-6]. Изатин легко подвергается глубокой мо-
с четвертичным азотом в положении 2.
дификации, его производные относятся к классу
На первом этапе во взаимодействие с изатинами
привилегированных гетероциклических структур
1-4 был введен реагент Жирара Т 5. Реакцию про-
[7, 8], на основе которых конструируют биологи-
водили при нагревании в этаноле в присутствии
чески активные вещества достаточно широкого
каталитических количеств трифторуксусной кис-
спектра действия, в связи с чем наибольшее число
лоты (схема 2). Анализ ЯМР 1Н, 13С и масс-спек-
публикаций по синтезу и исследованию свойств
тров продукта реакции 9 указал на отсутствие
изатина и его производных относится к области
аминометильного заместителя в положении 1 ге-
фармацевтической химии
[9-12]. Производные
тероцикла. В масс-спектре соединения 9 присут-
изатина обладают высокой противовирусной,
ствовал пик катиона с массой 261. Спектры ЯМР
противогрибковой, антибактериальной, антипро-
1Н и 13С соединения 9 полностью совпадали с
лиферативной, противоопухолевой, противовос-
описанными ранее [25-27]. Из продуктов реакций
палительной, антидиабетической, антигипертен-
изатинов 3, 4 с реагентом 5 в чистом виде были
зивной и противосудорожной активностью (схема 1)
выделены 2-(пиперазин-1-ил)пиримидин и ципро-
[13-21].
флоксацин соответственно. Аналогичным образом
1326
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ ИЗАТИНОВ
1327
Схема 1.
Схема 2.
с реагентом 5 взаимодействуют 1-ацилизатины
присутствует пик молекулярного иона с m/z 392,
6-8. При этом циклическая структура изатина со-
соответствующий массе катиона соли 15.
храняется в отличие от ранее описанных реакций
С целью получения водорастворимых ацилги-
аминов и гидразидов с 1-ацилизатинами, протека-
дразонов изатина, обладающих выраженной анти-
ющих с раскрытием диоксиндольного цикла [28].
микробной активностью [29-35], нами был полу-
В отличие от соединений 1-4 и 6-8 производное
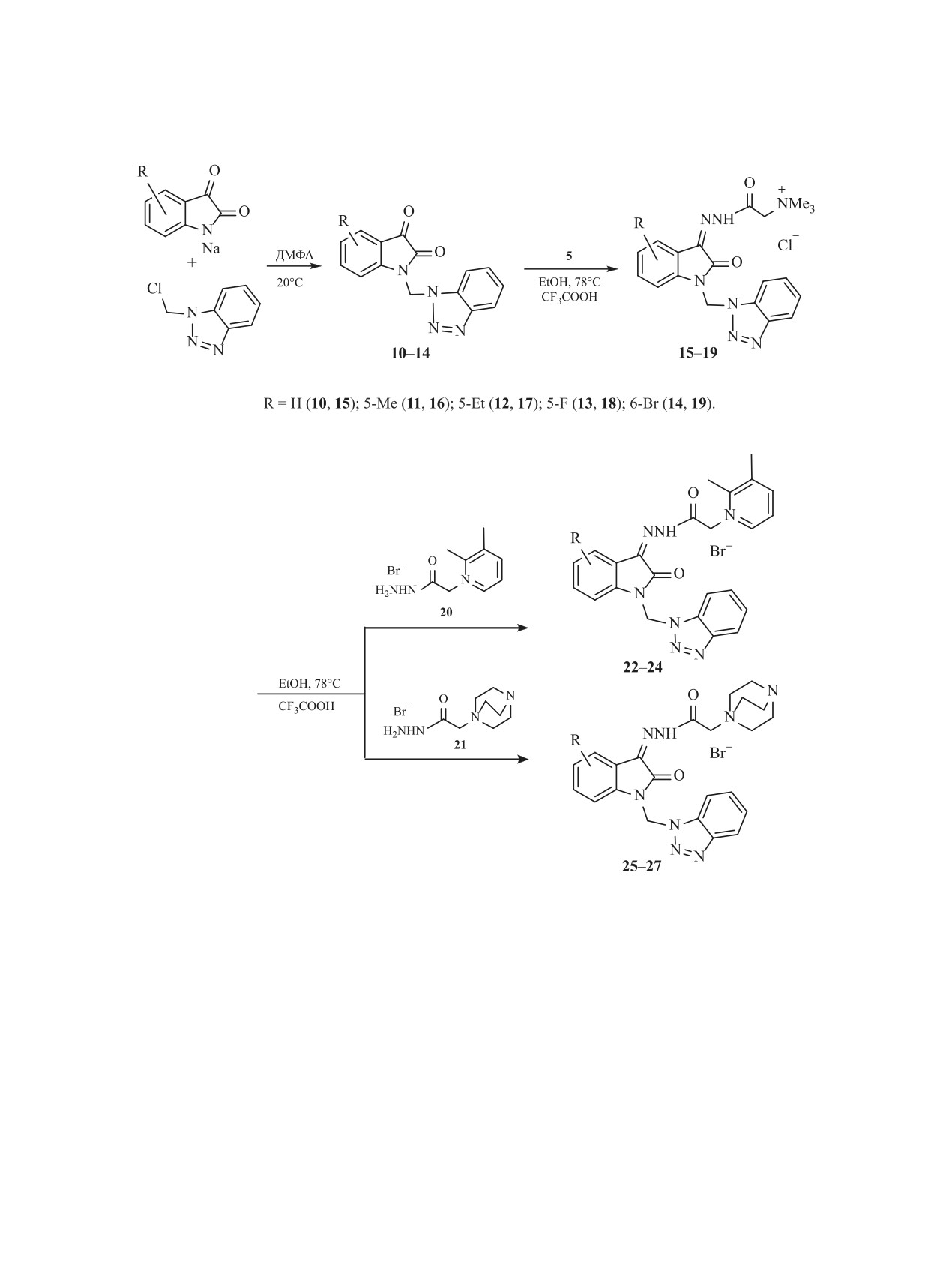
чен ряд бензотриазольных производных изатина
изатина 10 c бензотриазольным фрагментом взаи-
11-14 с электронодонорными и электроноакцеп-
модействует с реагентом Жирара Т в аналогичных
торными заместителями в бензофрагменте изати-
условиях [27] с сохранением заместителя в поло-
на алкилированием натриевых солей замещенных
жении 1 и образованием с высоким выходом гидра-
изатинов 1-(хлорметил)бензотриазолом. На осно-
зона 15. Сохранение в структуре продукта реакции
ве соединений 11-14 с высокими выходами были
1-ариламинометильного заместителя подтвержда-
получены водорастворимые гидразоны 15-19 с
ется наличием в спектре ЯМР 1Н восьми сигналов
триметиламиниевой группой в ацильном остатке
в слабом поле, соответствующими ароматическим
гидразона (схема 3).
протонам индольного и триазольного фрагментов,
Полученные нами ранее результаты указыва-
а также синглетом протонов метиленового спейсе-
ра при 6.61 м. д. Метиленовые и метильные про-
ют на влияние строения катионного центра и за-
тоны гидразонного фрагмента в спектре ЯМР 1Н
местителей в ароматическом фрагменте на селек-
проявляются в виде синглетов при 4.82 и 3.29 м. д.
тивность и уровень антимикробной активности
соответственно. В масс-спектре соединения
15
Nʹ-(изатин-3-илиден)ацилгидразидов с четвер-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1328
БОГДАНОВ и др.
Схема 3.
Схема 4.
+
+
10, 11, 13
+
+
тичным атомом азота в ацильной группе [33-35].
Сохранение изоиндольного заместителя в
Принимая это во внимание, мы синтезировали
структуре полученного гидразона 29 доказано ме-
ацилгидразоны 22-27 с фрагментами 2,3-диметил-
тодами ЯМР 1Н и 13С, состав - данными масс-спек-
трометрии и элементного анализа. В спектре ЯМР
пиридиния 20 или монокватернизированного ди-
1Н соединения 29 в области слабого поля, кроме
азабициклооктана 21 (схема 4).
трех сигналов ароматических протонов 2-оксо-
В продолжение исследования влияния строе-
индол-3-илиденовой группы, присутствует слож-
ния аминометильного заместителя в положении
ный мультиплет в области 7.87-7.91 м. д. с инте-
1 изатина на направление реакции во взаимодей-
гральной интенсивностью 4Н, соответствующий
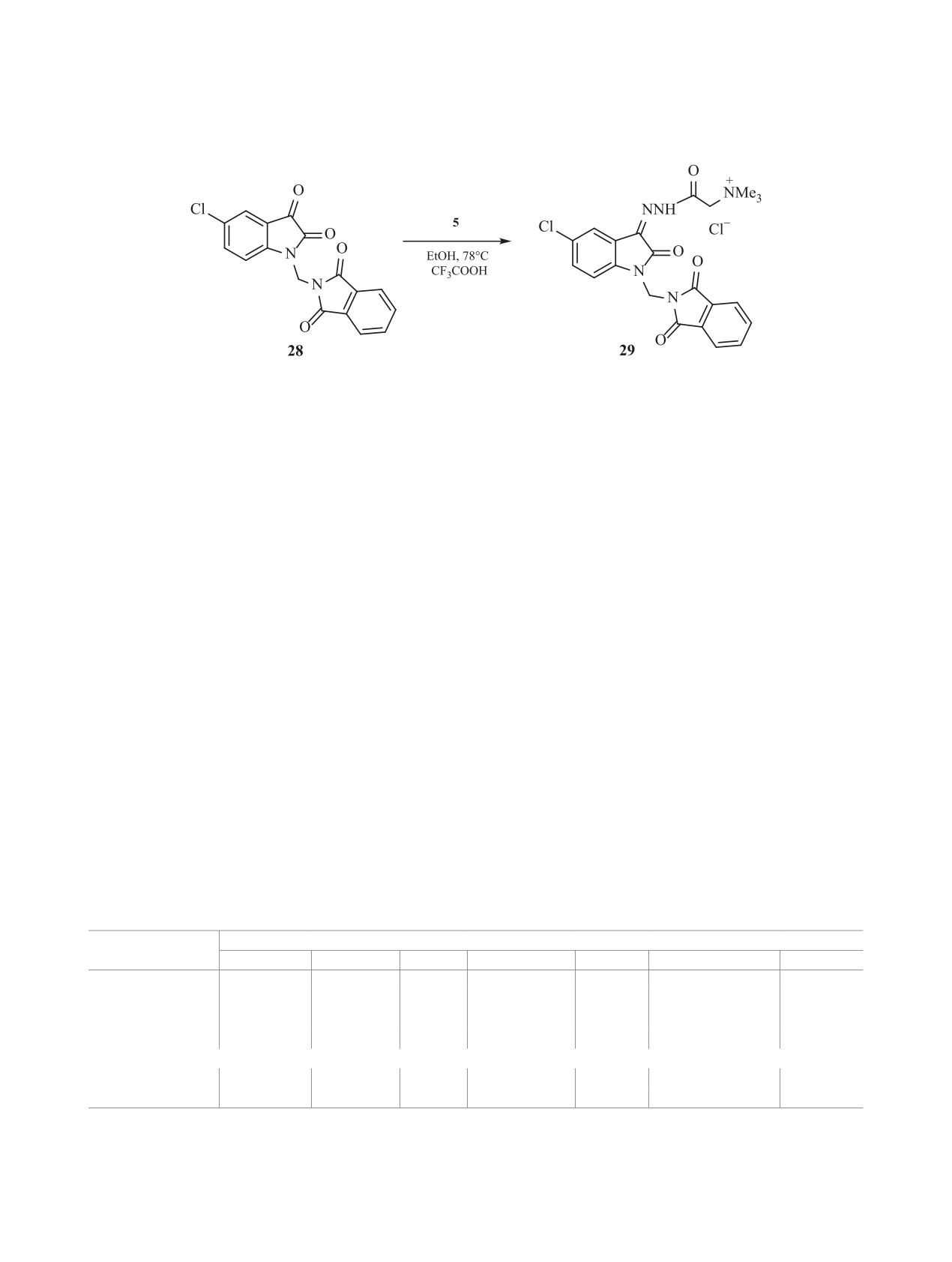
ствие с реагентом Жирара Т 5 был введен изатин
резонансу протонов
1,3-диоксоизоиндольного
28, замещенный 1,3-диоксоизоиндолилметильным
фрагмента. Протоны метиленовой связки между
фрагментом в положении 1 (схема 5).
гетероциклами проявляются в виде синглета при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ ИЗАТИНОВ
1329
Схема 5.
5.60 м. д. В спектре ЯМР 13С в области слабого
соединений
22-27 в отношении эритроцитов
поля присутствуют три сигнала при 159.79, 161.98
крови человека в диапазоне концентраций 125-
и 166.97 м. д., относящиеся к атомам углерода кар-
3.9 мкг/мл показала, что исследуемые соедине-
бонильных групп. Последний сигнал имеет вы-
ния не обладают высокой гемолитической актив-
сокую интенсивность, что позволяет приписать
ностью в концентрациях ≤ 62.5 мкг/мл, при кото-
его карбонильным группам изоиндола. В спектре
рых вызываемый ими гемолиз не превышает 2%
ЯМР 13С-{dept} проявляются 5 сигналов прото-
(табл. 2). Токсическое действие соединений 22-27
нированных ароматических атомов углерода, два
в отношении эритроцитов крови человека на 2-3
сигнала двух метиленовых атомов углерода и один
порядка ниже, чем у Грамицидина С. Поэтому
интенсивный сигнал метильных атомов углерода
имеются хорошие перспективы исследования но-
при 53.51 м. д.
вых соединений на предмет проявления ими про-
тивоопухолевых, противотуберкулезных и других
Производные изатина 10-14 и ацилгидразоны
видов активности, поскольку многие производные
на их основе были исследованы на антимикроб-
бензотриазола обладают широким спектром био-
ную (бактериостатическую, фунгистатическую,
логической активности [36, 37].
бактерицидную и фунгицидную) активность in
vitro в диапазоне концентраций 500-0.97 мкг/мл
Таким образом, реакция 1-ацилизатинов с ре-
(табл. 1). Из всего ряда новых соединений умерен-
агентом Жирара Т протекает с сохранением пя-
ную активность в отношении S. aureus 209p и B.
тичленного цикла и с отщеплением ацильного
cereus 8035 проявили производное изатина 10 и
заместителя. Взаимодействие
1-(аминометил)
гидразон на его основе 15, не содержащие заме-
изатинов с
2-(триметиламиний)замещенными
стителя в ароматическом фрагменте изатина. По
ацетогидразидами может протекать по двум на-
бактериостатическому действию соединение
10
правлениям. Если аминометильный заместитель
превосходит контроль в отношении S. aureus 209p
представляет собой насыщенный цикл или явля-
в 2 раза, а в отношении B. cereus 8035 находится
ется ациклическим, реакция протекает аналогично
на его уровне. Оценка гемолитического действия
1-ацилизатинам; если же атом азота аминометиль-
Таблица 1. Антимикробная активность соединений 10 и 15a
MIC, мкг/мл
Соединение
S. aureus
B. сereus
E. coli
P. aeruginosa
A. niger
T. mentagrophytes
C. аlbicans
10
31.3
62.5
>500
>500
>500
>500
125
15
250
>500
>500
>500
>500
>500
>500
Хлорамфеникол
62.5
62.5
125
-
-
-
-
Кетоконазол
-
-
-
-
-
3.9
3.9
Бактерицидная и фунгицидная активность
10
31.3
250
>500
>500
>500
>500
>500
15
250
>500
>500
>500
>500
>500
>500
a Соединения 11-14, 16-19, 22-27, 29 не проявили активности.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1330
БОГДАНОВ и др.
Таблица 2. Гемолитическое действие соединений 22-27 (с = 125-3.9 мкг/л)
Гемолиз, %
Соединение
125 ± 10
62.5 ± 5.3
31.3 ± 2.7
15.6 ± 1.2
7.8 ± 0.6
3.9 ± 0.3
22
0.3 ± 0.03
0
0
0
0
0
23
0.5 ± 0.04
0
0
0
0
0
24
0
0
0
0
0
0
25
0
0
0
0
0
0
26
1.9 ± 0.2
0.9 ± 0.05
0.1 ± 0.01
0.3 ± 0.02
0
0
27
0.9 ± 0.06
0.7 ± 0.07
0
0
0
0
Грамицидин С
100.0 ± 9.2
99.2 ± 7.8
98.2 ± 8.4
24.2 ± 2.2
1.5 ± 0.1
0.50 ± 0.03
ного заместителя входит в сопряженный цикл, то
(J, Гц): 7.86-7.84 м (1Н, Н4), 7.83-7.67 м (4Н, Н6,
отщепления не происходит. Полученные соедине-
Н7, Н11), 7.54 д (2Н, Н12, 3JНН = 8.4), 7.39 д. д. д
ния имеют низкую гемолитическую активность
(1Н, Н12, 3JНН = 7.6, 3JНН = 7.5, 4JНН = 0.8), 4.66
и перспективны для исследования на различные
с (CН2Cl). Масс-спектр (MAЛДИ), m/z: 300 [M +
виды биологической активности.
Н]+. Найдено, %: C 63.90; H 3.15; Cl 11.60; N 4.48.
C16H10ClNO3. Вычислено, %: C 64.12; H 3.36; Cl
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
11.83; N 4.67.
ИК спектры записаны на спектрометре Bruker
N,N,N-Триметил-2-оксо-2-[2-(2-оксо-1,2-ди-
Vector-22 для суспензий веществ между пластина-
гидро-3H-индол-3-илиден)гидразинил]этан-
ми KBr. Спектры ЯМР 1H и 13C зарегистрированы
1-аминия хлорид
(9). К смеси производного
на приборе Bruker Avance-400 (400 и 100.6 МГц
1-(аминометил)изатина
1-4 или
1-ацилизатина
соответственно) и Bruker Avance-600
(600 и
6-8 (5 ммоль) и реагента Жирара Т 5 (5 ммоль)
150.9 МГц соответственно). Химические сдвиги
в 7 мл абсолютного этанола добавляли 3 капли
приведены относительно остаточных сигналов
трифторуксусной кислоты. Реакционную массу
дейтерированного растворителя. Температуры
нагревали при кипении растворителя 2 ч. После
плавления измеряли на приборе SMP10 Stuart, эле-
самопроизвольного охлаждения раствора до ком-
ментный анализ проводили с использованием ана-
натной температуры осадок соединения 9 отфиль-
лизатора CHNS-3.
тровывали, промывали абсолютным диэтиловым
Гидразиды 20, 21 [38] и производные изатина
эфиром и сушили в вакууме (12 мм рт. ст.). Выход
1-4, 7 [39-41] получены по описанным ранее ме-
93%, желтый порошок, т. пл. 183°С (т. пл. 185°С
тодикам.
[25-27]). Все физико-химические характеристики
(спектры MALDI, ИК и ЯМР) полностью совпада-
1-[4-(Хлорметил)бензоил]-1Н-индол-2,3-ди-
ли с описанными ранее.
он (8). К раствору 1.47 г (10 ммоль) изатина в
20 мл ДМФА при перемешивании при комнат-
Общая методика синтеза производных иза-
ной температуре добавляли 0.42 г гидрида натрия
тина 10-14. К раствору изатина или его 5-заме-
(10 ммоль, 60%-ная суспензия в минеральном
щенного производного (10 ммоль) в 20 мл ДМФА
масле). Через 30 мин в реакционную массу при
при перемешивании при 10°C добавляли 0.42 г
охлаждении водяной баней со льдом медленно
(10 ммоль, 60%-ная суспензия в минеральном
прибавляли 1.89 г (10 ммоль) 4-(хлорметил)бен-
масле) гидрида натрия. Через 30 мин к реакцион-
зоилхлорида. Полученный раствор перемешивали
ной массе при 25°С добавляли 1.68 г (10 ммоль)
1-(хлорметил)-1H-бензо[d][1,2,3]триазола. Полу-
1 ч при 25°С, затем выливали в смесь 50 г льда
ченный раствор перемешивали при 25°С 1 ч, затем
и 50 мл воды. После самопроизвольного нагрева-
выливали в смесь 50 г льда и 50 мл воды. После
ния раствора до 25°С желтый осадок отфильтро-
самопроизвольного нагревания раствора до 25°С
вывали, промывали диэтиловым эфиром и суши-
осадок отфильтровывали, промывали диэтиловым
ли в вакууме (18 мм рт. ст.). Выход 2.48 г (83%),
эфиром и сушили в вакууме (18 мм рт. ст.).
т. пл. 159°С. ИК спектр, ν, см-1: 2910 (С-Н), 1716
(C=O), 1618 (C=C), 1529, 1455, 1347, 1291, 1155,
1-[(1H-Бензо[d][1,2,3]триазол-1-ил)метил]-
1023, 888, 839. Спектр ЯМР 1Н (СDCl3), δ, м. д.
1Н-индол-2,3-дион (10). Выход 2.34 г
(84%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ ИЗАТИНОВ
1331
оранжевый порошок, т. пл. 188°С. ИК спектр, ν,
C 66.51; H 4.49; N 18.03. C17H14N4O2. Вычислено,
см-1: 2998 (С-Н), 2824 (С-Н), 1747 (C=O), 1614
%: C 66.66; H 4.61; N 18.29.
(C=C), 1470, 1358, 1343, 1305, 1278, 1210, 1158,
1-[(1H-Бензо[d][1,2,3]триазол-1-ил)метил]-
1095, 768, 749. Спектр ЯМР 1Н (СDCl3), δ м. д. (J,
5-фтор-1Н-индол-2,3-дион
(13). Выход
2.81 г
Гц): 8.03 уш. д (1H, Н13, 3JНН = 8.4), 7.86 д (1H,
(95%), т. пл. 132°С. ИК спектр, ν, см-1: 3061 (С-Н),
Н10, 3JНН = 8.4), 7.66-7.62 м (2H, Н4, Н6), 7.60 уш.
2931 (С-Н), 1755 (C=O), 1625 (C=C), 1487, 1335,
д (1H, Н7, 3JНН = 6.9), 7.53 д. д. д (1H, Н12, 3JНН =
1269, 1199, 821, 737. Спектр ЯМР 1Н (СDCl3), δ,
7.3, 3JНН = 7.2, 4JНН = 0.7), 7.39 д. д. д (1H, Н11,
м. д. (J, Гц): 8.05 уш. д (1Н, 3JНН = 8.4), 7.85 д (1Н,
3JНН = 7.3, 3JНН = 7.2, 4JНН = 0.6), 7.16 д. д. д (1H,
3JНН = 8.4), 7.64 д. д (1Н, 3JНН = 8.6, 4JFН = 3.6),
Н5, 3JНН = 6.7, 3JНН = 6.5, 4JНН = 1.9), 6.54 с (2H,
7.85 уш. д. д (1Н, 3JНН = 7.8, 3JНН = 7.4), 7.39–7.43
CН2). Спектр ЯМР 13С (СDCl3), δС, м. д. (J, Гц)
м (1Н), 7.38 д. д. д (1Н, 3JFН = 8.6, 3JНН = 8.6, 4JНН =
(в скобках приведен вид сигнала в спектре ЯМР
2.6), 7.32 д. д (1Н, 3JFН = 6.4, 4JНН = 2.6), 6.54 с (2Н,
13С{1Н}): 181.45 д (с) (С3, 3JНС = 3.3), 157.96 т (с)
CН2). Масс-спектр (MAЛДИ), m/z: 297 [M + H]+.
(С2, 3JНС = 2.9), 148.65 м (с) (С7а), 146.10 д. д (с)
Найдено, %: C 60.61; H 2.90; N 18.83. C15H9FN4O2.
(С14, 3JНС = 10.0, 3JНС = 9.6), 138.91 д. д. д (с) (С6,
Вычислено, %: C 60.81; H 3.06; N 18.91.
1JНС = 162.7, 3JНС = 7.8, 2JНС = 1.9), 132.04 м (с)
1-[(1H-Бензо[d][1,2,3]триазол-1-ил)метил]-6-
(С9), 128.68 д. д. д (с) (С11, 1JНС = 161.8, 3JНС = 8.0,
бром-1Н-индол-2,3-дион (14). Выход 3.21 г (90%),
2JНС = 1.4), 125.65 д. д (с) (С4, 1JНС = 166.1, 3JНС =
оранжевый порошок, т. пл. 204°С. ИК спектр, ν,
7.5), 124.90 д. м (с) (С12, 1JНС = 164.0), 124.80 д. д
см-1: 3078 (С-Н), 2925 (С-Н), 1763 (C=O), 1740
(с) (С5, 1JНС = 162.4, 3JНС = 7.8), 120.01 д. д (с) (С7,
(C=O), 1606 (C=C), 1431, 1353, 1193, 1060, 753.
1JНС = 166.1, 3JНС = 8.1), 117.51 д. д (с) (С3а, 3JНС =
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 7.98
8.3, 3JНС = 7.4), 111.79 уш. д. д (с) (С13, 3JНС = 7.9,
д (1Н, 3JНН = 8.0), 7.91 д (1Н, 3JНН = 8.3), 7.84 д
наложение с компонентой сигнала С10), 110.09 д. д.
(1Н, 4JНН = 1.5), 7.54 уш. д. д (1Н, 3JНН = 8.0, 3JНН =
д (с) (С10, 1JНС = 168.3, 3JНС = 8.3, 2JНС = 1.4), 50.87
8.3), 7.44 д (1Н, 3JНН = 7.9), 7.32 д. д. д (1Н, 3JНН =
т (с) (С8, 1JНС = 155.6). Найдено, %: C 64.74; H 3.62;
N 20.13. C15H10N4O2. Вычислено, %: C 64.60; H
8.0, 3JНН = 8.0, 4JНН = 1.4), 7.17 д. д (1Н, 3JНН =
3.51; N 20.02.
7.9, 4JНН = 1.5), 6.62 с (2Н, NСН2). Найдено, %: C
50.29; H 2.41; Br 22.20; N 15.58. C15H9BrN4O2. Вы-
1-[(1H-Бензо[d][1,2,3]триазол-1-ил)метил]-
числено, %: C 50.44; H 2.54; Br 22.37; N 15.69.
5-метил-1Н-индол-2,3-дион (11). Выход 2.71 г
(93%), оранжевый порошок, т. пл. 185°С. ИК
1-[(1,3-Диоксо-1,3-дигидро-2Н-изоиндол-
спектр (KBr), см-1: 3012 (С-Н), 2924 (С-Н), 1742
2-ил)метил]-5-xлор-1Н-индол-2,3-дион
(28). К
(C=O), 1726 (C=O), 1622 (C=C), 1492, 1334, 1206
раствору 1.5 г (8.3 ммоль) 5-хлоризатина в 20 мл
(N=N), 1131, 1060, 749. Спектр ЯМР 1Н (СDCl3), δ,
ДМФА при перемешивании при комнатной
м. д. (J, Гц): 8.04 д (1Н, 3JНН = 8.4), 7.86 д (1Н, 3JНН =
температуре добавляли 0.33 г гидрида натрия
8.3), 7.54 т (1Н, 3JНН = 7.7), 7.49 д (1Н, 3JНН = 8.1),
(13.8 ммоль, 60%-ная суспензия в минеральном
7.44-7.39 м (3Н), 6.53 с (2Н, CН2), 2.31 с (3Н, CН3).
масле). Через 30 мин к реакционной массе добав-
Масс-спектр (ЭУ), m/z: 332 [M + K]+. Найдено, %:
ляли 1.89 г (8.3 ммоль) 2-(бромметил)-1Н-изоин-
C 65.60; H 4.02; N 19.01. C16H12N4O2. Вычислено,
дол-1,3(2Н)-диона (2-бромметилфталимида). По-
%: C 65.75; H 4.14; N 19.17.
лученный раствор перемешивали 8 ч при 25°С,
1-[(1H-Бензо[d][1,2,3]триазол-1-ил)метил]-5-
затем выливали в смесь 50 г льда и 50 мл воды.
этил-1Н-индол-2,3-дион (12). Выход 2.72 г (89%),
После самопроизвольного нагревания раствора до
оранжевый порошок, т. пл. 154°С. ИК спектр, ν,
25°С оранжевый осадок отфильтровывали, про-
см-1: 2964 (С-Н), 2931 (С-Н), 1743 (C=O), 1620
мывали диэтиловым эфиром и сушили в вакууме
(C=C), 1489, 1358, 1346, 1206, 745. Спектр ЯМР
(18 мм рт. ст.). Выход 2.73 г (97%), т. пл. 210°С. ИК
1Н (СDCl3), δ, м. д. (J, Гц): 8.05 д (1Н, 3JНН =
спектр, ν, см-1: 2997 (C-H), 1765 (C=O), 1719 (C=O),
8.3), 7.87 д (1Н, 3JНН = 8.3), 7.56-7.51 м (2Н),
1697 (C=O), 1608 (C=C), 1481, 1437, 1315, 1300,
7.47-7.38 м (3Н), 6.53 с (2Н, NCН2), 2.60 к (2Н,
1151, 1101, 735. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.
3JНН = 7.6, CН2), 1.18 т (3Н, 3JНН = 7.6, CН3). Масс-
(J, Гц): 7.92-7.85 м (4Н), 7.79 д. д (1Н, Н6, 3JНН =
спектр (MAЛДИ), m/z: 307 [M + Н]+. Найдено, %:
8.6, 4JНН = 2.0), 7.54 д (1Н, Н4, 4JНН = 2.0), 6.92 д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1332
БОГДАНОВ и др.
(Н7, 3JНН = 8.4), 5.52 с (2Н, NCН2). Масс-спектр
порошок, т. пл. 245-247°С. ИК спектр, ν, см-1: 3421
(MAЛДИ), m/z: 341 [M + Н]+. Найдено, %: C 59.78;
(N-H), 3015 (C-H), 2945 (C-H), 1720 (C=O), 1693
H 2.47; Cl 10.29; N 8.03. C17H9ClN2O4. Вычислено,
(C=O), 1621 (C=C), 1455, 1344, 1208 (N=N), 1161,
%: C 59.93; H 2.66; Cl 10.41; N 8.22.
753. Спектр ЯМР 1Н (D2O-ДМСО-d6, 1:3), δ, м. д.
(J, Гц): 8.05 д (1Н, 3JНН = 8.3), 7.96 д (1Н, 3JНН =
Общая методика синтеза гидразонов 15-19,
22-27, 29. К смеси производного изатина 10-14,
8.3), 7.63 д. д (1Н, 3JНН = 7.9, 3JНН = 7.5), 7.46-7.41
28
(5 ммоль) и соответствующего гидразида
м (3Н), 7.35 д (1Н, 3JНН = 8.1), 6.70 с (2Н, NСН2),
4.88 уш. с [2Н, С(О)СН2], 3.30 с (9Н, СН3), 2.29 с
(5 ммоль) в 7 мл абсолютного этанола добавляли
(3Н, СН3). Масс-спектр (MAЛДИ), m/z: 406 [M -
3 капли трифторуксусной кислоты. Реакционную
массу нагревали при кипении растворителя 2 ч.
Сl]+. Найдено, %: C 56.89; H 5.35; Cl 7.92; N 22.03.
После самопроизвольного охлаждения раствора
C21H24ClN7O2. Вычислено, %: C 57.08; H 5.47; Cl
до комнатной температуры осадок отфильтровы-
8.02; N 22.19.
вали, промывали абсолютным диэтиловым эфи-
2-{2-[1-(1H-Бензо[d][1,2,3]триазол-1-илме-
ром и сушили в вакууме (12 мм рт. ст.).
тил)-2-оксо-5-этил-1,2-дигидро-3H-индол-3-
2-{2-[1-(1H-Бензо[d][1,2,3]триазол-1-илме-
илиден]гидразинил}-N,N,N-триметил-2-оксо-
тил)-2-оксо-1,2-дигидро-3H-индол-3-илиден]-
этан-1-аминия хлорид (17). Выход 88%, желтый
гидразинил}-N,N,N-триметил-2-оксоэтан-1-
порошок, т. пл. 240-242°С. ИК спектр, ν, см-1: 3399
аминия хлорид (15). Выход 92%, желтый по-
(N-H), 3011 (C-H), 2942 (C-H), 1720 (C=O), 1694
рошок, т. пл. 228°С (разл.). ИК спектр, ν, см-1:
(C=O), 1620 (C=C), 1489, 1347, 1278, 1232, 1208
3430, 3017, 1693, 1612, 1452, 1404, 1354, 1281,
(N=N), 1160, 751. Спектр ЯМР 1Н (D2O-ДМСО-d6,
1227, 1209, 1167, 1136, 756. Спектр ЯМР 1Н (D2O-
2:3), δ, м. д. (J, Гц): 8.05 д (1Н, 3JНН = 8.4), 7.97 д
ДМСО-d6, 1:1), δ, м. д. (J, Гц): 7.94 д (1H, Н13, 3JНН =
(1Н, 3JНН = 8.4), 7.63 д. д (1Н, 3JНН = 7.6, 3JНН = 7.6),
8.4), 7.90 д (1H, Н4, 3JНН = 8.3), 7.57 д. д (1H, Н5,
7.47 уш. с (1Н), 7.46-7.43 м (2Н), 7.38 д (1Н, 3JНН =
3JНН = 8.3, 3JНН = 7.8), 7.53 д (1H, Н7, 3JНН = 7.8),
8.1), 6.71 с (2Н, NСН2), 4.90 уш. с [2Н, С(О)СН2],
7.46-7.43 м (2H, Н10, Н12), 7.39 д. д (1H, Н6, 3JНН =
3.30 с (9Н, СН3), 2.59 к (2Н, 3JНН = 7.5, СН2), 1.13 т
7.9, 3JНН = 7.5), 7.13-7.09 м (1H, Н11), 6.61 с (2H,
(3Н, 3JНН = 7.6, СН3). Масс-спектр (MAЛДИ), m/z:
NСН2), 4.82 уш. с (2H, С(О)СН2), 3.29 с (3H, СН3).
420 [M - Сl]+. Найдено, %: C 57.86; H 5.61; Cl 7.65;
Спектр ЯМР 13С (D2O-ДМСО-d6, 1:1), δ, м. д. (J,
N 21.39. C22H26ClN7O2. Вычислено, %: C 57.95; H
Гц): 167.05 м (с) (С=О), 161.21 м (с) (С=О), 145.79
5.75; Cl 7.78; N 21.50.
д. д (с) (С14, 3JНС = 9.9, 3JНС = 9.9), 142.30 м (с)
2-{2-[1-(1H-Бензо[d][1,2,3]триазол-1-илме-
(С7a), 135.20 м (с) (С9), 133.26 уш. д (с) (С4, 1JНС =
тил)-2-оксо-5-фтор-1,2-дигидро-3H-индол-3-
164.9), 133.09 м (с) (С3), 129.59 д. д (с) (С11, 1JНС =
илиден]гидразинил}-N,N,N-триметил-2-оксо-
163.5, 3JНС = 8.0), 126.10 д. д (с) (С12, 1JНС = 164.8,
этан-1-аминия xлорид (18). Выход 94%, жел-
3JНС 7.1), 125.27 д. д (с) (С6, 1JНС = 161.7, 3JНС =
тый порошок, т. пл. 237°С. ИК спектр, ν, см-1:
4.5), 122.44 уш. д (с) (С5, 1JНС = 164.2), 120.01 м (с)
3447 (N-H), 3377 (N-H), 3015 (С-Н), 2940 (С-Н),
(С3a), 119.61 д. д (с) (С7, 1JНС = 166.7, 3JНС = 7.9),
1702 (C=O), 1622 (C=C), 1487, 1276, 1176, 979,
111.57 д. м (с) (С13, наложение на компоненты сиг-
759. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц):
нала С10), 110.09 д. м (с) (С10, наложение на компо-
12.45 уш. с (1Н, NН), 8.08 д (1Н, 3JНН = 8.4), 8.01
ненты сигнала С13), 63.02 уш. т (с) (N+СН2, 1JНС =
д (1Н, 3JНН = 8.4), 7.65 д. д (1Н, 3JFН = 7.7, 3JНН =
147.8), 54.91 к (с) (NСН3, 1JНС = 145.1), 51.18 т (с)
7.6), 7.61 д. д (1Н, 4JFН = 3.9, 3JНН = 8.8), 7.54 уш.
(NСН2, 1JНС = 157.6). Масс-спектр (MAЛДИ), m/z:
с (1Н), 7.45 м (2Н), 6.79 с (2H, NСН2), 4.93 уш. с
392 [M - Cl]+. Найдено, %: C 56.14; H 5.18; Cl 8.29;
(2H, С(О)СН2), 3.33 с (9H, NСН3). Спектр ЯМР
N 22.91. C20H22ClN7O2. Вычислено, %: C 55.98; H
13С{1Н} (ДМСО-d6), δС, м. д. (J, Гц): 160.91 д
5.07; Cl 8.18; N 22.81.
(С5, 1JFС = 126.2), 160.32 с (С=О), 157.93 с (С=О),
2-{2-[1-(1H-Бензо[d][1,2,3]триазол-1-илме-
145.15 с (С14), 138.12 д (С7a, 4JFС = 1.5), 132.35 с
тил)-5-метил-2-оксо-1,2-дигидро-3H-индол-3-
(С9), 128.20 с (С13), 124.65 с (С10), 120.46 д (С3a,
илиден]гидразинил}-N,N,N-триметил-2-оксо-
3JFС = 9.4), 119.31 с (С11), 118.58 д (С6, 2JFС = 24.4),
этан-1-аминия хлорид (16). Выход 92%, желтый
112.46 д (С7, 3JFС = 8.0), 110.90 с (С12), 108.38 д (С4,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ ИЗАТИНОВ
1333
2JFС 16.0), 56.06 с (N+СН2), 53.64 с (NСН3), 50.43
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
с (NСН2). Масс-спектр (MAЛДИ), m/z: 410 [M -
метил]-5-метил-2-оксо-1,2-дигидро-3H-индол-
Cl]+. Найдено, %: C 53.71; H 4.59; Cl 7.83; N 21.87.
3-илиден}гидразинил)-2-оксоэтил]-2,3-диме-
C20H21ClFN7O2. Вычислено, %: C 53.87; H 4.75; Cl
тилпиридиния бромид (23). Выход 75%, желтый
7.95; N 21.99.
порошок, т. пл. 220°С (разл.). ИК спектр, ν, см-1:
3430 (N-H), 3015 (C-H), 1694 (C=O), 1618 (С=С),
2-{2-[1-(1H-Бензо[d][1,2,3]триазол-1-илме-
1491, 1450, 1340, 1250 (N=N), 1206, 1159, 1037, 749.
тил)-6-бром-2-оксо-1,2-дигидро-3H-индол-3-
Спектр ЯМР 1Н (CDCl3-ДМСО-d6, 2:1), δ, м. д. (J,
илиден]гидразинил}-N,N,N-триметил-2-оксо-
Гц): 12.60 с (1H, NН), 8.95 д (1H, Н13, 3JНН = 5.9),
этил-1-аминия xлорид (19). Выход 97%, желтый
7.99-7.94 м (2Н), 7.89 д. д. д (1H, Н17, 3JНН = 8.6,
порошок, т. пл. 236°С. ИК спектр, ν, см-1: 3424
3JНН = 6.5, 4JНН = 1.0), 7.58-7.54 м (1H), 7.47-7.44
(N-H), 2998 (C-H), 2959 (C-H), 1733 (C=O), 1704
м (2Н, Н10), 7.40-7.36 м (1Н), 7.29 д (1H, Н7, 3JНН =
(C=O), 1610 (C=C), 1482, 1456, 1366, 1277, 1225
7.8), 6.69 с (2H, NСН2), 6.22 с [2H, С(О)СН2], 2.66 с
(N=N), 1173, 1065, 757. Спектр ЯМР 1Н (D2O-
(3H, СН3), 2.56 с (3H, СН3), 2.31 с (3H, СН3). Масс-
ДМСО-d6, 2:3), δ, м. д. (J, Гц): 8.06 д (1Н, 3JНН = 8.3),
спектр (MAЛДИ), m/z: 454 [M - Br]+. Найдено, %:
7.98 д (1Н, 3JНН = 8.4), 7.82 д (1Н, 4JНН = 1.3), 7.64
C 55.89; H 4.32; Br 14.70; N 18.19. C25H24BrN7O2.
д. д (1Н, 3JНН = 7.6, 3JНН = 7.6), 7.58 д (1Н, 3JНН =
Вычислено, %: C 56.19; H 4.53; Br 14.95; N 18.35.
8.2), 7.46 д. д (1Н, 3JНН = 7.9, 3JНН = 7.8), 7.43 д. д
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
(1Н, 3JНН = 8.2, 4JНН = 1.3), 6.75 с (2Н, NСН2), 4.87
метил]-2-оксо-5-фтор-1,2-дигидро-3H-индол-3-
уш. с [2H, С(О)СН2], 3.28 с (9Н, СН3). Масс-спектр
илиден}гидразинил)-2-оксоэтил]-2,3-диметил-
(MAЛДИ), m/z: 470 [M - Cl]+. Найдено, %: C 47.29;
пиридиния бромид (24). Выход 75%, желтый по-
H 4.01; Br 15.60; Cl 6.89; N 19.19. C20H21BrClN7O2.
рошок, т. пл. 197°С (разл.). ИК спектр, ν, см-1: 3443
Вычислено, %: C 47.40; H 4.18; Br 15.77; Cl 7.00;
(N-H), 3015 (C-H), 1701 (C=O), 1618 (С=С), 1484,
N 19.35.
1449, 1372, 1259 (N=N), 1176, 1033, 749. Спектр
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
ЯМР 1Н (CDCl3-ДМСО-d6, 2:1), δ, м. д. (J, Гц):
метил]-2-оксо-1,2-дигидро-3H-индол-3-илиден}-
12.59 с (1Н, NН), 9.00 д (1Н, 3JНН = 5.8), 8.37 д (1Н,
гидразинил)-2-оксоэтил]-2,3-диметилпириди-
3JНН = 6.5), 7.96 д (1Н, 3JНН = 8.4), 7.92 д (1Н, 3JНН =
ния бромид (22). Выход 96%, желтый порошок,
8.3), 7.86-7.82 м (2Н), 7.50-7.56 м (1Н), 7.55-7.51
т. пл. 192°С (разл.). ИК спектр, ν, см-1: 3419 (N-H),
м (1Н), 7.42-7.35 м (2Н), 7.23-7.18 м (1Н), 6.67 с
3011 (C-H), 1701 (C=O), 1614 (С=С), 1493, 1469,
(2Н, NСН2), 6.27 с [2Н, С(О)СН2], 2.66 с (3Н, СН3),
1356, 1247 (N=N), 1170, 1101, 796. Спектр ЯМР 1Н
2.55 с (3Н, СН3). Масс-спектр (MAЛДИ), m/z: 458
(CDCl3-ДМСО-d6, 1:10) δ, м. д. (J, Гц): 12.59 с (1H,
[M - Br]+. Найдено, %: C 53.40; H 3.75; Br 14.69;
NН), 8.90 уш. с (1H, Н13), 8.49 д (1H, Н15, 3JНН =
F 3.38; N 18.01. C24H21BrFN7O2. Вычислено, %: C
7.6), 8.05 д (1H, Н17, 3JНН = 8.1), 8.02 д (1H, Н10,
53.54; H 3.93; Br 14.84; F 3.53; N 18.21.
3JНН = 8.1), 7.95 д. д (1H, Н16, 3JНН = 7.1, 3JНН =
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
6.8), 7.67-7.59 м (3H, Н11, Н12, Н7), 7.56 д. д (1H, Н6,
метил]-2-оксо-1,2-дигидро-3H-индол-3-илиден}-
3JНН = 7.5, 3JНН = 7.2), 7.44 д. д (1H, Н5, 3JНН = 7.6,
гидразинил)-2-оксоэтил]-4-аза-1-азониабицик-
3JНН = 7.3), 7.24 уш. с (1H, Н4), 6.79 с (2H, NСН2),
ло[2.2.2]октанбромид (25). Выход 87%, желтый
6.23 с [2H, С(О)СН2], 2.66 с (3H, СН3), 2.54 с (3H,
порошок, т. пл. 205°С (разл.). ИК спектр, ν, см-1:
СН3). Спектр ЯМР 13С-{1H} (CDCl3-ДМСО-d6, 1 :
3403 (N-H), 2932 (C-H), 1724 (C=O), 1707 (C=O),
10), δ, м.д. (J, Гц): 166.95 с (С=О), 160.37 с (С=О),
1614 (С=С), 1469, 1353, 1247 (N=N), 1175, 1102,
155.69, 146.64 (СН), 145.12 (СН), 144.71, 144.69,
1056, 795, 749. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.
141.64, 138.31 (СН), 134.33, 132.22, 132.08 (СН),
(J, Гц): 12.46 с (1Н, NН), 8.08 д (1Н, 3JНН = 6.9),
128.04 (СН), 124.51 (СН), 124.42 (СН),
123.98
8.01 д (1Н, 3JНН = 8.3), 7.69-7.63 м (2Н), 7.61-7.55
(СН), 120.95 (СН), 119.22 (СН), 118.76,
110.66
м (2Н), 7.47-7.45 м (1Н), 7.24 д. д (1Н, 3JНН = 6.6,
(СН), 59.11 (N+СН2), 50.32 (NСН2), 19.26 (СН3),
3JНН = 6.2), 6.79 с (2Н, NСН2), 4.87 с [2Н, С(О)СН2],
16.79 (СН3). Масс-спектр (MAЛДИ), m/z: 440 [M -
3.69-3.63 м (6Н, СН2), 3.19-3.14 м (6Н, СН2). Масс-
Br]+. Найдено, %: C 55.21; H 4.09; Br 15.17; N
спектр (MAЛДИ), m/z: 445 [M - Br]+. Найдено, %:
18.73. C24H22BrN7O2. Вычислено, %: C 55.39; H
C 52.39; H 4.65; Br 15.02; N 21.21. C23H25BrN8O2.
4.26; Br 15.35; N 18.84.
Вычислено, %: C 52.58; H 4.80; Br 15.21; N 21.33.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1334
БОГДАНОВ и др.
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
112.61 (СН), 62.97 (N+СН2), 53.51 (NСН3), 42.25
метил]-5-метил-2-оксо-1,2-дигидро-3H-индол-
(NСН2). Масс-спектр (MAЛДИ), m/z: 454 [M - Cl]+.
3-илиден}гидразинил)-2-оксоэтил]-4-аза-1-азо-
Найдено, %: C 53.65; H 4.23; Cl 14.29; N 14.08.
ниабицикло[2.2.2]октанбромид (26). Выход 93%,
C22H21Cl2N5O4. Вычислено, %: C 53.89; H 4.32; Cl
желтый порошок, т. пл. 231°С (разл.). ИК спектр,
14.46; N 14.28.
ν, см-1: 3403 (N-H), 2947 (C-H), 1696 (C=O), 1621
БЛАГОДАРНОСТЬ
(С=С), 1491, 1341, 1249 (N=N), 1207, 1173, 1057,
Авторы благодарят Коллективный спектро-ана-
837, 746. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J,
литический центр физико-химических исследова-
Гц): 12.48 с (1Н, NН), 8.08 д (1Н, 3JНН = 8.1), 8.00
ний строения, свойств и состава веществ и мате-
д (1Н, 3JНН = 8.3), 7.65 д. д (1Н, 3JНН = 7.7, 3JНН =
риалов Федерального исследовательского центра
7.4), 7.50-7.44 м (3Н), 7.39 д (1Н, 3JНН = 8.2), 6.76 с
«Казанский научный центр РАН» за техническую
(2Н, NСН2), 4.89 с [2Н, С(О)СН2], 3.77-3.65 м (6Н,
поддержку проведенных исследований.
СН2), 3.27-3.22 м (6Н, СН2), 2.32 с (3Н, СН3). Масс-
спектр (MAЛДИ), m/z: 459 [M - Br]+. Найдено, %:
КОНФЛИКТ ИНТЕРЕСОВ
C 53.26; H 4.86; Br 14.65; N 20.59. C24H27BrN8O2.
Авторы заявляют об отсутствии конфликта
Вычислено, %: C 53.44; H 5.05; Br 14.81; N 20.77.
интересов.
1-[2-(2-{1-[(1H-Бензо[d][1,2,3]триазол-1-ил)-
СПИСОК ЛИТЕРАТУРЫ
метил]-2-оксо-5-фтор-1,2-дигидро-3H-индол-3-
илиден}гидразинил)-2-оксоэтил]-4-аза-1-азони-
1.
Bogdanov A.V., Musin L.I., Mironov V.F. // Arkivoc
абицикло[2.2.2]октанбромид (27). Выход 91%,
2015. Vol. 6. P. 362. doi 10.3998/ark.5550190.p009.090
желтый порошок, т. пл. 205°С (разл.). ИК спектр,
2.
Randell N.M., Kelly T.L. // Chem. Rec. 2018. Vol. 18.
P. 1. doi 10.1002/tcr.201800135
ν, см-1: 3377 (N-H), 2931 (C-H), 1701 (C=O), 1622
3.
Lin Y.-Ch., Chen F.-H., Chiang Y.-Ch., Chueh Ch.-
(С=С), 1480, 1338, 1277, 1248 (N=N), 1177, 1029,
Ch., Chen W.-Ch. // ACS Appl. Mater. Interfaces 2019.
838, 759. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J,
Vol. 11. P. 34158. doi 10.1021/acsami.9b10943
Гц): 12.42 с (1Н, NН), 8.08 д (1Н, 3JНН = 8.2), 8.01 д
4.
Lee Ju., Shin E.-S., Kim Y.-J., Noh Yo.-Yo., Yang Ch. //
(1Н, 3JНН = 8.3), 7.66-7.56 м (3Н), 7.47-7.44 м (2Н),
J. Mater. Chem. C. 2020. Vol. 8. P. 296. doi 10.1039/
6.79 с (2Н, NСН2), 4.83 с [2Н, С(О)СН2], 3.68-3.61
c9tc05641f
м (6Н, СН2), 3.18-3.12 м (6Н, СН2). Масс-спектр
5.
Zhang G., Chen R., Sun Y., Kang B., Sun M., Lu H., Qiu L.,
(MAЛДИ), m/z: 463 [M - Br]+. Найдено, %: C 50.62;
Cho K., Ding Yu. // J. Mater. Chem. C. 2020. Vol. 8.
H 4.29; Br 14.50; F 3.29; N 20.45. C23H24BrFN8O2.
P. 1398. doi 10.1039/c9tc05374c
Вычислено, %: C 50.84; H 4.45; Br 14.70; F 3.50;
6.
Rout Y., Chauhan V., Misra R. // J. Org. Chem. 2020.
N 20.62.
Vol. 85. P. 4611. doi 10.1021/acs.joc.9b03267
7.
Leite A.C.L., Espíndola J.W.P., de Oliveira Cardoso M.V.,
2-(2-{1-[(1,3-Диоксо-1,3-дигидро-2Н-изоин-
de Oliveira Filho G.B. // Curr. Med. Chem. 2019.
дол-2-ил)метил]-2-оксо-5-хлор-1,2-дигидро-
Vol. 26. P. 4323. doi 10.2174/0929867324666171023
3H-индол-3-илиден}гидразинил)-N,N,N-триме-
163752
тил-2-оксоэтан-1-аминия xлорид
(29). Выход
8.
Ding Z., Zhou M., Zeng C. // Arch. Pharm. Chem.
97%, желтый порошок, т. пл. 237°С. ИК спектр,
Life Sci. 2020. Vol. 353. e1900367. doi 10.1002/
ν, см-1: 3412 (N-H), 3019 (C-H), 1776 (C=O), 1721
ardp.201900367
(C=O), 1704 (C=O), 1613 (C=C), 1482, 1447, 1417,
9.
Moradi R., Ziarani G.M. Lashgari N. // Arkivoc 2017.
Vol. 1. P. 148. doi 10.3998/ark.5550190.p009.980
1357, 1328, 1302, 1220 (N=N), 1174, 1122, 979, 740.
10.
Xua Zh., Zhang Sh., Gao Ch., Fan J., Zhao F., Lu Z.-Sh.,
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 12.55
Feng L.-Sh. // Chinese Chem. Lett. 2017. Vol. 28.
с (1Н, NН), 7.91-7.87 м (4Н), 7.73 уш. с (1Н), 7.61
P. 159. doi 10.1016/j.cclet.2016.07.032
д. д (1Н, 3JНН = 8.4, 4JНН = 2.1), 7.43 д (1Н, 3JНН =
11.
Pavlovska T.L., Redkin R.G., Lipson V.V., Atama-
8.4), 5.60 с (2Н, NСН2), 4.98 с [2Н, С(О)СН2], 3.23
nuk D.V. // Mol. Divers. 2016. Vol. 20. P. 299. doi
с (9Н, СН3). Спектр ЯМР 13С{1H} (ДМСО-d6), δС,
10.1007/s11030-015-9629-8
м. д. (J, Гц): 166.97 (С=О), 161.98 (С=О), 159.79
12.
Singh G.S., Desta Z.Y. // Chem. Rev. 2012. Vol. 112.
(С=О), 141.13, 134.86 (СН), 131.44 (СН), 131.22,
P. 6104. doi 10.1021/cr300135y
127.76, 123.42 (СН), 120.45, 120.35 (СН), 117.17,
13.
Gupta A.K., Tulsyan S., Bharadwaj M., Mehrotra R. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ВЛИЯНИЕ СТРОЕНИЯ 1-ЗАМЕЩЕННЫХ ИЗАТИНОВ
1335
Top. Curr. Chem. 2019. Vol. 377. P. 15. doi 10.1007/
29.
Богданов А.В., Зарипова И.Ф., Волошина А.Д.,
s41061-019-0240-9
Стробыкина А.С., Кулик Н.В., Бухаров С.В., Миро-
14.
Melis C., Meleddu R., Angeli A., Distinto S., Bianco G.,
нов В.Ф. // ЖОХ. 2018. Т. 88. С. 61; Bogdanov A.V.,
Capasso C., Cottiglia F., Angius R., Supuran C.T.,
Zaripova I.F., Voloshina A.D., Strobykina A.S.,
Maccioni E. // J. Enzym. Inhibition Med. Chem. 2017.
Kulik N.V., Bukharov S.V., Mironov V.F. // Russ.
Vol. 32. P. 68. doi 10.1080/14756366.2016.1235042
J. Gen. Chem. 2018. Vol. 88. P. 57. doi 10.1134/
15.
Xu Zh., Zhao Sh.-J., Lu Z.-Sh., Gao F., Wang Y., Zhang F.,
S1070363218010097
Bai L., Deng J.-L. // Eur. J. Med. Chem. 2019. Vol. 162.
30.
Bogdanov A.V., Zaripova I.F., Voloshina A.D.,
P. 396. doi 10.1016/j.ejmech.2018.11.032
Strobykina A.S., Kulik N.V., Bukharov S.V., Voroni-
16.
Aneja B., Khan N.Sh., Khan P., Queen A., Hussain A.,
na Ju.K., Khamatgalimov A.R., Mironov V.F. // Monatsh.
Rehman T., Alajmi M.F., El-Seedi H.R., Ali Sh., Hassan I.,
Chem. 2018. Vol. 149. P. 111. doi 10.1007/s00706-017-
Abid M. // Eur. J. Med. Chem. 2019. Vol. 163. P. 840.
2049-y
doi 10.1016/j.ejmech.2018.12.026
31.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapuno-
17.
Guo H. // Eur. J. Med. Chem. 2019. Vol. 164. P. 678. doi
va A.S., Kulik N.V., Voronina Ju.K., Mironov V.F. //
10.1016/j.ejmech.2018.12.017
Chem. Biodiversity 2018. Vol. 15. P. 1800088. doi
18.
Al-Wabli R.I., Almomen A.A., Almutairi M.S., Keeton A.B.,
10.1002/cbdv.201800088
Piazza G.A., Attia M.I. // Drug Des. Developm. Ther.
32.
Syakaev V.V., Morozova Ju.E., Bogdanov A.V., Shalae-
2020. Vol. 14. P. 483. doi 10.2147/dddt.s227862
va Ya.V., Ermakova A.M., Voloshina A.D., Zobov V.V.,
19.
Zhou L.-M., Qu R.-Y., Yang G.-F. // Expert Opin. Drug
Nizameev I.R., Kadirov M.K., Mironov V.F., Konova-
Discov. 2020. P. 1. doi 10.1080/17460441.2020.1733526
lov A.I. // Colloids Surf. A. 2018. Vol. 553. P. 368. doi
20.
Qin H.-L., Liu J., Fang W.-Y., Ravindar L., Rakesh K.P. //
10.1016/j.colsurfa.2018.05.078
Eur. J. Med. Chem. 2020. Vol. 194. 112245. doi
33.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapuno-
10.1016/j.ejmech.2020.112245
va A.S., Kulik N.V., Tsivunina I.V., Dobrynin A.B.,
21.
Maddela S., Mathew G.E., Parambi D.G.T., Aljoufi F.,
Mironov V.F. // J. Fluor. Chem. 2019. Vol. 227. 109345.
Mathew B. // Lett. Drug Design Discov. 2019. Vol. 16.
doi 10.1016/j.jfluchem.2019.109345
P. 220. doi 10.2174/1570180815666180516102100.
34.
Богданов А.В., Зарипова И.Ф., Мустафина Л.К.,
22.
Varma R.S, Nobles W.L. // J. Med. Chem. 1967. Vol. 10.
Волошина А.Д., Сапунова А.С., Кулик Н.В., Ми-
P. 972. doi 10.1021/jm00317a061
ронов В.Ф. // ЖОХ. 2019. Т. 89. С. 1004; Bogda-
23.
Богданов А.В., Вазыхова А.М., Хасиятуллина Н.Р.,
nov A.V., Zaripova I.F., Mustafina L.K., Voloshina
Криволапов Д.Б., Добрынин А.Б., Волошина А.Д., Ми-
A.D., Sapunova A.S., Kulik N.V., Mironov V.F. // Russ.
ронов В.Ф. // ХГС. 2016. Т. 52. С. 25; Bogdanov A.V.,
J. Gen. Chem. 2019. Vol. 89. P. 1368. doi 10.1134/
Vazykhova A.M., Khasiyatullina N.R., Krivolapov D.B.,
S107036321907003X
Dobrynin A.B., Voloshina A.D., Mironov V.F. // Chem.
35.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapuno-
Heterocycl. Compd. 2016. Vol. 52. P. 25. doi 10.1007/
va A.S., Kulik N.V., Bukharov S.V., Voronina Ju.K.,
s10593-016-1826-6
Vanduykov A.E., Mironov V.F. // ChemistrySelect 2019.
24.
Ozgun D.O., Yamali C., Gul H.I., Taslimi P.,
Vol. 4. P. 6162. doi 10.1002/slct.201901708
Gulcin I., Yanik T., Supuran C.T. // J. Enzyme
36.
Kale R.R., Prasad V., Mohapatra P.P., Tiwari V.K. //
Inhib. Med. Chem. 2016. Vol. 31. P. 1498. doi
Monatsh. Chem. 2010. Bd 141. S. 1159. doi 10.1007/
10.3109/14756366.2016.1149479
s00706-010-0378-1
25.
Богданов А.В., Кутузова Т.А., Криволапов Д.Б.,
37.
Briguglio I., Piras S., Corona P., Gavini E., Nieddu M.,
Добрынин А.Б., Миронов В.Ф. // ЖОХ 2016. Т. 86.
Boatto G., Carta A. // Eur. J. Med. Chem. 2015. Vol. 97.
С. 396; Bogdanov A.V., Kutuzova T.A., Krivolapov D.B.,
P. 612. doi 10.1016/j.ejmech.2014.09.089
Dobrynin A.B., Mironov V.F. // Russ. J. Gen. Chem.
38.
Богданов А.В., Кадомцева М.Е., Бухаров С.В., Во-
2016. Vol. 86. P. 539. doi 10.1134/S1070363216030087
лошина А.Д., Миронов В.Ф. // ЖОрХ. 2020. Т. 56.
26.
Богданов А.В., Кутузова Т.А., Миронов В.Ф. // ЖОХ
С. 488; Bogdanov A.V., Kadomtseva M.E., Bukha-
2016. Т. 86. С. 563; Bogdanov A.V., Kutuzova T.A.,
rov S.V., Voloshina A.D., Mironov V.F. // Russ. J.
Mironov V.F. // Russ. J. Gen. Chem. 2016. Vol. 86.
Org. Chem. 2020. Vol. 56. P. 555. doi 10.1134/
P. 756. doi 10.1134/S1070363216030440
S107042802003032X
27.
Богданов А.В., Гильфанова А.Р., Зарипова И.Ф., Ми-
39.
Bogdanov A.V., Musin L.I., Il’in A.V., Mironov V.F. // J.
ронов В.Ф. // ЖОХ 2018. Т. 88. С. 131; Bogdanov A.V.,
Heterocycl. Chem. 2014. Vol. 51. P. 1027. doi 10.1002/
Gil’fanova A.R., Zaripova I.F., Mironov V.F. // Russ.
jhet.2011
J. Gen. Chem. 2018. Vol. 88. P. 124. doi 10.1134/
40.
Sriram D., Yogeeswari P., Basha J.S., Radha D.R.,
S1070363218010206
Nagaraja V. // Bioorg. Med. Chem. 2005. Vol. 13.
28.
Богданов А.В., Зарипова И.Ф. // ХГС 2018. Т. 54.
P. 5774. doi 10.1016/j.bmc.2005.05.063
C. 686; Bogdanov A.V., Zaripova I.F. // Chem.
41.
Taher A.T., Khalil N.A., Ahmed E.M. // Arch. Pharm.
Heterocyclic Compd. 2018. Vol. 54. P. 686. doi 10.1007/
Res. 2011. Vol 34. P. 1615. doi 10.1007/s12272-011-
s10593-018-2331-x
1005-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1336
БОГДАНОВ и др.
Effect of Structure of 1-Substituted Isatins on Direction
of Their Reactions with Some Acetohydrazide Ammonium
Derivatives
A. V. Bogdanov*, A. D. Voloshina, A. S. Sapunova, N. V. Kulik, and V. F. Mironov
A.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center
of the Russian Academy of Sciences”, Kazan, 420088 Russia
*e-mail: abogdanov@inbox.ru
Received April 8, 2020; revised April 8, 2020; accepted April 18, 2020
The reaction of 1-acylisatins with Girard’s reagent T proceeds with elimination of the acyl substituent and the
formation of isatin-3-hydrazone with a quaternary nitrogen atom in the side chain. Depending on the structure
of the substituent in position 1,1-(aminomethyl)isatins reacted with the Girard’s reagent T to form hydrazones
either with the elimination of the aminomethyl substituent or with its retention. Isatin derivatives containing no
substituents in the aromatic fragment exhibit moderate activity against gram-positive bacteria S. aureus 209p
and B. cereus 8035. Low hemotoxicity of the obtained compounds was revealed.
Keywords: isatin, hydrazones, heterocycles, antimicrobial activity, ammonium salts
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020