ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1337-1348
УДК 547.856.1
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
КАК МНОГОЦЕНТРОВЫЕ С-НУКЛЕОФИЛЫ
В РЕАКЦИЯХ С ХИНАЗОЛИНОМ
© 2020 г. Ю. А. Азев*, О. С. Коптяева, О. С. Ельцов, Ю. А. Яковлева, А. Н. Цмокалюк,
А. В. Ивойлова, Е. А. Селиверстова, Т. А. Поспелова, В. А. Бакулев
Уральский федеральный университет имени первого Президента России Б. Н. Ельцина, ул. Мира 19,
Екатеринбург, 620002 Россия
*e-mail: azural@yandex.ru
Поступило в Редакцию 15 апреля 2020 г.
После доработки 15 апреля 2020 г.
Принято к печати 25 апреля 2020 г.
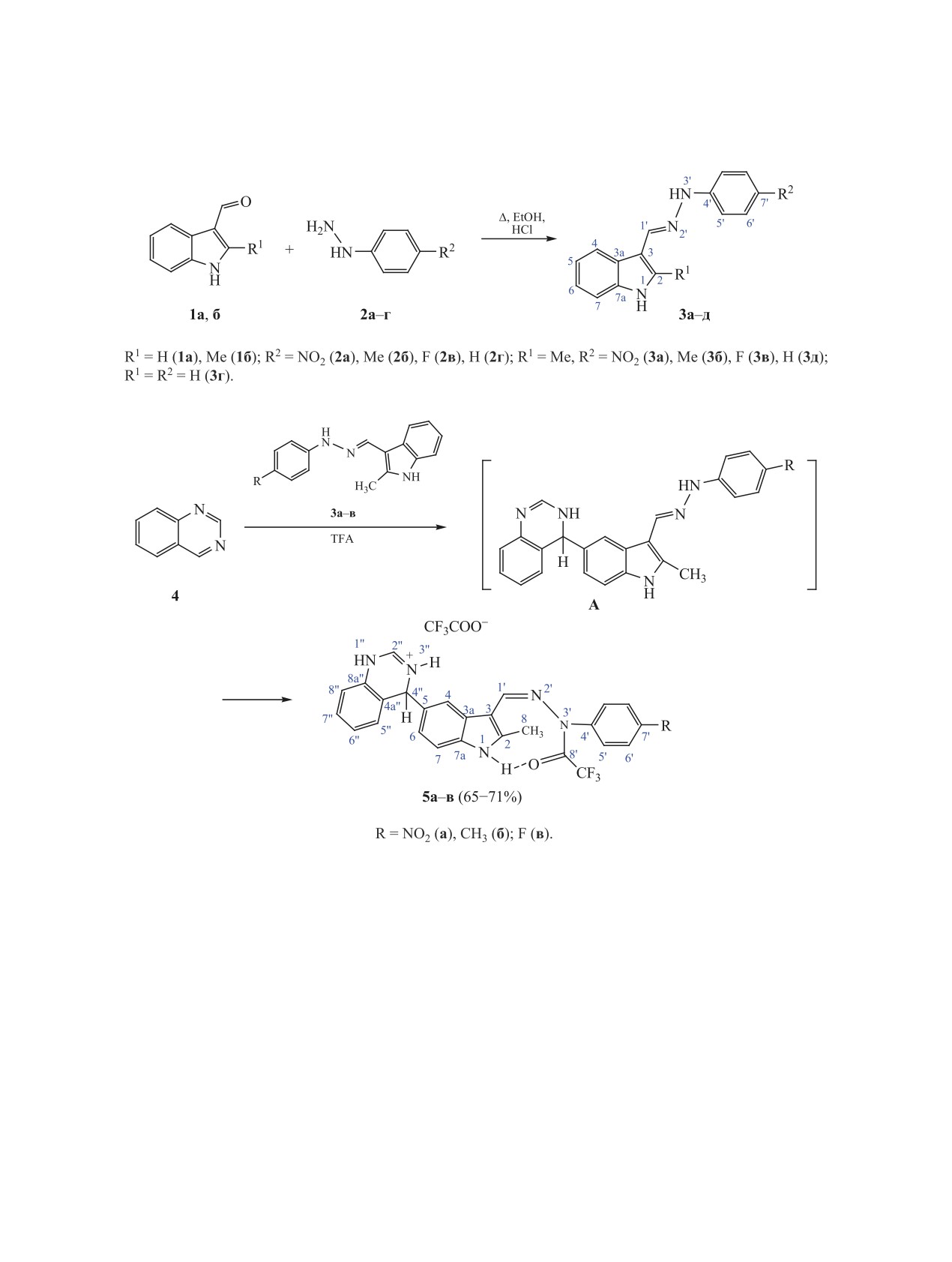
С,С-Cочетание арилгидразонов индол-3-карбальдегида c хиназолином в трифторуксусной кислоте
протекает по положению 5 или 7′ молекулы гидразона с образованием σ-аддуктов. С,С-Сочетание
сопровождается изменением Е-конфигурации связи С=N исходных гидразонов на Z-конфигурацию у
образующихся трифторацетилгидразидов хиназолина.
Ключевые слова: арилгидразоны, индол-3-карбальдегиды, С,С-сочетание, хиназолин, трифторгидра-
зиды
DOI: 10.31857/S0044460X20090036
Хиназолиновое ядро является составной частью
ства (гидрофильность, липофильность), биологи-
природных алкалоидов [1, 2]. Среди производных
ческую доступность и активность.
хиназолина выявлены соединения, обладающие
Индольное ядро входит в состав триптофана
различными видами биологической активности,
и его метаболитов, а также присутствует в ряде
включая противомикробную, противоаллергиче-
природных алкалоидов и антибиотиков [9]. Про-
скую, гипотоническую, противовирусную [3], про-
изводные индола проявляют противоопухолевую,
тивоопухолевую [4] и радиопротекторную [5].
противовирусную, противовоспалительную, анти-
Сообщалось о присоединении С-нуклеофи-
депрессантную и другие типы активности [10].
лов к иодиду 3-метилхиназолиния с образовани-
В продолжающихся исследованиях, посвящен-
ем
4-замещенных
3,4-дигидрохиназолинов
[6].
ных разработке методов синтеза биологически
Известно также, что незамещенный хиназолин
активных производных хиназолина [7], наиболее
реагирует с индолом, 5-метил-2-фенилпиразол-
перспективно использовать атом-экономные про-
3-оном,
1,3-диметилбарбитуровой кислотой и
цессы, соответствующие принципам «зеленой»
пирогаллолом в присутствии кислоты с образо-
химии [11], к которым относятся нуклеофильные
ванием 4-σ-аддуктов [7]. Описаны примеры ари-
реакции С,С-сочетания, протекающие в условиях
лирования хиназолина 1,3,5-триметоксибензолом,
кислотного катализа без применения металличе-
1-(4-метоксибензилиден)-2-фенилгидразином и
о-фенилендиаминами [8].
ских катализаторов и теоретически являющиеся
безотходными [12, 13].
Для создания эффективных лекарственных
препаратов хиназолинового ряда целесообразно
В качестве нуклеофилов нами использовались
варьировать заместители (фармакофорные фраг-
фенилгидразоны
3а-д индол-3-карбальдегидов,
менты) в структуре исследуемых соединений, что
которые были получены при кратковременном на-
позволит изменять их физико-химические свой-
гревании индол-3-карбальдегидов 1a, б с фенилги-
1337
1338
АЗЕВ и др.
Схема 1.
Схема 2.
дразинами 2a-г в водном этаноле при добавлении
Строение соединений 5а-в подтверждено дан-
HCl (схема 1).
ными ЯМР 1H, 13C, 19F и масс-спектрометрии, а
Структура полученных соединений подтверж-
также двумерных корреляционных спектров 2D
дены методами ЯМР 1Н, 13С, масс-спектрометрии
1H-13C gHMBC/gHSQC, 2D 1H-15N gHMBC.
и экспериментами 2D 1H-13C gHSQC/gHMBC, 2D
Установлено, что к атому С4′ хиназолина при-
1H-15N gHMBC. Для арилгидразонов более термо-
соединяется атом С5 индольного фрагмента мо-
динамически выгодна Е-конфигурация связи C=N,
лекулы гидразонов
3а-в. Это подтверждается
что было подтверждено данными рентгенострук-
присутствием характеристичных кросс-пиков
турного анализа [14, 15].
взаимодействия атома С7а c уширенным сигналом
При нагревании хиназолина 4 с гидразонами
протона Н4 и дублетом H6 в спектре 2D 1H-13C
3a-в в трифторуксусной кислоте (TFA) образуют-
HMBC соединения 5а. В случае альтернативного
ся соединения 5a-в (схема 2).
присоединения нуклеофила атомом С6 индольного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
1339
Схема 3.
фрагмента наблюдалось бы взаимодействие атома
сигналом протона группы N1H при 155.4 м. д. (5а,
С7а с дублетом атома водорода Н4.
JСF = 36.7 Гц). Кроме того, из спектра 13С без
развязки от протонов дополнительно была опре-
В спектрах ЯМР 1Н соединений 5а-в при-
делена константа 2hJ(C8′H1) = 3.2 Гц, обусловлен-
сутствует характерный синглет протона Н4′′ при
ная устойчивой внутримолекулярной водородной
6.25-6.26 м. д. у sp3-гибридизованного атома хи-
связью N-H∙∙∙O=C. Образование внутримолеку-
назолина С4′′, сигналы которого в спектре ЯМР
лярной водородной связи в молекуле позволяет
13С зарегистрированы в области 54.14-54.61 м. д.
полагать, что в соединениях 5а-в в ДМСО-d6 реа-
Сигналы протонов H5′ и Н6′ арильного заместите-
лизуется конформация молекулы, в которой связь
ля в соединениях 5 проявляются в виде связанных
C=N имеет Z-конфигурацию.
спин-спиновым взаимодействием двухпротонных
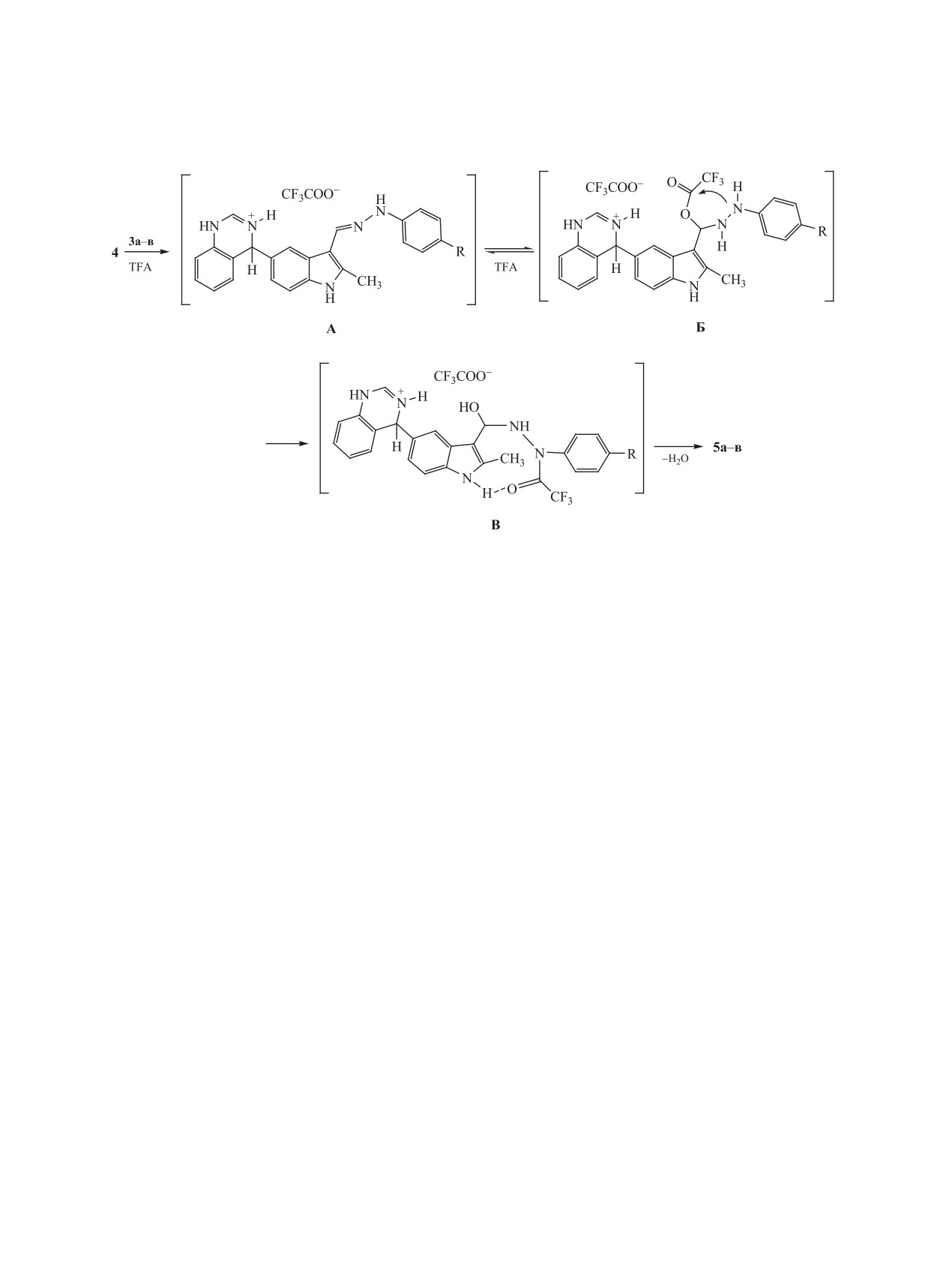
Синтез трифторацетилроизводных 5а-в, веро-
дублетов и определяются по кросс-взаимодействи-
ятно, протекает в несколько стадий. Первоначаль-
ям с атомами азота в спектре 2D 1H-15N gHMBC.
но гидразоны 3а-в присоединяются к хиназолину
Ацилирование интермедиата реакции А три-
4 с образованием интермедиата А. Далее происхо-
фторуксусной кислотой протекает по атому N3′,
дит ацилирование молекулы, которое начинается с
что подтверждается существенным слабопольным
присоединения трифторуксусной кислоты по свя-
сдвигом сигнала атома N3′ в спектрах ЯМР 15N. В
зи С=N (интермедиат Б), затем протекает внутри-
исходном гидразоне 3а химический сдвиг соответ-
молекулярная перегруппировка с образованием
ствующего атома азота находится при 155.43 м. д.,
N-ацетил-интермедиата В. Последующая дегидра-
тогда как в продукте ацилирования (трифтораце-
тация интермедиата В приводит к образованию со-
тилгидразиде 5а) - при 215.5 м. д. В спектрах ЯМР
единений 5а-в, в которых водородная связь между
1Н соединения 5а сохраняются сигналы протонов
карбонильной группой трифторацетильного фраг-
в группах NH индольного и хиназолинового фраг-
мента и группой NH индольного ядра замыкает
ментов. Следовательно, ацилированию подверга-
9-членный псевдоцикл (схема 3).
ется атом азота гидразинового фрагмента.
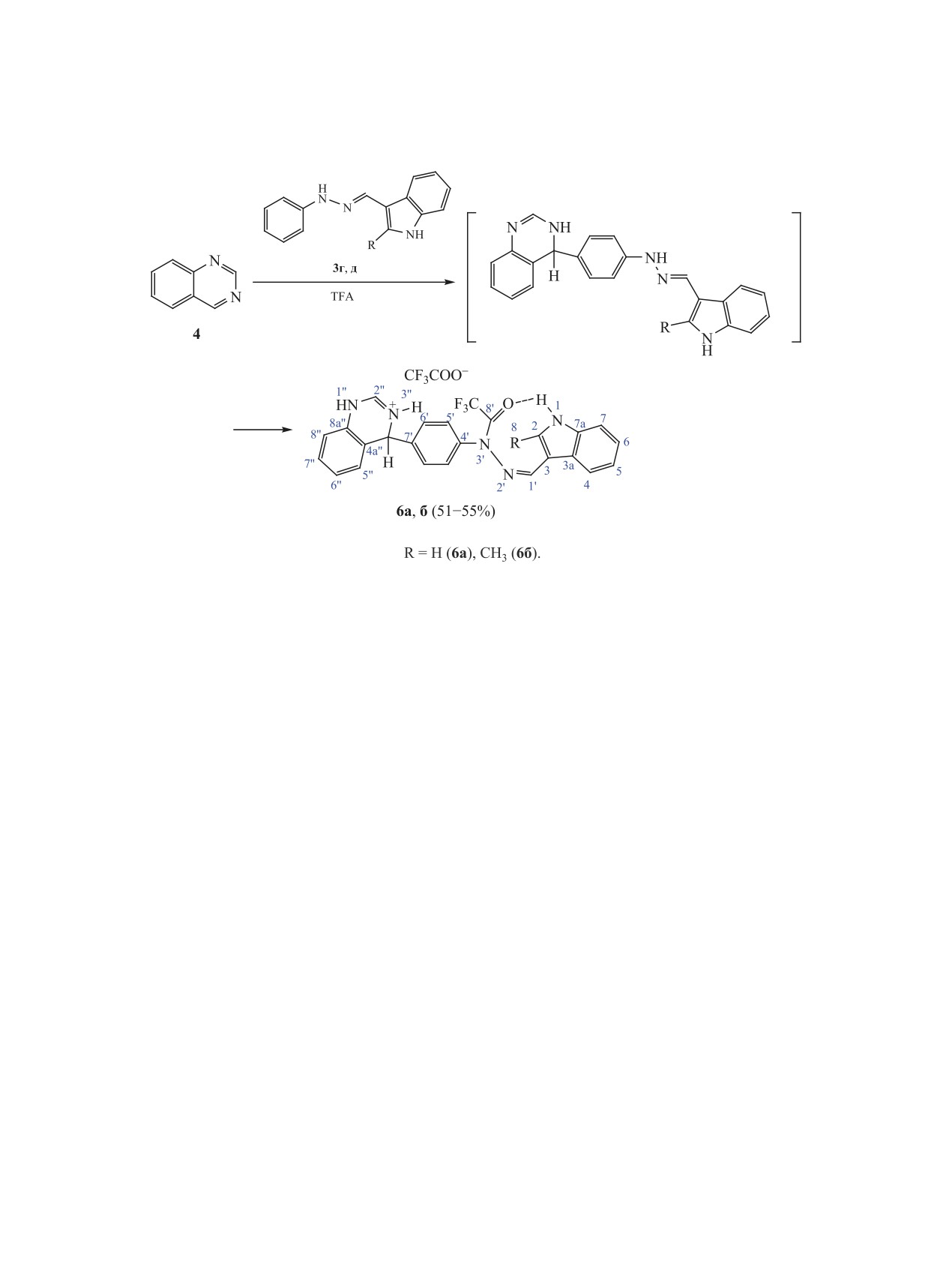
Гидразоны 3г, д (R1 = H, CH3, R2 = H), в отли-
В спектрах
2D 1H-13C gHMBC продуктов
чие от соединений 3a-в, в трифторуксусной кис-
ацилирования
5a-в наблюдаются интенсивные
лоте присоединяются к хиназолину 4 нуклеофиль-
кросс-пики между квартетным сигналом углеро-
ным центром С7′ с образованием аддуктов 6a, б
да С8′ трифторацетильной группы и уширенным
(схема 4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1340
АЗЕВ и др.
Схема 4.
В масс-спектрах соединений 6 наблюдаются
мому, происходит через стадии присоединения
молекулярные ионы, соответствующие продуктам
гидразона к хиназолину, ацилирования аддукта
присоединения молекулы гидразона к ядру хина-
трифторуксусной кислотой по группе N3′H с за-
золина. В спектре ЯМР 1Н наблюдается синглет
мыканием 9-членного псевдоцикла при участии
протона у sp3-гибридизованного атома хиназолина
трифторацетильной группы и протона группы NH
С4′′ при 6.24 м. д. Два дублета ароматических про-
индольного фрагмента.
тонов при 7.61 и 7.92 м. д. (6а) подтверждают при-
Таким образом, исследование реакционной
соединение гидразонов 3г, д к соединению 4 по
способности фенилгидразонов индол-3-карбаль-
пара-положению фенильной группы. Поскольку
дегидов 3а-д при взаимодействии с хиназолином
сигнал протона группы NH индольного фрагмента
4 в кислой среде позволило выявить два выражен-
в аддуктах 6 сохраняется, очевидно, что ацилиро-
ных С-нуклеофильных центра в молекулах гидра-
ванию подвергается гидразиновая часть молекулы.
зонов: атом С7′ фенильного фрагмента и атом С5
В спектрах 2D 1H-13C gHMBC аддуктов 6a, б
индольного фрагмента молекулы. Поскольку в от-
(аналогично спектрам соединений 5) наблюдаются
сутствие заместителей в положении 7′ фенильного
интенсивные кросс-пики между квартетным сиг-
фрагмента соединений 3г, д происходит присоеди-
налом углерода С8′ трифторацетильной группы при
нение к хиназолину атомом С7′, можно говорить о
155.9 м. д. (6а, 2JСF = 36.3 Гц) и уширенным сиг-
большей нуклеофильности этого центра по срав-
налом протона группы N1H, свидетельствующие
нению с атомом С5.
об образовании внутримолекулярной водородной
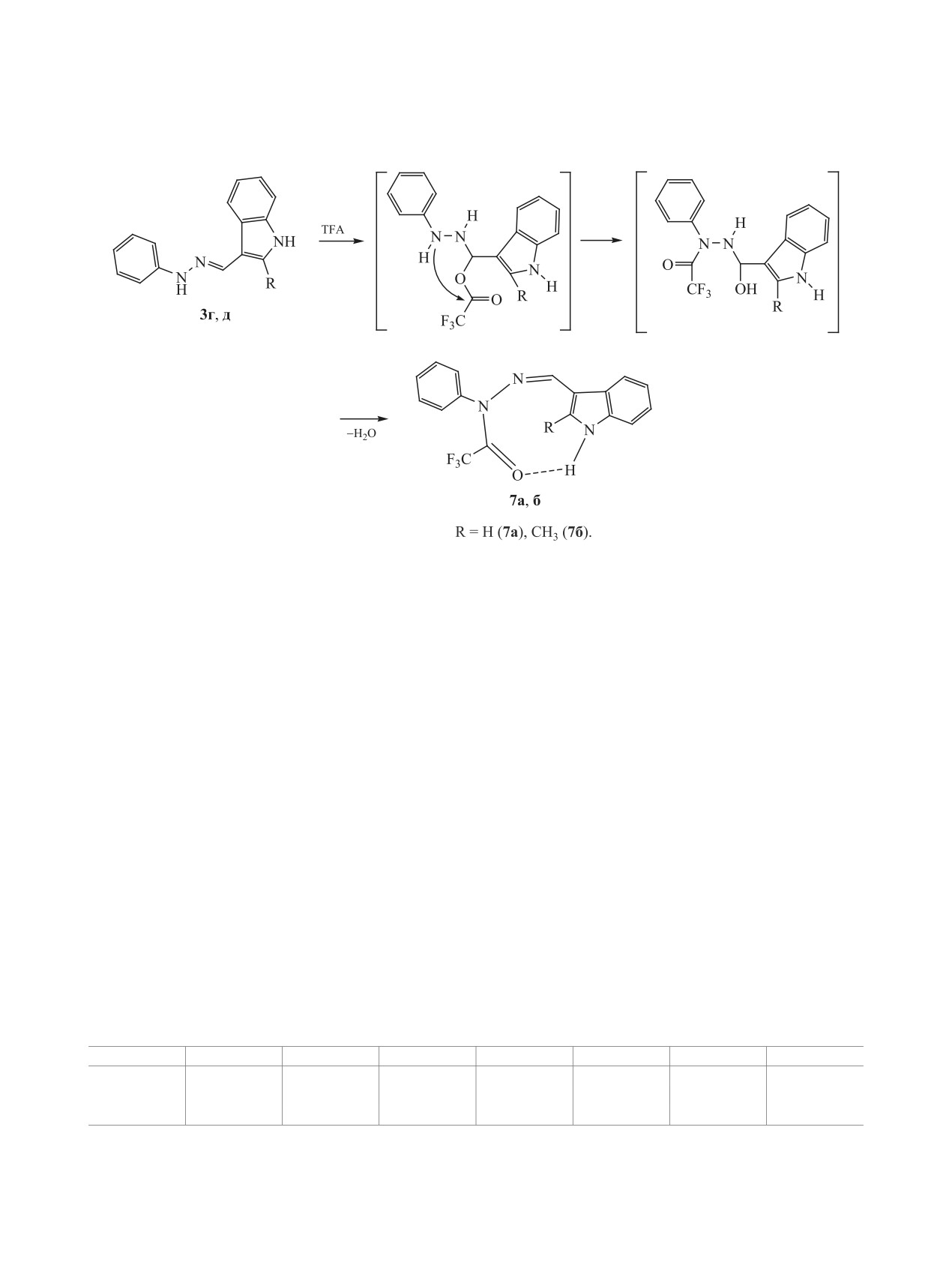
Так как в ходе С,С-сочетания происходит аци-
связи N-H∙∙∙O=C. Существование внутримолеку-
лирование гидразоновой группы NH, можно было
лярной водородной связи в молекуле позволяет
предположить, что при нагревании исходных ги-
полагать, что для полученных соединений 6а, б в
дразонов 3 в трифторуксусной кислоте также
ДМСО-d6 реализуется конформация молекулы, в
произойдет их ацилирование с образованием ги-
которой связь C=N имеет Z-конфигурацию, как и
дразидов 7, что было подтверждено в ходе экс-
в аддуктах 5.
периментов. При нагревании гидразонов 3г, д в
Образование трифторацетилпроизводных хи-
трифторуксусной кислоте получены трифторацил-
назолина 6 (схема 4), как и аддуктов 5, по-види-
производные 7а, б (схема 5).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
1341
Схема 5.
Строение продуктов ацилирования 7a, б под-
ет о том, что на первой стадии многоступенчатой
тверждено данными ЯМР 1Н, 13С, 15N и 19F с
реакции происходит присоединение молекулы ги-
привлечением двумерных корреляционных экс-
дразонов 3 к хиназолину, а затем протекает ацили-
периментов 2D 1H-13C HSQC/HMBC. Поскольку
рование.
в спектрах соединений 7a, б неизменно наблюда-
При изучении реакционной способности ги-
ются сигналы протонов NH индольного фрагмен-
дразонов электронодонорные свойства исследу-
та, очевидно, что ацилированию подвергается ги-
емых молекул оценивали методом вольтамперо-
дразиновая часть молекулы. В спектрах 2D 1H-13C
метрии. Оценка чувствительности соединений
HMBC продуктов ацилирования 7a, б, как и в слу-
к окислению (фрагмент гидразонов NH-N=CH
чае соединений 5 и 6, проявляются интенсивные
легко подвергается действию окислителей [16])
кросс-пики между квартетным сигналом углеро-
может использоваться при характеристике их ну-
да трифторацетильной группы (155.4 м. д., 2JСF =
клеофильных свойств.
36.7 Гц) и протоном группы N1H индольного
фрагмента (11.01 м. д.). Очевидно, что, данные
При электрохимическом окислении соединений
кросс-пики обусловлены спин-спинововым взаи-
3a-д и 7a, б на вольтамперограммах зафиксирован
модействием через водородную связь.
только один интенсивный пик окисления. Введе-
Полученные гидразиды 7 не вступают в реак-
ние электронодонорных заместителей в молекулу
гидразонов 3 заметно снижает потенциал первой
цию С,С-сочетания с хиназолином 4. При нагре-
вании хиназолина 4 с гидразидами 7a, б в триф-
волны окисления (табл. 1), тогда как при введении
торуксусной кислоте исходные соединения 7 были
электроноакцепторных заместителей он увеличи-
выделены в неизменном виде. Инертность гидра-
вается. Наиболее высокие потенциалы окисления
зидов 7 в реакции С,С-сочетания свидетельству-
показали трифторацетилгидразиды 7a, б.
Таблица 1. Потенциалы окисления гидразонов 3a-д и гидразидов 7a, б в ацетонитриле
R
3a
3б
3в
3г
3д
7a
7б
R1
CН3
CН3
CН3
H
CН3
CН3
CН3
R2
NO2
CН3
F
H
H
NO2
CН3
Eo, В
0.811
0.500
0.581
0.625
0.588
0.908
0.892
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1342
АЗЕВ и др.
Таблица 2. Энергии окисления и сродства катионов к электрону соединений 3а-д и 7a, б в ацетонитриле
№
EOx, В
Ecatopt, эВ
Eopt, эВ
EEAcat, эВ
3a
0.811
-26867.9
-26873
5.006898
3б
0.470
-22372.9
-22377.5
4.680361
3в
0.581
-24003.3
-24008
4.761995
3г
0.625
-20232.7
-20237.5
4.843629
3д
0.588
-21302.9
-21307.6
4.761995
7a
0.870
-39122
-39127.8
5.768817
7б
0.860
-34627
-34632.7
5.714394
Поскольку кривые электрохимического окисле-
ной смеси в ячейке спектрометра ЯМР в течение
ния гидразонов и гидразидов имеют одинаковый
30 ч при 50°С в спектре появлялись характерные
характер, можно предположить, что они отражают
сигналы образующихся аддуктов 5 и 6. По-види-
подобные процессы. При этом волна окисления
мому, радикальные частицы (катион-радикалы) не
исследуемых соединений, по-видимому, соответ-
лежат на координате рассматриваемых реакций.
ствует стадии одноэлектронного переноса. Ука-
Для выявления нуклеофильных центров в мо-
занное предположение подтверждается линейной
лекулах рассматриваемых соединений были про-
корреляцией между величинами потенциалов
изведены квантово-химические расчеты и опре-
окисления и расчетными данными сродства катио-
делена локализация электронной плотности на
нов соединений 3 и 7 к электрону (табл. 2).
верхних энергетических орбиталях. На примере
При изучении особенностей реакций соедине-
соединения 3г была рассчитана электронная плот-
ния 3б в трифторуксусной кислоте был обнаружен
ность на трех верхних ВЗМО, имеющих близкие
сигнал электронного парамагнитного резонанса
собственные значения энергии.
(ЭПР), указывающий на перенос одного электро-
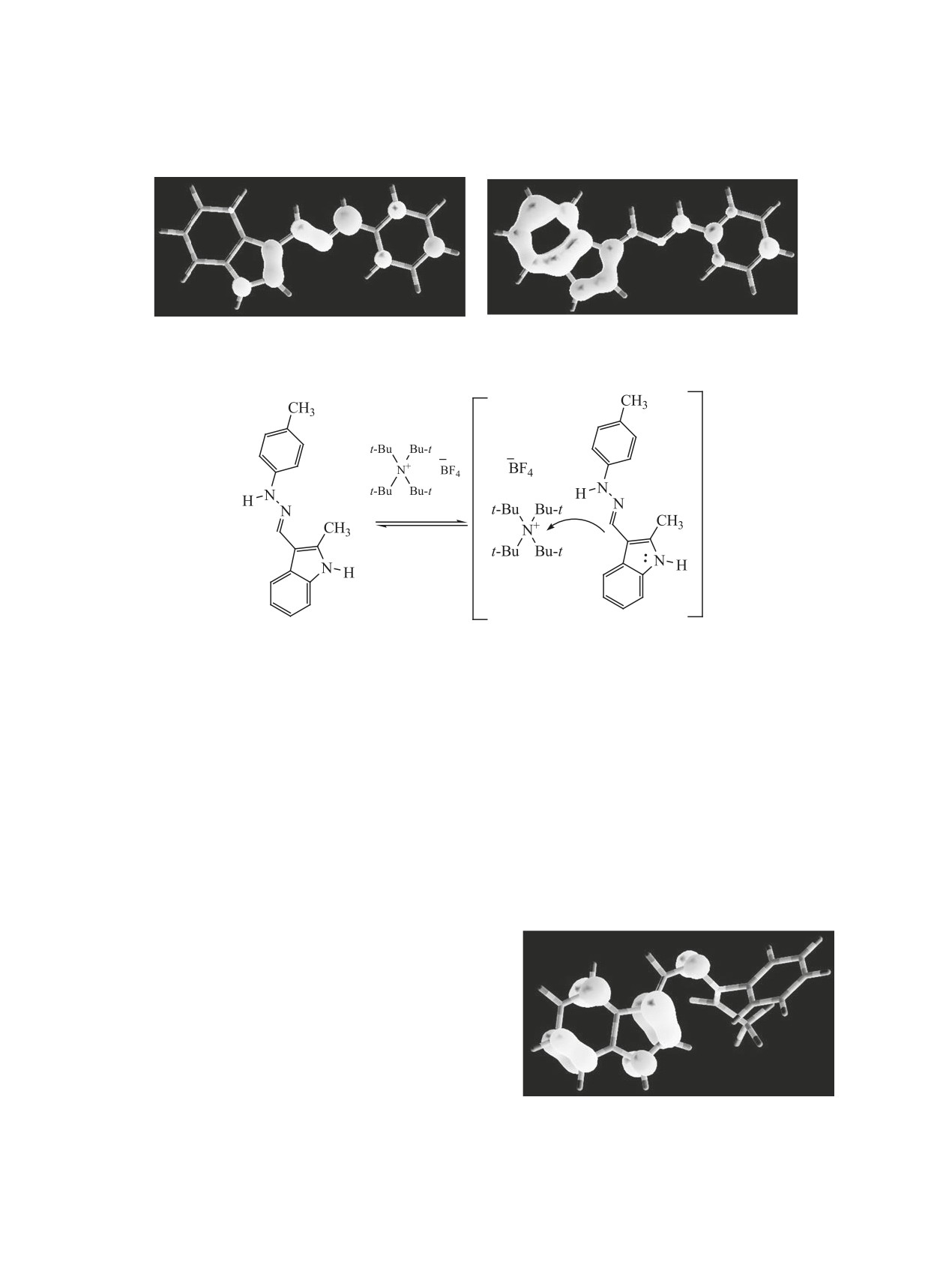
Из визуального анализа полученных данных
на c образованием катион-радикала. Можно пред-
(рис. 2) следует, что в наибольшей степени элек-
положить, что в молекуле гидразона 3б в присут-
тронная плотность локализуется на атоме N3 мо-
ствии акцептора (тетрабутиламмонийборфторид)
лекулы гидразона 3г. Это, по-видимому, проявля-
возникает донорно-акцепторное взаимодействие,
ется в наибольшей электронодонорной активности
в результате которого образуется катион-радикал
N-центров и отражается на потенциалах окисле-
(схема 6). Для катион-радикала соединения 3б рас-
ния молекул гидразонов, а также оказывает влия-
четными методами получен спектр ЭПР, хорошо
ние на образование стабильного катион-радикала
согласующийся с экспериментальным (рис. 1).
в растворе соединения 3б, имеющего наименьший
Известно, что радикальные процессы протека-
потенциал окисления.
ют быстро и в мягких условиях, однако методом
Из-за непрочности связи С-N стабильные ад-
спектроскопии ЯМР 1Н не обнаружено С,С-соче-
дукты в ходе реакции по центру N3 не образу-
тания гидразонов 3 с хиназолином 4 при комнат-
ются (в продуктах реакции не обнаружены). Об-
ной температуре. При выдерживании реакцион-
разование стабильных аддуктов возможно при
взаимодействии хиназолина 4 с С-нуклеофильны-
ми центрами С2, С5, С7′ гидразонов 3. Локализация
электронной плотности на атоме С7′, а также его
пространственная доступность приводит к образо-
ванию аддуктов по данному положению молекулы
(рис. 2, a). При пространственном экранировании
центров С7′ и С2 (в молекулах гидразонов 3a-в) ре-
ализуются нуклеофильные свойства атома С5, име-
ющего большую заселенность ВЗМО-1 и ВЗМО-2
Напряженность поля, Гаусс
(рис. 2, б). Как было показано ранее, именно ну-
клеофильные центры С5 и C7′ участвуют в реакции
Рис. 1. Экспериментальный (1) и расчетный (2) спектр
ЭПР катион-радикала соединения 3б в ацетонитриле.
С,С-сочетания гидразонов 3 с хиназолином 4.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
1343
(а)
(б)
Рис. 2. Распределение электронной плотности в молекуле соединения 3б: (а) ВЗМО, (б) ВЗМО-1, ВЗМО-2.
Схема 6.
При анализе структуры гидразонов 3 можно
рассматриваемых соединений, т. е. электронодо-
предположить, что локализация отрицательно-
норные свойства у этих соединений выражены
го заряда в положениях С5 и C7′ гидразонов обу-
заметно меньше, чем у гидразонов 3. Этим, по-ви-
словлена сопряжением π-электронов ароматиче-
димому, объясняется отсутствие реакции С,С-со-
ских ядер с электронами аминогрупп молекул 3.
четания соединений 7a, б с хиназолином 4.
Дезактивация обоих нуклеофильных центров в
Таким образом, фенилгидразоны индол-3-кар-
молекуле гидразида 7 обусловлена влиянием элек-
бальдегидов представляют собой многоцентро-
троноакцепторной трифторацетильной группы.
вые С-нуклеофильные реагенты, которые могут
Вычисление собственных энергий (эВ) и плотно-
быть использованы в реакции С,C-сочетания для
сти заселения молекулярных орбиталей (рис. 3) в
получения различных производных хиназолина,
молекуле трифторацетилпроизводного 7а показа-
перспективных для изучения их биологической
ло, что энергия ВЗМО для данной молекулы суще-
активности. Реакция С,С-сочетания гидразонов
ственно ниже энергии (эВ) ВЗМО неацилирован-
сопровождается ацилированием группы NH ги-
ного соединения 3г:
ВЗМО
ВЗМО-1
ВЗМО-2
‒5.1008
-6.3016
-6.4834 (3г)
‒6.2145
-6.7278
-6.7278 (7a)
Локализации электронной плотности на атомах
С5 и С7′ соединений 7a, б не наблюдается (рис. 3),
что объясняет инертность молекул 7a, б как С-ну-
клеофилов.
Трифторацетилгидразиды 7 имеют наиболее
Рис. 3. Распределение электронной плотности в
высокий потенциал окисления (табл.
1) среди
молекуле соединения 7а (ВЗМО).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1344
АЗЕВ и др.
дрозонового фрагмента трифторуксусной кисло-
фициента детерминации для линейной регрессии
той с изменением Е-конфигурации связи C=N ги-
сродства к электрону катиона и потенциала окис-
дразона на Z-конфигурацию.
ления (R2) составила 0.84.
Квантово-химические расчеты спектров ЭПР
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
катион-радикала соединения
3б выполнены в
Все используемые реагенты коммерчески до-
соответствии с DFT с геометрической оптими-
ступны (Sigma Aldrich, Merck) и использовались
зацией на основании метода B3LYP в базисном
без дополнительной очистки. Протекание реакции
наборе 6-31+G(d). Константы сверхтонкого взаи-
контролировали с помощью ТСХ на пластинах с
модействия вычисляли по методу UB3LYP в ба-
силикагелем (Merck).
зисе IGLO-III [20]. Вычисления выполнены в про-
Спектры ЯМР 1H, 19F, 13С и 15N записаны в
грамме ORCA 4.01 [21]. Моделирование спектров
ДМСО-d6 на спектрометрах Bruker AVANCE NEO-
ЭПР проводили с помощью программы EasySpin
600 и AVANCE-400. Химические сдвиги 1Н и 19F
[22].
измерены относительно внутренних стандартов -
Соединение 3г было получено в соответствии с
тетраметилсилана и трихлорфторметана соответ-
описанной методикой [23].
ственно, сдвиги 13С - относительно сигнала рас-
Общая методика синтеза гидразонов 3a-в, д.
творителя (ДМСО-d6). Масс-спектры электрон-
Раствор 0.5 ммоль 2-метил-1Н-индол-3-карбаль-
ного удара получены на приборе MicrOTOF-Q
дегида 1a, б в 3 мл этанола добавляли к раство-
фирмы Bruker Daltonics при среднем ионизирую-
ру 0.5 ммоль соответствующего гидразина 2а-г и
щем потенциале 75 эВ при 250°С. Масс-спектры
0.02 мл конц. НСl в 3 мл воды. Полученную смесь
высокого разрешения с ионизацией электроспреем
кипятили 3-5 мин и охлаждали. Осадок гидразона
получены на приборе Agilent 6545 Q-TOF LC-MS
отфильтровывали и сушили.
(Agilent Technologies, США).
2-Метил-3-{(Е)-[2-(4-нитрофенил)гидрази-
Циклические вольтамперометрические изме-
нилиден]метил}-1H-индол (3a). Выход 59%, т. пл.
рения выполняли с использованием потенцио-
288-289°С. Спектр ЯМР 1H (600 МГц), δ, м. д.:
стата-гальваностата μAutolab Type III (Metrohm,
2.54 с (3H, CH3), 7.09 уш. с (2H, H4′), 7.12-7.15 м
Швейцария) на стандартной трехэлектродной
(2H, H5, H6), 7.33-7.37 м (1H, H7), 8.12-8.17 м (3H,
ячейке. Рабочий электрод - стеклоуглеродный
H4, H5′), 8.34 с (1H, H1′), 10.98 с (1H, N3′H), 11.47
диск, впрессованный во фторопласт (d = 2.5 мм,
с (1H, N1H). Спектр ЯМР 13C (151 МГц), δС, м. д.:
Metrohm, Швейцария). В качестве вспомогатель-
108.08 (C3), 110.56 (C5′), 111.41 (C7), 120.86 (C5),
ного электрода использовали стержень из стеклоу-
121.11 (C4), 122.23 (C6), 125.68 (С3a), 126.93 (C6′),
глерода (Metrohm, Швейцария). Для сравнения ис-
136.18 (C7a), 137.38 (C7′), 139.65 (C2), 140.25 (C1′),
пользовали хлоридсеребряный электрод (Metrohm,
151.31 (C4′). Спектр ЯМР 15N (61 МГц), δN, м. д.:
Швейцария). В качестве сопутствующего реагента
144.79 (N1), 155.43 (N3′), 303.13 (N2′). Масс-спектр,
(фона) применяли тетрафторборат тетрабутилам-
m/z (Iотн, %): 294 (100) [M]+, 157 (86), 130 (64).
мония (ОСЧ, Panreac, Испания). Измерения про-
Масс-спектр (HRMS ESI-MS), m/z: 295.1203 [M +
водили с использованием ацетонитрила (ОСЧ,
H]+ (вычислено для C16H15N4O2: 295.1190).
НПК Криохром, Россия). Циклические вольтампе-
2-Mетил-3-{(Е)-[2-(4-метилфенил)гидрази-
рограммы регистрировали в линейном режиме со
нилиден]метил}-1H-индол (3б). Выход 61%, т. пл.
скоростью развертки потенциала 100 мВ/с.
143-144°C. Спектр ЯМР 1H (600 МГц), δ, м. д.:
Энергию сродства к электрону катионов иссле-
2.21 с (3H, CH3), 2.51 с (3H, C2CH3), 6.94 д (2H, H4′,
дуемых гидразонов в газовой фазе рассчитывали
J = 7.9 Гц), 7.03 д (2H, H5′, J = 8.1 Гц), 7.10 д. д (2Н,
с учетом энергии сольватации в ацетонитриле.
H5, H6, J = 5.9, 3.1 Гц), 7.31 д. д (1H, H7, J = 5.6, 3.4
Расчет производили в рамках теории функциона-
Гц), 8.15 с (2H, H1′, H4), 9.64 уш. с (1H, N3′H), 11.23
ла плотности. Использовали обменно-корреля-
с (1H, N1H). Спектр ЯМР 13C (151 МГц), δС, м. д.:
ционный функционал B3LYP в базисном наборе
108.79 (C3), 111.14 (C7), 111.85 (C5′), 120.25 (C5),
6-31G++(d, p) [17,18]. Расчеты выполняли в пакете
121.02 (C4), 121.77 (C6), 125.88 (С3a), 126.24 (C7′),
GAUSSIAN09 [19]. Рассчитанная величина коэф-
129.96 (C6′), 134.61 (C1′), 136.08 (C7a), 136.76 (C2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
1345
144.58 (C4′). Спектр ЯМР 15N (61 МГц), δN, м. д.:
с (3H, H8), 6.26 с (1H, H4′′), 7.13 д (1H, H5′′, J =
140.1 (N3′), 140.5 (N1), 311.7 (N2′). Масс-спектр, m/z
7.6 Гц), 7.20 д (1H, H8′′, J = 7.9 Гц), 7.24 т (1H, H6′′,
(Iотн, %): 263 (100) [M]+, 157 (68), 130 (41). Мас-
J = 7.5 Гц), 7.37 т (1Н, H7′′, J = 7.6 Гц), 7.50 д (2Н,
спектр (HRMS ESI-MS), m/z: 264.1506 [M + H]+
H7, J = 8.0 Гц), 7.53 с (1H, H4), 7.55 д (1Н, H6, J =
(вычислено для C17H18N3: 264.1495).
8.1 Гц), 7.76 с (1H, H1′), 7.87 д (2Н, H5′, J = 9.0 Гц),
2-Метил-3-{(E)-[2-(4-фторфенил)гидразини-
8.41 д (2Н, H6′, J = 8.9 Гц), 8.56 с (1H, H2′′), 11.12 с
лиден]метил}-1H-индол (3в). Выход 68%, т. пл.
(2H, N1H, N3′′H), 12.39 с (1H, COOH). Спектр ЯМР
133-134°C. Спектр ЯМР 1H (600 МГц), δ, м. д.:
13C (151 МГц), δС, м. д.: 12.22 (C8), 54.61 (C4′′),
2.51 с (3H, CH3), 6.98-7.02 м (2H, H5, H6), 7.05-7.11
116.39 (CF3, J = 288.7 Гц), 117.61 (C8′′), 119.67 (C3),
м (4H, H5′, H6′), 7.29-7.33 м (1H, H7), 8.11-8.14 м
121.93 (C4a′′), 124.75 (2C5′), 125.51 (2C6′), 127.62
(1H, H4), 8.15 с (1H, H1′), 9.75 с (1H, N3H), 11.23 с
(C6), 127.86 (C6′′), 128.60 (C5′′), 128.72 (C7), 129.86
(1H, N1H). Спектр ЯМР 13C (151 МГц), δС, м. д.:
(C8a′′), 130.05 (C7′′), 130.24 (C3a), 130.46 (C4), 133.64
108.65 (C3), 111.16 (C7), 111.83 (C5′), 120.98 (C5),
(C7a), 137.63 (C2), 141.26 (C1′), 142.44 (C5), 144.73
121.81 (C4), 122.34 (C6), 125.84 (C3a), 126.75 (C7′),
(C4′), 146.25 (C7′), 149.20 (C2′′),
155.83 (COCF3,
128.40 (C6′), 135.17 (C1′), 136.07 (C7a), 136.98 (C2),
2J = 36.3 Гц), 158.39 к (COOH, 2J = 31.6 Гц). Спектр
143.52 (C4′). Спектр ЯМР 19F (565 МГц): δF -127.76
ЯМР 19F (565 МГц), δF, м. д.: -73.53, -74.00. Спектр
м. д. Спектр ЯМР 15N (61 МГц), δN, м. д.: 142.2
ЯМР 15N (61 МГц), δN, м. д.: 126.1 (N1”, N3′′), 215.5
(N3′), 147.4 (N1), 315.2 (N2′). Масс-спектр, m/z (Iотн,
(N1, N3′), 304.2 (N2′), 369.2 (NO2). Масс-спектр, m/z
%): 267 (100) [M]+, 157 (69), 130 (51). Масс-спектр
(Iотн, %): 520 (15) [M]+, 390 (31), 131 (100). Масс-
(HRMS ESI-MS), m/z: 268.1255 [M + H]+ (вычисле-
спектр (HRMS ESI-MS), m/z: 521.1565 [M + H]+
но для C16H15FN3: 268.1245).
(вычислено для C26H20F3N6O3: 521.1543).
2-Метил-3-[(Е)-(2-фенилгидразинилиден)ме-
4-(2-Метил-3-{(Z)-[2-(4-метилфенил)-2-
тил]-1Н-индол (3д). Выход 59%, т. пл. 192-193°С
(2,2,2-трифторацетил)гидразинилиден]метил}-
(т. пл. 192-193°С [21]). Спектр ЯМР 1H (600 МГц),
1Н-индол-5-ил)-1,4-дигидрохиназолин-3-ий-
δ, м. д.: 2.49 с (3H, CH3), 6.67 т. т (1H, Hп, J = 7.3,
2,2,2-трифторацетат (5б). Выход 71%, т. пл. 118-
1.2 Гц), 7.03 д. д (2H, Ho, J = 8.5, 1.2 Гц), 7.08-7.12
119°C. Спектр ЯМР 1H (400 МГц), δ, м. д.: 2.15 с
м (2H, H5, H6), 7.21 д. д (2H, Hм, J = 8.5, 7.3 Гц),
(3H, H8), 2.39 с (3H, H7′), 6.25 с (1H, H4′′), 7.13 д (1Н,
7.31 м (1H, H7), 8.15 м (1H, H4), 8.17 с (1H, H1′),
H5′′, J = 8.0 Гц), 7.20 д (1Н, H8′′, J = 8.0 Гц), 7.24 т
9.78 уш. с (1H, N3′H), 11.23 с (1H, N1H). Спектр
(1Н, H6′′, J = 8.0 Гц), 7.42-7.30 м (4H, H4,6,7,7′′), 7.87
ЯМР 13C (151 МГц), δС, м. д.: 136.06 (C2), 118.04
д (2Н, H5′, J = 8.0 Гц), 7.60 с (1H, H1′), 8.41 м (2H,
(C3), 129.91 (C3a), 130.99 (C4), 127.76 (C5), 127.49
H6′), 8.55 с (2H, H2′′), 11.06 с (2H, N1H, N3′′H), 12.35
(C6), 127.78 (C7), 132.84 (C7a), 139.22 (C1′), 139.44
с (1H, COOH). Спектр ЯМР 13C (101 МГц), δС, м. д.:
(Cи), 124.4 (Co), 129.27 (Cм), 127.67 (Cп), 115.98
11.24 (C8), 20.57 (C8′), 54.14 (C4′′), 111.33 (CF3, J =
(CF3), 155.28 (C=O). Спектр ЯМР 15N (61 МГц), δN,
284.6 Гц), 117.10 (C3), 117.39 (2C5′), 117.79 (C8′′),
м. д.: 126.8 (N1), 305 (N3′), 218.5 (N3′). Масс-спектр,
121.45 (C4a′′), 122.55 (C6),
124.36
(2C6′),
126.64
m/z (Iотн, %): 249 (100) [M]+.
(C6′′), 127.35 (C5′′), 128.15 (C7), 129.33 (C8a′′), 129.71
Общая методика синтеза трифторацетил-
(C3a), 130.44 (C7′′), 130.97 (C7a), 132.98 (C4), 136.19
гидразидов 5а-в. Смесь 0.5 ммоль хиназолина 4
(C2), 136.95 (C1′), 137.35 (C5), 138.86 (C4′), 141.84
и 0.5 ммоль соответствующего гидразона 3а-в в
(C2′′),
148.70 (C7′),
155.67-154.96 м (COCF3),
3 мл трифторуксусной кислоты кипятили 65-70 ч.
158.13-157.77м(COOH).СпектрЯМР19F(376МГц),
Растворитель упаривали в вакууме, остаток су-
δF, м. д.: -73.65, -74.00. Спектр ЯМР 15N (61 МГц),
спендировали в 2 мл воды, отфильтровывали и су-
δN, м. д.: 128.3 (N1”, N3′′), 221.7 (N1, N3′), 300.6
шили.
(N2′). Масс-спектр, m/z (Iотн, %): 489 (38) [M]+, 359
(32), 131 (100). Масс-спектр (HRMS ESI-MS), m/z:
4-(2-Метил-3-{(Z)-[2-(4-нитрофенил)-2-
490.1872 [M + H]+ (вычислено для C27H23F3N5O:
(2,2,2-трифторацетил)гидразинилиден]метил}-
490.1849).
1Н-индол-5-ил)-1,4-дигидрохиназолин-3-ий-
2,2,2-трифторацетат (5a). Выход 68%, т. пл. 143-
2-Метил-4-{3-[2-(4-фторфенил)-2-
144°C. Спектр ЯМР 1H (600 МГц), δ, м. д.: 2.29
(2,2,2-трифторацетил)гидразинилиден]ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1346
АЗЕВ и др.
тил}-1Н-индол-5-ил)-1,4-дигидрохиназолин-
(376 МГц), δF, м. д.: -73.50, -74.12. Спектр ЯМР
3-ий-2,2,2-трифторацетат (5в). Выход 65%, т. пл.
15N (61 МГц), δN, м. д.: 126.9 (N1′, N3′′), 218.6 (N1,
123-124°C. Спектр ЯМР 1H (400 МГц), δ, м. д.:
N3′), 301.6 (N2′). Масс-спектр, m/z (Iотн, %): 461 (20)
2.16 с (3H, H8), 6.25 с (1H, H4′′), 7.13 д (1Н, H5′′, J =
[M]+, 369 (11), 131 (100).
8.0 Гц), 7.20 д (1Н, H8′′, J = 8.0 Гц), 7.25 т (1Н, H6′′,
4-(4-{2-[(Z)-(2-Mетил-1Н-индол-3-ил)метил-
J = 8.0 Гц), 7.44-7.35 м (4H, H4,6,7,7′′), 7.55-7.50
иден]-1-(2,2,2-трифторацетил)гидразинил}фе-
д. д (2Н, H6′, J = 14.4, 2.8 Гц), 7.56 д (2Н, H5′, J =
нил)-1,4-дигидрохиназолин-3-ий-2,2,2-трифтор-
8.0 Гц), 7.63 с (1H, H1′), 8.55 с (2H, H2′′), 11.08 с
ацетат (6б). Выход 55%, т. пл. 121-122°C. Спектр
(2H, N1H, N3′′H), 12.32 с (1H, COOH). Спектр ЯМР
ЯМР 1H (400 МГц), δ, м. д.: 2.21 с (3H, CH3), 6.28
13C (101 МГц), δС, м. д.: 11.14 (C8), 54.14 (C4′′),
с (1H, H4′′), 7.11 д (1H, СНAr, J = 7.4 Гц), 7.24 м
116.19 (CF3, J = 286.3 Гц), 117.10 (C8′′), 117.54
(2H, CHAr), 7.38 т (1Н, СНAr, J = 7.7 Гц), 7.44 с (5H,
(C3), 121.44 (C4a′′), 126.43-126.97 м (2C6′, 2C5′),
4CHиндол + CHAr), 7.63 с (3H, CHAr), 7.64 с (1H,
127.43 (C6), 127.72-127.83 м (C5′′, C6′′), 128.16 (C7),
H1′), 8.57 с (1H, H2′′), 11.03 м (2H, NH), 12.37 уш. с
129.35 (C8a′′), 129.56 (C7′′), 129.88 (C3a),
130.33
(1H, COOH). Спектр ЯМР 13C (151 МГц), δС, м. д.:
(C4), 130.89-131.03 м (C7′), 133.03 (C4′),
135.77
11.34 (СH3), 55.96 (C4′′), 115.33 (CF3, J = 147.38 Гц),
(C7a), 136.49 (C2), 139.16 (C1′), 141.86 (C5), 148.69
118.06 (C8′′), 119.17 (C3), 123.08 (C6′), 124.11 (C4a),
(С2′′), 154.97-155.64 м (COCF3), 157.59-158.18
124.53 (C7), 127.50 (C6′′), 127.67 (C7′), 127.74 (C5′),
м (COOH). Спектр ЯМР 19F (376 МГц), δF, м. д.:
127.78 (C5′′), 127.95 (C7′′), 129.85 (C8a),
130.97
-73.55, -74.01, -114.01. Спектр ЯМР 15N (61 МГц),
(C4), 132.86 (C7a), 136.05 (C3a), 138.50 (C4′), 138.87
δN, м. д.: 127.5 (N1”, N3′′), 218.1 (N1, N3′), 302.5
(C7), 138.87 (C5), 144.98 (C6), 146.48 (C2′′), 155.30
(N2′). Масс-спектр, m/z (Iотн, %): 493 (35) [M]+, 363
(COCF3, J = 36.5 Гц), 158.17 к (COOH, 2J = 30.9 Гц).
(18), 131 (100). Масс-спектр (HRMS ESI-MS), m/z:
Спектр ЯМР 19F (376 МГц), δF, м. д.: -73.72, -74.07.
494.1619 [M + H]+ (вычислено для C26H19F4N5O:
Масс-спектр, m/z (Iотн, %): 475 (27) [M]+, 345 (25),
494.1598).
131 (100).
Общая методика синтеза трифторацетилги-
Общая методика синтеза cоединений 7a, б.
дразидов 6а, б. Смесь 0.5 ммоль хиназолина 4 и
Раствор 0.3 моль гидразона 3г, д в 2 мл трифторук-
0.5 ммоль соответствующего гидразона 3г, д в 3 мл
сусной кислоты нагревали 45-50 ч. Растворитель
трифторуксусной кислоты кипятили 65-70 ч. Рас-
упаривали в вакууме, остаток суспендировали в
творитель упаривали в вакууме, остаток суспенди-
2 мл воды и подщелачивали 15%-ным водным рас-
ровали в 2 мл воды, отфильтровывали и сушили.
твором аммиака до рН = 7-8. Осадок отфильтро-
4-(4-{2-[(Z)-1H-Индол-3-илметилиден]-1-
вывали, промывали 2 мл воды и сушили.
(2,2,2-трифторацетил)гидразинил}фенил)-
2,2,2-Трифтор-N′-[(Z)-1H-индол-3-илметил-
1,4-дигидрохиназолин-3-ий-2,2,2-трифтор-
иден]-N-фенилацетoгидразид (7а). Выход 55%,
ацетат (6a). Выход 51%, т. пл. 112-113°C. Спектр
т. пл. 154-155°С. Спектр ЯМР 1H (600 МГц), δ,
ЯМР 1H (600 МГц), δ, м. д.: 6.24 с (1H, H4′′), 7.07
м. д.: 7.34 т. т (1H, Hп, J = 7.5, 1.0 Гц), 7.39 м (1H,
д (1Н, H5′′, J = 7.4 Гц), 7.20-7.24 м (2H, H6′′, H7′′),
H6), 7.43-7.46 м (2H, H5, H6), 7.54 д. д (2H, Hм, J =
7.37 т (1Н, H5, J = 7.7 Гц), 7.41 д (1Н, H4, J =
8.6, 7.5 Гц), 7.70 м (1H, H4), 7.85 д. д (2H, Hz, Ho,
6.7 Гц), 7.43-7.45 м (2H, H6,7), 7.61 д (2Н, H5′, J =
J = 8.6, 1.0 Гц), 7.97 с (1H, H1′), 8.78 с (1H, H2),
8.4 Гц), 7.69 д (2Н, H8′′, J = 7.6 Гц), 7.92 д (2Н, H6′,
11.15 с (1H, N1H). Спектр ЯМР 13C (151 МГц), δС,
J = 8.4 Гц), 7.98 с (1H, H1′), 8.57 с (1H, H2′′), 8.80
м. д.: 116.08 (CF3, J = 288.6 Гц), 118.22 (Co), 120.64
с (1H, H2), 11.18 с (2H, N1H, N3′′H), 12.37 с (1H,
(C3), 126.19 (C2), 126.49 (Cп), 127.57 (C6), 128.18
COOH). Спектр ЯМР 13C (151 МГц), δС, м. д.: 54.61
(C5), 128.18 (C7), 129.08 (C4), 129.64 (Cм), 131.36
(C4′′), 116.39 (CF3, J = 288.7 Гц), 117.59 (C8′′), 119.17
(C7a), 139.39 (Ci), 139.7 (C1′), 155.52 (C=O, J =
(C3), 121,42 (C6′), 122.42 (C4a), 126.86 (C7), 127.83
36.2 Гц). Спектр ЯMР 19F (470 MГц): δF -74.52 м.
(C6′′), 128.22 (C7′), 128.60 (C5′), 128.73 (C5′′), 129.34
д. Масс-спектр, m/z (Iотн, %): 331 (100) [M]+, 262
(C7′′), 129.48 (C4), 129.82 (C8a), 130.07 (C3a), 131.90
(44).
(C7a), 132.0 (C4′), 139.89 (C7), 140.54 (C5), 141.1
(C6), 149.14 (C2′′), 156.00 (COCF3, 2J = 36.3 Гц),
2,2,2-Трифтор-N′-[(Z)-(2-метил-1H-индол-
158.44 к (COOH, 2J = 30.7 Гц). Спектр ЯМР 19F
3-ил)метилиден]-N-фенилацетогидразид
(7б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
АРИЛГИДРАЗОНЫ ИНДОЛКАРБАЛЬДЕГИДОВ
1347
Выход 64%, т. пл. 164-165°C. Cпектр ЯMР 1H
2018. Р. 285. doi 10.1016/B978-0-08-102083-
(500 MГц), δ, м. Д.: 2.21 с (3H, CH3), 7.43-7.47
8.00008-X
м (5H, H4, H5, H6, H7, Hп), 7.52 д. д (2H, Ho, J =
11.
Anastas P.T., Warner J.C. Green Chemistry Theory and
Practice. New-York: Oxford University Press, 1998.
8.5, 1.4 Гц), 7.57 д. д (2H, Hм, J = 8.5, 7.2 Гц), 7.63
P. 516.
с (1H, H1′), 10.99 с (1H, N1H). Спектр ЯМР 13C
12.
Charushin V.N., Chupakhin O.N. Topics in Heterocyclic
(151 МГц), δС, м. д.: -115.98 (CF3, J = 288.8 Гц),
Chemistry. Switzerland: Springer, 2014. N 37. P. 1.
118.04 (C3), 124.4 (Co), 127.49 (C6), 127.67 (Cп),
13.
Makosza M., Wojciechowski K. Topics in Heterocyclic
127.76 (C5), 127.78 (C7), 129.27 (Cм), 130.99 (C4),
Chemistry. Switzerland: Springer, 2014. N 37. P. 50.
136.06 (C2), 132.84 (C7a), 139.22 (C1′), 139.44 (Ci),
14.
Zabaleta N., Uria U., Reyes E., Carrillo L., Vicario J.L. //
155.28 (C=O, J = 36.2 Гц). Спектр ЯМР 19F (376
Chem. Commun. 2018. Vol. 54. P. 8905. doi 10.1039/
МГц): δF -74.45 м. д. Масс-спектр, m/z (Iотн, %):
C8CC05311A
345 (80) [M]+, 276 (100).
15.
Tung T., Tezcan H., San M., Bueykguengoer O.,
Yagbasan R. // Acta Crystallogr. (C). 2003. Vol. 59.
КОНФЛИКТ ИНТЕРЕСОВ
P. 528. doi 10.1107/S0108270103016019
Авторы заявляют об отсутствии конфликта
16.
Китаев Ю.П., Бузыкин Б.И. Гидразоны. М.: Наука,
интересов
1974. 415 с.
17.
Jones R.O. // Rev. Mod. Phys. 2015. Vol. 87. P. 897. doi
CПИСОК ЛИТЕРАТУРЫ
10.1103/RevModPhys.87.897
1. Дьяконов А.Л., Тележенецкая М.В. // ХПС. 1997.
18.
Becke A.D // J. Chem. Phys. 1993. Vol. 98. P. 5648. doi
№ 33. С. 221.
10.1063/1.464913
2. Aniszewski T. Alkaloids. Helsinki: Elsevier Sci., 2015.
19.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
496 c.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
3. Asif M. // Int. J. Med. Chem. 2014. Article ID 395637.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
P. 1.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
4. Solyanik G.I. // Exp. Oncology. 2019. Vol. 41. P. 3. doi
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
10.32471/exp-oncology.2312-8852.vol-41-no-1.12414
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
5. Трегубенко И.П., Тарахтий Е.А., Чибиряк М.В., Го-
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
ломолзин Б.В., Егорова Л.Г. // Радиобиология. 1984.
mery Jr.J.A., Peralta J.E., Ogliaro F., Bearpark M.,
№ 24. С. 838.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
6. Пиличева Т.Л., Чупахин О.Н., Постовский И.Я. //
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
ХГС. 1975. № 4. С. 561; Pilicheva T.L., Chupakhin O.N.,
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Postovsky I.Ya. // Chem. Het. Compd. 1975. Вып. 11.
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
С. 561. doi 10.1007/BF00502444
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
7. Azev Yu.A., Shorshnev S.V., Golomolzin B.V. //
Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochter-
Tetrahedron Lett. 2009. Vol. 50. P. 2899. doi 10.1016/j.
ski J.W., Martin R.L., Morokuma K., Zakrzewski V.G.,
tetlet.2009.03.199
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
8. Азев Ю.А., Коптяева О.С., Селиверстова Е.А.,
Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
Ивойлова А.И., Поспелова Т.А. // ЖОХ. 2019. Т.
Cioslowski J., Fox D.J. Gaussian 09, Revision C. 01.
89. Вып. 12. С. 1854; Azev Yu.A., Koptyaeva O.S.,
Wallingford CT: Gaussian Inc. 2016.
Seliverstova E.A., Ivoilova A.V., Pospelova T.A. // Russ.
20.
Barilone J., Neese F. // Appl. Magn. Res. 2015. Vol. 46.
J. Gen. Chem. 2019. Vol. 89. N 12. P. 2374. doi 10.1134/
P. 117. doi 10.1007/s00723-014-0627-2
S1070363219120089
21.
Neese F. Wiley Interdiscip. Rev.: Comput. Mol. Sci.
9. Sundberg R.J. Indoles. San Diego: Acad. Press Inc.,
2012. N 2. P. 73. doi 10.1002/wcms.81
1996. 175 р.
22.
Stol S., Schweiger A. // J. Magn. Res. 2006. Vol. 178.
10. Chadra N., Silakari O. Key Heterocycle Cores for
P. 42. doi 10.1016/j.jmr.2005.08.013
Designing Multitargeting Molecules. Patiala: Elsevier,
23.
König W. // Ber. 1911. Bd 37. S. 4201.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1348
АЗЕВ и др.
Indole-3-carbaldehydes Arylhydrazones as Multisite
C-Nucleophiles in Reactions with Quinazoline
Yu. A. Azev*, O. S. Koptyaeva, O. S. Eltsov, Yu. A. Yakovleva, A. N. Tsmokalyuk,
A. V. Ivoilova, E. A. Seliverstova, T. A. Pospelova, and V. A. Bakulev
Ural Federal University, Yekaterinburg, 620002 Russia
*e-mail: azural@yandex.ru
Received April 15, 2020; revised April 15, 2020; accepted April 25, 2020
С,С-Coupling of indole-3-carbaldehyde arylhydrazones with quinazoline in trifluoroacetic acid proceeds at
position 5 or 7′ of the hydrazone molecule with the formation of σ-adducts. C,C-Coupling is accompanied
by a change in the E-configuration of the C=N bond of the starting hydrazones to the Z-configuration in the
quinazoline trifluoroacetylhydrazides formed.
Keywords: arylhydrazones, indole-3-carbaldehydes, С,С-coupling, quinazoline, trifluorohydrazides
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020