ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1358-1363
УДК 547.772.1;547.855.3;547.814.1
СИНТЕЗ 1-[3-(ГЕТАРИЛ)АЛЛИЛ]МОРФОЛИНОВ
В КАЧЕСТВЕ ПОТЕНЦИАЛЬНЫХ
АНТИХОЛИНЭСТЕРАЗНЫХ СРЕДСТВ
© 2020 г. Н. М. Чернов*, П. И. Ежов, Р. В. Шутов, И. П. Яковлев
Санкт-Петербургский государственный химико-фармацевтический университет,
ул. Профессора Попова 14/А, Санкт-Петербург, 197376 Россия
*e-mail: nikita.chernov@pharminnotech.com
Поступило в Редакцию 26 мая 2020 г.
После доработки 26 мая 2020 года
Принято к печати 7 июня 2020 года
На основе реакции хромонсодержащих аллилморфолинов с 1,2- и 1,3-бинуклеофильными реагентами
(гидразин, гуанидин, ацетамидин) получен ряд новых производных пиразола и пиримидина, содержащих
аллилморфолиновый фрагмент. Синтез протекает в мягких условиях (этанол, комнатная температура)
с высокими выходами. Полученные соединения представляют интерес как потенциальные антихолин-
эстеразные средства.
Ключевые слова: хромон, аллиламин, морфолин, пиразол, пиримидин, антихолинэстеразная активность
DOI: 10.31857/S0044460X2009005X
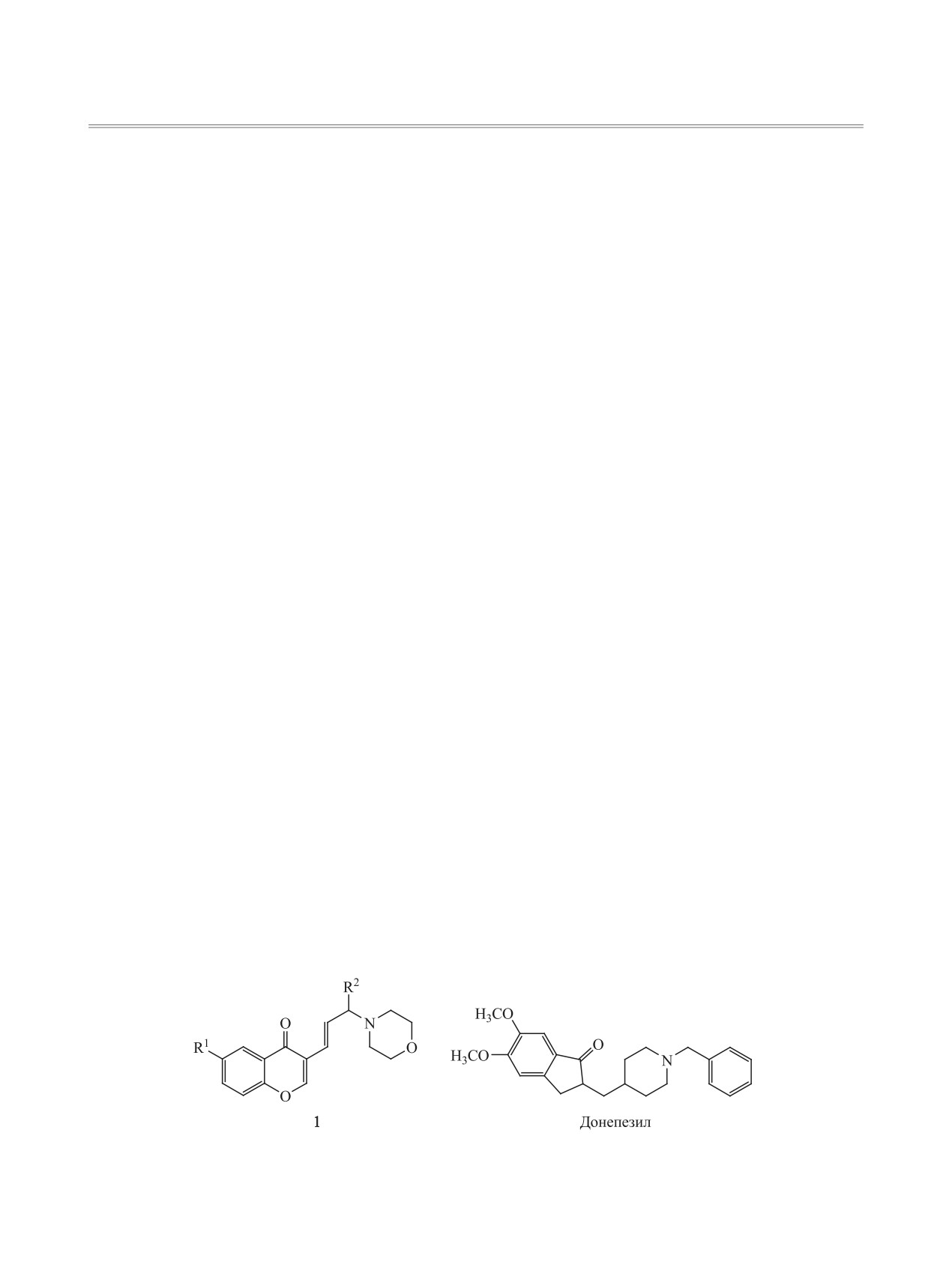
Исследования биологически активных хромо-
перспективными для применения в терапии ней-
нов занимают на сегодняшний день важное место
родегенеративных заболеваний. С другой сторо-
в химии гетероциклических соединений [1, 2],
ны, хромоновую систему соединений 1 можно
в том числе из-за роли хромоновой системы как
использовать для построения других гетероцикли-
основы вторичных метаболитов растений (напри-
ческих систем. Полученные таким образом гета-
мер, флавоноидов). Вызывает интерес и реакцион-
рилаллилморфолины потенциально также могут
ная способность данной группы веществ, облада-
являться ингибиторами холинэстеразы. Антихо-
ющей высоким синтетическим потенциалом. Так,
линэстеразные препараты часто обладают общими
хромоны способны выступать предшественника-
структурными мотивами, в частности, включают
ми азолов [3], азинов [4] и других гетероцикличе-
ароматическую систему в сочетании с фрагментом
ских систем [5, 6].
циклического амина в качестве акцептора водо-
В одной из более ранних работ [7] нами был
родных связей [8]. Примером является донепезил
разработан подход к синтезу хромонсодержащих
(схема 1).
аллилморфолинов 1, проявивших антихолинэсте-
Наиболее продуктивным подходом к конструи-
разную активность, что делает данные структуры
рованию гетероциклических соединений на осно-
Схема 1.
1358
СИНТЕЗ 1-[3-(ГЕТАРИЛ)АЛЛИЛ]МОРФОЛИНОВ
1359
Схема 2.
Схема 3.
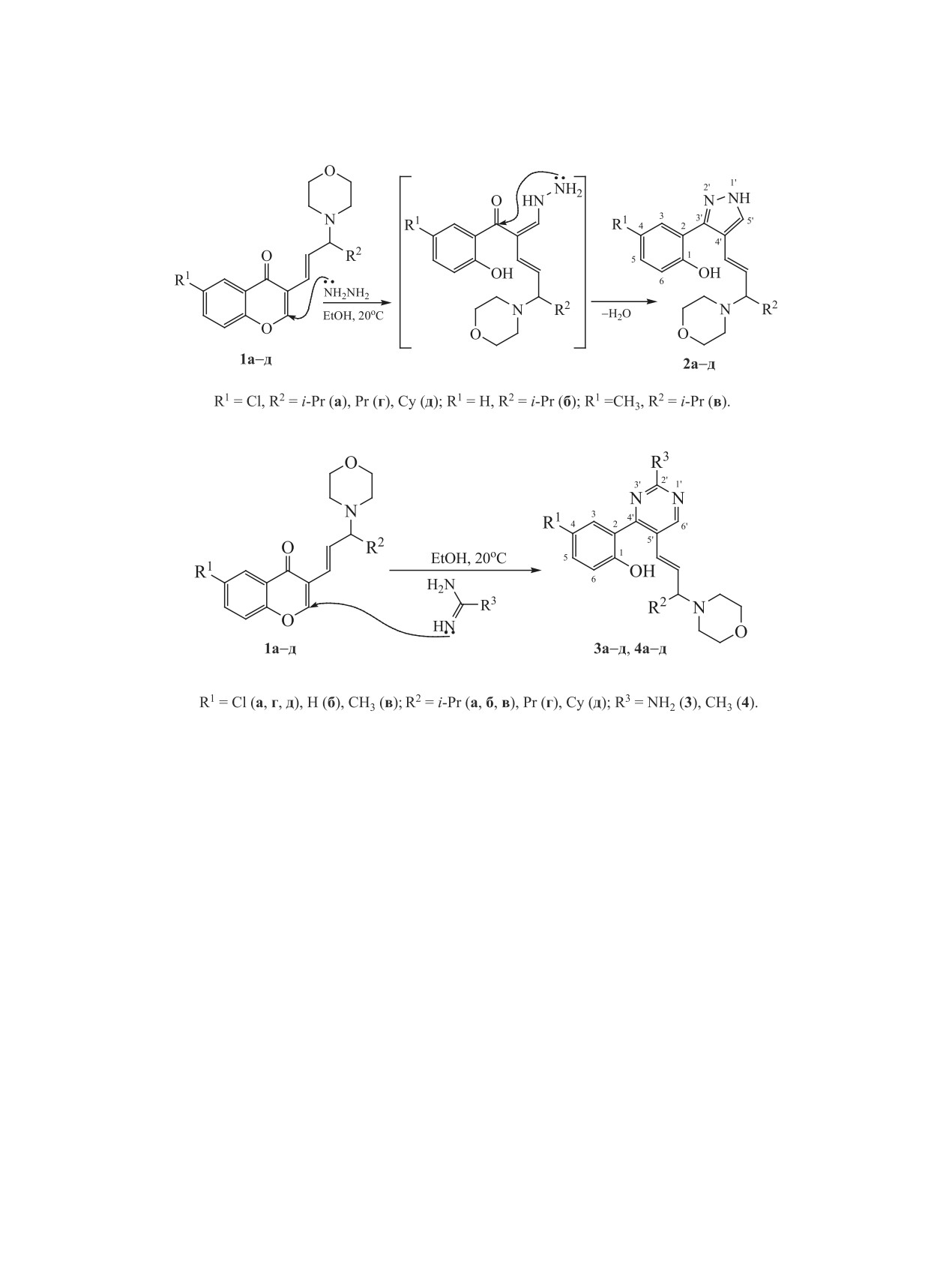
ве хромона являются реакции с 1,2- и 1,3-N,N-би-
В аналогичных условиях протекала реакция
нуклеофильными реагентами [9]. На первом этапе
хромонсодержащих аллилморфолинов
1а-д с
мы исследовали реакцию хромонов 1а-д с пред-
представителями
1,3-N,N-бинуклеофильных ре-
ставителем 1,2-бинуклеофильных реагентов - ги-
агентов - гуанидином и ацетамидином (схема 3).
дразином (схема 2). Реакция протекала в мягких
Синтез также проходил в мягких условиях и при-
условиях (этанол, комнатная температура) с не-
водил к производным пиримидина 3а-д и 4а-д с
большим (20 мол. %) избытком гидразина и при-
выходами 79-92 и 71-91% соответственно (табл. 1).
водила к пиразолсодержащим аллилмофролинам
Варьирование заместителей как в хромоновом
2а-д с умеренно высокими выходами (73-87%,
(R1), так и в аллильном фрагментах (R2) незначи-
табл. 1).
тельно отражается на выходе целевых продуктов.
Данный синтез представляет собой вариант
Скорость реакции также не имеет выраженной
синтеза Кнорра, в котором хромон, содержащий
зависимости от электронной природы заместите-
замаскированную β-дикарбонильную систему,
лей; во всех случаях полная конверсия (контроль
выступает донором трехуглеродного фрагмента
по ТСХ) исходных хромонов 1а-д достигалась за
при построении пиразольного цикла. Предполо-
4-7 ч.
жительно, реакция начинается с нуклеофильной
Строение полученных гетарилсодержащих ал-
атаки гидразином по положению 2 хромона с по-
лилморфолинов 2а-д, 3а-д и 4а-д было доказано
следующим замыканием нового гетероцикла по
с помощью спектроскопии ЯМР 1H и 13C (табл. 2).
положению 4.
Характерным признаком раскрытия хромоновой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1360
ЧЕРНОВ и др.
Таблица 1. Выходы, температуры плавления и данные масс-спектрометрии соединений 2-4
m/z [M + H]+
№
Выход, %
Т. пл., °C
Формула
найдено
вычислено
2а
73
120-122
C19H24ClN3O2
362.1628
362.1630
2б
79
119-121
C19H25N3O2
328.2027
328.2020
2в
82
130-131
C20H27N3O2
342.2171
342.2176
2г
78
124-126
C19H24ClN3O2
362.1632
362.1630
2д
87
134-135
C22H28ClN3O2
402.1936
402.1943
3а
90
123-125
C20H25ClN4O2
389.1734
389.1739
3б
81
121-122
C20H26N4O2
355.2133
355.2129
3в
92
126-128
C21H28N4O2
369.2284
369.2285
3г
79
110-111
C20H25ClN4O2
389.1739
389.1739
3д
84
138-140
C23H29ClN4O2
429.2058
429.2052
4а
78
129-131
C21H26ClN3O2
388.1781
388.1786
4б
75
124-126
C21H27N3O2
354.2170
354.2176
4в
71
131-132
C22H29N3O2
368.2335
368.2333
4г
75
118-120
C21H26ClN3O2
388.1787
388.1786
4д
91
136-137
C24H30ClN3O2
428.2104
428.2099
системы является уширенный синглет феноль-
ющему показателю донепезила (14±2 мкМ. [10]),
ной ОН-группы в спектрах ЯМР 1H соединений
можно сделать вывод о перспективности дальней-
2а-д, который наблюдается в слабом поле (11.56-
ших исследований пиразол- и 2-аминопиримидин-
12.85 м. д.) из-за влияния пиразольного цикла.
содержащих аллилморфолинов 2а-д и 3а-д как
Специфическим является также синглет прото-
потенциальных ингибиторов холинэстераз.
на Н5′ пиразолов 2а-д в области 7.84-7.87 м. д.,
Таким образом, были получены ряды пиразол-
который значительно смещен в сильное поле по
и пиримидинсодержащих аллилморфолинов с
сравнению с сигналом протона Н2 хромонов 1а-д
использованием хромонов как эквивалентов β-ди-
(8.57-8.63 м. д. [7]). Синглет протона H6′ в спек-
карбонильных соединений. Приведенные синтезы
трах производных пиримидина 3а-д и 4а-д (8.48-
осуществляются в мягких условиях (этанол, ком-
8.51 и 8.86-8.92 м. д. соответственно) расположен
натная температура) с высокими выходами целе-
практически в той же области, что и сигнал Н2
вых продуктов.
хромонов 1а-д. Можно отметить, что экзоцикли-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ческая двойная связь сохраняет транс-конфигура-
цию в ходе реакции.
Спектры ЯМР 1H и 13C растворов синтезиро-
В спектрах ЯМР 13C важным является исчез-
ванных соединений в ДМСО-d6 зарегистрированы
новение характерного слабопольного сигнала
на спектрометре Bruker Avance III (400 и 100 МГц)
атома углерода С4 хромоновой системы (174.54-
с использованием остаточного сигнала дейтериро-
174.88 м. д. [7]), а также появление ряда сигналов,
ванного растворителя как внутреннего стандарта.
соответствующих пиразольной и пиримидиновой
Масс-спектры высокого разрешения (HRMS) с ио-
системам.
низацией электроспреем (ESI) записаны на спек-
трометре Bruker micrOTOF. Тонкослойную хрома-
В ходе предварительных испытаний были опре-
тографию для доказательства индивидуальности
делены полуингибирующие концентрации (IC50)
соединения и полноты прохождения реакции вы-
соединений 2а, 3а и 4а в отношении бутирилхо-
полняли на пластинах Silica gel 60 F254 (Merck),
линэстеразы лошади. Производное 2-метилпири-
элюент - этилацетат, проявление в УФ свете. Тем-
мидина 4а оказалось неактивным (IC50 >100 мкМ.),
пературы плавления определяли капиллярным ме-
в то время как пиразол 2а и 2-аминопиримидин 3а
тодом и не корректировали.
обладают полуингибирующими концентрациями
18.0±0.7 и 17.4±0.6 мкМ. соответственно. Учиты-
Исходные хромонсодержащие аллилморфоли-
вая близость полученных значений к соответству-
ны или их гидрохлориды получали по известному
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ 1-[3-(ГЕТАРИЛ)АЛЛИЛ]МОРФОЛИНОВ
1361
Таблица 2. Данные спектроскопии ЯМР 1H и 13С (ДМСО-d6) соединений 2-4
№
δ, м. д. (J, Гц)
δC, м. д.
2а
0.80 д (3H, J = 6.5, CH3), 0.90 д (3H, J = 6.5, CH3), 1.88 м (1H, CH),
19.07, 20.74, 27.98, 50.47, 67.06,
2.33-2.46 м (5H, OCH2CH2N, CH), 3.54 м (4Н, OCH2CH2N), 5.73 д. д
74.40, 117.23, 118.42, 120.12, 121.80,
(1H, J = 9.5, 15.8, CH=CH), 6.24 д (1H, J = 15.8, CH=CH), 6.95 д (1H,
124.61,
126.46,
129.18,
129.54,
J 8.5, H6), 7.21 д. д (1H, J = 2.0, 8.5, H5), 7.27 д (1H, J = 2.0, H3), 7.85 c
133.28, 139.98, 155.82
(1H, H5’), 11.56 уш. с (2H, OH, NH)
2б
0.81 д (3H, J = 6.5, CH3), 0.91 д (3H, J 6.5, CH3), 1.88 м (1H, CH), 2.34-
19.10, 20.75, 28.04, 50.46, 67.08,
2.45 м (5H, OCH2CH2N, CH), 3.55 м (4Н, OCH2CH2N), 5.76 д. д (1H,
74.45, 116.72, 116.98, 118.15, 118.95,
J = 9.5, 15.8, CH=CH), 6.26 д (1H, J = 15.8, CH=CH), 6.85 псевдо-т (1H,
124.67,
125.74,
128.71,
130.35,
J = 7.3, H4), 6.97 д (1H, J = 7.3, H6), 7.20 псевдо-т (1H, J = 7.3, H5), 7.29
133.46, 140.76, 156.29
д (1H, J = 7.3, H3), 7.86 c (1H, H5’), 11.72 уш. с (2H, OH, NH)
2в
0.81 д (3H, J = 6.3, CH3), 0.91 д (3H, J = 6.3, CH3), 1.88 м (1H, CH), 2.22 c
19.07, 20.52, 20.73, 28.02, 50.46,
(3H, CH3), 2.35-2.47 м (5H, OCH2CH2N, CH), 3.56 м (4H, OCH2CH2N),
67.06, 74.44, 116.37, 117.07, 117.85,
5.74 д. д (1H, J = 9.5, 15.8, CH=CH), 6.25 д (1H, J = 15.8, CH=CH), 6.86
124.87,
126.14,
127.76,
130.05,
д (1H, J = 8.3, H6), 7.02 д (1H, J = 8.3, H5), 7.11 с (1H, H3), 7.84 c (1H,
130.17, 130.87, 140.93, 153.31
H5’), 9.81 уш. с (1H, OH), 12.85 уш. с (1H, NH)
2г
0.87 т (3H, J = 7.0, CH3), 1.24-1.38 м (4H, CH2), 1.56 м (1H, CH), 2.44
14.49, 19.45, 34.00, 50.25, 67.02,
м (4Н, OCH2CH2N), 2.77 м (1H, CH), 3.54 м (4H, OCH2CH2N), 5.79 д. д
67.50, 117.38, 118.22, 120.22, 122.42,
(1H, J = 8.8, 15.8, CH=CH), 6.24 д (1H, J = 15.8, CH=CH), 6.97 д (1H, J =
123.29,
128.45,
129.31,
129.77,
8.3, H6), 7.25 м (2H, H3, H5), 7.87 c (1H, H5’), 11.78 уш. с (2H, OH, NH)
133.14, 139.89, 154.97
2д
0.87 м (2Н), 1.15 м (3H), 1.65 м (5H), 1.83 м (1H), 2.40 м (4H, OCH2CH2N),
26.27, 26.33, 26.86, 29.65, 30.80,
3.53 м (4H, OCH2CH2N), 5.74 д. д (1H, J = 9.3, 15.8, CH=CH), 6.19 д
37.84, 50.25, 67.06, 73.26, 117.33,
(1H, J = 15.8, CH=CH), 7.00 д (1H, J = 8.5, H6), 7.25 м (2H, H3, H5), 7.85
118.34,
120.18,
122.20,
124.40,
c (1H, H5’), 11.79 уш. с (2H, OH, NH)
126.87,
129.20,
129.64,
133.07,
139.89, 155.28
3а
0.78 д (3H, J = 5.5, CH3), 0.87 д (3H, J = 5.5, CH3), 1.87 м (1H, CH),
19.12, 20.71, 28.00, 50.45, 67.05,
2.32 м (3H, OCH2CH2N, CH), 2.43 м (2H, OCH2CH2N), 3.54 м (4H,
74.39, 118.46, 118.63, 122.08, 125.94,
OCH2CH2N), 5.85 д. д (1H, J = 9.3, 15.8, CH=CH), 6.07 д (1H, J = 15.8,
127.04,
128.49,
129.96,
130.37,
CH=CH), 6.87 уш. с (2H, NH2), 6.94 д (1H, J = 8.5, H6), 7.26 м (2H, H3,
155.40, 157.56, 161.69, 162.28
H5), 8.50 c (1H, H6’), 10.84 уш. с (1H, OH)
3б
0.78 д (3H, J = 6.8, CH3), 0.87 д (3H, J = 6.8, CH3), 1.88 м (1H, CH),
19.15, 20.45, 28.12, 50.48, 67.08,
2.21-2.40 м (5H, OCH2CH2N, CH), 3.53 м (4H, OCH2CH2N), 5.88 д. д
74.26, 116.50, 117.02, 119.07, 125.43,
(1H, J = 9.5, 15.8, CH=CH), 6.20 д (1H, J = 15.8, CH=CH), 6.86 м (3H,
127.01,
128.86,
130.61,
131.00,
NH2, H4), 6.92 д (1H, J = 7.8, H6), 7.21 д (1H, J = 7.8, H3), 7.29 м (1H,
154.92, 157.89, 161.93, 162.55
H5), 8.51 c (1H, H6’), 10.68 уш. с (1H, OH)
3в
0.80 д (3H, J = 6.5, CH3), 0.89 д (3H, J = 6.5, CH3), 1.89 м (1H, CH), 2.20
19.18, 20.40, 20.72, 28.10, 50.49,
с (3H, CH3), 2.33 м (3H, OCH2CH2N, CH), 2.45 м (2H, OCH2CH2N), 3.54
67.08, 74.43, 116.83, 118.32, 122.88,
м (4H, OCH2CH2N), 5.85 д. д (1H, J = 9.3, 15.8, CH=CH), 6.14 д (1H, J =
126.72,
127.28,
129.17,
130.96,
15.8, CH=CH), 6.85 м (3H, NH2, H6), 7.08 д (1H, J = 8.0, H5), 7.13 c (1H,
131.66,
154.37,
158.06,
161.97,
H3), 8.48 c (1H, H6’), 10.59 уш. с (1H, OH)
162.77
3г
0.81 т (3H, J = 7.3, CH3), 1.25-1.50 м (4H, CH2), 2.33 м (2H, OCH2CH2N),
14.43, 19.28, 33.61, 50.39, 67.05,
2.42 м (2H, OCH2CH2N), 2.76 м (1H, CH), 3.52 м (4H, OCH2CH2N), 6.15
67.57, 118.42, 118.68, 121.79, 126.04,
д. д (1H, J = 8.8, 16.1, CH=CH), 6.22 д (1H, J = 16.1, CH=CH), 6.87 м
126.82,
128.39,
130.03,
130.32,
(3H, NH2, H6), 7.19 д (1H, J = 2.5, H3), 7.23 д. д (1H, J = 2.5, 8.8, H5), 8.49
154.95, 157.47, 161.53, 162.30
c (1H, H6’), 11.01 уш. с (1H, OH)
3д
0.76-0.87 м (2H), 1.04-1.14 м (3H), 1.51-1.80 м (7H), 2.27 м (2H,
26.25, 26.82, 29.64, 30.74, 32.31,
OCH2CH2N), 2.42 м (3H, OCH2CH2N, CH), 3.50 м (4H, OCH2CH2N),
37.83, 50.24, 67.04, 73.27, 118.62,
5.83 д. д (1H, J = 9.5, 15.8, CH=CH), 6.06 д (1H, J = 15.8, CH=CH), 6.82
118.78,
121.50,
126.10,
127.28,
уш. с (2H, NH2), 6.93 д (1H, J = 8.5, H6), 7.22 м (2H, H3, H5), 8.48 c (1H,
128.47,
129.88,
130.23,
156.05,
H6’), 11.12 уш. с (1H, OH)
157.38, 162.02, 162.27
4а
0.76 д (3H, J = 6.0, CH3), 0.86 д (3H, J = 6.0, CH3), 1.89 м (1H, CH), 2.30-
18.96, 20.57, 25.77, 27.88, 50.38,
2.41 м (5H, OCH2CH2N, CH), 2.62 с (3H, CH3), 3.53 м (4H, OCH2CH2N),
67.04, 74.15, 118.01, 122.81, 126.67,
6.13 м (2H, CH=CH), 6.96 д (1H, J = 8.5, H6), 7.23 c (1H, H3), 7.33 д (1H,
126.82,
127.40,
130.11,
130.51,
J = 8.5, H5), 8.92 c (1H, H6’), 10.21 уш. с (1H, OH)
132.39, 154.23, 155.17, 160.80, 165.59
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1362
ЧЕРНОВ и др.
Таблица 2. (продолжение)
№
δ, м. д. (J, Гц)
δC, м. д.
4б
0.76 д (3H, J = 6.8, CH3), 0.85 д (3H, J = 6.8, CH3), 1.87 м (1H, CH), 2.26-
18.95, 20.58, 25.80, 27.91, 50.38, 67.04,
2.42 м (5H, OCH2CH2N, CH), 2.62 с (3H, CH3), 3.51 м (4H, OCH2CH2N),
74.19, 116.36, 118.99, 125.05, 126.77,
6.08-6.20 м (2H, CH=CH), 6.87 псевдо-т (1H, J = 7.5, H4), 6.94 д (1H,
127.84, 130.68, 130.84, 131.70, 154.81,
J = 7.5, H6), 7.18 д (1H, J = 7.5, H3), 7.27 псевдо-т (1H, J = 7.5, H5), 8.88
155.56, 162.52, 165.45
c (1H, H6’), 10.35 уш. с (1H, OH)
4в
0.79 д (3H, J = 6.5, CH3), 0.88 д (3H, J = 6.5, CH3), 1.89 м (1H, CH), 2.21
19.01, 20.45, 20.76, 25.74, 27.98, 50.37,
с (3H, CH3), 2.33-2.45 м (5H, OCH2CH2N, CH), 2.61 с (3H, CH3), 3.53 м
67.05, 74.34, 116.78, 122.49, 126.52,
(4H, OCH2CH2N), 6.11 м (2H, CH=CH), 6.84 д (1H, J = 8.3, H6), 7.06 д
126.78, 127.67, 130.37, 131.10, 131.99,
(1H, J = 8.3, H5), 7.17 c (1H, H3), 8.91 c (1H, H6’), 10.28 уш. с (1H, OH)
153.96, 155.03, 161.02, 165.73
4г
0.80 т (3H, J = 7.3, CH3), 1.16-1.54 м (4H, CH2), 2.35 м (2H, OCH2CH2N),
14.45, 19.25, 25.77, 33.55, 50.19, 67.00,
2.41 м (2H, OCH2CH2N), 2.61 с (3H, CH3), 2.75 м (1H, CH), 3.49 м (4H,
67.28, 118.36, 121.33, 126.44, 126.86,
OCH2CH2N), 6.17 д. д (1H, J = 7.8, 16.1, CH=CH), 6.24 д (1H, J = 16.1,
126.99, 130.01, 130.30, 133.60, 154.67,
CH=CH), 6.89 д (1H, J = 8.8, H6), 7.16 д (1H, J 2.5, H3), 7.24 д. д (1H,
155.93, 161.49, 165.55
J = 2.5, 8.8, H5), 8.88 c (1H, H6’), 10.24 уш. с (1H, OH)
4д
25.80, 26.22, 26.27, 26.78, 29.50,
0.73-0.86 м (2H), 1.07-1.17 м (3H), 1.52-1.64 м (6H), 2.26 м (2H,
30.62, 37.72, 50.18, 67.04, 73.08,
OCH2CH2N), 2.43 м (3H, OCH2CH2N, CH), 2.61 c (3H, CH3), 3.48 м
118.66,
126.91,
127.15,
127.82,
(4H, OCH2CH2N), 6.11 д. д (1H, J = 9.0, 16.1, CH=CH), 6.20 д (1H, J =
127.92,
129.92,
130.16,
131.84,
16.1, CH=CH), 6.86 д (1H, J = 8.5, H6), 7.11 д (1H, J = 2.5, H3), 7.18 д. д
154.57, 157.09, 161.91, 165.45
(1H, J = 2.5, 8.5, H5), 8.86 c (1H, H6’), 10.28 уш. с (1H, OH)
методу [7]. Основания гуанидина и ацетамидин
гидрокарбоната натрия до pH = 7. Осадок пирими-
получали в виде этанольного раствора из соответ-
дина 3а-д или 4а-д отфильтровывали, промывали
ствующих гидрохлоридов по методике [4].
водой и сушили на воздухе. Для синтеза с равным
успехом может быть применен гидрохлорид амина
Общая методика взаимодействия хромон-
1а-д, при этом используют 4.4 ммоль гуанидина
содержащих аллилморфолинов 1а-д с гидра-
или ацетамидина.
зином. Смесь 2 ммоль хромона 1а-д и 120 мкл
(120 мг, 2.4 ммоль) гидрата гидразина в 10 мл
Выходы, температуры плавления и данные
этанола перемешивали 4-7 ч. Контроль за ходом
масс-спектрометрии соединений 2-4 представле-
реакции осуществляли с помощью ТСХ. После
ны в табл. 1, данные спектров ЯМР - в табл. 2.
окончания реакции полученную смесь выливали в
Изучение антихолинэстеразной активности.
100 мл 0.1 н. соляной кислоты и отфильтровывали
Антихолинстеразную активность соединений 2а,
нерастворимые примеси. К фильтрату прибавляли
3а и 4а определяли по отношению к бутирилхо-
раствор гидрокарбоната натрия до pH = 7. Оса-
линэстеразе из лошадиной сыворотки (C7512-
док пиразола 2а-д отфильтровывали, промывали
6KU; Sigma) спектрофотометрическим методом
водой и сушили на воздухе. Для синтеза с рав-
[11]. Эксперимент вели в 96-луночных планшетах.
ным успехом может быть применен гидрохлорид
В каждую лунку помещали 0.02 Ед бутирилхолин-
аллиламина 1а-д; в этом случае к реакционной
эстеразы и 50 мкл раствора соединения 2а, 3а или
массе дополнительно прибавляли 1 экв. (2 ммоль,
4а в ДМСО, содержащего 6.25, 12.5, 25, 50, 100
100 мкл) гидрата гидразина.
или 200 мкмоль изучаемого вещества, затем дово-
Общая методика взаимодействия хромон-
дили объем смеси до 250 мкл 0.1 М. фосфатным
содержащих аллилморфолинов 1а-д с гуани-
буфером с pH = 8. Планшеты инкубировали в тече-
дином и ацетамидином. К раствору 2.4 ммоль
ние 20 мин при 37°С и добавляли 0.35 мМ. иодида
бинуклеофильного реагента в 10 мл этанола при-
бутирилтиохолина (20820-5G, Sigma) и 0.35 мМ.
бавляли 2 ммоль хромона 1а-д, и реакционную
5,5′-дитиобис-2-нитробензойной кислоты (DTNB,
массу перемешивали 4-7 ч. Контроль за ходом
D218200-1G, Sigma). Оптическую плотность при
реакции осуществляли с помощью ТСХ. По за-
λ = 410 нм измеряли в кинетическом режиме каж-
вершении реакции смесь выливали в 100 мл 0.1
дые 60 с в течение 10 мин на ридере Tecan Infinite
н. соляной кислоты и отфильтровывали нераство-
M200 Pro. Значения IC50 определяли графически
римые примеси. К фильтрату прибавляли раствор
по кривым ингибирования (зависимость степени
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ 1-[3-(ГЕТАРИЛ)АЛЛИЛ]МОРФОЛИНОВ
1363
ингибирования от десятичного логарифма концен-
4. Chernov N.M., Shutov R.V., Potapova A.E., Yakovlev I.P. //
трации ингибитора). Контрольный эксперимент
Synthesis. 2020. Vol. 52. N 1. P. 40. doi 10.1055/s-
проводили в тех же условиях без ингибитора, кон-
0039-1690723
5. Chernov N.M., Shutov R.V., Sharoyko V.V., Kuz’-
трольный образец содержал буфер, ДМСО, DTNB
mich N.N., Belyakov A.V., Yakovlev I.P. // Eur. J.
и субстрат.
Org. Chem. 2017. Vol. 2017. P. 2836. doi 10.1002/
ФОНДОВАЯ ПОДДЕРЖКА
ejoc.201700310
Работа выполнена при стипендиальной под-
6. Bornadiego A., Díaz J., Marcos C.F. // J. Org. Chem.
2015. Vol. 80. N 12. P. 6165. doi 10.1021/acs.
держке Совета по грантам Президента Российской
joc.5b00658
Федерации (конкурс СП-2019).
7. Chernov N.M., Shutov R.V., Barygin O.I., Dron M.Y.,
КОНФЛИКТ ИНТЕРЕСОВ
Starova G.L., Kuz’mich N.N., Yakovlev I.P. // Eur. J.
Org. Chem. 2018. Vol. 2018. N 45. P. 6034. doi 10.1002/
Авторы заявляют об отсутствии конфликта
ejoc.201801159
интересов.
8. Gupta R.C., Dekundy A. // Drug Dev. Res. 2017. Vol. 68.
СПИСОК ЛИТЕРАТУРЫ
N 5. P. 253. doi 10.1002/ddr.20186
9. Plaskon A.S., Grygorenko O.O., Ryabukhin S.V. //
1. Gaspar A., Matos M.J., Garrido J., Uriarte E., Borges F. //
Tetrahedron. 2012. Vol. 68. P. 2743. doi 10.1016/j.
Chem. Rev. 2014. Vol. 114. N 9. P. 4960. doi 10.1021/
cr400265z
tet.2012.01.077
2. Ruan J., Zheng C., Liu Y., Qu L., Yu H., Han L., Zhang Y.,
10. Filippova P.V., Chernov N.M., Shutov R.V., Yakovlev I.P. //
Wang T. // Molecules. 2017. Vol. 22. P. 1698. doi
Russ. J. Gen. Chem. 2019. Vol. 89. N 12. P. 2471. doi
10.3390/molecules22101698
10.1134/S1070363219120235
3. Santos C.M.M., Silva V.L.M., Silva A.M.S. //
11. Ellman G.L., Courtney K.D., Andres V., Feathersto-
Molecules. 2017. Vol. 22. N 10. P. 1665. doi 10.3390/
ne R.M. // Biochem. Pharmacol. 1961. Vol. 7. P. 88. doi
molecules22101665
10.1016/0006-2952(61)90145-9
Synthesis of 1-[3-(Hetaryl)allyl]morpholines
as Potential Anticholinesterase Agents
N. M. Chernov*, P. I. Ezhov, R. V. Shutov, and I. P. Yakovlev
St. Petersburg State Chemical Pharmaceutical University, St. Petersburg, 197376 Russia
*e-mail: nikita.chernov@pharminnotech.com
Received May 26, 2020; revised May 26, 2020; accepted June 7; 2020
A number of new pyrazole and pyrimidine derivatives containing an allylmorpholine fragment were obtained
by reactions of chromone-containing allylmorpholines with 1,2- and 1,3-binucleophiles (hydrazine, guanidine,
acetamidine). The syntheses were carried out under mild conditions (ethanol, room temperature), and the target
products were isolated with high yields. The obtained compounds are of interest as potential cholinesterase
inhibitors.
Keywords: chromone, allylamine, morpholine, pyrazole, pyrimidine, anticholinesterase activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020