ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1376-1381
УДК 542.91:547.466.2:547.241
СИНТЕЗ ФОСФИНОВЫХ ИЗОСТЕРOB ЛЕЙЦИЛ-
И ИЗОЛЕЙЦИЛГЛИЦИНОВ
© 2020 г. С. Р. Головаш, М. Э. Дмитриев, В. И. Шестов, В. В. Рагулин*
Институт физиологически активных веществ Российской академии наук,
Северный проезд 1, Черноголовка, 142432 Россия
*e-mail: rvalery@dio.ru
Поступило в Редакцию 26 марта 2020 г.
После доработки 26 марта 2020 г.
Принято к печати 8 апреля 2020 г.
Получены фосфиновые изостеры лейцилглицина и изолейцилглицина амидоалкилированием в аце-
тилхлориде (3-бензилокси-3-оксопропил)фосфонистой кислоты, включающей структурный изостерный
фрагмент бензилового эфира глицина. Исследована трехкомпонентная амидная версия реакции Кабач-
ника-Филдса с участием метил- и (бензил)карбаматов и 2(3)-метилбутаналей в условиях ацилирования
исходной (3-бензилокси-3-оксопропил)фосфонистой кислоты и генерирования in situ бисацетилпроиз-
водного трехкоординированного фосфора, образование которого зафиксировано с помощью ЯМР 31Р.
Ключевые слова: псевдолейцилглицин, псевдоизолейцилглицин, ацетилхлорид, амидоалкилирование,
бисацетил(3-бензилокси-3-оксопропил)фосфонит
DOI: 10.31857/S0044460X20090085
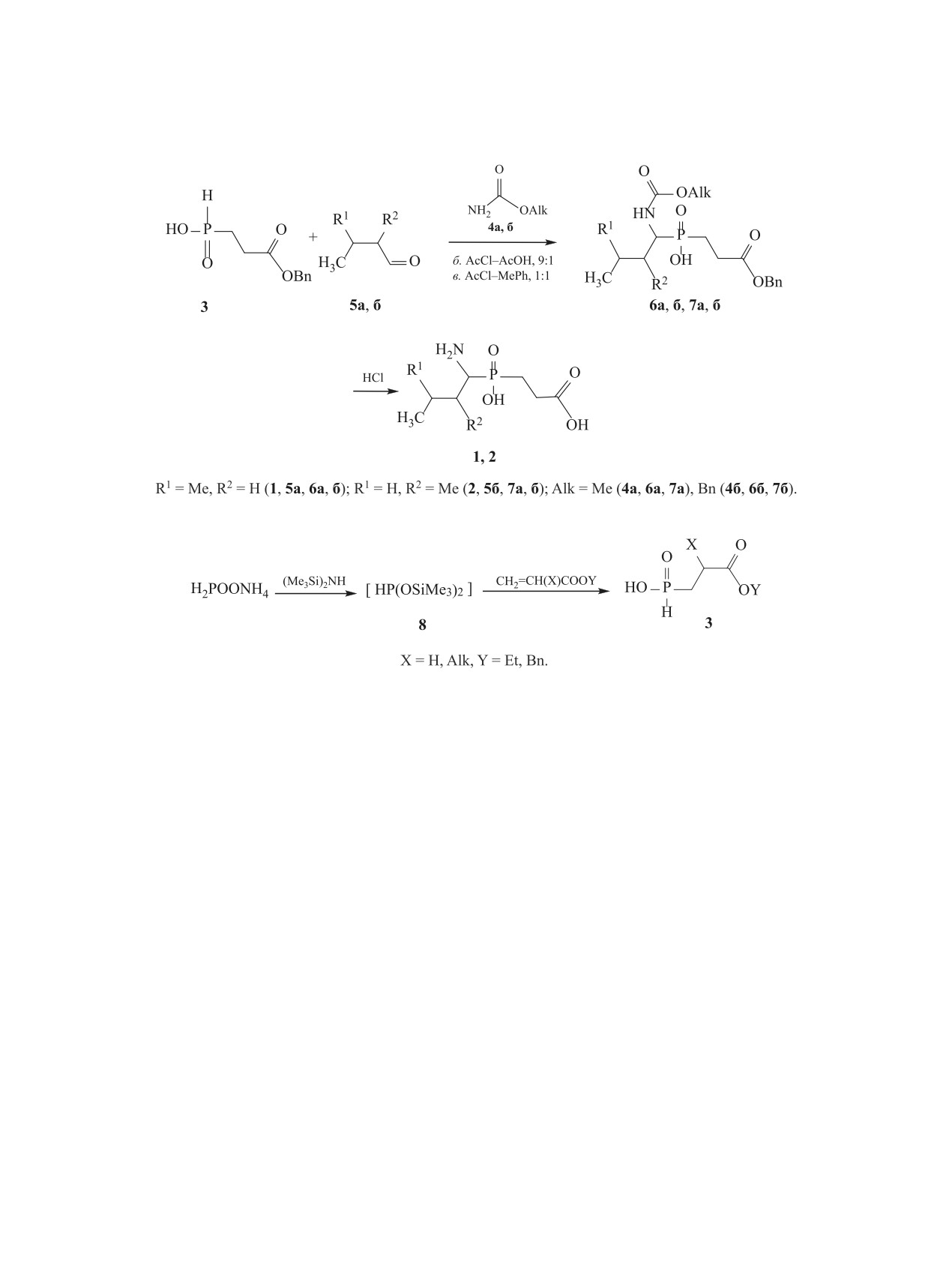
Фосфиновые пептиды являются изостерами
или 2 (схема 1) [7-9] заключается в амидоалкили-
природных пептидов, в молекуле которых пептид-
ровании фосфонистых кислот 3 (PC-компоненты),
ная связь NHC(O) замещена хелатирующим цинк
включающих структурный изостер аминокислоты
метиленфосфорильным фрагментом CH2P(O)(OH),
(на схеме 1 - изостер глицина), с использованием
имитирующим природную пептидную связь в
алкилкарбаматов 4 и альдегидов 5. При этом обра-
переходном состоянии пептидного гидролиза с
зуются N-защищенные аминофосфиновые кисло-
тетракоординированным атомом углерода [1-3].
ты 6а, б и 7а, б, гидролиз которых приводит к целе-
Фосфиновые пептиды, включающие негидроли-
вым фосфиновым псевдопептидам 1 и 2 (схема 1).
зуемый фосфиновый фрагмент, связывающий две
В развитие предложенной ранее стратегии
аминокислотные компоненты дипептида, - эффек-
синтеза фосфоизостеров пептидов из гипофос-
тивные ингибиторы Zn-металлопротеиназ [3, 4].
фитов
[7-12] нами получены псевдолейцил-
Преобладающая на данный момент NP+C-стра-
ψ[P(O)(OH)CH2]глицин
1 и псевдоизолейцил-
тегия синтеза фосфиновых дипептидов базируется
ψ[P(O)(OH)CH2]глицин 2 (схема 1) - перспектив-
на исследованиях в компании «Ciba-Geigy» [5, 6]
ные ингибиторы матриксных металлопротеиназ,
методов получения N,P-защищенных строитель-
представляющих собой семейство Zn-эндопроте-
ных блоков, представляющих собой фосфонистый
аз, вовлеченных в разнообразные биологические
изостер природной аминокислоты. Присоедине-
процессы [2-4, 13, 14].
ние последних по Михаэлю-Пудовику к соответ-
Предложенный нами ранее [7-10] подход к
ствующим α-замещенным акрилатам приводит к
синтезу РС-компоненты 3 основан на способ-
образованию фосфиновых пептидов [3, 4].
ности гипофосфитов к эффективному образова-
Развиваемая нами более короткая перспектив-
нию одной или двух фосфор-углеродных связей
ная N+PC-стратегия синтеза фосфиновых пепти-
симметричного и несимметричного характера
дов с обратным порядком построения молекул 1
[15, 16]. Генерируемый in situ из солей гипофос-
1376
СИНТЕЗ ФОСФИНОВЫХ ИЗОСТЕРOB
1377
Схема 1.
Схема 2.
фористой кислоты бис(триметилсилил)гипо-
зилоксикарбонил)амино]-2-метилбутил}[2-(эток-
фосфит 8 в мягких условиях при определенном
сикарбонил)этил]фосфиновую кислоту [17], эток-
соотношении реагентов образует продукт при-
сикарбонильный аналог кислоты 7б, привела к
соединения
(1:1) к α-замещенным акрилатам
частичному дезалкилированию этоксикарбониль-
(схема 2) [11, 12, 16]. В молекуле фосфонистых
ной функции и образованию (до 20%) фосфиновой
кислот
3 присутствует структурный изостер-
кислоты с карбоксильной функцией. Это усложня-
ный фрагмент соответствующей аминокислоты,
ет защиту фосфорильного фрагмента молекулы и
строение которой определяется заместителем X
синтез N,P-защищенной С-компоненты с целью
(схема
2). Нами получена
(3-бензилокси-3-ок-
последующего получения фосфинового трипепти-
сопропил)фосфонистая кислота 3, включающая
да [3, 4].
структурный изостер глицина (Х = Н, Y = Bn) в
В качестве РС-компоненты синтеза нами ис-
качестве PC-компоненты синтеза.
следована
(3-бензилокси-3-оксопропил)фосфо-
Уксусный ангидрид - мягкий растворитель-ре-
нистая кислота 3 в среде хлористого ацетила или
агент для амидоалкилирования производных фос-
в его смеси с уксусной кислотой или абсолютным
финовых кислот в условиях кислого катализа [8,
толуолом (схема 1). Амидоалкилирование кислоты
9]. Ацетилхлорид более эффективен по сравнению
3 происходит достаточно быстро (в течение 1-3 ч
с уксусным ангидридом, однако амидоалкилиро-
в зависимости от среды). О завершении реакции
вание в этом случае может осложняться побоч-
судили по исчезновению сигнала исходного соеди-
ными реакциями с участием карбонильной ком-
нения (~40 м. д.) в спектре ЯМР 31Р реакционной
поненты, а также частичным дезалкилированием
массы. На начальном этапе реакции удалось за-
сложноэфирных функций. Попытка получить в
фиксировать в области, характерной для соедине-
среде ацетилхлорида описанную раннее {1-[(бен-
ний трехкоординированного фосфора, сигнал с δР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1378
ГОЛОВАШ и др.
Схема 3.
193 м. д. Этот сигнал достаточно быстро исчезает,
(3-Бензилокси-3-оксопропил)фосфонистая
и одновременно появляется сигнал соединения 6
кислота (3) получена присоединением генери-
или 7 в области 55-60 м. д.
рованного in situ из гипофосфита аммония бис-
Появление сигнала при 193 м. д. обусловлено
(триметилсилил)гипофосфита
8 к бензиловому
генерируемым in situ бисангидридным произво-
эфиру акриловой кислоты [7, 12]. Выход 67%,
дным фосфонистой кислоты 3 - бисацетил(3-бен-
т. пл. 36-37°C. Cпектр ЯМР 1H (CDCl3), δ, м. д.:
зилокси-3-оксопропил)фосфонитом 9 (схема 3),
1.95-2.20 м (2Н, РСН2), 2.55-2.75 м (2Н, СН2С=O),
который нуклеофильно атакует стабильный ин-
5.12 c (2Н, CH2O), 7.17 д (1Н, РН, 1JРH = 561.2
термедиат - заряженное основание Шиффа 10, ге-
Гц), 7.34 с 7.20-7.45 м (5Н, Рh), 11.71 уш. c (1Н,
нерируемое in situ в условиях кислого катализа из
POOH). Cпектр ЯМР 13C (CDCl3), δС, м. д.: 24.12 д
алкилиденбис(карбамата) [8, 9]. В итоге, по схеме
(1JРС = 95.5 Гц), 25.83 д (2JРС = 2.2 Гц), 66.53,
реакции Арбузова образуется связь фосфор-угле-
127.99, 128.09, 128.32, 135.29, 171.48 д (3JРС =
род. Полученные результаты подтверждают ран-
13.3 Гц). Спектр ЯМР 31P (CDCl3): δР 35.7 м. д.
нее предложенный механизм амидоалкилирования
{1-[(Алкоксикарбонил)амино]алкил}(3-бен-
[8, 9].
зилокси-3-оксопропил)фосфиновые кислоты
Псевдодипептиды - N-защищенные α-амино-
(6а, б, 7a, б). К охлажденному до ~5°С раствору
фосфиновые кислоты 6, 7 - хорошо кристаллизу-
10 ммоль кислоты 3 и 10 ммоль алкилкарбамата
ющиеся белые вещества. Спектральные данные
4 в 10 мл реакционной среды [AcCl, AcCl-AcOH,
N-защищенных α-аминофосфиновых кислот 6а,
9:1 (мл), или AcCl-PhMe, 1:1 (мл)] добавляли по
б и 7 а, б свидетельствуют о существовании их в
каплям 11-12 ммоль альдегида 5. Образовавшу-
виде смесей конформерных и/или диастереомер-
юся смесь перемешивали при саморазогревании
ных форм, исследование которых не являлось це-
до комнатной температуры и затем несколько ча-
лью данной работы. Данные ЯМР подтверждают
сов до исчезновения сигнала ядра фосфора ис-
отсутствие гидролиза бензилового фрагмента в
ходной фосфиновой кислоты в спектре ЯМР 31Р
условиях реакции в среде ацетилхлорида.
реакционной смеси. Образовавшуюся массу без
Таким образом, использование фосфонистой
нагревания упаривали с толуолом (2×20 мл) и хло-
PC-компоненты, содержащей бензиловые карбо-
роформом (2×20 мл), остаток растворяли в 20 мл
новые эфиры, может быть успешным подходом в
хлороформа и промывали ледяной водой (2×5 мл).
синтезе псевдодипептидов.
Органическую фазу сушили сульфатом натрия и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
упаривали в вакууме. Остаток кристаллизовался
после обработки диэтиловым или петролейным
Спектры ЯМР 1H, 31P и 13С снимали на Фу-
эфиром (40/70). Фосфиновые кислоты 6 и 7 вы-
рье-спектрометре Bruker DPX-200. Для ионоо-
деляли после дополнительной кристаллизации из
бменной хроматографии использовали катио-
диэтилового эфира.
нит Purolite C100E (H+). Температуры плавления
определяли в открытом капилляре. Хроматогра-
(3-Бензилокси-3-оксопропил){3-метил-
фический анализ проводили на LC/MSD системе
1-[(метоксикарбонил)амино]бутил}фосфино-
Agilent 1100 серии с DAD, ELSD и одноквадру-
вая кислота (6а). Выход 57%, т. пл. 153-154°С,
польным масс-селективным детектором с иониза-
Rf ~0.20 [CHCl3-Me2C(O), 5:1]. Cпектр ЯМР 1H
цией электроспреем.
(CDCl3), δ, м. д.: 0.89 д (3Н, СН3, 3JHH = 5.3 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ ФОСФИНОВЫХ ИЗОСТЕРOB
1379
0.93 д (3Н, СН3, 3JHH = 5.9 Гц), 1.40-1.80 м (3Н,
1.45-1.85 м (3Н, СН2 + СН), 2.05-2.30 м (2Н, РСН2),
СН2 + СН), 1.95-2.20 м (2Н, РСН2), 2.55-2.80 м
2.65-2.92 м [2Н, СН2C(O)], 4.10-4.30 м (1Н, РСН),
[2Н, СН2C(O)], 3.66 с (3H, СH3O), 3.90-4.10 м (1Н,
5.05-5.25 м (4Н, 2СH2О), 5.72 д и 6.47* д (1H, NH,
РСН), 5.04 д (1Н, NH, 3JHH = 10 Гц), 5.11 уш. с (2Н,
3JHH = 9.7), 7.20-7.50 м (10Н, 2Ph). Cпектр ЯМР
СН2О), 5.86 уш. с (1Н, РООН), 7.33 уш. с (5Н, Ph).
13C (CDCl3), δС, м. д.: 20.64*и 21.00, 23.40, 23.45 д
Cпектр ЯМР 1H (CDCl3 + 1-2 капли CF3COOH), δ,
(1JРС = 97.0 Гц), 24.19, 26.29, 36.12 и 36.76, 47.68 д
м. д.: 0.88 д (3Н, СН3, 3JHH = 6.5 Гц), 0.96 д (3Н,
(1JРС = 106.5 Гц) и 48.77 д (1JРС = 105.0 Гц), 67.24,
СН3, 3JHH = 6.5 Гц), 1.25-1.85 м (3Н, СН2 + СН),
66.73 и 67.67*, 127.97, 128.21, 128.50, 135.61,
2.24 д. т (2Н, РСН2, 2JPH = 11.8, 3JHH = 7.1 Гц), 2.86
136.12, 156.08 д (3JPC = 3.7 Гц), 171.94 д (3JPC =
д. т [2Н, СН2C(O), 2JPH = 15.9, 3JHH = 7.1 Гц], 3.74
15.7 Гц). Спектр 31Р ЯМР (CDCl3), δР, м. д.: 53.8*
с и 3.81* с (3H, СH3O), 4.05-4.30 м (1Н, РСН),
(7%), 55.8 (93%). Масс-спектр (ESI), m/z: 448.6
5.18 уш. с (2Н, СН2О), 5.70 д (NH, 3JHH = 9.4 Гц),
[M + H+]. Найдено, %: Р 7.18. C23H30NO6P. Вычис-
6.41* д (NH, 3JHH = 11.2 Гц), 7.25-7.50 уш. с (5Н,
лено, %: P 6.92. Mвыч 447.5.
Ph). Здесь и далее звездочкой обозначены сигналы
(3-Бензилокси-3-оксопропил){2-ме-
минорной формы - диастереомера или конфор-
тил-1-[(метоксикарбонил)амино]бутил}фосфи-
мера. Cпектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.80 д
новая кислота (7а). Выход 53%, т. пл. 128-130°С,
(3Н, СН3, 3JHH = 6.4 Гц), 0.87 д (3Н, СН3, 3JHH =
Rf ~0.20 [CHCl3-Me2C(O), 5:1]. Cпектр ЯМР 1H
6.4 Гц), 1.25-1.65 м (3Н, СН2 + СН), 1.82 д. т
(CDCl3), δ, м. д.: 0.88* т (3Н, СН3, 3JHH = 7.1 Гц),
(2Н, РСН2, 2JPH = 12.2, 3JHH = 8.3 Гц), 2.40-2.65
0.90 т (3Н, СН3, 3JHH = 7.3 Гц), 0.98 д (3Н, СН3,
м [2Н, СН2C(O)], 3.51 с (3H, СH3O), 3.55-3.80 м
3JHH = 6.9 Гц), 1.01* д (3Н, СН3, 3JHH = 7.8 Гц),
(1Н, РСН), 5.09 уш. c (2Н, СН2О), 7.35 уш. c (5Н,
1.15-1.47 м (2Н, СН2), 1.92-2.18 м (3Н, РСН2 +
Ph). Cпектр ЯМР 13C (CDCl3), δС, м. д.: 11.45* и
СН), 2.56-2.74 м [2Н, СН2C(O)], 3.67 с (3H, СH3O),
11.59, 14.88, 16.52 д (3JPC = 9.6 Гц), 22.66 д (1JРС =
3.89* д. д. д (1Н, РСН, 2JРH = 10.8, 3JHH = 9.8, 3JHH =
91.8 Гц) и 22.94*д (1JРС = 93.3 Гц), 24.63, 26.31,
4.9 Гц), 4.03 д. д. д (1Н, РСН, 2JРH = 10.8, 3JHH = 10.2,
27.40 д (2JPC = 11.8 Гц), 34.03 и 34.92*, 51.69 д
3JHH = 2.9 Гц), 5.10 с (2Н, СН2О), 5.16 уш. с (1Н,
(1JРС = 101.7 Гц) и 54.03* (1JРС = 98.4 Гц), 66.83,
NH), 7.32 уш. с (5Н, Ph), 8.42 уш. с (1Н, РООН).
128.22, 128.28, 128.51, 135.52, 157.14 д (3JPC =
Cпектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.78* т (3Н,
5.5 Гц), 172.07 д (3JPC = 15.1 Гц). Спектр 31Р ЯМР
СН3, 3JHH = 7.3 Гц), 0.82 т (3Н, СН3, 3JHH = 7.3 Гц),
(CDCl3), δР, м. д.: 54.6* (11%), 56.1 (89%). Спектр
0.92 д (3Н, СН3, 3JHH = 6.8 Гц), 0.95* д (3Н, СН3,
31Р ЯМР (ДМСО-d6), δ, м. д.: 46.7* (7%), 47.2
3JHH = 6.3 Гц), 1.15-1.47 м (2Н, СН2), 1.02-1.22 м
(93%). Масс-спектр (ESI), m/z: 372.5 [M + H+].
(1Н, СН2СН), 1.22-1.45 м (1Н, СН2СН), 1.70-1.97
Найдено, %: C 54.80; H 7.18. C17H26NO6P. Вычис-
м (3Н, РСН2 + СН), 2.45-2.56 м [2Н, СН2C(O)],
лено, %: C 54.98; H 7.06. Mвыч 371.4
3.52* с и 3.53 с (3H, СH3O), 3.59* д. д. д и 3.75 д. д.
(3-Бензилокси-3-оксопропил){1-[(бензилок-
д (1Н, РСН, 2JРH = 12.2, 3JHH = 10.7, 3JHH = 3.9 Гц),
сикарбонил)амино]-3-метилбутил}фосфиновая
5.09 с (2Н, СН2О), 7.20-7.45 м (5Н, Ph). Cпектр
кислота (6б). Выход 64%, т. пл. 105-107°С, Rf 0.25
ЯМР 13C (CDCl3), δС, м. д.: 11.48* и 11.59, 14.64*
(CHCl3-MeOH-AcOH, 10:2:1). Cпектр ЯМР 1H
д (3JРС = 2.9 Гц), 14.87 д (3JРС = 2.6 Гц) и 16.53* д
(CDCl3), δ, м. д.: 0.88 д (3Н, СН3, 3JHH = 6.1 Гц),
(3JPC = 9.6 Гц), 22.72 д (1JРС = 92.2 Гц) и 22.99* д
0.91 д (3Н, СН3, 3JHH = 5.6 Гц), 1.40-1.80 м (3Н,
(1JРС = 92.5 Гц), 24.60* д (2JРС = 3.7 Гц) и 26.28 д
СН2 + СН), 1.90-2.20 м (2Н, РСН2), 2.50-2.75 м
(2JРС = 3.3 Гц), 27.41 (3JРС = 11.8 Гц), 34.00 и 34.90*,
[2Н, СН2C(O)], 3.95-4.15 м (1Н, РСН), 4.95-5.25
51.62 д (1JРС = 103.6 Гц) и 53.88*д (1JРС = 104.3 Гц),
уш. м (5Н, NH + 2СH2О), 7.15-7.45 м (10Н, 2Ph),
52.65, 66.73, 128.20, 128.24, 128.49, 135.58, 157.05
10.26 уш. с (1Н, РООН). Cпектр ЯМР 1H (CDCl3 +
д (3JPC = 5.9 Гц), 171.92 д (3JPC = 16.2 Гц). Спектр
1-2 капли CF3COOH), δ, м. д.: 0.80* д (3Н, СН3,
31Р ЯМР (CDCl3), δР, м. д.: 54.8* (10%), 56.1 (90%).
3JHH = 6.7 Гц), ~0.86* д (сигнал дублета второй
Спектр 31Р ЯМР (ДМСО-d6), δР, м. д.: 46.4* (5%),
группы СН3 минорной формы перекрыт сигнала-
46.9 (75%), 47.4* (20%). Масс-спектр (ESI), m/z:
ми двух групп СН3 основной формы), 0.88 д (3Н,
372.4 [M + H+]. Найдено, %: P 8.45. C17H26NO6P.
СН3, 3JHH = 6.7 Гц), 0.95 д (3Н, СН3, 3JHH = 6.7 Гц),
Вычислено, %: P 8.34. Mвыч 371.4.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1380
ГОЛОВАШ и др.
(3-Бензилокси-3-оксопропил){1-[(бензилок-
177.22 д (3JРС = 14.4 Гц). Спектр ЯМР 31Р (D2О):
сикарбонил)амино]-2-метилбутил}фосфиновая
δР 35.9 м. д. Найдено, %: C 42.68; H 8.32; N 6.33.
кислота (7б). Выход 47%, т. пл. 118-120°С, Rf 0.25
C8H18NO4. Вычислено, %: C 43.05; H 8.13; N 6.28.
(CHCl3-MeOH-AcOH, 10:2:1). Cпектр ЯМР 1H
3-[(1-Амино-2-метилбутил)(гидрокси)фосфо-
(CDCl3), δ, м. д.: 0.86* т (3Н, СН3, 3JHH = 7.3 Гц),
рил]пропановая кислота (псевдо-изолейцилг-
0.89 т (3Н, СН3, 3JHH = 6.9 Гц), 0.96 д (3Н, СН3,
лицин) (2) получена аналогично, константы и ана-
3JHH = 6.9 Гц), 1.01* д (3Н, СН3, 3JHH = 7.3 Гц),
литические данные значительно не отличались от
1.12-1.47 м (СН2, 2Н), 1.92-2.15 м (3Н, РСН2 + СН),
приведенных раннее [17].
2.52-2.72 м [2Н, СН2C(O)], 3.90* д. д. д (1Н, РСН,
2JРH = 10.8, 3JHH = 9.7, 3JHH = 4.4 Гц), 4.04 д. д. д
ФОНДОВАЯ ПОДДЕРЖКА
(1Н, РСН, 2JРH = 10.8, 3JHH = 10.2, 3JHH = 2.9 Гц),
Часть работы выполнена в рамках государ-
5.09 с (4Н, 2СН2), 5.19 уш. д (1Н, NH, 3JHH =
ственного задания Института физиологически
9.7 Гц), 7.32 уш. с (5Н, Ph), 8.69 уш. с (1H, POOH).
активных веществ РАН на 2020 г. (тема № 0090-
Cпектр ЯМР 13C (CDCl3), δС, м. д.: 11.46* и 11.58,
2019-0008) при частичной финансовой поддержке
14.57* д (3JРС = 2.2 Гц) и 14.87 д (3JРС = 2.2 Гц) и
Российского фонда фундаментальных исследова-
16.53* д (3JPC = 9.2 Гц), 22.81 д (1JРС = 92.2 Гц) и
ний (гранты №№ 18-03-00959, 18-03-01123).
23.07* д (1JРС = 92.6 Гц), 24.61* д (2JРС = 3.3 Гц)
и 26.32 д (2JРС = 2.6 Гц), 27.42 (3JРС = 11.7 Гц),
КОНФЛИКТ ИНТЕРЕСОВ
33.96 и 34.90*, 51.66 д (1JРС = 105.8 Гц) и 53.86*д
Авторы заявляют об отсутствии конфликта ин-
(1JРС = 105.4 Гц), 66.72, 67.34, 128.00, 128.20,
тересов.
128.50, 135.60, 136.05*, 156.37* д (3JPC = 5.9 Гц) и
156.42 д (3JPC = 5.9 Гц), 171.78* д (3JPC = 15.2 Гц) и
СПИСОК ЛИТЕРАТУРЫ
171.88 д (3JPC = 16.7 Гц). Спектр 31Р ЯМР (CDCl3),
1. Collinsova M., Jiracek J. // Curr. Med. Chem. 2000.
δР, м. д.: 54.6* (9%), 55.9 (55%), 56.0* (36%). Масс-
Vol. 7. N 6. P. 629. doi 10.2174/0929867003374831
спектр (ESI), m/z: 448.5 [M + H+]. Найдено, %: C
2. Dive V., Georgiadis D., Matziari M., Makaritis A.,
61.53; H 6.90; Р 7.08. C23H30NO6P. Вычислено, %:
Beau F., Cuniasse P., Yiotakis A. // Cell. Mol. Life Sci.
C 61.74, H 6.76, P 6.92. Mвыч 447.5.
2004. Vol. 61. P. 2010. doi 10.1007/s00018-004-4050-y
Соединения 1, 2 получали гидролизом фос-
3. Mucha A. // Molecules. 2012. Vol.17. P.13530. doi
финовых кислот 6 и 7 в кипящей 6 н. соляной
10.3390/molecules171113530
кислоте. После упаривания реакционной массы в
4. Georgiadis D., Dive V. // Top Curr. Chem. 2015.
вакууме остаток смешивали с водой, упаривали
Vol. 360. P. 1. doi 10.1007/128_2014_571
и хроматографировали на катионите (элюент -
5. Baylis E.K., Campbell C.D., Dingwall J.G. // J. Chem.
0.5 н. HCl). Фракции с положительной реакцией на
Soc. Perkin Trans. 1. 1984. P. 2845. doi 10.1039/
P19840002845
нингидрин упаривали, смешивали с водой и упа-
6. McCleery P.P., Tuck B. // J. Chem. Soc. Perkin Trans. 1.
ривали, остаток обрабатывали окисью пропилена
1989. P. 1319. doi 10.1039/P19890001319
в водном спирте (1:4-7). Продукт реакции кри-
7. Rozhko L.F., Ragulin V.V. // Amino Acids. 2005. Vol. 29.
сталлизовали из водного спирта (1:4), и выделяли
P. 139. doi 10.1007/s00726-005-0194-9
(67-83%) псевдодипептиды 1 и 2.
8. Dmitriev M.E., Ragulin V.V. // Tetrahedron Lett. 2010.
3-[(1-Амино-3-метилбутил)(гидрокси)фос-
Vol. 51. N. 19. P. 2613. doi 10.1016/j.tetlet.2010.03.020
форил]пропановая кислота (псевдолейцилгли-
9. Dmitriev M.E., Ragulin V.V. // Tetrahedron Lett. 2012.
цин) (1). Т. пл. 177-179°С. Спектр ЯМР 1Н (D2О),
Vol. 53. N. 13. P. 1634. doi 10.1016/j.tetlet.2012.01.094
δ, м. д.: 0.81 д (3Н, СН3, 3JНH = 6.5 Гц), 0.86 д (3Н,
10. Kurdyumova N.R., Ragulin V.V., Tsvetkov E.N. //
СН3, 3JНH = 5.9 Гц), 1.43-1.66 м (3Н, СН2 + СН),
Mendeleev Commun. 1997. N 2. P. 69. doi 10.1070/
1.70-1.92 м (2Н, РСН2), 2.40-2.60 м (2Н, СН2СО),
MC1997v007n02ABEH000721
3.16 д. т (1Н, РСНN, 2JPH = 7.6, 3JНH = 7.0 Гц).
11. Ragulin V.V., Rozhko L.F., Saratovskikh I.V., Zefirov N.S.
Спектр ЯМР 13С (D2О), δС, м. д.: 19.97, 22.31, 22.55
Pat. 18568. 2000 (Japan); C. A. 2001. AN 2001:552806.
д (1JРС = 95.5 Гц), 24.00 д (3JРС = 8.9 Гц), 26.50
12. Ragulin V.V., Rozhko L.F.,Saratovskikh I.V., Zefirov N.S.
д (2JРС = 3.7 Гц), 36.08, 48.27 д (1JРС = 92.9 Гц),
Pat. 18581. 2000 (Japan); C. A. 2001. AN 2001:574226.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ ФОСФИНОВЫХ ИЗОСТЕРOB
1381
13. Xiong Z.M., Kitagawa K., Nishiuchi Y., Kimura T.,
Russ. Chem. Bull. 1988. Vol. 37. N 11. P. 2393. doi
Inagaki C. // Neurosci. Lett. 2007. Vol. 419. N 3.
10.1007/BF00959918
P. 247. doi 10.1016/j.neulet.2007.04.022
16. Курдюмова Н.Р., Рожко Л.Ф., Рагулин В.В., Цвет-
14. Xiong Z.M., Kitagawa K., Nishiuchi Y., Kimura T.,
ков Е.Н. // ЖОХ. 1997. Т. 67. № 12. С. 1965.
Nakamura T., Inagaki C. // Life Sci. 2009. Vol. 84.
17. Дмитриев М.Э., Рагулин В.В. // ЖОХ. 2015. Т. 85.
P. 132. doi 10.1016/j.lfs.2008.11.011
№ 9. С. 1511; Dmitriev M.E., Ragulin V.V. // Russ. J.
15. Рагулин В.В., Цветков Е.Н. // Изв. АН СССР. Cер.
Gen. Chem. 2015. Vol. 85. N 9. P. 2091. doi 10.1134/
хим. 1988. № 11. С. 2652; Ragulin V.V., Tsvetkov E.N. //
S1070363215090121
Synthesis of Phosphinic Isosteres
of Leucyl- and Isoleucylglycines
S. R. Golovash, M. E. Dmitriev, V. I. Shestov, and V. V. Ragulin*
Institute of Physiologically Active Compounds of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
*e-mail: rvalery@dio.ru
Received March 26, 2020; revised March 26, 2020; accepted April 8, 2020
Phosphinic isosteres of leucylglycine and isoleucylglycine were obtained by amidoalkylation of (3-benzyloxy-3-
oxopropyl)phosphonous acid bearing the structural isostere fragment of glycine benzyl ester with acetyl chloride.
A three-component amide version of the Kabachnik-Fields reaction involving methyl (benzyl) carbamates
and 2(3)-methylbutanals was studied. The reaction proceeded under the conditions of acylation of the starting
(3-benzyloxy-3-oxopropyl)phosphonous acid and in situ generation of a bisacetyl derivative of three-coordinated
phosphorus, the formation of which was detected using NMR 31Р.
Keywords: pseudo-leucylglycine, pseudo-isolecylglycine, acetyl chloride, amidoalkylation, bisacetyl(3-ben-
zyloxy-3-oxopropyl)phosphonite
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020