ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1452-1455
УДК 544.344.3
ИCCЛЕДОВАНИЕ ДИССОЦИАЦИИ ХЛОРИДОВ
ТЕТРАЭТИЛАММОНИЯ И ЛИТИЯ В
АЦЕТОНИТРИЛЬНЫХ РАСТВОРАХ
© 2020 г. А. А. Видякина, Н. А. Богачев, М. Ю. Скрипкин, А. С. Мерещенко*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: a.mereshchenko@spbu.ru
Поступило в Редакцию 27 мая 2020 г.
После доработки 11 июня 2020 г.
Принято к печати 15 июня 2020 г.
Методом электронной спектроскопии поглощения исследованы растворы хлоридов тетраэтиламмония
и лития в ацетонитриле. При концентрациях до 100 ммоль/л хлорид тетраэтиламмония полностью
диссоциирует. Спектрофотометрическим методом определена константа ассоциации хлорида лития в
ацетонитриле (Kасс = 4800 моль-1∙л) и исследованы электронные спектры ионной пары Li+Cl- и аниона
Cl- в ацетонитриле.
Ключевые слова: хлорид тетраэтиламмония, хлорид лития, константа ассоциации
DOI: 10.31857/S0044460X20090176
Катионы лития и тетраалкиламмония представ-
5 ммоль/л) в интервале длин волн от 190 до
ляют собой объекты, принципиально различаю-
230 нм (рис. 1). Во всех спектрах присутствует
щиеся по поведению в растворах. Первые характе-
только одна полоса поглощения с максимумом
ризуются довольно высокими энергиями ионной
при λ = 197 нм. Для оценки степени диссоциации
сольватации в полярных средах. Катионы тетра-
хлорида тетраэтиламмония в ацетонитриле была
алкиламмония при сравнительно небольшом раз-
построена зависимость оптической плотности на
мере углеводородного заместителя взаимодейству-
краю полосы (210 нм) от концентрации соли. В ди-
ют крайне слабо с большинством традиционно ис-
апазоне концентраций 0.1-100 ммоль/л выполня-
пользуемых растворителей. Исследования форм
существования в растворах солей с этими ионами
относятся в основном к водным системам [1, 2].
Данные для неводных систем носят отрывочный
характер. Вместе с тем, неводные растворы гало-
генидов лития используются в качестве электро-
лита в литий-ионных аккумуляторах [3], а соли
тетраалкиламмония зарекомендовали себя как
эффективные межфазные катализаторы активации
анионных нуклеофилов [4] (реакции проводятся в
апротонных органических растворителях). Нами
исследована ионная ассоциация хлоридов лития и
тетраэтиламмония в ацетонитриле методом элек-
λ, нм
тронной спектроскопии поглощения.
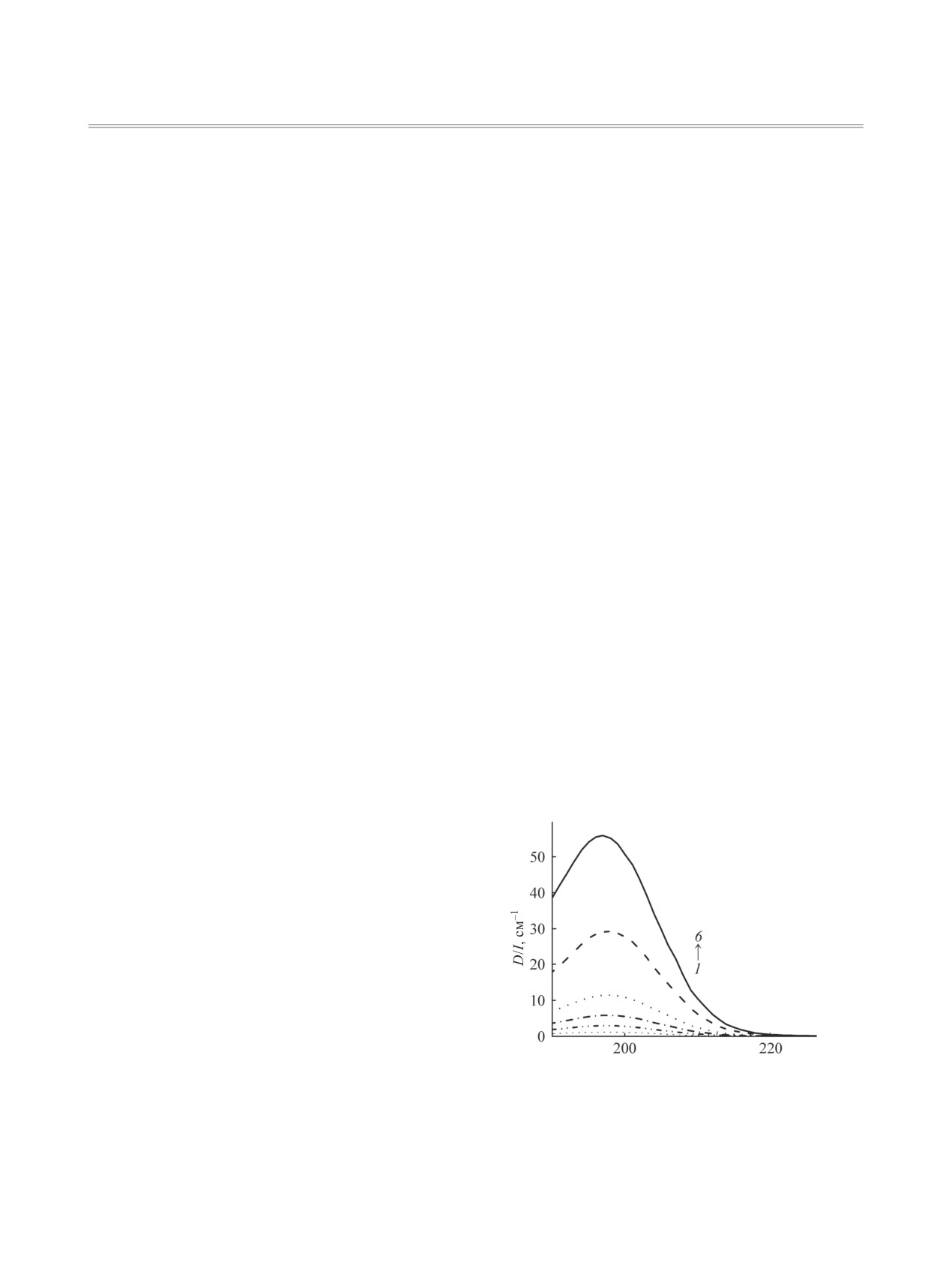
Для изучения ассоциации ионов Et4N+ и Cl-
Рис. 1. Электронные спектры поглощения растворов
были измерены электронные спектры поглоще-
Et4NCl в ацетонитриле. с = 0.1 (1), 0.25 (2), 0.5 (3), 1.0
(4), 2.5 (5), 5.0 мМ. (6).
ния растворов Et4NCl разных концентраций (0.1-
1452
ИCCЛЕДОВАНИЕ ДИССОЦИАЦИИ ХЛОРИДОВ ТЕТРАЭТИЛАММОНИЯ И ЛИТИЯ
1453
λ, нм
λ, нм
Рис. 2. Электронные спектры поглощения растворов
Рис. 3. Электронные спектры поглощения 0.1 мМ. рас-
LiCl в ацетонитриле. с = 0.1 (1), 0.25 (2), 0.5 (3), 1.0 (4),
2.5 (5), 5.0 (6), 10.0 (7), 15.0 мМ. (8).
творов LiCl (1) и Et4NCl (2) в ацетонитриле.
ется закон Бугера-Ламберта-Бера. Таким образом,
При малых концентрациях электронные спек-
в системе Et4NCl-ацетонитрил все хлорид-ионы
тры поглощения растворов хлорида лития и хло-
присутствуют только в одной химической форме.
рида тетраэтиламмония имеют одинаковую фор-
Следовательно, соль или полностью диссоциирует,
му. Предполагая, что при низких концентрациях
или вся находится в ассоциированном состоянии.
(0.1 ммоль/л) LiCl диссоциирует практически на-
Для подтверждения гипотезы о полной диссоци-
цело, полосу при 197 нм в спектрах растворов LiCl
ации Et4NCl был проведен анализ спектров по-
и Et4NCl можно отнести к поглощению иона Cl-.
глощения солей Et4NClО4 и LiCl в ацетонитриле.
Таким образом, на основе линейной зависимо-
Оптическая плотность 200 мМ раствора перхло-
сти оптической плотности раствора от концентра-
рата тетраэтиламмония в ацетонитриле составля-
ции хлорида тетраэтиламмония сделан вывод о его
ет менее 0.05 в интервале длин волн 190-300 нм
полной диссоциации во всем концентрационном
в кювете толщиной 1 см. Из этого следует, что ка-
интервале (0-100 ммоль/л), что хорошо согласу-
тион NEt4+ не поглощает в данном диапазоне длин
ется с данными для других галогенидов тетраэти-
волн (190-300 нм) и полоса с максимумом на 197
ламмония [5]. При повышении концентрации LiCl
нм соответствует поглощению либо хлорид-иона,
до 1 ммоль/л наблюдается полоса поглощения при
если Et4NCl полностью диссоциирует, либо ион-
λ < 190 нм, соответствующая поглощению ассоци-
ной пары Et4N+Cl-, если хлорид тераэтиламмония
ированной формы LiCl, вероятно, существующей
практически не диссоциирует.
в виде ионной пары Li+Cl-.
Электронные спектры поглощения растворов
Для определения константы ассоциации хлори-
LiCl в ацетонитриле (0.1-15 ммоль/л) измерены
да лития спектры поглощения растворов LiCl раз-
в диапазоне длин волн 190-300 нм (рис. 2). Как
личных концентраций были обработаны с исполь-
видно из представленных данных, форма спек-
зованием хемометрической программы ReactLab
тров растворов хлорида лития изменяется при ва-
рьировании концентраций (0.1-15 ммоль/л). При
Equilibria. Расчетная модель рассматривала кати-
низких концентрациях наблюдается только одна
он Li+ как частицу, не поглощающую в диапазо-
полоса поглощения с максимумом при 197 нм; с
не длин волн 190-230 нм), а спектр поглощения
увеличением концентрации появляется другая
аниона Cl- был рассчитан из спектров поглощения
полоса с максимумом < 190 нм. Спектр поглоще-
Et4NCl c учётом полной диссоциации молекулы
ния наиболее концентрированного раствора LiCl
Et4NCl. Принимали, что ионная пара Li+Cl- имеет
(15 ммоль/л) состоит из полосы с максимумом по-
полосу поглощения в диапазоне длин волн 190-
глощения < 190 нм и плеча при 200 нм (рис. 3).
230 нм. В результате обработки данных рассчита-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1454
ВИДЯКИНА и др.
λ, нм
с0(LiCl), мМ
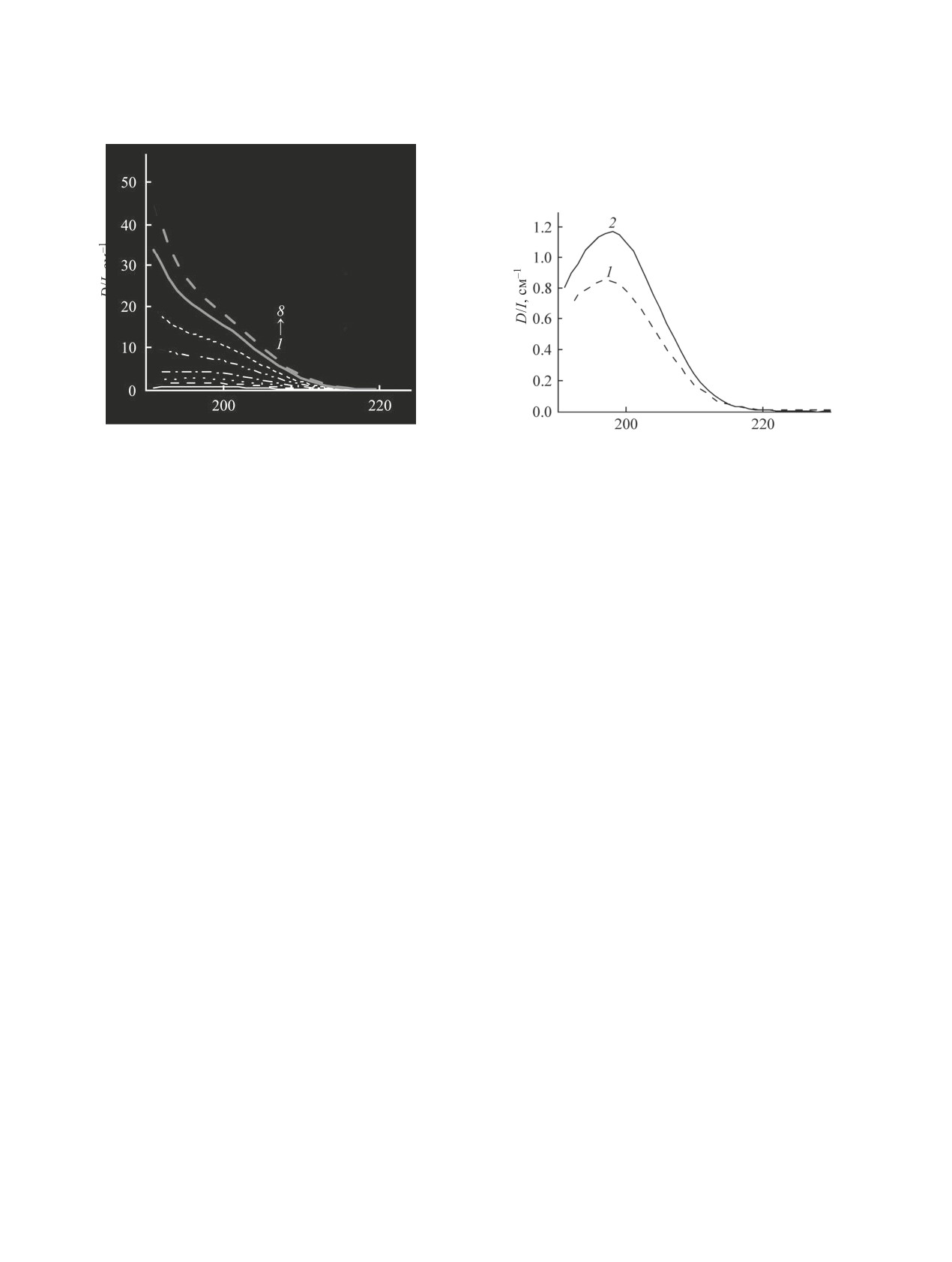
Рис. 4. Индивидуальные электронные спектры погло-
щения ионной пары Li+Cl- (1) и аниона Cl- (2) в ацето-
Рис. 5. Зависимость доли форм ионной пары Li+Cl- (1)
нитриле, по результатам хемометрической обработки
и аниона Cl- (2) от концентрации соли.
данных.
ны спектр ионной пары Li+Cl- (рис. 4) и константа
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ассоциации хлорида лития Kacс = 4800 моль-1∙л,
Все использованные в работе реактивы имели
что хорошо согласуется с экспериментальными
квалификацию ХЧ. Перед работой все соли очи-
данными, полученными методом кондуктометрии
щали перекристаллизацией, затем сушили в вакуу-
(Kacс = 3850±350 моль-1∙л) [6]. Следует отметить,
ме 12 ч при 110°С. Отсутствие воды в ацетонитри-
что константа ассоциации LiCl в ацетонитриле на
ле подтверждали методом титрования по Фишеру.
3 порядка больше, чем в водных растворах [7], что
Растворы готовили весовым методом по точной
подтверждает доминирующий вклад снижения
навеске. Спектры поглощения регистрировали на
диэлектрической проницаемости (78.3 и 36.02 со-
прецизионном спектрофотометре Lambda
1050
ответственно) для растворов солей с малыми по
(Perkin Elmer). Толщина кювет 1, 0.1, 0.02 см. Оп-
размеру ионами.
тическая плотность нормирована на толщину кю-
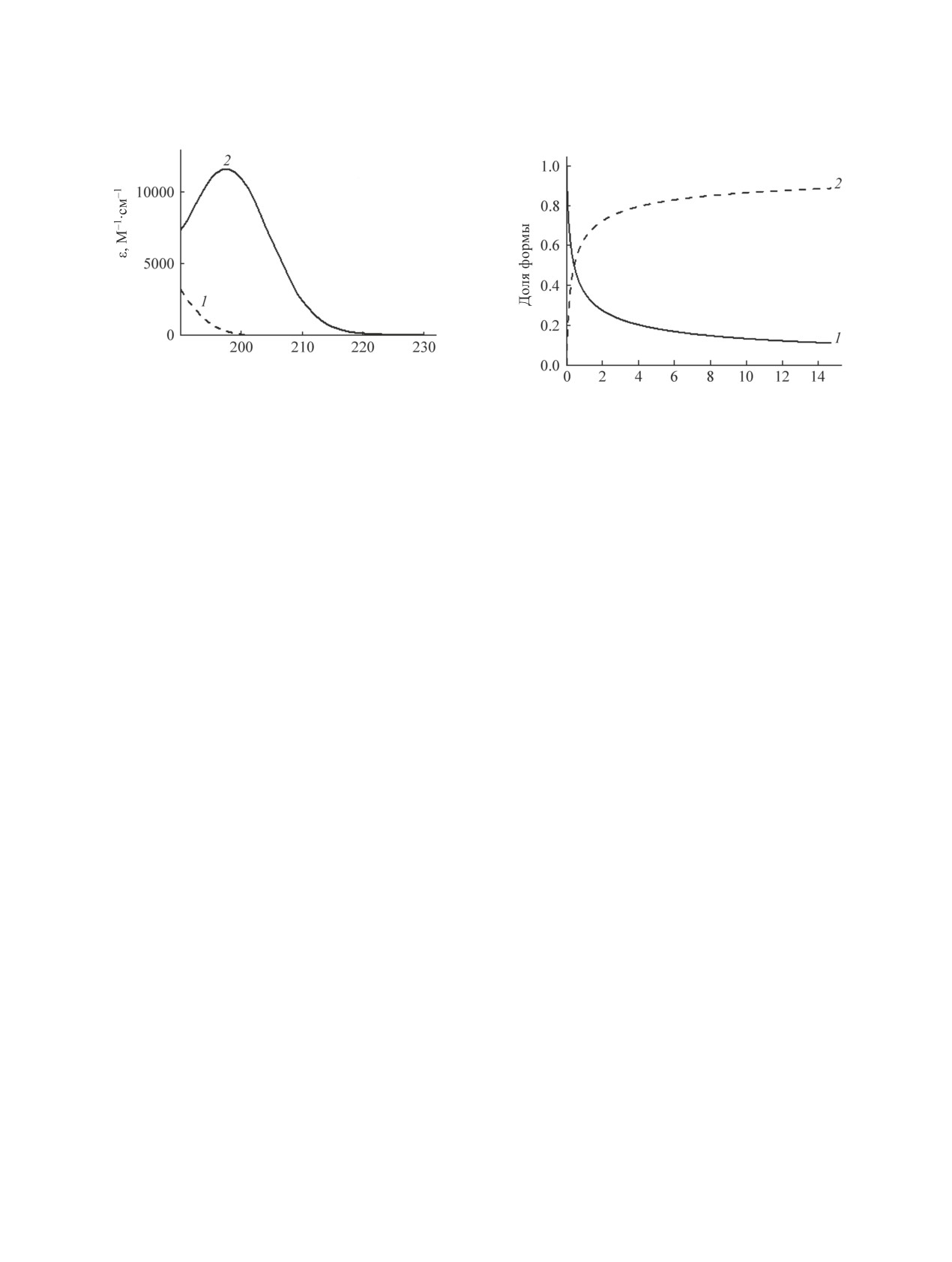
Дополнительно были рассчитаны доли ассо-
веты. В качестве раствора сравнения использовали
циированной формы LiCl (ионная пара Li+Cl-)
ацетонитрил. Все измерения проводили при 25°С.
и аниона Cl- (рис. 5) при концентрациях соли
Обработку результатов производили с помощью
0.1-15 ммоль/л. При низкой концентрации LiCl
программного обеспечения ReactLab Еquilibria.
(0.1 ммоль/л) доля формы аниона Cl- составляет
74%, а доля формы ионной пары Li+Cl- - 26 %. По-
ФОНДОВАЯ ПОДДЕРЖКА
лученный результат объясняет, почему интенсив-
Работа выполнена при поддержке Российского
ность спектра поглощения 0.1 мМ. раствора LiCl
фонда фундаментальных исследований (проект
меньше, чем 0.1 мМ. раствора Et4NCl (рис. 4). При
№ 20-33-70025 «Стабильность») с использованием
высоких концентрациях хлорид лития существу-
оборудования ресурсных центров Научного парка
ет преимущественно в ассоциированной форме
Санкт-Петербургского государственного универ-
Li+Cl-. При концентрации 15 ммоль/л доля формы
ситета «Нанотехнологии», «Оптические и лазер-
аниона Cl- составляет 11%, а доля формы ионной
ные методы исследования вещества», «Развитие
пары Li+Cl- - 89 %.
молекулярных и клеточных технологий», «Крио-
Таким образом, проведенные эксперименты
генный отдел».
показывают, что в пределах концентраций 0.1-
КОНФЛИКТ ИНТЕРЕСОВ
100 ммоль/л хлорид тетраэтиламмония полностью
диссоциирует в ацетонитриле, в то время как хло-
Авторы заявляют об отсутствии конфликта
рид лития диссоциирует частично.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ИCCЛЕДОВАНИЕ ДИССОЦИАЦИИ ХЛОРИДОВ ТЕТРАЭТИЛАММОНИЯ И ЛИТИЯ
1455
СПИСОК ЛИТЕРАТУРЫ
4. Shirakawa S., Liu S., Kaneko S., Kumatabara Y., Fuku-
da A., Omagari Y., Moruoka K. // Angew. Chem. Int. Ed.
1. Смирнов П.Р. // ЖОХ. 2019. Т. 89. Вып. 12. С. 1938;
2015. Vol. 54. P. 15767. doi 10.1002/annie.201508659
Smirnov P.R. // Russ. J. Gen. Chem. 2019. Vol. 89.
5. Marcus Y., Hefter G. // Chem. Rev. 2006. Vol. 106.
N 12. P. 2443. doi 10.1134/S0044460X19120199
N 11. P. 4585. doi 10.1021/cr040087x
2. Кустов А.В. // ЖНХ. 2009. Т. 54. № 2. С. 329;
6. Hopkins H.P., Jahagirdar D.V., Norman A.B. // J.
Kustov A.V. // Russ. J. Inorg. Chem. 2009. Vol. 54.
Solution Chem. 1979. Vol. 8. N 2. P. 147. doi 0095-
N 2. P. 323. doi 10.1134/S0036023609020284
9782/79/0200-0147S03.00/0
3. Xin N., Sun Y., He M., Radke C.-J., Prausnitz J.-M. //
7. Xu J.-J., Yi H.-B., Li H.-J., Chen Y. // Mol. Phys.
Fluid Phase Equilibr. 2018. Vol. 461. P. 1. doi 10.1016/j.
2014. Vol. 112. N 12. P. 1710. doi 10.1080/
fluid.2017.12.034
00268976.2013.860244
Study of Tetraethylammonium and Lithium Chlorides
Dissociation in Acetonitrile Solutions
A. A. Vidiakina, N. A. Bogachev, M. Yu. Skripkin, and A. S. Mereshchenko*
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: a.mereshchenko@spbu.ru
Received May 27, 2020; revised June 11, 2020; accepted June 15, 2020
Solutions of tetraethylammonium and lithium chlorides in acetonitrile were studied by absorption spectroscopy.
It was shown that at concentrations up to 100 mM. tetraethylammonium chloride completely dissociates. The
spectrophotometric method was used to determine the association constant of lithium chloride in acetonitrile
(Kass = 4800 M.-1) and to study electronic absorption spectra of the ion pair Li+Cl- and Cl- in acetonitrile.
Keywords: tetraethylammonium chloride, lithium chloride, association constant
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020