ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1456-1459
КРАТКИЕ
СООБЩЕНИЯ
УДК 547-31/-39:547.422
СИНТЕЗ АЦЕТАЛЕЙ 2,3-ДИФЕНИЛАКРОЛЕИНА
© 2020 г. Г. Н. Сахабутдинова, Г. З. Раскильдина*, С. С. Злотский
Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450062 Россия
*e-mail: graskildina444@mail.ru
Поступила в Pедакцию 23 апреля 2020 г.
После доработки 23 апреля 2020 г.
Принято к печати 30 апреля 2020 г.
Синтезированы линейные карбонильные соединения при разложении транс- и цис-2,3-дифе-
нил-1,1-дихлорциклопропанов в присутствии алифатических спиртов (этанола и бутанола). Сопостав-
лена активность индивидуальных транс- и цис-стильбенов в сравнении со стиролом в реакции дихлор-
карбенирования. Методами ЯМР и хромато-масс-спектрометрии установлено строение полученных
соединений.
Ключевые слова: транс- и цис-стильбены, дихлоркарбенирование, анионит, гем-дихлорциклопропан
DOI: 10.31857/S0044460X20090188
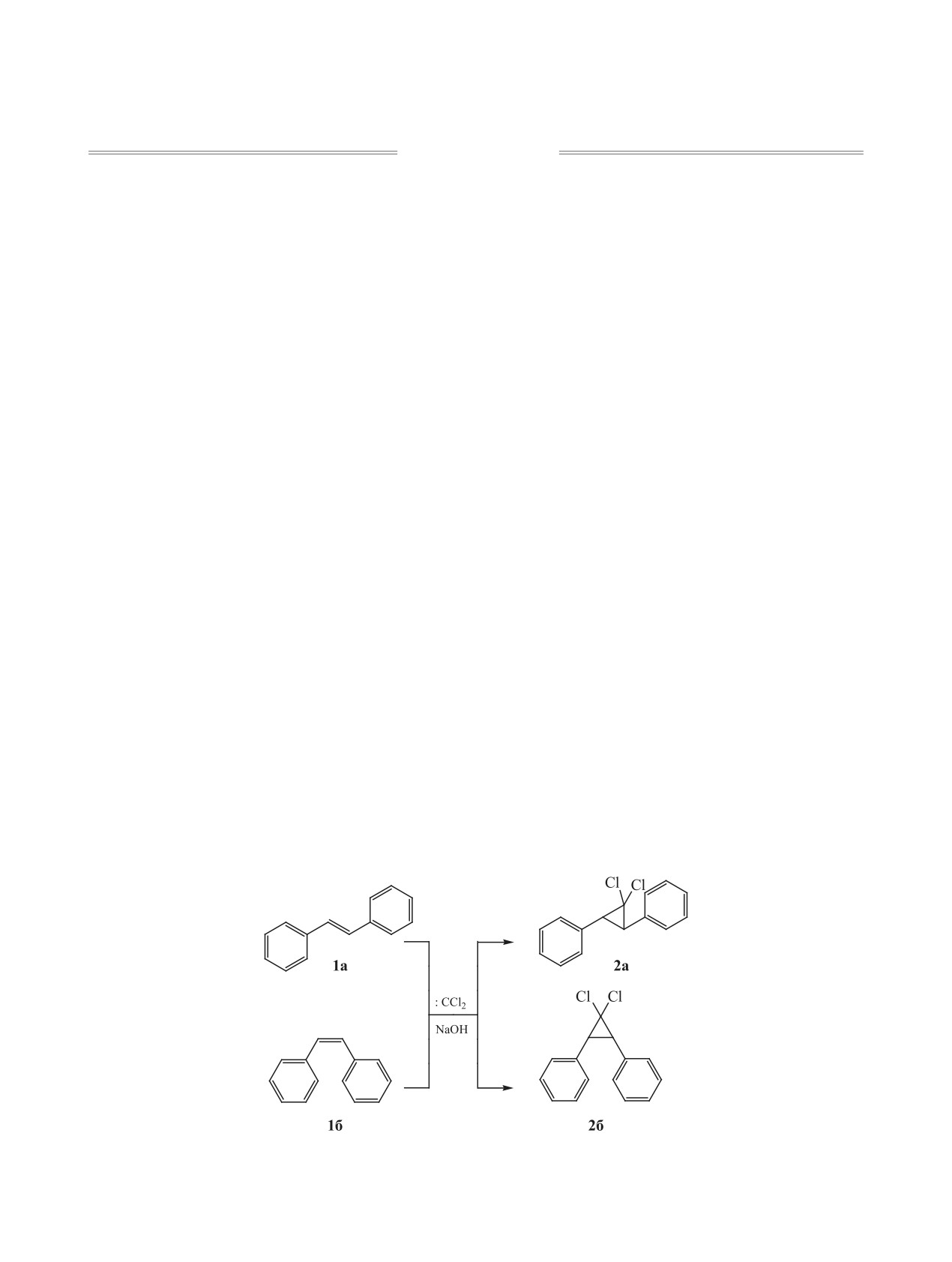
Соединения, включающие гем-дихлорцикло-
получены соответствующие транс- и цис-2,3-ди-
пропановый фрагмент, широко используются в
фенил-1,1-дихлорциклопропаны 2а, б (схема 1).
синтезе полифункциональных непредельных со-
Методом конкурентных реакций найдено, что
единений, применяемых при создании ингибито-
в изученных условиях по активности транс- и
ров, биопрепаратов, добавок к топливам, маслам и
цис-изомеры 1а, б близки друг к другу и на поря-
полимерам [1-7].
док инертнее стирола. Полагаем, что это связано
Алкоголиз арил-гем-дихлорциклопропанов в
с затруднением подхода карбена :CCl2 к двойной
щелочной среде приводит к ацеталям арилакроле-
связи НС=СН, соединяющей объемные фениль-
ные группы.
инов и их производным [8, 9]. Дихлоркарбениро-
ванием [10] индивидуальных транс- и цис-стиль-
Расщепление индивидуальных изомеров 2,3-ди-
бенов 1а, б с количественными выходами нами
фенил-1,1-дихлорциклопропана 2а, б в кипящем
Схема 1.
1456
СИНТЕЗ АЦЕТАЛЕЙ 2,3-ДИФЕНИЛАКРОЛЕИНА
1457
Схема 2.
этаноле (75-80°С) в присутствии NaOH протекало
ЯМР 13С ацеталя 4а сигналы углеродных атомов
за 20 ч на 56% и приводило к соответствующим
С=С проявляются в более слабом поле (114.97-
индивидуальным ацеталям 3а, б. Активность изо-
141.16 м. д.) по сравнению с сигналами аналогич-
меров
2,3-дифенил-1,1-дихлорциклопропана
2а,
ных атомов его изомера 4б (114.45 и 141.12 м. д.).
б в реакции разложения одинакова, и они в 8 раз
Химические сдвиги углерода в группе ОСО разли-
активнее 2-фенил-1,1-дихлорциклопропана. Веро-
чаются и составляют 111.31 (4а) и 110.29 м. д. (4б).
ятно, это связано с присутствием в молекулах сое-
Таким образом, разложением транс- и
динений 2а, б двух способных к 1,2-миграции бен-
цис-2,3-дифенил-1,1-дихлорциклопропанов али-
зильных атомов водорода в положениях 2 и 3. К
фатическими спиртами синтезированы линейные
недостаткам данного метода получения ацеталей
карбонильные соединения с выходами 50-84%.
3а, б относятся высокий расход щелочи (мольное
Общая методика синтеза ацеталей 2,3-ди-
соотношение NaOH-гем-дихлорциклопропан
=
фенилакролеина 3a, б и 4а, б. К раствору 10 г
1:1) и длительное время реакции (> 20 ч).
(0.04 моль) 2,3-дифенил-1,1-дихлорциклопропа-
Мы изменили условия реакции и вместо легко-
на 2a, б в спирте (этаноле или бутаноле) (300 мл)
кипящего этанола использовали бутан-1-ол, а в ка-
добавляли 1 г (0.004 моль) анионита АВ-17 или
честве щелочного катализатора - промышленный
1.6 г (0.04 моль) NaOH и кипятили 20 ч при 80°С
анионит АВ-17. При 115-120°С в этих условиях
(в этанолe) и 8 ч при 120°C в бутаноле (темпера-
конверсия изомеров 2а, б за 8 ч составила более
тура бани). Пробу отбирали через каждые 3 ч по
80%, а выход соединений 4а, б - 87%. Но при тем-
10 мл реакционной массы для определения обра-
пературе реакции выше 100°С нарушалась стерео-
зования продукта реакции. По окончании реакции
селективность расщепления циклопропанов 2а, б,
реакционную массу охлаждали, добавляли 10 мл
и в продуктах разложения присутствовали оба изо-
бензола, промывали насыщенным раствором соли
мера 4а, б (схема 2).
(Na2SO4), осушали и растворитель удаляли. Оста-
Строение соединений 3а, б и 4а, б установле-
ток очищали с помощью колоночной хроматогра-
но на основании данных ЯМР 1H, 13C и хрома-
фии, элюент - гексан-этилацетат (9.5:0.5)
то-масс-спектрометрии. Характерными сигналами
1,1′-[(1Z)-3,3-Диэтоксипроп-1-ен-1,2-диил]-
для индивидуальных соединений 4а и 4б являются
дибензол (3а). Выход 5.8 г (56%), Rf 0.52, желтое
протоны группы ОCHО в виде синглета с химиче-
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.26 т (6H,
скими сдвигами 5.77 и 4.94 м. д. соответственно.
CH3, J = 7.1 Гц), 3.63 к (2H, CH2, J = 7.1 Гц), 3.75
Протоны эфирной группы CH2O в спектре ацеталя
к (2H, CH2CH3, J = 7.1 Гц), 5.21 с (1H, CH), 6.88
4а резонируют при 3.67 м. д., а в изомере 4б - при
с (1H, CH=), 7.04 т (2H, CH, Ph, J = 7.1 Гц), 7.12
3.69 м. д. Сигналы протонов группы =CH наблю-
д (2H, CH, Ph, J = 7.1 Гц), 7.24 т (1H, CH, Ph, J =
даются при 6.58 (4а) и 5.98 м. д. (4б). В спектре
7.1 Гц), 7.32 т (2H, CH, Ph, J = 7.1 Гц), 7.38 т (1H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1458
САХАБУТДИНОВА и др.
CH, Ph, J = 7.1 Гц), 7.63 д (2H, CH, Ph, J = 7.1 Гц).
1,1′-[(1E)-3,3-Дибутоксипроп-1-ен-1,2-диил]-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 15.12 (2CH3),
дибензол (4б). Выход 10.8 г (80%), Rf 0.44, желтое
61.94 (CH2CH3), 104.41 (CH), 111.47 (CH=), 127.12
масло. Спектр ЯМР 1Н, δ, м. д.: 1.27 т (6H, CH3,
(2CH, Ph), 127.39 (CH, Ph), 127.53 (CH, Ph), 128.44
J = 7.3 Гц), 1.40 к (4H, CH2CH3, J = 7.3 Гц), 1.52
(2CH, Ph), 128.91 (2CH, Ph), 129.71 (2CH, Ph),
к (2H, CH2CH2, J = 7.3 Гц), 1.56 к (2H, CH2CH2,
136.13 (С), 138.05 (С), 138.76 (С). Масс-спектр, m/z
J = 7.3 Гц), 3.69 к (4H, OCH2, J = 7.3 Гц), 4.94 с
(Iотн, %): 283 (22) [M]+, 237 (28), 227 (42), 207 (36),
(1H, CH), 5.98 с (1H, CH=), 7.12 т (2H, CH, Ph, J =
191 (76), 191 (94), 165 (42), 149 (100), 135 (46), 105
7.3 Гц), 7.26 т (1H, CH, Ph, J = 7.3 Гц), 7.33 т (1H,
(80), 79 (74), 44 (32). Найдено, %: С 80.79; H 7.84.
CH, Ph, J = 7.3 Гц), 7.35 д (2H, CH, Ph, J = 7.3 Гц),
C19H22O2. Вычислено, %: С 80.82; H 7.85.
7.47 т (2H, CH, Ph, J = 7.3 Гц), 7.71 д (2H, CH, Ph,
1,1′-[(1E)-3,3-Диэтоксипроп-1-ен-1,2-диил]-
J = 7.3 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
дибензол (3б). Выход 5.2 г (50%), Rf 0.46, желтое
13.87 (2CH3), 19.82 (2CH2CH3), 31.99 (2CH2CH2),
масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.37 т
69.11
(2OCH2), 110.29 (ОCHО), 114.45 (CH=),
(6H, CH3, J = 7.1 Гц), 3.90 к (2H, CH2, J = 7.1 Гц),
125.89 (CH, Ph), 126.99 (CH, Ph), 128.48 (2CH, Ph),
3.99 к (2H, CH2, J = 7.1 Гц), 4.94 с (1H, CH), 5.88
128.60 (2CH, Ph), 128.82 (2CH, Ph), 135.97 (С),
с (1H, CH=), 7.02 т (2H, CH, Ph, J = 7.1 Гц), 7.13
140.02 (С), 141.12 (С). Масс-спектр, m/z (Iотн, %):
д (2H, CH, Ph, J = 7.1 Гц), 7.17 т (1H, CH, Ph, J =
339 (16) [M]+, 281 (10), 266 (12), 208 (38), 180 (100),
7.1 Гц), 7.29 т (2H, CH, Ph, J = 7.1 Гц), 7.41 т (1H,
165 (24), 131 (27), 107 (44), 91 (22), 79 (20), 57 (16),
CH, Ph, J = 7.1 Гц), 7.67 д (2H, CH, Ph, J = 7.1 Гц).
40 (36). Найдено, %: С 81.58; H 8.92. C23H30O2. Вы-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 15.49 (2CH3),
числено, %: С 81.61; H 8.93.
67.05 (2CH2), 103.88 (CH), 114.87 (CH=), 127.01
Продукты реакции анализировали методом
(2CH, Ph), 127.46 (CH, Ph), 127.62 (CH, Ph), 128.30
ГЖХ на хроматографе Кристалл-2000М (Россия)
(2CH, Ph), 128.95 (2CH, Ph), 129.98 (2CH, Ph),
с детектором по теплопроводности, газ-носитель -
135.75 (С), 139.59 (С), 144.84 (С). Масс-спектр, m/z
гелий марки А (колонка длиной 2 м и диаметром
(Iотн, %): 283 (26) [M]+, 237 (25), 227 (43), 207 (39),
5 мм с 5 % SE-30 на носителе Chromaton N-AW).
191 (66), 191 (99), 165 (32), 149 (86), 135 (42), 105
Программированный температурный режим: тер-
(74), 79 (68), 44 (34). Найдено, %: С 80.79; H 7.84.
мостат колонок 80-230°С, скорость увеличения
C19H22O2. Вычислено, %: С 80.82; H 7.85.
температуры 20 град/мин, температура испари-
1,1′-[(1Z)-3,3-Дибутоксипроп-1-ен-1,2-диил]-
теля и детектора 250°С. Масс-спектры записали
дибензол (4а). Выход 11.4 г (84%), Rf 0.48, жел-
на приборе Кристалл-5000М. Условия анализа:
тое масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.99
капиллярная колонка длиной 30 м, температура
т (6H, CH3, J = 7.3 Гц), 1.36 к (4H, CH2CH3, J =
колонки от 80 до 280°С, температура переходной
7.3 Гц), 1.44 к (2H, CH2CH2, J = 7.3 Гц), 1.59 к (2H,
линии 300°С, температура источника ионов 300°С,
CH2CH2, J = 7.3 Гц), 3.67 к (4H, OCH2, J = 7.3 Гц),
градиент температуры 20 град/мин; газ-носитель -
5.77 с (1H, CH), 6.58 с (1H, CH=), 7.09 т (2H, CH,
гелий. Спектры ЯМР 1Н и 13С записывали на спек-
Ph, J = 7.3 Гц), 7.22 т (1H, CH, Ph, J = 7.3 Гц), 7.24
трометре Bruker AVANCE-500 с рабочими часто-
т (1H, CH, Ph, J = 7.3 Гц), 7.31 д (2H, CH, Ph, J =
тами 400.13 и 75.47 МГц соответственно, раство-
7.3 Гц), 7.42 т (2H, CH, Ph, J = 7.3 Гц), 7.73 д (2H,
ритель CDCl3, внутренний стандарт - SiMe4.
CH, Ph, J = 7.3 Гц). Спектр ЯМР 13С (CDCl3),
ФОНДОВАЯ ПОДДЕРЖКА
δС, м. д.: 13.87 (2CH3), 19.71 (2CH2CH3), 34.85
(2CH2CH2), 62.56 (2OCH2), 111.31 (ОCHО), 114.97
Исследования выполнены при финансировании
(CH=), 125.95 (CH, Ph), 126.17 (CH, Ph), 128.24
гранта Президента РФ для государственной под-
(2CH, Ph), 128.97 (2CH, Ph), 129.37 (2CH, Ph),
держки молодых российских ученых - кандидатов
136.02 (С), 139.94 (С), 141.16 (С). Масс-спектр, m/z
наук и докторов наук (№ МК-1689.2020.3).
(Iотн, %): 339 (16) [M]+, 281 (18), 266 (14), 208 (52),
КОНФЛИКТ ИНТЕРЕСОВ
180 (86), 165 (14), 131 (12), 107 (32), 91 (17), 79
(16), 57 (18), 40 (100). Найдено, %: С 81.58; H 8.92.
Авторы заявляют об отсутствии конфликта
C23H30O2. Вычислено, %: С 81.61; H 8.93.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ АЦЕТАЛЕЙ 2,3-ДИФЕНИЛАКРОЛЕИНА
1459
СПИСОК ЛИТЕРАТУРЫ
Chem. 2016. Vol. 86. N 9. P. 2126. doi 10.1134/
S1070363216090255
1.
Борисова Ю.Г., Раскильдина Г.З., Яныбин В.М.,
6. Croteau R., Kutchan T.N., Lewis N.G. In: Biochemistry
Султанова Р.М., Спирихин Л.В., Злотский С.С. //
and Molecular Biology of Plants. ASPB, 2000. P. 1250.
Докл. АН. 2016. Т. 466. № 2. С. 174; Borisova Yu.G.,
7. Теплова В.В., Исакова Е.П., Кляйн О.И., Дергаче-
Raskildina G.Z., Yanybin V.M., Sultanova R.M.,
ва Д.И., Гесслер Н.Н., Дерябина Ю.И. // Прикл.
Spirikhin L.V., Zlotsky S.S. // Doklady Chem. 2016.
биохим. микробиол. 2018. Т. 54. № 3. С. 215; Teplo-
Vol. 466. N 2. P. 174. doi 10.1134/S0012500816010043
va V.V., Isakova E.P., Klein O.I., Dergachova D.I.,
2.
Валиев В.Ф., Раскильдина Г.З., Злотский С.С. //
Gessler N.N., Deryabina Y.I. // Appl. Biochem.
ЖПХ. 2016. Т. 89. Вып. 5. С. 619; Valiev V.F., Raskildi-
Microbiol. Vol. 54. N. 3. P. 221. doi 10.1134/
na G.Z., Zlotsky S.S. // Russ. J. Appl. Chem. 2016.
S0003683818030146
Vol. 89. N 5. P. 753. doi 10.1134/S1070427216050116
8. Kagabu S., Mizoguchi S. // Synthesis. 1995. P. 372. doi
3.
Сухоносова Е.В., Злотский С.С., Чанышев Р.Р. //
Баш. хим. ж. 2017. Т. 24. № 1. С. 7.
10.1002/chin.199633159
4.
Клеттер Е.А., Ганиуллина Э.Р., Мусавиров О.Р., Ши-
9. Сахабутдинова Г.Н., Раскильдина Г.З., Чаны-
риазданова А.Р., Злотский С.С. // Баш. хим. ж. 2009.
шев Р.Р., Злотский С.С. // Баш. хим. ж. 2020. Т. 27.
Т. 16. № 1. С. 16.
№ 1. С. 15.
5.
Борисова Ю.Г. Раскильдина Г.З., Злотский С.С. //
10. Зефиров Н.С., Казимирчик И.В., Лукин К.А. Ци-
ЖОХ. 2016. Т. 86. Вып. 9. С. 1564; Borisova Yu.G.,
клоприсоединение дихлоркарбена к олефинам. М.:
Raskildina G.Z., Zlotsky S.S. // Russ. J. Gen.
Наука, 1985. С. 152.
Synthesis of 2,3-Diphenylacroleine Acetals
G. N. Sakhabutdinova, G. Z. Raskil’dina*, and S. S. Zlotskii
Ufa State Petroleum Technological University, Ufa, 450062 Russia
*e-mail: graskildina444@mail.ru
Received April 23, 2020; revised April 23, 2020; accepted April 30, 2020
Linear carbonyl compounds were synthesized by the decomposition of trans- and cis-2,3-diphenyl-1,1-dichloro-
cyclopropanes in the presence of aliphatic alcohols (ethanol and butanol). The activity of individual trans- and
cis-stilbenes in comparison with styrene in the dichlorocarbenation reaction was compared. Structure of the
obtained compounds was established by NMR and gas chromatography-mass spectrometry data.
Keywords: trans- and cis-stilbenes, dichlorocarbenation, anion exchanger, gem-dichlorocyclopropane
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020