ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1460-1463
КРАТКИЕ
СООБЩЕНИЯ
Памяти М.М. Зобачевой и В.М. Берестовицкой
УДК 547.751
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ АНАЛОГОВ
ТРИПТАМИНА С ДИХЛОРЭТОКСИФОСФОРИЛЬНОЙ
И ЭТОКСИКАРБОНИЛЬНОЙ ГРУППАМИ
© 2020 г. З. М. Саркисян*
Санкт-Петербургский государственный педиатрический медицинский университет,
ул. Литовская 2, Санкт-Петербург, 194100 Россия
*e-mail: zara-sark@inbox.ru
Поступило в Редакцию 9 апреля 2020 г.
После доработки 12 апреля 2020 г.
Принято к печати 16 апреля 2020 г.
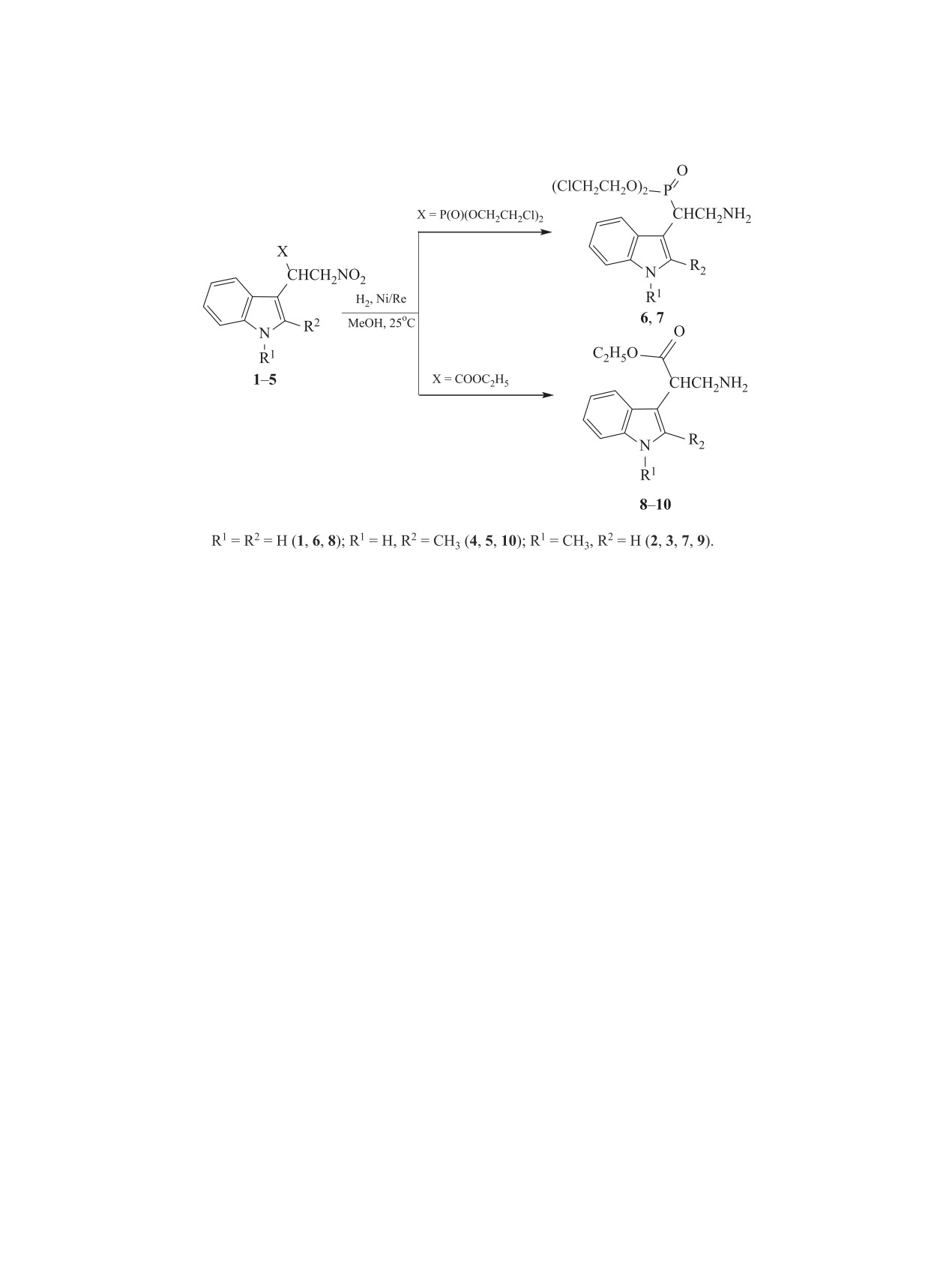
Предложен рациональный метод синтеза функционалированных предшественников триптамина восста-
новлением 1- и 2-замещенных 3-нитроэтилиндолов на никелевом катализаторе.
Ключевые слова: индолиламиноэтилфосфонаты, индолиламинопропаноаты, предшественники трип-
тамина
DOI: 10.31857/S0044460X2009019X
Триптамин и его аналоги, будучи биологически
применение нашли синтетические лекарственные
активными веществами, представляют интерес в
препараты на основе триптамина. Среди них ан-
плане возможности синтеза их предшественни-
тидипрессант индопан, радиопротектор мексамин,
ков с целью изучения свойств, в том числе как
иммуностимулятор тимоген [1].
лекарственных препаратов [1]. Так, авторами [2]
В связи с этим, синтез аналогов триптамина,
показано успешное снижение неспецифической
обладающих широким спектром биологической
цитотоксичности и сохранение ингибирования
активности, представляет несомненный интерес.
ферментативной активности
2-[1-(3,4-дихлор-
Важным фактором при получении таких соеди-
бензил)-2-метил-5-(метилтио)-1H-индол-3-ил]-
нений является не только простота аппаратурно-
этанамина, а также способность этих соединений
го оформления процесса, но и достижение мини-
связываться с липидом II и оказывать антибакте-
мально затратных с экономической точки зрения и
риальное действие при низкой концентрации. С
рациональных путей синтеза. Удобным методом в
другой стороны, в работе [3] описана антимутаген-
этом плане является гидрирование индолилнитро-
ная активность производных мелатонина, рассма-
этилфосфонатов и -пропаноатов на скелетном ще-
триваемых, в том числе, как замещенные аналоги
лочном никелевом катализаторе при атмосферном
триптамина. В доклинических испытаниях была
давлении и комнатной температуре в метиловом
выявлена также нейропротекторная активность
спирте (схема 1). Исходные индолилнитроэтил-
новых производных мелатонина для лечения цен-
фосфонаты 1, 2 и индолилнитропропаноаты 3-5
были получены по методикам, описанным ранее
тральной невропатии у крыс, вызванной акрила-
мидом [4]. Кроме того, известны алкалоиды, со-
[6-8].
держащие фрагмент триптамина: лизергиновая
Целевые соединения 6-10 были выделены с по-
кислота, стрихнин, клавин и т. д. [5]. Широкое
мощью колоночной хроматографии с выходом 49-
1460
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ АНАЛОГОВ ТРИПТАМИНА
1461
Схема 1.
81%. Строение и состав полученных соединений
5.27; N 7.36, 7.38; P 8.20, 8.21. C14H19Cl2N2O3P.
подтверждены методами ИК, ЯМР спектроскопии
Вычислено, %: C 46.03; H 5.21; N 7.39; P 8.18.
и данными элементного анализа.
Соединения 7-10 получали аналогично.
Таким образом, предложен и простой и удоб-
Бис(2-хлорэтил)-2-амино-1-(1-метилиндол-
ный метод получения аналогов триптамина с фос-
3-ил)этилфосфонат (7). Выход 0.52 г (68%), свет-
фонатной и карбоксилатной функциями, которые
ло-зеленые кристаллы, т. пл. 94-95°С (CHCl3). ИК
могут представлять интерес как вещества с потен-
спектр (СНCl3), ν, см-1: 1240 с (P=O); 1040, 1078
циальной биологической активностью.
(P-O-C); 3000-3450 ш (NH2). Спектр ЯМР 1Н
Бис(2-хлорэтил)-2-амино-1-(индол-3-ил)-
(CDCl3), δ, м. д.: 3.75 (3Н, NCH3), 3.65 к (4Н, CH2Cl,
этилфосфонат
(6).
Через раствор
0.79 г
J = 6.0 Гц), 4.12 к (4Н, CH2OP, J = 7.0 Гц), 4.50 с
(0.002моль)бис(2-хлорэтил)-1-(индол-3-ил)-2-нит-
(1Н, CH), 4.00-4.85 м (2Н, CH2N), 7.00-7.70 м (4Н,
роэтилфосфоната в 17 мл метанола пропускали
Ind), 7.20 с (2Н, NH2). Спектр ЯМР 31Р (ДМСО-d6):
водород в присутствии никелевого катализатора
δР 26.40 м. д. Найдено, %: С 47.01, 47.07; Н 5.96,
(1 г никеля в 15 мл абсолютного метанола) при ком-
5.91; N 7.27, 7.28; P 8.09, 8.08. C15H21Cl2N2O3P. Вы-
натной темепартуре. Восстановление продолжали
числено, %: C 47.49; H 5.54; N 7.39; P 8.18.
до полного поглощения водорода (150 мл). Ката-
Этил-3-амино-2-(индол-3-ил)пропаноат
(8).
лизатор отфильтровывали и промывали 3-4 раза
Выход 1.02 г (63%), коричневое масло, Rf 0.76. ИК
горячим метанолом. Фильтрат упаривали, остаток
спектр (СНCl3), ν, см-1: 1725 с (С=O), 1015-1190
хроматографировали на силикагеле, элюент - аце-
(С-O-C), 3430-3480 ш (NH2, NH). Спектр ЯМР
тон-метанол (1:1). Выход 0.36 г (49%), коричне-
1Н (CDCl3), δ, м. д.: 1.20 м (3Н, CH3), 3.65-3.85 м
вое масло, Rf 0.10. ИК спектр, ν, см-1 (СНCl3):
(2Н, CH2N), 4.18-4.25 м (2Н, CH2O), 4.55 с (1Н,
1230 (P=O); 1030, 1080 (P-O-C); 3000-3400, 3480
СН), 7.00-7.65 м (4Н, Ind), 7.20 с (2Н, NH2), 9.00
(NH2, NH). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
уш. с (1Н, NН). Найдено, %: С 66.96, 66.93; Н 6.28,
3.25 к (4Н, CH2Cl, J = 6.0 Гц), 3.60 к (4Н, CH2OP,
6.29; N 11.82, 11.80. C13H16N2O2. Вычислено, %: C
J = 7.0 Гц), 3.95 с (1Н, СН), 4.02 д (2Н, CH2N,
67.24; H 6.89; N 12.07.
J = 7.5 Гц), 6.95 с (2Н, NH2), 7.00-7.65 м (4Н, Ind),
8.50 уш. с (1Н, NH). Спектр ЯМР 31Р (ДМСО-d6):
Этил-3-амино-2-(1-метилиндол-3-ил)пропа-
δР 28.10 м. д. Найдено, %: С 45.93, 45.95; Н 5.25,
ноат (9). Выход 1.99 г (81%), коричневое масло,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1462
САРКИСЯН
Rf 0.70. ИК спектр, ν, см-1 (СНCl3): 1725 с (С=O),
КОНФЛИКТ ИНТЕРЕСОВ
1020-1180 с (С-O-C), 3400 ш (NH2). Спектр ЯМР
Автор заявляет об отсутствии конфликта
1Н, δ, м. д. (CDCl3): 1.20 м (3Н, CH3), 3.75 м (3Н,
интересов.
NСН3), 3.80 д (2Н, CH2N, J = 4.0 Гц), 4.40 с (1Н,
СН), 4.18-4.25 м (2Н, CH2O), 7.10-7.70 м (4Н, Ind),
СПИСОК ЛИТЕРАТУРЫ
7.17 c (2Н, NH2). Найдено, %: С 68.71, 68.72; Н
1. Машковский М.Д. Лекарственные средства. М.:
7.11, 7.14; N 10.98, 10.99. C14H18N2O2. Вычислено,
Новая волна, 2005. Т. 2. 1200 с.
%: C 68.29; H 7.32; N 11.38.
2. Sosič I., Anderluh M., Sova M., Gobec M., Mlinarič
Этил-3-амино-2-(2-метилиндол-3-ил)пропа-
Raščan I., Derouaux A., Amorso A., Terrak M., Breu-
ноат (10). Выход 0.75 г (76%), желто-коричневое
kink E., Gobec S. // J. Med. Chem. 2015. Vol. 58. N 24.
масло, Rf 0.65. ИК спектр, ν, см-1 (СНCl3): 1720 с
P. 9712. doi 10.1021/acs.jmedchem.5b01482
(С=O), 1019-1190 с (С-O-C); 3400, 3480 ш (NH2).
3. Elmegeed G.A., Khalil W.K.B., Raouf A.A., Abdel-
Спектр ЯМР 1Н, δ, м. д. (CDCl3): 1.15 м (3Н, CH3),
halim M.A. // Eur. J. Med. Chem. 2008. Vol. 43. P. 763.
2.35 c (3Н, СIndСН3), 3.65 д (2Н, CH2N, J = 4.0 Гц),
doi 10.1016/j.ejmech.2007.06.003
4.10-4.22 м (2Н, CH2O), 4.20 с (1Н, СН), 7.00-7.60
4. Ahmed H.H., Elmegeed G.A., El-Sayed E.-S.M., Abd-
м (4Н, Ind), 7.15 м (2Н, NH2), 8.35 уш. с (1Н, NH).
Elhalim M.M., Shousha W.G., Shafic R.W. // Eur. J.
Найдено, %: С 67.79, 67.68; Н 7.50, 7.62; N 10.83,
Med. Chem. 2010. Vol. 45. P. 5452. doi 10.1016/j.
10.88. C14H18N2O2. Вычислено, %: C 68.29; H 7.32;
N 11.38.
ejmech.2010.09.017
5. Общая органическая химия / Под ред. Н.К. Кочетко-
Спектры ЯМР 1Н и 31Р получены на спектро-
ва. М.: Химия, 1985. Т. 8. С. 556.
метре Bruker AC-200 (200 МГц). ИК спектры сня-
6. Berestovitskaya V.M., Deiko L.I., Sarkissyan Z.M.,
ты на Фурье-спектрометрах Specord 75-IR или
Vereschagina Y. // Phosphorus, Sulfur, Silicon, Relat.
UR-20 в растворе хлороформа (при концентрации
Elem. 2002. Vol. 177. P. 2211. doi 10.1080/
40 мг/мл).
10426500290095449
Очистку и абсолютирование используемых
7. Саркисян З.М., Макаренко С.В., Берестовицкая В.М.,
в работе растворителей осуществляли по стан-
Дейко Л.И., Беркова Г.А. // ЖОХ. 2003. Т. 73. № 8.
дартной методике [9]. Для очистки и разделения
С. 1404; Sarkisyan Z.M., Makarenko S.V.,
продуктов реакции наряду с перекристаллизаци-
Berestovitskaya V.M., Deiko L.I., Berkova G.A. // Russ.
ей применяли метод колоночной хроматографии.
J. Gen. Chem. 2003. Vol. 73. P. 1328. doi 10.1023/B:R
В качестве адсорбента использовали силикагель
UGC.0000007671.40282.1a
марки Chemapol L 100/200 μ, двуокись крем-
8. Ишмаева Э.А., Верещагина Я.А., Литвинов И.А.,
ния (чда) при соотношении вещество-носитель в
Фаттахова Г.Р., Губайдуллин А.Т., Берестовицкая
среднем 1:10 (по весу), элюотропный ряд раство-
В.М., Васильева О.С., Остроглядов Е.С., Сарки-
рителей по Траппе [10]. Индивидуальность полу-
ченных продуктов и ход реакции контролировали
сян З.М., Александрова С.М. // XVII Менделеевский
методом тонкослойной хроматографии; значения
съезд по общей и прикладной химии. Tезисы докла-
Rf для аминоэфиров определяли с использованием
дов. 2003. С. 343.
метода бумажной хроматографии и смеси раство-
9. Гордон А. Спутник химика. М.: Мир, 1976. С. 96.
рителей ледяная уксусная кислота-дистилирован-
10. Органикум. Практикум по органической химии /
ная вода-н-бутанол (5:3:10).
Под ред. А.Н. Коста. М.: Мир, 1979. Т. 2. 392 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ АНАЛОГОВ ТРИПТАМИНА
1463
Synthesis of Functionalized Triptamine Analogues with
Dichloroethoxyphosphoryl and Ethoxycarbonyl Groups
Z. M. Sarkisyan*
St. Petersburg State Pediatric Medical University, St. Petersburg, 194100 Russia
* e-mail: zara-sark@inbox.ru
Received April 9, 2020; revised April 12, 2020; accepted April 16, 2020
A rational method for the synthesis of functionalized tryptamine precursors by reduction of 1- and 2-substituted
3-nitroethylindoles on a nickel catalyst was proposed.
Keywords: indolylaminoethylphosphonates, indolylaminopropanoates, tryptamine precursors
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020