ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 9, с. 1473-1476
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.241.298.2.057
ОДНОРЕАКТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
N-ФОСФОРИЛИРОВАННЫХ МОНО- И ДИИМИДАТОВ
© 2020 г. В. Е. Шишкин, Ю. В. Попов, О. В. Анищенко*, М. А. Шевченко,
С. М. Леденев, Н. А. Соколов
Волгоградский государственный технический университет, пр. Ленина 28, Волгоград, 400131 Россия
*e-mail: anishchenko@vstu.ru
Поступило в Редакцию 23 марта 2020 г.
После доработки 23 марта 2020 г.
Принято к печати 1 апреля 2020 г.
Разработан эффективный однореакторный метод получения фосфорорганических производных имидо-
вых кислот, основанный на взаимодействии гидрохлоридов моно- и диимидатов с диалкилхлорфосфа-
тами в присутствии триэтиламина без выделения свободных имидатов.
Ключевые слова: гидрохлориды имидатов, N-фосфорилированные ацетимидаты, N-фосфорилирован-
ные малонодиимидаты, фосфорилирование, диалкилхлорфосфаты
DOI: 10.31857/S0044460X2009022X
В химии важное место занимают фосфорор-
Реакцией Пиннера из малонодинитрила, этилово-
ганические соединения, среди которых особый
го спирта и хлористого водорода в зависимости от
интерес представляют фосфорсодержащие произ-
мольного соотношения реагентов можно получить
водные имидовых кислот, амины и амиды [1, 2].
гидрохлориды моно- и диимидатов (схема 1).
Известны имидаты с фосфорсодержащей группой
Установлено, что превращение нитрильных
в углеводородной части - С-фосфорилированные
групп в имидные происходит ступенчато, и при со-
имидаты [3-5], которые являются биологически
отношении реагентов малонодинитрил:спирт:хло-
активными веществами. Среди них найдены ве-
ристый водород = 1:1:2 селективно удается полу-
щества с высокой инсектицидной, акарицидной,
чить гидрохлорид этил-(2-циано)ацетимидата 1 с
фунгицидной, гербицидной и росторегулирующей
выходом 97%, а при соотношении малонодини-
активностью [6]. Кроме того, в связи с высокой ре-
трил:спирт:хлористый водород = 1:2:4 с выходом
акционной способностью, соединения этих клас-
97% образуется гидрохлорид диэтилмалонодии-
сов можно использовать для получения новых ти-
мидата 2 (схема 1). Реакцию Пиннера проводили
пов фосфорорганических соединений [7, 8].
в среде безводного диоксана при барботировании
С целью получения новых производных имидо-
хлористого водорода через смесь динитрила и
вых кислот нами осуществлена реакция фосфори-
спирта при температуре 0±5°С. После насыще-
лирования гидрохлоридов этил-(2-циано)ацетими-
ния хлористым водородом как в первом, так и во
датов и диэтилмалонодиимидатов по атому азота.
втором случае реакционную массу выдерживали в
Схема 1.
1473
1474
ШИШКИН и др.
Схема 2.
течение 15-24 ч. Полученные гидрохлориды пред-
лирующими агентами проходило полностью при
ставляют собой кристаллические вещества, кото-
температуре 30-40°С в течение 2.5-3 ч. Мольное
рые могут храниться длительное время без изме-
соотношение гидрохлорид-диалкилхлорфосфат-
нений на холоду и без доступа влаги.
триэтиламин составляет 1:1:2.25 в случае получе-
ния моноимидатов и 1:2:4.2 в случае синтеза дии-
Широко используемым способом получения
мидатов. Для выделения целевого вещества соль
N-замещенных имидатов является двухстадий-
триэтиламина отделяли фильтрованием, раствори-
ный процесс, когда сначала выделяют свободный
тель и избыток триэтиламина удаляли в вакууме.
имидат, а затем проводят замещение по имино-
Выход N-фосфорилированных моно- и диимида-
группе. По этому способу свободные имидаты
тов составил свыше 90%.
количественно выделяются из гидрохлоридов
триэтиламином в среде диоксана по методике [9].
Полученные продукты очищали колоночной
Взаимодействие свободных имидатов с фосфори-
хроматографией. Индивидуальность соединений
лирующими агентами осуществляли в среде диок-
контролировали методом тонкослойной хромато-
сана в присутствии акцептора хлористого водоро-
графии. Структуру и состав синтезированных сое-
да триэтиламина. Реакции протекают энергично
динений устанавливали ИК и ЯМР 1Н спектроско-
уже при комнатной температуре, сопровождаются
пией, и по данным элементного анализа.
экзотермическим эффектом. Для завершения про-
Полученные N-фосфорилированные моно- и
цесса требуется нагревание до 40°С в течение 2-
диимидаты 3-6 представляют собой вязкие жидко-
3 ч. N-Фосфорилированные моно- и диимидаты
сти желтого цвета, хорошо растворимые в органи-
получены с высокими выходами (более 89%).
ческих растворителях и плохо растворимые в воде.
С целью оптимизации вышеописанного про-
В присутствии триэтиламина в качестве ак-
цесса предложено проводить получение N-фосфо-
цептора хлористого водорода процесс получения
рилированных производных напрямую из гидрох-
N-фосфорилированных моно- и диимидатов не
лоридов имидатов, совмещая синтез свободных
осложняется побочными реакциями. Установлено,
имидатов и реакцию фосфорилирования в одном
что процесс можно проводить в одном реакторе
реакторе (схема 2).
с образованием продуктов фосфорилирования по
иминогруппам. Предложенный способ является
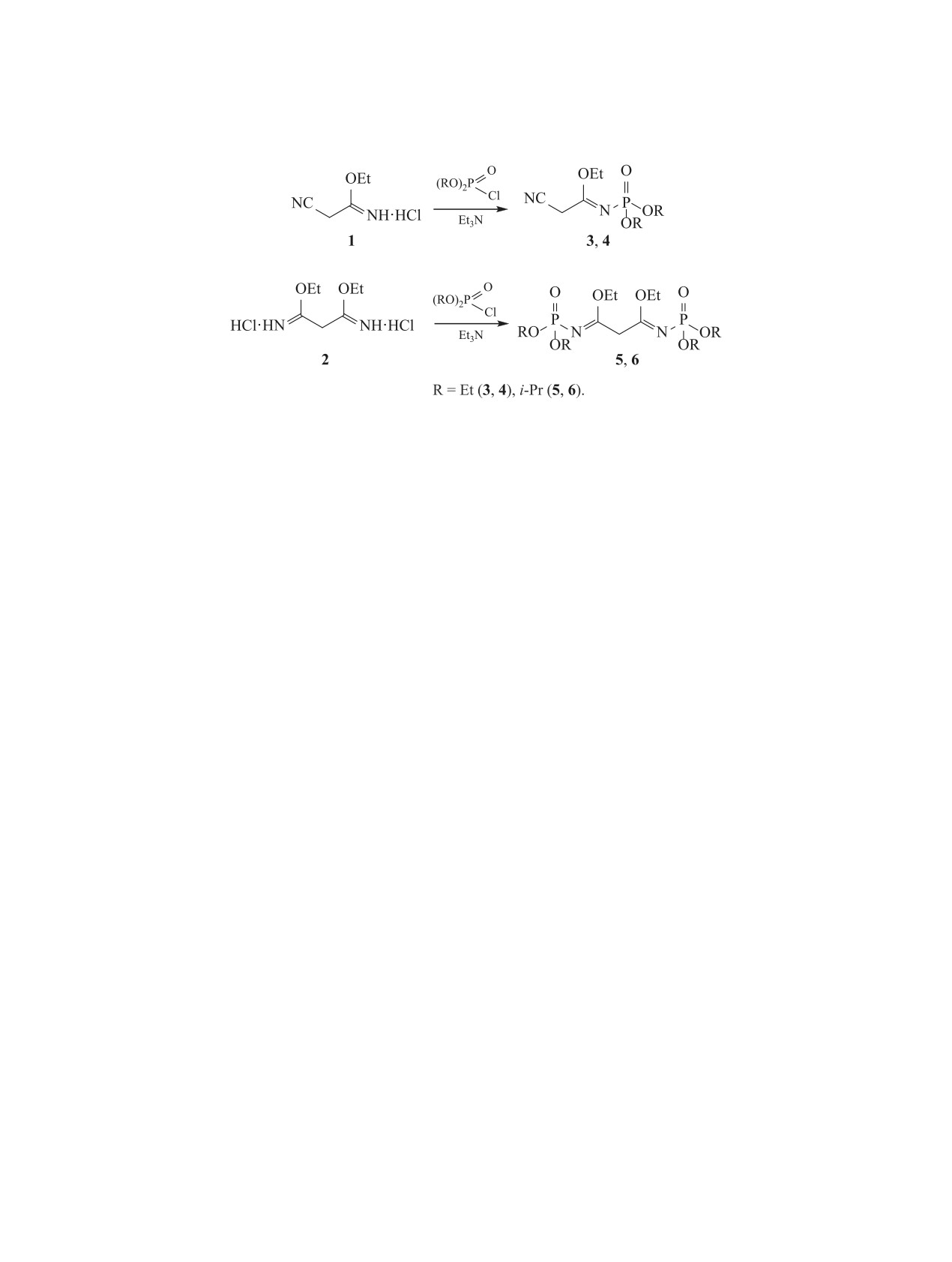
Полученные гидрохлориды 1 и 2 без выделения
свободных имидатов вводили в реакцию фосфори-
удобным, так как позволяет увеличить выход це-
лирования диалкилхлорфосфатами (схема 2). При
левых продуктов из-за отсутствия потерь свобод-
добавлении триэтиламина сразу же наблюдалось
ных имидатов на стадии их выделения, уменьшить
образование осадка соли триэтиламина. Реакция
расход растворителя, затраты на его регенерацию
сопровождалась выделением тепла, поэтому ре-
и сократить время процесса.
акционную смесь охлаждали до 10-15°С, затем
На основании компьютерного скрининга [10]
при перемешивании и охлаждении прибавляли
для синтезированных имидатов прогнозируются
диалкилхлорфосфат. Взаимодействие с фосфори-
разнообразные виды биологической активности:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
ОДНОРЕАКТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
1475
антипсориазная, противоопухолевая, ингибиро-
спектр, ν, см-1: 970-1030 (РОС), 1160 (Р=О), 1216
вание гидролазы, глюконат-2-дегидрогеназы, ку-
(C-O-C), 1598 (С=N), 2278 (C≡N). Спектр ЯМР 1Н
тиназы, ацетилэстеразы. Это свидетельствует о
(ССl4), δ, м. д.: 1.05 т (9Н, СН3, JHH = 6.0 Гц), 2.52
целесообразности поиска среди N-фосфорилиро-
с (2H, CH2), 3.78 к (2Н, СН2О, JHH = 6.0 Гц), 3.95
ванных производных имидатов фармакологически
д. к (4H, CH2ОР, JHP = 9.0, JHH = 6.0 Гц). Найдено,
активных веществ.
%: N 11.12; P 12.66. C9H17N2O4P. Вычислено, %: N
11.28; P 12.49.
Гидрохлорид этил-(2-циано)ацетимидата (1).
Через смесь 3 г (0.045 моль) малонодинитрила,
Этил-N-диизопропилфосфорил-(2-циано)-
2.1 г (0.045 моль) безводного этилового спирта и
ацетимидат
(4) получали аналогично из
6 г
10 мл безводного диоксана пропускали газообраз-
(0.040 моль) гидрохлорида этил-(2-циано)аце-
ный хлористый водород (3.3 г, 0.090 моль) при
тимидата 1, 8.0 г (0.040 моль) диизопропилхлор-
0°С. Контроль поглощенного реакционной смесью
фосфата и 9.1 г (0.090 моль) триэтиламина. Выход
хлористого водорода проводили взвешиванием.
9.9 г (90%), nD20 1.4403, d420 1.2040. ИК спектр, ν,
Мольное соотношение малонодинитрил:этиловый
см-1: 950-1000 (РОС), 1026 (Р=О), 1181 (C-O-C),
спирт:хлористый водород = 1:1:2. Реакционную
1634 (С=N), 2350 (C≡N). Спектр ЯМР 1Н (ССl4),
смесь перемешивали в течение 15 ч при -5°С, за-
δ, м. д.: 1.07 т (3Н, СН3, JHH = 6.0 Гц), 1.25 д (12Н,
тем удаляли избыток хлористого водорода и ди-
СН3, JHH = 6.0 Гц), 2.55 с (2H, CH2), 3.75 к (2Н,
оксан в вакууме. Остаток промывали безводным
СН2О, JHH = 6.0 Гц), 4.10 д. септетов (2H, CHОР,
диэтиловым эфиром и вакуумировали. Выход 6.5 г
JHP = 9.0, JHH = 6.0 Гц). Найдено, %: N 10.11; P
(97%).
10.99. C11H21N2O4P. Вычислено, %: N 10.13; P
11.22.
Гидрохлорид диэтилмалонодиимидата
(2)
получали аналогично из 3 г (0.045 моль) малоно-
Диэтил-N-диэтилфосфорилмалонодиими-
динитрила, 4.2 г (0.090 моль) безводного этило-
дат (5) получали аналогично из 6 г (0.026 моль)
вого спирта, 10 мл безводного диоксана и 6.6 г
гидрохлорида диэтилмалонодиимидата 2, 9.0 г
(0.180 моль) хлористого водорода. После насы-
(0.052 моль) диэтихлорфосфата и
10.5 г
щения хлористым водородом реакционную массу
(0.105 моль) триэтиламина. Выход 10.3 г (92%),
выдерживали 24 ч при -5°С. Мольное соотноше-
nD20 1.4432, d420 1.2120. ИК спектр, ν, см-1: 957-1012
ние малонодинитрил:этиловый спирт:хлористый
(РОС), 1278 (Р=О), 1216 (C-O-C), 1621 (С=N).
водород = 1:2:4. Выход 10.1 г (97%).
Спектр ЯМР 1Н (ССl4), δ, м. д.: 1.14 т (18Н, СН3,
J
= 6.0 Гц), 2.55 с (2H, CH2), 3.70 к (4Н, СН2О,
Этил-N-диэтилфосфорил-(2-циано)ацетими-
HH
J
= 6.0 Гц), 3.82 д. к (8H, CH2ОР, JHP = 9.0, JHH =
дат (3). К смеси 6.0 г (0.040 моль) гидрохлорида
HH
6.0 Гц). Найдено, %: N 6.41; P 7.39. C15H32N2O8P2.
этил-(2-циано)ацетимидата 1 и 15 мл безводного
Вычислено, %: N 6.51; P 7.20.
диоксана при температуре 10-15°С при перемеши-
вании по каплям добавляли 9.2 г (0.090 моль) три-
Диэтил-N-диизопропилфосфорилмало-
этиламина. Реакционную смесь перемешивали при
нодиимидат (6) получали аналогично из 6 г
комнатной температуре 30 мин, затем по каплям
(0.026 моль) гидрохлорида диэтилмалонодиими-
добавляли раствор 6.9 г (0.040 моль) диэтилхлор-
дата 2, 10.4 г (0.052 моль) диизопропилхлорфос-
фата и 10.5 г (0,105 моль) триэтиламина. Выход
фосфата в 5 мл диоксана. Постепенно повышали
температуру до 30-40°С и продолжили переме-
11.5 г (91%), nD20 1.4436, d420 1.216. ИК спектр, ν,
шивание в течение 2.5-3 ч. Образовавшуюся соль
см-1: 945-1006 (РОС), 1227 (Р=О), 1181 (C-O-C ).
гидрохлорида триэтиламина отфильтровывали,
Спектр ЯМР 1Н (ССl4), δ, м. д.: 1.12 т (6Н, СН3,
J
= 6.0 Гц), 1.24 д (24Н, СН3, JHH = 6.0 Гц), 2.55
отгоняли растворитель и избыток триэтиламина
HH
с (2H, CH2), 3.68 к (4Н, СН2О, JHH = 6.0 Гц), 4.13 д.
в вакууме (10-15 мм рт. ст.). Остаток хроматогра-
септетов (4H, CHОР, JHP = 9.0, JHH = 6.0 Гц). 1596
фировали на силикагеле марки μLC 5/40, элюент -
(С=N). Найдено, %: N 6.00; P 6.45. C19H40N2O8P2.
диэтиловый эфир-хлороформ, 2:1. Индивидуаль-
ность контролировали методом ТСХ на пластин-
Вычислено, %: N 5.75; P 6.37.
ках Silufol (диэтиловый эфир-хлороформ, 2:1, Rf
Спектры ЯМР 1Н регистрировали на спектро-
0.67). Выход 9.3 г (94%), nD20 1.4386, d420 1.194. ИК
метре Varian Mercury 300 BB, рабочая частота -
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020
1476
ШИШКИН и др.
300 МГц, растворитель - четыреххлористый угле-
pov Y.V., Anishchenko O.V., Shevchenko M.A.,
род. ИК спектры снимали на приборе PerkinElmer
Ledenev S.M., Moroz A.A., Kosheleva I.A. // Russ. J.
Gen. Chem. 2017. Vol. 87. N. 9 P. 2133. doi 10.1134/
в тонком слое.
S1070363217090390
КОНФЛИКТ ИНТЕРЕСОВ
5. Шишкин В.Е., Попов Ю.В., Анищенко О.В., Шев-
ченко М.А., Кошелева И.А., Соколов Н.А. // ЖОХ.
Авторы заявляют об отсутствии конфликта ин-
2018. Т. 88. № 10. С. 1714; Shishkin V.E., Popov Y.V.,
тересов.
Anishchenko O.V., Shevchenko M.A., Kosheleva I.A. //
СПИСОК ЛИТЕРАТУРЫ
Russ. J. Gen. Chem. 2018. Vol. 88. N 10 P. 2200. doi
10.1134/S0044460X18100219
1. Гейн В.Л., Замараева Т.М., Федотов А.Ю., Ба-
6. Шишкин В.Е., Медников Е.В., Юхно Ю.М. // Изв.
ландина А.В., Дмитриев М.В. // ЖОХ. 2016. Т. 86.
ВолгГТУ. 2007. Вып. 4. № 5. C. 62.
№ 11. С. 1794; Gein V.L., Zamaraeva T.M., Fedotov A.Y.,
7. Егорова А.В., Викторов Н.Б., Ляменкова Д.В., Свин-
Balandina A.V., Dmitriev M.V. // Russ. J. Gen.
цицкая Н.И., Гарабаджиу А.В., Догадина А.В. //
Chem. 2016. Vol. 86. N 11. P. 1794. doi 10.1134/
ЖОХ. 2016. Т. 86. № 11. С. 1803; Egorova A.V.,
S1070363216110062
Viktorov N.B., Lyamenkova D.V., Svintsitskaya N.I.,
2. Яркевич А.Н., Брель В.К., Махаева Г.Ф., Серебряко-
Garabadziu A.V., Dogadina A.V. // Russ. J. Gen.
ва О.Г., Болтнева Н.П., Ковалева Н.В. // ЖОХ.
Chem. 2016. Vol. 86. N 11. P. 2446. doi 10.1134/
2015. Т. 85. № 7. С. 1120; Yarkevich A.N., Brel V.K.,
S1070363216110086
Makhaeva G.F., Serebryakova O.G., Boltneva N.P.,
8. Багаутдинова Р.Х., Бурилов А.Р., Пудовик М.А.,
Kovaleva N.V. // Russ. J. Gen. Chem. 2015. Vol. 85.
Пудовик Е.М. // ЖОХ. 2015. Т. 85. № 5. С. 875;
N 7. P. 1644. doi 10.1134/S1070363215070129
Bagautdinova R.K., Burilov A.R., Pudovik M.A.,
3. Шишкин В.Е., Медников Е.В., Попов Ю.В., Шевчен-
Pudovik E.M. // Russ. J. Gen. Chem. 2015. Vol. 85. N 5.
ко М.А., Анищенко О.В. // ЖОХ. 2016. Т. 86. № 3.
P. 1204. doi 10.1134/S1070363215050370
С. 378; Shishkin V.E., Mednikov, E.V., Popov Y.V.,
9. Шишкин В.Е., Попов Ю.В., Уфимцев С.В., Анищен-
Shevchenko M.A., Anishchenko O.V. // Russ. J. Gen.
ко О.В., Шевченко М.А., Кошелева И.А., Соколов Н.А. //
Chem. 2016. Vol. 86. N. 3 P. 522. doi 10.1134/
Изв. ВолгГТУ. 2017. № 11 (206). C. 41.
S1070363216030051
10. PASS Online. Laboratory for Structure-Function
4. Шишкин В.Е., Попов Ю.В., Анищенко О.В., Шевчен-
Based Drug Design, Institute of Biomedical Chemistry
ко М.А., Леденев С.М., Мороз А.А., Кошелева И.А. //
ЖОХ. 2017. Т. 87. № 9. С. 1578; Shishkin V.E., Po-
passonline/predict.php
One-Pot Method for Synthesis of N-Phosphorylated Mono-
and Diimidates
V. E. Shishkin, Y. V. Popov, O. V. Anishchenko*, M. A. Shevchenko,
S. M. Ledenev, and N. A. Sokolov
Volgograd State Technical University, Volgograd, 400131 Russia
*e-mail: anishchenko@vstu.ru
Received March 23, 2020; revised March 23, 2020; accepted April 1, 2020
An effective one-pot method was developed for the preparation of organophosphorus derivatives of imidic acids
based on the reaction of mono- and diimidates hydrochlorides with dialkyl chlorophosphates in the presence of
triethylamine without isolation of free imidates.
Keywords: imidate hydrochloride, N-phosphorylated acetimidates, N-phosphorylated malonodiimidates,
phosphorylation, dialkyl chlorophosphates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 9 2020