ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 3-37
ОБЗОРНАЯ
СТАТЬЯ
УДК 577.58.54
2-АРИЛБЕНЗОТИАЗОЛЫ: ПЕРСПЕКТИВЫ
СОЗДАНИЯ ПРОТИВОРАКОВЫХ И
ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ
© 2021 г.
Е. П. Студенцова,
А. А. Головинаа,*, Р. Н. Красиковаb, В. В. Орловскаяb,
Д. Д. Ваулинаb, В. И. Крутикова, С. М. Рамша
а Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Институт мозга человека имени Н. П. Бехтеревой Российской академии наук, Санкт-Петербург, 197376 Россия
*e-mail: golovina@technolog.edu.ru
Поступило в Редакцию 7 октября 2020 г.
После доработки 15 ноября 2020 г.
Принято к печати 3 декабря 2020 г.
В обзоре обобщены и проанализированы литературные данные по медицинской химии физиологически
активных 2-арилбензотиазолов - перспективного класса противораковых соединений и средств диагно-
стики болезни Альцгеймера. Рассмотрены соотношения структура-активность в ряду 2-арилбензотиазо-
лов и механизмы биоактивации субстанций с использованием меченых радиофармпрепаратов. В резуль-
тате проведенного анализа выбраны и отдельно рассмотрены соединения-лидеры, которые прошли или
рекомендованы для клинических испытаний. Проанализированы методы синтеза 2-арилбензотиазолов,
которые легли в основу разработок лекарственных препаратов нового поколения. Рассмотрены методы
получения биологически активных фторсодержащих 2-арилбензотиазолов, включая противоопухолевые
препараты РМХ 610, 5-Фтор 203, Фортресс с высокой антипролиферативной активностью. Обсуждаются
перспективы применения 2-арилбензотиазолов в биологии и медицине.
Ключевые слова: 2-арилбензотиазолы, структура-активность, противораковые препараты, диагностика
болезни Альцгеймера, радиофармпрепараты, позитронно-эмиссионная томография
DOI: 10.31857/S0044460X21010017
1. Введение
3
2. Биологическая активность 2-арилбензотиазолов
5
3. Основные методы получения 2-арилбензотиазолов
6
4. Противоопухолевые свойства фторсодержащих 2-арилбензотиазолов
12
5. Способы получения противоопухолевых фторсодержащих 2-арилбензотиазолов
17
6. Применение 2-арилбензотиазолов в биологии и медицине
24
7. Заключение
31
1. ВВЕДЕНИЕ
антитуберкулезным [3], антималярийным [4], про-
Бензотиазолы
- уникальный класс гетеро-
тивосудорожным [5], антидиабетическим [6], ан-
циклических соединений с широким спектром
тимикробным [3,7], противовирусным (включая
фармакологической активности [1, 2]. Среди них
вирус иммунодефицита) [8] и противораковым [9]
найдены лекарственные препараты, обладающие
действием.
3
4
СТУДЕНЦОВ и др.
Рис. 1. 2-Арилбензотиазолы и их индольный аналог - потенциальные противоопухолевые и терапевтические препараты::
PMX 610 (GW610, NSC 721648) [23, 24], 6F PMX 610 [24], 5F 203 (NSC 703786) [25], Фортресс (NSC 710365) [26], DF 203
(NSC 674495) [27], РМХ 464 (AW 464, NSC 706704, хинол) [28, 29], фторированный хинол (AJM 290) [30, 31], Френтизол
[32]. (*) Нетоксичный противовирусный и иммуносупрессорный агент, используется в клинике при лечении ревматоидного
артрита и красной волчанки [32].
Данный обзор является продолжением серии
биологически активных 2-арилбензотиазолов и
наших обзорных работ по синтезу и фармаколо-
биохимической трансформации лекарственных и
гическим свойствам лекарственных препаратов,
диагностических субстанций.
таких как: фторированные гетероциклы, нукле-
Особое место в стратегии решения социаль-
иновые основания, нуклеозиды, обладающие
но-экономических проблем занимает создание
противораковой активностью [10]; производные
эффективных лекарственных средств нового поко-
D-люциферина, являющегося биомаркером для
ления для лечения тяжелых заболеваний человека:
выявления различных микробных заболеваний
СПИДа, рака, болезни Альцгеймера. Выполнение
и патологий человека [11]; фторуглеводы и ради-
этой сложной задачи требует объединения усилий
офармпрепараты, используемые в практической
медицине [12]; иммуностимуляторы и адаптогены
в междисциплинарных исследованиях в различ-
[13]. Отличительной особенностью данного об-
ных областях химии, фармакологии, молекулярной
зора является детальное освещение химических
биологии. Перспективным направлением поиска
аспектов методологии направленного синтеза
новых терапевтических средств является всесто-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
5
Рис. 2. Препараты для диагностической визуализации β-амилоидов [33].
роннее исследование биологической активности
можного механизма их действия. Эти работы были
производных 2-арилбензотиазолов, которые отно-
сопряжены с разработкой средств для диагностики
сятся к привилегированному классу, содержащему
нейродегенеративных заболеваний методом пози-
активные фармакофоры. В Национальном раковом
тронно-эмиссионной томографии (ПЭТ) с визуа-
институте (США) выполнен большой объем ра-
лизацией короткоживущими изотопами (11С, 18F).
бот по экспериментальному изучению различных
Итоги этих и других работ отражены в научных
гетероциклических соединений
- потенциаль-
обзорах [15-22].
ных противораковых препаратов и неинвазивных
2. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
диагностических средств для профилактики и
2-АРИЛБЕНЗОТИАЗОЛОВ
лечения рака [14]. В данном институте в рамках
государственных программ на протяжении более
Изучение литературы по биологической актив-
20 лет осуществлялся планомерный скрининг про-
ности производных 2-арилбензотиазолов позволи-
тивоопухолевых препаратов в классе бензотиазо-
ло выделить в этом ряду два класса перспективных
лов на 60 линиях опухолевых клеток человека, а
лекарственных препаратов: противоопухолевые
также углубленное экспериментальное изучение
соединения и средства, предназначенные для ди-
наиболее активных препаратов на животных со
агностики нейродегенеративных заболеваний. На
злокачественными новообразованиями. В резуль-
рис. 1, 2 приведены химические структуры потен-
тате, отобрано значительное количество веществ с
циальных лекарственных средств и диагности-
противоопухолевой активностью, а среди них вы-
ческих препаратов, обладающих в эксперименте
явлены наиболее перспективные малотоксичные
выраженной биологической активностью. Соеди-
лекарственные субстанции с установлением воз-
нения-лидеры обозначены медицинскими номе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
6
СТУДЕНЦОВ и др.
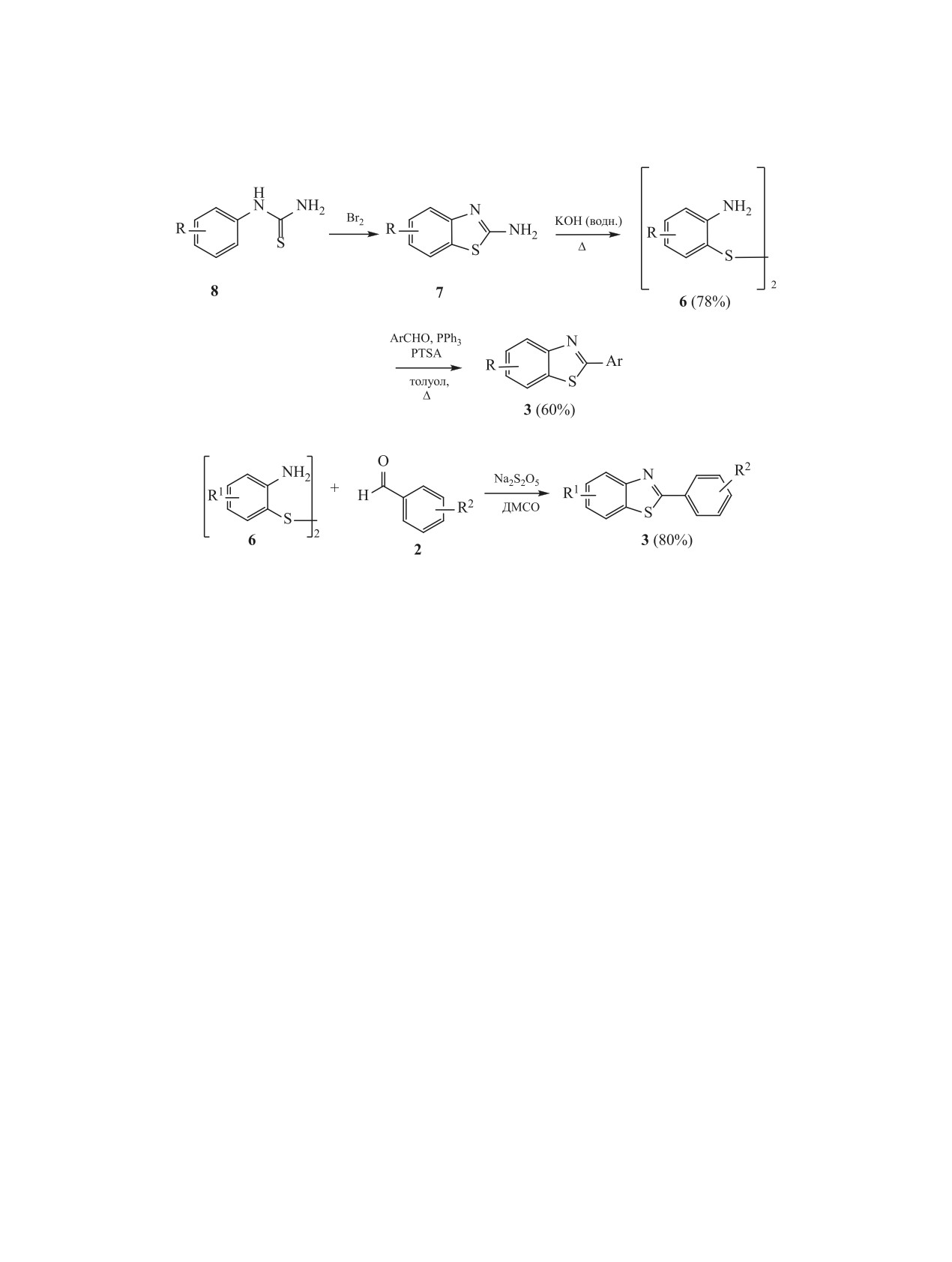
Схема 1.
рами и шифрами, они рекомендованы к клиниче-
(свободный радикал
4-метокси-2,2,6,6-тетраме-
ским испытаниям.
тил-1-пиперидинилокси) [47], I2 [42]. Высокий вы-
ход 2-(R-фенил)бензотиазолов 3а, где R = п- или
3. ОСНОВНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ
м-CH3, ОСН3, СN, NO2, достигнут при проведении
2-АРИЛБЕНЗОТИАЗОЛОВ
реакции в спирте при комнатной температуре в те-
Способы получения, строение и реакционная
чение 15-40 мин в присутствии иммобилизирован-
способность 2-арилбензотиазолов подробно рас-
ной серной кислоты на силикагеле (H2SO4/SiO2)
смотрены в монографиях и обзорах [20, 21, 34-38].
[53]. В некоторых синтезах соединений 3а ионная
Ниже приведена краткая сводка способов получе-
жидкость - [PMIM]Br (1-пропил-3-метилимида-
ния и свойств 2-арилбензотиазолов, подготовлен-
золийбромид) - выполняет роль и растворителя,
ная по указанным источникам с привлечением, по
и катализатора [48]. В так называемых «зеленых»
мере необходимости, дополнительных данных.
методах синтеза соединений 3а реакцию проводят
3.1. Конденсация 2-аминотиофенола с бен-
в полиэтиленгликоле (PEG) [49] или глицерине
зальдегидами, бензойными кислотами и их
[44], в гамма-валеролактоне [54], а также в воде
производными. Бóльшая часть методов синтеза
с ионнообменной смолой Dowex 50W в качестве
2-арилбензотиазолов, о которых сообщается в ли-
катализатора [50]. При проведении конденсации
тературе, относится к получению незамещенных в
без растворителя в условиях микроволновой акти-
вации в качестве катализатора применяют CuSO4
бензотиазольном фрагменте 2-арилбензотиазолов
3а. К таким методам относится циклоконденсация
[51] или SiO2 [52].
2-аминотиофенола 1 с бензальдегидами, бензой-
И в кислотной, и в щелочной среде при кон-
ными кислотами 2, а также с их эфирами или хло-
денсации 2-аминотиофенола 1 с бензальдегидами
рангидридами [34].
сначала через промежуточные 2-(бензилиденами-
Предложены различные варианты синтеза
но)тиофенолы 4 (основания Шиффа) образуются
2-арилбензотиазолов 3а из 2-аминотиофенола 1 и
2,3-дигидробензотиазолы 5, которые при окис-
лении FeCl3 превращаются в соответствующие
бензальдегидов [39-55]. 2-Аминотиофенол 1 чув-
2-арилбензотиазолы 3а (схема 1). В отдельных
ствителен к кислороду воздуха, неустойчив при
случаях окисление может происходить за счет кис-
нагревании, склонен к самопроизвольной димери-
зации, поэтому целесообразно проводить синтез
лорода воздуха, в том числе в процессе кристалли-
соединений 3а в мягких условиях с использовани-
зации из спирта [20, 41, 47, 53, 55].
ем катализаторов. В качестве катализаторов могут
Классические методы синтеза 2-арилбензотиа-
использоваться FeCl3 в метаноле [45], п-толуол-
золов 3а путем конденсации 2-аминотиофенола 1
сульфокислота (PTSA) [46, 49], 4-метокси-TEMPO
с бензойной кислотой 2 (схема 2) или ее произво-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
7
Схема 2.
Схема 3.
Схема 4.
дными, которая проводится при нагревании в по-
(38-74%). Лучшие выходы были достигнуты при
лифосфорной кислоте (PPA), не утратили своего
использовании избытка исходного бензотиазола.
значения и по сей день [56, 57]. Взаимодействие
3.2 Конденсация дифенилдисульфидов с
о-аминотиофенола 1 с бензоилхлоридами проис-
бензальдегидами. Синтез
2-арилбензотиазолов
ходит в основных растворителях (пиридин, триэ-
с различными заместителями в бензотиазольном
тиламин) [58, 59]. В этой реакции, как и в случае
фрагменте осуществляется по модифицированно-
конденсации с бензальдегидами, была успешно
му методу [36] конденсацией 2-аминотиодисуль-
применена ионная жидкость [60].
фидов 6 с замещенными бензальдегидами в кипя-
щем толуоле в присутствии трифенилфосфина при
Конденсацию аминотиофенола 1 с эфирами
катализе PTSA (схема 5).
проводят в N-метилпирролидоне (NMP) с ис-
Исходный дисульфид 6 легко получить путем
пользованием K2CO3 в качестве катализатора [61]
окислительного гидролитического расщепления
(схема 3).
тиазольного цикла в
2-амино-5(6)-замещенных
Относительно новым, альтернативным спо-
бензотиазолах при нагревании (100°С) в водном
собом получения 2-арилбензотиазолов является
растворе гидроксида калия [36]. Синтез исходных
окислительная конденсация бензотиазола с бен-
2-аминобензотиазолов 7 проводят циклизацией
зальдегидами в присутствии персульфата калия
соответствующих N-арилтиомочевин 8 бромом
[62] (схема 4).
или хлором в хлороформе или уксусной кислоте
Реакцию проводят в инертной среде при 100°С.
[37, 63]. В синтезах 2-арилбензотиазолов трифе-
Выходы варьируются от умеренных до хороших
нилфосфин выполняет роль мягкого восстанови-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
8
СТУДЕНЦОВ и др.
Схема 5.
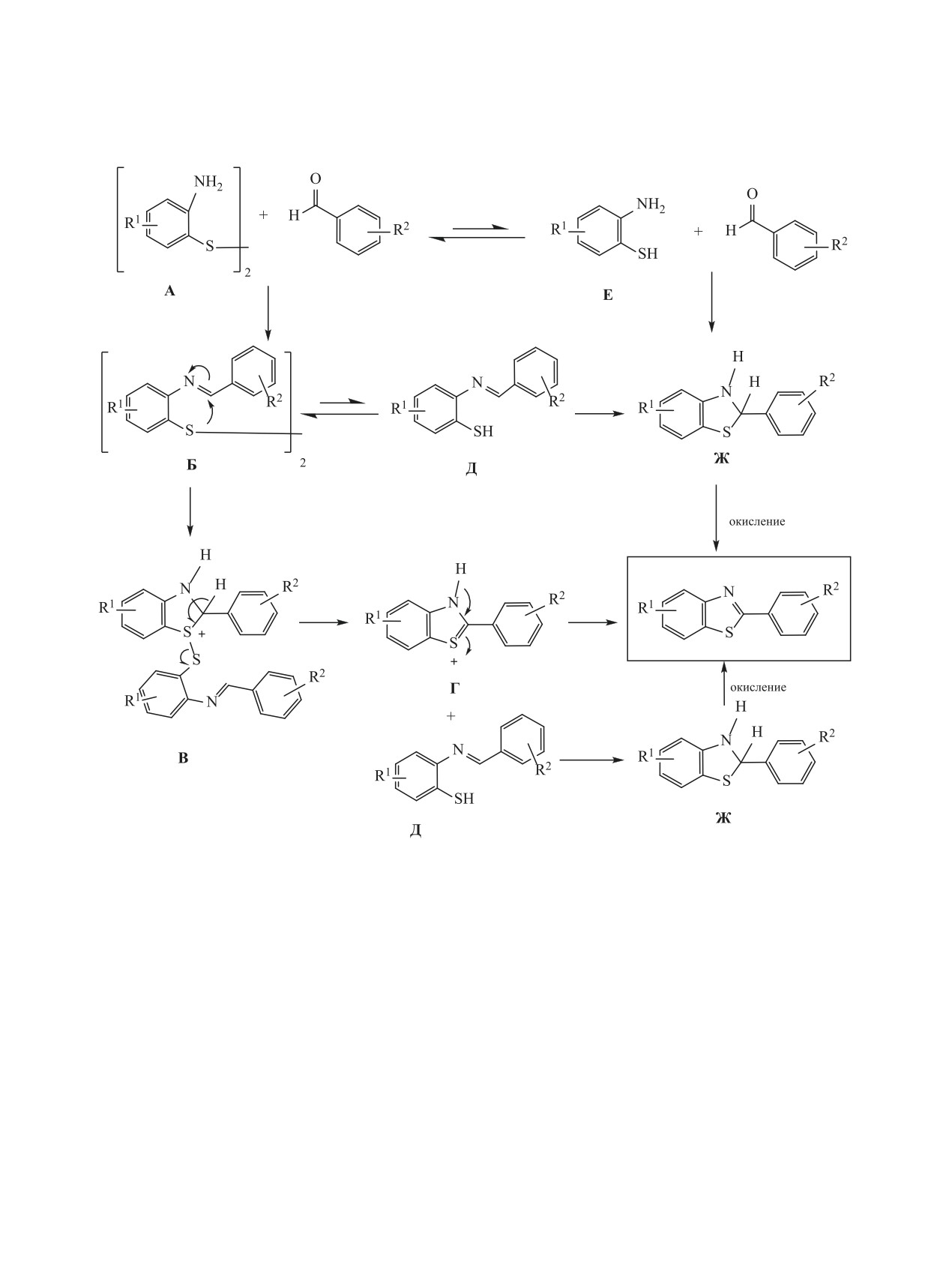
Схема 6.
теля с образованием in situ соответствующего ти-
протекания реакции была подробно рассмотрена
ола. Процесс полной циклизации промежуточного
в работах [20, 63] (схема 7). Предполагают, что
продукта происходит медленно (15-30 ч, 110°С,
аминогруппа замещенного
2-аминотиофенолди-
толуол) с выходом около 60% в зависимости от
сульфида А на первой стадии сначала реагирует с
типа заместителей в исходном дисульфиде 6. По
бензальдегидом с образованием иминодисульфида
литературным данным [63], полученные таким об-
Б. Циклизация интермедиата В с самопроизволь-
разом 2-арилбензотиазолы необходимо очищать от
ным расщеплением дисульфидной связи приводит
побочных продуктов, в том числе от образующей-
к образованию катиона 2-фенилбензотиазола Г (в
ся окиси трифенилфосфина, с помощью колоноч-
оригинале ошибочно назван таутомером) и имино-
ной хроматографии на силикагеле. В связи с этим
тиофенола Д, который может либо циклизоваться
в той же работе сообщается об упрощенном спосо-
в дигидробензотиазол Ж, либо повторно окислен
бе синтеза биологически активных производных
до промежуточного соединения Б, которое потом
2-арилбензотиазолов конденсацией замещенных
циклизуется в бензотиазольный продукт через ин-
2-аминотиофенолдисульфидов с рядом бензальде-
термедиаты В и Г. Авторы [63] допускают альтер-
гидов с использованием в качестве окислителя ме-
нативный механизм данной реакции, связывая его
табисульфита натрия (Na2S2O5) при нагревании в
с возможностью тиол-дисульфидного равновесия
ДМСО или ДМФА при 120°С в течение 40-90 мин
в высокополярном растворителе ДМСО. Считают,
(cхема 6). После обработки продуктов реакции во-
что в силу гигроскопичности последнего неболь-
дой 2-арилбензотиазолы 3 с различными замести-
шие количества воды могут реагировать при на-
телями в гетероцикле и фенильном кольце (R1, R2 =
гревании с бисульфитом натрия с выделением SO2,
OCH3, ОС2Н5, F, Cl, Br, NO2, CN, OH, без защиты
способного выступать в качестве восстановителя с
фенольной группы) очищают кристаллизацией из
образованием тиофенола Д и промежуточного ин-
хлористого метилена и выделяют с выходом более
термедиата Е, который обычным путем циклизует-
80% в большинстве случаев.
ся в дигидробензотиазол Ж, а затем окисляется в
Использование в данных реакциях циклиза-
2-арилбензотиазол.
ции окислителя Na2S2O5 вместо восстановителя
3.3. Внутримолекулярная циклизация за-
трифенилфосфина является довольно необыч-
мещенных тиоанилидов. Внутримолекулярная
ным. Рабочая гипотеза возможного механизма
циклизация замещенных тиоанилидов может быть
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
9
Схема 7.
осуществлена под действием таких реагентов,
атакой бензольного цикла с отщеплением протона
как NaH-I2 [64], Cs2CO3-CuI, 2,6-дихлор-3,5-ди-
и превращением в бензотиазол II; путь б включает
циано-1,4-бензохинон [65, 66], гипервалентный
реакцию тиобензамида с основанием, который в
реактив Мартина [67], Cs2CO3-CuI-1,10-фенан-
форме тиолат-иона III превращается в тиорадикал
тролин [68, 69], NaOH [70]. Классическим реа-
IV в результате одноэлектронного окисления, с
гентом циклизации тиоанилидов в бензотиазолы
последующим элиминированием водород-радика-
по методу Якобсона является феррицианид калия,
ла и образованием бензотиазола II (схема 9) [71].
метод основан на прямой радикально-окислитель-
При синтезе тиоанилидов по Якобсону может
ной циклизации тиоанилидов в щелочной среде
быть использован реагент Лавессона или пента-
(схема 8) [20, 34].
сульфид фосфора (Р2S5) при нагревании бензани-
При трактовке механизма реакции Якобсона
лидов в гексаметилфосфортриамиде (ГМФА), гек-
рассматриваются два возможных пути превраще-
саметилдисилоксане (ГМДСО) или хлорбензоле,
ния: путь а связывают с промежуточным обра-
но применение их ограничено, если бензанилид
зованием тиоамидного катиона I с последующей
содержит другие функциональные карбонильные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
10
СТУДЕНЦОВ и др.
Схема 8.
Схема 9.
группы. В большинстве случаев внутримолеку-
по реакции Якобсона продуктом реакции являет-
лярная циклизация (реакция Якобсона) протекает
ся не 4,6,7-триметоксибензотиазол 12, а 5,6-ди-
региоселективно с замещением протона. Однако,
метоксифенилбензотиазол
13. Выход продукта
когда в о-положении по отношению к тиоамидной
ипсо-замещения может быть увеличен в присут-
находится метоксигруппа, а также присутствуют
ствии азобисизобутиронитрила (AIBN) при цикли-
еще две электронодонорные группы, то цикли-
зации соединения 11 в нитробензоле, когда после
зация идет с ипсо-замещением о-метоксигруппы
кипячения в течение 15 мин образуется 5,6-ди-
с очень низкими выходами. Например, в случае
метоксифенилбензотиазол
13 с выходом
93%
N-(2,4,5-триметоксифенил)тиобензанилида
11
(схема 10) [71].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
11
Схема 10.
Схема 11.
3.4 Прямое арилирование 2-галоидбензоти-
тивом Гриньяра (арилмагнийгалогенидом) при ка-
азолов. Открытая в 1972 г. реакция Кумада-Та-
тализе PEPPSI-IPr 14, содержащим в своей струк-
мао-Корриу [72] нашла широкое применение в
туре 4 изопропильные группы. Реакция проходит
органической химии при осуществлении кросс-со-
при комнатной температуре в тетрагидрофуране и
четания алкил-, алкенил- и арил- и гетарилгалоге-
представляет собой региоселективный способ по-
нидов с образованием новой углерод-углеродной
лучения 2-арилбензотиазолов (схема 11) [75].
связи при катализе комплексными соединениями
3.5. Реакция Сузуки. Одним из методов син-
палладия (PEPPSI, pyridine-enhanced precatalyst
теза 2-арилбензотиазолов является реакция Сузу-
preparation stabilization and initation), никеля
ки [76] - сочетание арил- и винилборных кислот
(NiPPh3), а также переходными металлами [73, 74].
с арил- или винилгалогенидами при катализе ком-
В частности, этот метод был использован в синтезе
плексными соединениями палладия(0) (схема 12)
2-арилбензотиазолов в реакциях сочетания с реак-
[77] или палладий-медными комплексами [78].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
12
СТУДЕНЦОВ и др.
Схема 12.
4. ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
рецепторных лигандов при исследовании болезни
ФТОРСОДЕРЖАЩИХ
Альцгеймера с помощью метода ПЭТ [87-89]. Ис-
2-АРИЛБЕНЗОТИАЗОЛОВ
пользование таких радиофармацевтических пре-
паратов позволяет изучать процессы метаболизма,
Фторсодержащие соединения находят широ-
механизмы ферментативных реакций и структуры
кое применение в биологии и медицине [79]. В
активных центров ферментов [90].
последние два десятилетия медицинская химия
4.1 Противоопухолевые свойства и метабо-
фтора привлекает интерес многих исследователей,
лизм наиболее эффективных препаратов PMX
а дизайн и разработка фторорганических фарма-
610 и 5F 203. Соединение лидер РМХ 610 (NSC
цевтических препаратов приобретают все боль-
шее значение. Селективное введение фтора может
721648)
-
2-(3,4-диметоксифенил)-5-фторбензо-
улучшить фармакокинетические и физико-хими-
тиазол - обладает мощной антипролиферативной
ческие свойства активного соединения, а также
активностью в наномолярных концентрациях на
его метаболическую стабильность [79, 80]. Спец-
многих видах раковых клеток человека (молочной
ифичность действия фторсодержащих соединений
железы, толстой кишки, кишечника и др.) [23, 24, 91].
обусловлена наличием атома фтора, близкого по
Высокую противоопухолевую активность с из-
размерам к атому водорода, но отличающегося
бирательным действием на определенных линиях
липофильностью и высокой электрофильностью.
опухолевых клеток человека (МCF-7, MDA-468
Понимание влияния фторирования на биологиче-
и др.) проявляют и другие липофильные фторсо-
ские особенности молекулы привело к открытию
держащие 2-арилбензотиазолы, например, 5F 203
эффективных терапевтических средств [21].
(NSC 703786) - 2-(4-амино-3-метилфенил)-5-фтор-
К ним относятся, например, препараты антиме-
бензотиазол [25,86,92]. Они эффективны на опу-
таболитного типа - производные углеводов, ами-
холевых штаммах почек, толстой кишки, что под-
нокислот, стероидов, компонентов нуклеиновых
тверждают доклинические испытания [25, 85, 86].
кислот и родственных гетероциклов [79-81]. В
Несмотря на структурные различия препаратов
частности, к антиметаболитам относятся широко
РМХ 610 и 5F 203, эти липофильные соединения
используемые в онкологии производные 5-фтор-
обладают сходными механизмами действия.
урацила (фторафур), в том числе нуклеозидные,
Исследование биологической активности се-
являющиеся эффективными ингибиторами тими-
рии производных
2-(4-аминофенил)бензотиа-
дилатсинтетазы [82].
золов показало, что некоторые из них являются
Не составляют исключения в этом отношении и
сильнодействующими агентами избирательного
производные бензотиазола, среди которых найдено
действия за счет биотрансформации с участием
большое число физиологически активных веществ
специфических ферментов клеточных рецепторов
(антибиотиков, антидепрессантов, психотропных
[9, 18, 27, 93, 94]. Вообще в процессе метаболизма
препаратов и др.) [1, 2, 19, 21, 22, 81, 83]. Так,
может происходить либо биоактивация 2-фенил-
ряд фторированных 2-арилбензотиазолов проде-
бензотиазолов с увеличением противоопухолевой
монстрировал широкий спектр действия in vivo и
активности, либо наблюдается образование неак-
in vitro на клеточных опухолях человека [84-86].
тивных метаболитов. Так, в процессе окислитель-
Меченные фтором 18 и углеродом 11 производные
ного метаболизма высокоэффективного препарата
бензотиазола могут быть использованы при диа-
DF 203 (NSC 674495), 2-(4-амино-3-метилфенил)-
гностике опухолевого процесса, а также в качестве
бензотиазола, его противоопухолевая активность
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
13
Таблица 1. Противоопухолевые фторированные бензотиазолы, их неактивные метаболиты и активные фторирован-
ные аналоги
Соединение
R1
R2
R3
R4
2-(4-Амино-3-метилфенил)бензотиазол (DF 203)
Н
H
H
H
2-(4-Амино-3-метилфенил)-6-гидроксибензотиазол (6-ОН 203)
Н
H
OH
H
2-(4-Амино-3-метилфенил)-4-фторбензотиазол (4F 203)
F
H
H
H
2-(4-Амино-3-метилфенил)-5-фторбензотиазол (5F 203)
H
F
H
H
2-(4-Амино-3-метилфенил)-6-фторбензотиазол(6F 203)
H
H
F
H
2-(4-Амино-3-метилфенил)-5,6-дифторбензотиазол (5,6-F
203)
H
F
F
H
2
2-(4-Амино-3-метилфенил)-7-фторбензотиазол(7F 203)
H
H
H
F
ослабеваетиз-заобразованиянеактивного6-гидрок-
ное влияние на биологическую активность этих
си-(4-амино-3-метилфенил)бензотиазола
(6-ОН
соединений [84, 98], при этом эффективность и
203) (табл. 1) [95, 96].
избирательность противоопухолевого действия
зависят от природы заместителя и его местона-
Метаболитная дезактивация может быть
хождения в гетероциклическом или фенильном
успешно заблокирована фторированием бензотиа-
золов по положениям 5 или 5 и 6 с получением
фрагменте [15, 92, 99, 100]. Активными соедине-
препаратов 5F 203 и 5,6-F2 203 с высокой противо-
ниями оказались производные с метил-, гидрокси-,
опухолевой активностью, некоторые из них приве-
аминогруппами, атомами галогена в положении 3′
дены в таблице 1 [97].
фенильного кольца [15, 86]. Это свидетельствует
о важной роли структурных особенностей моле-
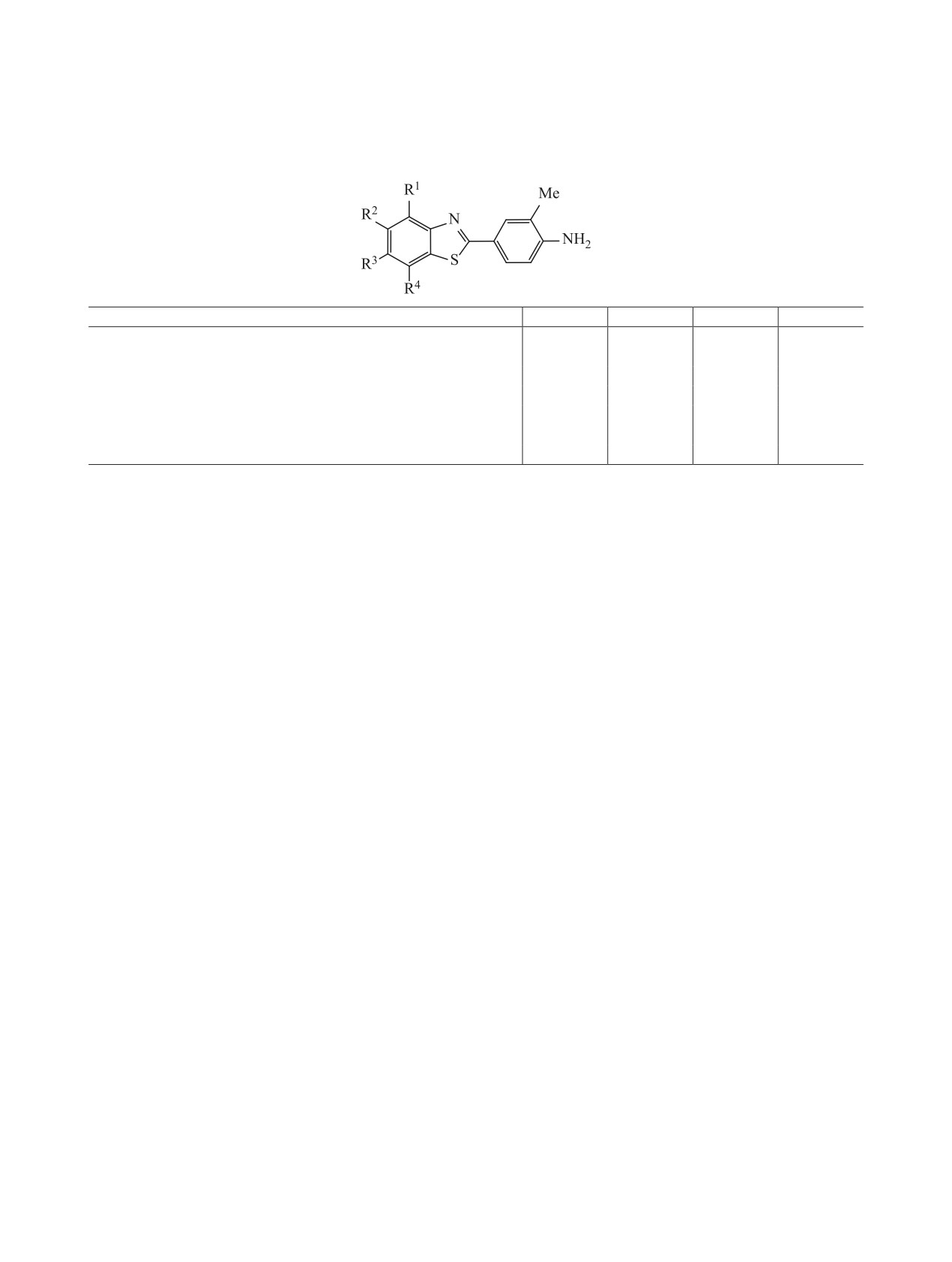
В патенте [98] представлены данные по соот-
кул 2-арилбензотиазолов для их взаимодействия
ношению структура - активность в ряду произ-
с арилгидрокарбоновыми рецепторами (AhR) [95,
водных РМХ 610 и их аналогов (более 100 соеди-
96, 101]. Этот механизм был подтвержден при ис-
нений). Экспериментально установлено, что изме-
пытаниях новых 2-(4-аминофенил)бензотиазолов,
нения в структуре производных и аналогов РМХ
содержащих другие группы в гетероциклическом
610 оказывают сильное влияние на биологиче-
фрагменте и положении 3′ фенильного кольца.
скую активность этих соединений. Обнаружено,
Высокую активность по аналогии с препаратом 5F
что у соединений 15 и 16 с атомом F в 4- или 6-по-
203 проявляют 4-, 6-, 7-фторсодержащие аминофе-
ложении сохраняется противоопухолевая актив-
нилбензотиазолы.
ность. Удаление атома фтора из бензотиазольной
части (соединения 17 и 21) или его замена на дру-
Механизм визуализации опухолевого процесса
гие галогены (соединения 22 и 23), равно как и за-
основан на специфическом связывании меченого
мена одной или двух метоксигрупп в фенильном
соединения с арилгидрокарбоновыми рецепто-
кольце в 3′,4′- положениях на гидроксильные (сое-
рами (AhR) с последующей экспрессией в пора-
динения 18, 19 и 20) или другие группы приводят
женных клетках. В метаболизм метки вовлечен
к потере ингибирующей активности в отношении
цитохром 450 - один из ключевых ферментов ней-
противоопухолевых клеток [86]. Вместе с тем при
трализации ксенобиотиков у человека. [93,94].
наличии хлора или брома вместо метоксигруппы
AhR - белок, кодируемый у человека AhR-ге-
в 3′-положении фенильного кольца противоопухо-
ном, он является лиганд-зависимым внутри-
левая активность сохраняется (соединения 24 и 25,
клеточным рецептором, который стимулирует
табл. 2).
транскрипцию генов в ответ на связывание с ксе-
Таким образом, структурные изменения в рядах
нобиотиком. Таким образом запускаются каскад-
производных РМХ 610 и 5F 203 оказывают силь-
ные реакции сегментного метаболизма лекарств
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
14
СТУДЕНЦОВ и др.
Таблица 2. Вариации заместителей в молекуле соединения РМХ 610 для изучения соотношения структура-актив-
ность
Соединение
R1
R2
R3
R4
R1'
R2'
R3'
РМХ 610 (NSC 721648)
H
F
H
H
H
OMe
OMe
15
F
H
H
H
H
OMe
OMe
16
H
H
F
H
H
OMe
OMe
17
H
H
H
H
H
OMe
OMe
18
H
F
H
H
H
OH
OMe
19
H
F
H
H
H
OMe
OH
20
H
F
H
H
H
OH
OH
21
H
H
H
H
H
OH
OH
22
H
Cl
H
H
H
OMe
OMe
23
H
Br
H
H
H
OMe
OMe
24
Н
F
H
H
H
Cl
OMe
25
H
F
H
H
H
Br
OMe
с участием цитохромов P450, которые, в свою
мых синтезов установлено, что в случае препарата
очередь, являются мишенями для противоопухо-
РМХ 610 продуктами микросомального С-окис-
левой терапии [102]. В ходе связывания с такими
ления является
2-(2,3-дигидрокси-4-метоксифе-
лигандами AhR перемещается в ядро клетки, где
нил)-5-фторбензотиазол в виде конъюгата с GSH; в
образует комплекс со своим гетеродимеризующим
случае соединения 5F 203 происходит N-окисление
партнером
- арилгидрокарбонатным ядерным
с образованием 5-фтор-2-(2-гидрокси-3-метил-4-
транслокатором (AhRNТ). Этот комплекс, в свою
амино)бензотиазола с промежуточным образова-
очередь, усиливает экспрессию в AhR мишенных
нием хинонимина (схема 13). Различия в структу-
генах, содержащих необходимую ДНК-последова-
ре и физико-химических свойствах метаболитов
тельность, что приводит к изменению внутрикле-
определяют селективное противоопухолевое дей-
точных превращений, вызывающих экспрессию
ствие препаратов РМХ 610 и 5F 203. Поврежде-
м-РНК и вытекающую из этого индукцию необ-
ние ДНК объясняют возможностью образования
ходимого гена, например, цитохромов P450 1А1 и
электрофильного интермедиата - нитрений-иона,
P450 2W1 [103]. Этот механизм, опубликованный
выполняющего функцию алкилирующего агента
в большом числе работ, был подтвержден при ис-
ДНК по положению N7 2ʹ-дезоксигуанозина. При
пытаниях новых 2-(4-аминофенил)бензотиазолов,
этом не исключено образование комплексов ДНК с
содержащих амино-, метил-, ацетилоксигруппы в
липофильными производными бензотиазола, име-
гетерофрагменте и атомы Сl или I в положении 3′
ющими планарную структуру. Они, как специфи-
фенильного кольца [15, 103]. В последней работе
ческие интеркаляторы, изменяют активность ДНК
были проведены широкие исследования метабо-
в процессе синтеза м-РНК [103].
лизма препаратов РМХ 610 и 5F 203 при микросо-
4.2. Уникальный противораковый препа-
мальном окислении их конъюгатов с глутатионом
рат Фортресс. В связи с тем, что тестирование
(GSH) цитохромами P450 1А1 и P450 2W1 [103].
2-(4-амино-3-метилфенил)-5-фторбензотиазола
В результате детального изучения состава и
(5F 203) выявило его высокую противоопухоле-
строения образующихся метаболитов и их интер-
вую активность по отношению к человеческим
медиатов с помощью ЯМР 1Н, 19F высокого разре-
клеточным культурам карциномы яичников, груди,
шения, хромато-масс-спектрометрии и независи-
почек и кишечника, опосредованную индуцирова-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
15
Схема 13.
нием разрушения ДНК и блокированием митоза
щен следующим образом: благодаря химической
[25, 104-106], большой клинический интерес вы-
стабильности молекулы пролекарства спонтанный
зывает тестирование и метаболическое превраще-
гидролиз амидной связи в отсутствие клеток не
ние аминокислотного прекурсора (пролекарства)
имеет места, но пролекарство быстро и количе-
5F 203 - его L-лизиламида NSC 710305 (26), он же
ственно гидролизуется в исходный амин (лекар-
Фортресс [26, 107].
ство) в присутствии как чувствительных, так и
Фортресс,
2-(4-амино-3-метилфенил)-5-фтор-
не чувствительных к нему клеток. В то же время
бензотиазол-L-лизиламид гидрохлорид 26, пока-
метаболизм лекарства протекает лишь в чувстви-
зал выраженную избирательную противоопухо-
тельных, т. е. пораженных опухолевым процессом,
левую активность, как отдельно [108-111], так и
клетках. Исходный амин (5F 203) селективно за-
в комбинации с антибиотиком доксорубицином
хватывается опухолевыми клетками, связывается
[112]. Преимуществами соединения 26 по сравне-
с их AhR рецепторами и транслоцируется в ядра
нию с препаратом 5F 203 являются его стабиль-
клеток, с последующей индукцией изоформы
ность и хорошая растворимость в воде, что допу-
CYP1A1 цитохрома P450 и конверсией молекулы
скает разработку инъекционных форм лекарств,
лекарства в электрофильный реакционноспособ-
что, в свою очередь, улучшает биодоступность и
ный интермедиат - нитрений-ион, который кова-
предотвращает быструю дезактивацию в печени
лентно связывается с ДНК, вызывая летальные
через CYP1A-медиированный механизм [26]. На
повреждения клеток-мишеней [26]. Механизм ин-
момент обсуждаемых публикаций Фортресс про-
гибирования опухоли, обусловленного поврежде-
ходил первую фазу клинических испытаний в Ве-
нием ДНК опухолевых клеток, схематично отра-
ликобритании.
жен на cхеме 14.
4.3. Свойства противоопухолевых 4-гидрок-
Механизм действия этого уникального предста-
сициклогекса-2,5-диенонов (хинолов). Представ-
вителя семейства бензотиазолов может быть обоб-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
16
СТУДЕНЦОВ и др.
Схема 14.
ляют интерес новые противораковые препара-
мотив типа CXXC, где С - цистеин, а Х - любая,
ты, относящиеся к группе 4-гидроксициклогек-
как правило гидрофобная, аминокислота. Еще
са-2,5-диенонов (так называемых хинолов), в
одна отличительная черта всех тиоредоксинов -
частности, препарат PMX 464 (ранее назывался
специфическая третичная структура, которая на-
AW 464) и его фторированные аналоги (схема 15).
зывается тиоредоксиновой укладкой. Тиоредоксин
Хинолы и их аналоги проявили антипролифе-
посредством фермента тиоредоксин-редуктазы
ративную активность по отношению к клеточным
осуществляет НАДФ-зависимое восстановление
линиям карциномы толстой кишки (HCT116 и
дисульфидных связей других белков [115-118].
НТ29) [29], что открывает возможность создания
Тиоредоксин оказывает плейотропное влияние
новых, более эффективных лекарственных препа-
на клеточный метаболизм: усиливает клеточную
ратов, альтернативных 5-F-урацилу, остающемуся
пролиферацию через воздействие на рибонукле-
основным препаратом выбора для лечения этой
иновую редуктазу [117]; вовлечен в реакции ок-
формы рака. Как показали исследования, мишенью
сидативного стресса через регуляцию активности
препарата PMX 464 являются тиоредоксин-редук-
тиоредоксин-пероксидазы
[118]; предотвращает
тазная сигнальная система [28, 29, 113] и ядерный
апоптоз через ингибирование апоптической сиг-
«каппа-би» фактор (NF-κB) [114]. Тиоредоксины
нальной киназы (APK-1) [119]. Таким образом,
представляют собой небольшие белки с молеку-
ингибирование тиоредоксина может проявляться
лярной массой около 12 кДа, характерной особен-
антипролиферативным и проапоптическим эффек-
ностью которых является наличие двух располо-
тами, что и лежит в основе терапевтических меха-
женных рядом остатков цистеина, заключенных в
низмов препарата PMX 464 [28, 120].
4.4. Полигидроксибензотиазольные аналоги
Схема 15.
флавоноидов - активные ингибиторы тиро-
зинкиназ. Интенсивно исследуются полигидрок-
силированные 2-арилбензотиазолы [121, 122] с
новым механизмом действия по типу флавоновых
кварцетинов [123] и изофлавоновых генистеинов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
17
Схема 16.
[124], которые являются активными ингибиторами
мических свойств фторсодержащих 2-арилбензо-
тирозинкиназы - ключевого фермента в передаче
тиазолов, в первую очередь, соединений лидеров
внутриклеточных сигналов при каталитическом
РМХ 610 [2-(3,4-диметоксифенил)-5-фторбензо-
переносе фосфатного остатка от АТФ на тирози-
тиазол], его 6-фторированного аналога [2-(3,4-ди-
новый компонент белка мишени, с чем связывают
метоксифенил)-6-фторбензотиазол],
5F
203
ингибирование роста опухолей. Рецепторы тиро-
[2-(4-амино-3-метилфенил)-5-фторбензотиазол],
зинкиназ являются ключевыми регуляторами нор-
Фортресс (лизиламидное производное препарата
мальных клеточных процессов, включая факторы
5F 203) и их производных, а также промежуточ-
роста, цитокины и гормоны. Кроме того, они явля-
ных продуктов их синтеза.
ются критичным фактором в развитии и прогрес-
5.1. Синтез препарата РМХ 610. Известно не-
сировании многих видов опухолей [125]. Наиболее
сколько способов получения препарата РМХ 610 -
активным ингибитором оказался
4,6-дигидрок-
2-(3,4-диметоксифенил)-5-фторбензотиазола
[23,
си-2-(4-гидроксифенил)бензотиазол,
который
24, 36, 98, 128].
имеет расположение гидроксильных групп, подоб-
ное генистеину [121]. Кроме того, N-замещенные
Препаративный метод синтеза 2-(3,4-диметок-
2-(аминоарил)бензотиазолы были подвергнуты
сифенил)-5-фторбензотиазола включает несколько
скринингу в программе «Ингибиторы киназ», в
стадий (схема 16):
результате была идентифицирована и оптимизи-
- получение 3-фторфенилтиомочевины 8 вза-
рована хиназолин-связанная 4-(бензотиазол-2-ил)
имодействием 3-фторанилина 27 с бензоилхлори-
анилиновая структура, показавшая наибольшую in
дом в присутствии тиоцианата аммония при кипя-
vitro активность против киназ [126, 127].
чении в ацетоне (1 ч) с выходом 90%;
5. СПОСОБЫ ПОЛУЧЕНИЯ ПРОТИВООПУ-
- циклизацию 3-фторфенилтиомочевины 8 в
ХОЛЕВЫХ ФТОРСОДЕРЖАЩИХ 2-АРИЛ-
2-амино-5-фторбензотиазол 7 под действием бро-
БЕНЗОТИАЗОЛОВ
ма в дихлорметане (30°С, 3 ч) с последующей кри-
сталлизацией продукта из бензола с выходом 64%;
В развитие работ по целенаправленному синте-
зу физиологически активных препаратов в классе
- щелочной гидролиз 2-амино-5-фторбензоти-
2-арилбензотиазолов, представленных в разделах
азола 7 (KОН, 100°С) по методу [36] с образова-
1-3, большое практическое значение имеет разра-
нием бис(2-амино-4-фторфенил)дисульфида 6 с
ботка способов получения и изучение физико-хи-
выходом 76%;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
18
СТУДЕНЦОВ и др.
Схема 17.
Схема 18.
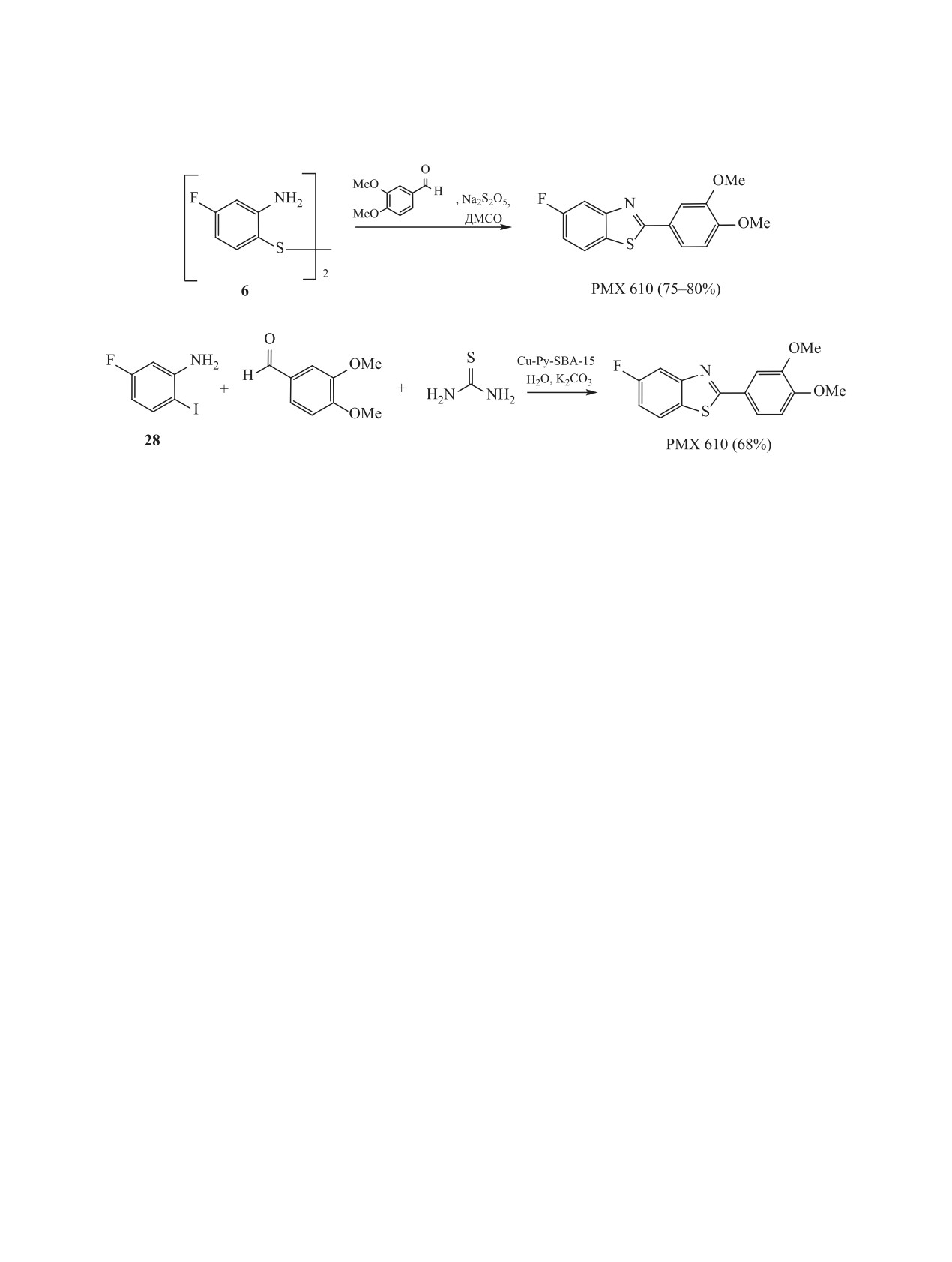
- конденсацию дисульфида 6 с 3,4-диметокси-
может быть использован и для получения других
бензальдегидом при кипячении (15-24 ч) в толу-
2-арилзамещенных бензотиазолов, причем без не-
оле в инертной атмосфере в присутствии трифе-
обходимости защиты фенольной группы в исход-
нилфосфина и каталитических количеств PTSA с
ном бензальдегиде [63].
последующей очисткой целевого продукта коло-
Стратегия однореакторного способа получения
ночной хроматографией на силикагеле в системе
препарата РМХ 610 заключается в совмещенной
метилендихлорид-гексан с 60%-ным выходом чи-
трехкомпонентной конденсации 5-фтор-2-иодани-
стого препарата РМХ 610.
лина 28, 3,4-диметоксибензальдегида и тиомоче-
Недостатками описанного выше способа полу-
вины в кипящей воде (100°С, 24 ч) в присутствии
чения препарата РМХ 610 является образование
карбоната калия и эффективного мезопористого
трудноотделимых изомерных соединений и необ-
катализатора Сu-Py-SBA-15 [128]. Способ был
ходимость использования колоночной хроматогра-
апробирован при синтезе миллиграммовых коли-
фии при очистке целевого продукта, что снижает
честв препарата РМХ 610 (схема 18).
практическую значимость способа при масштаби-
Функционализированный пиразолом SBA-15
ровании процесса. Первые три стадии могут быть
(Py-SBA-15) был получен путем модификации
реализованы в препаративном варианте, однако
SBA-15 (микромезопористая модификация крем-
при конденсации бис(2-амино-4-фторфенил)ди-
незема Santa Barbara Amorphous) триаминопропил-
сульфида 6 с 3,4-диметоксибензальдегидом реак-
триэтоксисиланом с последующей конденсацией с
ция протекает медленно (24 ч), несмотря на избы-
1-фенил-2-гидроксифенил-4-формилпиразолом с
ток 3-фенилфосфина [20, 63].
образованием основания Шиффа. Обработка Py-
Авторам [63] удалось устранить эти недостат-
SBA-15 хлоридом меди(II) в абсолютном этаноле
ки. Модифицированный способ получения препа-
привела к образованию целевого комплекса Сu-
рата РМХ 610 включает использование в качестве
Py-SBA-15. Каталитическая активность создается
катализатора бисульфита натрия (Na2S2O5) вместо
за счет привитой Cu(II) внутри функционализиро-
трифенилфосфина и проведение реакции конден-
ванного мезапористого SBA-15 [128].
сации дисульфида 6 с 3,4-диметоксибензальде-
гидом при нагревании в ДМСО (115-120°С). По
Трактовка авторами механизма трехкомпо-
данным ТСХ, реакция полностью проходит за
нентного синтеза препарата РМХ 610 представ-
1-1.5 ч с образованием только 2-(3,4-диметокси-
лена на схеме 19 и состоит в следующем: сначала
фенил)-5-фторбензотиазола с выходом
75-80%
5-фтор-2-иоданилин 28 образует промежуточное
(схема 17). Продукт выделяли осаждением избыт-
основание Шиффа с 3,4-диметоксибензальдегидом
ком воды и флеш-фильтрацией метиленхлоридно-
(продукт З), при этом гетерогенный катализатор
го экстракта через силикагель. Указанный способ
генерирует активные частицы Cu(I) под действием
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
19
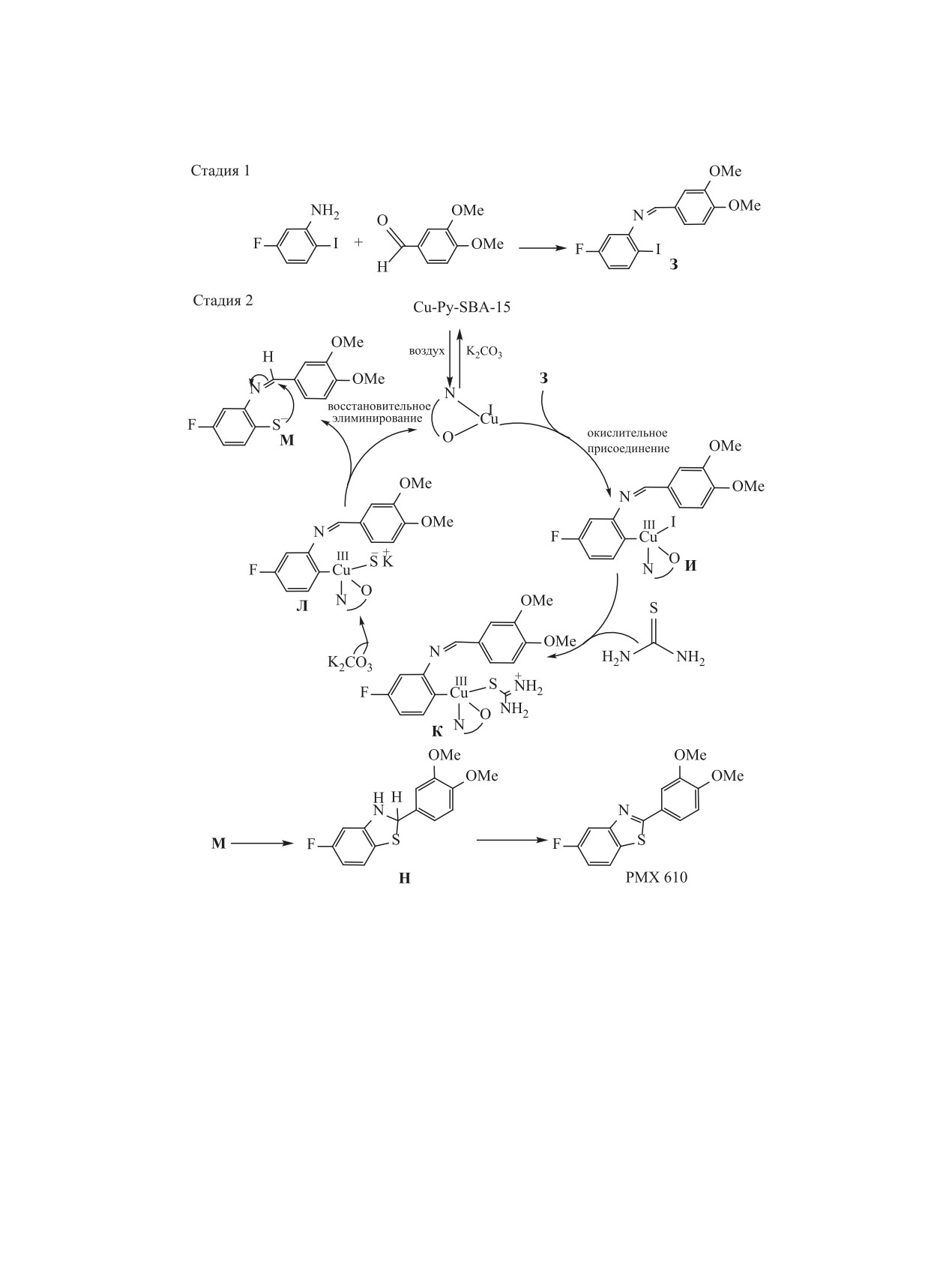
Схема 19.
основания in situ. Активная часть Cu(I) далее всту-
регенерации Cu(II)-катализатора. Внутримолеку-
пает в окислительное присоединение к промежу-
лярная циклизация аниона М приводит к образо-
точному продукту З с образованием интермедиата
ванию промежуточного дигидропроизводного Н,
И. Затем тиомочевина вовлекается в лигандный
которое в присутствии воздуха окисляется с обра-
обмен с образованием комплекса К, гидролиз ко-
зованием конечного продукта PMX 610.
торого в присутствии основания приводит к со-
При масштабировании данного процесса на-
ответствующему комплексу Л. Следующий шаг
блюдалась плохая воспроизводимость результатов
заключается в восстановительном расщеплении
вследствие, по-видимому, сложного характера па-
комплекса Л с образованием промежуточного ани-
раллельных восстановительно-окислительных ре-
она М и активных частиц Cu(I). Аэробное окисле-
акций с образованием различных интермедиатов,
ние активного промежуточного Cu(I) приводит к
специфических особенностей мезапористого ката-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
20
СТУДЕНЦОВ и др.
Схема 20.
Схема 21.
лизатора, а также образования побочных окрашен-
сом противоопухолевых веществ являются про-
ных продуктов окисления иоданилина и комплекс-
изводные 2-(4-аминофенил)бензотиазола, облада-
ных оснований Шиффа.
ющие in vivo и in vitro избирательным действием
в отношении ряда штаммов опухолей человека.
Среди работ по синтезу 2-арилбензотиазолов
Родоначальным соединением является препарат
заслуживает внимания эффективный одностадий-
DF 203 - 2-(4-амино-3-метилфенил)бензотиазол.
ный метод синтеза 2-замещенных бензазолов по
Введение атома фтора в молекулу этого соедине-
Бала и др. Особенностью метода является катали-
ния и его производных привело к увеличению про-
зируемая водой стадия, он исключает использо-
тивоопухолевой активности. Основным способом
вание каких-либо токсичных катализаторов и ре-
получения фторированных 2-(4-аминофенил)бен-
агентов, обеспечивает отличную селективность и
зотиазолов, содержащих атом фтора в гетеро- или
хорошие выходы при высокой устойчивости функ-
фенильном фрагменте, является использование
циональных групп (схема 20) [129].
моно- или дифторнитроанилидов 32, получаемых
5.2. Синтез 6-фтор-2-(3,4-диметоксифенил)-
бензоилированием соответствующих фторанили-
бензотиазола. Получение 6-фтор-2-(3,4-диметок-
нов 31 при кипячении в пиридине. Фторнитробен-
сифенил)бензотиазола 29 осуществляется по ана-
занилиды 32 под действием реагента Лавессона в
логии с синтезом препарата РМХ 610 по методу
ДМФА или ГМФТА превращаются во фторнитро-
[24] конденсацией дисульфида 30 с 3,4-диметокси-
фенилтиобензамиды 33, циклизация которых по
бензальдегидом [98] (схема 21).
методу Якобсона и последующее восстановление
Альтернативным способом получения является
нитрогруппы приводит к 2-(4-аминофенил)бензо-
радикальная циклизация тиобензамидов по методу
тиазолам 35 с атомами фтора в положениях 4, 5, 6
Якобсона (схема 8) [34].
или 7 (схема 22).
5.3. Синтез и физико-химические свойства
5.3.1. Синтез препарата 5F 203. Региоселектив-
2-(4-аминофенил)бензотиазолов. Новым клас-
ный синтез противоопухолевого препарата 5F 203
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
21
Схема 22.
Схема 23.
[2-(3-метил-4-аминофенил)-5-фторбензотиазолa]
ров 5,6-дифтор- и 6,7-дифторнитрофенилбензоти-
[84] состоит в щелочном гидролизе 2-амино-5-
азола 38 и 39 в соотношении 2:1 (схема 24) [84, 97].
фторбензотиазола 7 с последующим превращени-
Для получения
5- или
7-фтор- и
5,6-ди-
ем в промежуточный нитробензанилиддисульфид
фтор-2-(4-нитро-3-метилфенил)бензотиазолов
36, восстановление которого приводит к препарату
был осуществлен альтернативный путь синтеза
5F 203 (схема 23).
действием гидрида натрия в N-метилпирролидоне
Реакция Якобсона может быть использована
(схема 25).
для получения других фторсодержащих 4-ами-
Их восстановление приводит к целевым фтори-
нофенилбензотиазолов, на основе которых могут
рованным
2-(4-амино-3-метилфенил)бензотиазо-
быть синтезированы новые лекарственные препа-
раты. При взаимодействии 3,4-дифторнитротио-
лам. Региоспецифичность в данном синтезе обе-
бензамида 37 с феррицианидом калия в щелочной
спечивается наличием атома брома в о-положении
среде образуется трудноразделимая смесь изоме-
по отношению к тиоамидной группе.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
22
СТУДЕНЦОВ и др.
Схема 24.
Схема 25.
5.3.2. Синтез противоопухолевого препарата
ладают препараты-лидеры РМХ 464 и AJM 290
Фортресс. На основе препарата 5F 203 был син-
(схема 27).
тезирован противоопухолевый препарат пролон-
Отправной точкой синтеза 5- и 6-фторхинолов
гированного действия Фортресс 26, который в
является однореакторное восстановление 4-фтор-
момент написания обзора проходил клинические
или
5-фтордисульфидов трифенилфосфином c
испытания [106].
конденсацией in situ продуктов восстановления с
4-гидроксибензальдегидом в присутствие п-толу-
Синтез соединения
26 осуществлялся кон-
олсульфокислоты (PTSA), приводящее к 5- или
денсацией препарата 5F 203 с Boc-защищенным
6-фтор-2-(4-гидроксифенил)бензотиазолу. Второй
L-лизином в присутствии карбодиимида в мети-
путь, использованный для синтеза 4-фтор-2-(4-ги-
ленхлориде по типу образования пептидной связи
дроксифенил)бензотиазола 45, состоит в получе-
(схема 26). Аналогичным образом синтезирован
нии из о-фторанилина 41 анилида 42, перевод его
аланиновый аналог Фортресса (40), также облада-
в тиоанилид 43 действием P2S5 в ГМДСО с после-
ющий противоопухолевым действием.
дующим деметилированием метоксипроизводного
5.4. Получение противоопухолевых хинолов.
44 гидрохлоридом пиридина при 210°С (схема 28)
Хинолами называют 4-замещенные производные
[30].
4-гидроксициклогекса-2,5-диенона. Среди них
Превращение в хинолы 46 фенольных соедине-
высокой антипролиферативной активностью об-
ний 45 происходит при их окислении гипервалент-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
23
Схема 26.
Схема 27.
Схема 28.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
24
СТУДЕНЦОВ и др.
Схема 29.
ным иодом(III) [бис(трифторацетокси)иодбензол]
в опухоли обусловлено тем, что злокачественные
в присутствии стабильного радикала TEMPO
клетки характеризуются более активными процес-
(2,2,6,6-тетраметил-1-пиперидинилокси) в смеси
сами гликолиза ввиду повышенного уровня бел-
ацетонитрил-вода (схема 29).
ков, транспортирующих глюкозу (транспортеров
глюкозы GLUT1 и GLUT2), и, в большей степени,
6. ПРИМЕНЕНИЕ 2-АРИЛБЕНЗОТИАЗОЛОВ
увеличения активности гексокиназы в неоплазме.
В БИОЛОГИИ И МЕДИЦИНЕ
За более чем 30-летний период развития ПЭТ
6.1. Перспективы использования меченных
разработан целый ряд других радиофармацевти-
фтором-18 и углеродом-11 производных 2-арил-
ческих препаратов с различными механизмами
бензотиазолов в ПЭТ-диагностике опухолей.
включения в метаболические и другие процессы,
Ввиду того, что некоторые 2-арилбензотиазолы об-
ассоциирующиеся со злокачественностью опу-
ладают высокой противоопухолевой активностью,
холей (транспорт аминокислот, пролиферация,
их меченые производные могут рассматриваться в
апоптоз и ангиогенез, гипоксия). Особый интерес
качестве радиотрейсеров в диагностике опухолей
представляют радиофармацевтические препара-
методом позитронной эмиссионной томографии. В
ты на основе лекарственных средств, использу-
основе метода лежит изучение in vivo распределе-
емых для лечения гормонозависимых опухолей,
ния соединений, меченных радиоактивными изо-
характеризующихся повышенной экспрессией
топами (радиотрейсеров, радиофармпрепаратов),
определенного типа рецепторов. Так, в диагно-
с помощью внешней системы детекторов. Радио-
стике нейроэндокринных опухолей с повышенной
активной меткой в ПЭТ служат короткоживущие
экспрессией рецепторов соматостатина (SSRT)
радиоактивные изотопы с позитронным типом
в качестве радиофармацевтических препаратов
распада, который сопровождается образованием
используют различные пептиды, меченные гене-
двух гамма-квантов аннигиляции энергией 0.511
раторным изотопом галлия (68Ga, T1/2 68 мин), а
МэВ, испускаемых под углом 180°, детектируемых
также фтором-18. Кроме того, меченые аналоги
камерой томографа с использованием схемы со-
лекарственных средств могут использоваться для
впадений. Наиболее короткоживущие циклотрон-
изучения их фармакокинетки методом ПЭТ.
ные ПЭТ радионуклиды (15O, T1/2 2.04 мин; 13N,
Недавние исследования показали, что образо-
T1/2 9.96 мин; 11C, T1/2 20.4 мин) являются изото-
вание опухолей молочной железы сопровождается
пами жизненно важных биологических элементов.
повышенной экспрессией арилгидрокарбоновых
Введение этих изотопов в структуру различных
рецепторов (AhR) [130]. AhR является одним из
молекул не влияет на биохимическое поведение и
нескольких лиганд-зависимых внутриклеточных
метаболизм. Четвертый радионуклид, фтор-18, не
рецепторов, которые стимулируют транскрипцию
входит в число элементов-органогенов, однако счи-
генов в ответ на воздействие ксенобиотиков, пре-
тается идеальным ПЭТ-радионуклидом благодаря
жде всего высокотоксичного диоксина. Показано,
относительно длительному периоду полураспада
что AhR играет важную роль в процессах проли-
(110 мин) и другим важным ядерно-физическим
ферации и дифференциации клеток при раке пред-
характеристикам. Основным радиофармацевтиче-
стательной железы [131]. Недавно в результате
ским препаратом для ПЭТ, используемым в более
пионерских работ группы ученых из Хайдельбер-
90% всех исследований, является меченный фто-
га была высказана гипотеза о том, что именно на-
ром-18 фторированный аналог глюкозы, 2-[18F]-
рушения AhR, вызванные действием эндогенного
фтор-2-дезокси-D-глюкоза ([18F]ФДГ) - радиотрей-
кинуренина (kynurenine - Kyn), продукта катабо-
сер гликолиза. Повышенное накопление [18F]ФДГ
лизма триптофана, являются определяющим фак-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
25
тором в степени агрессивности глиом - опухолей
традиционно используемых в качестве уходящих,
мозга, практически не поддающихся лечению [132].
при введении фтора-18 в ароматические субстраты
[18F]фторидом в составе комплекса с криптофик-
Как указано в разделе 4, противоопухолевое
сом ([K/K 2.2.2]+ 18F- ), малоэффективна.
действие некоторых соединений из ряда 2-арил-
бензотиазолов осуществляется посредством их
Более перспективным методом введения метки
воздействия на AhR рецепторы. В настоящее вре-
в пятое положение молекулы РМХ 610 является
мя на стадии клинических испытаний находится
использование в качестве предшественников со-
пролекарственное средство Фортресс 26, действие
лей диарилиодония с различными противоиона-
которого непосредственно связано с транскрипци-
ми. Этим методом были получены производные
онным фактором, который опосредует индукцию
2-арил-6-[18F]фторбензотиазола с различными
CYP1-семейства цитохрома Р450. Для фармако-
заместителями в бензольном кольце: 2-(4′-амино-
кинетических исследований этого препарата был
фенил)-6-[18F]фторбензотиазол,
2-(4′-N-диметил-
синтезирован его меченный фтором-18 аналог 5F
аминофенил)-6-[18F]фторбензотиазол и 2-(4′-N-ме-
203 [133], однако данные о результатах доклини-
тиламинофенил)-6-[18F]фторбензодиазол
[136].
ческих или клинических испытаний данного ради-
Радиотрейсеры были получены с высокими ра-
отрейсера не приводились. Следует отметить, что
диохимическими выходами (19-40%, без поправ-
в данном исследовании для введения метки фтор-
ки на радиоактивный распад изотопа) и высокой
18 в исходную молекулу был использован метод
удельной мольной активностью с перспективой
электрофильного радиофторирования газообраз-
их использования в качестве рецепторных ради-
ным фтором-18 ([18F]F2). Работа с этим агентом,
олигандов в диагностике болезни Альцгеймера -
генерируемым в газовой мишени циклотрона, со-
основной области применения меченых произво-
пряжена с целым рядом технических сложностей,
дных 2-арилбензотиазолов в ПЭТ.
а получаемые радиофармацевтические препараты
Недавно для целей онкодиагностики было
обладают низкой удельной мольной активностью
предложено использовать меченный фтором-18
[134].
фторэтилированный аналог препарата РМХ 610,
Что касается других ПЭТ-радиотрейсеров,
2-(3,4-диметоксифенил-6-(2-[18F]фторэтокси)бен-
предложенных для визуализации AhR рецепторов,
зотиазол 48 [137]. Получение предшественника,
то немногочисленные исследования в этой обла-
6-тозилоксиэтокси-2-(3,4-диметоксифенил)бензо-
сти включают синтез меченных фтором-18 произ-
тиазола 47, показано на схеме 30.
водных стильбенов [135], без дальнейшей оценки
Сам радиотрейсер [18F]ФЭДБТ 48 был полу-
возможностей их использования в ПЭТ.
чен реакцией прямого нуклеофильного замещения
Большой интерес представляет получение ме-
тозильной группы в молекуле соответствующего
ченных фтором-18 аналогов 2-(3,4-диметоксифе-
предшественника 47 на фтор-18 (схема 31). Для вы-
нил)-5-фторбензотиазола (РМХ 610), отличающе-
деления целевого продукта из реакционной смеси
гося высокой антипролиферативной активностью
был разработан метод твердофазной экстракции -
с уровнем ГТ50 < 0.1 нM. в отношении опухолей
современная технология, преимуществом которой
молочной железы MCF-7 и MDA-46841 [24]. Для
по сравнению с традиционной ВЭЖХ-очисткой
является быстрота и возможность автоматизации
получения меченного фтором-18 аналога препара-
та РМХ 610 необходимо введение метки в пятое
в модулях синтеза радиофармацевтических препа-
положение молекулы. Однако использование для
ратов для ПЭТ. Радиохимический выход с поправ-
этой цели традиционного метода нуклеофильного
кой на радиоактивный распад составлял 60%.
радиофторирования c использованием [18F]фтори-
Изучение биораспределения [18F]ФЭДБТ в ор-
да, генерируемого по ядерной реакции 18O(p,n)18F
ганах и тканях крыс с индуцированной опухолью
при облучении воды-18О в мишени циклотрона,
MDA-MB-231 (рак молочной железы с тройным
представляет собой нетривиальную задачу. Поло-
негативным фенотипом) и in vivo динамические
жение нуклеофильной атаки в этой молекуле не
ПЭТ-исследования указывают на перспективность
активировано, поэтому реакция нуклеофильного
использования нового радиофармацевтического
замещения нитрогруппы, брома и других групп,
препарата в ПЭТ-диагностике рака молочной же-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
26
СТУДЕНЦОВ и др.
Схема 30.
Схема 31.
лезы [137]. Данные по биораспределению показа-
ченные рением-188 комплексы могут быть исполь-
ли, что максимум накопления радиотрейсера [%
зованы в качестве радиотерапевтических агентов
ID/g = 2.73±0.36 (n = 3) - процентное содержание
при лечении рака молочной железы.
от введенной дозы на 1 г ткани) достигался на
Тем не менее, несмотря на результаты, полу-
30-й мин, а максимальное отношение опухоль/
ченные при использовании [18F]ФЭДБТ, синтез
мышца (Tumour/Muscle, Т/М) составляло 1.82±0.25
меченного фтором-18 истинного аналога препара-
на 120 мин после инъекции. Сходное значение
та РМХ 610 для ПЭТ-исследований AhR рецепто-
Т/М = 1.65±0.59 на 120-й мин было получено при
ров остается актуальной задачей. Для ее решения
ПЭТ-исследовании на сканнере для малых животных.
может быть эффективно использован предло-
Данные по биораспределению
[18F]ФЭДБТ
женный недавно [139] метод введения фтора-18
сравнимы с результатами, полученными с исполь-
в неактивированное положение ароматического
зованием рецепторных AhR радиолигандов на ос-
кольца биологически активных молекул реакци-
нове технеция-99m - широко используемого ради-
ей прямого нуклеофильного радиофторирования
онуклида для диагностики методом однофотонной
предшественника, содержащего в качестве ухо-
эмиссионной компьютерной томографии. Радио-
дящей пинаколборонатную группу, при катализе
трейсеры были получены конъюгацией 2-(4′-ами-
комплексом двухвалентной меди Cu(OTf)2Py4.
нофенил)бензотиазола и его 6-метилпроизводного
Представляет интерес и изучение производных
с комплексными карбонильными производными
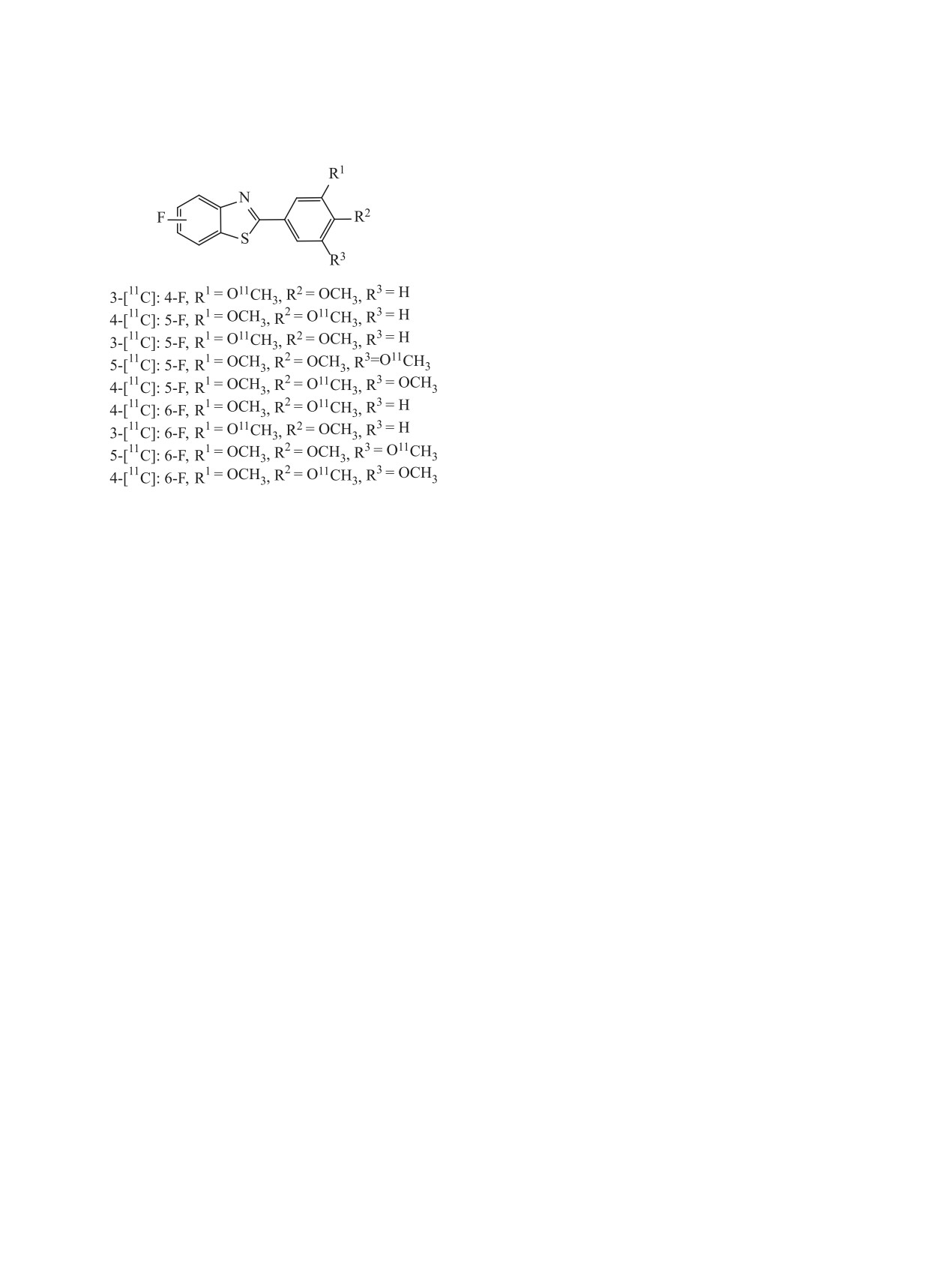
препарата РМХ 610, меченных углеродом-11, ко-
технеция 99mTc(I)(CO)3(NNO) [138]. Максималь-
торые легко получаются метилированием соот-
ное отношение опухоль/мышца составляло 2.17 на
ветствующих фенольных предшественников с
15-й мин и уменьшалось до 1.76 на 60-й мин после
помощью стандартного в ПЭТ-радиохимии мети-
инъекции; данные были получены при исследова-
лирующего агента метилтрифлата, [11С]CH3OTf. В
нии мышей типа SCID с индуцированными опухо-
работе [33] была получена серия радиотрейсеров
лями MCF-7. Этими же авторами были получены и
с различными заместителями (схема 32). Метили-
соответствующие комплексы рения, поскольку ме-
рование проводили в ацетонитриле в присутствии
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
27
дополнительные требования, основными из кото-
Схема 32.
рых являются [140]:
- проницаемость через гематоэнцефалический
барьер (ГЭБ), определяемая липофильностью
(logP 1.5-4) и низкой молекулярной массой (<450);
- высокая аффинность к исследуемому типу ре-
цепторов (Kd 0.1-1 нM.);
- низкое неспецифическое связывание с альбу-
мином и другими протеинами крови (которое воз-
растает с ростом липофильности);
- отношение специфического/неспецифическо-
го связывания не менее 2;
- медленный метаболизм и отсутствие меченых
метаболитов, проникающих через ГЭБ;
- достижение равновесия за время ПЭТ иссле-
дования (лимитированное периодом полураспада
радионуклида);
NaOH с последующей очисткой методом твердо-
фазной экстракции.
В связи с быстрым старением населения особое
Однако дальнейшие биологические исследова-
значение приобретает ПЭТ диагностика болезни
ния этой группы радиотрейсеров не проводились,
Альцгеймера, где на настоящий момент досто-
поэтому судить об их перспективности в качестве
верное подтверждение диагноза возможно только
с помощью данных нейроморфологического, как
туморотропных ПЭТ-агентов не представляется
правило, посмертного, исследования головного
возможным.
мозга. К ключевым гистологическим признакам
6.2. Использование меченых производных
болезни Альцгеймера относятся образование ней-
2-арилбензотиазолов в качестве рецепторных
рофибриллярных клубков в нейронах и сенильных
радиолигандов в ПЭТ-исследованиях болезни
бляшек. Оба вида поражения вызваны отложением
Альцгеймера. Метод ПЭТ предоставляет уни-
аномальных белков и развиваются относительно
кальные возможности in vivo изучения нейрохи-
независимо друг от друга. В сенильных бляшках
мических процессов с участием рецепторов и ней-
таким аномальным белком является бета-амилоид-
ротрансмиттеров как в норме, так и при различных
ный пептид (амилоид-β-протеин, Aβ-пептид), а в
патологиях. Благодаря исключительно высокой
нейрофибриллярных клубках - тау-протеин. Хотя
мольной (удельной) активности ПЭТ-радиотрей-
патогенетического лечения болезни Альцгеймера
серов (до 100 Ки/мкмоль) количество вводимого
пока нет, при ранней диагностике можно приоста-
в составе радиофармацевтических препаратов не-
новить развитие симптомов болезни с использова-
радиоактивного субстрата минимально (на уровне
нием уже имеющихся в арсенале врачей средств.
нано- и пико молей), что является определяющим
Разработка радиотрейсеров для ПЭТ-диагностики
фактором при проведении рецепторных исследо-
болезни Альцгеймера - бурно развивающаяся об-
ваний. За годы развития ПЭТ создан целый ряд ме-
ласть исследований, что отражено в ряде обзоров
ченых соединений (рецепторных радиолигандов),
[141-143]. Структуры наиболее значимых ради-
специфично связывающихся с отдельными типа-
офармацевтических препаратов, применяемых в
ми и подтипами рецепторов центральной нерв-
клинических ПЭТ-исследованиях пациентов с бо-
ной системы (ЦНС), вовлеченных в патологию
лезни Альцгеймера, приведены на рис. 3.
различных нейропсихических заболеваний, таких
как паркинсонизм, шизофрения, болезнь Альцгей-
Одним из первых радиофармацевтических пре-
мера, депрессивный синдром и другие. Наряду с
паратов, предложенных для ПЭТ диагностики бо-
высокой мольной удельной активностью к радио-
лезни Альцгеймера, был 2-(1-{6-[(2-18F-фторэтил)-
лигандам для исследования мозга предъявляются
(метил)амино]-2-нафтил}этилиден)малонитрил
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
28
СТУДЕНЦОВ и др.
([18F]FDDNP), однако радиотрейсер обладал низ-
и быстро выводятся из здоровых клеток мозга.
кой селективностью, связываясь как с β-амилоид-
Из серии производных Th-T для использо-
ными агрегатами, так и с тау-протеинами [144]. В
вания в клинических ПЭТ-исследованиях был
отличие от [18F]FDDNP, меченные углеродом-11
выбран
[11C]-2-[4-метиламино)фенил]-1,3-бен-
производные арилбензотиазола, полученные пу-
зотиазол-6-ол
([11C]-6-OH-BTA-1,
[11C]PIB или
тем модификации структуры известного флуорес-
Pittsburgh Compound-B) (рис. 4) [146]. Этот ра-
центного маркера Тиофлавина-Т (Th-T) (рис. 4),
диотрейсер обладает высокой аффинностью к
применяемого в посмертной (post-mortem) диа-
β-амилоиду, Ki 4.3 нМ. по отношению к синтетиче-
гностике пациентов с болезнью Альцгеймера [145,
скому Aβ(1-40) пептиду (табл. 3). Образующиеся
146], специфически связываются с β-амилоидными
меченые метаболиты являются полярными и не
протеинами. Было показано, что удаление метиль-
проходят через ГЭБ. В исследованиях пациентов с
ной группы при атоме азота в гетероциклическом
болезнью Альцгеймера накопление [11C]PIB в коре
фрагменте молекулы ThT, т. е. элиминирование
головного мозга было в 2-3 раза выше по сравне-
положительного заряда, позволяет получить ли-
нию здоровыми добровольцами и коррелировало с
пофильные производные нейтральных бензоти-
данными проведенных посмертных in vitro иссле-
азоланилинов (рис. 4). Эти соединения обладают
дований.
высокой аффинностью к β-амилоиду (на уровне
Для введения метки в молекулу [11C]PIB ис-
наномолей), проходят через ГЭБ в количествах,
пользуется стандартная реакция N-метилирования
достаточных для проведения ПЭТ-исследований,
деметильного предшественника 49 с использова-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
29
Рис. 4. Структуры тиофлавина-Т, его нейтральных аналогов и [11C]-6-OH-BTA-1 ([11C]PIB).
нием [11С]CH3I в качестве метилирующего агента
высокое, как и у [11C]PIB, значение аффинности к
с последующим снятием защиты гидроксильной
Aβ-пептиду, является более низкое неспецифиче-
группы (схема 33). [11С]CH3I получают так на-
ское связывание, что обусловлено меньшей липо-
зываемым газофазным методом, основанным на
фильностью соединения.
радикальной реакции
[11С]CH4, производимого
Ввиду малого периода полураспада углерода-11
в газовой мишени медицинского циклотрона, с
(T1/2 20.4 мин) соответствующие радиотрейсеры
кристаллическим иодом, находящимся при темпе-
могут использоваться лишь в ПЭТ-центрах, обо-
ратуре реакции иодирования (720-730°С) в виде
рудованных собственным циклотроном для про-
паров. Для увеличения выхода [11С]CH3I процесс
иодирования многократно повторяют за счет цир-
Схема 33.
куляции при непрерывном извлечении получен-
ного меченого продукта адсорбцией на сорбенте
типа Porapak при -196°С.
В настоящее время препарат [11C]PIB использу-
ется в качестве золотого стандарта при разработ-
ке новых радиофармацевтических препаратов для
визуализации областей накопления бета-амилоид-
ного пептида у пациентов с болезнью Альцгейме-
ра. ПЭТ исследования с [11C]PIB проводятся в бо-
лее чем 60 ПЭТ-центрах; к 2012 г. было проведено
более 10 тысяч ПЭТ-исследований.
Среди других радиофармацевтических пре-
паратов, меченных углеродом-11, следует от-
метить разработанный фирмой «Астра-Зенека»
(Astra-Zeneka)
[11C]-2-[6-(метиламино)пири-
дин-3-ил]-1,3-бензотиазол-6-ол
([11C]AZD2184),
где 2-фенильный фрагмент молекулы [11C]PIB
заменен на пиридильный (рис. 3) [148]. Преиму-
ществом этого радиотрейсера, имеющего такое же
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
30
СТУДЕНЦОВ и др.
Таблица 3. Влияние структуры нейтральных производных Тh-Т на аффинность (Ki, нмоль) к пептиду Aβ(1-40)а
2
R
R1
NH2
NHCH3
N(CH3)2
CH3
9.5
10
64
H
37
10
4.0
OH
46
4.3
4.4
OCH3
7.0
4.9
1.9
a Значения Ki определены с использованием меченного тритием [N-метил-3H]6-OH-BTA-1 в качестве радиолиганда синтетиче-
ских Aβ (1-40) агрегатов [147].
изводства 11С, что ограничивает зону применения
наработку радиофармацевтических препаратов в
ПЭТ-диагностики. В последние годы отмечается
стерильной инъекционной форме с высоким ради-
интерес к радиофармацевтическим препаратам на
охимическим выходом при минимальном вмеша-
основе наиболее долгоживущего из циклотрон-
тельстве оператора-радиохимика.
ных ПЭТ-радионуклидов, фтора-18 (T1/2 110 мин),
Соответственно, фирмой
«Астра-Зенека»
которые можно доставлять на достаточно боль-
был получен и 18F-фторированный аналог [11C]
шие расстояния в клиники, оборудованные лишь
AZD2184, 2-[2-[18F]Фтор-6-(метиламино)-3-пири-
ПЭТ-сканнерами. Кроме того, в случае фтора-18
нидил]-1-бензофуран-5-ол
([18F]AZD4694) (рис.
обеспечивается наиболее высокое пространствен-
3), с высокой аффинностью к Aβ-пептиду и более
ное разрешение, что обусловлено низкой энерги-
благоприятной фармакокинетикой, а также други-
ей испускаемых позитронов и, соответственно,
ми преимуществами, обеспечиваемыми использо-
минимальным пробегом в клетке (2.4 мм). Был
ванием долгоживущего фтора-18 [151]. В насто-
синтезирован ряд меченных фтором-18 произво-
ящее время [18F]AZD4694 также используется в
дных Th-T [147], наилучшим из которых оказался
клинических ПЭТ-исследованиях [152].
18F-аналог PIB, 2-(3-[18F]фтор-4-метиламино-фе-
В последние годы разработке меченных фто-
нил)бензотиазол-6-ол [149], по диагностическим
ром-18 радиотрейсеров для визуализации обла-
свойствам близкий к [11C]PIB. Этот радиофарма-
стей концентрирования Aβ-протеинов при бо-
цевтический препарат под коммерческим названи-
лезни Альцгеймера было посвящено множество
ем GE-067 или [18F]флутеметамол (Визамил) заре-
исследований, подробно рассмотренных в обзо-
гистрирован в США и Европе фирмой «Дженерал
ре [142]; был выполнен также ряд коммерческих
электрик» как агент для визуализации амилоид-
разработок. Например, фирмой «Piramal Imaging»
ного пептида у пациентов с болезнью Альцгейме-
разработано производное стильбена, (E)-4-(N-ме-
ра [150]. Синтез [18F]флютеметамола основан на
тиламино)-4′-{2-[2-(2-[18F]фторэтокси)этокси]}-
стандартной реакции нуклеофильного замещения
стильбен
([18F]BAY94-9172,
[18F]флорбетабен)
нитро-группы в молекуле предшественника [18F]
(рис. 3); этот радиотрейсер также зарегистриро-
фторидом в присутствии криптофикса (К2.2.2.)
ван в США (FDA) и Европе [153]. Среди недавно
в качестве катализатора фазового переноса. По
разработанных и одобренных 18F-меченных трей-
окончании радиофторирования проводится дери-
серов также можно отметить флорбетапир (рис. 3),
ватизация избытка нитропредшественника мети-
выпускаемый компанией «Eli Lilly» под торговой
латом калия. Это позволило провести выделение
маркой Амивид [142].
меченного фтором-18 продукта из реакционной
Менее успешными оказались разработки в об-
смеси экспресс-методом твердофазной экстракции
ласти радиофармацевтических препаратов для
на одноразовых картриджах. На основе этой раз-
ОФЭКТ-исследований пациентов с болезнью Аль-
работки была создана так называемая кассетная
цгеймера. Так, наиболее перспективный радио-
версия синтеза [18F]флутеметамола на автомати-
трейсер на основе меченого иодом-123 (T1/2 13.2 ч)
зированном модуле GE FastLab, обеспечивающая
производного бензофурана, [123I]6-иодо-2-(4′-ди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
31
метиламино)фенилимидазо[1,2-a]пиридин
([123I]
эту тему подробно представлена в недавних обзо-
IMPY), обладал достаточно высокой аффинностью
рах [157, 158] и других работах.
к синтетическим Aβ(1-42)-агрегатам (Ki 10.5 нМ.)
7. ЗАКЛЮЧЕНИЕ
in vitro. Однако уже в первых ПЭТ-исследованиях
пациентов с болезнью Альцгеймера было выявле-
Обобщены и проанализированы литератур-
но низкое отношение сигнал-шум, затрудняющее
ные данные по методам направленного синтеза
визуализацию областей с повышенной плотно-
физиологически активных
2-арилбензотиазо-
стью Aβ-протеина [154]. Это было объяснено от-
лов. Выявлены два направления использования
носительно высокой липофильностью и низкой in
2-арилбензотиазолов в фармакологии: в качестве
vivo стабильностью данного соединения. Работы
противоопухолевых препаратов и средств для
по изучению других меченых иодпроизводных
диагностики болезни Альцгеймера. Рассмотре-
бензофурана продолжаются, но пока ограничива-
ны соотношения структура - активность в ряду
ются исследованиями на экспериментальных жи-
2-арилбензотиазолов, вопросы терапии опухоле-
вотных.
вых заболеваний с помощью 2-арилбензотиазо-
лов, а также диагностики опухолей и нейродеге-
Наиболее востребованными для ОФЭКТ-диа-
неративных заболеваний методом позитронной
гностики являются радиофармацевтические препа-
эмиссионной томографии с использованием со-
раты на основе 99mTc (T1/2 6.01 ч), что обусловлено
ответствующих
2-арилбензотиазолов, меченных
широкой доступностью этого изотопа, произво-
короткоживущими радиоизотопами
11С и
18F.
димого в изотопном генераторе. Так, в недавней
Обсуждаются возможные механизмы действия
работе [155] были получены четыре нейтраль-
лекарственных препаратов
- фторпроизводных
ных меченных технецием-99m конъюгата 2-арил-
2-арилбензотиазолов, их метаболизм, процессы
(гетарил)бензоксазолов с бис(аминоэтантиол)-
активации и биоактивации на примере соедине-
хелатирующим лигандом. Аффинность получен-
ний-лидеров РМХ 610, 5F 203, Фортресс, Pittsburg
ных радиотрейсеров к Aβ(1-42)-агрегатам варьиро-
Compound B и др. Рассмотрены схемы синтеза
вала в широких пределах: показатель Ki колебался
указанных перспективных соединений. Показано,
в пределах от 15.86 до 393.18 нM. Исследования,
что экспериментальные достижения в области ме-
проведенные на срезах мозга трансгенных мышей
дицинской химии 2-арилбензотиазолов позволяют
с индуцированной болезнью Альцгеймера, указы-
вести целенаправленное конструирование эффек-
вают на принципиальную возможность использо-
тивных лекарственных и диагностических средств
вания радиофармацевтических препаратов этого
в указанном ряду.
класса в ОФЭКТ-диагностике пациентов с болез-
нью Альцгеймера [155], однако соответствующие
СПИСОК СОКРАЩЕНИЙ
клинические исследования не проводились.
[11C]-6-OH-BTA-1
-
[11C]-2-[4-метиламино)фе-
Следует подчеркнуть, что, несмотря на огром-
нил]-1,3-бензотиазол-6-ол
ное число работ, диагностическая ценность
[11C]AZD2184
-
[11C]-2-[6-(метиламино)пири-
ПЭТ-исследований пациентов с болезнью Альц-
дин-3-ил]-1,3-бензотиазол-6-ол
геймера с использованием амилоидных рецептор-
ных радиолигандов до сих пор остается предме-
[11C]PIB - Питтсбургский комплекс B (Pittsburgh
том научной дискуссии [156]. В последние 3-5 лет
Compound-B)
интерес исследователей прикован к изучению дру-
[123I]IMPY - [123I]6-иодо-2-(4-диметиламино)фенил-
гих маркеров болезнью Альцгеймера, в частности,
имидазо[1,2-a]пиридин
тау-протеинов, образующихся в нейрофибрилляр-
ных клубках нейронов у пациентов с болезни Аль-
[123I]TZDM–[125I]6-иодо-2-(4-диметиламинофенил)-
цгеймера. За очень короткий период была создана
бензотиазол
серия меченных фтором-18 радиотрейсеров на ос-
[125I]TZPI
-
[125I]6-иодо-2-(4-(4-метилпипера-
нове производных арилхинолинов (так называе-
зин-1-ил)фенил)бензотиазол
мая THK-серия), специфически связывающихся с
тау-протеинамии и отличающихся исключительно
[18F]AZD4694
-
2-[2-[18F]фтор-6-(метилами-
высокой селективностью тау/Aβ. Информация на
но)-3-пиринидил]-1-бензофуран-5-ол
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
32
СТУДЕНЦОВ и др.
[18F]BAY94-9172 - [18F]флорбетабен; (E)-4-(N-мети-
PMX 464 - 4-(бензотиазол-2-ил)-4-гидрокси-2,5-ци-
ламино)-4′-{2-[2-(2-[18F]фторэтокси)этокси]}стильбен
клогексадиен-1-он
[18F]FDDNP - 2-(1-{6-[(2-18F-фторэтил)(метил)ами-
PPA - полифосфорная кислота
но]-2-нафтил}этилиден)малонитрил
PTSA - п-толуолсульфокислота
[18F]ФДГ - 2-[18F]-фтор-2-дезокси-D-глюкоза
SBA-15 - микромезопористая модификация крем-
[18F]флутеметамол - 2-(3-[18F]фтор-4-метиламино-
нозема SantaBarbaraAmorphous
фенил)бензотиазол-6-ол
SCID - тяжелый комбинированный иммунодефицит
[18F]ФЭДБТ
-
2-(3,4-диметоксифенил-6-(2-[18F]
(severe combined immunodeficiency)
фторэтокси)бензотиазол)
SSRT - рецепторы соматостатина
[PMIM]Br -1-пропил-3-метилимидазолийбромид
Th-T - Тиофлавин-Т
4F 203 - 2-(4-амино-3-метилфенил)-4-фторбензоти-
ТEMPO - 2,2,6,6-тетраметил-1-пиперидинилокси
азол
AIBN - азобисизобутиронитрил
5,6-F2 203 - 2-(4-амино-3-метилфенил)-5,6-дифтор-
АТФ - аденозинтрифосфорная кислота
бензотиазол
ГМДСО - гексаметилдисилоксан
5F 203 - 2-(4-амино-3-метилфенил)-5-фторбензоти-
азол
ГМФТА - гексаметилфосфортриамид
6F 203 - 2-(4-амино-3-метилфенил)-6-фторбензоти-
ГЭБ - гематоэнцефалический барьер
азол
ОФЭКТ - однофотонная эмиссионная компьютер-
6F PMX 610 - 2-(3,4-диметоксифенил)-6-фторбензо-
ная томография
тиазол
ПЭТ - позитронно-эмиссионная томография
6-ОН 203 - 6-гидрокси-(4-амино-3-метилфенил)-
Фортресс - 2-(4-амино-3-метилфенил)-5-фторбен-
бензотиазол
зотиазол L-лизиламид гидрохлорид
7F 203 - 2-(4-амино-3-метилфенил)-7-фторбензоти-
КОНФЛИКТ ИНТЕРЕСОВ
азол
Авторы заявляют об отсутствии конфликта
AhR - арилгидрокарбоновые рецепторы
интересов.
AhRNТ - арилгидрокарбонатный ядерный трансло-
катор
СПИСОК ЛИТЕРАТУРЫ
AJM 290 -
4-(1-бензилсульфонил-6-фтор-1H-ин-
1. Gill R.K., Rawal R.K., Bariwal J. // Arch. Pharm. 2015.
дол-2-ил)-4-гидроксициклогекса-2,5-диенон
Vol. 348. N 3. P. 155. doi 10.1002/ardp.201400340
APK-1 - апоптическая сигнальная киназа
2. Yadav P.S., Prakash D., Senthilkumar G.P. // Int. J.
Aβ - β-амилоид
Pharm. Sci. Drug Res. 2011. Vol. 3. N 1. P. 1. doi
CYP 1A1 - цитохром Р450, семейство 1, подсемей-
10.1002/chin.201140238
ства А, полипептид 1
3. Patel N.B., Khan I.H., Rajani S.D. // Arch. Pharm. 2010.
Vol. 343. N 11-12. P. 692. doi 10.1002/ardp.201000061
DF 203 - 2-(4-амино-3-метилфенил)бензотиазол
4. Burger A., Sawhney S.N. // J. Med. Chem. 1968. Vol. 11.
GLUT1 - глюкозный транспортер
N 2. P. 270. doi 10.1021/jm00308a018
GLUT2- глюкозный транспортер
5. Amnerkar N.D., Bhusari K.P. // Eur. J. Med.
GSH - глутатион
Chem. 2010. Vol. 45. N 1. P. 149. doi 10.1016/j.
HCT116 - линия клеток рака кишечника
ejmech.2009.09.037
НТ29 - линия клеток рака кишечника
6. Zhang P., Li S., Yan Y., Lu W., Ke H., Ye D., Li X., Chu
Y. // Bioorg. Med. Chem. Lett. 2014. Vol. 24. N 24. P.
K/K 2.2.2 - комплекс с криптофиксом
5639. doi 10.1016/j.bmcl.2014.10.078
Kyn - кинуренин (kynurenine)
7. Westwell A.D., Stevens M.F.G. // Drug Discov. Today.
MDA-MB-231 - рак молочной железы с тройным
2004. Vol. 9. N 15. P. 625. doi 10.1016/S1359-
негативным фенотипом
6446(04)03162-9
PEG - полиэтиленгликоль
8. Racanè L., Tralić-Kulenović V., Fišer-Jakić L., Boy-
PEPPSI - pyridine-enhanced precatalyst preparation
kin D.W., Karminski-Zamola G. // Heterocycles. 2001.
stabilization and initation
Vol. 55. N 11. P. 2085. doi 10.3987/COM-01-9305
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
33
9.
Bradshaw T.D., Wrigley S., Shi D.-F., Schultz R.J.,
25.
Callero M.A., Luzzani G.A., De Dios D.O., Brad-
Paull K.D., Stevens M.F.G. // Br. J. Cancer. 1998. Vol.
shaw T.D., Loaiza Perez A.I. // J. Cell. Biochem. 2013.
77. N 5. P. 745. doi 10.1038/bjc.1998.122
Vol. 114. N 10. P. 2392. doi 10.1002/jcb.24589
10.
Студенцов Е.П., Ганина М.Б., Казурова Н.Г., Го-
26.
Bradshaw T.D., Westwell A.D. // Curr. Med. Chem. 2004.
ловина А.А. // Изв. СПбГТИ (ТУ). 2014. Т. 23.
Vol. 11. N 8. P. 1009. doi 10.2174/0929867043455530
Вып. 49. С. 26.
27.
Bradshaw T.D., Stevens M.F.G., Westwell A.D. //
11.
Студенцов Е.П., Непорожнева О.В., Головина А.А.,
Curr. Med. Chem. 2001. Vol. 8. P. 203. doi
Новикова Н.И., Орловская В.В., Рамш С.М. // Изв.
10.2174/0929867013373714
СПбГТИ (ТУ). 2016. Т. 34. Вып. 60. С. 49.
28.
Mukherjee A., Westwell A.D., Bradshaw T.D., Ste-
12.
Студенцов Е.П., Непорожнева О.В., Головина А.А.,
vens M.F.G., Carmichael J., Martin S.G. // Br. J. Cancer.
2005. Vol. 92. P. 350. doi 10.1038/sj.bjc.6602338
Новикова Н.И., Орловская В.В., Красикова Р.Н. //
29.
Wells G., Berry J.M., Bradshaw T.D., Burger A.M.,
Изв. СПбГТИ (ТУ). 2015. Т. 32. Вып. 58. С. 69.
Seaton A., Wang B., Westwell A.D., Stevens M.F. // J.
13.
Студенцов Е.П., Рамш С.М., Казурова Н.Г., Не-
Med. Chem. 2003. Vol. 46. N 4. P. 532. doi 10.1021/
порожнева О.В., Гарабаджиу А.В., Кочина Т.А.,
jm020984y
Воронков М.Г., Кузнецов В.А., Криворотов Д.В. //
30.
Lion C.J., Matthews C.S., Wells G., Bradshaw T.D.,
Обзоры по клинической фармакологии и лекарствен-
Stevens M.F., Westwell A.D. // Bioorg. Med. Chem.
ной терапии. 2013. Т. 11. Вып. 4. С. 3. doi 10.17816/
Lett. 2006. Vol. 16. N 19. P. 5005. doi 10.1016/j.
RCF1143-43
bmcl.2006.07.072.
14.
Boyd M.R., Paull K.D. // Drug Dev. Res. 1995. Vol. 34.
31.
Jones D.T., Pugh C.W., Wigfield S., Stevens M.F., Har-
N 2. P. 91. doi 10.1002/ddr.430340203
ris A.L. // Clin. Cancer Res. 2006. Vol. 12. N 18.
15.
Dubey R., Shrivastava P.K., Basniwal P.K., Bhattacharya
P. 5384. doi 10.1158/1078-0432.CCR-05-2380
S., Moorthy N.S. // Mini-Rev. Med. Chem. 2006. Vol. 6.
32.
Scheetz M.E., Carlson D.G., Schinitsky M.R. // Infect.
N 6. P. 633. doi 10.2174/138955706777435706
Immun. 1977. Vol. 15. N 1. P. 145. doi 10.1128/
16.
Hroch L., Aitken L, Benek O., Dolezal M., Kuca K.,
iai.15.1.145-148.1977
Gunn-Moore F. // Curr. Med. Chem. 2015. Vol. 22. N
33.
Wang M., Gao M., Mock B.H., Miller K.D., Sledge G.W.,
6. P. 730. doi 10.2174/0929867322666141212120631
Hutchins G.D., Zheng Q.H. // Bioorg. Med. Chem. 2006.
17.
Keri R.S., Quintanova C., Marques S.M., Esteves A.R.,
Vol. 14. N 24. P. 8599. doi 10.1016/j.bmc.2006.08.026
Cardoso S.M., Santos M.A. // Bioorg. Med. Chem. 2013.
34.
Heterocyclic compounds / Ed. R.C. Elderfield. New
Vol. 21. N 15 P. 4559. doi 10.1016/j.bmc.2013.05.028
York: John Wiley & Sons Inc., 1957. Vol. 5.
18.
Shi D.F., Bradshaw T.D., Wrigley S., McCall C.J.,
35.
Comprehensive organic chemistry / Ed. S.D. Barton,
Lelieveld P., Fichtner I., Stevens M.F. // J. Med. Chem.
Ollis W.D. Oxford: Pergamon, 1979. doi 10.1002/
1996. Vol. 39. N 17. P. 3375. doi 10.1021/jm9600959
jps.2600690651
19.
Singh M., Singh S. // Anticancer. Agents Med.
36.
Chang Y.-H., Peak J.D., Wierschke S.W., Feld W.A. //
Chem. 2014. Vol. 14. N 1. P. 127. doi 10.2174/
Synth. Commun. 1993. Vol. 23. N 5. P. 663. doi
18715206113139990312
10.1080/00397919308009825
20.
Weekes A.A., Westwell A.D. // Curr. Med. Chem.
37.
Кочинова О.Ф., Зубкова И.В., Черных В.П., Ковален-
2009. Vol. 16. N 19. P. 2430. doi 10.2174/
ко С.Н., Синтез, реакционная способность и биоло-
092986709788682137
гическая активность производных 2-аминобензоти-
21.
Westwell A.D. Fluorinated Pharmaceuticals: Advances
азола. Харьков: НФАУ, 2000. С. 158.
in Medical Chemistry. London: Future Sci. Ltd, 2015.
38.
Metzger J.V. // Compr. Heterocycl. Chem. 1984. Vol. 6.
22.
Kamal A., Syed M.A.H., Mohammed S.M. // Expert
P. 235. doi 10.1016/B978-008096519-2.00087-4
Opin. Ther. Pat. 2015. Vol. 25. N 3. P. 335. doi
39.
Bahrami K., Khodaei M.M., Naali F. // J. Org. Chem.
10.1517/13543776.2014.999764
2008. Vol. 73. N 17. P. 6835. doi 10.1021/jo8010232
23.
Aiello S., Wells G., Stone E.L., Kadri H., Bazzi R.,
40.
Itoh T., Nagata K., Ishikawa H., Ohsawa A. //
Bell D.R., Stevens M.F.G., Matthews C.S., Brad-
Heterocycles. 2004. Vol. 62. N 1. P. 197. doi 10.3987/
shaw T.D., Westwell A.D. // J. Med. Chem. 2008.
COM-03-S(P)47
Vol. 51. N 16. P. 5135. doi 10.1021/jm800418z.
41.
Itoh T., Nagata K., Ishikawa H., Ohsawa A. //
24.
Mortimer C.G., Wells G., Crochard J.P., Stone E.L.,
Heterocycles. 2004. Vol. 63. N 12. P. 2769. doi 10.3987/
Bradshaw T.D., Stevens M.F., Westwell A.D. // J.
COM-04-10215
Med. Chem. 2006. Vol. 49. N 1. P. 179. doi 10.1021/
42.
Li Y., Wang Y.-L., Wang J.-Y. // Chem. Lett. 2006.
jm050942k
Vol. 35. N 4. P. 460. doi 10.1246/cl.2006.460
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
34
СТУДЕНЦОВ и др.
43.
Mukhopadhyay C., Datta A. // Heterocycles. 2007.
62.
Yang Z., Chen X., Wang S., Liu J., Xie K., Wang A., Tan
Vol. 71. N 8. P. 1837. doi 10.3987/COM-07-11079
Z. // J. Org. Chem. 2012. Vol. 77. N 16. P. 7086. doi
44.
Sadek K.U., Mekheimer R.A., Hameed A.F.A., Elnahas F.,
10.1021/jo300740j
Elnagdi M.H. // Molecules 2012. Vol. 17. N 5. P. 6011.
63.
Weekes A.A., Bagley M.C., Westwell A.D. // Tetrahedron.
doi 10.3390/molecules17056011
2011. Vol. 67. N 40. P. 7743. doi 10.1016/j.
45.
Chen G.F., Jia H.M., Zhang L.Y., Chen B.H., Li J.T. //
tet.2011.08.004
Ultrason. Sonochem. 2013. Vol. 20. N 2. P. 627. doi
64.
Downer-Riley N.K., Jackson Y.A. // Tetrahedron. 2007.
10.1016/j.ultsonch.2012.09.010
Vol. 63. N 41. P. 10276. doi 10.1016/j.tet.2007.07.076
46.
Rostamizadeh S., Housaini S.A.G. // Phosphorus, Sulfur,
65.
Bose D.S., Idrees M., Srikanth B. // Synthesis. 2007.
Silicon, Relat. Elem. 2005. Vol. 180. N 5-6. P. 1321. doi
N 6. P. 819. doi 10.1055/s-2007-965929
10.1080/10426500590912268
66.
Bose D.S., Idrees M. // Tetrahedron Lett. 2007. Vol. 48.
47.
Chen Y.-X., Qian L.-F., Zhang W., Han B. // Angew.
N 4. P. 669. doi 10.1016/j.tetlet.2006.11.105
Chem. Int. Ed. 2008. Vol. 47. N 48. P. 9330. doi
67.
Bose D.S., Idrees M. // J. Org. Chem. 2006. Vol. 71.
10.1002/anie.200803381
N 21. P. 8261. doi 10.1021/jo0609374
48.
Ranu B.C., Jana R., Dey S.S. // Chem. Lett. 2004.
68.
Evindar G., Batey R.A. // J. Org. Chem. 2006. Vol. 71.
Vol. 33. N 3. P. 274. doi 10.1246/cl.2004.274
N 5. P. 1802. doi 10.1021/jo051927q
49.
Deligeorgiev T.D., Kaloyanova S., Vasilev A.,
69.
Joyce L.L., Evindar G., Batey R.A. // Chem. Commun.
Vaquero J.J. // Phosphorus, Sulfur, Silicon,
2004. N 4. P. 446. doi 10.1039/B311591G
Relat. Elem. 2010. Vol. 185. N 11. P. 2292. doi
70.
Lyon M.A., Lawrence S., Williams D.J., Jackson Y.A. //
10.1080/10426501003598648
J. Chem. Soc. Perkin Trans. 1. 1999. N 4. P. 437. doi
50.
Mukhopadhyay C., Datta A. // J. Heterocycl. Chem.
2009. Vol. 46. N 1. P. 91. doi 10.1002/jhet.9
10.1039/A809203F
51.
Moghaddam F.M., Ismaili H., Bardajee G.R. // Heteroat.
71.
Downer N.K., Jackson Y.A. // Org. Biomol. Chem. 2004.
Chem. 2006. Vol. 17. N 2. P. 136. doi 10.1002/hc.20191
Vol. 2. N 20. P. 3039. doi 10.1039/B410373D
52.
Kodomari M., Tamaru Y., Aoyama T. // Synth. Commun.
72.
Tamao K., Sumitani K., Kumada M. // J. Am. Chem. Soc.
2004. Vol. 34. N 16. P. 3029. doi 10.1081/SCC-
1972. Vol. 94. N 12. P. 4374. doi 10.1021/ja00767a075
200026663
73.
Egi M., Liebeskind L.S. // Org. Lett. 2003. Vol. 5. N 6.
53.
Maleki B., Salehabadi H., Moghaddam M.K. // Acta
P. 801. doi 10.1021/ol0273497
Chim. Slov. 2010. Vol. 57. N 3. P. 741.
74.
Rueping M., Ieawsuwan W. // Synlett 2007. Vol. 2.
54.
Diwan F., Shaikh M.H., Shaikh M., Farooqui M. // Org.
P. 0247. doi 10.1055/s-2007-968013
Commun. 2019. Vol. 12. N 1. P. 1. doi 10.25135/ACG.
75.
Organ M.G., Abdel-Hadi M., Avola S., Hadei N.,
OC.54.19.02.1212
Nasielski J., O’Brien C.J., Valente C. // Chem. -
55.
Kamal A., Khan M.N., Reddy K.S., Srikanth Y.V., Srid-
A Eur. J. 2007. Vol. 13. N 1. P. 150. doi 10.1002/
har B. // Chem. Biol. Drug Des. 2007. Vol. 71. N 1.
chem.200601360
P. 78. doi 10.1111/j.1747-0285.2007.00609.x
76.
Miyaura N., Yamada K., Suzuki A. // Tetrahedron Lett.
56.
Lin G.W., Wang Y., Jin Q.M., Yang T.T., Song J.M.,
1979. Vol. 20. N 36. P. 3437. doi 10.1016/S0040-
Lu Y., Huang Q.J., Song K., Zhou J., Lu T. // Inorg.
4039(01)95429-2
Chim. Acta. 2012. Vol. 382. N 1. P. 35. doi 10.1016/j.
77.
Majo V.J., Prabhakaran J., Mann J.J., Dileep Kumar J.S. //
ica.2011.10.004
Tetrahedron Lett. 2003. Vol. 44. N 47. P. 8535. doi
57.
Gao Sh., Yang T.T., Zhao J. X., Duan Q., Liang Q.C.,
10.1016/j.tetlet.2003.09.138
Jiang D. Y. // Chem. Pap. 2017. Vol. 71. N 10. P. 1929.
78.
Liebeskind L.S., Srogl J. // Org. Lett. 2002. Vol. 4. N 6.
doi 10.1007/s11696-017-0187-7
P. 979. doi 10.1021/ol0200091
58.
Wang Y., Mathis C.A., Huang G-F., Debnath M.L.,
79.
Böhm H.J., Banner D., Bendels S., Kansy M., Kuhn B.,
Holt D.P., Shao L., Klunk W.E. // J. Mol. Neurosci. 2003.
Müller K., Obst-Sander U., Stahl M. // Chem.
Vol. 20. P. 255.
Bio. Chem. 2004. Vol. 5. N 5. P. 637. doi 10.1002/
59.
Harrop T.C., Rodriguez K., Mascharak P.K. // Synth.
cbic.200301023
Commun. 2003. Vol. 33. P. 1943. doi 10.1081/SCC-
120020209
80.
Shah P., Westwell A.D. // J. Enzyme Inhib. Med.
60.
Nadaf R.N., Siddiqui S.A., Daniel T., Lahoti R.J.,
Chem. 2007. Vol. 22. N 5. P. 527. doi 10.1080/
Srinivasan K.V. // J. Mol. Catal. (A). 2004. Vol. 214.
14756360701425014
N 1. P. 155. doi 10.1016/j.molcata.2003.10.064
81.
Novak M., Zhang Y. // Adv. Phys. Org. Chem. 2012.
61.
Chakraborti A.K., Rudrawar S., Kaur G., Sharma L. //
Vol. 46. P. 121. doi 10.1016/B978-0-12-398484-
Synlett. 2004. N 9. P. 1533. doi 10.1055/s-2004-829089
5.00003-1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
35
82.
Visser G.W., Gorree G.C., Braakhuis B.J., Hers-
97. Hutchinson I., Stevens M.F.G., Westwell A.D. //
cheid J.D. // Eur. J. Nucl. Med. 1989. Vol. 15. N 5.
Tetrahedron Lett. 2000. Vol. 41. N 3. Р. 425. doi
P. 225. doi 10.1007/bf00257538
10.1016/S0040-4039(99)02076-6
83.
Keri R.S., Quintanova C., Marques S.M., Esteves A.R.,
98. Stevens M.F.G., Westwell A.D., Poole T.D., Wells G. Pat.
Cardoso S.M., Santos M.A. // Bioorg. Med. Chem. 2013.
US 7384966B2 (2008).
Vol. 21. N 15. P. 4559. doi 10.1016/j.bmc.2013.05.028
99. Chua M.S., Shi D.F., Wrigley S., Bradshaw T.D.,
84.
Hutchinson I., Chua M.S., Browne H.L., Trapani V.,
Hutchinson I., Shaw P.N., Barrett D.A., Stanley L.A.,
Bradshaw T.D., Westwell A.D., Stevens M.F. // J.
Stevens M.F. // J. Med. Chem. 1999. Vol. 42. N 3. P. 381.
Med. Chem. 2001.Vol. 44. N 9. P. 1446. doi 10.1021/
doi 10.1021/jm981076x
jm001104n
100.
Venkatachalam T.K., Stimson D.H., Bhalla R., Pie-
85.
Leong C.O., Suggitt M., David J. Swaine D.J., Bibby M.C.,
rens G.K., Reutens D.C. // J. Label. Compd. Radio-
Stevens M.F., Bradshaw T.D. // Mol. Cancer Ther. 2004.
pharm. 2014. Vol. 57. N 9. Р. 566. doi 10.1002/jl-
Vol. 3. N 12. P. 1565.
cr.3216
86.
Brantley E., Patel V., Stinson S.F., Trapani V.,
101.
Frydrych J. Diploma Thesis, Hradec Králové, 2013.
Hose C.D., Ciolino H.P., Yeh G.C., Gutkind J.S.,
P. 122.
Sausville E.A., Loaiza-Pérez A.I. // Anticancer. Drugs.
102.
Mulero-Navarro S., Fernandez-Salguero P.M. // Front.
2005. Vol. 16. N 2. P. 137. doi 10.1097/00001813-
Cell Develop. Biol. 2016. Vol. 4. Р. 45. doi 10.3389/
200502000-00004
fcell.2016.00045
87.
Lee B.C., Kim J.S., Kim B.S., Son J.Y., Hong S.K.,
103.
Wang K., Guengerich F.P. // Chem. Res. Toxicol. 2012.
Park H.S., Moon B.S., Jung J.H., Jeong J.M., Kim S.E. //
Vol. 25. N 8. Р. 1740. doi 10.1021/tx3001994
Bioorganic Med. Chem. 2011. Vol. 19. N 9. P. 2980. doi
104.
Bradshaw T.D., Bibby M.C., Double J.A., Fichtner
10.1016/j.bmc.2011.03.029
I., Cooper P.A., Alley M.C., Donohue S., Stinson S.F.,
88.
Serdons K., Van Laere K., Janssen P., Kung H.F.,
Tomaszewjski J.E., Sausville E.A., Stevens M.F.G. //
Bormans G., Verbruggen A.J. // Med. Chem. 2009.
Mol. Cancer Ther. 2002. Vol. 1. N 4. Р. 239.
Vol. 52. N 22. Р. 7090. doi 10.1021/jm900871v
105.
Martinez J.M., Sali T., Okazaki R., Anna C., Holling-
89.
Serdons K., Terwinghe C., Vermaelen P., Van Laere K.,
shead M., Hose C., Monks A., Walker N.J., Baek S.J.,
Kung H., Mortelmans L., Bormans G., Verbruggen A.J. //
Eling T.E. // J. Pharmacol. Exp. Ther. 2006. Vol. 318.
Med. Chem. 2009. Vol. 52. N 5. Р. 1428. doi 10.1021/
N 2. Р. 899. doi 10.1124/jpet.105.100081
jm8013376
106.
Stone E.L., Citossi F., Singh R., Kaur B., Gaskell
90.
Li Z., Conti P.S. // Adv. Drug Deliv. Rev. 2010. Vol. 62.
M., Farmer P.B., Monks A., Hose C., Stevens M.F.,
N 11. Р. 1031. doi 10.1016/j.addr.2010.09.007
Leong C.O., Stocks M., Kellam B., Marlow M., Brad-
91.
Tan B.S., Tiong K.H., Muruhadas A., Randhawa N.,
shaw T.D. // Bioorg. Med. Chem. 2015. Vol. 23. N 21.
Choo H.L., Bradshaw T.D., Stevens M.F., Leong C.O. //
Р. 6891. doi 10.1016/j.bmc.2015.09.052
Mol. Cancer Ther. 2011. Vol. 10. N 10. P. 1982. doi
107.
Cui J., Li S. // Curr. Med. Chem. 2014. Vol. 21. N 5.
10.1158/1535-7163.mct-11-0391
Р. 519. doi 10.2174/09298673113206660277
92.
Brantley E., Trapani V., Alley M.C., Hose C.D.,
108.
Behrsing H.P., Furniss M.J., Davis M., Tomaszew-
Bradshaw T.D., Stevens M.F., Sausville E.A., Stin-
ski J.E., Parchment R.E. // Toxicol. Sci. 2012.
son S.F. // Drug Metab. Dispos. 2004. Vol. 32. N 12. Р.
Vol. 131. N 2. Р. 470. doi 10.1093/toxsci/kfs319
1392. doi 10.1124/dmd.104.001057
109.
Bradshaw T.D., Wren J.E., Bruce M., Barrett D.A.,
93.
Danielson P.B. // Curr. Drug Metab. 2002. Vol. 3. N 6.
Leong C.O., Gaskell M., Wright E.K., Farmer P.B.,
Р. 561. doi 10.2174/1389200023337054
Henderson C.J., Wolf R., Stevens M.F. // Pharmacolo-
94.
Guenderich F.P. Cytochrome P450: Structure,
gy. 2009. Vol. 83. N 2. Р. 99. doi 10.1159/000183846
Mechanism, and Biochemistry. New York: Kluwer
110.
Mukherjee A., Martin S.G. // Int. J. Oncol. 2006.
Academic, 2005. P. 377
Vol. 29. N 5. Р. 1287. doi 10.3892/ijo.29.5.1287
95.
Bradshaw T.D., Trapani V., Vasselin D.A, Westwell A.D. //
111.
Zhang Y., Chakraborty M., Cerda-Smith C.G., Brat-
Curr. Pharm. Des. 2002. Vol. 8. N 27. Р. 2475. doi
ton R.N., Maurer N.E., Senser E.M., Novak M. // J.
10.2174/1381612023392784
Org. Chem. 2013. Vol. 78. N 14. Р. 6992. doi 10.1021/
96.
Loaiza-Pérez A.I., Trapani V., Hose C., Singh S.S.,
jo400826f
Trepel J.B., Stevens M.F., Bradshaw T.D., Sausvil-
112.
Fichtner I., Monks A., Hose C., Stevens M.F., Brad-
le E.A. // Mol. Pharmacol. 2002. Vol. 61. N 1. P. 13. doi
shaw T.D. // Breast Cancer Res. Treat. 2004. Vol. 87.
10.1124/mol.61.1.13
N 1. P. 97. doi 10.1023/b:brea.0000041586.64371.88
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
36
СТУДЕНЦОВ и др.
113.
Mukherjee A., Huber K., Evans H., Lakhani N., Mar-
131.
Morrow D., Qin C., Smith R., Safe S.J. // Steroid
tin S. Br. // J. Pharmacol. 2007. Vol. 151. N 8. Р. 1167.
Biochem. Mol. Biol. 2004. Vol. 88. N 1. P. 27. doi
doi 10.1038/sj.bjp.0707342
10.1016/j.jsbmb.2003.10.005
114.
Callister M.E., Pinhu L., Catley M.C., Westwell A.D.,
132.
Opitz C.A., Litzenburger U.M., Sahm F., Ott M.,
Newton R., Leaver S.K., Quinlan G.J., Evans T.W.,
Tritschler I., Trump S., Schumacher T., Jestaedt L.,
Griffiths M.J., Burke-Gaffney A. // Br. J. Pharmacol.
Schrenk D., Weller M., Jugold M., Guillemin G.J.,
2008. Vol. 155. N 5. Р. 661. doi 10.1038/bjp.2008.258
Miller C.L., Lutz C., Radlwimmer B., Lehmann I.,
von Deimling A., Wick W., Platten M. // Nature. 2011.
115.
Hirota K., Nakamura H., Masutani H., Yodoi J. //
Vol. 478. N 7368. Р. 197. doi 10.1038/nature10491
Ann. N.Y. Acad. Sci. 2002. Vol. 957. N 1. Р. 189. doi
133.
Brown G.D., Wilson H.K., Westwell A.D., Hutchinson I.,
10.1111/j.1749-6632.2002.tb02916.x
Stevens M.F.G., Price P.M., Aboagye E., Luthra S.K.,
116.
Holmgren A. // J. Biol. Chem. 1989. Vol. 264. N 24.
Brady F. // J. Label. Compd. Radiopharm. 2001.
Р. 13963.
Vol. 44. N S1. Р. S374. doi 10.1002/jlcr.25804401132
117.
Mau B.L., Powis G. // Biochem. Pharmacol. 1992.
134.
Орловская В.В., Федорова О.С., Красикова Р.Н.
Vol. 43. N 7. Р. 1621. doi 10.1016/0006-
// Изв. АН. Сер. хим. 2015. № 7. C. 1518; Orlov-
2952(92)90220-d
skaya V.V., Fedorova O.S., Krasikova R.N. // Russ.
118.
Powis G., Montfort W.R. // Annu. Rev. Biophys. Bio-
Chem. Bull. 2015. Vol. 64. P. 1518. doi 10.1007/
mol. Struct. 2001. Vol. 30. P. 421. doi 10.1146/an-
s11172-015-1037-9
nurev.biophys.30.1.421
135.
Gao M., Wang M., Miller K.D., Sledge G.W., Hut-
119.
Saitoh M., Nishitoh H., Fujii M., Takeda K., Tobiume K.,
chins G.D., Zheng Q.H. // Bioorg. Med. Chem. Lett.
Sawada Y., Kawabata M., Miyazono K., Ichijo H. //
2006. Vol. 16. N 22. Р. 5767. doi 10.1016/j.bm-
EMBO J. 1998. Vol. 17. N 9. P. 2596. doi 10.1093/
cl.2006.08.088
emboj/17.9.2596
136.
Pike V.W., Aigbirhio F.I. // J. Chem. Soc. Chem. Com-
120.
Mau B.L., Powis G. // Biochem. Pharmacol. 1992.
mun. 1995. N 21. Р. 2215. doi 10.1039/C39950002215
Vol. 43. N 7. Р. 1613. doi 10.1016/0006-
137.
Li G.Y., Vaulina D.D., Li J.J., Fedorova O.S., Wang H.E.,
2952(92)90220-d
Liu R.S., Krasikova R.N., Chen C.L. // Bioorg.
121.
Stevens M.F., McCall C.J., Lelieveld P., Alexander P.,
Med. Chem. Lett. 2017. Vol. 27. N 15. Р. 3460. doi
Richter A., Davies D.E. // J. Med. Chem. 1994. Vol. 37.
10.1016/j.bmcl.2017.05.079
N 11. P. 1689. doi 10.1021/jm00037a020
138.
Tzanopoulou S., Sagnou M., Paravatou-Petsotas M.,
122.
Vasselin D.A., Westwell A.D., Matthews C.S., Brad-
Gourni E., Loudos G., Xanthopoulos S., Lafkas D., Kia-
shaw T.D., Stevens M.F. // J. Med. Chem. 2006.
ris H., Varvarigou A., Pirmettis I.C., Papadopoulos M.,
Vol. 49. N 13. Р. 3973. doi 10.1021/jm060359j
Pelecanou M.J. // Med. Chem. 2010. Vol. 53. N 12.
123.
Graziani, Y., Erikson E., Erikson R.L. // Eur. J. Bio-
Р. 4633. doi 10.1021/jm1001293
139.
Tredwell M., Preshlock S.M., Taylor N.J., Gruber S.,
chem. 1983. Vol. 135. N 3. Р. 583. doi 10.1111/j.1432-
1033.1983.tb07692.x
Huiban M., Passchier J., Mercier J., Génicot C., Gou-
verneur V.A. // Angew. Chem. Int. Ed. 2014. Vol. 53.
124.
Akiyama T., Ishida J., Nakagawa S., Ogawara H.,
N 30. P. 7751. doi 10.1002/anie.201404436
Watanabe S., Itoh N., Shibuya M., Fukami Y. // J. Biol.
140.
Ametamey S.M., Schubiger P.A. // Nucl. Sci. Tech.
Chem. 1987. Vol. 262. N 12. Р. 5592.
2006. Vol. 17. N 3. P. 143. doi10.1016/S1001-
125.
Zwick E., Bange J., Ullrich A. // Endocr. Relat. Cancer.
8042(06)60028-6.
2001. Vol. 8. N 3. Р. 161. doi 10.1677/erc.0.0080161
141.
Lockhart A. // Drug Discov. Today. 2006. Vol. 11.
126.
Tasler S., Müller O., Wieber T., Herz T., Pegoraro S.,
N 23-24. Р. 1093. doi 10.1016/j.drudis.2006.10.008
Saeb W., Lang M., Krauss R., Totzke F., Zirrgiebel U.,
142.
Mason N.S., Mathis C.A., Klunk W.E. // J. Label.
Ehlert .JE., Kubbutat M.H., Schächtele C. // Bio-
Compd. Radiopharm. 2013. Vol. 56. N 3-4. Р. 89. doi
org. Med. Chem. 2009. Vol. 17. N 18. Р. 6728. doi
10.1002/jlcr.2989
10.1016/j.bmc.2009.07.047
143.
Någren K., Halldin C., Rinne J.O. // Eur. J. Nucl.
127.
Tasler S., Müller O., Wieber T., Herz T., Krauss R., Tot-
Med. Mol. Imaging. 2010. Vol. 37. N 8. Р. 1575. doi
zke F., Kubbutat M.H., Schächtele C. // Bioorg. Med.
10.1007/s00259-009-1301-z
Chem. Lett. 2009. Vol. 19. N 5. Р. 1349. doi 10.1016/j.
144.
Shoghi-Jadid K., Small G.W., Agdeppa E.D., Kepe V.,
bmcl.2009.01.054
Ercoli L.M., Siddarth P., Read S., Satyamurthy N.,
128.
Mondal J., Sreejith S., Borah.P., Zhao Y. // ACS
Petric A., Huang S.C., Barrio J.R. // Am. J. Geriatr.
Sustain. Chem. Eng. 2014. Vol. 2. N 4. Р. 934. doi
Psychiatry. 2002. Vol. 10. N 1. Р. 24. doi 10.1176/appi.
10.1021/sc400530a
ajgp.10.1.24
129.
Bala M., Verma P.K., Sharma D., Kumar N., Singh B. //
145.
Klunk W.E., Wang Y., Huang G., Debnath M.L., Holt D.P.,
Mol. Divers. 2015. Vol. 19. N 2. Р. 263. doi 10.1007/
Mathis C.A. // Life Sci. 2001. Vol. 69. N 13. P. 1471.
s11030-015-9572-8
doi 10.1016/S0024-3205(01)01232-2
130.
Powell J.B., Goode G.D., Eltom S.E. // J. Cancer Ther.
146.
Mathis C.A., Bacskai B.J., Kajdasz S.T., McLellan M.E.,
2013. Vol. 4. N 7. Р. 1177. doi 10.4236/jct.2013.47137
Frosch M.P., Hyman B.T., Holt D.P., Wang Y.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
2-АРИЛБЕНЗОТИАЗОЛЫ
37
Huang G.F., Debnath M.L., Klunk W.E. // Bioorg. Med.
son S., Farde L. // J. Nucl. Med. 2012. Vol. 53. N 3.
Chem. Lett. 2002. Vol. 12. N 3. Р. 295. doi 10.1016/
Р. 415. doi 10.2967/jnumed.111.094029
s0960-894x(01)00734-x
153. Syed Y.Y., Deeks E. // CNS Drugs. 2015. Vol. 29. N 7.
147. Mathis C.A., Mason N.S., Lopresti B.J., Klunk W.E. //
Р. 605. doi 10.1007/s40263-015-0258-7
Semin. Nucl. Med. 2012, Vol. 42, N 6. Р. 423. doi
154. Newberg A.B., Wintering N.A., Plössl K., Hochold J.,
10.1053/j.semnuclmed.2012.07.001
148. Nyberg S., Jönhagen M.E., Cselényi Z., Halldin C., Ju-
Stabin M.G., Watson M., Skovronsky D., Clark C.M.,
lin P., Olsson H., Freund-Levi Y., Andersson J., Varnäs K.,
Kung M.P., Kung H.F. // J. Nucl. Med. 2006. Vol. 47.
Svensson S., Farde L. // Eur. J. Nucl. Med. Mol. Imag-
N 5. Р. 748.
ing. 2009. Vol. 36. N 11. Р. 1859. doi 10.1007/s00259-
155. Wang X., Cui M., Jia J., Liu B. // Eur. J. Med.
009-1182-1
Chem. 2015. Vol. 89. Р. 331. doi 10.1016/j.ej-
149. Mathis C., Lopresti B., Mason N., Price J., Flatt N.,
mech.2014.10.046
Wenzhu Bi., Ziolko S., DeKosky S., Klunk W. // J. Nucl.
156. Frey K.A. // J. Nucl. Med. . 2015. Vol. 56. N 3 P. 331.
Med. 2007. Vol. 48. supplement 2. Р. 56
150. Vandenberghe R., Van Laere K., Ivanoiu A., Salmon E.,
doi10.2967/jnumed.114.151571
Bastin C., Triau E., Hasselbalch S., Law I., Andersen A.,
157. Johnson K.A., Schultz A., Betensky R.A., Becker J.A.,
Korner A., Minthon L., Garraux G., Nelissen N., Bor-
Sepulcre J., Rentz D., Mormino E., Chhatwal J., Amari-
mans G., Buckley C., Owenius R., Thurfjell L., Farrar G.,
glio R., Papp K., Marshall G., Albers M., Mauro S., Pe-
Brooks D.J. // Ann. Neurol. 2010. Vol. 68. N 3. P. 319.
pin L., Alverio J., Judge K., Philiossaint M., Shoup T.,
doi 10.1002/ana.22068
Yokell D., Dickerson B. Gomez-Isla T., Hyman B.,
151. Juréus A., Swahn B.M., Sandell J., Jeppsson F.,
Johnson A.E., Johnström P., Neelissen J.A., Sunne-
Vasdev N., Sperling R. // Neurol. 2016. Vol. 79. N 1.
mark D., Farde L., Svensson S.P. // J. Neurochem.
Р. 110. doi 10.1002/ana.24546
2010. Vol. 114, N 3, P. 784. doi 10.1111/j.1471-
158. Villemagne V.L., Fodero-Tavoletti M.T., Masters C.L.,
4159.2010.06812.x
152. Cselényi Z., Jönhagen M.E., Forsberg A., Halldin C.,
Rowe C.C. // Lancet Neurol. 2015. Vol. 14. N 1. Р. 114.
Julin P., Schou M., Johnström P., Varnäs K., Svens-
doi 10.1016/S1474-4422(14)70252-2
2-Arylbenzothiazoles: Advances in the Creation of Anti-Cancer
and Diagnostic Pharmaceuticals
E. P. Studentsova,
A. A. Golovinaa, R. N. Krasikovab, V. V. Orlovskajab,
D. D. Vaulinab, V. I. Krutikova, and S. M. Ramsha
a St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
b Bechtereva Institute of Human Brain Russian Academy of Science, St. Petersburg, 197376 Russia
*e-mail: golovina@technolog.edu.ru
Received October 7, 2020; revised November 15, 2020; accepted December 3, 2020
This review summarizes and analyzes published medicinal chemistry data regarding physiologically active
2-arylbenzothiazoles - a promising class of antiproliferative agents and potential diagnostic agents for Alzhei-
mer’s disease. The data is examined in the light of QSAR approach to properties of 2-arylbenzothiazoles and
substrate activation mechanisms using labeled radiopharmaceuticals. The most promising leaders-in-class for
which clinical trials have been recommended or conducted have been highlighted. The synthetic methods for
preparation of 2-arylbenzothiazoles as starting point for new-generation drugs are analyzed in details. Various
synthesis methods of fluorine-containing 2-arylbenzothiazoles, including synthetic pathway to antiprolifera-
tive drug PMX 610, 5-F 203, Phortress are described. 2-Arylbenzothiazole future application in biology and
medicine is discussed.
Keywords: 2-arylbenzothiazoles, anticancer drugs, structure-activity relationship, Alzheimer’s disease diag-
nostics, radiotracers, positron emission tomography
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021