ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 49-53
УДК 547.745
СИНТЕЗ 1-АМИНОКАРБОНИЛМЕТИЛ-5-АРИЛ-
4-АРОИЛ-3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНОВ
© 2021 г. В. Л. Гейн*, Е. В. Пастухова
Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в Редакцию 2 сентября 2020 г.
После доработки 2 сентября 2020 г.
Принято к печати 15 сентября 2020 г.
Трехкомпонентной реакцией метилового эфира ароилпировиноградной кислоты со смесью арома-
тического альдегида и глицинамида гидрохлорида в среде ледяной уксусной кислоты в присутствии
безводного гидрокарбоната натрия синтезирован ряд новых 1-аминокарбонилметил-5-арил-4-ароил-3-ги-
дрокси-3-пирролин-2-онов.
Ключевые слова: 1-аминокарбонилметил-5-арил-4-ароил-3-гидрокси-3-пирролин-2-оны, глицинамида
гидрохлорид, тетрагидропиррол-2,3-дионы, трехкомпонентные реакции
DOI: 10.31857/S0044460X21010042
Поиск новых высокоактивных веществ с за-
ности: ноотропной, антигипоксической, анальге-
данными фармакологическими и биологическими
тической, противовоспалительной, антиагрегант-
свойствами и низкой токсичностью является од-
ной и противовирусной [2]. Наличие в структуре
ной из основных задач фармацевтической химии.
3-гидрокси-3-пирролин-2-онов нескольких реак-
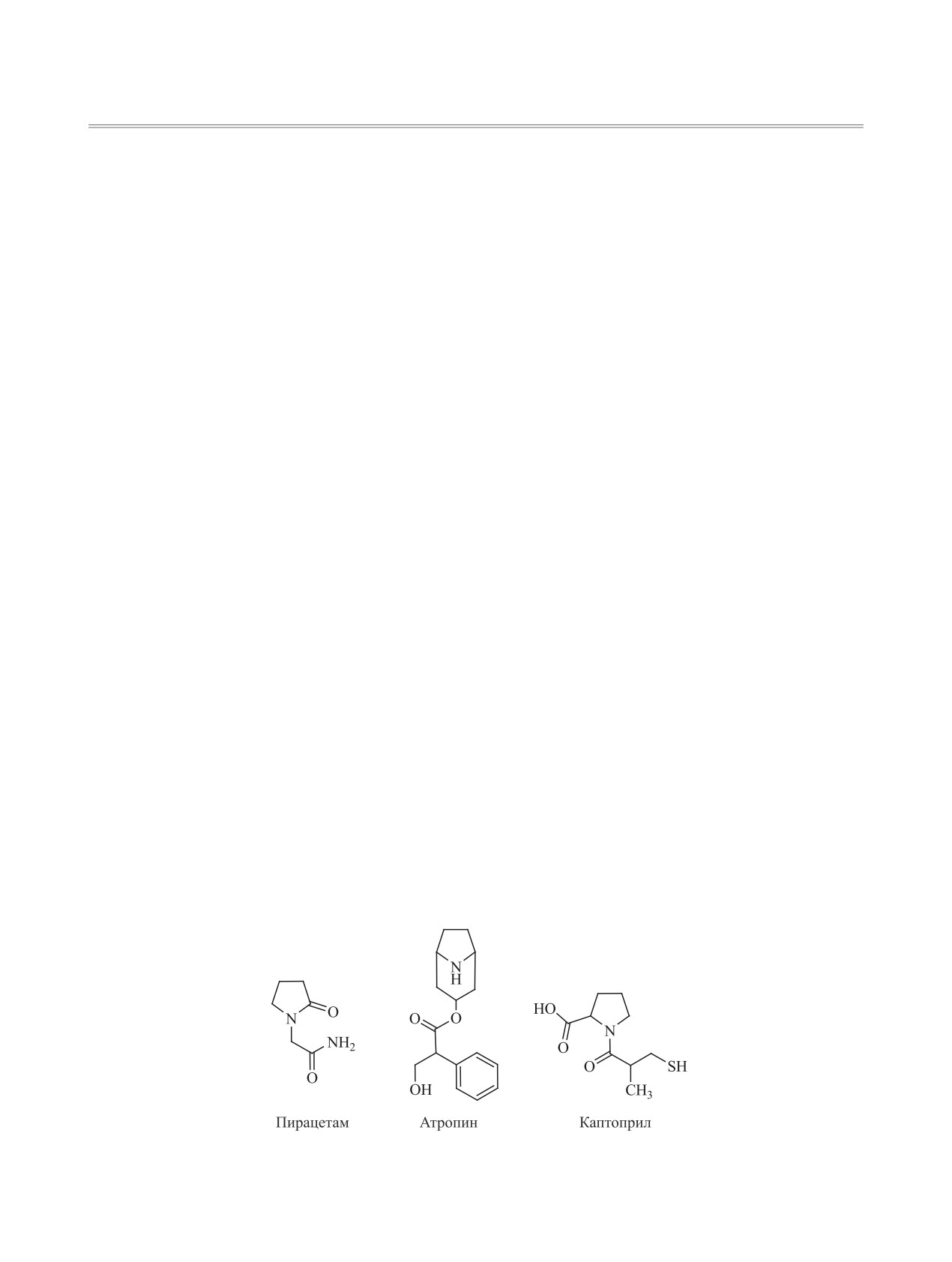
Класс гетероциклических соединений на основе
ционных центров позволяет вовлекать их в реак-
3-гидрокси-3-пирролин-2-онов представляет осо-
ции с различными нуклеофильными реагентами,
бый интерес, так как пирролиновый фрагмент вхо-
такими как мочевина и гидразингидрат [3]. Таким
дит в состав различных известных лекарственных
образом, разработка методов синтеза производных
препаратов, таких как пирацетам, атропин, капто-
3-гидрокси-3-пирролин-2-онов, содержащих в по-
прил, линкомицин и др., а также молекул фермен-
ложении 1 гетероцикла аминокарбонилметильный
тов-оксидоредуктаз [1] (схема 1).
фрагмент и изучение их биологической активно-
Производные
3-гидрокси-3-пирролин-2-онов
сти является актуальным направлением фармацев-
обладают широким спектром биологической актив-
тической химии [3, 4].
Схема 1.
49
50
ГЕЙН, ПАСТУХОВА
Схема 2.
С целью синтеза 4,5-дизамещенных 1-амино-
известной реакцией глицинамида гидрохлорида
карбонилметил-3-гидрокси-3-пирролин-2-онов
с безводным гидрокарбонатом натрия в уксус-
нами была изучена трехкомпонентная реакция ме-
нокислой среде непосредственно в ходе реакции
тилового эфира ароилпировиноградной кислоты
[5, 6]. Предположительно, реакция протекает с об-
со смесью ароматического альдегида и глицина-
разованием промежуточного основания Шиффа,
мида [5]. Данная реакция протекает при кратковре-
по двойной связи которого присоединяется исход-
менном нагревании эквимолярного количества ре-
ный эфир с последующей циклизацией промежу-
агентов в присутствии безводного гидрокарбоната
точного эфира
4-арил-4-амино-2-оксобутановой
натрия в среде ледяной уксусной кислоты с обра-
кислоты в соответствующие 3-гидрокси-3-пирро-
зованием
1-аминокарбонилметил-5-арил-4-аро-
лин- 2-оны 1-15 (схема 3).
ил-3-гидрокси-3-пирролин-2-онов 1-15 (схема 2).
Полученные соединения 1-15 представляют
Глицинамид, который в свободном виде в
собой белые кристаллические вещества, раствори-
обычных условиях не существует, был получен
мые в ДМСО, ДМФА, диоксане, при нагревании -
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ 1-АМИНОКАРБОНИЛМЕТИЛ-5-АРИЛ-...
51
в этаноле и ледяной уксусной кислоте, нераство-
1-Аминокарбонилметил-3-гидрокси-5-фе-
римые в воде.
нил-4-(4-хлорбензоил)-3-пирролин-2-он
(1). К
раствору 0.55 г (0.005 моль) глицинамида гидрох-
В ИК спектрах соединений 1-15 наблюдают-
лорида в 10 мл уксусной кислоты прибавляли
ся полосы поглощения лактамной карбонильной
0.42 г (0.005 моль) гидрокарбоната натрия и пере-
группы при 1765-1703 см-1 и полоса поглощения
мешивали до полного растворения. Далее добав-
амидной группы при 1713-1664 см-1. Полоса по-
ляли смесь 0.51 мл (0.005 моль) бензальдегида и
глощения карбонильной группы боковой цепи
1.2 г (0.005 моль) метилового эфира п-хлорбензо-
наблюдается в области 1635-1624 см-1. Интенсив-
илпировиноградной кислоты. Реакционную смесь
ная полоса поглощения енольной гидроксильной
нагревали до растворения компонентов и выдер-
группы регистрируется при 3250-3150 см-1, поло-
живали при комнатной температуре в течение
са поглощения NH2-групп - при 3568-3441 см-1.
1 сут. Выпавший при охлаждении осадок отфиль-
В спектрах ЯМР 1Н соединений 1-15 присут-
тровывали и перекристаллизовывали из этанола.
ствуют сигналы ароматических протонов (6.27-
Выход 0.95 г (51%), т. пл. 256-257°С. ИК спектр, ν,
7.94 м. д.), синглет метинового протона при атоме
см-1: 1695 (CON), 1668 (CONH2), 1606 (CO), 3200
C5 (5.40-5.90 м. д.), дублеты протонов метилено-
(OH), 3445 (NH2). Спектр ЯМР 1Н, δ, м. д.: 4.23 д
вой группы аминокарбонилметильного замести-
(1Н, CαНАНВ, J 16.0 Гц), 3.12 д (1Н, CαНАНВ, J 16.0
теля (3.07-3.24 м. д., CαHAHB; 4.12-4.88 м. д.,
Гц), 5.51 с (1H, С5Н), 7.12-7.73 м (9H, CHAr), 7.05
CαHAHB). Отсутствие сигнала енольной гидрок-
c и 7.15 с (2H, NH2). Найдено, %: C 61.82; H 4.34;
сильной группы в спектрах полученных соедине-
N 7.82. C19H15ClN2O4. Вычислено, %: C 61.55; H
ний объясняется обменными внутримолекулярны-
4.08; N 7.56.
ми процессами. Кроме того, в спектрах соединений
Соединения 2-15 получали аналогично и очи-
1-15 присутствуют два синглета протонов первич-
щали перекристаллизацией из этанола.
ной амидной аминогруппы в областях 6.07-7.21 и
1-Аминокарбонилметил-3-гидрокси-
6.68-7.22 м. д.
4-(4-хлорбензоил)-5-(4-хлорфенил)-3-пирро-
Полученные соединения дают характерное
лин-2-он (2). Выход 0.5 г (25%), т. пл. 242-244°С.
окрашивание при взаимодействии с хлоридом
ИК спектр, ν, см-1: 1707 (CON), 1687 (CONH2),
железа(III), что наряду с данными ЯМР 1Н и ИК
1635 (CO), 3150 (OH), 3451 (NH2), Спектр ЯМР 1Н,
спектроскопии дает основание сделать вывод об
δ, м. д.: 4.21 д (1Н, CαНАНВ, J 16.0 Гц), 3.19 д (1Н,
их преимущественном существовании в енольной
CαНАНВ, J 16.0 Гц), 5.51 с (1H, С5Н), 7.11-7.73 м
форме.
(8H, CHAr), 7.09 с и 7.11 с (2H, NH2). Найдено, %: C
Таким образом, взаимодействием метилового
56.63; H 3.74; N 7.19. C19H14Cl2N2O4. Вычислено,
%: C 56.31; H 3.48; N 6.91.
эфира ароилпировиноградной кислоты со сме-
сью ароматического альдегида и глицинамида
1-Аминокарбонилметил-3-гидрокси-
в ледяной уксусной кислоте в присутствии ги-
4-(4-хлорбензоил)-5-(2-хлорфенил)-3-пирро-
дрокарбоната натрия впервые получены 1-ами-
лин-2-он (3). Выход 0.6 г (30%), т. пл. 227-229°С.
нокарбонилметил-5-арил-4-ароил-3-гидрок-
ИК спектр, ν, см-1: 1709 (CON), 1685 (CONH2),
си-3-пирролин-2-оны, содержащие в положении 1
1626 (CO), 3180 (OH), 3445 (NH2). Спектр ЯМР 1Н,
δ, м. д.: 4.18 д (1Н, CαНАНВ, J 16.0 Гц), 3.11 д (1Н,
гетероцикла аминокрабонилметильную группу.
CαНАНВ, CH2CO, J 16.0 Гц), 5.67 с (1H, С5Н), 7.13-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
7.77 м (8H, CHAr), 7.11 с и 7.13 с (2H, NH2). Най-
ИК спектры записаны на спектрометре Specord
дено, %: C 56.57; H 3.73; N 6.65. C19H14Cl2N2O4.
M-80 в таблетках KBr. Спектры ЯМР 1Н записаны
Вычислено, %: C 56.31; H 3.48; N 6.91.
на спектрометре Bruker Avance III HD 400 с рабо-
1-Аминокарбонилметил-3-гидрокси-5-(3-ни-
чей частотой 400 МГц в ДМСО-d6, внутренний
трофенил)-4-(4-хлорбензоил)-3-пирролин-2-он
стандарт - ТМС. Элементный анализ проведен на
(4). Выход 0.45 г (22%), т. пл. 206-208°С. ИК
приборе Perkin Elmer 2400. Температуры плавле-
спектр, ν, см-1: 1765 (CON), 1703 (CONH2), 1620
ния определены на приборе Melting Point M-565.
(CO), 3198 (OH), 3568 (NH2). Спектр ЯМР 1Н, δ,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
52
ГЕЙН, ПАСТУХОВА
м. д.: 4.2 д (1Н, CαНАНВ, J 16.0 Гц), 3.28 д (1Н,
(9). Выход 0.75 г (39%), т. пл. 209-211°С. ИК
CαНАНВ, J 16.0 Гц), 5.63 с (1H, С5Н), 7.06-8.77 м
спектр, ν, см-1: 1707 (CON), 1674 (CONH2), 1635
(8H, CHAr), 7.06 с и 7.08 с (2H, NH2). Найдено, %:
(CO), 3168 (OH), 3451 (NH2). Спектр ЯМР 1Н, δ,
C 55.14; H 3.62; N 10.39. C19H14ClN3O6. Вычисле-
м. д.: 4.23 д (1Н, CαНАНВ, J 16.0 Гц), 3.12 д (1Н,
но, %: C 54.89; H 3.39; N 10.11.
CαНАНВ, J 16.0 Гц), 5.48 с (1H, С5Н), 7.09-8.09 м
(11H, CHAr), 7.09 с и 7.12 с (2H, NH2). Найдено, %:
1-Аминокарбонилметил-3-гидрокси-5-(2-ни-
C 65.54; H 4.09; N 7.61. C20H17ClN2O4. Вычислено,
трофенил)-4-(4-хлорбензоил)-3-пирролин-2-он
%: C 65.27; H 3.83; N 7.35.
(5). Выход 0,55 г (26%), т. пл. 176-178°С. ИК
спектр, ν, см-1: 1703 (CON), 1682 (CONH2), 1630
1-Аминокарбонилметил-3-гидрокси-5-(4-
(CO), 3160 (OH), 3451 (NH2). Спектр ЯМР 1Н, δ,
фторфенил)-4-(4-хлорбензоил)-3-пирролин-
м. д.: 4.28 д (1Н, CαНАНВ, J 16.0 Гц), 4.26 д (1Н,
2-он (10). Выход 0.85 г (44%), т. пл. 264-266°С. ИК
CαНАНВ, J 16.0 Гц), 5.31 с (1H, С5Н), 7.00-8.20 м
спектр, ν, см-1: 1707 (CON), 1682 (CONH2), 1633
(CO), 3190 (OH), 3453 (NH2). Спектр ЯМР 1Н, δ,
(8H, CHAr), 7.00 с и 7.01 с (2H, NH2). Найдено, %:
м. д.: 4.21 д (1Н, CαНАНВ, CH2CO, J 16.0 Гц), 3.17 д
C 55.13; H 3.61; N 10.36. C19H14ClN3O6. Вычисле-
(1Н, CαНАНВ, J 16.0 Гц), 5.52 с (1H, С5Н), 7.10-8.10
но, %: C 54.89; H 3.39; N 10.11.
м (8H, CHAr), 7.10 с и с 7.12 (2H, NH2). Найдено, %:
1-Аминокарбонилметил-3-гидрокси-
C 58.91; H 3.87; N 7.47. C19H14ClFN2O4. Вычисле-
4-(4-хлорбензоил)-5-(4-этилфенил)-3-пирро-
но, %: C 58.70; H 3.63; N 7.21.
лин-2-он (6). Выход 1.05 г (55%), т. пл. 253-254°С.
1-Аминокарбонилметил-4-бензоил-3-гид-
ИК спектр, ν, см-1: 1707 (CON), 1687 (CONH2),
рокси-5-(2-хлорфенил)-3-пирролин-2-он
(11).
1630 (CO), 3185 (OH), 3451 (NH2). Спектр ЯМР 1Н,
Выход 1.00 г (69%), т. пл. 247-249°С. ИК спектр, ν,
δ, м. д.: 4.22 д (1Н, CαНАНВ, J 16.0 Гц), 3.11 д (1Н,
см-1: 1759 (CON), 1713 (CONH2), 1624 (CO), 3188
CαНАНВ, J 16.0 Гц), 5.48 с (1H, С5Н), 7.11-7.73 м
(OH), 3451 (NH2). Спектр ЯМР 1Н, δ, м. д.: 4.19
(12H, CHAr), 7.18 с и 7.21 с (2H, NH2). Найдено, %:
д (1Н, CαНАНВ, J 16.0 Гц), 3.11 д (1Н, CαНАНВ, J
C 63.51; H 5.05; N 7.28. C21H17ClN2O4. Вычислено,
16.0 Гц), 5.69 с (1H, С5Н), 6.73-7.69 м (9H, CHAr),
%: C 63.24; H 4.80; N 7.02.
6.07 с и 6.68 с (2H, NH2). Найдено, %: C 61.83;
1-Аминокарбонилметил-3-гидрокси-5-(2-
H 4.31; N 7.80. C19H15ClN2O4. Вычислено, %: C
изопропилфенил)-4-(4-хлорбензоил)-3-пирро-
61.55; H 4.08; N 7.56.
лин-2-он (7). Выход 0.95 г (46%), т. пл. 262-263°С.
1-Аминокарбонилметил-4-бензоил-3-гид-
ИК спектр, ν, см-1: 1709 (CON), 1687 (CONH2),
рокси-5-(2-нитрофенил)-3-пирролин-2-он
(12).
1633 (CO), 3225 (OH), 3447 (NH2), Спектр ЯМР 1Н,
Выход 0.42 г (22%), т. пл. 179-181°С. ИК спектр, ν,
δ, м. д.: 4.22 д (1Н, CαНАНВ, J 16.0 Гц), 3.10 д (1Н,
см-1: 1707 (CON), 1685 (CONH2), 1630 (CO), 3192
CαНАНВ, J 16.0 Гц), 5.48 с (1H, С5Н), 7.12-7.75 м
(OH), 3456 (NH2). Спектр ЯМР 1Н, δ, м. д.: 4.25
(15H, CHAr), 7.20 с и 7.21 с (2H, NH2). Найдено, %:
д (1Н, CαНАНВ, J 16.0 Гц), 3.35 д (1Н, CαНАНВ, J
C 64.27; H 5.40; N 7.05. C22H21ClN2O4. Вычислено,
16.0 Гц), 6.09 с (1H, С5Н), 7.15-7.98 м (9H, CHAr),
%: C 64.00; H 5.13; N 6.79.
6.81 с и 7.15 с (2H, NH2). Найдено, %: C 60.09; H
1-Аминокарбонилметил-3-гидрокси-5-(4-ме-
4.22; N 11.27. C19H15N3O6. Вычислено, %: C 59.84;
токсифенил)-4-(4-хлорбензоил)-3-пирро-
H 3.96; N 11.02.
лин-2-он (8). Выход 0.6 г (30%), т. пл. 242-245 °С.
1-Аминокарбонилметил-4-бензоил-3-гид-
ИК спектр, ν, см-1: 1709 (CON), 1691 (CONH2),
рокси-5-(3-нитрофенил)-3-пирролин-2-он
(13).
1633 (CO), 3195 (OH), 3441 (NH2). Спектр ЯМР 1Н,
Выход 0.41 г (21%), т. пл. 202-204°С. ИК спектр, ν,
δ, м. д.: 4.21 д (1Н, CαНАНВ, J 16.0 Гц), 3.14 д (1Н,
см-1: 1703 (CON), 1680 (CONH2), 1633 (CO), 3185
CαНАНВ, J 16.0 Гц), 5.46 с (1H, С5Н), 6.86-7.74 м
(OH), 3451 (NH2). Спектр ЯМР 1Н, δ, м. д.: 4.21
(11H, CHAr), 7.21 с и 7.22 с (2H, NH2). Найдено, %:
д (1Н, CαНАНВ, J 16.0 Гц), 3.33 д (1Н, CαНАНВ, J
C 60.21; H 4.56; N 7.25. C20H17ClN2O5. Вычислено,
16.0 Гц), 5.70 с (1H, С5Н), 7.41-8.18 м (9H, CHAr),
%: C 59.93; H 4.28; N 6.99.
7.08 с и с 7.10 (2H, NH2). Найдено, %: C 60.05; H
1-Аминокарбонилметил-3-гидрокси-5-(4-ме-
4.22; N 11.26. C19H15N3O6. Вычислено, %: C 59.84;
тилфенил)-4-(4-хлорбензоил)-3-пирролин-2-он
H 3.96; N 11.02.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ 1-АМИНОКАРБОНИЛМЕТИЛ-5-АРИЛ-...
53
1-Аминокарбонилметил-4-бензоил-3-гид-
5.39; N 8.27. C20H18N2O4. Вычислено, %: C 68.56;
рокси-5-(4-изопропилфенил)-3-пирролин-2-он
H 5.18; N 8.00.
(14). Выход 0.43 г (23%), т. пл. 270-272°С. ИК
КОНФЛИКТ ИНТЕРЕСОВ
спектр, ν, см-1: 1703 (CON), 1674 (CONH2), 1635
(CO), 3250 (OH), 3451 (NH2). Спектр ЯМР 1Н, δ,
Авторы заявляют об отсутствии конфликта
м. д.: 4.23 д (1Н, CαНАНВ, J 16.0 Гц), 3.11 д (1Н,
интересов.
CαНАНВ, J 16.0 Гц), 5.49 с (1H, С5Н), 7.11-7.73 м
СПИСОК ЛИТЕРАТУРЫ
(16H, CHAr), 7.11 с и 7.21 с (2H, NH2). Найдено, %:
1. Машковский М.Д. Лекарственные средства. М.: Но-
C 70.08; H 6.12; N 7.63. C22H22N2O4. Вычислено,
вая волна, 2010. С. 116, 214, 556, 616.
%: C 69.83; H 5.86; N 7.40
2. Марьясов М.А., Гейн В.Л. Тетрагидропиррол-2,3-ди-
1-Аминокарбонилметил-4-бензоил-3-гид-
оны. Пермь: ПГФА, 2013. С. 29.
рокси-5-(4-метифенил)-3-пирролин-2-он
(15).
3. Гейн В.Л. Тетрагидропиррол- и тетрагидрофу-
ран-2,3-дионы. Пермь: ПГФА, 2004. С. 130.
Выход 0.35 г (20%), т. пл. 250-252°С. ИК спектр, ν,
4. Андрейчиков Ю.С., Гейн В.Л., Аникина И.Н. // ЖОрХ.
см-1: 1703 (CON), 1664 (CONH2), 1624 (CO), 3220
1986. Т. 22. Вып. 8. С. 1749.
(OH), 3464 (NH2), Спектр ЯМР 1Н, δ, м. д.: 4.23
5. Король А.Н. Автореф. дис
канд. фарм. наук.
д (1Н, CαНАНВ, J 16.0 Гц), 3.11 д (1Н, CαНАНВ, J
Пермь, 2015. 23 с.
16.0 Гц), 5.49 с (1H, С5Н), 7.12-8.09 м (12H, CHAr),
6. Гейн Л.Ф. Автореф. дис
докт. фарм. наук. Пермь,
7.09 с и с 7.12 (2H, NH2). Найдено, %: C 68.81; H
2009. 51 с
Synthesis of 1-Aminocarbonylmethyl-5-aryl-4-aroyl-3-hydroxy-
3-pyrroline-2-ones
V. L. Gein* and E. V. Pastukhova
Perm State Pharmaceutical Academy, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received September 2, 2020; revised September 2, 2020; accepted September 15, 2020
A series of new 1-aminocarbonylmethyl-5-aryl-4-aroyl-3-hydroxy-3-pyrrolin-2-ones has been synthesized
through a three-component reaction of aroylpyruvic acid methyl ester with a mixture of aromatic aldehyde and
glycinamide hydrochloride in glacial acetic acid in the presence of anhydrous sodium bicarbonate.
Keywords: 1-aminocarbonylmethyl-5-aryl-4-aroyl-3-hydroxy-3-pyrrolin-2-ones, glycinamide hydrochloride,
tetrahydropyrrol-2,3-diones, three-component reactions
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021