ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 54-67
УДК 547.461.3:547.822.7:547.824
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-
3,5-ДИКАРБОНИТРИЛА В РЕАКЦИИ МАННИХА
© 2021 г. В. В. Доценкоa,b,*, А. Н. Хрусталеваc, К. А. Фроловa, Н. А. Аксеновb,
И. В. Аксеноваb, С. Г. Кривоколыскоa
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
c Российский университет дружбы народов, Москва, 117198 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 17 октября 2020 г.
После доработки 17 октября 2020 г.
Принято к печати 28 октября 2020 г.
1,6-Диамино-2-оксо-1,2,3,4-тетрагидропиридин-3,5-дикарбонитрилы под действием первичных алифа-
тических аминов и избытка 37%-ного формалина в этаноле превращаются в производные 2,3,8,9-тетра-
гидро-6,10-метано[1,2,4]триазоло[1,5-a][1,5]диазоцин-6,10(7Н)-дикарбонитрила. В то же время, реакция
Манниха в случае 1,6-диамино-4-арил-2-оксо-1,2-дигидропиридин-3,5-дикарбонитрилов протекает
неоднозначно, и в зависимости от условий дает либо продукты N-этоксиметилирования, либо произво-
дные [1,2,4]триазоло[1,5-а]пиридина. Проведен предикторный анализ биологической активности новых
соединений in silico.
Ключевые слова: 2-цианоацетгидразид, аминометилирование, реакция Манниха, [1,2,4]триазоло[1,5-а]-
пиридины, 3,7-диазабицикло[3.3.1]нонаны
DOI: 10.31857/S0044460X21010054
Химия
3-цианопиридин-2(1Н)-халькогенонов
нонана 1 [12-15], пиридо[1,2-а][1,3,5]триазина 2,
привлекает внимание исследователей благодаря
3
[16-18], дипиридо[1,2-а:1′2′-е][1,3,5,7]тетразо-
высокому синтетическому потенциалу соедине-
цина 4 [19], 3,5,7,11-тетраазатрицикло[7.3.1.02,7]-
ний данного ряда, а также вследствие разнопла-
тридец-2-ена 5 [20-24], пиридо[2,1-b][1,3,5]тиади-
новой биологической активности многих произ-
азина 6 [25, 26] (схема 1), а также ряд более слож-
водных (обзорные работы по химии и свойствам
ных полициклических структур.
3-цианопиридин-2(1Н)-халькогенонов см. [1-9]).
В развитие исследований в области изуче-
Известно [10, 11], что реакция Манниха с участи-
ния реакции Манниха в ряду гетероциклических
ем
3-цианопиридин-2(1Н)-халькогенонов край-
субстратов [27, 28], мы решили изучить амино-
не чувствительна строению субстрата, аминного
метилирование доступных производных 1,6-ди-
компонента и соотношениям исходных реаген-
амино-2-оксо-1,2,3,4-тетрагидропиридин-3,5-ди-
тов. Весьма важными факторами, кардинальным
карбонитрила [29, 30]. Исходные соединения 7а,
образом влияющими на регионаправленность
б получали однореакторным методом [31], осно-
аминометилирования, являются степень насы-
ванным на конденсации соответствующего кето-
щенности пиридинового цикла, наличие и поло-
на с малононитрилом, цианоуксусным эфиром и
жение донорных (NH2, OH) или акцепторных (CN,
гидразингидратом при ультразвуковом облучении.
COOEt, CONHR) заместителей в кольце. Таким
Установлено, что при кипячении соединений 7 с
образом, исходя из замещенных 3-цианопири-
первичными алифатическими аминами и избыт-
дин-2(1Н)-халькогенонов нам ранее удалось син-
ком НСНО протекает аминометилирование по
тезировать производные 3,7-диазабицикло[3.3.1]
положениям С3 и С5 пиридинового цикла, а так-
54
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
55
Схема 1.
Схема 2.
же аминометилирование и этоксиметилирование
растворимые в этаноле и диэтиловом эфире, уме-
с участием обеих аминогрупп, приводящие к фор-
ренно растворимые в ацетоне и ДМСО. Их стро-
мированию замещенного
1,2,4-триазолинового
ение доказано комплексом спектральных данных
цикла. В результате с выходами 29-61% были вы-
ЯМР 1Н, 13С, ИК спектрометрии, а также данными
делены ранее не описанные в литературе 3-эток-
элементного анализа. В ИК спектрах соединений
симетил-2,3,8,9-тетрагидро-6,10-метано[1,2,4]-
8а-г не обнаруживаются полосы поглощения свя-
триазоло[1,5-a][1,5]диазоцин-6,10(7Н)-дикарбо-
зей N-H, но присутствуют сильные полосы погло-
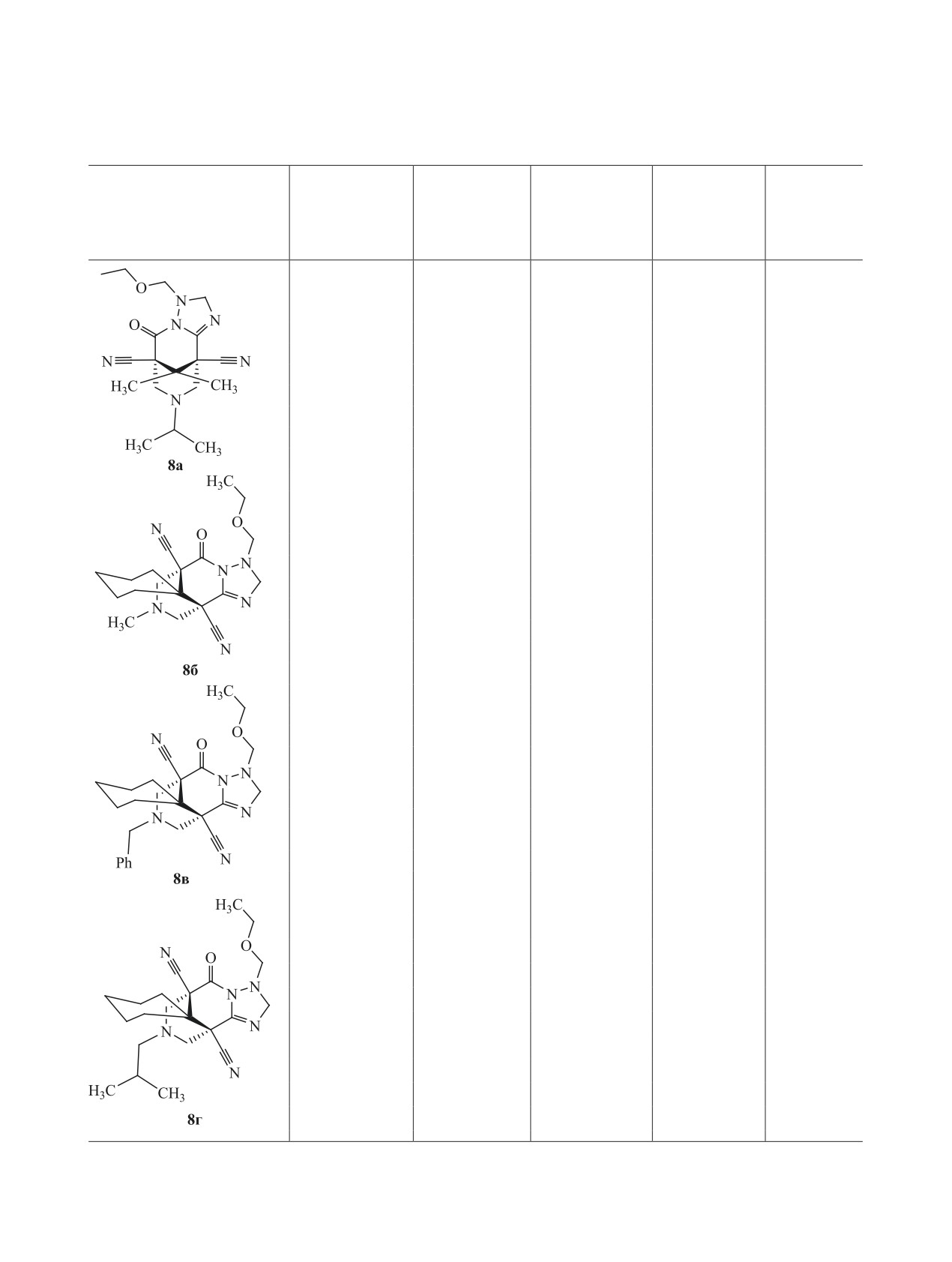
нитрилы 8а-г (схема 2). Стоит отметить, что пер-
щения в области 1695-1709 см-1 (С=О), а также
вичный амин вступает в реакцию в количестве 1
низкоинтенсивные полосы, соответствующие ва-
экв. даже в том случае, если амин был взят в из-
лентным колебаниям несопряженных нитрильных
бытке.
групп при 2247-2257 см-1.
Соединения 8а-г представляют собой мелко-
В спектрах ЯМР 1Н соединений 8 обнаружива-
кристаллические вещества белого цвета, плохо
ются сигналы протонов двух метиленовых групп
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
56
ДОЦЕНКО и др.
Схема 3.
С7Н2 и С9Н2 в виде двух пар дублетов в интервале
описанные (например, в работах [33, 40-44, 46,
2.88-3.30 м. д. (2J 11.5-12.2 Гц). Из числа других
48, 50-53]) высокие (>70%) выходы соединений
характерных сигналов следует также отметить
9 недостижимы, если в реакцию вводится менее
АВ-систему протонов эндоциклической метиле-
2 экв. динитрила 10 (или 2 экв. альдегида и ма-
новой группы С2Н2 (в виде двух дублетов в интер-
лононитрила) относительно гидразида 11, что под-
валах 4.88-4.97 и 5.06-5.15 м. д., 2J 12.4-13.0 Гц) и
тверждает наблюдения авторов работы [32]. Уста-
фрагмента NСН2ОСН2СН3.
новлено, что природа основания (Et3N, пиперидин,
морфолин, EtONa) не оказывает существенного
С целью выявления возможности использо-
влияния на выходы продукта. Так, взаимодействие
вания данного метода для получения других сое-
малононитрила, бензальдегида и цианоацетгидра-
динений со структурным фрагментом [1,2,4]три-
зида 11, взятых в мольных соотношениях 1:1:1, в
азоло[1,5-a]пиридина мы изучили поведение в
присутствии каталитических количеств пипериди-
условиях реакции Манниха дегидрированных ана-
на в EtOH при 25°С дает выход целевого продукта
логов соединений 7 - 1,6-диамино-2-оксо-1,2-ди-
9а (Ar = Ph) 32%, а при кипячении на протяжении
гидропиридин-3,5-дикарбонитрилов 9. Соедине-
2 ч - 34%.
ния 9 были впервые получены Сото и сотр. [32]
в 1981 г. катализируемой пиперидином конден-
Аналогичная трехкомпонентная реакция с уча-
сацией 2 экв. арилметиленмалононитрила 10 с
стием анисового альдегида при 25°С дает продукт
цианоацетгидразидом 11 (схема 3). Доступность
9б (Ar = 4-CH3OC6H4) с выходом 36%, при кипяче-
исходных реагентов и легкость практической ре-
нии в течение 2 ч - 46%. Реакция (4-метоксибензи-
ализации этого способа получения N-аминопири-
лиден)малононитрила 10б с гидразидом 11 (1:1) в
донов 9 привели к тому, что к настоящему времени
присутствии избытка EtONa (1.5 экв.) при кипяче-
в литературе накоплено большое многообразие
нии в абс. этаноле (3 ч) дает соединение 9б с вы-
практических процедур, ведущих к соединениям 9
ходом 41%. В то же время, использование 2 экв.
с выходами, близкими к количественным. Общим
нитрила 10б относительно гидразида 11 позволяет
трендом в данной области является использование
завершить реакцию за 30 мин с выходом 83-86%
многокомпонентных однореакторных подходов
при катализе морфолином или Et3N.
(схема 3) и новых каталитических систем. Ряд под-
По нашему мнению, использование экзоти-
ходов описан в литературных источниках [33-53]
ческих катализаторов (например, описанных в
и суммирован в табл. 1.
работах [34, 35, 37, 38, 49]) с точки зрения эф-
Нами были выборочно опробованы некото-
фективности или удешевления процесса не дает
рые из описанных подходов. Установлено, что
существенных преимуществ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
57
Таблица 1. Методы получения 1,6-диамино-2-оксо-1,2-дигидропиридин-3,5-дикарбонитрилов 9
Катализатор
Условия реакции
Выход %
Литературная ссылка
Пиперидин
H2O, 20°С, 11-17 ча
75-93
[33]
Металлоорганический каркас
H2O, кипячение, 20-40 минб
74-92
[34]
MIL-101(Cr)-N(CH2PO3H2)2
KF-Al2O3
EtOH-H2O, 20°С, 30-40 мина
84-96
[35]
Пиперидин
EtOH, 20°С, 3 ча
65-80
[36]
0.4 мол% нано-Co3S4
EtOH, кипячение, 30-55 минб
75-94
[37]
0.06 мол% нано-CdZr4(PO4)6
EtOH, кипячение, 30-45 минб
82-93
[38]
8 мол% нано-ZnO
EtOH, кипячение, 40 минб
82-92
[39]
Et3N
абс. EtOH, 20°С, 12 ч
71
[40]
Пиперидин
абс. EtOH, кипячение, 5 ч
85
[41]
Пиперидин
EtOH, 40°С → 20°С
80
[42]
Пиперидин
EtOH, 80-85°С
30-50
[43]
Пиперидин
абс. EtOH, кипячение, 4 ч
-
[44]
Без катализатора
абс. EtOH, кипячение, 3 ч
60
[45]
Пиперидин
абс. EtOH, кипячение, 6-8 ч
71
[46]
Bu4NBr
H2O, 70°C, 10-20 мина
93-9
[47]
Пиперидин
абс. EtOH, 20°С, 5 ч
80–95
[48]
нано-ZrP2O7
EtOH, кипячение, 20-35 минб
83-92
[49]
Пиперидин
абс. EtOH, 20°С, ночь
71
[50]
Et3N
EtOH, 20°С, 1 ч
85
[51]
Пиперидин
абс. EtOH, кипячение, 3 ч
74-75
[52, 53]
а Многокомпонентная реакция малононитрила, альдегида и цианоацетгидразида 11.
б Многокомпонентная реакция малононитрила, альдегида, цианоуксусного эфира и гидразингидрата.
Мы установили, что взаимодействие соедине-
окисляется кислородом воздуха до известного со-
ний 9а, б с формальдегидом и первичными ами-
единения 14.
нами в условиях, аналогичных таковым в синтезе
Следует отметить, что в литературе описаны
с использованием тетрагидропиридинов 7, вопре-
реакции как взаимодействия
1,6-диаминопири-
ки ожиданиям не приводит к образованию сое-
дин-2-онов 9 с карбонильными соединениями с
динений со структурным фрагментом [1,2,4]три-
образованием тетрагидро[1,2,4]триазоло[1,5-a]пи-
азоло[1,5-a]пиридина, аналогичных соединени-
ридинов [30, 46-48, 53], так и реакции их окисле-
ям 8. Так, при взаимодействии 1,6-диамино-2-ок-
ния, приводящие к триазолопиридинам, подобным
со-4-фенил-1,2-дигидропиридин-3,5-дикарбони-
cоединению 14 [45, 53, 54]. Однако, насколько нам
трила 9а (Ar = Ph) с бензиламином и формалином
известно, в условиях реакции Манниха образова-
в кипящем спирте (метод а, схема 4) был выделен
ния структур типа соединения 14 ранее не наблю-
только продукт N-этоксиметилирования 12а. Это
далось.
же соединение с сопоставимым выходом получа-
Строение соединений 12а и 14 подтверждено
ется при кипячении 1-аминопиридина 9а в эта-
данными ИК, ЯМР спектроскопии и ВЭЖХ-МС.
ноле с формалином и в отсутствие амина (метод
В спектрах ЯМР 1Н соединения 12а обнаруживают-
б, схема 4). В то же время, соединение 9б (Ar =
ся сигналы ациклического фрагмента -NHCH2O-
4-MeOC6H4) при взаимодействии с MeNH2 и
в виде дублета протонов метиленовой группы
HCHO с последующим подкислением дает [1,2,4]-
(4.34 м. д.) и триплета протона NH (7.32 м. д.)
триазоло[1,5-a]пиридин
14. Предположительно,
с константой спин-спинового взаимодействия
продукт этоксиметилирования 12б (не выделен)
3JNH-CH 3.5 Гц. При этом протоны аминогруппы
при обработке кислотой подвергается циклизации
обнаруживаются в виде двух уширенных пиков в
в конденсированное производное 1,2,3,5-тетра-
области 8.22-8.68 м. д. Это соответствует химиче-
гидро[1,2,4]триазоло[1,5-a]пиридина 13, которое
скому сдвигу протонов группы С6NН2, так как, со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
58
ДОЦЕНКО и др.
Схема 3.
гласно литературным данным (например, [32, 33,
ента распределения между н-октанолом и водой
38]), протоны группы N-NH2 резонируют в обла-
log(coctanol/cwater], растворимость (logS), площадь то-
сти более сильного поля (5.50-6.00 м. д.). Данные
пологической полярной поверхности (Topological
ВЭЖХ-МС соответствуют приведенным структу-
Polar Surface Area, TPSA), ряд токсикологических
рам.
характеристик - рисков побочных эффектов (му-
тагенные, онкогенные, репродуктивные эффекты),
Следует отметить, что [1,2,4]триазоло[1,5-a]пи-
ридины представляют интерес вследствие обшир-
параметр сходство с известными лекарственными
ного спектра биологической активности [30, 46,
препаратами (drug-likeness), а также общая оценка
47, 55-60]. С другой стороны, наличие в молекуле
фармакологического потенциала соединения (drug
трициклических структур 8а-г 3,7-диазабицик-
score). Полученные расчетные данные представле-
ло[3.3.1]нонанового (биспидинового) фрагмента,
ны в табл. 2.
относящегося к привилегированным структурам
Как следует из приведенных в табл. 2 данных,
(недавние обзоры по химии биспидинов см. [61-
значение сLogP для всех исследованных структур
65]), также делает эти соединения перспективны-
находится в диапазоне -1.19…0.40, что указывает
ми объектами для биологических исследований.
на вероятную хорошую абсорбцию и проницае-
В связи с этим мы решили провести предиктор-
мость [66-68]. В то же время, для соединений 8в,
ный анализ и расчет in silico возможных мишеней,
12а и 14 значение S < -4.0 указывает на невысо-
параметров ADMET и соответствия критериям
кую растворимость (менее 1×10-4 моль/л). Моле-
биодоступности для новых соединений 8а-г, 12а,
кулярные массы всех соединений и показатели
14. Анализ структур на соответствие «правилу
параметра TPSA соответствует критериям перо-
пяти» К. Липински [молекулярная масса (MW) ≤
ральной биодоступности. Практически все соеди-
500, сLogP ≤ 5.0, TPSA ≤ 140 Å2, число акцепто-
нения демонстрируют риск возможного влияния
ров водородных связей ≤ 10, доноров ≤ 5] [66-68]
на репродуктивную систему. Для соединений 8а,
проведен с использованием программного сервиса
12а и 14 отмечены наивысшие значения параметра
OSIRIS Property Explorer [69]. Рассчитаны следу-
сходства с лекарством (drug-likeness) и показателя
ющие параметры: сLogP [логарифм коэффици-
фармакологического потенциала соединения (drug
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
59
Таблица 2. Риски токсичности и физико-химические параметры соединений 8а-г, 12а, 14, спрогнозированные с
помощью OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug likeness
drug Score
8а
-
-
-
+
-1.15
-2.75
358
96.0
-0.81
0.34
8б
-
-
-
+
-1.19
-2.97
370
96.0
-3.95
0.26
8в
-
-
-
+
0.23
-4.29
446
96.0
-4.62
0.21
8г
-
-
-
+
-0.11
-3.70
412
96.0
-10.54
0.23
12а
-
-
-
-
-0.79
-4.15
309
115.1
-1.19
0.50
14
-
-
-
+
0.40
-4.24
291
101.5
0.80
0.41
a Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности; A - мутагенность, B -
канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
Таблица 3. Расчетные параметры ADMET для соединений 8а-г, 12а, 14
Ингибирование цитохромов Р450а
Острая
Проник-
Гастроинтес-
токсичность
новение
тинальная
(крысы) pLD50,
через ГЭБа
абсорбцияа
CYP1A2
CYP2C19
CYP2C9
CYP2D6
CYP3A4
lg[1/(моль/кг)]
8а
+
+
-
-
-
-
-
-
2.7881
0.8820
1.0000
0.5219
8б
+
+
-
-
-
-
-
-
2.7965
0.9476
1.0000
0.5000
8в
+
+
-
+
+
+
+
-
2.8112
0.9577
1.0000
0.5000
8г
+
+
-
+
-
-
+
-
2.7919
0.8961
1.0000
0.5273
12а
+
+
-
-
-
-
-
-
2.5407
0.9193
1.0000
0.5663
14
+
+
+
-
-
-
-
+
2.6917
0.9590
1.0000
0.5435
а Знаком «+» или «-» показано наличие или отсутствие эффекта, число означает вероятность эффекта в долях от единицы.
score). Можно также отметить, что для соедине-
достоверность > 0, если вероятность активности
ний 8 замена двух метильных групп в положении
больше вероятности неактивности Pa > Pi).
11 трициклической системы на спиросочлененный
Для прогнозирования параметров ADMET
циклогексановый фрагмент в целом неблагоприят-
(Absorption, Distribution, Metabolism, Excretion,
но сказалась на фармакологическом потенциале.
Toxicity) и вероятных мишеней использовали про-
Для прогнозирования биологической активно-
граммные пакеты SwissADME [73] и admetSAR
сти также использовали открытые программные
[74]. Согласно критериям US EPA, по острой пе-
продукты PASS Online [70, 71] и AntiBac-Pred
роральной токсичности исследуемые соединения
[72]. По полученным данным, для соединения
можно отнести к II (соединение 14, 50 мг/кг < LD50
12а с вероятностью 0.57 прогнозируется антикон-
< 500 мг/кг) и III (остальные соединения, 500 мг/
вульсантное действие, а соединение 14 с вероят-
кг < LD50 < 5000 мг/кг) категориям. Для всех ис-
ностью 0.743 является усилителем экспрессии
следованных соединений прогнозируется высокая
белка HMGCS2 (3-hydroxy-3-methylglutaryl-CoA
гастроэнтеральная абсорбция и возможность про-
synthase 2). Лучшее антибактериальное действие
никновения через гематоэнцефалический барьер
прогнозируется для соединения 8б в отноше-
(ГЭБ), а также преимущественное отсутствие ин-
нии патогенных бактерий Dialister pneumosintes
гибирующего действия в отношении цитохромов
и Dialister micraerophilus (достоверность 0.2122;
Р450 (табл. 3). Оценка возможного мутагенного/
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
60
ДОЦЕНКО и др.
Таблица 4. Результаты прогнозирования протеин-лигандного взаимодействия для соединений 8а-г, 12а, 14
Пре-докинговая
Свободная
Общая оценка
Идентификатор
Идентификатор
оценка протеин-
энергия связы-
протеин-
Соединение
протеина PDB
протеина
лигандного
вания,
лигандного
ID
UniProt ID
взаимодействия
ккал/моль
взаимодей-
(Predock score)
(Docking score)
ствия
4rc3
P11309
0.226
-13.984
0.331
5hic
P00533
0.192
-16.361
0.315
2xe6
P00558
0.189
-15.353
0.305
4fki
P24941
0.175
-15.503
0.291
3o9v
P27487
0.182
-13.358
0.282
4k77
P23458
0.164
-15.193
0.278
5ekn
O15264
0.144
-16.734
0.270
3uuo
Q9Y233
0.167
-13.374
0.267
3zep
P52333, P52333
0.146
-16.026
0.267
2i6b
P55263
0.147
-15.628
0.264
4rc3
P11309
0.244
-16.144
0.366
5hcx
P00533
0.199
-15.632
0.316
2xe6
P00558
0.195
-15.951
0.315
6n7a
P23458
0.185
-16.849
0.312
5kby
P27487
0.190
-15.513
0.306
4z16
P52333, P52333
0.173
-17.451
0.304
4fki
P24941
0.185
-15.148
0.299
3uuo
Q9Y233
0.184
-14.592
0.294
2i6b
P55263
0.160
-16.169
0.281
5ekn
O15264
0.146
-17.854
0.280
6aak
P52333
0.244
-21.954
0.409
5tel
P11309
0.252
-20.343
0.404
5tq4
O60674
0.221
-24.157
0.402
6n7a
P23458
0.231
-21.311
0.391
5c8k
P00533
0.230
-21.071
0.388
4wnp
O75385
0.230
-19.987
0.380
2vd5
Q09013
0.214
–22.082
0.380
3fxz
Q13153
0.234
-19.175
0.378
2bro
O14757
0.215
-21.622
0.377
3v8w
Q08881, Q08881
0.209
-21.650
0.371
5c8k
P00533
0.228
-19.748
0.376
5ane
P24941
0.239
-17.498
0.370
6eo9
P00734
0.198
-21.539
0.359
4rc3
P11309
0.213
-18.430
0.352
4ivd
P23458
0.192
-20.878
0.348
5tq4
O60674
0.178
-21.444
0.339
4fyo
P43405
0.200
-16.634
0.325
5jzn
O15075, O15075
0.173
-19.799
0.321
5ih9
Q14680
0.187
-17.882
0.321
6dud
P52333
0.181
-18.561
0.320
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
61
Таблица 4. (продолжение)
Пре-докинговая
Свободная
Общая оцен-
Идентификатор
Идентификатор
оценка протеин-
энергия связы-
ка протеин-
Соединение
протеина PDB
протеина
лигандного
вания,
лигандного
ID
UniProt ID
взаимодействия
ккал/моль
взаимодей-
(Predock score)
(Docking score)
ствия
6aaj
O60674
0.215
-19.233
0.359
1uwj
P15056, P15056
0.202
-20.223
0.354
5hsu
P00374
0.200
-19.366
0.345
6da4
P52333
0.200
-18.241
0.337
3mpm
P06239
0.198
-18.207
0.334
5kx8
Q9NWZ3
0.182
-20.178
0.333
5kwh
P68400
0.189
-18.857
0.330
2xir
P35968
0.193
-17.970
0.327
2jbp
P49137
0.194
-17.716
0.327
4mha
Q12866, Q12866
0.192
-18.038
0.327
6hmb
P19784
0.193
-17.379
0.323
3vhe
P35968
0.160
-19.863
0.309
1jwh
P67870, P68400
0.162
-18.322
0.299
5cqw
P68400
0.170
-17.195
0.299
4xmo
P08581
0.162
-17.116
0.290
4q4d
O43314
0.154
-16.934
0.281
5ji8
Q9H8M2
0.155
-15.999
0.274
3cnk
P21333, P21333
0.122
-20.190
0.273
5up3
Q99683
0.143
-17.356
0.273
5lqf
P06493, P14635
0.129
-18.688
0.269
канцерогенного эффекта в тесте Эймса на дает од-
вают сродство к широкой группе белков - транс-
нозначных результатов.
фераз и гидролаз. В частности, для соединений 8а,
б, г прогнозируется афинность к протоонкогену
Возможные протеиновые мишени для полу-
Ser/Thr-протеин киназе Pim-1 [78] (PDB ID 4rc3)
ченных соединений были спрогнозированы с
(см. рисунок), что делает эту группу соединений
использованием нового протокола протеин-ли-
перспективной для изучения противоопухолевой
гандного докинга GalaxySagittarius [75] на базе
активности.
веб-сервера GalaxyWeb [76, 77]. Предварительно
3D-структуры соединений были оптимизированы
Таким образом, нами разработан способ
средствами молекулярной механики в силовом
получения 3-этоксиметил-2,3,8,9-тетрагидро-6,10-
поле ММ2 для оптимизации геометрии и мини-
метано[1,2,4]триазоло[1,5-a][1,5]диазоцин-
мизации энергии. Докинг с использованием про-
6,10(7Н)-дикарбонитрилов путем аминометилиро-
токола GalaxySagittarius проводился в режимах
вания
1,6-диамино-2-оксо-1,2,3,4-тетрагидропи-
Binding compatability prediction и Re-ranking using
ридин-3,5-дикарбонитрилов действием первичных
docking. В табл. 4 представлены результаты докин-
аминов и НСНО в кипящем этаноле. Дегидриро-
га по каждому из соединений 8а-г, 12а, 14 для 10
ванные аналоги вышеуказанных пиридиновых
комплексов мишень-лиганд с минимальной сво-
субстратов - 1,6-диамино-2-оксо-1,2-дигидропи-
бодной энергии связывания ΔGbind и наилучшей
ридин-3,5-дикарбонитрилы - в условиях реакции
оценкой протеин-лигандного взаимодействия.
Манниха реагируют неоднозначно. Изучение ре-
Прогнозируемые протеиновые мишени указаны с
акций алкокси- и аминометилирования 1,6-диами-
помощью ID-идентификаторов в Protein Data Bank
но-2-оксо-1,2-дигидропиридин-3,5-дикарбонитри-
(PDB) и в базе данных UniProt. Как можно заме-
лов требует более детального изучения и составит
тить из табл. 4, полученные соединения обнаружи-
предмет наших дальнейших исследований. Допол-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
62
ДОЦЕНКО и др.
Малононитрил является коммерчески доступ-
ным реагентом (Acros). Цианоацетгидразид полу-
чали реакцией цианоуксусного эфира с гидразин-
гидратом по известной методике [79].
Общая методика синтеза 5-оксо-3-этокси-
метил-2,3,8,9-тетрагидро-6,10-метано[1,2,4]-
триазоло[1,5-a][1,5]диазоцин-6,10(7Н)-дикарбо-
нитрилов 8а-г. К смеси 2.0 ммоль тетрагидропи-
ридина 7а, б и алифатического амина (4.0 ммоль)
в 10-12 мл 96%-ного EtOH добавляли избыток
(2.0 мл, 26.6 ммоль) 37%-ного формалина, свобод-
ного от примеси параформа. Реакционную смесь
кипятили в течение 2 ч, затем фильтровали через
складчатый бумажный фильтр и оставляли для
кристаллизации продукта при комнатной темпера-
туре. Через 72 ч отфильтровывали кристаллы про-
дукта 8в-г (в случае соединения 8а потребовалось
Прогнозируемая структура протеин-лигандного ком-
плекса соединения 8б и серин/треонин-протеин киназы
предварительное подкисление реакционной массы
pim-1 (PDB ID 4rc3) (получено с использованием про-
водн. HCl до рН 4), промывали EtOH. Соединения
токола GalaxySagittarius).
8а-г получали в аналитически чистом виде.
нительно проведен анализ литературных данных
8-Изопропил-11,11-диметил-5-оксо-3-(эток-
методов получения 1,6-диамино-2-оксо-1,2-диги-
симетил)-2,3,8,9-тетрагидро-6,10-метано[1,2,4]-
дропиридин-3,5-дикарбонитрилов, установлены
триазоло[1,5-a][1,5]диазоцин-6,10(7Н)-дикарбо-
оптимальные условия синтеза. Результаты экспе-
нитрил (8а). Выход 300 мг (42%), белый мелко-
риментов по оценке параметров биологической
кристаллический порошок, т. пл. 166-168°С. ИК
активности и биодоступности in silico позволяют
спектр, ν, см-1: 2257 сл (С≡N), 1709 ш. с (С=О).
рассматривать полученные соединения как пер-
Спектр ЯМР 1Н, δ, м. д.: 0.90 д [6Н, СН(СН3)2, 3J
спективные объекты для дальнейшего скрининга.
6.6 Гц], 1.06 т (3Н, ОСН2СН3, 3J 7.1 Гц), 1.34 с (3Н,
СН3), 1.43 с (3Н, СН3), 2.80-2.88 м [1Н, СН(СН3)2],
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
, 2J 12.2 Гц), 3.06 д (1Н,
3.04 д (1Н, С7Н2 или С9Н2
ИК спектры получали на спектрометре ИКС-
С9Н2 или С7Н2, 2J 11.7 Гц), 3.21 д (1Н, С7Н2 или
29 (ЛОМО) в вазелиновом масле. Спектры ЯМР
С9Н2, 2J 12.2 Гц), 3.22 д (1Н, С9Н2 или С7Н2, 2J
регистрировали на приборе Bruker Avance III HD
11.7 Гц), 3.50 к (2Н, ОСН2СН3, 3J
7.1 Гц), 4.18
400MHz (400.17 MГц на ядрах 1Н, 100.63 МГц -
д (1Н, СН2OEt, 2J 9.4 Гц), 4.45 д (1Н, СН2OEt, 2J
13С) в растворе ДМСО-d6 (соединения 8а-в) и
9.4 Гц), 4.88 д (1Н, NСН2N, 2J 13.0 Гц), 5.06 д (1Н,
CDCl3 (8г), в качестве стандарта использовали
NСН2N, 2J 13.0 Гц). Спектр ЯМР 13С, δC, м. д.: 14.9
ТМС и остаточные сигналы растворителя. Эле-
(CH3CH2O), 17.3 [СН(СН3)2], 18.2 [СН(СН3)2], 19.3
ментный анализ проводили на приборе Carlo Erba
(CH3), 23.3 (CH3), 38.9 (C11), 45.1 [СН(СН3)2], 49.3
1106 Elemental Analyzer. ВЭЖХ-МС-Анализ сое-
(C10), 50.7 (C6), 53.2 (C7 или С9), 53.3 (C9 или С7),
динений проводили на жидкостном хроматографе
63.8 (CH3CH2O), 77.2 (NCH2O), 82.8 (C2), 115.2
Agilent 1100 с детекторами DAD, ELSD Sedex 75,
(C≡N), 115.4 (C≡N), 151.9 (С10a), 157.1 (С5). Най-
совмещенном с масс-спектрометром Agilent LC/
дено, %: С 60.25; Н 7.35; N 23.41. C18H26N6O2. Вы-
MSD VL, ионизация электрораспылением (ES-
числено, %: С 60.32; Н 7.31; N 23.45. M 358.44
API, положительный и отрицательный режимы).
Индивидуальность полученных образцов контро-
8-Метил-5-оксо-3-(этоксиметил)-2,3,8,9-те-
лировали методом ТСХ на пластинах Silufol UV-
трагидроспиро[6,10-метано[1,2,4]триазоло-
254, элюент - ацетон-гексан, 1:1, проявитель -
[1,5-a][1,5]диазоцин-11,1′-циклогексан]-
пары иода, УФ детектор. Температуры плавления
6,10(5Н,7Н)-дикарбонитрил (8б). Выход 415 мг
определяли на столике Кофлера и не корректировали.
(56%), белый мелкокристаллический порошок,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
63
т. пл. 142-144°С. ИК спектр, ν, см-1: 2247 сл
240 мг (29%), белый мелкокристаллический по-
(С≡N), 1695 ш. с (С=О). Спектр ЯМР 1Н, δ, м. д.:
рошок, т. пл. 101-103°С. ИК спектр, ν, см-1: 2250
1.06 т (3Н, ОСН2СН3, 3J 7.1 Гц), 1.41-1.57 м [2Н,
сл (С≡N), 1695 ш. с (С=О). Спектр ЯМР 1Н, δ,
(СН2)5], 1.73-2.00 м [7Н, (СН2)5], 2.18-2.23 м [1Н,
м. д.: 0.75-0.78 м [6Н, СН(СН3)2], 1.02-1.07 м
(СН2)5], 2.27 с (3Н, NСН3), 2.97-3.09 м (3Н, на-
[1Н, СН(СН3)2], 1.14 т (3Н, ОСН2СН3, 3J 7.1 Гц),
ложение сигналов С7Н2 и С9Н2), 3.21 д (1Н, С9Н2
1.50-1.57 м [2Н, (СН2)5], 1.61-1.71 м [2Н, (СН2)5],
или С7Н2, 2J 11.5 Гц), 3.40-3.55 м (2Н, ОСН2СН3),
1.83-2.00 м [5Н, (СН2)5], 2.15-2.19 м [3Н, наложе-
4.19 д (1Н, СН2OEt, 2J 9.5 Гц), 4.51 д (1Н, СН2OEt,
ние СН2СН(СН3)2, (СН2)5], 3.02 д (1Н, С7Н2 или
2J 9.5 Гц), 4.93 д (1Н, NСН2N, 2J 12.7 Гц), 5.08 д
С9Н2, 2J 12.0 Гц), 3.07-3.16 м (3Н, наложение сиг-
(1Н, NСН2N, 2J 12.7 Гц). Спектр ЯМР 13С, δC, м. д.:
налов С7Н2 и С9Н2), 3.48-3.54 м (2Н, ОСН2СН3),
15.1 (CH3CH2O), 20.0 [(СН2)5], 20.6 [(СН2)5], 24.0
4.09 д (1Н, СН2OEt, 2J 9.4 Гц), 4.71 д (1Н, СН2OEt,
[(СН2)5], 27.2 [(СН2)5], 31.7 [(СН2)5], 39.6 (C11),
2J 9.4 Гц), 4.97 д (1Н, NСН2N, 2J 12.4 Гц), 5.15 д
42.9 (NCH3), 44.5 (C10), 53.7 (C7 или С9), 54.2 (C9
(1Н, NСН2N, 2J 12.4 Гц). Спектр ЯМР 13С, δC, м.
или С7), 56.4 (C6), 63.9 (CH3CH2O), 77.1 (NCH2O),
д.: 15.1 (CH3CH2O), 20.0 [(СН2)5], 20.1 [(СН3)2СН],
82.6 (C2), 116.5 (C≡N), 116.8 (C≡N), 151.7 (С10a),
20.5 [(СН2)5], 21.0 [(СН3)2СН], 24.2 [(СН2)5], 27.9
156.7 (С5). Найдено, %: С 61.53; Н 7.14; N 22.65.
[(СН2)5], 29.7 [(СН2)5], 32.2 [CH2CH(CH3)2], 40.6
C19H26N6O2. Вычислено, %: С 61.60; Н 7.07; N
(C11), 44.9 (C10), 53.8 (C7 или С9), 54.6 (C9 или С7),
22.69. M 370.45
56.5 (C6), 63.7 (CH3CH2O), 78.1 (NCH2O), 83.3 (C2),
8-Бензил-5-оксо-3-(этоксиметил)-2,3,8,9-те-
116.1 (C≡N), 116.5 (C≡N), 152.9 (С10a), 157.3 (С5).
трагидроспиро[6,10-метано[1,2,4]триазоло-
Найдено, %: С 64.21; Н 8.00; N 20.23. С22Н32N6О2.
[1,5-a][1,5]диазоцин-11,1′-циклогексан]-
Вычислено, %: С 64.05; Н 7.82; N 20.37. М 412.53
6,10(5Н,7Н)-дикарбонитрил (8в). Выход 545 мг
1,6-Диамино-2-оксо-4-фенил-1,2-дигидро-
(61%), белый мелкокристаллический порошок,
пиридин-3,5-дикарбонитрил (9а) был получен
т. пл. 175-177°С. ИК спектр, ν, см-1: 2250 сл
кипячением в EtOH (15 мл) смеси цианоацетги-
(С≡N), 1695 ш. с (С=О). Спектр ЯМР 1Н, δ, м. д.:
дразида 11 (0.99 г, 1 ммоль), бензальдегида (1.0
1.07 т (3Н, ОСН2СН3, 3J 7.1 Гц), 1.44-1.53 м [2Н,
мл, 1 ммоль) и малононитрила (0.66 г, 1 ммоль) в
(СН2)5], 1.73-1.83 м [5Н, (СН2)5], 1.92-1.97 м [2Н,
присутствии 3 капель пиперидина на протяжении
(СН2)5], 2.18-2.23 м [1Н, (СН2)5], 2.88 д (1Н, С7Н2
2 ч. Выпавший в ходе кипячения осадок отфиль-
или С9Н2, 2J 11.5 Гц), 3.07 д (1Н, С9Н2 или С7Н2,
тровывали, промывали этанолом и сушили. Выход
2J 12.0 Гц), 3.24 д (1Н, С9Н2 или С7Н2, 2J 12.0 Гц),
850 мг (34%), бледно-желтый порошок, т. пл. 240°С
3.30 д (1Н, С7Н2 или С9Н2, 2J 11.5 Гц), 3.46-3.55
(т. пл. 240°С [32], 332-334°C [33], 237-239°С [39],
м (2Н, ОСН2СН3), 3.68 к (2Н, PhСН2, 2J 13.6 Гц,
238-240°С [47]). Спектральные характеристики
АВ-система), 4.23 д (1Н, СН2OEt, 2J 9.5 Гц), 4.55
соответствуют описанным ранее.
д (1Н, СН2OEt, 2J 9.5 Гц), 4.91 д (1Н, NСН2N, 2J
12.8 Гц), 5.12 д (1Н, NСН2N, 2J 12.8 Гц), 7.13 д (2Н,
1,6-Диамино-4-(4-метоксифенил)-2-оксо-
H2 и Н6 Ph, 3J 7.0 Гц), 7.24-7.34 м (3Н, Н3-Н5 Ph).
1,2-дигидропиридин-3,5-дикарбонитрил
(9б)
Спектр ЯМР 13С, δC, м. д.: 15.0 (CH3CH2O), 20.0
был получен кипячением смеси цианоацетгидра-
[(СН2)5], 20.6 [(СН2)5], 23.9 [(СН2)5], 27.3 [(СН2)5],
зида 11 (0.99 г, 1 ммоль) и 2-(4-метоксибензили-
31.7 [(СН2)5], 40.1 (C11), 44.4 (C10), 52.0 (C7 или С9),
ден)малононитрила 10б (1.84 г, 1 ммоль) в раство-
54.31 (C9 или С7), 54.34 (CH2Ph), 58.3 (C6), 63.7
ре этилата натрия (1.5 ммоль) в EtOH (15 мл) на
(CH3CH2O), 77.4 (NCH2O), 82.8 (C2), 116.5 (C≡N),
протяжении 3 ч (выход 41%), а также реакцией 11
116.7 (C≡N), 127.5 (C4 Ph), 128.3 (2C, Ph), 128.4
(1 ммоль) с 10б (2 ммоль) в 20 мл EtOH в присут-
(2C, Ph), 136.4 (C1-Ph), 151.9 (С10a), 156.7 (С5).
ствии 3 капель морфолина при перемешивании в
Найдено, %: С 67.19; Н 6.88; N 18.77. С25Н30N6О2.
течение 30 мин при умеренном нагревании (50°С).
Вычислено, %: С 67.24; Н 6.77; N 18.82. M 446.55
Выход 86% в расчете на цианоацетгидразид, блед-
8-Изобутил-5-оксо-3-(этоксиметил)-
но-желтый порошок, т. пл. 223-224°С (т. пл. 225°С
2,3,8,9-тетрагидроспиро[6,10-метано[1,2,4]-
[32], 321-323°C [33], 221-224°С [35]). Спектраль-
триазоло[1,5-a][1,5]диазоцин-11,1′-циклогек-
ные характеристики соответствуют описанным в
сан]-6,10(5Н,7Н)-дикарбонитрил
(8г). Выход
литературе.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
64
ДОЦЕНКО и др.
6-Амино-2-оксо-4-фенил-1-[(этоксиметил)-
нию солей с основаниями [80, 81]), и через 48 ч
амино]-1,2-дигидропиридин-3,5-дикарбони-
отфильтровывали кристаллы, промывали этано-
трил (12а). Метод a. К смеси 500 мг (1.99 ммоль)
лом и сушили. Выход 151 мг (26%), светло-жел-
1,6-диаминопиридона 9а и 430 мг (4.0 ммоль) бен-
тые кристаллы, т. пл. > 300°С. ИК спектр, ν, см-1:
зиламина в 10 мл 96%-ного EtOH добавляли из-
3146 ш. сл (N-H), 2218 с (2 C≡N), 1664 с (C=О).
быток (2.0 мл, 26.6 ммоль) 37%-ного формалина,
Спектр ЯМР 1Н, δ, м. д.: 3.83 с (3Н, ОСН3), 7.09 д
свободного от примеси параформа. Реакционную
(2Н, Н3, Н5 Ar, 3J 8.8 Гц), 7.47 д (2Н, Н2, Н6 Ar, 3J
смесь кипятили в течение 5 мин, затем фильтро-
8.8 Гц), 7.68 уш. с (1Н, NH), 8.51 с (1Н, H2). Спектр
вали через бумажный складчатый фильтр. Через
ЯМР 13С, δC, м. д.: 55.4 (OCH3), 76.2 (C8), 85.0 (C6),
72 ч выделяли продукт 12а, промывали этанолом
113.9 (C3, С5 Ar), 116.3 (C≡N), 117.9 (C≡N), 127.4
и сушили. Выход 190 мг (31%), белый мелкокри-
(C2, C6 Ar), 130.2 (C1 Ar), 149.9 (C2), 150.8 (C7),
сталлический порошок. ИК спектр, ν, см-1: 3380
155.7 (С8a), 155.9 (С-OMe), 160.3 (C=O). Масс-
сл, 3220 ш. с (N-H), 2217 с (2 С≡N), 1670 с (С=О).
спектр, m/z: 292.0 [M + H]+, 371.0 [M + ДМСО +
Спектр ЯМР 1Н, δ, м. д.: 1.06 т (3Н, ОСН2СН3, 3J
H]+, 290.0 [M - H]-. Найдено, %: С 61.80; Н 3.24; N
7.0 Гц), 3.62 к (2Н, ОСН2СН3, 3J 7.0 Гц), 4.34 д (1Н,
24.00. С15Н9N5О2. Вычислено, %: С 61.85; Н 3.11;
NHСН2OEt, 3JNH-CH 3.5 Гц), 7.32 т (1Н, NHСН2OEt,
N 24.04. M 291.26
3JNH-CH 3.5 Гц), 7.48-7.54 м (5Н, Ph), 8.22 уш. с (1Н,
ФОНДОВАЯ ПОДДЕРЖКА
NH2), 8.68 уш. с (1Н, NH2). Масс-спектр, m/z: 310.0
Исследование выполнено при финансовой под-
[M + H]+, 264.0 [M - EtOH]+, 320.2 [M + H2O - H]-,
держке Кубанского научного фонда в рамках на-
308.2 [M - H]-, 262.0 [M - EtOH - H]-. Найдено, %:
учного проекта МФИ-20.1-26/20 (заявка № МФИ-
С 62.17; Н 4.94; N 22.60. С16Н15N5О2. Вычислено,
20.1/45) и Министерства образования и науки
%: С 62.13; Н 4.89; N 22.64. M 309.32
Российской Федерации (тема 0795-2020-0031).
Метод б. К смеси 500 мг (1.99 ммоль) 1,6-ди-
аминопиридона 9а в 10 мл 96%-ного EtOH до-
КОНФЛИКТ ИНТЕРЕСОВ
бавляли избыток (2.0 мл, 26.6 ммоль) 37%-ного
Авторы заявляют об отсутствии конфликта
формалина, свободного от примеси параформа.
интересов.
Реакционную смесь кипятили 2 ч, затем фильтров-
СПИСОК ЛИТЕРАТУРЫ
ли через бумажный складчатый фильтр и оставля-
ли при комнатной температуре. Кристаллизация
1. Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A.,
продукта 12а наблюдается через 24 ч, через 72 ч
Shestopalov A.M., Senning A. // J. Sulfur Chem. 1992.
кристаллы отфильтровывали, промывали холод-
Vol. 13. N 1. P. 1. doi 10.1080/01961779208048951
2. Litvinov V.P. // Phosphorus, Sulfur, Silicon,
ным этанолом и сушили. Выход 150 мг (25%).
Relat. Elem. 1993. Vol. 74. N 1. P. 139. doi
Аналитические данные соответствуют таковым
10.1080/10426509308038105
для образца, полученного по методу а.
3. Литвинов В.П. // Изв. АН. Сер. xим. 1998. № 11.
7-(4-Метоксифенил)-5-оксо-1,5-дигидро-
С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998. Vol.
[1,2,4]триазоло[1,5-а]пиридин-6,8-дикарбони-
47. N 11. P. 2053. doi 10.1007/BF02494257
трил (14). К смеси 560 мг (1.99 ммоль) 1,6-ди-
4. Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. //
аминопиридона 9б, 340 мг (4.0 ммоль) 40%-ного
ХГС. 1999. № 5. С. 579; Litvinov V.P., Krivokolys-
водного раствор метиламина (d 0.9 г/мл) и 200 мг
ko S.G., Dyachenko V.D. // Chem. Heterocycl. Compd.
1999. Vol. 35. N 5. P. 509. doi 10.1007/BF02324634
(1.98 ммоль) Et3N в 12 мл 96%-ного EtOH добав-
5. Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7.
ляли избыток (2.0 мл, 26.6 ммоль) 37%-ного фор-
С. 645; Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75.
малина, свободного от примеси параформа. Реак-
N 7. P. 577. doi 10.1070/RC2006v075n07ABEH003619
ционную смесь кипятили 2 ч, затем фильтровали
6. Родиновская Л.А., Промоненков В.К., Шаранин Ю.А.,
через бумажный складчатый фильтр и оставляли
Литвинов В.П., Шестопалов А.М.. // Итоги науки и
при комнатной температуре. Через 24 ч раствор
техники. Серия Органическая химия. М.: ВИНИТИ,
подкисляли HCl до pH 5 (ввиду выраженной осо-
1989. Т. 17. С. 3.
бенности производных 1,5-дигидро[1,2,4]триазо-
7. Литвинов В.П., Промоненков В.К., Шаранин Ю.А.,
ло[1,5-а]пиридин-6,8-дикарбонитрила к образова-
Шестопалов А.М // Итоги науки и техники. Серия
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
65
Органическая химия. М.: ВИНИТИ, 1989. Т. 17.
Krivokolysko S.G. // Russ. J. Org. Chem. 2014. Vol. 50.
С. 72.
N 12. P. 1804. doi 10.1134/S107042801412015X
8.
El-Sayed H.A., Moustafa A.H., Said S.A., Assy M.G.,
18.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
Amr A.E.-G.E. // Synth. Commun. 2018. Vol. 48. N 20.
ХГС. 2007. № 11. C. 1709; Dotsenko V.V., Krivokolys-
P. 2615. doi 10.1080/00397911.2018.1496262
ko S.G., Litvinov V.P. // Chem. Heterocycl. Compd.
9.
Salem M.A., Helel M.H., Gouda M.A., Ammar Y.A., El-
2007. Vol. 43. N 11. P. 1455. doi 10.1007/s10593-007-
Gaby M.S.A. // Synth. Commun. 2018. Vol. 48, N 4. P.
0224-5
345. doi 10.1080/00397911.2017.1394468
19.
Доценко В.В., Суйков С.Ю., Пехтерева Т.М., Кри-
10.
Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
воколыско С.Г. // ХГС. 2013. № 7. C. 1082; Dotsen-
ХГС. 2015. Т. 51. № 2. С. 109; Dotsenko V.V., Fro-
ko V.V., Suikov S.Yu., Pekhtereva T.M., Krivokolys-
lov K.A., Krivokolysko S.G. // Chem. Heterocycl.
ko S.G. // Chem. Heterocycl. Compd. 2013. Vol. 49.
Compd. 2015. Vol. 51. N 2. P. 109. doi 10.1007/s10593-
N 7. P. 1009. doi 10.1007/s10593-013-1339-5
015-1668-7
20.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
11.
Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
Изв. АН. Сер. хим. 2012. № 1. С. 134; Dotsenko V.V.,
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв. АН.
Krivokolysko S.G., Litvinov V.P. // Russ. Chem. Bull.
Сер. Хим. 2019. № 4. С. 691; Dotsenko V.V., Frolov
2012. Vol. 61. N 1. P. 136. doi 10.1007/s11172-012-
K.A., Chigorina E.A., Khrustaleva A.N., Bibik E.Yu.,
0019-4
Krivokolysko S.G. // Russ. Chem. Bull. 2019. Vol. 68.
21.
Фролов К.А., Доценко В.В., Кривоколыско С.Г., Зу-
N 4. P. 691. doi 10.1007/s11172-019-2476-5
батюк Р.И., Шишкин О.В. // ХГС 2013. № 3. C. 507;
12.
Доценко В.В., Фролов К.А., Кривоколыско С.Г., Чи-
Frolov K.A., Dotsenko V.V., Krivokolysko S.G., Zuba-
горина Е.А., Пехтерева Т.М., Суйков С.Ю., Папа-
tyuk R.I., Shishkin O.V. // Chem. Heterocycl. Compd.
янина Е.С., Дмитриенко А.О., Бушмаринов И.С. //
2013. Vol. 49. N 3. P. 472. doi 10.1007/s10593-013-
ХГС. 2016. Т. 52. № 2. C. 116; Dotsenko V.V., Fro-
1270-9.
lov K.A., Krivokolysko S.G., Chigorina E.A., Pekhtere-
22.
Фролов К.А., Доценко В.В., Кривоколыско С.Г. //
va T.M., Suykov S.Yu., Papayanina E.S., Dmitrienko A.O.,
Изв. АН. Сер. хим. 2013. № 6. С. 1401; Frolov K.A.,
Bushmarinov I.S. // Chem. Heterocycl. Compd. 2016.
Dotsenko V.V., Krivokolysko S.G. // Russ. Chem. Bull.
Vol. 52. N 2. P. 116. doi 10.1007/s10593-016-1843-5
2013. Vol. 62. N 6. P. 1401. doi 10.1007/s11172-013-
13.
Чигорина Е.А., Фролов К.А., Доценко В.В., Головеш-
0201-3
кин А.С., Бушмаринов И.С., Кривоколыско С.Г. //
23.
Хрусталева А.Н., Доценко В.В., Кривоколыско С.Г. //
Изв. АН Сер. хим. 2016. № 9. С. 2260; Chigorina E.A.,
ЖОрХ. 2016. Т. 52. № 9. С. 1367; Khrustaleva A.N.,
Frolov K.A., Dotsenko V.V., Goloveshkin A.S., Bushmari-
Dotsenkо V.V., Krivokolysko S.G. // Russ. J. Org.
nov I.S., Krivokolysko S.G. // Russ. Chem. Bull. 2016.
Chem. 2016. Vol. 52. N 9. P. 1368. doi 10.1134/
Vol. 65. N 9. P. 2260. doi 10.1007/s11172-016-1576-8
S1070428016090232
14.
Хрусталева А.Н., Фролов К.А., Доценко В.В., Ак-
24.
Orlov A.A., Eletskaya A.A., Frolov K.A., Golinets A.D.,
сенов Н.А., Аксенова И.В., Кривоколыско С.Г. //
Palyulin V.A., Krivokolysko S.G., Kozlovskaya L.I.,
ХГС. 2017. Т. 53. № 8. C. 887; Khrustaleva A.N., Fro-
Dotsenko V.V., Osolodkin D.I. // Arch. Pharm. 2018. Vol.
lov K.A., Dotsenko V.V. , Aksenov N.A., Aksenova I.V.,
351. N 6. Article 1700353. doi 10.1002/ardp.201700353
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2017.
25.
Osolodkin D.I., Kozlovskaya L.I., Dueva E.V., Dotsen-
Vol. 58. N 8. P. 887. doi 10.1007/s10593-017-2140-7
ko V.V., Rogova Y.V., Frolov K.A., Krivokolysko S.G.,
15.
Khrustaleva A.N., Frolov K.A., Dotsenko V.V.,
Romanova E.G., Morozov A.S., Karganova G.G.,
Aksenov N.A., Aksenova I.V., Krivokolysko S.G. //
Palyulin V.A., Pentkovski V.M., Zefirov N.S. // ACS Med.
Tetrahedron Lett. 2017. Vol. 58. P. 4663. doi 10.1016/j.
Chem. Lett. 2013. Vol. 4. N 9. P. 869. doi 10.1021/
tetlet.2017.10.069
ml400226s
16.
Хрусталева А.Н., Фролов К.А., Доценко В.В., Дми-
26.
Dotsenko V.V., Frolov K.A., Pekhtereva T.M.,
триенко А.O., Бушмаринов И. С., Кривоколыско С.Г. //
Papaianina O.S., Suikov S.Yu., Krivokolysko S.G. // ACS
ХГС. 2014. № 1. C. 52; Khrustaleva A.N., Frolov K.A.,
Comb. Sci. 2014. Vol. 16. N 10. P. 543. doi 10.1021/
Dotsenkо V.V., Dmitrienko A.O., Bushmarinov I.S.,
co5000807
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2014.
27.
Доценко В.В., Чигорина Е.А., Кривоколыско С.Г.
Vol. 50. N 1. P. 46. doi 10.1007/s10593-014-1447-x
// ЖОХ. 2020. Т. 90. № 8. С. 1199; Dotsenko V.V.,
17.
Хрусталева А.Н., Фролов К.А., Доценко В.В.,
Chigorina E.A., Krivokolysko S.G. // Russ. J. Gen.
Кривоколыско С.Г. // ЖОрХ. 2014. Т.50. № 12.
Chem. 2020. Vol. 90. N. 8. P. 1411. doi 10.1134/
С. 1823; Khrustaleva A.N., Frolov K.A., Dotsenkо V.V.,
S107036322008006X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
66
ДОЦЕНКО и др.
28.
Доценко В.В., Кривоколыско С.Г., Чигорина Е.А. //
46.
Mohamed K.S., Tawfik E.H., Dardeer H.M., Fadda A.A. //
ЖОХ. 2020. Т. 90. № 4. С. 522; Dotsenko V.V.,
Acta Chim. Slov. 2018 Vol. 65. N 4. P. 787. doi
Krivokolysko S.G., Chigorina E.A. // Russ. J. Gen.
10.17344/acsi.2018.4294
Chem. 2020. Vol. 90. N 4. P. 590. doi 10.1134/
47.
Keerthy H.K., Mohan S., Bharathkumar H., Rangappa S.,
S1070363220040052
Svensson F., Bender A., Mohan C.D., Rangappa K.S.,
29.
Bondock S., Tarhoni A.E.G., Fadda A.A. // Arkivoc.
Bhatnagar R. // Chem. Biodivers. 2019. Vol. 16. N 9.
2006. Vol. 9. P. 113. doi 10.3998/ark.5550190.0007.905
Pap. N e1900234. doi 10.1002/cbdv.201900234
30.
Ibrahim M.A., El-Gohary N.M. // Heterocycles. 2014.
48.
Mohamed M.S., Zaki M.E., Khalifa Ν.M., Zohny Υ.M. //
Vol. 89. N 5. P. 1125. doi 10.3987/REV-13-790
Heterocycl. Commun. 2008. Vol. 14. N 5. P. 345. doi
31.
Yang J., Li Q., Zhang J., Lin W., Wang J., Wang Y.,
10.1515/HC.2008.14.5.345
Huang Z., Shi D. // Molecules. 2013. Vol. 18. N 12.
49.
Safaei-Ghomi J., Shahbazi-Alavi H., Saberi-Mogha-
dam M.R., Ziarati A. // Iran. J. Catal. 2014. Vol. 4.
P.14519. doi 10.3390/molecules181214519
N 4. P. 289.
32.
Soto J.L., Seoane C., Zamorano P., Cuadrado F.J. //
50.
Khalifa N.M., Naglah A.M., Al-Omar M.A., Amr A.E. //
Synthesis. 1981. N 7. P. 529. doi 10.1055/s-1981-29512
Asian J. Chem. 2014. Vol. 26. N 23. P. 8185. doi
33.
Hosseini H., Bayat M. // RSC Adv. 2018. Vol. 8. N 48.
10.14233/ajchem.2014.17869
P. 27131. doi 10.1039/C8RA05690K
51.
Fathy N.M., Elgemeie G.H. // J. Chem. Eng. Data. 1988.
34.
Babaee S., Zarei M., Sepehrmansourie H., Zolfigol
Vol. 33. N 2. P. 218. doi 10.1021/je00052a046
M.A., Rostamnia S. // ACS Omega. 2020. Vol. 5. N 12.
52.
Fadda A.A., Refat H.M., Mohamed K.S. // Heterocycles.
P. 6240. doi 10.1021/acsomega.9b02133
2014. Vol. 89. N 10. P. 2318. doi 10.3987/COM-14-
35.
Kshiar B., Shangpliang O.R., Myrboh B. // Synth.
13072
Commun. 2018. Vol. 48. N 14. P. 1816. doi
53.
Ali T.E., Ibrahim M.A. // J. Braz. Chem. Soc.
10.1080/00397911.2018.1468467
2010. Vol. 21. N 7. P. 1007. doi 10.1590/S0103-
36.
Abdel Latif F.F., Mekheimer R., Ahmed E.K., Abdel
50532010000600010
Aleem T.B. // Pharmazie. 1993. Vol. 48. N 10. P. 736.
54.
Harb A.A. // Chem. Pap. 2004. Vol. 58. N 4. P. 260.
doi 10.24355/dbbs.084-201901181427-0.
55.
Abdel-Monem W.R. // Chem. Pap. 2004. Vol. 58. N 4.
37.
Safaei-Ghomi J., Esmaili S., Teymuri R., Shahbazi-
P. 276.
Alavi H. // Org. Prep. Proced. Int. 2019 Vol. 51. N 4.
56.
Mekheimer R.A., Sayed A.A., Ahmed E.A. // J. Med.
P. 388. doi 10.1080/00304948.2019.1615365
Chem. 2012. Vol. 55. N 9. P. 4169. doi 10.1021/
38.
Safaei-Ghomi J., Shahbazi-Alavi H., Ziarati A. // Res.
jm2014315
Chem. Intermed. 2017. Vol. 43. N 1. P. 91. doi 10.1007/
57.
Dugan B.J., Gingrich D.E., Mesaros E.F., Milkie-
s11164-016-2608-6
wicz K.L., Curry M.A., Zulli A.L., Dobrzanski P.,
39.
Safaei-Ghomi J., Saberi-Moghadam M.R., Shahbazi-
Serdikoff C., Jan M., Angeles T.S., Albom M.S.,
Alavi H., Asgari-Kheirabadi M. // J. Chem. Res. 2014.
Mason J.L., Aimone L.D., Meyer S.L., Huang Z., Wells-
Vol. 38. N 10. P. 583. doi 10.3184/174751914X14109
Knecht K.J., Ator M.A., Ruggeri B.A., Dorsey B.D. // J.
743944636
Med. Chem. 2012. Vol. 55. N 11. P. 5243. doi 10.1021/
40.
Srour A.M., Fahmy H.H., Khater M.A., El-Manawaty M.A.,
jm300248q
Shalaby E.M. // Monatsh. Chem. 2018. Vol. 149. N 6.
58.
Oguro Y., Cary D.R., Miyamoto N., Tawada M., Iwata H.,
P.1137. doi 10.1007/s00706-018-2153-7
Miki H., Hori A., Imamura S. // Bioorg. Med.
41.
Assiri M.A., Abdel-Kariem S.M., Ali T.E., Yahia I.S. //
Chem. 2013. Vol. 21. N 15. P. 4714. doi 10.1016/j.
Arkivoc. 2018. Vol. 5. P. 240. doi 10.24820/
bmc.2013.04.042
ark.5550190.p010.478
59.
Luo Y., Hu Y. // Arch. Pharm. 2006. Vol. 339. N 5.
42.
Elmoghayar M.R., El-Agamey A.G., Nasr M.Y., Sal-
P. 262. doi 10.1002/ardp.200500227
lam M.M. // J. Heterocycl. Chem. 1984. Vol. 21. N 6.
60.
Girgis A.S., Barsoum F.F. // Eur. J. Med. Chem. 2009.
P. 1885. doi 10.1002/jhet.5570210660
Vol. 44. N 5. P. 1972. doi 10.1016/j.ejmech.2008.09.049
43.
Ranjbar-Karimi R., Darehkordi A., Bahadornia F.,
61.
Tomassoli I., Gündisch D. // Curr. Top. Med. Chem.
Poorfreidoni A. // J. Heterocycl. Chem. 2018. Vol. 55.
2016. Vol. 16. N 11. P. 1314. doi 10.2174/1568026615
N 11. P. 2516. doi 10.1002/jhet.3283
666150915111434
44.
Tahmasby M., Darehkordi A., Mohammadi M.,
62.
Comba P., Kerscher M., Rück K., Starke M. // Dalton
Nejadkhorasani F. // J. Mol. Struct. 2021. Vol. 1224.
Trans. 2018. Vol. 47. N 28. P. 9202. doi 10.1039/
Pap. N 129032. doi 10.1016/j.molstruc.2020.129032
C8DT01108G
45.
Basyouni W.M. // Acta Chim. Slov. 2003. Vol. 50. N 2.
63.
Breuning M., Steiner M. // Synthesis. 2008. Vol .2008.
P. 223.
N 18. P. 2841. doi 10.1055/s-2008-1067241
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
ПРОИЗВОДНЫЕ 1,6-ДИАМИНО-2-ОКСОПИРИДИН-3,5-ДИКАРБОНИТРИЛА
67
64.
Nonat A.M., Roux A., Sy M., Charbonnière L.J. // Dalton
Trans. 2019. Vol. 48. N 44. P. 16476. doi 10.1039/
com/antibac/
C9DT03480C
73. Daina A., Michielin O., Zoete V. // Sci. Rep. 2017. Vol. 7.
65.
Mukherjee G., Sastri C.V. // Israel J. Chem. 2020.
Article N 42717. doi 10.1038/srep42717
Vol. 60. P. 1032. doi 10.1002/ijch.202000045
74. Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
66.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3.
N 11. P. 3099. doi 10.1021/ci300367a
P. 4. doi 10.1016/S0169-409X(96)00423-1
75. Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
67.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
68.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
76. GalaxyWEB. A web server for protein structure
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4.
prediction, refinement, and related methods.
doi 10.1016/j.addr.2012.09.019
Computational Biology Lab, Department of Chemistry,
69.
Sander T. OSIRIS Property Explorer. http://
seoklab.org/index.html
Pharmaceuticals Ltd, Switzerland.
77. Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res.
70.
PASS Online. Laboratory for Structure-Function
2012. Vol. 40. N W1. P. W294. doi 10.1093/nar/gks493.
Based Drug Design, Institute of Biomedical Chemistry
78. Bachmann M., Möröy T. // Int. J. Biochem. Cell
Biol. 2005. Vol. 37. N 4. P. 726. doi 10.1016/j.
passonline/predict.php.
biocel.2004.11.005
71.
Филимонов Д.А., Лагунин А.А., Глориозова Т.А., Ру-
79. Gorobets N.Y., Yousefi B.H., Belaj F., Kappe C.O. //
дик А.В., Дружиловский Д.С., Погодин П.В., Порой-
Tetrahedron. 2004. Vol. 60. N 39. P. 8633. doi 10.1016/j.
ков В.В. // ХГС. 2014. № 3. С. 483; Filimonov D.A.,
tet.2004.05.100
Lagunin A.A., Gloriozova T.A., Rudik A.V., Druzhilov-
80. Callejo M.J., Lafuente P., Martín-León N., Quinteiro M.,
skii D.S., Pogodin P.V., Poroikov V.V. // Chem.
Seoane C., Soto J.L. // J. Chem. Soc. Perkin Trans 1.
Heterocycl. Compd. 2014. Vol. 50. N 3. P. 444. doi
1990. N 6. P. 1687. doi 10.1039/P19900001687
10.1007/s10593-014-1496-1
81. Hadi A., Martin N., Seoane C., Soto J.L., Albert A.,
72.
Way2Drug. antiBac-Pred. Laboratory for Structure-
Cano F. // J. Heterocycl. Chem. 1992 Vol. 29. N 5.
Function Based Drug Design, Institute of Biomedical
P. 1229. doi 10.1002/jhet.5570290531
1,6-Diamino-2-oxopyridine-3,5-dicarbonitrile Derivatives
in the Mannich Reaction
V. V. Dotsenkoa,b,*, A. N. Khrustalevac, K. A. Frolova, N. A. Aksenovb,
I. V. Aksenovab, and S. G. Krivokolyskoa
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
c Peoples’ Friendship University of Russia, Moscow, 117198 Russia
*e-mail: victor_dotsenko_@mail.ru
Received October 17, 2020; revised October 17, 2020; accepted October 28, 2020
1,6-Diamino-2-oxo-1,2,3,4-tetrahydropyridine-3,5-dicarbonitriles under the action of primary aliphatic
amines and an excess of 37% formalin in ethanol were converted into 2,3,8,9-tetrahydro-6,10-methano[1,2,4]-
triazolo[1,5-a][1,5]diazocine-6,10(7H)-dicarbonitrile derivatives. At the same time, the Mannich reaction in the
case of 1,6-diamino-4-aryl-2-oxo-1,2-dihydropyridine-3,5-dicarbonitriles proceeds ambiguously, and, depending
on the conditions, gives either N-ethoxymethylation products or 1,2,4-triazolo[1,5-a]pyridine derivatives. In
silico predictive analysis of the biological activity of new compounds was carried out.
Keywords: 2-cyanoacethydrazide, aminomethylation, Mannich reaction, 1,2,4-triazolo[1,5-a]pyridines, 3,7-di-
azabicyclo[3.3.1]nonanes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021