ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 85-90
УДК 547.1;547.233;547.235;547.794
РЕАКЦИЯ ДИЭТИЛХЛОРЭТИНИЛФОСФОНАТА
С 3-АМИНО-1,2,4-ТРИАЗОЛАМИ
© 2021 г. А. С. Крылова, В. В. Толстякова, В. В. Гуржийb, А. В. Догадинаа,*
а Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: dog_alla@mail.ru
Поступило в Редакцию 2 декабря 2020 г.
После доработки 2 декабря 2020 г.
Принято к печати 12 декабря 2020 г.
Реакцией диэтилхлорэтинилфосфоната с 2-замещенными 3-амино-1,2,4-триазолами с последующей
5-эндо-диг-циклизацией получены новые 6-фосфонилированные 1H-имидазо[2,1-c][1,2,4]триазолы.
Установлено, что наличие атома брома в положении 5 исходного 1,2,4-триазола полностью меняет хе-
моселективность реакции, приводя к образованию соответствующего симметричного амидина, диэтил-
{2-[(3-бром-1-метил-1H-1,2,4-триазол-5-ил)амино]-2-[(3-бром-1-метил-1H-1,2,4-триазол-5-ил)имино]-
этил}фосфоната.
Ключевые слова: хлорэтинфосфонат, 3-амино-1,2,4-триазолы, имидазотриазолы, фосфорилирование
DOI: 10.31857/S0044460X2101008X
Конденсированные полиядерные азотсодержа-
Существующие подходы к синтезу имида-
щие гетероциклические соединения привлекают
зотриазолов состоят в построении бициклической
большое внимание вследствие их разнообразной
системы, исходя из 3-амино-1,2,4-триазола. Тра-
биологической активности. Имеются сведения о
диционно образование имидазольного фрагмента
основано на использовании α-галогенкетонов [11].
фармакологическом потенциале имидазотриазо-
Мультикомпонентная реакция Гребке-Блэкберна
льного каркаса, присутствие которого в структуре
между 3-амино-1,2,4-триазолами, альдегидами и
обусловливает наличие противораковых [1, 2], ан-
алифатическими изонитрилами успешно приме-
тиоксидантных [3], противомикробных [4] и про-
няется для получения N-алкилиден-4H-имида-
тивовоспалительных свойств [5].
зо[1,2-b][1,2,4]триазол-6-аминов [12, 13]. Взаимо-
Как известно, фосфонаты обладают высокой
действие 5-диазоимидазолов с нитро-, галоген- и
способностью подавлять многие важные биохи-
ацетиламиномалоновыми эфирами с последую-
мические реакции, имитируя эфиры фосфорных и
щей циклизацией приводит к образованию имида-
карбоновых кислот в различных метаболических
зо[5,1-c][1,2,4]триазолов [14].
процессах [6-8]. Особый интерес представляют
С целью синтеза биологически релевантных
фосфорсодержащие гетероциклические соедине-
гетероциклических структур с одновременной
ния, поскольку они проявляют широкий спектр
функционализацией их фосфорсодержащими
биологической активности [9, 10]. В связи с этим,
заместителями мы исследовали реакцию диэ-
синтез новых азагетероциклических фосфонатов,
тилхлорэтинилфосфоната 2 с 3-амино-1,2,4-триа-
содержащих имидазотриазольный фрагмент, явля-
золами 1а-е (схема 1).
ется актуальной задачей, так как данные соедине-
Реакция проходит при комнатной температуре
ния могут найти применение в качестве перспек-
в среде ацетонитрила в присутствии K2CO3 как
тивных объектов для дизайна на их основе новых
акцептора хлористого водорода, приводя к обра-
лекарственных препаратов.
зованию диэтил-1Н-имидазо[2,1-c][1,2,4]триазол-
85
86
КРЫЛОВ и др.
Схема 1.
5-илфосфонатов 3а-е с высокими выходами. Кон-
протонов имидазольного фрагмента наблюдается
троль за ходом реакции осуществляли с помощью
в основном в виде синглета в области 7.65 м. д.
спектроскопии ЯМР на ядрах 31P, что позволило
Однако в некоторых случаях (соединения 3д, е)
подобрать оптимальные условия (см. таблицу).
наблюдается малая константа спин-спинового вза-
Установлено, что наилучшая регио- и хемоселек-
имодействия (3JHP 1.3 Гц) с ядром атома фосфора,
тивность наблюдается при кипячении исходных
что является достаточно редким случаем для ана-
реагентов в CCl4 в присутствии K2CO3. Продукты
логичных шестичленных соединений [15]. Протон
реакции выделяли с помощью колоночной хрома-
триазольного цикла регистрируется в виде син-
тографии на силикагеле (элюент - 1%-ный MeOH
глета при 8.0 м. д. В спектрах ЯМР 13С сигналы
в CH2Cl2). Фосфонаты 3а-в, д, е представляют со-
атомов углерода имидазольного цикла проявля-
бой желтоватые вязкие маслообразные вещества.
ются в слабом поле с характерными константами
Фосфонат 3г - бесцветное кристаллическое веще-
спин-спинового взаимодействия с ядром фосфора
ство с температурой плавления 125-126°C.
1JCP 236.8, 2JCP 36.7, 3JCP 26.9 Гц. Для отнесения
сигналов в спектрах ЯМР 1H, 13C использовали
Строение соединений полученных соединений
методы двумерной гетероядерной спектроскопии
подтверждено данными спектроскопии ЯМР 1Н,
ЯМР HMBC (схема 2).
13С, 31Р с применением методов корреляционной
гетероядерной спектроскопии (1Н-13С HSQC и
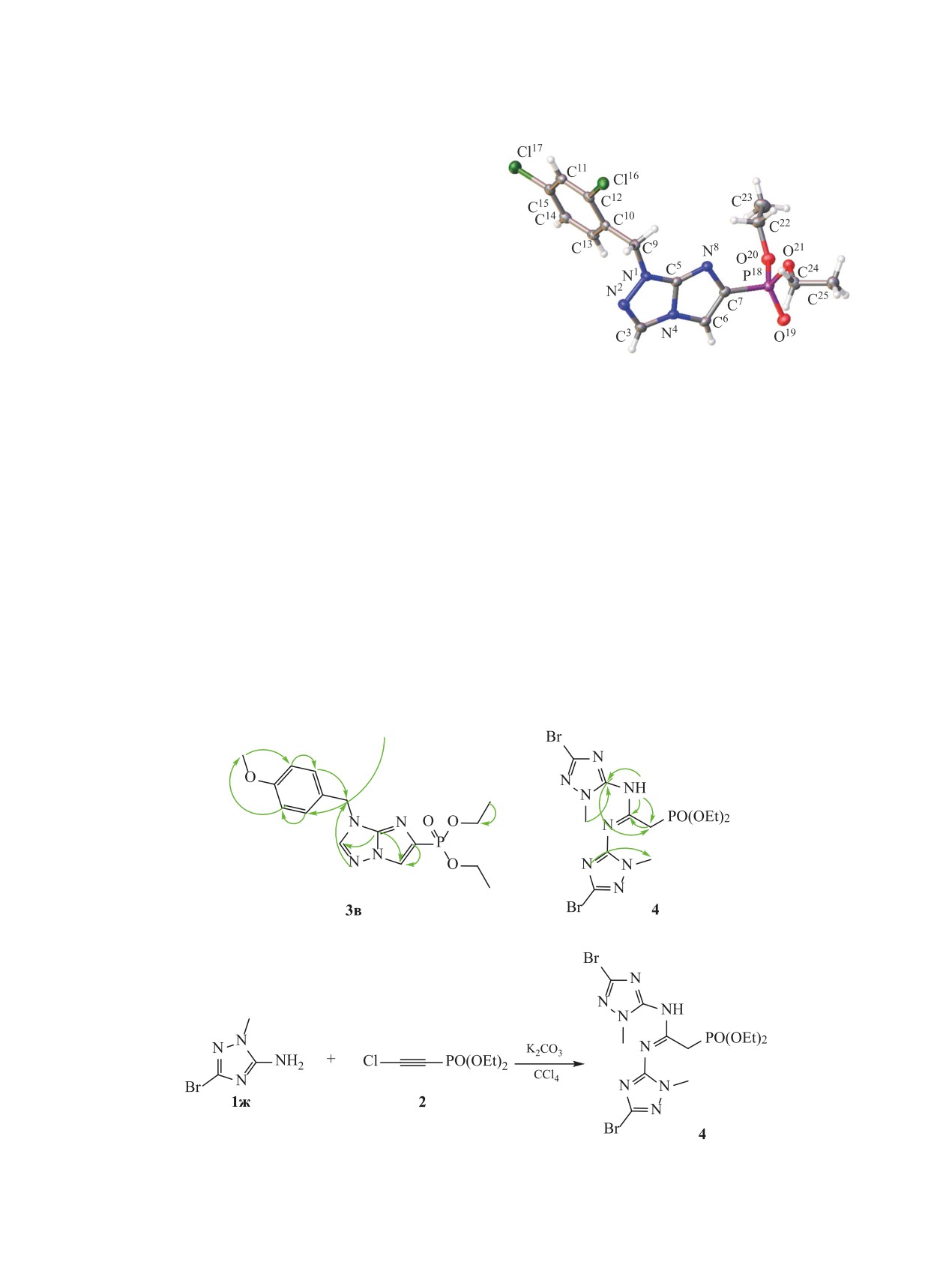
Однозначно строение фосфорилированных
HMBC) и масс-спектрометрии высокого разре-
имидазотриазолов 3а-е подтверждено данными
шения (HRMS-ESI). Химический сдвиг фосфора
рентгеноструктурного анализа на примере соеди-
нения 3г (см. рисунок).
имидазотриазолов 3а-е находится в области 10.2-
10.7 м. д., что свидетельствует о связи фосфонат-
На примере 2-аминопиридинов нами было ра-
ной группы с углеродом sp2-гибридизации. Сигнал
нее показано [15], что наличие атома брома ря-
Влияние условий реакции на выход имидазотриазолов 3а-е
№
Растворитель
Температура, °C
Время, ч
Конверсия фосфоната 2, %a
Выход, %a
1
CH3CN
20-25
48
<5
Следы
2
CH3CN
82
24
>95
64
3
CCl4
77
24
>95
92
4
Толуол
80
24
>95
86
5
CH3OH
65
12
>99
32
6
ДМФА
80
8
>99
43
а По данным спектроскопии ЯМР 31P.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
РЕАКЦИЯ ДИЭТИЛХЛОРЭТИНИЛФОСФОНАТА
87
дом с эндоциклическим атомом азота затрудняет
циклизацию. В случае использования в реакции
с диэтилхлорэтинилфосфонатом
2 пятичлен-
ных
5-бром-гетероциклических аминов также
наблюдается изменение хемоселективности ре-
акции. Так, при введении в реакцию 3-амино-
5-бром-1,2,4-триазола 1ж наблюдалось образова-
ние соответствующего амидина 4 (схема 3). Такое
направление реакции [16] обычно реализуется в
результате образования промежуточного инами-
на, последующей его изомеризации в кетенимин
и присоединении еще одной молекулы амина 1ж.
Общий вид молекулы соединения 3г в кристалле
(CCDC 2046366).
Химический сдвиг фосфора соединения
4
(20.95 м. д.) находится в характерной области для
реакцией хлорэтинилфосфоната с 2-замещенными
алкилфосфонатов. Сигнал протонов метиленовой
3-амино-1,2,4-триазолами.
группы наблюдается в виде дублета при 3.87 м. д.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
с КССВ от ядра фосфора 2JHP 20.2 Гц. Протоны
двух метильных групп в триазольных кольцах ре-
Спектры ЯМР 1Н, 13С, 31Р сняты на спектроме-
зонируют синглетом при 3.84 м. д. В слабом поле
тре Bruker Avance III HD 400 NanoBay на рабочих
регистрируется сигнал протона NH амидинового
частотах 400.17, 100.63 и 162.01 МГц соответствен-
фрагмента (12.3 м. д.). Определенные молекуляр-
но в растворе CDCl3. Химические сдвиги фосфора
ные массы продуктов соответствуют рассчитан-
приведены относительно внешнего стандарта -
ным значениям.
85%-ной фосфорной кислоты. Для отнесения сиг-
Таким образом, показана возможность форми-
налов в спектрах ЯМР 1H, 13C использовали методы
рования конденсированных циклов, а именно 1-за-
двумерной гетероядерной спектроскопии HMBC.
мещенных диэтил-(1H-имидазо[2,1-c][1,2,4]триа-
ИК спектры записаны на спектрометре Shimadzu
зол-6-ил)фосфонатов, хемо- и региоселективной
IRAffinity-1 в таблетках KBr. Масс-спектры высо-
Схема 2.
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
88
КРЫЛОВ и др.
кого разрешения записаны на масс-спектрометре
Диэтил-{1-(4-метоксибензил)-1H-имида-
Bruker MicrOTOF при ионизации вещества распы-
зо[2,1-c][1,2,4]триазол-6-ил}фосфонат (3в). Вы-
лением в электрическом поле (ESI) (температура
ход 89%, желтоватое вязкое масло. ИК спектр,
ионизационной камеры - 180°С, напряжение ио-
ν, см-1: 732, 804, 964, 1018 (P-O-C), 1037, 1228
низации - 70 и 100 эВ). Температуры плавления
(P=O), 1601 (C=N), 2360, 2941. Спектр ЯМР 1H
измерена на столике Кофлера (VEB Wägetechnik
(CDCl3), δ, м. д. (J, Гц): 1.32 т (6Н, СН2СН3, 3JHH
7.1), 3.73 с (3H, OCH3), 4.06-4.27 м (4H, OCH2),
Rapido, PHMK
81/2969). Рентгеноструктурный
5.24 с (2H, CH2Ph), 6.80 д (2H, Ph-H3,5, 3JHH 8.6),
анализ выполнен на дифрактометре Rigaku Oxford
7.32 д (2H, Ph-H2,6, 3JHH 8.6), 7.61 с (1H, H3), 8.01
Diffraction XtaLab Synergy HyPix-6000 при 100 K.
с (1H, H5). Спектр ЯМР 13C (CDCl3), δС, м. д. (J,
Общая методика синтеза фосфонатов 3а-е, 4.
Гц): 16.31 д (3JCP 6.4), 51.43, 55.23, 62.59 д (2JCP
К раствору 1 ммоль 3-аминотриазола 1а-ж в 5 мл
5.5), 112.54 д (2JCP 36.7), 114.04, 129.86, 137.72 д
безводного четыреххлористого углерода добавля-
(1JCP 236.3), 152.65 д (3JCP 26.9), 159.57. Спектр
ли 1.1 ммоль свежепрокаленного K2CO3 и 1 ммоль
ЯМР 31P (CDCl3): δР 10.72 м. д. Масс-спектр
диэтилхлорэтинилфосфоната
2.
Реакционную
(HRMS-ESI), m/z: 365.1369 [M + H]+ (вычислено
смесь интенсивно перемешивали при кипении в
для C16H21N4O4P: 365.1373 [M + H]+).
течение 24 ч. По окончании реакции отфильтровы-
Диэтил-(1-(2,4-дихлорбензил)-1H-имида-
вали осадок неорганических солей, полученный
зо[2,1-c][1,2,4]триазол-6-ил)фосфонат
(3г).
раствор упаривали в вакууме. Остаток очищали
Выход 95%, бесцветные кристаллы, т. пл. 125-
колоночной хроматографией на силикагеле (элю-
126°C (гептан-CH2Cl2). ИК спектр, ν, см-1: 732,
ент - 1%-ный MeOH в CH2Cl2).
812, 973, 1012 (P-O-C), 1218 (P=O), 1456, 1622
Диэтил-(1-метил-1H-имидазо[2,1-c][1,2,4]-
(C=N), 2948, 3439. Спектр ЯМР 1H (CDCl3), δ, м. д.
триазол-6-ил)фосфонат (3а). Выход 87%, желто-
(J, Гц): 1.37 т (6Н, СН2СН3, 3JHH 7.1), 4.12-4.32 м
ватое вязкое масло. ИК спектр, ν, см-1: 732, 802,
(4H, OCH2), 5.47 с (2H, CH2Ph), 7.16-7.26 м (2H,
858, 962, 1016 (P-O-C), 1229 (P=O), 1440, 1616
Ph-H5,6), 7.44 д (1H, Ph-H3, 4JHH 1.9), 7.69 c (1H,
(C=N), 2983, 3441. Спектр ЯМР 1H (CDCl3), δ, м. д.
H3), 8.08 с (1H, H5). Спектр ЯМР 13C (CDCl3), δС, м.
(J, Гц): 1.32 т (6Н, СН2СН3, 3JHH 7.1), 3.86 с (3H,
д. (J, Гц): 16.36 д (3JCP 6.4), 48.89, 62.68 д (2JCP 5.5),
112.66 (2JCP 36.6), 126.34, 127.41, 129.64, 130.71,
NCH3), 4.08-4.24 м (4H, ОСН2), 7.65 с (1H, H3),
131.44, 134.17, 134.92, 138.29 д (1JCP 236.4), 152.75
8.04 с (1H, H5). Спектр ЯМР 13C (CDCl3), δС, м. д.
(3JCP 26.8). Спектр ЯМР 31P (CDCl3): δР 10.30 м. д.
(J, Гц): 16.30 д (3JCP 6.5), 35.00, 62.60 д (2JCP 5.6),
Масс-спектр (HRMS-ESI), m/z:
403.0487
[M +
112.67 д (2JCP 36.8), 125.50, 137.69 д (1JCP 236.8),
H]+ (вычислено для C15H17Cl2N4O3P:
403.0488
153.01 д (3JCP 26.9). Спектр ЯМР 31P (CDCl3): δР
[M + H]+). Кристаллы соединения 3г ромбические,
10.67 м. д. Масс-спектр (HRMS-ESI), m/z: 259.0956
C15H17Cl2N4O3P, Pbca, a 8.38490(11), b 14.8465(2),
[M + H]+ (вычислено для C9H15N4O3P: 259.0955
c 28.9122(4) Å, V 3599.18(9) Å3, Z 8, dвыч 1.488 г/см3,
[M + H]+).
μ(CuKα) 4.295 мм-1, F(000) 1664, R1 0.0296 и wR2
Диэтил-(1-бензил-1H-имидазо[2,1-c][1,2,4]-
0.0754 (для 3101 |Fo| ≥ 4σF), CCDC 2046366.
триазол-6-ил)фосфонат (3б). Выход 92%, желто-
Диэтил-(1-(тетрагидро-2H-пиран-2-ил)-
ватое вязкое масло. ИК спектр, ν, см-1: 783, 815,
1H-имидазо[2,1-c][1,2,4]триазол-6-ил)фосфонат
829, 875, 1003 (P-O-C), 1248 (P=O), 1298, 1404,
(3д). Выход 83%, желтоватое вязкое масло. ИК
1495, 1629 (C=N). Спектр ЯМР 1H (CDCl3), δ, м. д.
спектр, ν, см-1: 738, 814, 1012, 1043 (P-O-C), 1251
(J, Гц): 1.37 т (6Н, СН2СН3, 3JHH 7.1), 4.11-4.32 м
(P=O), 1338, 1637 (C=N). Спектр ЯМР 1H (CDCl3),
(4H, OCH2), 5.37 с (2H, CH2Ph), 7.29-7.48 м (3H,
δ, м. д. (J, Гц): 1.35 т (3H, CH2CH3, 3JHH 7.1), 1.36
C6H5), 7.66 с (1H, H3), 8.03 с (1H, H5). Спектр ЯМР
т (3H, CH2CH3, 3JHH 7.1), 1.53-1.79 м (3H, Hc,d,dʹ),
13C (CDCl3), δС, м. д. (J, Гц): 16.34 д (3JCP 6.4),
1.91-2.14 м (2H, Hb,cʹ), 2.41-2.58 м (1H, Hbʹ), 3.67-
51.96, 62.63 д (2JCP 5.5), 112.51 д (2JCP 36.7), 125.90,
3.82 м (1H, He), 4.01-4.11 м (1H, Heʹ), 4.11-4.32 м
128.37, 128.76, 135.20, 138.02 д (1JCP 236.2), 152.79
(4H, CH2CH3), 5.62 д. д (1H, CHa, 3Jaa 10.5, 3Jae 2.4),
д (3JCP 27.0). Спектр ЯМР 31P (CDCl3): δР 10.61 м. д.
7.66 д (1H, H3, 3JHP 1.3), 8.07 c (1H, H5). Спектр
Масс-спектр (HRMS-ESI), m/z: 335.1275 [M + H]+
ЯМР 13C (CDCl3), δС, м. д. (J, Гц): 16.32 д (3JCP
(вычислено для C14H20N4O3P: 335.1268 [M + H]+).
6.6), 16.35 д (3JCP 6.2), 22.66, 24.71, 28.92, 62.57 д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
РЕАКЦИЯ ДИЭТИЛХЛОРЭТИНИЛФОСФОНАТА
89
(2JCP 6.1), 62.63 д (2JCP 6.1), 68.10, 84.15, 112.48 д
КОНФЛИКТ ИНТЕРЕСОВ
(2JCP 36.3), 126.56, 137.65 д (1JCP 236.6), 152.10 д
Авторы заявляют об отсутствии конфликта
(3JCP 27.1). Спектр ЯМР 31P (CDCl3): δР 10.50 м. д.
интересов.
Масс-спектр (HRMS-ESI), m/z: 351.1190 [M + H]+
СПИСОК ЛИТЕРАТУРЫ
(вычислено для C13H21N4O4P: 351.1193 [M + Na]+).
Диэтил-(1-(2-гидроксиэтил)-1H-имида-
1.
Fascio M.L., Errea M.I., D’Accorso N.B. // Eur.
зо[2,1-c][1,2,4]триазол-6-ил)фосфонат
(3е).
J. Med. Chem. 2015. Vol. 90. P. 666. doi 10.1016/j.
Выход 85%, желтоватое вязкое масло. ИК спектр,
ejmech.2014.12.012
2.
Hassan A.Y., El Deeb M.A., Sarg M.T., El Rabeeb S.I. //
ν, см-1: 798, 1043 (P-O-C), 1232 (P=O), 1573, 1651
Tetrahedron. 2020. Vol. 76. N 23. P. 131218. doi
(C=N), 2360, 3273, 3419. Спектр ЯМР 1H (CDCl3),
10.1016/j.tet.2020.131218
δ, м. д. (J, Гц): 1.32 т (6Н, СН2СН3, 3JHH 7.1), 4.03-
3.
Sayed H.H., Morsy E.M.H., Flefel E.M. // Synth.
4.11 м (2H, CH2OH), 4.09-4.25 м (4H, OCH2), 4.28-
Commun.
2010. Vol.
40. P.
1360. doi
4.35 м (2H, NCH2), 7.66 д (1H, H3, 3JHP 1.3), 8.12 с
10.1080/00397910903079631
(1H, H5). Спектр ЯМР 13C (CDCl3), δС, м. д. (J, Гц):
4.
Aouali M., Mhalla D., Allouche F., El Kaim L., Tounsi S.,
16.30 д (3JCP 6.5), 51.64, 60.04, 62.72 д (2JCP 5.5),
Trigui M., Chabchoub F. // Med. Chem. Res. 2015.
112.66 д (2JCP 36.1), 126.05, 137.34 д (1JCP 236.1),
Vol. 24. P. 2732. doi 10.1007/s00044-015-1322-z
152.87 д (3JCP 26.6). Спектр ЯМР 31P (CDCl3): δР
5.
Huang Y., Hu X.-Q., Shen D.-P., Chen Y.-F., Xu P.-F. //
10.21 м. д. Масс-спектр (HRMS-ESI), m/z: 311.0865
Mol. Divers. 2007. Vol. 11. P. 73. doi 10.1007/s11030-
[M + H]+ (вычислено для C10H17N4O4P: 311.0880
007-9059-3
[M + Na]+).
6.
Horsman G.P., Zechel D.L. // Chem. Rev. 2017. Vol. 117.
N 8. P. 5704. doi 10.1021/acs.chemrev.6b00536
Диэтил-{2-[(3-бром-1-метил-1H-1,2,4-триа-
7.
Petkowski J.J., Bains W., Seager S. // Molecules. 2019.
зол-5-ил)амино]-2-[(3-бром-1-метил-1H-1,2,4-
Vol. 24. P. 866. doi 10.3390/molecules24050866
триазол-5-ил)имино]этил}фосфонат
(4).
Вы-
8.
Kafarski P. In: Biological Role of Phosphorus / Ed.
ход 82%, желтоватое вязкое масло. ИК спектр,
G. Churchill. London: IntechOpen, 2019. doi 10.5772/
ν, см-1: 712, 837, 962, 1030 (P-O-C), 1248 (P=O),
intechopen.87155
1417, 2936, 3482. Спектр ЯМР 1H (CDCl3), δ, м. д.
9.
Van der Jeught S., Stevens C.V. // Chem. Rev. 2009.
(J, Гц): 1.28 т (6Н, СН2СН3, 3JHH 7.1), 3.84 с (6H,
Vol. 109. N 6. P. 2672. doi 10.1021/cr800315j
NCH3), 3.87 д (2H, PCH2, 2JHP 20.2), 4.11-4.11 д. к
10.
Moonen K., Laureyn I., Stevens C.V. // Chem. Rev. 2004.
(4H, OCH2, 3JHH 7.2, 3JHP 7.2), 12.29 с (1H, NH).
Vol. 104. N 12. P. 6177. doi 10.1021/cr030451c
Спектр ЯМР 13C (CDCl3), δС, м. д. (J, Гц): 16.31 д
11.
Chernyshev V.M., Pyatakov D.A., Astakhov A.V., Soko-
(3JCP 6.2), 33.55 д (1JCP 131.1), 34.10, 34.69, 62.66 д
lov A.N., Fakhrutdinov A.N., Rybakov V.B., Cherny-
(2JCP 6.1), 134.71, 136.87, 148.61, 153.84 д (2JCP 8.2),
shev V.V. // Tetrahedron. 2015. Vol. 71. N 36. P. 6259.
155.49 д (4JCP 2.5 Гц). Спектр ЯМР 31P (CDCl3): δР
doi 10.1016/j.tet.2015.06.059
20.95 м. д. Масс-спектр (HRMS-ESI), m/z: 512.9763
12.
Parchinsky V.Z., V.V. Koleda, Shuvalova O., Kravchen-
[M + H]+ (вычислено для C12H19Br2N8O3P: 512.9757
ko D.V., Krasavin M. // Tetrahedron Lett. 2006. Vol. 47.
P. 6891. doi 10.1016/j.tetlet.2006.07.037
[M + H]+).
13.
Sadek K.U., Abdel-Hameed A.M., Abdelnabi H.A.
ФОНДОВАЯ ПОДДЕРЖКА
Meleigy Y. // Green Process Synth. 2019. Vol. 8. P. 297.
doi 10.1515/gps-2018-0093
Работа выполнена финансовой поддерж-
14.
Безматерных М.А., Мокрушин В.С., Поспелова Т.А. //
ке Министерства науки и высшего образования
ХГС. 1999. Т. 35. Вып. 11. С. 1544. Bezmaternykh M.A.,
РФ (госзадание № 785.00.Х6019) и Российского
Mokrushin V.S., Pospelova T.A. // Chem. Heterocycl.
фонда фундаментальных исследований (грант
Compd. 1999. Vol. 35. P. 1349. doi 10.1007/
№ 19-03-00365) с использованием оборудования
BF02252008
Инжиниригового центра Санкт-Петербургского
15.
Krylov A.S., Kaskevich K.I., Erkhitueva E.B.,
государственного технологического института,
Svintsitskaya N.I., Dogadina A.V. // Tetrahedron Lett.
ресурсных центров «Рентгенодифракционные ме-
2018. Vol. 59. P. 4326. doi 10.1016/j.tetlet.2018.10.052
тоды исследования» и «Методы анализа состава
16.
Erkhitueva E.B., Panikorovskii T.L., Svintsitskaya N.I.,
вещества» Научного парка Санкт-Петербургского
Trifonov R.E., Dogadina A.V. // Synlett. 2018. Vol. 29.
государственного университета.
N 7. P. 933. doi 10.1055/s-0036-1591919
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
90
КРЫЛОВ и др.
Reaction of Diethyl Chloroethynylphosphonate
with 3-Amino-1,2,4-triazoles
A. S. Krylova, V. V. Tolstyakova, V. V. Gurzhiyb, and A. V. Dogadinaa,*
a St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: dog_alla@mail.ru
Received December 2, 2020; revised December 2, 2020; accepted December 12, 2020
New 6-phosphonylated 1H-imidazo[2,1-c][1,2,4]triazoles were obtained by the reaction of diethyl chloroethyn-
ylphosphonate with 2-substituted 3-amino-1,2,4-triazoles followed by 5-endo-dig cyclization. It was found that
3-amino-5-bromo-1,2,4-triazole reacts in the other way, leading to the formation of the corresponding symmetric
amidine, diethyl {2-[(3-bromo-1-methyl-1H-1,2,4-triazol-5-yl)amino]-2-[(3-bromo-1-methyl-1H-1,2,4-triazol-
5-yl)imino]ethyl}phosphonate.
Keywords: chloroethynylphosphonate, 3-amino-1,2,4-triazole, imidazotriazole, phosphorylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021