ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 91-101
УДК 547.724.3
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ
ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
4-(1,2,3-СЕЛЕНАДИАЗОЛ-4-ИЛ)-5-МЕТИЛФУРАН-
2-КАРБОНОВОЙ КИСЛОТЫ
© 2021 г. А. Г. Машичев, Л. М. Певзнер*, М. Л. Петров
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 14 сентября 2020 г.
После доработки 14 сентября 2020 г.
Принято к печати 25 сентября 2020 г.
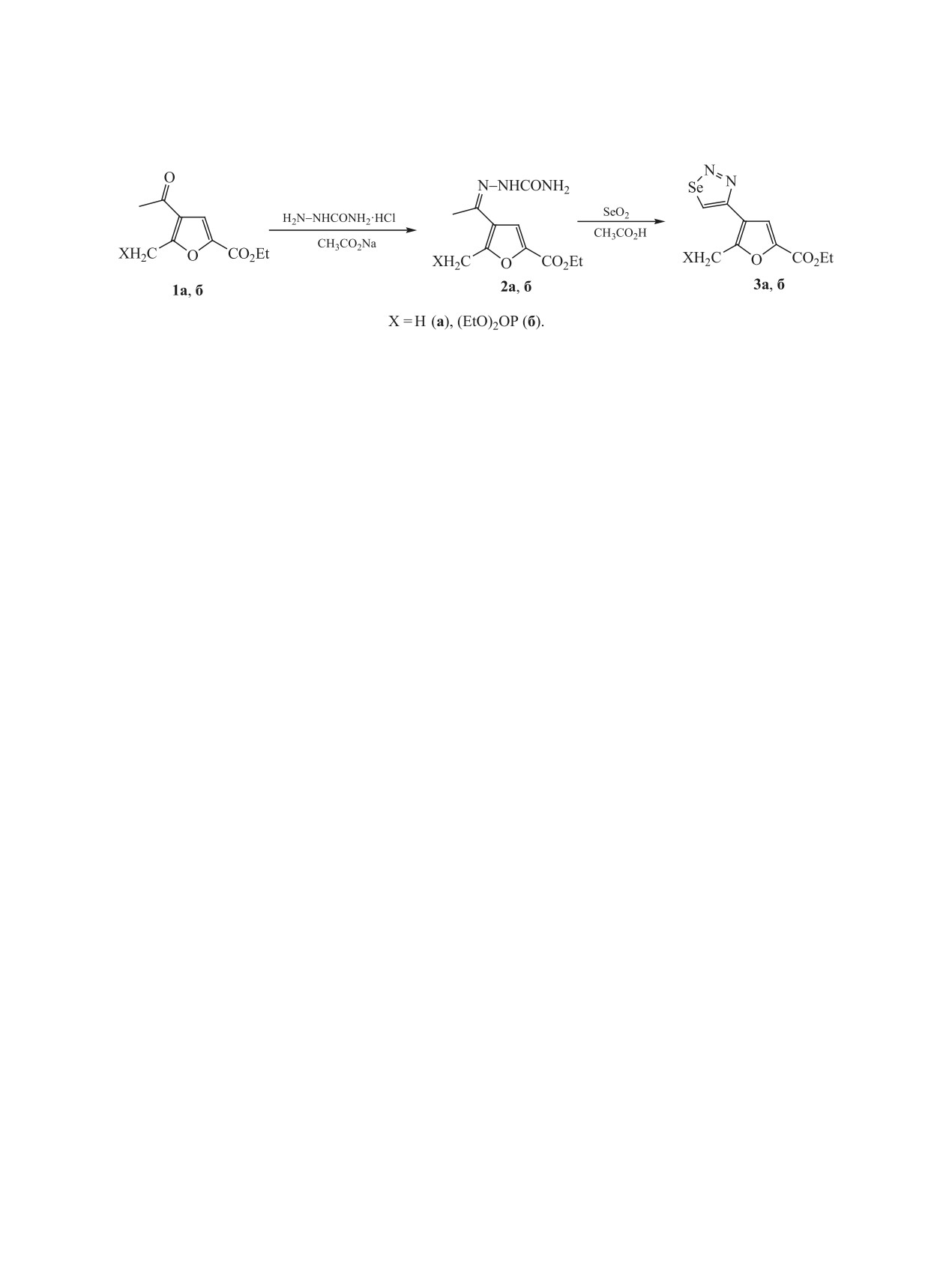
Действием двуокиси селена на семикарбазон этилового эфира 4-ацетил-5-метилфуран-2-карбоновой
кислоты синтезирован этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-5-метилфуран-2-карбоновой кислоты.
Установлено, что это соединение разлагается при попытке бромирования N-бромсукцинимидом, поэтому
для получения его производных по метильной группе функциональную группу следует вводить перед
формированием селенадиазольного кольца. Таким способом синтезированы соответствующий фосфонат
и серия фениловых эфиров.
Ключевые слова: семикарбазоны, двуокись селена, алкилирование фенолов, межфазный катализ
DOI: 10.31857/S0044460X21010091
В настоящее время 1,2,3-селенадиазолы при-
зультате, возможность получения целевых продук-
влекают повышенное внимание работающих в
тов определяется устойчивостью функциональной
области нанотехнологии, фармацевтики и синтеза
группы в ходе образования семикарбазона и его
новых элементоорганических соединений [1]. Про-
окисления двуокисью селена.
должая изучение методов синтеза и химических
В настоящей работе нами описан синтез произ-
свойств гибридных гетероциклических систем,
водных 2-фуранкарбоновой кислоты, содержащих
включаюших 1,2,3-селенадиазольное кольцо, мы
1,2,3-селенадиазольный цикл в положении 4 фура-
обратились к синтезу производных 4-(1,2,3-селе-
нового кольца. Целью работы было установление
надиазол-4-ил)фурана, содержащих в положении
возможности образования производных фурана,
2 фуранового кольца сложноэфирную группу.
несущих селенадиазольный заместитель в β-по-
Ранее окислением семикарбазона этилового
ложении фуранового кольца и сравнение условий
эфира 2-метил-5-ацетилфуран-3-карбоновой кис-
стабилизации этих соединений и соответствую-
лоты двуокисью селена нами был получен эфир
щих α-изомеров с помощью введения акцепторно-
2-метил-5-(1,2,3-селенадиазол-4-ил)фуран-3-кар-
го заместителя в фурановый цикл.
боновой кислоты и установлено, что бромирова-
В качестве исходного соединения был выбран
ние его в радикальных условиях N-бромсукци-
нимидом приводит к разложению субстрата [2].
этиловый эфир
4-ацетил-5-метилфуран-2-кар-
Поэтому для получения функциональных произ-
боновой кислоты 1а. Взаимодействием его с ги-
водных по метильной группе необходимо вводить
дрохлоридом семикарбазида и ацетатом натрия в
заместитель на стадиях, предшествующих фор-
мольном соотношении 1:1.3:3.8 был получен семи-
мированию 1,2,3-селенадиазольного кольца. В ре-
карбазон 2а с выходом 65% (схема 1). Окисление
91
92
МАШИЧЕВ и др.
Схема 1.
соединения 2a до соответствующего селенадиазо-
завершалась в течение 8 ч. При разбавлении реак-
ла проводили в уксусной кислоте при температуре
ционной массы водой постепенно выкристаллизо-
бани 80°С. Мольное соотношение семикарбазона
вывался спектрально чистый семикарбазон. Выход
и двуокиси селена составляло 1:1.1, реакция про-
целевого продукта составлял 49%. В спектре ЯМР
текала в течение 7 ч. После разделения реакцион-
13С этого соединения дублет ядра углерода С4 фу-
ной массы был выделен целевой селенадиазол 3a
ранового кольца располагается при 124.23 м. д.
с выходом 77%. Соединение 3a постепенно окра-
(3JPC 9.2 Гц), а дублет ядра С3 при 117.57 м. д. (4JPC
шивается на свету в красный цвет за счет выделе-
4.0 Гц). Эти данные хорошо согласуются с поло-
ния коллоидного селена. Образование 1,2,3-селе-
жением соответствующих сигналов в семикарба-
надиазольного цикла подтверждается наличием в
зоне 2а. Дублет при 143.43 м. д. (4JPC 3.7 Гц) одно-
спектрах ЯМР сигнала протона (Н5-селенадиазол)
значно принадлежит ядру С2 фуранового кольца,
при 9.19 м. д. (сателлиты с 2JHSe 40.0 Гц) и сигна-
поэтому расположенный рядом сигнал при 139.85
лов ядер углерода при 155.31 (С4-селенадиазол) и
м. д. характеризует ядро углерода азометиновой
137.23 м. д. (С5-селенадиазол). В кристаллическом
группы. В спектре семикарбазона 2а аналогичный
сигнал располагается при 139.97 м. д. Дублет кар-
состоянии полученный продукт стабилен при ком-
бонильной группы при фурановом кольце в соеди-
натной температуре в течение нескольких недель
нении 2б находится при 158.21 м. д. (5JPC 1.9 Гц),
при отсутствии прямого солнечного света.
что позволяет приписать сигнал при 158.27 м. д.
Оказалось, что при попытке бромирования
в спектре семикарбазона 2а карбонильной группе
N-бромсукцинимидом по метильной группе селе-
сложноэфирного фрагмента.
надиазол 3а разлагается. Поэтому для получения
Окисление семикарбазона 2б до селенадиазола
его производных, несущих функциональную груп-
3б проводили в уксусной кислоте при 70°С в тече-
пу в боковой цепи, требуемый заместитель необхо-
ние 8.5 ч под действием 60%-ного избытка двуоки-
димо вводить в структуру заранее. Этот подход и
си селена (схема 1). Целевой продукт был выделен
получил развитие в настоящей работе.
с выходом 57%. Образование селенадиазольного
Удобным методом установления структуры
кольца подтверждается присутствием в спектре
синтезированных соединений является введение в
ЯМР 1Н сигнала протона при 9.60 м. д. (сателлиты
него функциональной группы, имеющей в своем
с 2JHSe 40.0 Гц). В спектре ЯМР 13С фосфоната 3б
составе магнитно-активный атом, например фос-
дублет углерода С4 фуранового кольца располага-
фор. Наличие дальних констант спин-спинового
ется при 118.15 м. д. (3JPC 9.2 Гц), а сигнал углерода
взаимодействия JPH и JPC позволяет сделать од-
С3 - при 118.62 м. д. (4JPC 3.7 Гц). Сигналы с близ-
нозначное отнесение сигналов в спектрах ЯМР. С
кими химическими сдвигами наблюдаются в спек-
этой целью нами исходя из известного фосфоната
тре селенадиазола 3а. Таким образом, оказывает-
1б [3] были синтезированы фосфорилированный
ся, что сигналы β-углеродов фуранового кольца в
семикарбазон 2б и селенадиазол 3б.
семикарбазонах и селенадиазолах меняются ме-
Получение семикарбазона
2б проводили в
стами. В спектре соединения 3б дублет при 144.23
этаноле при кипячении (схема 1). Мольное соот-
м. д. (4JPC 3.5 Гц) принадлежит углероду С2, анало-
ношение фосфонат 1б-гидрохлорид семикарба-
гичный сигнал в спектре соединения 3а располага-
зида-ацетат натрия составляло 1:1.7:4.6. Реакция
ется при 143.01 м. д. Сигнал карбонильного атома
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
93
Схема 2.
углерода сложноэфирной группы в соединении 3б
эфиры 5-гидроксиметилфурфурола при подобной
при 158.24 расщепляется от фосфора с констан-
жесткой обработке распадаются на компоненты.
той 5JPC 1.9 Гц. Таким образом, селенадиазольный
Мы предположили, что сходные по строению про-
цикл в описываем продукте характеризуется сиг-
изводные
5-феноксиметилфуран-2-карбоновых
налами при 138.96 (С5-селенадиазол) и 154.12 м. д.
кислот, несущие в положении 4 фуранового коль-
(С4-селенадиазол). Данное отнесение однознач-
ца остаток 1,2,3-селенадиазола, могли бы пред-
но, поскольку только эти два слабопольных
ставлять интерес как переносчики двухвалентного
сигнала не расщеплены. Близкие по положению
селена в живых системах. Поэтому следующим
шагом в нашей работе была разработка способа
сигналы наблюдаются и в спектре соединения 3а.
получения эфиров
4-ацетил-5-феноксиметилфу-
Таким образом, введение магнитного ядра фос-
ран-2-карбоновых кислот и 1,2,3-селенадиазолов
фора в структуру семикарбазона фуранового ке-
на их основе.
тоэфира и селенадиазолилфурана в значительной
В качестве фенольных компонентов были выб-
степени облегчает отнесение сигналов в спектрах
раны 2-метоксифенол и эфиры о-, м- и п-гидрок-
ЯМР. В результате, установление структуры серии
сибензойных кислот. Алкилирующим агентом слу-
синтезированных соединений становится более
жил эфир 4-ацетил-5-бромметилфуран-2-карбоно-
обоснованным. Необходимо также отметить, что
вой кислоты 4 [3].
введение фосфонатной группы в боковую цепь по-
вышает термическую стабильность фурилселена-
Алкилирование 2-метоксифенола проводили в
диазола.
этаноле, используя предварительно приготовлен-
ный фенолят калия. Мольное соотношение бромид
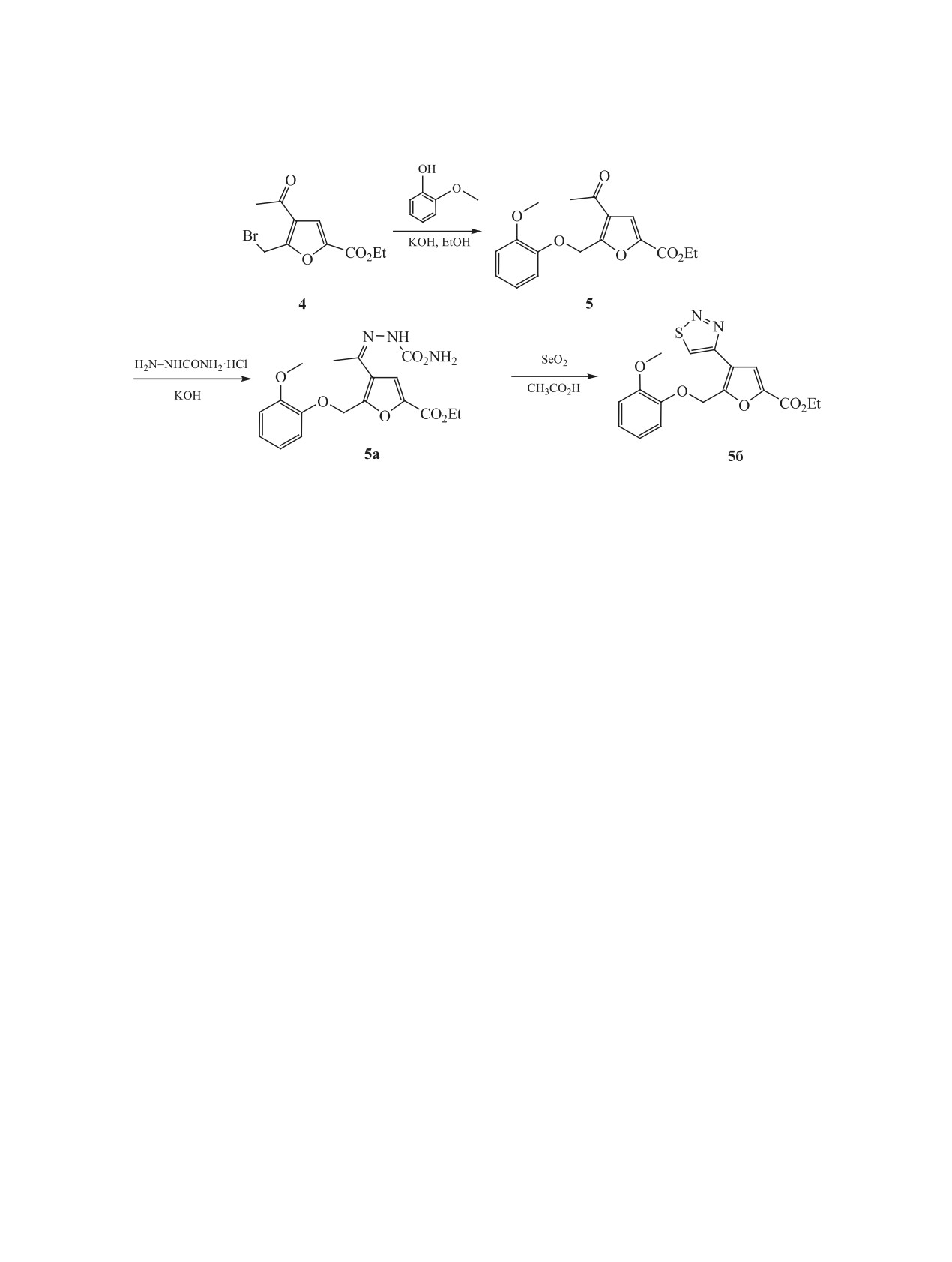
Далее мы попытались ввести феноксильный
4-фенолят составляло 1:1.05, реакция протекала в
заместитель по метильной группе 4-ацетил-5-ме-
течение 8 ч. Фениловый эфир 5 был выделен с вы-
тилфуран-2-карбоновой кислоты и на основе этих
ходом 34% (схема 2).
производных получить соответствующие селена-
Алкилирование этилового эфира салициловой
диазолы. Выбор направления работы был обуслов-
кислоты бромидом 4 в аналогичных условиях при-
лен следующим фактором. Считается, что фени-
вело к осмолению реакционной массы. Тогда ре-
ловые эфиры 5-гидроксиметилфурфурола входят
акция была проведена в системе вода-хлороформ
в состав экстрактивных веществ коры кустарника
с использованием бромида триэтилбензиламмо-
Pseudopanax colensoi, активно поедаемой оленями
[4]. Xотя эти соединения и не были выделены в чи-
ния (ТЕBА-Br) в качестве межфазного катализа-
стом виде из кислых метанольных экстрактов, на-
тора. Мольное соотношение бромид 4:салици-
личие в последних фенолокислот и 5-гидроксиме-
лат:ТЕBА-Br:KОН = 1:2:0.8:2.2. Гидроксид калия
тилфурфурола позволяет считать, что фениловые
использовали в виде 1 н. раствора. Реакцию про-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
94
МАШИЧЕВ и др.
Схема 3.
водили в течение 10 ч при интенсивном перемеши-
после чего последняя экстрагируется в хлороформ
вании и кипячении. Оказалось, что в реакционной
и вступает в реакцию с галогенидом. В случае наи-
массе присутствовали только исходные вещества.
менее гидрофильного этилсалицилата переход фе-
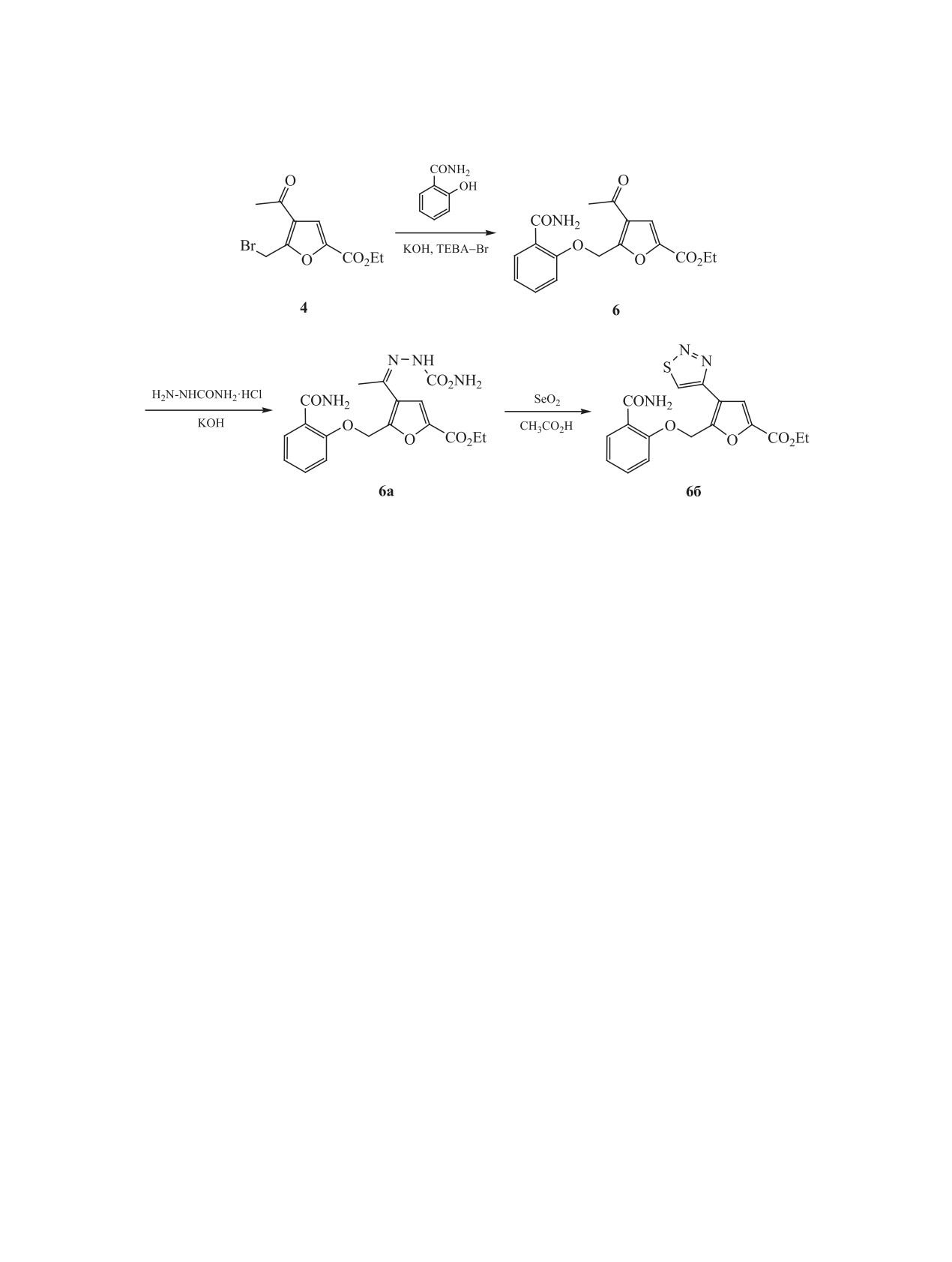
Напротив, алкилирование салициламида в анало-
нола в водную фазу пренебрежимо мал, и реакция
гичных условиях привело к целевому фенилово-
не идет. Более полярный салициламид экстраги-
му эфиру 6 с выходом 66% даже при уменьшении
руется в воду значительно легче, что и приводит
мольного соотношения бромид 4:ТЕВА-Br с 0.8
к образованию целевого продукта. Аналогично,
увеличение полярности при переходе от этилового
до 0.1 (схема 3).
эфира м-гидроксибензойной кислоты к метилово-
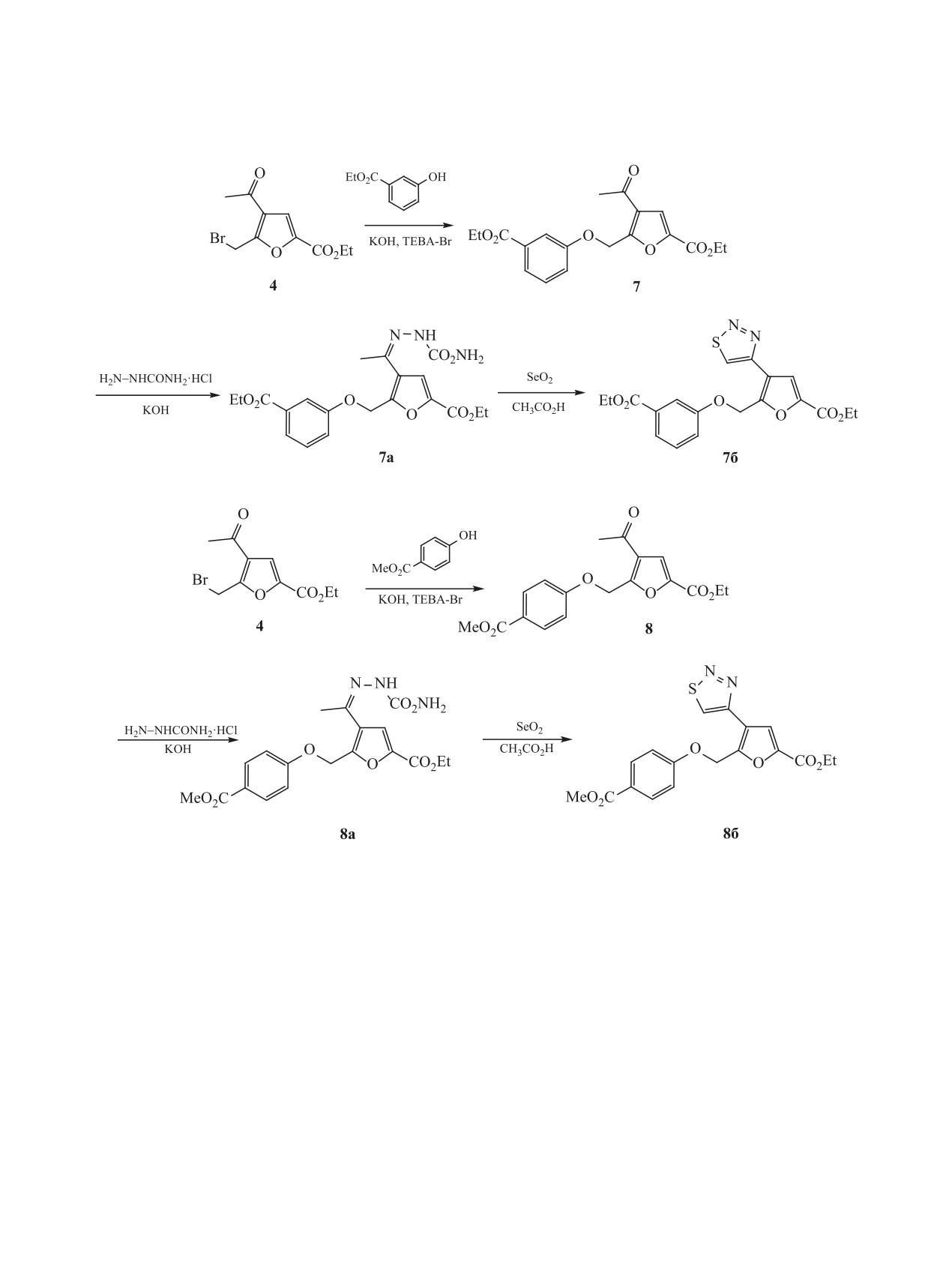
Алкилирование этилового эфира м-гидрокси-
му эфиру п-гидроксибензойной кислоты приводит
бензойной кислоты проводили аналогично, ис-
к тому, что алкилирование проходит эффективно
пользуя 0.8 моль ТЕВА-Br на 1 моль бромида 4.
при снижении количества катализатора в 8 раз.
Фениловый эфир 7 был выделен с выходом 94%
Альтернативный механизм, включающий экстрак-
(схема 4). Алкилирование метилового эфира п-гид-
цию ионной пары ТЕВА с гидроксид-ионом в хло-
роксибензойной кислоты протекает в аналогич-
роформ и последующую ионизацию фенола, не
ных условиях в присутствии 0.1 моль ТЕВА-Br на
реализуется. Это подтверждается не только отсут-
1 моль бромида 4. Фениловый эфир 8 был выделен
ствием продукта алкилирования в случае этилса-
с выходом 92% (схема 5). Обмена заместителей в
лицилата, но и тем, что ни в одном случае не отме-
сложноэфирных группах не наблюдалось.
чено гидролиза сложноэфирных групп в исходных
Полученные данные по условиям алкилиро-
веществах или в продуктах реакции. Кроме того,
вания производных гидроксибензойных кислот в
данный факт свидетельствует об эффективности
условиях межфазного катализа с использованием
переноса ионной пары ТЕВА-фенолят в органи-
ТЕВА-Br в системе вода-хлороформ показывают,
ческую фазу, препятствующему гидролизу эфиров
что условия и сама возможность алкилирования
гидроксибензойных кислот в водной фазе.
изучаемых соединений напрямую зависит от их
Получение семикарбазонов соединений
5-8
гидрофильности и, соответственно, от распределе-
проводили по одной и той же методике в спир-
ния в системе вода-хлороформ. Оказывается, что
то-бензольной среде используя 10%-ный избыток
ионизация фенольной ОН-группы и образование
гидрохлорида семикарбазида и гидроксида калия
ионной пары с ТЕВА происходит в водной фазе,
в присутствии 20 мол% п-толуолсульфокислоты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
95
Схема 4.
Схема 5.
(схемы 2-5). Образующаяся вода выводилась из
Окисление семикарбазонов 5а-8а двуокисью
сферы реакции путем отгонки тройного гетеро-
селена до селенадиазолов проводили в уксусной
генного азеотропа бензол-спирт-вода и разделе-
кислоте при 70°С в течение 6 ч (схемы 2-5). Се-
ния его на органическую и водную фазы в ловушке
ленадиазолы 5б-8б были выделены с выходом 59-
Дина-Старка. Выход целевых продуктов реакции
87%. Важно, что периферийная амидная группа не
5а-8а составлял 51-89%. Семикарбазон 8а в рас-
окисляется двуокисью селена, что открывает путь
творе в ДМСО, согласно данным спектроскопии
к производным фурилселенадиазола имеющим
ЯМР, существует в виде смеси син- и анти-изоме-
псевдопептидую структуру. Соединения
5б-8б
ров в соотношении 1:0.5. Отнесение сигналов про-
довольно стабильны к действию рассеянного све-
тонов метильных групп соответствующих форм
та и умеренному нагреванию, коллоидный селен
было сделано на основе литературных данных
при этом практически не выделяется в течение
[5-7].
2-3 месяцев, однако все продукты сильно пахнут
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
96
МАШИЧЕВ и др.
селеноводородом. Как известно, незаменимые
254.1143 [M + H]+ (вычислено для С11Н15N3O4:
аминокислоты селенометионин и селеноцистеин
254.1135).
синтезируются в живых системах из селеноводо-
Семикарбазон этилового эфира 4-ацетил-5-
рода [8]. Поэтому соединения, с одной стороны,
(диэтоксифосфорилметил)фуран-2-карбоновой
достаточно стабильные, а с другой способные
кислоты (2б). Смесь 3.03 г (9.1 ммоль) фосфоната
селективно и медленно выделять селеноводород,
1б, 1.77 г (15.9 ммоль) гидрохлорида семикарбази-
представляют большой интерес как потенциаль-
да, 2.46 г (42.2 ммоль) ацетата натрия и 40 мл эта-
ные препараты для лечения и профилактики дефи-
нола кипятили пре перемешивании 8 ч, после чего
цита селена в организме.
разбавляли 100 мл воды. Через сутки отфильтровы-
Таким образом, установлено, что акцепторного
вали выпавшие кристаллы и сушили их на воздухе
воздействия сложноэфирной группы в положении
до постоянной массы. Выход 1.76 г (49%), т. пл.
2 фуранового кольца 4-(1,2,3-селенадиазол-4-ил)-
189°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.30 т (6Н,
фуранов достаточно для стабилизации этих ге-
СН3-фосфонат, JHH 7.2 Гц), 1.39 т (3Н, СН3-эфир,
тероциклических систем. При получении функ-
J
7.2 Гц), 2.18 с (3Н, СН3-семикарбазон), 3.62 д
HH
циональных производных по метильной группе
(2Н, РСН2, JРH 22.4 Гц), 4.04-4.14 м (4Н, СН2ОР),
в положении 5 введение заместителей в боковую
4.38 к (2Н, СН2О-эфир, JHH 7.2 Гц), 4.92 уш. с (1Н,
цепь должно предшествовать формированию се-
NH2), 7.26 с (1Н, Н3-фуран), 7.81 уш. с (1Н, NH2),
ленадиазольного кольца. Феноксильная, амидная
8.77 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δС, м. д.:
и фосфонатная группы на периферии молекулы не
14.32 (СН3-эфир), 14.79 (СН3-семикарбазон), 16.30
окисляются двуокисью селена и не препятствуют
д (СН3-фосфонат, 3JРС 5.9 Гц), 27.99 д (РСН2, 1JРС
превращению семикарбазонов β-ацетилфуранов в
141.7 Гц), 61.18 (СН2О-эфир), 62.81 д (СН2ОР, 2JРС
β-(1,2,3-селенадиазол-4-ил)фураны.
6.7 Гц), 117.57 д (С3-фуран, 4JРС 4.0 Гц), 124.23 д
(С4-фуран, 3JРС 9.2 Гц), 139.85 уш. с (С=N), 143.43
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
д (С2-фуран, 4JРС 3.7 Гц), 147.85 д (С5-фуран, 2JРС
Спектры ЯМР 1Н, 13С, и 31Р получали на
13.4 Гц), 158.21 д (С=О, 5JРС 1.9 Гц), 158.35 уш. с
приборе Bruker AVANCE-400
(400.13,
100.16,
(СОNH2). Спектр ЯМР 31Р (CDCl3): δР 22.02 м. д.
161.97 МГц соответственно). Масс-спектры (ESI)
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
получали на приборе Bruker MicrOTOF.
5-метилфуран-2-карбоновой кислоты
(3а). К
Семикарбазон этилового эфира
4-аце-
раствору 1.70 г (6.7 ммоль) семикарбазона 2а в
тил-5-метилфуран-2-карбоновой кислоты (2а).
30 мл уксусной кислоты прибавляли
0.81 г
Смесь 2.00 г (11 ммоль) этилового эфира 4-аце-
(7.3 ммоль) двуокиси селена. Полученную смесь
тил-5-метилфуран-2-карбоновой кислоты, 1.56 г
перемешивали 7 ч при 80°С, после чего вылива-
(14 ммоль) гидрохлорида семикарбазида, 3.40 г
ли в 70 мл воды и экстрагировали хлороформом
(42 ммоль) ацетата натрия и 50 мл этанола кипяти-
(3×15 мл). Экстракт разбавляли в 2 раза гексаном,
ли при перемешивании 20 ч. Реакционную массу
выдерживали 30 мин и фильтровали через бумаж-
разбавляли 60 мл воды, выпавший осадок отфиль-
ный фильтр, покрытый слоем хлористого натрия.
тровывали и сушили на воздухе до постоянной
Фильтрат промывали насыщенным раствором
массы. Выход 1.82 г (64%), т. пл. 231°С. Спектр
бикарбоната натрия до нейтральной реакции и
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.29 т (3Н, СН3-эфир,
сушили сульфатом натрия. Высушенный раствор
JHH 7.2 Гц), 2.12 с (3Н, СН3-семикарбазон), 2.53
фильтровали через небольшой слой силикагеля и
с (3Н, СН3-фуран), 4.27 к (2Н, СН2О-эфир, JHH
упаривали досуха. Кристаллы сушили на воздухе
7.2 Гц), 6.36 уш. с (2Н, NH2), 7.61 (1Н, Н3-фуран),
без доступа света до постоянной массы. Выход
9.30 с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6), δС,
1.47 г (77%), т. пл. 69°С (гексан). Спектр ЯМР 1Н
м. д.: 14.68 (СН3-эфир), 15.08 (СН3-семикарбазон),
(CDCl3), δ, м. д.: 1.40 т (3Н, СН3-эфир, JHH 7.2 Гц),
15.64 (СН3-фуран),
60.92 (СН2О-эфир),
119.18
2.75 с (3Н, СН3-фуран), 4.39 к (2Н, СН2О-эфир, JHH
(С3-фуран),
122.98 (С4-фуран),
139.97 (С=N),
7.2 Гц), 7.53 с (1Н, Н3-фуран), 9.19 с (1Н, Н5-се-
141.55 (С2-фуран),
154.88 (С5-фуран),
157.66
ленадиазол, сателлит 2JHSe 40.0 Гц). Спектр ЯМР
(CONH2), 158.27 (С=О-фуран). Масс-спектр, m/z:
13С (CDCl3), δС, м. д.: 14.31 (СН3-фуран), 14.37
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
97
(СН3-эфир), 61.13 (СН2О-эфир), 117.79 (С4-фу-
без доступа воздуха 8 ч, затем отгоняли этанол,
ран), 118.47 (С3-фуран), 137.22 (С5-селенадиа-
остаток затирали с 20 мл воды. Образовавшиеся
зол), 143.01 (С2-фуран), 155.31 (С4-селенадиазол),
кристаллы отфильтровывали, сушили на воздухе и
158.28 (С5-фуран), 158.57 (С=О).
перекристаллизовывали из метанола. Выход 0.82 г
(34%), т. пл. 86°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
1.40 т (3Н, СН3-эфир, JHH 7.2 Гц), 2.51 с (3Н, СН3-
5-(диэтоксифосфорилметил)фуран-2-карбоно-
ацетил), 3.88 с (3Н, СН3О), 4.40 к (2Н, СН2О-эфир,
вой кислоты (3б). К раствору 1.09 г (2.8 ммоль)
J
7.2 Гц), 5.43 с (2Н, СН2О-фенил), 6.87-6.93
семикарбазона 2б в 30 мл уксусной кислоты при-
HH
м (2Н, СН-фенил), 6.99-7.03 м (2Н, СН-фенил),
бавляли при перемешивании 0.5 г (4.5 ммоль) дву-
7.44 с (1Н, Н3-фуран). Спектр ЯМР 13С (CDCl3),
окиси селена. Полученную смесь перемешивали
δС, м. д.: 14.27 (СН3-эфир), 29.15 (СН3-ацетил),
8.5 ч при 70°С, затем выливали в 50 мл воды. К
55.93 (СН3О), 61.06 (СН2О-эфир), 62.94 (СН2О-фе-
полученной смеси прибавляли 30 мл этилацета-
нил), 112.23 (С3-фенил), 115.76 (С6-фенил), 117.51
та и образовавшуюся эмульсию фильтровали на
(С3-фуран),
120.86 (С5-фенил),
122.84 (С4-фе-
воронке Бюхнера через слой хлористого натрия.
нил), 125.35 (С4-фуран), 144.28 (С2-фуран), 147.39
Отделяли органический слой и сушили его суль-
(С2-фенил), 150.19 (С1-фенил), 157.68 (С5-фуран),
фатом натрия. Высушенную органическую фазу
158.10 (С=О).
фильтровали через слой силикагеля и упаривали
досуха. Остаток растворяли в хлороформе, промы-
Алкилирование производных гидроксибен-
вали насыщенным раствором бикарбоната натрия
зойных кислот этиловым эфиром 4-ацетил-
до нейтральной реакции, затем раствором NaCl и
5-бромметилфуран-2-карбоновой кислоты 5 в
сушили сульфатом натрия. После удаления хлоро-
условиях межфазного катализа (общая методи-
форма остаток выдерживали в вакууме (1 мм рт.
ка). К раствору 10 ммоль галогенида 5 в 60 мл хло-
ст.) 1 ч при комнатной температуре. Выход 0.67 г
роформа прибавляли указанное ниже количество
(57%), светло-коричневое сиропообразное веще-
ТЕВА-Br и 20 ммоль эфира или амида гидрокси-
ство, которое при хранении в течение месяца при
бензойной кислоты. К образовавшейся смеси при-
комнатной температуре кристаллизуется, т. пл.
бавляли 22 ммоль гидроксида калия в виде 1 н. во-
63-64°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.26 т
дного раствора. Полученную смесь кипятили при
(6Н, СН3-фосфонат, JHH 7.2 Гц), 1.39 т (3Н, СН3-э-
интенсивном перемешивании при 60°С в течение
фир, JHH 7.2 Гц), 3.80 д (2Н, РСН2, JРH 21.6 Гц),
10 ч, после чего отделяли водный слой, органи-
4.13 д.к (4Н, СН2ОР, JHH 7.2 Гц, JРH 14.4 Гц), 4.39
ческую фазу промывали 0.5 н. водным раствором
к (2Н, СН2О-эфир, JHH 7.2 Гц), 7.60 с (1Н, Н3-фу-
гидроксида калия (2×10 мл), 10 мл воды и сушили
ран), 9.60 с (1Н, Н5-селенадиазол, сателлит 2JHSe
хлористым кальцием. После удаления хлороформа
40.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.30
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
(СН3-эфир), 16.13 д (СН3-фосфонат, 3JРС 6.4 Гц),
при комнатной температуре.
26.92 д (РСН2, 1JРС 140.2 Гц), 61.25 (СН2О-эфир),
Этиловый эфир 4-ацетил-5-(2-аминокарбо-
63.01 д (СН2ОР, 2JРС 6.6 Гц), 118.15 д (С4-фуран,
нилфеноксиметил)фуран-2-карбоновой кис-
3JРС 8.6 Гц), 118.62 д (С3-фуран, 4JРС 3.7 Гц), 138.96
лоты (6). Использовали 1 ммоль ТЕВА-Br. Вы-
(С5-селенадиазол), 144.23 д (С2-фуран, 4JРС 3.5 Гц),
ход 66%, т. пл. 173°С (гексан). Спектр ЯМР 1Н
148.17 д (С5-фуран, 2JРС 13.4 Гц), 154.12 (С4-се-
(CDCl3), δ, м. д.: 1.40 т (3Н, СН3-эфир, JHH 7.2 Гц),
ленадиазол), 158.24 д (С=О, 5JРС 1.2 Гц). Спектр
2.52 с (3Н, СН3-ацетил), 4.40 к (2Н, СН2О-эфир,
ЯМР 31Р (CDCl3): δР 21.52 м. д.
J
7.2 Гц), 5.55 с (2Н, СН2О-фенил), 6.00 уш. с
HH
Этиловый эфир
4-ацетил-5-(2-метоксифе-
(1Н, NH2), 7.11-7.14 м (2Н, Н4, Н6-фенил), 7.45 с
ноксиметил)фуран-2-карбоновой кислоты (5).
(1Н, Н3-фуран), 7.48 т. д (1Н, Н5-фенил, Jорто 8.0,
К раствору 0.98 г (7.9 ммоль) 2-метоксифенола
J
2.0 Гц), 7.91 уш. с (1Н, NH2), 8.21 д. д (1Н,
мета
в 30 мл этанола прибавляли при перемешивании
Н3-фенил, Jорто 8.0, Jмета 2.0 Гц). Спектр ЯМР 13С
раствор 0.42 г (7.5 ммоль) гидроксида калия в
(CDCl3), δС, м. д.: 14.30 (СН3-эфир), 29.00 (СН3-
10 мл этанола, затем к полученной суспензии фе-
ацетил),
61.74 (СН2О-эфир),
62.68 (СН2О-фе-
нолята прибавляли 2.07 г (7.5 ммоль) бромида 4.
нил), 112.23 (С6-фенил), 117.26 (С3-фуран), 121.61
Реакционную массу кипятили при перемешивании
(С2-фенил),
122.91 (С4-фенил),
124.64 (С4-фу-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
98
МАШИЧЕВ и др.
ран), 132.83 (С5-фенил), 133.37 (С3-фенил), 144.58
лоты и 10 ммоль фенилового эфира 5-8. Получен-
(С2-фуран), 155.94(С1-фенил), 156.46 (С5-фуран),
ную смесь кипятили 9-10 ч при перемешивании
157.75 (С=О-фуран),
166.65 (СО-NH2),
193.44
с ловушкой Дина-Старка до прекращения отделе-
(С=О-кетон).
ния воды. После этого реакционную массу упари-
вали досуха, остаток суспендировали в воде, от-
Этиловый эфир 4-ацетил-5-(3-этоксикарбо-
фильтровывали кристаллы и сушили их на воздухе
нилфеноксиметил)фуран-2-карбоновой кисло-
до постоянной массы.
ты (7). Использовали 8 ммоль ТЕВА-Br. Выход
94%, желтое сиропообразное вещество. Спектр
Семикарбазон этилового эфира
4-аце-
ЯМР 1Н (CDCl3), δ, м. д.: 1.37 т (3Н, СН3-эфир,
тил-5-(2-метоксифенилметил)фуран-2-карбо-
JHH 7.2 Гц), 1.38 т (3Н, СН3-эфир, JHH 7.2 Гц), 2.50
новой кислоты (5а). Выход 89%, желтые кристал-
с (3Н, СН3-ацетил), 4.35 к (2Н, СН2О-эфир, JHH
лы, т. пл. 203°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.
7.2 Гц), 4.37 к (2Н, СН2О-эфир, JHH 7.2 Гц), 5.42 с
д.: 1.30 т (3Н, СН3-эфир, JHH 7.2 Гц), 2.13 с (3Н,
(2Н, СН2О-фенил), 7.17 д. д (1Н, Н6-фенил, Jорто
СН3-семикарбазон), 3.73 с (3Н, СН3О), 4.30 к (2Н,
8.0, Jмета 2.0 Гц), 7.34 т (1Н, Н5-фенил, Jорто
СН2О-эфир, JHH 7.2 Гц), 5.23 с (2Н, СН2О-фенил),
8.0 Гц), 7.43 с (1Н, Н3-фуран), 7.74 д (1Н, Н2-фе-
6.45 уш. с (2Н, NH2), 6.86 д. д. д (1Н, Н5-фенил,
J
7.6, Jорто 8.0, Jмета 1.4 Гц), 6.92-6.99 м (2Н,
нил, Jмета 2.0 Гц), 7.66 д (1Н, Н4-фенил, Jорто
орто
8.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.24
Н3,4-фенил), 7.05 д (1Н, Н6-фенил, Jорто 8.0 Гц),
7.72 c (1Н, Н3-фуран), 9.47 с (1Н, NH). Спектр
(СН3-эфир), 14.25 (СН3-эфир), 29.13 (СН3-аце-
ЯМР 13С (ДМСО-d6), δС, м. д.: 14.63 (СН3-эфир),
тил), 61.01 (СН2О-эфир), 61.41 (СН2О-эфир), 61.56
15.42 (СН3-семикарбазон), 55.79 (СН3О),
61.36
(СН2О-фенил), 115.24 (С2-фенил), 117.95 (С3-фу-
(СН2О-эфир), 62.66 (СН2О-фенил), 112.67 (С3-
ран), 119.86 (С6-фенил), 122.86 (С4-фенил), 126.00
фенил),
114.88 (С6-фенил),
118.69 (С3-фуран),
(С4-фуран),
129.49 (С5-фенил),
131.93 (С3-фе-
121.01 (С5-фенил),
122.51 (С4-фенил),
127.10
нил), 144.47 (С2-фуран), 156.92(С5-фуран), 157.94
(С4-фуран),
138.70 (С=N),
143.24 (С2-фуран),
(С=О-фуран), 162.04 (С1-фенил), 166.16 (С=О-фе-
147.45 (С2-фенил),
149.79 (С1-фенил),
151.49
нил), 193.09 (С=О-кетон).
(CONH2), 157.59 (С5-фуран), 158.22 (С=О-фуран).
Этиловый эфир 4-ацетил-5-(4-метоксикар-
Семикарбазон этилового эфира
4-ацетил-
бонилфеноксиметил)фуран-2-карбоновой кис-
5-(2-аминокарбонилфенилметил)фуран-2-кар-
лоты (8). Использовали 1 ммоль ТЕВА-Br. Выход
боновой кислоты
(6а). Выход
81%, желтые
92%, светло-коричневые кристаллы, т. пл. 84-
кристаллы, т. пл. 189-190°С. Спектр ЯМР 1Н
85°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.34 т (3Н,
(ДМСО-d6), δ, м. д.: 1.30 т (3Н, СН3-эфир, JHH
СН3-эфир, JHH 7.2 Гц), 2.47 с (3Н, СН3-ацетил),
7.2 Гц), 2.16 с (3Н, СН3-семикарбазон), 4.30 к (2Н,
3.83 с (3Н, СН3О), 4.33 к (2Н, СН2О-эфир, JHH
СН2О-эфир, JHH 7.2 Гц), 5.47 с (2Н, СН2О-фенил),
7.2 Гц), 5.40 с (2Н, СН2О-фенил), 6.96 д (2Н,
6.39 уш. с (2Н, NH2), 7.07 т (1Н, Н4-фенил, Jорто
Н2,6-фенил, Jорто 8.8 Гц), 7.40 с (1Н, Н3-фуран),
7.4 Гц), 7.24 д (1Н, Н6-фенил, Jорто 8.4 Гц), 7.45-
7.93 д (2Н, Н3,5-фенил, Jорто 8.8 Гц). Спектр ЯМР
7.54 уш. м (3Н, NH2, Н5-фенил), 7.76 д. д (1Н,
13С (CDCl3), δС, м. д.: 14.23 (СН3-эфир), 29.11
Н3-фенил, Jорто 7.4, Jмета 2.0 Гц), 7.76 с (1Н,
(СН3-ацетил), 51.85 (СН3О), 61.16 (СН2О-эфир),
Н3-фуран), 9.47 с (1Н, NH). Спектр ЯМР 13С (ДМ-
61.57 (СН2О-фенил), 114.35 (С2,6-фенил), 117.34
СО-d6), δС, м. д.: 14.62 (СН3-эфир), 15.56 (СН3-се-
(С3-фуран), 123.40 (С4-фенил), 125.14 (С4-фуран),
микарбазон), 61.39 (СН2О-эфир), 62.98 (СН2О-фе-
131.58 (С3,5-фенил), 144.51 (С2-фуран),
156.54
нил), 113.82 (С6-фенил), 118.77 (С3-фуран), 121.77
(С5-фуран), 157.85 (С=О-фуран), 162.04 (С1-фе-
(С2-фенил), 124.11 (С4-фуран), 126.61 (С4-фенил),
нил), 166.56 (С=О-фенил), 193.18 (С=О-кетон).
131.13 (С5-фенил),
132.70 (С3-фенил),
138.89
Общая методика синтеза гидразонов 5а-8а.
(С=N), 143.46 (С2-фуран), 150.72 (CONH2), 156.03
К суспензии 11 ммоль гидрохлорида семикарбази-
(С1-фенил), 157.42 (С5-фуран), 158.14 (С=О-фу-
да в 50 мл бензола прибавляли при перемешива-
ран), 166.76 (CONH2-фенил).
нии насыщенный раствор 11 ммоль гидроксида ка-
Семикарбазон этилового эфира
4-ацетил-
лия в этаноле. Реакционную массу перемешивали
5-(3-этоксикарбонилфенилметил)фуран-2-кар-
20 мин, прибавляли 2 ммоль п-толуолсульфокис-
боновой кислоты (7а). Выход 73%, светло-корич-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
99
невые кристаллы, т. пл. 119-120°С (этанол). Спектр
экстрагировали хлороформом (3×20 мл). Экстракт
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.30 уш. с (6Н, СН3-
промывали насыщенным раствором бикарбоната
эфир), 2.27 уш. с (3Н, СН3-семикарбазон), 4.30 уш.
натрия до прекращения выделения СО2, 15 мл рас-
с (4Н, СН2О-эфир), 5.56 уш. с (2Н, СН2О-фенил),
твора NaCl и сушили сульфатом натрия. Раствор
5.86 уш. с (2Н, NH2), 7.32 уш. с (1Н, Н6-фенил),
разбавляли в 2 раза этилацетатом, выдерживали
7.45 уш. с (1Н, Н5-фенил), 7.56 уш. с (2Н, Н4-фе-
2-3 ч при комнатной температуре для коагуля-
нил, Н6-фенил), 7.72 уш. с (1Н, Н3-фуран), 9.89
ции коллоидного селена, затем фильтровали через
уш. с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6), δС,
слой силикагеля, отгоняли растворители, остаток
м. д.: 14.54 (СН3-эфир), 14.60 (СН3-эфир), 17.00
выдерживали в вакууме (1 мм рт. ст.) 1 ч при ком-
(СН3-семикарбазон),
61.30 (СН2О-эфир),
61.50
натной температуре.
(СН2О-эфир), 62.31 (СН2О-фенил), 114.78 (С2-фе-
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
нил), 118.87 (С3-фуран), 119.19 (С6-фенил), 122.57
5-(2-метоксифеноксиметил)фуран-2-карбоно-
(С4-фенил), 125.63 (С4-фуран), 130.53 (С5-фенил),
вой кислоты (5б). Выход 87%, т. пл. 83°С (гексан,
131.83 (С3-фенил), 142.00 уш.с (С=N),
143.91
разл.). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.41 т (3Н,
(С2-фуран), 152.91 (CONH2), 157.17 (С5-фуран),
СН3-эфир, JHH 7.0 Гц), 3.83 с (3Н, СН3О), 4.42 к (2Н,
158.14 (С=О-фуран), 158.01 (С1-фенил),
165.79
СН2О-эфир, JHH 7.0 Гц), 5.41 с (2Н, СН2О-фенил),
(C=O-фенил).
6.90 д (2Н, Н3,6-фенил, Jорто 8.0 Гц), 6.99 т и 7.04
Семикарбазон этилового эфира
4-ацетил-
т (2Н, Н4,5-фенил, Jорто 8.0 Гц), 7.71 с (1Н, Н3-фу-
5-(4-метоксикарбонилфенилметил)фуран-
ран), 9.66 с (1Н, Н5-селенадиазол, сателлит 2JHSe
2-карбоновой кислоты (8а). Выход 51%, свет-
40.4 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.34
ло-коричневые кристаллы, т. пл. 158°С. Спектр
(СН3-эфир), 55.73 (СН3О), 61.45 (СН2О-эфир),
ЯМР 1Н (ДМСО-d6), δ, м. д.: общие сигналы, 1.30
63.22 (СН2О-фенил), 112.10 (С3-фенил),
116.28
т (3Н, СН3-эфир, JHH 6.6 Гц), 3.82 с (3Н, СН3О),
(С6-фенил),
118.67 (С3-фуран),
120.02 (С4-фу-
4.30 к (2Н, СН2О-эфир, JHH 6.6 Гц), 6.39 уш. с (2Н,
ран), 120.99 (С5-фенил), 123.09 (С4-фенил), 140.11
NH2), 7.14 д (2Н, Н2,6-фенил, Jорто 8.4 Гц ), 7.92
(С5-селенадиазол),
144.43 (С2-фуран),
147.00
д (2Н, Н3,5-фенил, Jорто 8.4 Гц ), 9.47 с (1Н, NH);
(С2-фенил), 150.27 (С1-фенил), 151.54 (С4-селена-
син-изомер, 2.16 с (3Н, СН3-семикарбазон), 5.43
диазол), 153.82 (С5-фуран), 158.48 (С=О-фуран).
с (2Н, СН2О-фенил), 7.74 с (1Н, Н3-фуран); анти-
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
изомер, 2.09 с (3Н, СН3-семикарбазон), 5.49 с (2Н,
5-(2-аминокарбонилфеноксиметил)фуран-
СН2О-фенил), 7.82 с (1Н, Н3-фуран). Спектр ЯМР
2-карбоновой кислоты (6б). Выход 65%, т. пл.
13С (ДМСО-d6), δС, м. д.: общие сигналы, 14.61
142°С (хлороформ-гексан,
1:1). Спектр ЯМР
(СН3-эфир),
61.71 (СН2О-эфир),
62.21 (СН2О-
1Н (CDCl3), δ, м. д.: 1.33 т (3Н, СН3-эфир, JHH
эфир), 115.09 (С2,6-фенил), 131.76 (С3,5-фенил),
7.0 Гц), 4.35 к (2Н, СН2О-эфир, JHH 7.0 Гц), 5.71
138.79 (С=N), 150.52 (CONH2), 162.03 (С1-фенил),
с (2Н, СН2О-фенил), 7.07 т (1Н, Н5-фенил, Jорто
166.26 (C=O-фенил); син-изомер, 15.55 (СН3-се-
8.0 Гц), 7.30 д (1Н, Н6-фенил, Jорто 8.0 Гц), 7.46
микарбазон), 52.34 (СН3О), 61.39 (СН2О-фенил),
уш. м (2Н, NH2, Н4-фенил), 7.79 д (1Н, Н3-фенил,
118.71 (С3-фуран),
123.04 (С4-фенил),
127.06
Jорто 7.2 Гц), 8.04 с (1Н, Н3-фуран), 8.32 уш. с (1Н,
(С4-фуран), 143.49 (С2-фуран), 157.46 (С5-фуран),
NH2), 10.23 с (1Н, Н5-селенадиазол, сателлит 2JHSe
158.15 (С=О-фуран); анти-изомер, 14.57 (СН3-се-
38.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.62
микарбазон), 52.36 (СН3О), 61.51 (СН2О-фенил),
(СН3-эфир), 61.61 (СН2О-эфир), 62.82 (СН2О-фе-
118.96 (С3-фуран),
123.17 (С4-фенил),
125.70
нил), 113.98 (С6-фенил), 119.04 (С3-фуран), 119.86
(С4-фуран), 143.95 (С2-фуран), 156.53 (С5-фуран),
(С2-фенил),
121.83 (С4-фенил),
124.12 (С4-фу-
157.86 (С=О-фуран).
ран), 131.21 (С5-фенил), 132.75 (С3-фенил), 143.47
(С2-фуран),
144.57 (С5-селенадиазол),
147.00
Общая методика синтеза семикарбазонов
(С2-фенил),
150.84 (С4-селенадиазол),
153.92
5б-8б. К раствору 10 ммоль семикарбазона 5а-8а в
(С5-фуран), 156.07 (С1-фенил), 158.04 (С=О-фу-
20 мл уксусной кислоты прибавляли при пере-
ран), 166.71 (CONH2).
мешивании 11 ммоль двуокиси селена. Образо-
вавшуюся смесь перемешивали 6 ч при 70°С.
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
Реакционную смесь разлагали 50 мл воды, затем
5-(3-этоксикарбонилфеноксиметил)фуран-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
100
МАШИЧЕВ и др.
2-карбоновой кислоты (7б). Выход 59%, жел-
158.26 (С=О-фуран), 161.22 (С1-фенил),
166.70
тое сиропообразное вещество. Спектр ЯМР
(C=O-фенил).
1Н (CDCl3), δ, м. д.: 1.37 т (3Н, СН3-эфир, JHH
ФОНДОВАЯ ПОДДЕРЖКА
7.2 Гц), 1.40 т (3Н, СН3-эфир, JHH 7.2 Гц), 4.35 к
Работа выполнена в рамках государственно-
(2Н, СН2О-эфир, JHH 7.2 Гц), 4.41 к (2Н, СН2О-
го задания Министерства образования и науки
эфир, JHH 7.2 Гц), 5.48 с (2Н, СН2О-фенил), 7.18 д
России (№ 785.00X6019) с использованием обо-
(1Н, Н6-фенил, Jорто 8.0 Гц), 7.34 т (1Н, Н5-фенил,
рудования инжинирингового центра Санкт-Пе-
Jорто 8.0 Гц), 7.64 с (1Н, Н3-фуран), 7.66 уш. с (1Н,
тербургского государственного технологического
Н2-фенил), 7.67 д (1Н, С4-фенил, Jорто 8.0 Гц), 9.39
института (технического университета).
с (1Н, Н5-селенадиазол, сателлит 2JHSe 39.6 Гц).
Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.30 (СН3-
КОНФЛИКТ ИНТЕРЕСОВ
эфир), 61.19 (СН2О-эфир), 61.55 (СН2О-эфир),
Авторы заявляют об отсутствии конфликта
61.79 (СН2О-фенил), 115.37 (С2-фенил),
118.17
интересов.
(С3-фуран), 119.67 (С4-фуран), 119.96 (С6-фенил),
CПИСОК ЛИТЕРАТУРЫ
122.94 (С4-фенил),
129.59 (С5-фенил),
131.95
(С3-фенил),
139.34 (С5-селенадиазол),
144.89
1. Joshi P.G., More M.S., Jadhav A.A., Khanna P.K. //
(С2-фуран),
150.97 (С4-селенадиазол),
153.83
Mater. Today Chem. 2020. Vol. 16. P. 100255. doi
10.1016/j.mtchem.2020.100255
(С5-фуран), 157.88 (С=О-фуран), 158.35 (С1-фенил),
2. Маадади Р., Певзнер Л.М., Петров М.Л. // ЖОХ.
166.28 (C=O-фенил).
2017. Т. 87. Вып. 2. С. 284; Maadadi R., Pevzner L.M,
Этиловый эфир 4-(1,2,3-селенадиазол-4-ил)-
Petrov M.L. // Russ. J. Gen. Chem. 2017. Vol. 87. N 2.
5-(4-метоксикарбонилфеноксиметил)фуран-
P. 259. doi 10.1134/S1070363217020177
2-карбоновой кислоты (8б). Выход 60%, т. пл.
3. Певзнер Л.М., Игнатьев В.М., Ионин Б.И. // ЖОХ.
1996. Т. 66. Вып. 5. С. 763.
89°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.43 т (3Н,
4. Jogia M.K., Vakamoce V., Weavers R.T. // Austr. J.
СН3-эфир, JHH 7.2 Гц), 3.89 с (3Н, СН3О), 4.44 к (2Н,
Chem. 1985. Vol. 38. P. 1009. doi 10.1071/CH9851009
СН2О-эфир, JHH 7.2 Гц), 5.45 с (1Н, СН2О-фенил),
5. Karabatsos G.R., Taller R.A. // J. Am. Chem. Soc. 1963.
5.53 с (1Н, СН2О-фенил), 7.04 д (2Н, Н2,6-фенил,
Vol. 85. N 22. P. 3624. doi 10.1021/ja00905a020
Jорто 8.8 Гц), 8.00 с (2Н, Н3,5-фуран), 9.38 с (1Н,
6. Karabatsos G.R., Taller R.A., Vane F.M. // J. Am.
Н5-селенадиазол, сателлит 2JHSe 39.6 Гц). Спектр
Chem. Soc. 1963. Vol. 85. N 4. P. 2326. doi 10.1021/
ja00898a033
ЯМР 13С (CDCl3), δС, м. д.: 14.33 (СН3-эфир), 51.96
7. Karabatsos G.R., Vane F.M., Taller R.A., Hsi N. // J. Am.
(СН3О), 61.57 (СН2О-эфир), 61.62 (СН2О-фенил),
Chem. Soc. 1964. Vol. 86. N 8. P. 3351. doi 10.1021/
114.49 (С2,6-фенил),
118.02 (С3-фуран),
119.69
ja01070a022
(С4-фуран), 123.50 (С4-фенил), 131.70 (С3,5-фе-
8. Крюков В.С., Глебова И.В., Зиновьев С.В., Шевяко-
нил), 139.32 (С5-селенадиазол), 145.03 (С2-фу-
ва А.Н. // Проблемы биологии продуктивных живот-
ран), 150.64 (С4-селенадиазол), 156.65 (С5-фуран),
ных. 2017. Вып. 4. С. 24.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ ПО МЕТИЛЬНОЙ ГРУППЕ ПРОИЗВОДНЫХ ЭФИРА
101
Synthesis of 4-(1,2,3-Selenadiazol-4-yl)-5-methylfuran-2-
carboxylic Acid Derivatives Functionalized by the Methyl Group
A. G. Mashichev, L. M. Pevzner*, and M. L. Petrov
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received September 14, 2020; revised September 14, 2020; accepted September 25, 2020
The action of selenium dioxide on the semicarbazone of ethyl 4-acetyl-5-methylfuran-2-carboxylic acid was
used to synthesize ethyl 4-(1,2,3-selenadiazol-4-yl)-5-methylfuran-2-carboxylic acid ethyl ester. It was found
that this compound decomposes when attempting to brominate with N-bromosuccinimide; therefore, to obtain
its derivatives at the methyl group, the functional group should be introduced before the formation of the
selenadiazole ring. In this way, the corresponding phosphonate and a series of phenyl esters were synthesized.
Keywords: semicarbazones, selenium dioxide, alkylation of phenols, phase transfer catalysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021