ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 116-124
УДК 541.49;547.556.93;544.18;539.27
СИНТЕЗ, СТРОЕНИЕ И КОМПЛЕКСООБРАЗУЮЩАЯ
СПОСОБНОСТЬ АЦИЛГИДРАЗОНА НА ОСНОВЕ
о-(ТОЗИЛАМИНО)БЕНЗАЛЬДЕГИДА И РЕАКТИВА
ЖИРАРА Т
© 2021 г. Л. Д. Поповa,*, С. И. Левченковa,b, В. В. Луковa, К. Б. Гишкоa, С. А. Бородкинa,
Ю. П. Туполоваa, О. И. Аскалеповаa, В. Г. Власенкоc, Д. В. Спиридоноваd, В. А. Лазаренкоe,
А. С. Бурловf, И. Н. Щербаковa
a Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
b Южный научный центр Российской академии наук, Ростов-на-Дону, 344006 Россия
c Научно-исследовательский институт физики Южного федерального университета, Ростов-на-Дону, 344090 Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
e Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
f Научно-исследовательский институт физической и органической химии Южного федерального университета,
Ростов-на-Дону, 344090 Россия
*e-mail: ldpopov@mail.ru
Поступило в Редакцию 5 ноября 2020 г.
После доработки 5 ноября 2020 г.
Принято к печати 20 ноября 2020 г.
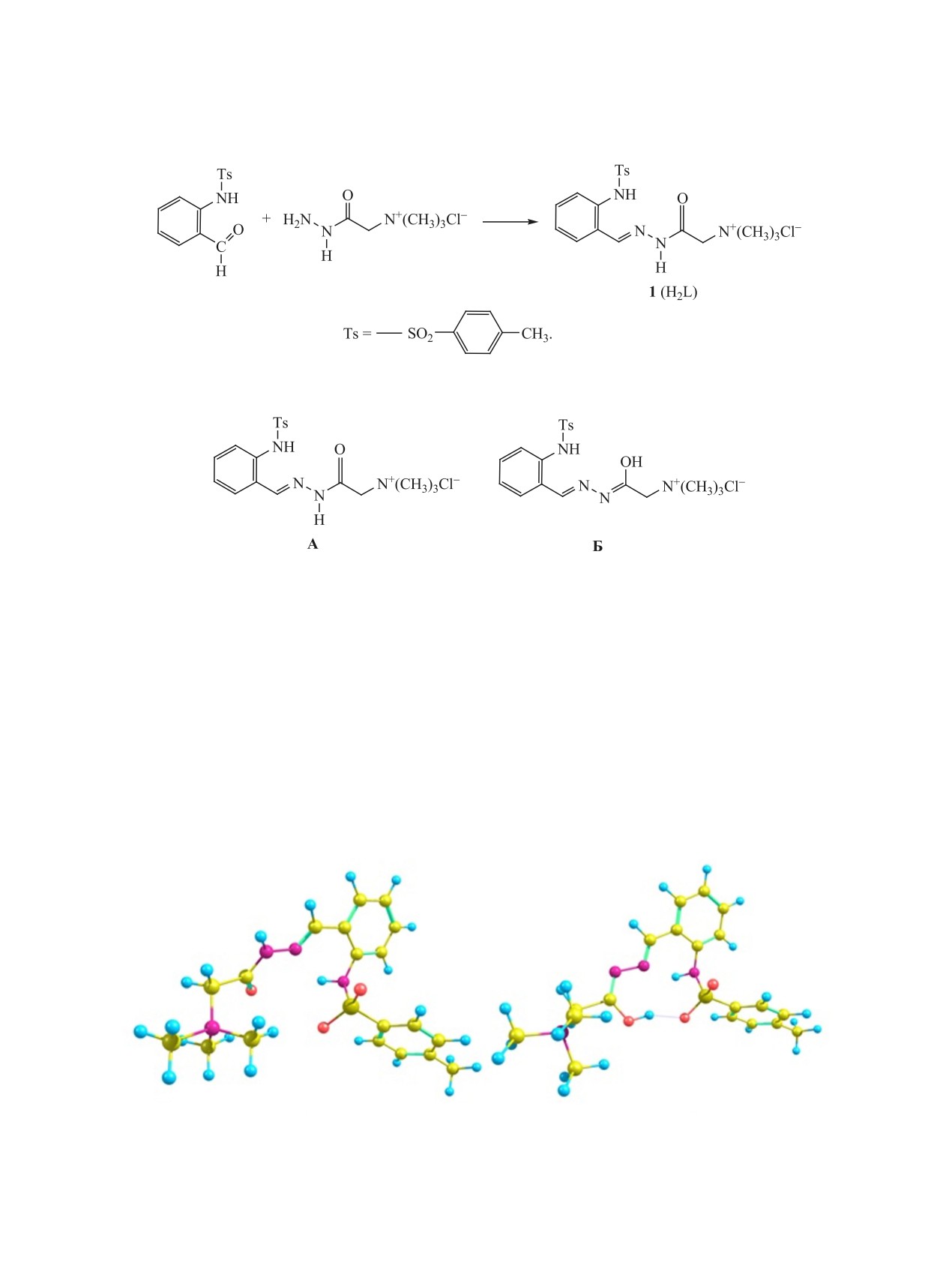
Синтезирован и исследован новый гидразон - продукт конденсации о-(тозиламино)бензальдегида и
реактива Жирара Т, а также комплексы Cu(II), Ni(II), Co(II) и Fe(III) на его основе. Строение и свойства
гидразона изучены с привлечением ИК, УФ, ПМР, масс-спектроскопии и потенциометрии. Структура
комплекса никеля(II) установлена методом РСА.
Ключевые слова: гидразоны, комплексные соединения, рентгеноструктурный анализ, квантово-хими-
ческие расчеты, магнетохимия, спектроскопия
DOI: 10.31857/S0044460X21010121
Гидразоны карбонильных соединений обла-
реактив Жирара Т - 2-гидразинил-N,N,N-триме-
дают разнообразной биологической активностью
тил-2-оксоэтанаминия хлорид, применяющийся
[1-3], высокой комплексообразующей способно-
для выделения кетонов из природных масел [29] и
стью [4-6], фотохимическими [7, 8], электрохи-
для получения их водорастворимых производных,
мическими [9, 10], сенсорными [11-13] свойства-
что важно для практического использования. Ги-
ми. При взаимодействии с ионами металлов они
дразоны на основе реактива Жирара Т находят
образуют моно-, би- и полиядерные комплексы с
применение в хроматографии [30], обладают био-
магнетохимическими [14, 15], фотолюминесцент-
логической активностью [31], являются ингиби-
ными [16, 17], каталитическими [18, 19], ингиби-
торами коррозии стали [32]. Ранее были изучены
рующими [20] свойствами. Некоторые гидразоны
металлокомплексы с некоторыми гидразонами ре-
о-(тозиламино)бензальдегида и их металлоком-
актива Жирара Т [33-36].
плексы были получены ранее [21-28].
Гидразон 1 выделен в форме соли, раствори-
В качестве гидразинной компоненты для син-
мой в воде, спиртах, нерастворимой в хлорофор-
теза ацилгидразона 1 (схема 1) нами использован
ме, ацетоне, CCl4. Гидразон 1 идентифицирован на
116
СИНТЕЗ, СТРОЕНИЕ И КОМПЛЕКСООБР
АЗУЮЩАЯ СПОСОБНОСТЬ
117
Схема 1.
Схема 2.
основе данных элементного анализа, ИК, ЯМР 1H,
ле от 10 до 14 м. д. наблюдаются четыре сигнала
электронной спектроскопии, масс-спектрометрии
(вместо ожидаемых двух), соответствующие груп-
и потенциометрии. В его масс-спектре отсутству-
пам NH и OH, в областях от 4 до 5 и от 8 до 9 м. д.
ет пик молекулярного иона, что свидетельствует о
находятся по два сигнала (вместо ожидаемого од-
неустойчивости соединения к электронному уда-
ного) групп СН2 и СН=N соответственно.
ру, регистрируется пик иона [M - HCl]+, m/z 388,
В ИК спектре гидразона 1 в конденсированной
характерный для гидрохлорида, и присутствуют
фазе при 3396 и 3149 см-1 наблюдаются две полосы
пики разной интенсивности от фрагментов, обра-
валентных колебаний связей N-H, а при 1708 см-1 -
зующиеся при его распаде.
высокоинтенсивная полоса валентных колебаний
На основании спектра ЯМР 1H можно предпо-
карбонильной группы C=O. При 1609 см-1 заре-
лагать существование в растворе двух таутомер-
гистрирована полоса валентных колебаний связи
ных форм А, Б гидразона 1 (схема 2): в интерва-
CH=N, а при 1566 см-1 - полоса, отнесенная к ва-
(a)
(б)
Рис. 1. Общий вид наиболее устойчивых конформеров (a) А, (б) Б гидразона 1 по данным расчетов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
118
ПОПОВ и др.
Таблица 1. Полная энергия и относительная устойчивость таутомерных форм А, Б соединения 1 в вакууме и в эта-
нольном растворе
E, a. e.
ΔE, ккал/моль
Форма
вакуум
этанол
вакуум
этанол
Гидразон (А)
-1581.9209214
-1582.0155652
1.19
0.00
α-Гидроксиазин (Б)
-1581.9228215
-1581.9992310
0.00
10.25
лентным колебаниям связи C=C. Интенсивные по-
ризующиеся соответствующими константами Ka,1,
лосы поглощения νas(SO2) и νs(SO2) проявляются
Ka,2, Ka,3.
при 1341 и 1169 см-1 соответственно. Таким об-
(1)
разом, гидразон 1 в конденсированном состоянии
(2)
находится в кетонной форме А.
Для оценки относительной устойчивости тау-
(3)
томеров А, Б был проведен квантово-химический
расчет их полной энергии и геометрии в газовой
фазе и в этанольном растворе. Молекулярное стро-
ение наиболее устойчивых конформеров обеих та-
По данным потенциометрического титрова-
утомерных форм показано на рис. 1.
ния рассчитаны величины констант диссоциации
В вакууме, по данным расчетов, несколько бо-
протонированной, монодепротонированной и ди-
лее устойчива α-гидроксиазинная форма Б, однако
депротонированной форм гидразона 1: рKа,1 2.38,
разница полных энергий с гидразонным таутоме-
рKа,2 8.19, рKа,3 11.5, а также констант модельного
ром составляет всего лишь 1.19 ккал/моль. В эта-
соединения 2 (без тозильного фрагмента, схема 3)
нольном растворе, напротив, более устойчивым
[37]: рKа,1 2.32 и рKа,2 10.28.
является гидразонный таутомер, причем разница
Электронные спектры поглощения соедине-
полных энергий весьма велика - 10.25 ккал/моль
ния 1 в нейтральной, кислой среде и в этанольном
(табл. 1).
растворе различаются незначительно. Интенсив-
В зависимости от кислотности среды можно
ность полосы поглощения с максимумом 284 нм
предположить существование в растворе протони-
(lgε 4.29) при протонировании (рис. 2, 3) незначи-
рованной (H3R+), молекулярной (H2R) и депрото-
тельно уменьшается (lgε 4.23). Протонированная
нированных форм (HR- и R2-). Анализ кривой по-
форма H
R+ существует в растворе при рН 1.5-3.5.
3
тенциометрического титрования показывает, что в
При рН 7-9.5 в растворе находится монодепрото-
растворе реализуются равновесия (1)-(3), характе-
нированная форма HR-, для которой сохраняется
поглощение с максимумом при 284 нм и появля-
ется плечо при 330 нм. В спектре соединения 1 в
щелочной среде (рН > 10) для формы R2- наблюда-
ется небольшое батохромное смещение (Δ = 5 нм,
lgε 4.16) и появляется выраженная длинноволно-
вая полоса поглощения при 331 нм (lgε 4.06).
Взаимодействие гидразона 1 (H2L) с ацетата-
ми никеля(II), кобальта(II), меди(II) в метаноле в
присутствии триэтиламина, согласно данным эле-
Схема 3.
Рис. 2. Электронные спектры поглощения гидразона 1
в этаноле (2) и при рН 6.8 (1), 1.2 (3), 10 (4), 12.5 (5).
с = 2.8×10-5 моль/л.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И КОМПЛЕКСООБР
АЗУЮЩАЯ СПОСОБНОСТЬ
119
ментного анализа, независимо от соотношения ре-
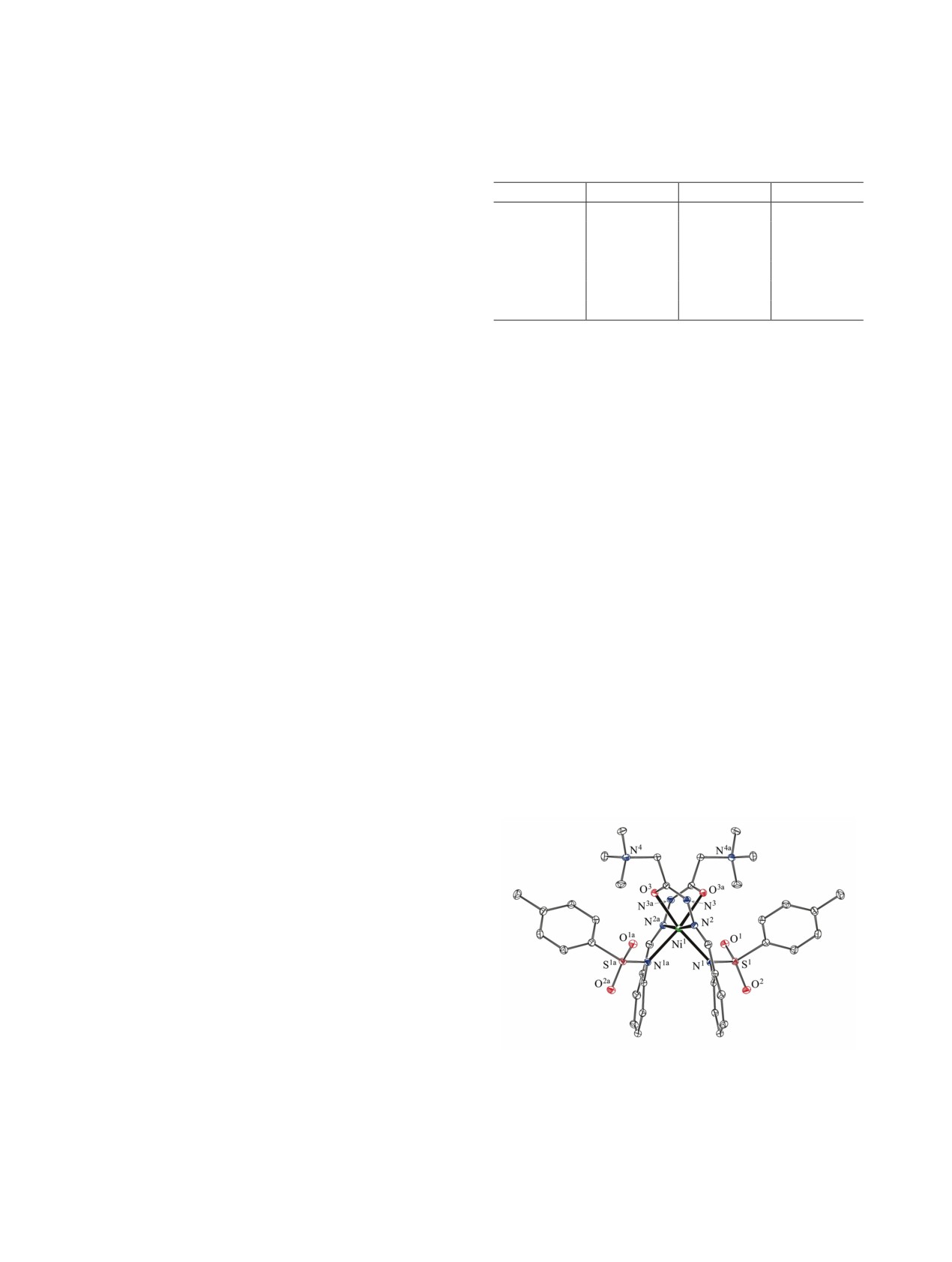
Таблица 2. Основные межатомные расстояния и ва-
агентов приводит к комплексам ML2 3-5 (схема 4).
лентные углы в молекуле комплекса NiL2·4CH3OH 3
В ИК спектрах комплексов 3-5 по сравнению с
Связь
d, Å
Угол
φ, град
соединением
1 наблюдаются характерные для
Ni1-N1
2.122(1)
O3Ni1O3a
80.20(5)
хелатных структур изменения: исчезают полосы
Ni1-O3
2.132(1)
N2Ni1N2a
172.00(6)
поглощения ν(NH) и ν(C=O), полосы поглощения
Ni1-N2
2.028(1)
N1Ni1O3
163.05(5)
N2Ni1O3
96.82(5)
ν(СH=N) смещаются в высокочастотную область
N1Ni1N2
86.39(6)
на 7-13 см-1, а полосы νas(SO2) и νs(SO2) - в низ-
N1Ni1N1a
87.05(5)
кочастотную область на 7-10 и 35-38 см-1 соот-
ветственно. Все комплексы представляют собой
слабоокрашенные порошки с высокими темпера-
комплекса меди (1.82 М. Б.) практически не из-
турами плавления, плохо растворимые в большин-
меняется при понижении температуры до 77.4 K,
стве органических растворителей, кроме ДМФА,
что свидетельствует об отсутствии магнитного
ДМСО, пиридина, мало растворимые в воде. Стро-
обменного взаимодействия и o моноядерном стро-
ение комплекса никеля установлено методом РСА
ении комплекса. Эффективный магнитный момент
(рис. 3).
комплекса кобальта (4.90 М. Б.) характерен для ок-
таэдрического окружения иона Co2+ в высокоспи-
Длины связей и валентные углы в координаци-
новом состоянии. Подтверждением этого являют-
онном многограннике, имеющем вид искаженного
ся электронные спектры, в которых обнаружены
октаэдра, приведены в табл. 2. Молекула комплек-
переходы в области 19050 и 20000-20885 см-1,
са 3 имеет симметрию C2. Органические лиганды
отнесенные к 4T1g(F)→4A2g(F) и 4T1g(F)→4T2g(P)
координированы к иону никеля в дважды депрото-
соответственно.
нированной форме аминными (N1 и N1a) и азоме-
тиновыми (N2 и N2a) атомами азота и α-гидроксиа-
Полученный нами из FeCl3 комплекс железа
зинными атомами кислорода (O3 и O3a).
6 имеет, по данным элементного анализа, состав
FeLCl2. В его ИК спектре исчезают полосы валент-
Два пятичленных металлохелатных цикла
ных колебаний групп OH и NH, а также незначи-
NiNNCO имеют конформацию конверта, кла-
тельно изменяется положение полосы связи C=N.
пан которого образован атомом Ni1, выходящим
Эффективный магнитный момент комплекса 6 при
из средней плоскости остальных атомов цикла
комнатной температуре (5.86 М. Б.) соответствует
на 0.371 Å. Оба шестичленных металлохелатных
высокоспиновому состоянию иона Fe3+. Исследо-
цикла сильно искажены: атом Ni1 и азометино-
вание температурной зависимости показало, что
вый атом N2 отклоняются от средней плоскости
комплекс ведет себя как обычный парамагнетик.
остальных атомов цикла на 1.099 и 0.441 Å соот-
ветственно.
Сольватные молекулы метанола в комплексе
NiL2·4CH3OH образуют прочные межмолекуляр-
ные водородные связи с одним из атомов кислоро-
да тозильных групп (O4-H4A···O1; O4-H4A 0.82 Å,
H4A···O1 1.96 Å, O4···O1 2.732(3) Å, угол O4H4AO1
157°) и с депротонированным атомом азота гидра-
зонного фрагмента [O5-H5A···N3; O5-H5A 0.82 Å,
H5A···N3 2.00 Å, O5···N3 2.798(2) Å, угол O5H5AN13
164°].
Эффективный магнитный момент комплекса
никеля (3.10 М. Б.) характерен для октаэдрическо-
Рис. 3. Молекулярная структура комплекса NiL2∙
го или псевдооктаэдричекского строения хелатно-
4CH3OH 3 в представлении атомов эллипсоидами те-
го узла иона никеля, находящегося в высокоспино-
пловых смещений с 50%-ной вероятностью (атомы
вом состоянии. Эффективный магнитный момент
водорода и молекулы метанола не показаны).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
120
ПОПОВ и др.
Схема 4.
В комплексном соединении 6 ион железа(III) нахо-
циями на тяжелых атомах 6-311G(d) (программа
дится в пентакоординированном окружении, кото-
Gaussian’09 [42]). Оптимизацию геометрии прово-
рое образовано набором атомов N-N-O тридентат-
дили без ограничения по симметрии, минимумы
ного однозарядного дважды депротонированного
поверхности потенциальной энергии характери-
лиганда и двумя ионами хлора. Предполагаемое
зовали отсутствием мнимых частот рассчитанных
строение комплекса 6 имеет вид тригональной би-
нормальных колебаний. Влияние среды учитыва-
пирамиды (схема 4), что согласуется с данными
ли в рамках модели непрерывной поляризуемой
работы [38].
среды (PCM) [43] с использованием параметров
для растворителя (ДМСО), принятых в програм-
Таким образом, ацилгидразон, синтезирован-
ме Gaussian’09 по умолчанию. Для подготовки
ный на основе о-(тозиламино)бензальдегида и
данных, презентационной графики, визуализации
реактива Жирара Т, образует только моноядерные
результатов расчетов использовали программу
комплексы с металлами.
Chemcraft [44].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рентгеноструктурный анализ. Монокристалл
Элементный анализ выполнен на приборе
сольвата комплекса 3 (NiL2·4CH3OH) для РСА
PerkinElmer 240C в лаборатории микроанализа
получен при медленном охлаждении раствора в
Южного федерального университета. Масс-спектр
метаноле. Светло-зеленые призматические кри-
получен на приборе Bruker AUTOFLEX II; метод
сталлы (М = 961.82), моноклинные при 100(2) K,
ионизации - электроспрей. Спектры ЯМР 1Н полу-
a 23.6515(5) Å, b 9.49452(15) Å, с 22.3455(4) Å, β
чены на спектрометре Bruker (600 МГц). ИК спек-
112.501(2)°, V 4635.89(16) Å3, пространственная
тры зарегистрированы на приборе Varian Scimitar
группа C2/c, Z 4, dвыч 1.378 г/cм3, μ 1.979. Параме-
1000 FT-IR для образцов в вазелиновом масле в
тры элементарной ячейки и интенсивности 22907
области 4000-600 см-1. Электронные спектры сня-
отражений измеряли на дифрактометре Rigaku
ты на приборе Varian Cary 5000 в области 200-800
XtaLAB Synergy, PhotonJet (Cu) X-ray Source,
нм. Магнитную восприимчивость поликристалли-
λ(CuKα) = 1.54184 Å, зеркальный монохроматор,
ческих образцов определяли относительным мето-
ω-сканирование, θmax 76.245°, для монокристалли-
дом Фарадея в интервале температур 77.4-300 K
ческого образца размером 0.20 × 0.18 × 0.10 мм3.
при напряженности магнитного поля 9000 Э. Уста-
Обработку исходного массива измеренных ин-
новку калибровали по комплексу Hg[Co(CNS)4].
тенсивностей проводили с помощью программы
Температурную зависимость магнитной воспри-
Olex2 1.2 [45, 46]. Структура расшифрована пря-
имчивости комплексов интерпретировали в рам-
мым методом и уточнена полноматричным МНК
ках модели изолированного обменного кластера
в анизотропном приближении для неводородных
Гейзенберга-Дирака-Ван Флека [39, 40].
атомов по F2hkl. Атомы водорода помещали в ге-
Расчетные методы. Квантово-химический
ометрически рассчитанные положения и уточня-
расчет проводили в рамках теории функционала
ли с использованием модели наездника [Uiso(H) =
плотности с использованием гибридного обмен-
nUeq(C), где n = 1.5 для атомов углерода метиль-
но-корреляционного функционала B3LYP [41] в
ных групп, n = 1.2 для остальных атомов C]. Окон-
валентно-расщепленном базисе гауссовых функ-
чательные факторы расходимости R1 = 0.0364 и
ций, расширенного поляризационными d-функ-
wR2 0.0935 для 4273 независимых отражений с I >
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И КОМПЛЕКСООБР
АЗУЮЩАЯ СПОСОБНОСТЬ
121
2σ(I), R1 0.0372 и wR2 0.0941 для всех 4402 неза-
кобальта(II), меди(II) или хлорида железа(III) в
висимых отражений, 293 уточняемых параметра,
5 мл метанола (1.2 ммоль). К полученному раство-
GOOF 1.052. Все расчеты проведены с использо-
ру добавляли 0.4 мл триэтиламина и кипятили 4-
ванием программного комплекса SHELXL-2013
5 ч. Выпавший осадок отфильтровывали, промы-
[47]. Для анализа структуры использовали про-
вали кипящим метанолом и сушили в вакууме.
грамму PLATON [48]. Избранные межатомные
Комплекс NiL2 (3). Выход 67%, зеленые кри-
расстояния и валентные углы приведены в табл. 2.
сталлы, т. пл. 270°С. ИК спектр, ν, см-1: 1620
Координаты атомов и температурные факторы де-
(CH=N), 1592 (C=N), 1555 (C=C), 1439,
1331
понированы в Кембриджском банке структурных
[νas(SO2)], 1267, 1248, 1226, 1131 [νs(SO2)], 1087,
данных (CCDC 2043014).
1042, 966, 910, 871, 815, 766, 660, 585, 567. Найде-
Для синтеза гидразона 1 использовали коммер-
но, %: С 54.9; Н 4.8; N 13.8; Ni 6.8. C38H46N8NiO6S2.
чески доступный реактив Жирара Т (Alfa Aesar).
Вычислено, %: С 54.78; H 5.52; N 13.44; Ni 7.05.
Комплекс CoL2 (4). Выход 80%, розовый амор-
2-{2-[2-(Тозиламино)бензилиден]гидрази-
фный порошок, т. пл. 295°С. ИК спектр, ν, см-1:
нил}-N,N,N-триметил-2-оксоэтанаминийхло-
1610 (CH=N), 1596 (C=N), 1554 (C=C), 1483,
рид (1). К горячему раствору 0.8 г (2.9 ммоль)
1406, 1340,
1321
[νas(SO2)], 1291, 1256, 1204,
о-(тозиламино)бензальдегида в 10 мл бутан-1-
1131 [νs(SO2)], 1080, 1047, 945, 871, 753, 662, 585,
ола добавляли 0.48 г (2.9 ммоль) реактива Жирара
560. Найдено, %: С 54.9; H 4.7; N 13.7; Co 6.7.
Т. Полученный раствор кипятили 5 ч. Выпавший
C38H46CoN8O6S2. Вычислено, %: С 54.63; H 5.52;
осадок отфильтровывали, промывали бутан-1-
N 13.44; Co 7.07.
олом и перекристаллизовывали из этанола. Вы-
Комплекс CuL2 (5). Выход 67%, темно-зеле-
ход 0.68 г (76%), смесь двух таутомерных форм в
ный аморфный порошок, т. пл. 285°С. ИК спектр,
соотношении 62:38 , белый аморфный порошок,
ν, см-1: 1616 (CH=N), 1598 (C=N), 1538 (C=C),
т. пл. 233-234°C. ИК спектр (вазелин), ν, см-1:
1445, 1358, 1334 [νas(SO2)], 1280, 1252, 1212, 1134
3396 (NH), 3149 (NH), 1708 (C=O), 1609 (CH=N),
[νs(SO2)], 1088, 1041, 960, 916, 871, 810, 749, 666,
1566 (C=C), 1494, 1414, 1341 [νas(SO2)], 1282,
554. Найдено, %: С 54.8; H 5.0; N 13.6; Cu 7.3.
1256, 1226, 1169 [νs(SO2)], 1157, 1092, 1051, 959,
C38H46CuN8O6S2. Вычислено, %: С 54.47; H 5.49;
917, 857, 772, 666, 616, 572, 542. Спектр ЯМР 1H
N 13.37; Cu 7.58.
(ДМСО-d6), δ, м. д.: 2.35 с и 2.32 с (3Н, СН3С6Н4),
Комплекс FeLCl2 (6). Выход 70%, светло-ко-
3.34 с и 3.33 с [9Н, N+(СН3)3], 4.85 с и 4.46 с (2Н,
ричневый аморфный порошок, т. пл. 267°С. ИК
СН2), 6.84-7.83 м (8НAr), 8.39 с и 8.48 с (1Н,
спектр, ν, см-1: 1622 (CH=N), 1596 (C-N), 1574
НС=N), 10.21 с и 10.80 с (1Н, NН), 12.16 с и 13.08
(C=C), 1434, 1347, 1289, 1206, 1166, 1119, 1089,
с (1Н, ОН). Найдено, %: С 54.20; Н 5.40; N 13.40;
968, 933, 856, 817, 762, 680, 657, 620, 570. Найде-
S 7.50. C19H25ClN4O3S Вычислено, %: С 53.73; H
но, %: С 44.80; H 4.00; N 11.30; Fe 10.50; Cl 13.90.
5.89; N 13.19; S 7.04.
C19H23FeCl2N4O3S. Вычислено, %: С 44.47; H 4.48;
2-(2-Бензилиденгидразинил)-N,N,N-триме-
N 10.91; Fe 10.91; Cl 13.64.
тил-2-оксоэтанаминийхлорид (2) получен по ме-
ФОНДОВАЯ ПОДДЕРЖКА
тодике [37]. Выход 82%, т. пл. 170°C (т. пл. 169°C
Исследование выполнено при финансовой
[37]). Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: преобла-
поддержке Российского фонда фундаментальных
дающий анти-изомер, 3.37 с [9H, N+(СН3)3], 4.88
исследований (проект № 20-33-90173) с исполь-
с (2H, СН2), 7.58-7.35 м (3HAr), 7.86-7.63 м (2HAr),
зованием оборудования Центров коллективного
8.23 с (1H, HC=N), 12.28 с (1H, NH); син-изомер,
пользования Южного федерального университета
3.33 с [9H, N+(СН3)3], 4.47 с (2H, СН2), 7.58-7.35 м
«Молекулярная спектроскопия» и «Высокопроиз-
(3HAr), 7.86-7.63 м (2HAr), 8.45 с (1H, HC=N), 13.20
водительные вычисления».
с (1H, NH).
КОНФЛИКТ ИНТЕРЕСОВ
Комплексы гидразона 1 с металлами. К го-
рячему раствору гидразона 1 (2.5 ммоль) в 5 мл
Авторы заявляют об отсутствии конфликта
метанола добавляли раствор ацетата никеля(II),
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
122
ПОПОВ и др.
СПИСОК ЛИТЕРАТУРЫ
18.
Sutradhar M., Kirillova M.V., Guedes da Silva M.F.C.,
Liu C.-M., Pombeiro A.J.L. // Dalton Trans. 2013.
1.
Kölmel D.K., Kool E.T. // Chem Rev. 2017. Vol. 117.
Vol. 42. P. 16578. doi 10.1039/C3DT52453A
N 15. P. 10358. doi 10.1021/acs.chemrev.7b00090
19.
Monfared H.H., Sadighian S., Kamyabi M.-A., Mayer P. //
2.
Rollas S., Küçükgüzel S.G. // Molecules. 2007. Vol. 12.
J. Mol. Catal. A Chem. 2009. Vol. 304. N 1-2. P. 139.
N 8. P. 1910. doi 10.3390/12081910
doi 10.1016/j.molcata.2009.02.004
3.
Pandeya S.N., Dimmock J.R. // Pharmazie. 1993.
20.
Singh P., Singh A.K., Singh V.P. // Polyhedron. 2013.
Vol. 48. N 9. P. 659.
Vol. 65. P. 73. doi 10.1016/j.poly.2013.08.008
4.
Попов Л.Д., Морозов А.Н., Щербаков И.Н., Туполо-
21.
Левченков С.И., Попов Л.Д., Ефимов Н.Н., Минин В.В.,
ва Ю.П., Луков В.В., Коган В.А. // Усп. хим. 2009.
Уголкова Е.А., Александров Г.Г., Старикова З.А.,
Т. 78. № 7. С. 697; Popov L.D., Morozov A.N.,
Щербаков И.Н., Ионов А.М., Коган В.А. // ЖНХ.
Shcherbakov I.N., Tupolova Y.P., Lukov V.V., Ko-
2015. Т. 60. № 9. С. 1238; Levchenkov S.I., Popov L.D.,
gan V.A. // Russ. Chem. Rev. 2009. Vol. 78. N 7. P. 643.
Shcherbakov I.N., Ionov A.M., Kogan V.A., Efimov N.N.,
doi 10.1070/RC2009v078n07ABEH003890
Minin V.V., Ugolkova E.A., Aleksandrov G.G., Stariko-
5.
Коган В.А., Зеленцов В.В., Ларин Г.М., Луков В.В.
va Z.A. // Russ. J. Inorg. Chem. 2015. Vol. 60. N 9.
Комплексы переходных металлов с гидразонами. М.:
P. 1129. doi 10.1134/S0036023615040129
Наука, 1990. С. 112.
22.
Попов Л.Д., Щербаков И.Н., Левченков С.И., Ту-
6.
Dutta R.L., Hossain M.M. // J. Sci. Ind. Res. 1985.
полова Ю.П., Бурлов А.С., Александров Г.Г., Лу-
Vol. 44A. P. 635.
ков В.В., Коган В.А. // Коорд. хим. 2011. Т. 37. № 7.
7.
Naseema K., Sujith K.V., Manjunatha K.B., Kallu-
С. 483; Popov L.D., Shcherbakov I.N., Tupolova Yu.P.,
raya B., Umesh G., Rao V. // Opt. Laser Technol. 2010.
Burlov A.S., Lukov V.V., Kogan V.A., Levchenkov S.I.,
Vol. 42. N 5. P. 741. doi 10.1016/j.optlastec.2009.11.019
Aleksandrov G.G. // Russ. J. Coord. Chem. 2011. Vol. 37.
8.
Feng Q., Li Y., Shi. G., Wang L., Zhang W., Li K.,
N 7. P. 483. doi 10.1134/S1070328411060078
Hou H., Song Y. // J. Mater. Chem. C. 2016. Vol. 4.
23.
Попов Л.Д., Левченков С.И., Щербаков И.Н., Ца-
N 36. P. 8552. doi 10.1039/C6TC01549B
турян А.А., Туполова Ю.П., Старикова З.А., Бур-
9.
Lawrence M.A.W., Lorraine S.C., Wilson K.A., Wilson K. //
лов А.С., Луков В.В., Коган В.А. // Коорд. хим. 2013.
Polyhedron. 2019. Vol. 173. P. 114111. doi 10.1016/j.
Т. 39. № 5. С. 259; Popov L.D., Shcherbakov I.N.,
poly.2019.114111
Tsaturyan A.A., Tupolova Y.P., Burlov A.S., Lukov V.V.,
10.
Heinze J., Frontana-Uribe B.A., Ludwigs S. // Chem.
Kogan V.A., Levchenkov S.I., Starikova Z.A. // Russ. J.
Rev. 2010. Vol. 110. N 8. P. 4724. doi 10.1021/
Coord. Chem. 2013. Vol. 39. N 5. P. 367. doi 10.1134/
cr900226k
S107032841304009X
11.
Su X., Aprahamian I. // Chem. Soc. Rev. 2014. Vol. 43.
24.
Гэрбэлэу Н.В., Гарновский А.Д., Арион В.Б., Боу-
P. 1963. doi 10.1039/C3CS60385G
рош И.Н., Симонов Ю.А., Алексеенко В.А., Индри-
12.
Gale P.A., Busschaert N., Haynes C.J.E., Karagian-
чан К.М., Хохлов А.В. // ЖНХ. 1988. Т. 33. № 7.
nidis L.E., Kirby I.L. // Chem. Soc. Rev. 2014. Vol. 43.
С. 1781.
P. 205. doi 10.1039/C3CS60316D
25.
Попов Л.Д., Распопова Е.А., Морозов А.Н., Левчен-
13.
Turner A.P.F. // Chem. Soc. Rev. 2013. Vol. 42. N 8.
ков С.И., Александров Г.Г., Бурлов А.С., Щерба-
P. 3184. doi 10.1039/C3CS35528D
ков И.Н., Коган В.А. // Коорд. хим. 2014. Т. 40. № 11.
14.
Коган В.А., Луков В.В. // Коорд. хим. 2004. Т. 30. № 3.
С. 668; Popov L.D., Raspopova E.A., Morozov A.N.,
С. 219; Kogan V.A., Lukov V.V. // Russ. J. Coord. Chem.
Burlov A.S., Shcherbakov I.N., Levchenkov S.I., Ko-
2004. Vol. 30. N 3. P. 205. doi 10.1023/B:RUCO.00000
gan V.A., Aleksandrov G.G. // Russ. J. Coord.
22119.12007.9c
Chem. 2014. Vol. 40. N 11. P. 806. doi 10.1134/
15.
Коган В.А., Луков В.В., Щербаков И.Н. // Коорд.
S1070328414110050
хим. 2010. Т. 36. № 6. С. 403; Kogan V.A., Lukov V.V.,
26.
Kovalenko A., Rublev P.O., Tcelykh L.O., Golovesh-
Shcherbakov I.N. // Russ. J. Coord. Chem. 2010. Vol. 36.
kin A.S., Lepnev L.S., Burlov A.S., Vashchenko A.A.,
N 6. P. 401. doi 10.1134/S1070328410060011
Marciniak L., Magerramov A.M., Shikhaliyev N.G.,
16.
Utochnikova V.V., Kovalenko A.D., Burlov A.S.,
Vatsadze S.Z., Utochnikova V.V. // Chem. Mater.
Marciniak L., Ananyev I.V., Kalyakina A.S., Kurcha-
2019. Vol. 31. N 3. P. 759. doi 10.1021/acs.
vov N.A., Kuzmina N.P. // Dalton Trans. 2015. Vol. 44.
chemmater.8b03675
P. 12660. doi 10.1039/C5DT01161B
27.
Бурлов А.С., Гарновский А.Д., Алексеенко В.А.,
17.
Kovalenko A.D., Bushmarinov I.S., Burlov A.S., Lep-
Мистрюков А.Э., Сергиенко В.С., Залетов В.Г., Лу-
nev L.S., Ilina E.G., Utochnikova V.V. // Dalton Trans.
ков В.В., Хохлов А.В., Порай-Кошиц М.А. // Коорд.
2018. Vol 47. P. 4524. doi 10.1039/C7DT04387B
хим. 1992. Т. 18. № 8. С. 859.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И КОМПЛЕКСООБР
АЗУЮЩАЯ СПОСОБНОСТЬ
123
28.
Попов Л.Д., Бородкин С.А., Туполова Ю.П., Левчен-
40.
Ракитин Ю.В. // Итоги науки и техники. Строение
ков С.И., Ткачев В.В., Бурлов А.С., Цатурян А.А. //
молекул и химическая связь. М.: ВИНИТИ, 1986.
ЖСХ. 2017. Т. 58. № 2. С. 383; Popov L.D., Borod-
Т. 10. С. 132.
kin S.A., Tupolova Yu.P., Levchenkov S.I., Tkachev V.V.,
41.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
Burlov A.S., Tsaturyan A.A. // J. Struct. Chem. 2017.
doi 10.1063/1.464913
Vol. 58. N 2. P. 366. doi 10.1134/S0022476617020214
42.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
29.
Gadbois D.F., Mendelsohn J.M., Ronsivalli L.J. //
Anal. Chem. 1965. Vol. 37. N 13. P. 1776. doi 10.1021/
Robb M.A., Cheeseman J.R., G. Scalmani V.B.,
ac60232a041
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
30.
Lederer E., Lederer M. Chromatographic. New York:
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Elsevier, 1953. P. 113.
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fuku-
31.
Wheeler O.H. // Chem. Rev. 1962. Vol. 62. N 3. P. 205.
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
doi 10.1021/cr60217a002
Nakai H., Vreven T., Montgomery J.A., Peralta J.E.,
32.
Vojinović-Ješić L.S., Češljević V.I., Bogdanović G.A.,
Ogliaro F., Bearpark M., Heyd J.J., Brothers E.,
Leovac V.M., Mészáros Szécsényi K., Divjaković V.,
Kudin K.N., Staroverov V.N., Kobayashi R., Normand J.,
Joksović M.D. // Inorg. Chem. Commun. 2010. Vol. 13.
N 9. P. 1085. doi 10.1016/j.inoche.2010.06.022
Raghavachari K., Rendell A., Burant J.C., Iyengar S.S.,
33.
Vojinović-Ješić L.S., Novaković S.B., Leovac V.M.,
Tomasi J., Cossi M., Rega N., Millam J.M., Klene M.,
Cesljevic V.I. // J. Serbian Chem. Soc. 2012. Vol. 77.
Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J.,
N 9. P. 1129. doi 10.2298/JSC120704083V
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
34.
Milenković M., Pevec A., Turel I., Milenković M.,
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
Čobeljić B., Sladić D., Krstić N., Anđelković K. //
Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P.,
J. Coord. Chem. 2015. Vol. 68. N 16. P. 2858. doi
Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O.,
10.1080/00958972.2015.1055260
35.
Anđelković K., Milenković M.R., Pevec A., Turel I.,
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
Matić I.Z., Vujčić M., Sladić D., Radanović D., Brađan G.,
Gaussian 09, Revision A.02. 2009.
Belošević S., Čobeljić B. // J. Inorg. Biochem. 2017.
43.
Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
Vol. 174. P. 137. doi 10.1016/j.jinorgbio.2017.06.011
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009
36.
Čobeljić B., Pevec A., Stepanović S., Spasojević V.,
44.
Zhurko G.A., Zhurko D.A. Chemcraft ver. 1.6 (build
Milenković M., Turel I., Swart M., Gruden-Pavlović M.,
Adaila K., Anđelković K. // Polyhedron. 2015. Vol. 89.
45.
Bourhis L.J., Dolomanov O.V., Gildea R.J., Ho-
P. 271. doi 10.1016/j.poly.2015.01.024
ward J.A.K., Puschmann H. // Acta Crystallogr.
37.
Levrand B., Fieber W., Lehn J.-M., Herrmann A. // Helv.
сhim. аcta. 2007. Vol. 90. N 12. P. 2281. doi 10.1002/
(A). 2015. Vol. 71. N 1. P. 59. doi 10.1107/
hlca.200790237
S2053273314022207
38.
Ревенко М.Д., Боурош П.Н., Паламарчук О.В., Лип-
46.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ковский Я., Гданец М., Симонов Ю.А. // ЖНХ. 2009.
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Т. 54. № 10. С. 1656; Revenko M.D., Palamarchuk O.V.,
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
Bourosh P.N., Simonov Yu.A., Lipkowski J., Gdaniec M. //
47.
Sheldrick G.M. // Acta Crystallogr. (A). 2007. Vol. 64.
Russ. J. Inorg. Chem. 2009. Vol. 54. N 10. P. 1581. doi
N 1. P. 112. doi 10.1107/S0108767307043930
10.1134/S0036023609100143
39.
Ракитин Ю.В., Калинников В.Т. Современная магне-
48.
Spek A.L. // J. Appl. Crystallogr. 2003. Vol. 36. P. 7. doi
тохимия. СПб: Наука, 1994. 276 с.
10.1107/S0021889802022112
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
124
ПОПОВ и др.
Acylhydrazone Based on 2-N-Tosylaminobenzaldehyde
and Girard T Reagent: Synthesis, Structure,
and Coordination Ability
L. D. Popova,*, S. I. Levchenkova,b, V. V. Lukova, K. B. Gishkoa, S. A. Borodkina,
Y. P. Tupolovaa, O. I. Askalepovaa, V. G. Vlasenkoc, D. V. Spiridonovad, V. A. Lazarenkoe,
A. S. Burlovf, and I. N. Shcherbakova
a Southern Federal University, Rostov-on-Don, 344090 Russia
b Southern Scientific Center of the Russian Academy of Sciences, Rostov-on-Don, 344006 Russia
c Scientific Research Institute of Physics, Southern Federal University, Rostov-on-Don, 344090 Russia
d St. Petersburg University, St Petersburg, 199034 Russia
e National Research Center «Kurchatov Institute», Moscow, 123182 Russia
f Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
*e-mail: ldpopov@mail.ru
Received November 5, 2020; revised November 5, 2020; accepted November 20, 2020
The novel hydrazone, a condensation product of 2-N-tosylaminobenzaldehyde and Girard T reagent, as well as
the Cu(II), Ni(II), Co(II) and Fe(III) complexes on its base were synthesized. The ligand structure and properties
were studied with IR, UV, NMR H1 spectroscopy, mass-spectrometry and potentiometry method. Structure of
nickel(II) complex was determined by X-ray diffraction analysis.
Keywords: hydrazones, complex compounds, X-ray structural analysis, quantum-chemical calculations, mag-
netochemistry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021