ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 1, с. 125-135
УДК 541.49:546.562:548.736:547.574
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ
АКТИВНОСТЬ СМЕШАННО-ЛИГАНДНЫХ
АМИНСОДЕРЖАЩИХ КООРДИНАЦИОННЫХ
СОЕДИНЕНИЙ МЕДИ(II) C
2-(2-ГИДРОКСИБЕНЗИЛИДЕН)-N-(ПРОП-2-ЕН-1-ИЛ)-
ГИДРАЗИНКАРБОТИОАМИДОМ
© 2021 г. А. П. Гуляa, В. О. Граурa, Я. И. Улькинаa,*, П. Н. Боурошb,
B. A. Смаглийc, О. С. Гарбузa,d, В. И. Цапковa
a Молдавский государственный университет, ул. Матеевича 60, Кишинев, MD-2009 Молдова
b Институт прикладной физики, Кишинев, MD-2028 Молдова
c Институт химии, Кишинев, MD-2028 Молдова
d Институт зоологии, Кишинев, MD-2028 Молдова
*e-mail: ianina.ulchina@gmail.com
Поступило в Редакцию 2 октября 2020 г.
После доработки 2 октября 2020 г.
Принято к печати 17 октября 2020 г.
Взаимодействие нитрата меди(II) с 2-(2-гидроксибензилиден)-N-(проп-2-ен-1-ил)гидразинкарботиоа-
мидом (H2L) в молярном отношении 1:1 в этаноле приводит к образованию координационного соеди-
нения Cu(HL)NO3·H2O. Введение в реакционную смесь аминов [имидазола (Im), 3,5-дибромпиридина
(3,5-Br2Py), 4-метилпиридина (4-Pic)] в молярном отношении 1:1:2 приводит к образованию комплексов
CuA(HL)NO3·nH2O [A = Im, 3,5-Br2Py, 4-Pic; n = 0, 3]. Строение полученных соединений установлено
методом РСА. Синтезированные комплексы проявляют противомикробную, противогрибковую, анти-
оксидантную и противораковую активность.
Ключевые слова: координационные соединения Cu(II), амины, 4-аллилтиосемикарбазон салицилового
альдегида, противомикробная активность, противораковая активность
DOI: 10.31857/S0044460X21010133
Тиосемикарбазоны и координационные сое-
этим представляет интерес синтез и исследование
динения переходных металлов с ними являются
новых смешанно-лигандных аминосодержащих
биологически активными соединениями
[1-3].
координационных соединений меди(II) с тиосеми-
Многие из них проявляют противомикробную,
карбазонами.
противогрибковую и противораковую активность
Нами были синтезированы координационные
[4-6]. В большинстве случаев координация ти-
соединения меди(II) c
2-(2-гидроксибензили-
осемикарбазонов к ионам меди(II) приводит к
ден)-N-(проп-2-ен-1-ил)гидразинкарботиоамидом
наиболее значительному усилению биологиче-
(H2L, схема 1) и такими аминами, как имидазол
ской активности по сравнению с ионами других
(Im), 3,5-дибромпиридин (3,5-Br2Py), 4-метилпи-
3d-металлов. Ряд исследований
[7-9] показал,
что введение различных аминов во внутреннюю
ридин (4-Pic), установлен их состав и строение,
сферу тиосемикарбазонатов меди(II) приводит к
исследованы физико-химические и биологические
изменению их биологических свойств. В связи с
свойства.
125
126
ГУЛЯ и др.
Схема 1.
S2
C12
C13
При взаимодействии горячего (50-55°С) эта-
C5
O1
O2
нольного раствора тиосемикарбазона H2L с эта-
C4
нольным раствором нитрата меди(II) в молярном
C6
Cu1
отношении 1:1 образуется мелкокристаллическое
S1
C7
соединение состава Cu(HL)NO3·H2O (1). Для
синтеза комплексов меди, содержащих в своем
C8
C3
составе гетероароматические амины, были про-
C2
N1
ведены реакции этанольных растворов тиоамида
C1
N2
H2L с нитратом меди(II) и аминами (имидазолом,
3,5-дибромпиридином, 4-метилпиридином) в мо-
C9
лярном соотношении 1:1:2. В результате получе-
N3
ны три аминосодержащих комплекса 2-4 состава
C10
CuA(HL)NO3·nH2O [A = Im (2), 3,5-Br2Py (3), 4-Pic
(4), n = 0 (2, 3), 3 (4)].
O3
Полученные координационные соединения 1-4
O4
C11
нерастворимы в диэтиловом эфире, мало раство-
N4
O5
римы в воде, лучше - в спиртах, хорошо раство-
римы в ДМФА и ДМСО. Определение молярной
электропроводности (æ) синтезированных ком-
Рис. 1. Общий вид молекулы комплекса 1а в кристалле.
плексов в метаноле показало, что соединения 1-4
и комплексов 1-4. В спектрах синтезированных
представляют собой бинарные электролиты типа
соединений присутствуют полосы поглощения в
1:1 (æ = 92-103 Ом-1·см2·моль-1) (табл. 1).
областях 3380-3100, 1630-1570, 1400-1100 см-1,
Магнетохимическое исследование синтезиро-
которые характеризуют валентные колебания коор-
ванных координационных соединений показало,
динированных молекул соответствующих лиган-
что комплексы 1-4 обладают заниженным значе-
дов. В области 3380-3100 см-1 ИК спектров всех
нием эффективного магнитного момента (μэф =
комплексов исчезает полоса поглощения ν(O-H)
1.42-1.50 М. Б., табл. 1) по сравнению с чисто спи-
фенольной группы, что указывает на депротони-
новым значением для одного неспаренного элек-
рование молекулы лиганда H2L в результате ко-
трона, что указывает на их полиядерное строение.
ординации. Кроме того, в спектрах наблюдается
Для определения способа координации тио-
смещение полосы поглощения ν(С=N) в низкоча-
семикарбазона к ионам меди(II) был проведен
стотную область на 18-25 см-1 и полосы погло-
сравнительный анализ ИК спектров лиганда H2L
щения ν(С=S) в высокочастотную область на 24-
Таблица 1. Физико-химические характеристики координационных соединений меди с 2-(2-гидроксибензилиден)-
N-(проп-2-ен-1-ил)гидразинкарботиоамидом
а
Выход,
μэфa,
æ,
Найдено, %
Вычислено, %
№
Формула
%
М. Б.
Ом-1·см2·моль-1
Cu
N
S
Cu
N
S
1
71
1.50
103
16.97
15.02
8.69
C11H14CuN4O5S
16.82
14.83
8.49
2
72
1.47
97
14.63
19.84
7.70
C14H16CuN6O4S
14.85
19.64
7.49
3
85
1.42
96
10.53
11.16
5.48
C16H15Br2CuN5O4S
10.65
11.74
5.37
4
83
1.50
92
12.36
14.15
6.60
C17H25CuN5O7S
12.53
13.81
6.32
а При 293 K.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
127
Таблица 2. Кристаллографические характеристики, данные эксперимента и уточнение структур комплексов 1а и 2-4
Параметр
1а
2
3
4
Химическая формула
C13H18Cu1N4O5S2
C28H32Cu2N12O8S2
C32H30Br4Cu2N10O8S2
C34H50Cu2N10O14S2
М
437.97
855.85
1193.50
1014.04
Сингония
Триклинная
Триклинная
Триклинная
Орторомбическая
Пространственная группа
P1
P1
P1
Рnna
Z
2
1
1
4
a, Å
4.4503(5)
7.4237(6)
7.1201(7)
26.5825(13)
b, Å
12.5530(12)
11.4130(9)
12.7325(11)
22.4006(10)
c, Å
17.0921(18)
11.8704(11)
13.0483(10)
7.5445(7)
α, град
108.339(9)
113.657(9)
114.097(8)
90
β, град
93.073(9)
98.037(8)
96.429(8)
90
γ, град
91.077(9)
97.209(7)
100.090(8)
90
V, Å3
904.40(18)
893.70(14)
1040.73(17)
4492.5(5)
dвыч , г/см3
1.608
1.590
1.904
1.499
μ, см-1
1.470
1.372
5.022
1.113
F(000)
450
438
586
2104
Размеры образца, мм
0.08×0.04×0.03
0.45×0.14×0.06
0.4×0.09×0.04
0.6×0.05×0.015
θmax, град
3.25-25.05
3.07-25.05
2.97-25.50
2.95-25.04
Пределы h, k, l
-5 ≤ h ≤ 5,
-8 ≤ h ≤8,
-8 ≤ h ≤ 8,
-31 ≤ h ≤ 29,
–14 ≤ k ≤ 14,
-13 ≤ k ≤ 9,
-12 ≤ k ≤ 15,
-16 ≤ k ≤ 26,
–20 ≤ l ≤ 15
-13 ≤ l ≤ 14
-15 ≤ l ≤ 15
-8≤ l ≤ 8
Измеренные/независимые
4883
4348
5800
14413
рефлексы
3194 [R(int) 0.0762]
3082 [R(int) 0.0213]
3847 [R(int) 0.0203]
3954 [R(int) 0.0736]
Рефлексы с I > 2σ(I)
1175
2309
2979
2251
GOOF
1.001
1.002
1.001
1.008
R-Факторы с I > 2σ(I)
R1 0.0847,wR2 0.1358
R1 0.0466,wR2 0.0873
R1 0.0374,wR2 0.0899
R1 0.0733,wR2
0.1583
R-Факторы по всему
R1 0.2269,
R1 0.0718,
R1 0.0551,
R1 0.1372,
массиву
wR2 0.1894
wR2 0.0979
wR2 0.0972
wR2 0.1853
Δρmax/Δρmin, е/Å3
0.426/-0.400
0.276/-0.262
0.538/-0.408
0.466/-0.273
38 см-1. Это указывает на координацию лиганда
при перекристаллизации полиядерного комплекса
H2L к центральным атомам посредством депрото-
1 из ДМСО произошло образование одноядерного
нированного фенольного атома кислорода, азоме-
соединения [Cu(DMSO)(HL)]NO3 1а, содержащего
тинового атома азота и атома серы в тионной фор-
координированную молекулу ДМСО (рис. 1). Тио-
ме. В ИК спектрах всех комплексов появляется ряд
семикарбазон выступает в качестве тридентатного
новых полос поглощения в области 510-415 см-1,
монодепротонированного лиганда и координи-
обусловленных колебаниями ν(Cu-N), ν(Cu-O) и
руется к центральному атому металла, используя
ν(Cu-S).
ONS-набор донорных атомов и образуя два ме-
При перекристаллизации комплекса 1 из ДМСО
таллоцикла: пятичленный тиосемикарбазидный
и комплексов 2-4 из этанола получены монокри-
и шестичленный салицилиденовый. Четвертое
сталлы, структура которых была установлена
координационное место атома Cu1 занимает атом
методом РСА. Соединение 1а, полученное пере-
О молекулы ДМСО, а его координационный по-
кристаллизацией комплекса 1 из ДМСО, кристал-
лиэдр, образованный O2NS-набором донорных
лизуется в триклинной пространственной группе
атомов, представляет собой искаженный квадрат.
P1 (табл. 2). В независимой части элементарной
При этом отклонение координированных атомов
ячейки кристалла находится комплексный катион
от средней плоскости равно ±0.05 Å. Межатомные
[Cu(DMSO)(HL)]+ и анион NO–. Таким образом,
расстояния Cu-O1, Cu-N1 и Cu-S1 равны 1.896(7),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
128
ГУЛЯ и др.
Таблица 3. Межатомные расстояния и валентные углы в координационных полиэдрах Cu(II) соединений 1а и 2-4а
d, Å
Связь
1а
2
3
4
Cu1-N1
1.933(8)
1.954(3)
1.971(3)
1.957(5)
Cu1-O1
1.896(7)
1.925(2)
1.926(3)
1.923(4)
Cu1-S1
2.263(3)
2.294(1)
2.295(1)
2.279(2)
Cu1-O2/N4
1.952(6)
1.961(3)
2.044(3)
2.000(6)
Cu1-O1*
2.703(1)
2.405(1)
2.664(1)
Угол
ω, град
N1Cu1O1
93.1(3)
90.8(1)
89.26(12)
92.57(2)
N1Cu1S1
87.0(3)
85.31(9)
84.76(10)
85.4(2)
N1Cu1O2/N4
173.3(4)
174.9(1)
171.07(12)
172.5(2)
N1Cu1O1*
-
94.3(4)
99.96(11)
90.7(1)
O1Cu1S1
178.3(3)
176.08(8)
173.74(8)
177.9(1)
O1Cu1O2/N4
92.1(3)
90.0(1)
90.00(12)
89.1(2)
O1Cu1O1*
–
83.7(9)
81.00(10)
82.9(1)
S1Cu1O2/N4
87.9(2)
93.89(9)
96.19(9)
93.0(1)
S1Cu1O1*
-
95.8(10)
98.17(7)
96.9(3)
N4Cu1O1*
-
90.9(9)
88.71(10)
96.8(3)
а
* -x+1, -y+1, -z (2); -x+1, -y+1, -z+1 (3); x, -y+3/2, -z+1/2 (4).
1.933(8) и 2.263(3) Å и соответствуют значениям
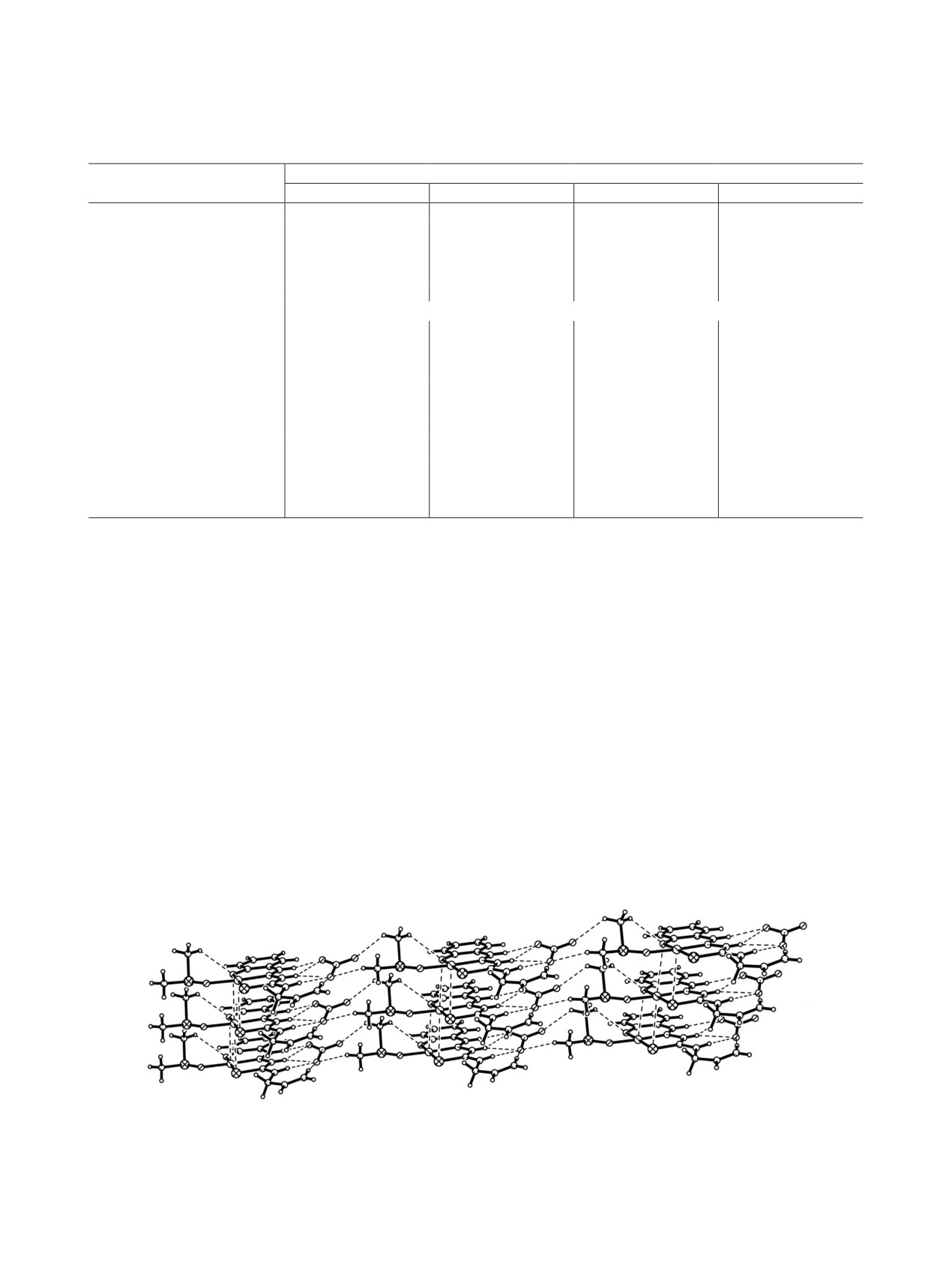
того, в кристалле можно выделить отдельные слои
для подобных соединениий [3, 10, 11]; расстояние
(рис. 2), связанные между собой слабыми водород-
Cu-O2 равно 1.952(6) Å (табл. 3).
ными связями С-Н∙∙∙S (рис. 3).
В кристалле соединения 1а комплексные кати-
Рентгеноструктурный анализ показал, что сое-
оны ассоциированы в стопку вдоль оси а слабы-
динения 2-4, также как и комплекс 1а, являются
ми взаимодействиями Сu1∙∙∙О1 (x+1, y, z) 3.525 Å и
ионными, однако в них образованы двуядерные
Сu1∙∙∙S1 (x-1, y, z) 3.505 Å, межатомное расстояние
комплексные катионы, заряды которых компенси-
Сu1∙∙∙Сu1 (x+1, y, z) 3.525 Å (рис. 2, 3). Комплексные
рованы теми же анионами NO–. В кристаллах со-
катионы дополнительно стабилизированы внутри-
единений 2 и 3 нет кристаллизационных молекул
молекулярными водородными связями С13-Н∙∙∙О1
растворителя, в то время как в комплексе 4 выяв-
(табл. 4). Анионы NO– связаны с одним катионом
лены разупорядоченные молекулы воды, занимаю-
как посредством протонов лиганда HL-, образуя
щие 10 позиций, в соотношении катионы:анионы:
межмолекулярные водородные связи N2-Н∙∙∙О3,
молекулы воды = 1:2:6.
N2-Н∙∙∙О4, N3-Н∙∙∙О4 и слабые С2-Н∙∙∙О3 и С11-
Координационные соединение 2-4 кристалли-
Н∙∙∙О4, так и связями С-Н∙∙∙О протонов метильных
зуются в пространственных группах P1 триклин-
групп молекул ДМСО (рис. 1-3, табл. 4). Кроме
ной и Рnna орторомбической сингоний (табл. 2).
Рис. 2. Образование стопок из комплексных катионов и формирование слоя в комплексе 1а.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
129
Координационные формулы этих соединений
[Cu2(Im)2(HL)2](NO3)2
2,
[Cu2(3,5-Br2Py)2(HL)2]·
(NO3)2 3 и [Cu2(4-Pic)2(HL)2](NO3)2·6H2O 4, т. е
во всех кристаллах обнаружены двухъядерные
комплексные катионы [Cu2(А)2(HL)2]2+ (рис. 4).
Координационные полиэдры атомов меди в ком-
плексах 2-4 - искаженные квадратные бипира-
миды, координиционные числа которых можно
описать как 4+1+1. В экваториальной плоскости
полиэдров находятся ONS-набор атомов моноде-
Рис. 3. Упаковка слоев в кристалле соединения 1а.
протонированного лиганда НL- и атом азота соот-
меди(II) с N-метилзамещенным лигандом [10]. В
ветствующего амина: Im, 3,5-Br2Py и 4-Pic. Кроме
того, лиганды HL- выполняют функцию мостиков.
результате этого, в одной из аксиальных позиций
Аналогичный способ координирования лиганда
полиэдров металла находится атом кислорода О1
HL- найден в трехъядерном комплексе сульфа-
второго лиганда HL- из данного димера (табл. 3).
та меди(II) [12] и двуядерном комплексе нитрата
Вторую аксиальную позицию координационного
Таблица 4. Геометрические параметры водородных связей для соединений 1а и 2-4
Расстояние, Å
Преобразование симметрии
Контакт D-H∙∙∙A
Угол DHA
D-H
H∙∙∙A
D∙∙∙A
для атомов А
1а
N2-H2∙∙∙O3
0.86
1.92
2.74(1)
158
x, y, z
N2-H2∙∙∙O4
0.86
2.53
3.25(1)
141
x, y, z
N3-H3∙∙∙O4
0.86
2.06
2.89(1)
163
x, y, z
C2-H2∙∙∙O3
0.93
2.58
3.32(2)
137
x, y, z
C11-H11A∙∙∙O4
0.93
2.33
3.34(1)
165
x, y, z
C12-H12B∙∙∙O5
0.96
2.61
3.33(1)
133
x-1, y+1, z
C13-H13C∙∙∙O1
0.96
2.53
3.12(1)
120
x, y, z
C13-H13B∙∙∙O5
0.96
2.48
3.23(1)
134
x-1, y+1, z
2
N2-H2∙∙∙O2
0.86
1.92
2.767(4)
167
x, y, z
N3-H3∙∙∙O4
0.86
2.05
2.899(4)
170
x, y, z
N5-H5∙∙∙O4
0.86
1.98
2.831(4)
169
x, y-1, z-1
C2-H2∙∙∙O2
0.93
2.56
3.319(5)
139
x, y, z
C10-H10∙∙∙O3
0.93
2.46
3.361(6)
164
-x, -y+2, -z+2
C12-H12∙∙∙O1
0.93
2.37
2.830(5)
110
x, y, z
3
N2-H2∙∙∙O3
0.86
2.54
3.244(5)
139
x, y, z
N2-H2∙∙∙O4
0.86
1.91
2.733(4)
160
x, y, z
N3-H3∙∙∙O3
0.86
1.97
2.817(5)
169
x, y, z
C2-H2∙∙∙O4
0.93
2.48
3.243(5)
139
x, y, z
C12-H12∙∙∙S1
0.93
2.73
3.307(4)
121
x, y, z
C16-H16∙∙∙O1
0.93
2.24
2.802(5)
119
x, y, z
4
N2-H2∙∙∙O2
0.86
2.54
3.243(5)
178
x, y, z
N3-H3∙∙∙O3
0.86
1.91
2.734(4)
180
x, y, z
C15-H15∙∙∙O4
0.93
2.45
3.371(8)
170
x-1/2, y, -z+1
C9-H9B∙∙∙O7W
0.97
2.75
3.607(4)
143
x, y, z
C16-H16∙∙∙O5W
0.93
2.73
3.419(5)
131
x, y, z
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
130
ГУЛЯ и др.
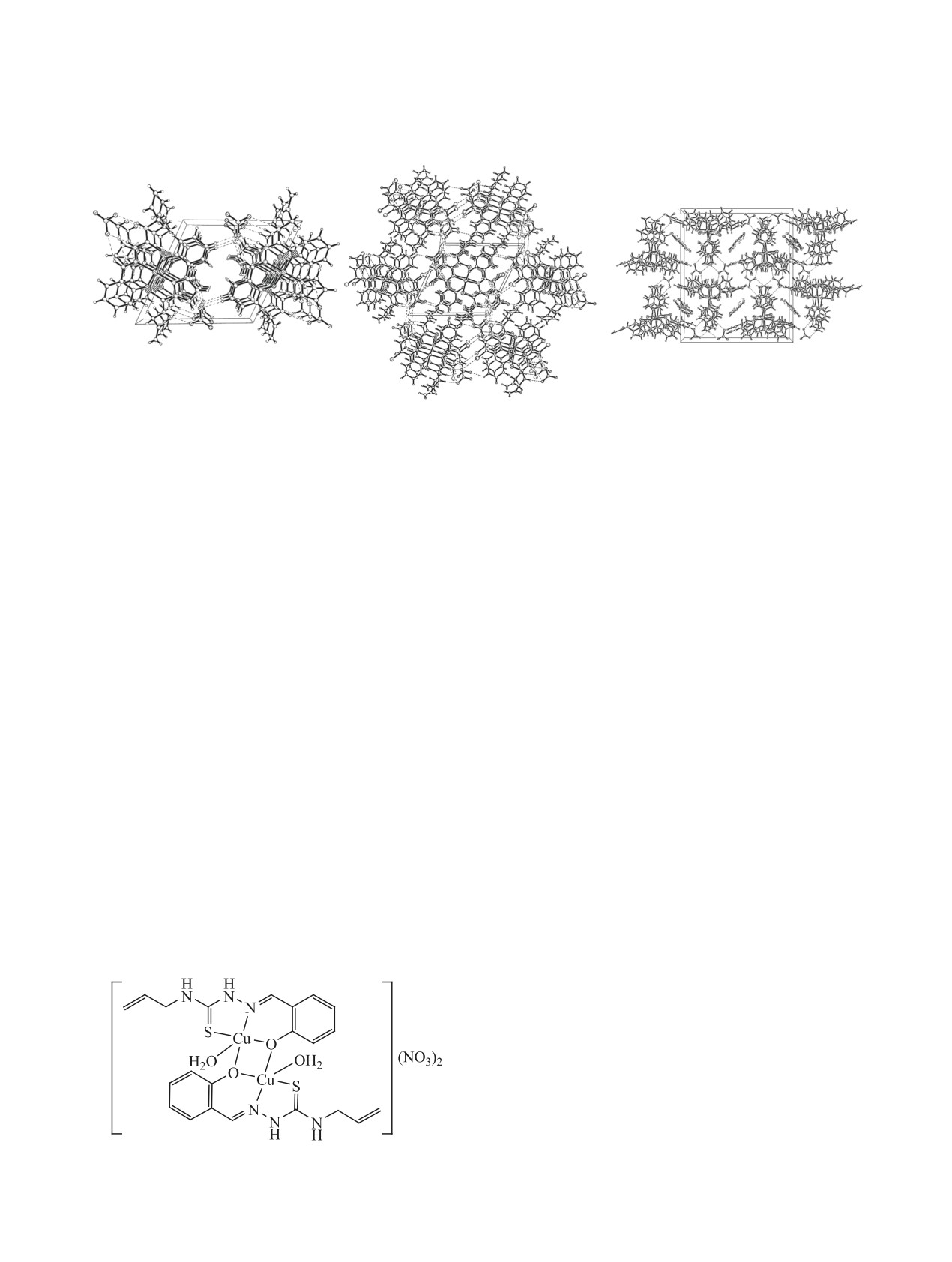
Рис. 4. Общий вид молекул двухъядерных комплексов 2 (а), 3 (б), 4 (в).
(a)
(б)
(в)
Рис. 5. Кристаллическая упаковка двухъядерных комплексных соединений 2 (а), 3 (б), 4 (в).
полиэдра занимает атом серы S1 соседнего димера
равны 3.486 и 3.957 Å (2), 3.308 и 3.853 Å (3), 3.462
(рис. 5). Межатомные расстояния Cu-O1, Cu-N1 и
и 4.102 Å (4) (рис. 2, 3, 5). При этом сами катионы
Cu-S1 в координационных полиэдрах комплексов
в кристалле объединены с анионами NO3- водо-
2-4, равные в среднем 1.925(3), 1.9614 и 2.289(1) Å
родными связями N2-H∙∙∙O, N3-H∙∙∙O и C-H∙∙∙O1.
(табл. 3), подобны найденным ранее [12] и не-
Донорами протонов выступают различные груп-
пы лиганда HL-, а акцепторами - атомы кисло-
много отличаются от найденных в комплексе 1а,
рода нитрат-ионов (табл. 4, рис. 4, 5). При этом
а расстояния Cu-N4, Cu-О1*, Cu-S1* находятся в
комплексы 2 и 3 ассоциированы в трехмерный
интервалах 1.961(3)-2.044(3), 2.405(1)-2.703(1) и
каркас за счет водородных связей C-H∙∙∙O, в ко-
3.328(1)-3.484(1) Å соответственно. Геометриче-
торых в качестве доноров выступают СН-группы
ские параметры аминов соответствуют найден-
как лиганда HL-, так и аминов. Кроме того, в ком-
ным в комплексах меди с подобными лигандами
плексе 2 можно выделить слои, образованные за
из Кембриджской базы структурных данных [13].
счет более сильных водородных связей N5-H∙∙∙O4*
Во всех кристаллических структурах 2-4 мож-
(рис. 6а). В комплексе 3 можно выделить допол-
но выделить стопки, образованные двуядерными
нительно Br∙∙∙O-взаимодействия с расстояниями
комплексными катионами с нанизанными на них
между атомами 3.017 и 3.169 Å (рис. 6б). В струк-
анионами. Межатомные расстояния Сu1∙∙∙Сu1*
туре комплекса 4 можно отметить образование
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
131
(a)
(б)
(в)
c
b
a
0
0
a
0
c
b
b
a
Рис. 6. Фрагменты кристаллической упаковки соединений 2 (а), 3 (б) и 4 (в).
слоев посредством водородных связей C-H∙∙∙O,
но, что лиганд H2L не проявляет противомикроб-
при упаковке которых образуются полости, в ко-
ной активности в отношении грамотрицательных
торых расположены разупорядоченные молекулы
микроорганизмов и Candida albicans, но проявля-
воды (рис. 6в). Расчет объема полостей в 4 пока-
ет как бактериостатическую, так и бактерицидную
зал, что они занимают 765.1 из 4492.5 Å3 элемен-
активность в отношении Staphylococcus aureus
тарной ячейки, что составляет 17.0%, больше, чем
в интервале концентраций 7-60 мкг/мл (табл. 5).
найденное в комплексе 2 (18.3 из 893.7 Å3 элемен-
Комплекс 1 не проявил активности в отношении
тарной ячейки, что составляет 2.0%). В кристал-
изученных штаммов микроорганизмов. Синтези-
лах соединений 1а и 3 не обнаружены полости,
рованные аминосодержащие координационные
доступные для кристаллизационных молекул.
соединения 2-4 проявляют противомикробную и
противогрибковую активность и обладают значе-
На основании полученных физико-химических
ниями минимальной подавляющей концентрации
данных распределение химических связей в ком-
(МПК) и минимальной бактерицидной концентра-
плексе 1, для которого не были получены моно-
ции (МБК) в интервале 3-500 мкг/мл. Следова-
кристаллы, можно представить следующим обра-
тельно, координация аминов привела к значитель-
зом (схема 2).
ному усилению противомикробной активности в
Для тиосемикарбазона H2L и координацион-
отношении грамотрицательных микроорганизмов
ных соединений 1-4 были изучены in vitro про-
и противогрибковой активности. Наиболее суще-
тивомикробная и противогрибковая активности в
ственное усиление активности по отношению к
отношении стандартных штаммов грамположи-
грамотрицательным микроорганизмам наблюдает-
тельного микроорганизма Staphylococcus aureus
ся в случае комплекса 4, содержащего 4-метилпи-
(ATCC
25923), грамотрицательных микроорга-
ридин.
низмов Escherichia coli (ATCC 25922) и Klebsiella
Изучение антипролиферативной активности
pneumonae (ATCC 13883), а также представителя
лиганда H2L и соединений 1-3 в отношении линий
грибов Candida albicans (ATCC 10231). Установле-
раковых клеток HL-60 миелоидной лейкемии че-
Схема 2.
ловека (табл. 6) и HeLa рака шейки матки (табл. 7)
показало, что соединение H2L практически не
проявляет активности, подавляя рост и размно-
жение раковых клеток на 7-8% при концентрации
10 мкМ. Соединение 1 подавляет рост и размно-
жение клеток HL-60 на 100% при концентрации
10 мкМ., а при более низких концентрациях (1 и
0.1 мкМ.) оно полностью теряет свою активность.
Введение аминов во внутреннюю сферу комплек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
132
ГУЛЯ и др.
Таблица 5. Минимальные подавляющие (МПК) и бактерицидные/фунгицидные (МБК/МФК) концентрации коорди-
национных соединений 1-4 по отношению к тест-микробам и грибам
Eschirichia coli
Klebsiella pneumoniae
Staphylococcus aureus
Candida albicans
ATCC 25922
ATCC 13883
ATCC 25923
ATCC 10231
Соединение
МПК
МБК
МПК
МБК
МПК
МБК
МПК
МФК
мкг/мл
Cu(NO3)2·3H2O
>1000
>1000
>1000
>1000
>1000
>1000
>1000
>1000
H2L
>
>
>1000
>1000
7
60
>
>
1
>
>
>1000
>1000
>
>
>
>
2
30
60
500
500
30
30
30
30
3
120
120
250
500
250
250
30
30
4
3
3
120
250
30
60
30
30
Таблица 6. Антипролиферативная активность соединений H2L и 1-3 в отношении линии клеток HL-60 миелоидной
лейкемии человека
Ингибирование клеточного роста, %a
Соединение
IC50, мкМ.
10 мкМ.
1 мкМ.
0.1 мкМ.
H2L
7.0
0
0
>10
1
100
0
0
5.0
2
97.6
96.6
7.6
0.32
3
96.8
94.9
25.4
0.28
Доксорубицин
99
98
15
0.50
а Средние результаты трех экспериментов, SEM < ±4%.
Таблица 7. Антипролиферативная активность соединений H2L и 1-3 в отношении линии клеток HeLa рака шейки
матки
Ингибирование клеточного роста, %a
Соединение
IC50, мкМ.
10 мкМ.
1 мкМ.
0.1 мкМ.
H2L
8.0
4.4
3.6
>10
1
100
13.6
11.9
1.3
2
88.3
0
0
7.0
3
100
0
0
5.0
Доксорубицин
49.8
12.2
0
10.0
а Средние результаты трех экспериментов, SEM < ±4%.
сов меди(II) 2 и 3 приводит к усилению активно-
раковой активности, показывающие во сколько раз
сти в отношении клеток HL-60. Эти комплексы
активность в отношении раковых клеток выше,
ингибируют пролиферацию данного вида раковых
чем в отношении нормальных клеток MDCK.
клеток почти на 100% при концентрациях 10 и
Активность комплекса 1 без амина во внутрен-
1 мкМ., а также проявляют небольшую активность
ней сфере значительно уступает по активности
и при концентрации 0.1 мкМ. В случае клеток
и селективности доксорубицину, применяемому
HeLa усиления активности не наблюдается.
в медицинской практике в качестве противора-
В табл. 8 представлены значения концентрации
кового вещества. Аминосодержащие комплексы
полумаксимального ингибирования IC50, который
2-3 превосходят доксорубицин по активности в
представляют собой показатель эффективности
отношении клеток HL-60 в 1.5-1.8 и в 1.4-2 раза
антипролиферативного действия исследуемых ве-
превосходят его активность в отношении клеток
ществ в отношении клеток HL-60, HeLa и модель-
HeLa. Кроме того, комплексы 2 и 3 превосходят
ной линии нормальных клеток млекопитающих
доксорубицин по селективности в отношении дан-
MDCK, а также индексы селективности противо-
ных линий раковых клеток. Их действие в отно-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
133
Таблица 8. Концентрации полумаксимального ингибирования IC50 исследуемых веществ в отношении клеток
MDCK, HL-60 и HeLa и индексы селективности SI
MDCK
HL-60
HeLa
Соединение
IC50, мкМ.
IC50, мкМ.
SIa
IC50, мкМ.
SIa
H2L
>10
>10
-
>10
-
1
6.0
5.0
1.2
1.3
4.6
2
12
0.32
37.5
7.0
1.7
3
9.0
0.28
32.1
5.0
1.8
Доксорубицин
7.1
0.50
14.2
10.0
0.71
шении нормальных клеток MDCK в 32.1-37.5 раза
ометрически рассчитанных позициях, а их темпе-
слабее, чем в отношении раковых клеток HL-60.
ратурные факторы UH приняты в 1.2 или 1.5 раза
большими, чем у связанных с ними атомов угле-
Результаты исследования антиоксидантной ак-
рода, азота и кислорода. Кристаллизационные
тивности соединений H2L и 1-4 в отношении ка-
молекулы воды в комплексе 4 локализованы в 10
тион-радикалов ABTS•+ представлены в табл. 9 в
позициях с коэффициентом заполнения от 0.15
виде концентраций полумаксимального ингибиро-
до 0.55. Основные параметры эксперимента, ре-
вания IC50. Некоординированный тиосемикарба-
шение и уточнение структур приведены в табл. 2,
зон H2L проявляет более высокую активность, чем
межатомные расстояния и валентные углы в коор-
тролокс, применяемый в медицинской практике в
динационных полиэдрах - в табл. 3, а параметры
качестве ингибитора свободных радикалов. Коор-
водородных связей - в табл. 4. Координаты базис-
динация H2L к иону меди(II) (комплекс 1) приво-
ных атомов исследованных структур депонирова-
дит к снижению антиоксидантной активности, а
ны в Кембриджский банк данных (CCDC 2033700-
введение аминов во внутреннюю сферу (комплек-
2033703).
сы 2-4) вновь повышает антиоксидантную актив-
ность, причем активность комплексов с аминами
Сопротивление растворов комплексов 1-4 в
превышает не только активность комплекса 1, но и
метаноле (20°С, с 0.001 моль/л) измеряли с помо-
исходного тиосемикарбазона H2L.
щью реохордного моста Р-38. ИК спектры веществ
Вышеприведенные экспериментальные дан-
регистрировали на спектрометре Bruker ALPHA
ные указывают на перспективность дальнейшего
(4000-400 см-1). Эффективные магнитные мо-
поиска селективных противомикробных, проти-
менты соединений 1-4 определяли методом Гуи.
вогрибковых и противораковых веществ среди
Расчет молярной магнитной восприимчивости с
смешанно-лигандных аминосодержащих коорди-
поправкой на диамагнетизм проводили исходя из
национных соединений меди с производными ти-
теоретических значений магнитной восприимчи-
осемикарбазона салицилового альдегида.
вости органических соединений.
Противомикробную, противогрибковую, анти-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
пролиферативную и антиоксидантную активности
Рентгеноструктурные данные для комплексов
изучали по стандартным методикам, описанным в
1а и 2-4 получены при 293(2) K на дифрактоме-
тре Xсalibur Е с МоKα-излучением и графитовым
Таблица 9. Антиоксидантная активность соединений
монохроматором. Параметры элементарной ячей-
H2L и 1-4 в отношении катион-радикалов ABTS•+
ки, уточненные по всему массиву, и остальные
Соединение
IC50, мкМ.
экспериментальные данные получены, используя
H2L
9.0
комплекс программ CrysAlis Oxford Diffraction
1
40
[14]. Их структуры решены прямыми методами и
2
5.8
уточнены МНК в анизотропном приближении для
3
7.5
неводородных атомов по программам SHELX-97
4
5.8
[15]. Атомы водорода включены в уточнение в ге-
Тролокс
33
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
134
ГУЛЯ и др.
работах [16, 17].
раствору добавляли этанольный раствор 10 ммоль
2-(2-Гидроксибензилиден)-N-(проп-2-ен-
2-(2-гидроксибензилиден)-N-(проп-2-ен-1-ил)ги-
1-ил)гидразинкарботиоамид (H2L) был получен
дразинкарботиоамида H2L и продолжали переме-
реакцией конденсации N-(проп-2-ен-1-ил)гидра-
шивание при умеренном нагревании в течение 1 ч.
зинкарботиоамида (4-аллилтиосемикарбазида) с
При охлаждении образовывался осадок, который
2-гидроксибензальдегидом (салициловым альде-
отфильтровывали, промывали небольшим количе-
гидом) в соответствии с методикой, описанной в
ством этанола и сушили на воздухе.
работе [18].
БЛАГОДАРНОСТЬ
Нитрат бис[µ2-2-({2-[(проп-2-ен-1-ил)карба-
Авторы выражают благодарность Г.Г. Бэлан и
мотиоил]гидразинилиден}метил)фенолято-
О.С. Бурдунюк (Государственный медицинский и
S,N,O:O]диаквадимеди(II) (1). К этанольному
фармацевтический университет им. Н. Тестемицану)
раствору, содержащему 10 ммоль 2-(2-гидрокси-
бензилиден)-N-(проп-2-ен-1-ил)гидразинкарботи-
за помощь при проведении биологических испы-
оамида H2L в 20 мл спирта, при непрерывном пе-
таний синтезированных веществ.
ремешивании и нагревании (50-55°С) прибавляли
ФОНДОВАЯ ПОДДЕРЖКА
раствор, содержащий 10 ммоль тригидрата нитра-
Работа выполнена в рамках государствен-
та меди(II) в 20 мл этанола. Полученную реакци-
ных программ Республики Молдова (проекты
онную смесь перемешивали в течение 40-50 мин.
После охлаждения до комнатной температуры на-
20.80009.5007.10 и 20.80009.5007.15).
блюдалось образование мелкокристаллического
КОНФЛИКТ ИНТЕРЕСОВ
вещества, которое отфильтровывали на стеклян-
ном фильтре, промывали небольшим количеством
Авторы заявляют об отсутствии конфликта
этанола и сушили на воздухе до постоянной массы.
интересов.
Нитрат бис[µ2-2-({2-[(проп-2-ен-1-ил)карба-
СПИСОК ЛИТЕРАТУРЫ
мотиоил]гидразинилиден}метил)фенолято-
1. Beraldo H., Gambino D. // Mini Rev. Med. Chem. 2004.
S,N,O:O]диимидазолдимеди(II)
(2).
К горя-
Vol. 4. N 1. P. 31. doi 10.2174/1389557043487484
чему (50-55°С) этанольному раствору (20 мл),
2. Joseph J., Mary N.L., Sidambaram R. // Synth. React.
содержащему
10 ммоль
2-(2-гидроксибензили-
Inorg. Metal-Org. Nano-Metal Chem. 2010. Vol. 40.
ден)-N-(проп-2-ен-1-ил)гидразинкарботиоами-
N 10. P. 930. doi 10.1080/15533174.2010.522661
да H2L, добавляли 10 ммоль тригидрата нитрата
3. Гуля А.П., Граур В.О., Чумаков Ю.М., Петрен-
меди(II). Полученную смесь перемешивали при
ко П.А., Бэлан Г.Г., Бурдунюк О.С., Цапков В.И.,
нагревании в течение 40-50 мин, затем к полу-
Рудик В.Ф. // ЖОХ. 2019. Т. 89. Вып. 5. С. 766. doi
ченному раствору добавляли этанольный раствор
10.1134/S0044460X19050159; Gulea A.P., Graur V.O.,
20 ммоль имидазола и продолжали перемешивание
Chumakov Yu.M., Petrenko P.A., Balan G.G., Bur-
при нагревании в течение 30 мин. При охлаждении
duniuc O.S., Tsapkov V.I., Rudic V.F. // Russ. J.
образовывался осадок, который отфильтровывали,
Gen. Chem. 2019. Vol. 89. N 5. P. 953. doi 10.1134/
промывали небольшим количеством этанола и су-
S1070363219050153
шили на воздухе.
4. Lovejoy D.B. // Blood. 2002. Vol. 100. N 2. P. 666. doi
10.1182/blood.v100.2.666
Аналогично, используя вместо имидазола
5. Pelosi G. // Open Crystallogr. J. 2010. Vol. 3. P. 16. doi
3,5-дибромпиридин синтезировали соединение 3.
10.2174/1874846501003010016
Гексагидрат нитрата бис[µ2-2-({2-[(проп-2-
6. Liberta A.E., West D.X. // Biometals. 1992. Vol. 5. N 2.
ен-1-ил)карбамотиоил]-гидразинилиден}ме-
P. 121. doi 10.1007/bf01062223
тил)фенолято-S,N,O:O]бис(4-метилпиридин)-
7. Присакарь В.И., Цапков В.И., Бурачева С.А.,
димеди(II) (4). К горячему (50-55°С) этанольному
Быркэ М.С., Гуля А.П. // Хим.-фарм. ж. 2005. T.
раствору (20 мл), содержащему 20 ммоль 4-метил-
39. № 6. С. 30. doi 10.30906/0023-1134-2005-39-6-
пиридина, добавляли 10 ммоль тригидрата нитра-
30-32; Prisakar’ V.I., Tsapkov V.I., Buracheeva S.A.,
та меди(II). Полученную смесь перемешивали при
Byrke M.S., Gulea A.P. // Pharm. Chem. J. 2005. Vol. 39.
нагревании в течение 30 мин, затем к полученному
N 6. P. 313. doi 10.1007/s11094-005-0142-8
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
135
8. Pahontu E., Fala V., Gulea A., Poirier D., Tapcov V.,
13. Allen. F.H. // Acta Crystallogr. (A). 2002. Vol. 58.
Rosu T. // Molecules. 2013. Vol. 18. N 8. P. 8812. doi
P. 380. doi 10.1107/S0108768102003890
10.3390/molecules18088812
14. CrysAlis RED, Oxford Diffraction Ltd., Version
9. Bindu P., Kurup M.R.P., Satyakeerty T.R. // Polyhedron.
1.171.34.76, 2003.
1998. Vol. 18. N 3-4. P. 321. doi 10.1016/S0277-
15. Sheldrich G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
5387(98)00166-1
Р. 112. doi 10.1107/S0108767307043930
10. Zhang Z., Gou Y., Wang J., Yang K., Qi J., Zhou Z.,
16. Gulea A., Poirier D., Roy J., Stavila V., Bulimestru I.,
Liang Sh., Liang H., Yang F. // Eur. J. Med. Chem. 2016.
Tapcov V., Popovschi L // J. Enzyme Inhib. Med.
Vol. 121. P. 399. doi 10.1016/j.ejmech.2016.05.021
Chem. 2008. Vol. 23. N 6. P. 806. doi 10.1080/
11. Orysyk S.I., Repich G.G., Bon V.V., Dyakonenko V.V.,
14756360701743002
Orysyk V.V., Zborovskii Yu.L., Shishkin O.V.,
17. Balan G., Burduniuc O., Usataia I., Graur V., Chuma-
Pekhnyo V.I., Vovk M.V. // Inorg. Chim. Acta. 2014.
kov Yu., Petrenko P., Gudumac V., Gulea A., Pahontu E. //
Vol. 423A. P. 496. doi 10.1016/j.ica.2014.08.056
Appl. Organometal. Chem. 2020. Vol. 34. N 3. P. e5423.
12. Бонь В.В., Орысык С.И., Пехньо В.И. // Коорд.
doi 10.1002/aoc.5423
хим. 2011. Т. 37. № 2. С. 151; Bon’ V.V., Orysyk S.I.,
18. Orysyk S.I., Bon V.V., Zholob O.O., Pekhnyo V.I.,
Pekhno V.I. // Russ. J. Coord. Chem. 2011. Vol. 37. N 2.
Orysyk V.V., Zborovskii Y.L., Vovk M.V. // Polyhedron.
P. 149. doi 10.1134/S1070328411010027
2013. Vol. 51. P. 211. doi 10.1016/j.poly.2012.12.021
Synthesis, Structure and Biological Activity of Mixed-Ligand
Amine-Containing Copper(II) Coordination Compounds
with 2-(2-Hydroxybenzylidene)-N-(prop-2-en-1-yl)-
hydrazinecarbothioamide
А. P. Guleaa, V. О. Graura, Ia. I. Ulchinaa,*, P. N. Bouroshb,
V. A. Smagliic, O. S. Garbuza,d, and V. I. Tsapkova
a State University of Moldova, Chisinau, MD-2009 Moldova
b Institute of Applied Physics, Chisinau, MD-2028 Moldova
c Institute of Chemistry, Chisinau, MD-2028 Moldova
d Institute of Zoology, Chisinau, MD-2028 Moldova
*e-mail: ianina.ulchina@gmail.com
Received October 2, 2020; revised October 2, 2020; accepted October 17, 2020
Сopper(II) nitrate reacts in ethanol with 2-(2-hydroxybenzylidene)-N-(prop-2-en-1-yl)hydrazinecarbothioamide
H2L in a 1:1 molar ratio to form coordination compound Cu(HL)NO3·H2O. Ligand H2L reacts with copper(II)
nitrate and amines [imidazole (Im), 3,5-dibromopyridine (3,5-Br2Py), 4-methylpyridine (4-Pic)] in a 1:1:2 molar
ratio to give coordination compounds CuA(HL)NO3·nH2O [A = Im, 3,5-Br2Py, 4-Pic; n = 0, 3]. The structures
of the obtained amine-containing complexes were determined by X-ray diffraction analysis. The synthesized
complexes exhibit antimicrobial, antifungal and antioxidant activities, as well as selective anticancer activity
against human leukemia HL-60 cell line.
Keywords: Cu(II) coordination compounds, amines, salicylaldehyde 4-allylthiosemicarbazone, antimicrobial
activity, anticancer activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 1 2021