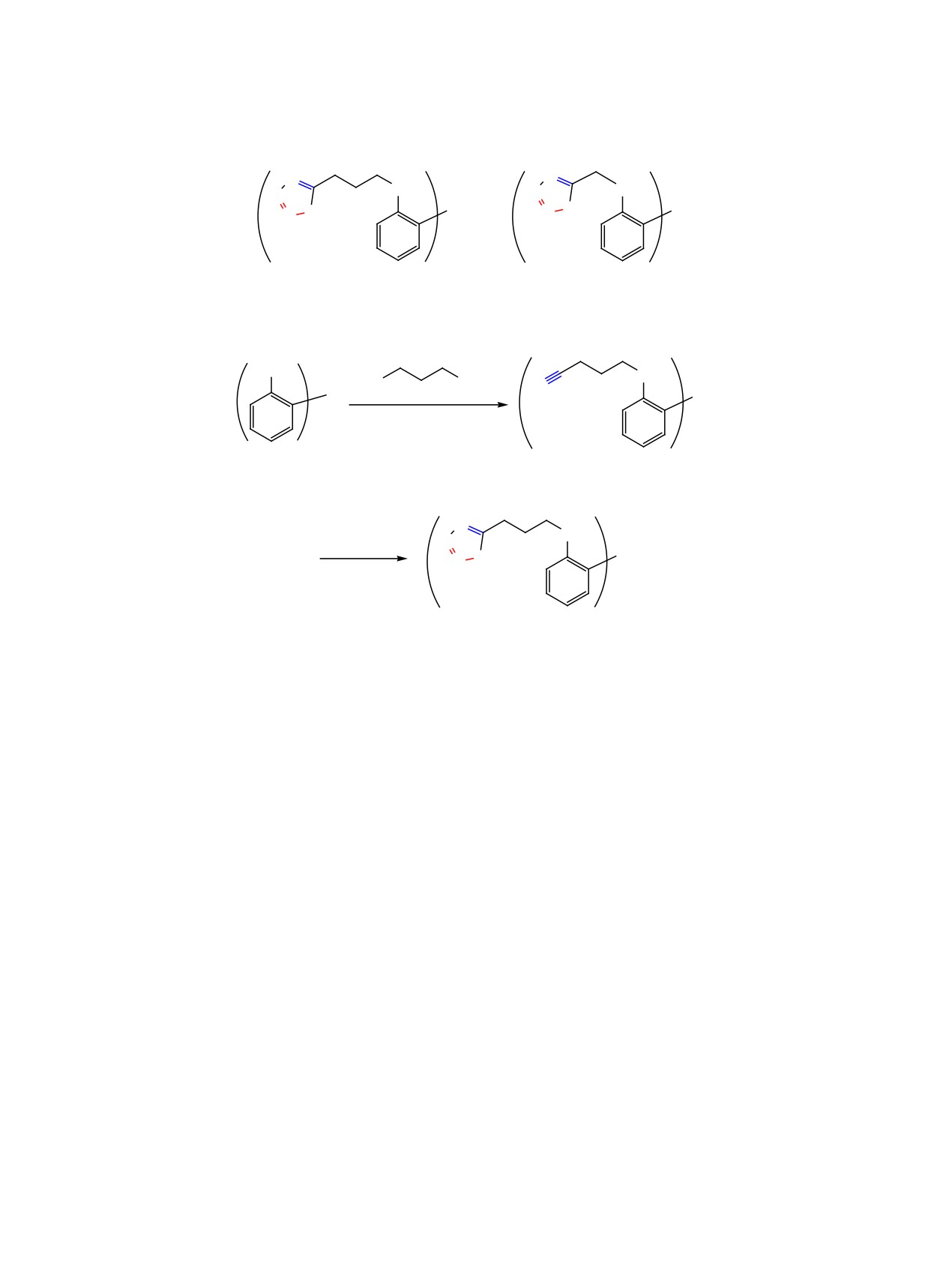ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 10, с. 1617-1626
УДК 547.796.1:541.118:541.49
ТРИПОДАЛЬНЫЙ ФОСФИНОКСИДНЫЙ ЛИГАНД С
ТЕТРАЗОЛЬНЫМИ ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ
© 2021 г. Т. В. Баулина*, И. Ю. Кудрявцев, О. В. Быховская, М. П. Пасечник,
Л. В. Аникина, А. В. Вологжанина, В. А. Кочмарик, В. К. Брель
Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
*e-mail: zaq@ineos.ac.ru
Поступило в Редакцию 31 июля 2021 г.
После доработки 31 июля 2021 г.
Принято к печати 19 августа 2021 г.
Алкилированием три-(2-гидроксифенил)фосфиноксида 4-бромбутиронитрилом получен тринитрил
[2-NC(CH2)3OC6H4]3PO, структура которого установлена рентгеноструктурным анализом. Концевые
CN группы полученного нитрила превращены в тетразольные циклы клик-реакцией с образованием
нового гибридного триподального пропеллерного лиганда - трис{2-[3′-(тетразол-5′′-ил)пропокси]фенил)-
фосфиноксида. Получены палладиевые комплексы данного лиганда и его короткоцепного аналога -
трис[2-(тетразол-5′-илметокси)фенил]фосфиноксида. Изучена цитотоксичность данных лигандов и их
палладиевых комплексов.
Ключевые слова: тетразольные триподальные лиганды, комплексы с Pd(II), кристаллическая структура
DOI: 10.31857/S0044460X2110019X
Соединения, содержащие тетразольные фраг-
ским превращениям [16]. Тетразолы проявляют
менты, представляют большой интерес для ко-
антиангиогенную [17], антибактериальную [18],
ординационной химии как лиганды для ионов
антираковую [19, 20], фунгицидную [21], противо-
металлов [1-3] и структурные элементы для кон-
малярийную [22], противотуберкулезную [23], ан-
струирования новых материалов: координацион-
тивирусную [24] активность.
ных полимеров [4, 5] металлоорганических сеток
Использование
трифенилфосфиноксидного
(metal-organic frameworks, MOFs) [6], энергети-
фрагмента как структурного ядра триподального
ческих материалов [7], суперконденсаторов [8],
лиганда может благоприятствовать комплексообра-
спин-кроссоверов [9, 10].
зованию с ионами металлов [25-29]. Сочетание
В литературе описано несколько триподальных
фрагмента P=O и тетразольных функциональных
лигандов с тетразольными подвесками [5, 6, 8,
групп в гибридных лигандах предоставляет под-
11-13]. Их комплексы с d- и f-элементами были
ход к новым соединениям, перспективным в каче-
предложены в качестве светоизлучающих матери-
стве лигандов и биологически активных молекул.
алов [1, 2] и контрастных агентов [14].
Целью настоящей работы является синтез ги-
В то же время тетразолы имеют особое значе-
бридного лиганда 1, содержащего центральное
ние для медицинской химии, поскольку они прояв-
фосфиноксидное ядро и боковые тетразольные
ляют широкий спектр биологической активности,
группы, и изучение его свойств, в частности цито-
хотя и не встречаются в природе [15]. Тетразолы
токсичности по отношению к опухолевым клеткам
являются биоизостерами карбоновой кислоты и
как самого лиганда, так и его палладиевого ком-
метаболически устойчивы ко многим биологиче-
плекса. Также было интересно сравнить лиганд 1 с
1617
1618
БАУЛИНА и др.
Схема 1.
N
N
O
O
N
N
PO
PO
N NH
N NH
3
3
1
2
Схема 2.
OH
O
Br
CN
N
PO
PO
K2CO3, ДМФА, ∆
3
3
3
4
N
O
NaN3, NH4Cl
N
PO
N NH
ДМФА-H2O, ∆
3
1
его аналогом 2 с более коротким линкером опубли-
квинтетов в области 1.6-4.1 м. д. Сигналы фениль-
кованным нами ранее [Быховская О.В. и др., ЖОХ,
ных протонов центрального трифенилфосфинок-
2019, 89, № 12] (схема 1).
сидного ядра имеют химические сдвиги и мульти-
плетности типичные для соединений этой серии
Целевой лиганд 1 был получен в две стадии
[31] и проявляются в виде дублетов и триплетов
по следующей схеме. На первой стадии реакцией
при 6.8-7.7 м. д. В спектре ЯМР 13C имеются син-
фосфиноксида 3 [30] c 4-бромбутиронитрилом в
глетные сигналы метиленовых групп линкера в
присутствии K2CO3 в безводном ДМФА был по-
области 13-66 м. д. и CN-группы при 119.3 м. д.
лучен трис[2-(3′-цианопропокси)фенил]фосфин-
Сигналы атомов углерода трифенилфосфинок-
оксид 4 с выходом 96.2% (схема 2). Соединение
сидного ядра проявляются в виде дублетов в об-
было выделено в виде белого кристаллического
ласти 111-161 м. д. с характерными константа-
порошкообразного вещества, хорошо растворимо-
ми спин-спинового взаимодействия JPС от 1.7 до
го в органических растворителях (CH2Cl2, CHCl3,
111.2 Гц. В спектре ЯМР 31P имеется синглет с хи-
ДМФА, ДМСО и др.).
мическим сдвигом 28.1 м. д. типичным для триа-
Состав и строение полученного тринитрила 4
рилфосфиноксидов.
подтверждены данными элементного анализа, ИК
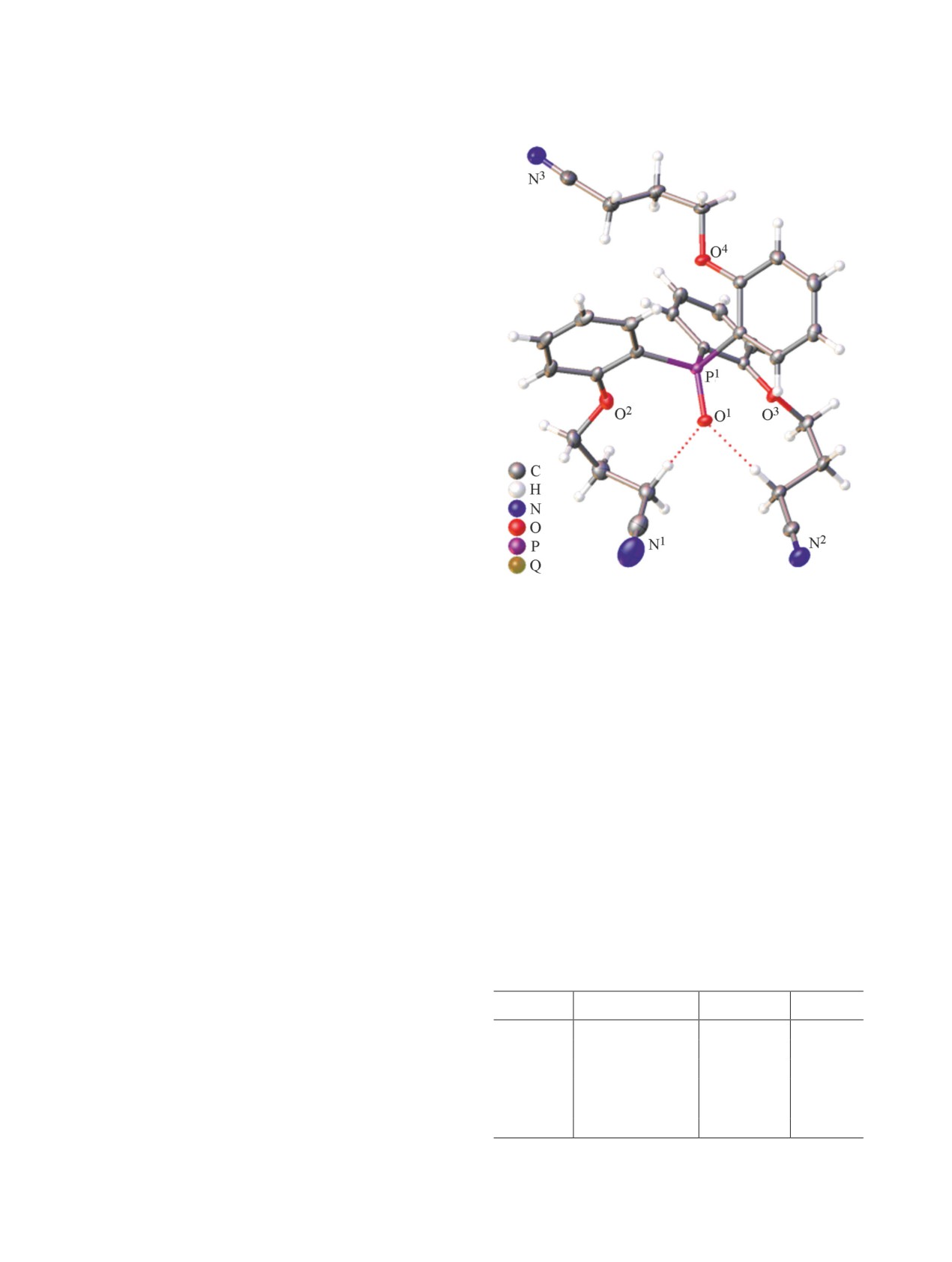
Молекулярное строение трис[2-(3′-цианопро-
и ЯМР (1Н, 13С и 31Р) спектроскопии. В ИК спек-
покси)фенил]фосфиноксида 4 окончательно уста-
тре соединения 4 наблюдаются полосы ν(С≡N) при
новлено методом рентгеноструктурного анализа
2241 см-1 и ν(P=O) при 1176 см-1. В спектре ЯМР
(рис. 1). Некоторые длины связей приведены в
1H раствора в CDCl3 наблюдаются сигналы мети-
табл. 1. Молекула фосфиноксида 4 имеет асим-
леновых протонов линкера в виде триплетов или
метричную конформацию, в которой два из трех
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
ТРИПОДАЛЬНЫЙ ФОСФИНОКСИДНЫЙ ЛИГАНД
1619
орто-заместителей расположены по ту же сторо-
ну, что и группа P=O по отношению к углерод-
ным атомам POC3-фрагмента, а третий замести-
тель направлен в противоположную сторону. Угол
O1P1C22O4, соответствующий заместителю, распо-
ложенному на противоположной стороне от фос-
финоксидной группы равен -172.2(1)°, а два дру-
гих заместителя находятся по ту же сторону, что
и группа P=O, и образуют углы OPCO от 38.6(1)
до 64.8(1)°. В ранее описанных трис(тетразолах)
и трис(алканолах) [31] конформация молекулы
дополнительно стабилизирована двумя связями
C-H···O(P). В молекуле соединения 4 также име-
ются две внутримолекулярные связи O-H···O(P)
двух заместителей, расположенных по ту же сто-
рону, что и группа P=O (рис. 1). Длины связей и
углы имеют обычные значения для фосфорилтри-
с(2,1-фенилен)оксиалкенов, опубликованных ра-
нее [27, 29, 31-33].
На второй стадии тринитрил 4 был введен в
реакцию с NH4N3 полученным in situ из NH4Cl и
Рис. 1. Общий вид молекулы трис[2-(3′-цианопропок-
NaN3, в результате чего был получен лиганд 1 с
си)фенил]фосфиноксида 4 (CCDC 2085004) в пред-
выходом 74.2% (схема 2). Его строение установле-
ставлении атомов в виде тепловых эллипсоидов (p
но методами ИК, КР и ЯМР (1H, 13C, 31P) спектро-
50%). Внутримолекулярные взаимодействия C-H···O
скопии. Трис([2-(тетразол-5′-илметокси)фенил]-
обозначены пунктирными линиями.
фосфиноксид 2 был получен нами ранее [Быхов-
ская О.В. и др., ЖОХ, 2019, т. 89, № 12] тем же
методом, что и соединение 1 из соответствующего
Отнесение частот колебаний колец основа-
цианопроизводного [25].
но на данных расчета частот и форм нормаль-
ных колебаний 5-замещенных тетразолов [34].
ИК и КР спектры лиганда 1 были сопостав-
Полосы поглощения в области 1600-1400 см-1,
лены с ранее описанными спектрами лиганда 2
относящиеся в основном к колебаниям ν(C=N)
известного строения (табл. 2). ИК спектр соеди-
и ν(N=N), в спектрах соединений 1 и 2 перекры-
нения 1 не содержит полос исходного тринитри-
ваются интенсивными полосами феноксигрупп
ла 4 при 2241 см-1 [ν(С≡N)] и 1176 см-1 [ν(P=O)].
и не могут быть надежно определены. Поло-
Вместо этого спектр содержит полосу ν(P=O) при
са при 1480 см-1 в спектре лиганда 1 (табл. 2)
1086 см-1, как и для лиганда 2, которая соответ-
ствует фосфорильной группе, вовлеченной в би-
фуркатную водородную связь В области колебаний
Таблица 1. Некоторые длины связей и углы в молекуле
ν(NH) спектр соединения 1 аналогичен спектру
соединения 4
соединения 2. Следует отметить, что спектр рас-
твора лиганда 1 в ДМСО-d6 содержит не только
Связь
d, Å
Угол связи
ω, град
полосу ν(P=O), соответствующую фосфориль-
P=O
1.4943(8)
O1P1C2O2
-65.0(1)
ной группе, связанной одной водородной связью
P-C
1.807(1)-1.809(1)
O1P1C12O3
-37.6(1)
(1157 см-1), и, в отличие от лиганда 2, полосу сво-
CAr-O
1.365(1)-1.366(1)
O1P1C22O4
-172.2(1)
бодной группы P=O (1185 см-1). Эта особенность
C(H2)-O
1.435(1)-1.441(2)
может быть связана с большей длиной, что прида-
N≡C
1.144(2)-1.146(2)
NC-C(H2)
1.467(2)-1.469(2)
ет более высокую мобильность подвескам.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
1620
БАУЛИНА и др.
Таблица 2. Данные ИК спектроскопии для лигандов 1, 2 и комплексов 5, 6
Соединение
Состояние/растворитель
ν, см-1
ν(P=O, см-1
ν(NH), см-1
1
Твердый образец
1480, 1466, 1242, 1124, 1110, 1043, 986
~1090
~2700 ш
ДМСО-d6
1248, 1219, 1127, 1065
1185, 1157a
- б
1∙PdCl2 (5)
Твердый образец
1474, 1245, 1111, 1064, 1042, 942
~1090
3200-2100
2
Кристаллы
1388, 1246, 1233, 1118, 1104, 1041, 1027
~1090
~2700 ш
ДМСО-d6
1248, 1219, 1127, 1065
1155a
- б
2∙PdCl2 (6)
Твердый образец
1396, 1247, 1123, 1066, ~1030 ш
~1090
3200-2200
a Плечо полосы поглощения растворителя при 1090 см-1.
б Полоса поглощения растворителя.
принадлежит в основном колебаниям ν(C-N),
спектроскопии. По данным элементного анализа,
полоса 1242 см-1 относится к колебаниям связей
лиганды 1 и 2 образуют с PdCl2 комплексы состава
N=N, смешанными с деформациями кольца, в то
1:1. В отличие от лантанового комплекса с депро-
время как полосы при 1124 и 1110 см-1 принадле-
тонированным лигандом 2, описанным нами ранее
жат деформационным колебаниям δ(NH). Полоса
[Быховская О.В. и др., ЖОХ, 2019, т. 89, № 12], в
в области 1040 см-1 обусловлена внеплоскостными
комплексе 6 сохраняются аминогруппы, способ-
колебаниями ρ(NH), смешанными с деформацией
ные к образованию водородных связей, что может
цикла или кольца, а полоса при 990 см-1 относится
влиять на координационные свойства лиганда. В
к деформации цикла. При растворении лиганда 1 в
области колебаний ν(NH) палладиевого комплек-
ДМСО-d6 происходит разрушение межмолекуляр-
са, полосы по сравнению со свободным лигандом
ных водородных связей и одной внутримолекуляр-
меняют свою форму: максимум при 2700 см-1 ста-
ной водородной связи Р=О∙∙∙HN, о чем свидетель-
новится менее интенсивным, и появляется второй
ствуют изменения полос δ(NH) и ν(P=O) (табл. 2).
максимум (~3100 см-1), который может относиться
В спектре ЯМР 1H лиганда 1 имеются сигналы
к менее прочно связанным NH-группам и колеба-
метиленовых групп линкера в виде трех уширен-
ниям ν(ОH) связанной воды. Полоса ν(Р=О), как и
ных синглетов в области 1.7-3.9 м. д. Арильные
в спектре лиганда, находится около 1090 см-1, что
протоны проявляются в виде мультиплетов при
свидетельствует о сохранении внутримолекуляр-
6.8-7.3 и 7.4-7.7 м. д. В спектре ЯМР 1H не обнару-
ной водородной связи фосфорильного кислорода
жено сигналов NH-группы, что является обычной
с двумя тетразольными кольцами, полосы колеба-
особенностью спектров тетразолов. В спектрах
ний колец изменяются (табл. 2). Спектр КР ком-
ЯМР 13C имеется три синглетных сигнала мети-
плекса 6 содержит полосу при 300 см-1, которая
леновых групп линкера при 19-67 м. д., синглет
может быть отнесена к симметричным колебани-
тетразольного углерода при 155.67 м. д. и несколь-
ям νs(Pd-Cl) в комплексе транс-строения [36], т. е.
ко дублетов арильных углеродов в области 113-
палладий, видимо, координирует два тетразоль-
160 м. д. Спектр ЯМР 31P содержит синглет при
ных кольца в транс-положении. Учитывая, что
28 м. д., типичный для триарилфосфиноксидов.
комплекс имеет состав 1:1, можно предположить,
Известно, что палладиевые комплексы с раз-
Схема 3.
личными гетероциклическими соединениями про-
являют противоопухолевую активность [35]. В
HCl + H2O
связи с этим, мы синтезировали комплексы соста-
1 + PdCl2
1·PdCl2·2.5H2O↓
EtOH
ва 1:1 нового лиганда 1 (n = 3) и полученного ранее
5
2 (n = 1) с PdCl2. В результате были получены ком-
HCl + H2O
плексы 5 и 6 соответственно (схема 3).
2 + PdCl2
2·PdCl2·H2O↓
Комплексы были выделены и охарактеризо-
EtOH
6
ваны данными элементного анализа, ИК и ЯМР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
ТРИПОДАЛЬНЫЙ ФОСФИНОКСИДНЫЙ ЛИГАНД
1621
Таблица 3. Данные спектроскопии ЯМР 1Н для лигандов 1, 2 и комплексов 5, 6 (δ, м. д.)
Соединение
CH2CH2CH2
CH2-тетразол
CН2О
Н3, Н5
Н4, Н6
31P{1Н}
1
1.76 уш. с
2.65 уш. с
3.87 уш. с
6.85-7.25 м
7.42-7.60 м
28.0
2 [4]
-
5.37 уш. с
-
6.95 т (Н5), 7.32 д. д
7.25 д. д (Н6),
32.0
(Н3)
7.60 т (Н4)
а
5
1.74 уш. с
2.63 т
6.98 т (Н5), 7.08 д. д
7.47 д. д (Н6),
28.1
(Н3)
7.53 т (Н4)
6
-
-
5.38 уш. с
6.96 т (Н5), 7.34 т. д
7.26 д. д (Н6),
29.5
(Н3)
7.58 т (Н4)
а Сигнал заслонен сигналом воды.
что эти тетразольные кольца принадлежат разным
Спектр ЯМР 1Н комплекса 6 содержит широ-
молекулам, и образуются димеры, в которых одно
кий синглет CН2О-группы при 5.38 м. д. и сигна-
из тетразольных колец играет роль мостика. Кроме
лы ароматических протонов в виде триплетов при
того, молекула воды может быть связана как с про-
6.96 (Н5) и 7.58 м. д. (Н4), триплетов дублетов при
тоном, так и атомом азота с образованием связей
7.34 м. д. (Н3) и дублетов дублетов при 7.26 м. д.
между комплексами.
(Н6). Сравнение сигналов протонов для лигандов
Полоса ν(Р=О) в спектре комплекса 5, как и в
1 и 2 и комплексов 5 и 6 (табл. 3) указывает на то,
комплексе 6, не изменила своего положения по
что комплексообразование с PdCl2 не вызывает
сравнению со спектром свободного лиганда, поэ-
значительного изменения спектров ЯМР 1Н. Ана-
тому, можно предположить сохранение узла с би-
логичная картина наблюдается для спектров ЯМР
фуркатной водородной связью. Положение полос
31P: сигнал атома фосфора при комплексообразо-
кольца немного изменилось (см. табл. 2). В спектре
вании сдвигается в слабое поле на 0.1-2.5 м. д. Эти
КР имеется полоса νs(Pd-Cl) при 299 см-1 более
данные указывают на отсутствие координации с
интенсивная, чем для комплекса 6, и характерная
группой P=O при комплексообразовании.
для транс-геометрии координационной плоско-
Лиганды 1, 2 и их комплексы с палладием(II)
сти. В целом, сравнение колебательных спектров
5 и 6 были протестированы на цитотоксическую
указывает на сходство строения этих двух палла-
активность по отношению к культурам клеток че-
диевых комплексов.
ловека А549 (карцинома легкого), НСТ116 (карци-
Таким образом, на основании колебательных
нома толстого кишечника), HeLa (аденокарцинома
спектров, мы предполагаем транс-строение ком-
шейки матки), MCF7 (аденокарцинома молочной
плексов 5 и 6 с координацией тетразольных колец
железы). Полученные результаты представлены в
двух лигандов и сохранением бифуркатной вну-
табл. 4.
тримолекулярной водородной связи с фосфориль-
Все протестированные соединения проявили
ной группой.
активность ниже, чем стандарт (камптотецин).
Комплексы 5 и 6 медленно растворяются в
Палладиевый комплекс 5 оказался неактивным по
ДМСО, причем, судя по ИК спектрам, не разлагаются.
отношению ко всем изученным культурам клеток,
Спектр ЯМР 1Н раствора комплекса 5 содер-
а все соединения были неактивны по отношению
жит широкий синглет центральной метиленовой
к клеткам НCT116 (карцинома толстого кишечни-
группы линкера при 1.74 м. д. и триплет протонов
ка). Лиганды 1 и 2 проявили почти одинаковую
CH2N при 2.63 м. д., тогда как сигнал CН2О-прото-
цитотоксичность в отношении клеток А549, HeLa
нов заслонен сигналом воды (табл. 3). Арильные
и MCF7. В то же время комплекс 6 проявил вдвое
протоны комплекса 5 проявляются в виде трипле-
более высокую цитотоксичность по отношению к
тов при 6.98 (Н5), 7.53 (Н4) и дублетов дублетов
клеткам А549, HeLa, MCF7 по сравнению с исход-
при 7.08 (Н3) и 7.47 м. д. (Н6).
ным лигандом 2. В целом, Pd-комплекс лиганда 2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
1622
БАУЛИНА и др.
Таблица 4. Цитотоксичность соединений 1, 2, 5, 6 in vitro в MTT-тестеа
IC50, мкМ.
Соединение
А549
НCT116
HeLa
MCF7
1
333.92±48.33
-
350.14±22.01
586.13±23.40
2
382.17±20.84
-
242.75±17.24
444.00±15.60
5
-
-
-
-
6
171.36±9.02
-
141.17±5.68
160.55±10.21
Камптотецин
6.57±0.16
5.68±0.28
0.33±0.07
24.30±2.87
а «-» - нет эффекта.
с коротким линкером оказался наиболее активным
разцов в области 3500-100 см-1 были записаны на
соединением в этой серии.
спектрометре Jobin-Ivon LabRAM 300, снабжен-
ном микроскопом и лазерным CCD-детектором.
Таким образом, нами был получен трис-
В качестве источника возбуждения использовали
[2-(3′-цианопропокси)фенил]фосфиноксид,
его
линию 632.8 нм He-Ne лазера мощностью не бо-
молекулярная структура была установлена рент-
лее 2 мВт. Спектры ЯМР 1Н, 13С{1Н} и 31P{1Н}
геноструктурным анализом. Синтезирован но-
растворов синтезированных соединений в CDCl3
вый триподальный лиганд - трис{2-[3′-(тетра-
и ДМСО-d6 регистрировали на приборе Bruker
зол-5′′-ил)пропокси]фенил}фосфиноксид - и его
Avance 400. Рабочие частоты 1Н, 13С и 31P состав-
комплекс с PdCl2. Изучена противораковая актив-
ляли 400.13, 100.61 и 161.98 МГц соответственно.
ность полученных соединений по отношению к
В спектрах ЯМР 1Н и 13С сигналы остаточных про-
культурам клеток человека. Согласно полученным
тонов и атомов углерода растворителя использова-
данным, наиболее перспективным для дальней-
ны в качестве внутренних стандартов, точность
ших исследований оказался комплекс с трис[2-
определения химических сдвигов не менее 0.01 и
(тетразол-5′-илметокси)фенил]фосфиноксидом.
0.03 м. д., соответственно. Значения химических
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
сдвигов в спектрах ЯМР 31P получены относитель-
. Отнесе-
но внешнего стандарта 85%-ная H3PO4
Органические растворители марки ХЧ обезво-
ние сигналов было сделано на основании сравне-
живали и очищали по стандартным методикам
ния со спектрами родственных соединений [31].
[37]. Дейтерированные растворители CDCl3 и
Температуры плавления измерены укороченными
ДМСО-d6 (Acros) и 4-бромбутиронитрил (Aldrich,
термометрами Аншютца в специальном блоке с
97%) использовали без дополнительной очистки.
использованием капилляров. Содержание С, H, N
Соли PdCl2 (ХЧ, Реахим), азид натрия (Acros),
определено на приборе Carlo Erba 1106, содержа-
NH4Cl (ХЧ, Реахим) использовали без допол-
ние P определено в соответствии с известной ме-
нительной очистки. K2CO3 (ХЧ, Реахим) перед
тодикой [38].
использованием прокаливали. Трис(2-гидрокси-
Трис[2-(3′-цианопропокси)фенил]фосфин-
фенил)фосфиноксид 3 получен по методике [30].
оксид (4). Смесь 0.74 г (0.005 моль) 4-бромбути-
Трис[2-(тетразол-5′-илметокси)фенил]фосфинок-
ронитрила, 2.1 г (0.015 моль) свежепрокаленного
сид 2 синтезирован нами ранее.
K2CO3 и 0.49 г (0.0015 моль) трис(2-гидроксифе-
ИК спектры твердых образцов соединений 1, 5,
нил)фосфиноксида 3 в 20 мл безводного ДМФА
и 6 получены на ИК Фурье-спектрометре Bruker
нагревали при перемешивании при 95°C в тече-
Tensor 37 с разрешением 2 см-1 в диапазоне 4000-
ние 4 ч. Далее удаляли растворитель и к сухому
400 см-1, (таблетки KBr, суспензия в нуйоле). ИК
остатку добавляли 15 мл CH2Cl2, полученную
спектры растворов в ДМСО-d6 (c 0.04 M., толщина
смесь промывали водой (4×15 мл). Органический
кювет CaF2 - 0.06 мм) были записаны в диапазоне
раствор сушили Na2SO4, затем удаляли раствори-
4000-1100 см-1. КР спектры порошкообразных об-
тель. Получали светло-желтое масло, которое при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
ТРИПОДАЛЬНЫЙ ФОСФИНОКСИДНЫЙ ЛИГАНД
1623
стоянии кристаллизуется. Вещество перекристал-
(ДМСО-d6), δ, м. д.: 1.76 уш. с (6Н, CH2CH2CH2),
лизовали из смеси CH2Cl2-Et2O, получали белое
2.65 уш. с (6Н, CH2-тетразол), 3.87 уш. с (6Н,
кристаллическое вещество. Выход 0.76 г (96.2%),
СН2О), 6.85-7.25 м (6Н, Н3, Н5), 7.42-7.60 м (6Н,
т. пл. 159°С. Кристаллы, пригодные для РСА,
Н4, Н6). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.:
были получены перекристаллизацией из этанола.
19.28 (CH2CH2CH2), 26.52 (CH2-тетразол), 66.62
ИК спектр (KBr), ν, см-1: 2935 ср, 2875 сл, 2241 ср
(СН2О), 113.03 д (С3, 4JPС 6.0 Гц), 119.28 д ( С1, 1JPС
(C≡N), 1591 с, 1575 ср, 1481 ср, 1465 ср, 1441 о. с,
115.8 Гц), 120.95 д (С5, 3JPС 12.5 Гц), 134.31 д (С6,
1383 ср, 1282 оч. с, 1253 ср, 1176 ср (P=O), 1157 ср,
2JPС 8.4 Гц), 134.68 (С4), 155.67 (С=N), 160.49 д
1136 ср, 1086 ср, 1047 с, 953 ср, 933 ср, 826 ср, 772
(С2, 2JPС 1.7 Гц). Спектр ЯМР 31Р{1Н} (ДМСО-d6):
с, 754 ср, 739 ср, 705 ср, 615 сл, 558 с, 530 ср, 509
δР 28.0 м. д. Найдено, %: C 54.22; H 5.28; N 25.02;
ср, 414 ср. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.77
P 4.71. C30H33N12O4P∙0.5H2O. Вычислено, %: C
квинтет (6Н, CH2CH2CH2, 3JHH 6.0 Гц), 2.03 т (6Н,
54.13; H 5.15; N 25.25; P 4.65.
CH2CN, 3JHH 7.0 Гц), 4.02 т (6Н, CH2O, 3JHH 5.4 Гц),
Дихлоро(трис{2-[3′-(тетразол-5′′-ил)пропок-
6.98 д. д (3Н, Н3, 3JHH 8.4, 4JPH 5.6 Гц), 7.10 т. д (3Н,
си]фенил}фосфиноксидпалладий
(5).
21.3 мг
Н5, 3JHH 7.5, 4JPH 2.1 Гц), 7.48 д. д. д (3Н, Н6, 3JPH
PdCl2 (0.12 ммоль) растворяли в 2 мл EtOH при
14.8, 3JHH 7.6, 4JHH 1.2 Гц), 7.57 т. д (3Н, Н4, 3JHH
добавлении нескольких капель 6 М. HCl при на-
7.8, 4JHH 1.4 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
гревании. Этот раствор добавляли по каплям при
13.79 (CH2CH2CH2), 24.82 (CH2CN), 65.60 (СН2О),
перемешивании к раствору лиганда 1 в 5 мл EtOH.
111.96 д (С3, 3JPС 6.5 Гц), 119.27 (CN), 119.48 д ( С1,
Наблюдалось образование светло-желтого осадка,
1JPС 111.2 Гц), 121.27 д (С5, 3JPС 12.8 Гц), 134.24 д
который отфильтровывали, промывали Et2O и су-
(С6, 2JPС 9.2 Гц), 134.44 д (С4, 4JPС 1.7 Гц), 160.32
шили. Выход 0.10 г (95.2%), т. пл. >280°С (разл.).
д (С2, 2JPС 1.9 Гц). Спектр ЯМР 31P{1Н} (CDCl3):
ИК спектр (KBr), ν, см-1: 3446 ш, 3100-2200 (NH),
δР 28.1 м. д. Найдено, %: C 67.80; H 5.90; N 7.75; P
1900 сл, ш, 1590 о. с, 1575 с, 1558 пл, 1543 пл,
5.74. C30H30N3O4P. Вычислено, %: C 68.30; H 5.73;
1473 с, 1443 о. с, 1386 сл, 1282 о. с, 1245 с, 1166
N 7.97; P 5.87.
ср, 1141 ср, 1111 ср, 1087 ср (P=O), 1063 пл, 1042
Трис{2-[3′-(тетразол-5′′-ил)пропокси]фенил}-
ср, ш, 942 ср, ш, 829 сл, 758 ср, 706 сл, 557 ср, 519
фосфиноксид (1). К раствору 0.53 г (0.001 моль)
ср, ш. Спектр КР, ν, см-1: 3071, 2937, 2885, 1588,
трис(3-цианопропоксифенил)фосфиноксида
в
1481, 1436, 1404, 1281, 1247, 1164, 1143, 1040,
15 мл безводного ДМФА при комнатной темпе-
943, 825, 801, 670, 604, 349, 299. Спектр ЯМР 1Н
ратуре и интенсивном перемешивании прибавля-
(ДМСО-d6), δ, м. д.: 1.74 уш. с (6H, CH2CH2CH2),
ли 0.59 г (0.009 моль) NaN3 и 0.48 г (0.009 моль)
2.63 т (6H, CH2-тетразол, 3JHH 5.6 Гц), сигнал
NH4Cl. Полученную суспензию выдерживали при
CH2О перекрывается сигналом воды, 6.98 т (3H,
130°С в течение 80 ч, затем охлаждали до комнат-
H5, 3JHH 7.0), 7.08 д. д (3H, H3, 3JHH 8.4, 4JPH 5.4 Гц),
ной температуры и добавляли 25 мл воды. Полу-
7.47 д. д (3H, H6, 3JPH 15.2, 3JHH 7.6 Гц), 7.53 т (3H,
ченный раствор экстрагировали СНСl3 (5 × 10 мл).
H4, 3JHH 7.8 Гц). Спектр ЯМР 31Р{1Н} (CDCl3): δР
Органические фракции объединяли, промывали
28.1 м. д. Найдено, %: С 40.99; H 4.16; N 18.67; Cl
водой (4 × 10 мл) и сушили Na2SO4. После уда-
7.84; P 3.13. C30H33Cl2N12O4PPd·2.5H2O. Вычисле-
ления растворителя остаток представлял собой
но, %: С 40.99; H 4.36; N 19.12; Cl 8.07; P 3.52.
подвижное масло, которое кристаллизовали из ди-
Дихлоро(трис{2-[3′-(тетразол-5′′-ил)меток-
этилового эфира. Выход 0.49 г (74.2%), т. пл. 155-
си]фенил}фосфиноксидпалладий
(6).
PdCl2
156°С. ИК спектр, ν, см-1: 3435 сл, ш (H2O), 2700
(29.8 мг, 0.168 ммоль) растворяли в 2 мл EtOH при
ср, ш (NH)), 1900 о. с, ш, 1592 о. с, 1578 с, 1574 пл,
добавлении нескольких капель 6 М. HCl при на-
1567 пл, 1561 сл. пл, 1477 о. с, 1444 о. с, 1388 ср,
гревании. Полученный раствор добавляли по ка-
1280 о. с, 1249 ср, 1236 ср, 1211 с, 1160 ср, 1142 с,
плям при перемешивании к раствору лиганда 2 в
1116 ср, 1098 пл, 1089 с, 1050 с, 1040 с, 1027 пл,
5 мл MeOH. Полученный светло-желтый осадок
1009 ср, 925 сл, 853 сл, 802 пл, 764 с, 750 ср, 730
отфильтровывали, промывали диэтиловым эфи-
с, 720 с, 698 ср, 587 сл, 577 сл, 563 ср, 552 ср, 532
ром и сушили. Выход 0.12 g (93.0%), т. пл. >240°C
ср, 514 ср, 487 ср, 450 сл, 429 сл. Спектр ЯМР 1Н
(разл.). ИК спектр (KBr), ν, см-1: 3446 ш, 3100-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
1624
БАУЛИНА и др.
2200 (NH), 1900 сл. ш, 1591 о. с, 1576 с, 1556 пл,
сыворотки, 2 мМ. глутамина и 1%-ного гентамици-
1476 о. с, 1442 о. с, 1282 о. с, 1219 ср, 1167 ср, 1142
на в качестве антибиотика при 37°С и во влажной
ср, 1120 пл, 1090 ср (P=O), 1064 пл, 1041 пл, 1028
атмосфере СО2 (5%). Клетки адгезионных куль-
с, 857 сл, 803 сл, 758 ср, 698 ср, 557 ср, 500 пл.
тур А549, НСТ116, MCF7 и HeLa были посеяны в
Спектр КР, ν, см-1: 3068, 2942, 1588, 1575, 1474,
концентрации 1∙104 клеток/200 мкл в 96-луночный
1451, 1284, 1257, 1162, 1221, 1144, 1041, 851, 799,
планшет и культивировались при 37°С во влаж-
662, 587, 357, 300. Спектр ЯМР 1H (ДМСО-d6),
ной атмосфере с 5% СО2. После 24 ч инкубации
δ, м. д.: 5.38 уш. с (6H, CH2), 6.96 т (3H, H5, 3JHH
к культурам клеток были добавлены различные
7.0 Гц), 7.26 д. д (3H, H6, 3JPH 14.8, 3JHH 7.2 Гц),
концентрации тестируемых соединений (от 100 до
7.34 т. д (3H, H3, 3JHH 8.4, 4JPH 6.0 Гц), 7.58 т (3H,
1.56 рМ). и далее клетки культивировались в тех же
H4, 3JHH 7.6 Гц). Спектр ЯМР 31P{1H} (CDCl3): δР
условиях 72 ч. Каждая концентрация была выпол-
29.5 м. д. Найдено, %: C 37.51; H 3.00; N 21.52; Cl
нена в трех повторностях. Все вещества были рас-
8.79; P 3.77. C24H21Cl2N12O4PPd · H2O. Вычислено,
творены в ДМСО, конечная концентрация ДМСО
%: C 37.54; H 3.02; N 21.89; Cl 9.23; P 4.03.
в лунке не превышала 1% и не была токсична для
Рентгеноструктурный анализ трис[2-(3′-
клеток. Контрольными лунками выступали лунки,
цианопропокси)фенил]фосфиноксида
4. Мо-
в которые добавляли растворитель в конечной кон-
нокристаллы фосфиноксида
4 получены кри-
центрации 1%. После инкубации в каждую лунку
сталлизацией из этанола. Интенсивности 309409
было добавлено 20 мкл МТТ (5 мг/мл) и планше-
отражений для этих кристаллов были получе-
ты инкубировали еще 2 ч. Далее из планшетов
ны на диффрактометре Bruker Apex II CCDc
была удалена среда и в каждую лунку добавлено
с использованием графитового монхромато-
100 мкл ДМСО для растворения образовавшихся
ра (MoKα-излучение, λ
0.71073 Å,
2θ-скани-
кристаллов формазана. С помощью планшетно-
рование) при
120.0(2) K. Кристаллографиче-
го анализатора Cytation3 (BioTeklnstruments, Inc)
ские данные для соединения
4: C30H30N3O4P,
определяли оптическую плотность при 536 нм.
M 527.54, кристаллы моноклинные, простран-
Значение концентрации, вызывающее
50%-ное
ственная группа P21/n, a 11.0546(4), b 14.3483(5),
ингибирование роста популяции клеток (IC50,
c 17.0770(6) Å, β 96.596(1)°, V 2690.7(2) Å3,
мкМ.), было определено на основе дозозависимых
Z 4, dвыч 1.302 г/см3, μ 0.143 мм-1, 12087 незави-
кривых с помощью программного обеспечения
симых отражений (Rint 0.0394), 8661 наблюдаемых
OriginPro 9.0.
отражений, окончательные факторы сходимо-
сти R1 [I > 2σ(I)] 0.047, wR(F2) 0.130 и GOF 1.01.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Структура решена с использованием программы
SHELXT [39] и уточнена полноматричным мето-
org/0000-0003-0821-0056
дом наименьших квадратов для F2. Неводородные
атомы уточнены анизотропно; положения водо-
org/0000-0002-4324-8001
родных атомов вычислены и все атомы водорода
включены в уточнение с использованием моде-
org/0000-0003-4645-3251
ли наездника с Uiso(H) = 1.2Ueq(C). Все вычисле-
ния сделаны с использованием пакетов программ
ФОНДОВАЯ ПОДДЕРЖКА
SHELXL2014 [40] и OLEX2 [41]. CCDC 2085004
содержит дополнительную кристаллографиче-
Работа выполнена при поддержке Российского
скую информацию для настоящей статьи. Эти дан-
научного фонда (грант № 20-13-00329). Элемент-
ный анализ и регистрация спектров ЯМР, ИК и КР
cam.ac.uk/structures/.
выполнены при поддержке Министерства науки и
Цитотоксичность in vitro в МТТ-тесте. Куль-
высшего образования Российской Федерации с ис-
туры клеток человека А549 и НСТ116 выращивали
пользованием оборудования Центра исследования
в среде DMEM, MCF7 и HeLa - в среде ЕМЕМс
строения молекул Института элементоорганиче-
добавлением 10%-ной эмбриональной телячьей
ских соединений РАН.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
ТРИПОДАЛЬНЫЙ ФОСФИНОКСИДНЫЙ ЛИГАНД
1625
КОНФЛИКТ ИНТЕРЕСОВ
16.
Zou Y., Liu L., Liu J., Liu G. // Future Med. Chem. 2020.
Vol. 12. P. 91. doi 10.4155/fmc-2019-0288
В.К. Брель является членом редколлегии
17.
Li Y., Pasunooti K.K., Li R.J., Liu W., Head S.A., Shi
Журнала общей химии. Остальные авторы
W.Q., Liu J.O. // J. Med. Chem. 2018. Vol. 61. P. 11158.
заявляют об отсутствии конфликта интересов.
doi 10.1021/acs.jmedchem.8b01252
18.
Gao F., Xiao J., Huang G. // Eur. J. Med. Chem. 2019.
СПИСОК ЛИТЕРАТУРЫ
Vol. 184. P. 111744. doi 10.1016/j.ejmech.2019.111744
19.
Zhang J.Y., Wang S., Ba Y.Y., Xu Z. // Eur. J. Med.
1. Гапоник П.Н., Войтехович С.В., Ивашкевич О.А. //
Chem. 2019. Vol. 178. P. 341. doi 10.1016/j.
Усп. хим. 2006. Т. 75. № 6. С. 569; Gaponik P.N.,
ejmech.2019.05.071
Voitekhovich S.V., Ivashkevich O.A. // Russ.
20.
Popova E.A., Protas A.V., Trifonov RE. // Anti-Cancer
Chem. Rev. 2006. N 75. P. 507. doi 10.1070/
Agents Med. Chem. 2018. Vol. 17. P. 1856. doi
RC2006v075n06ABEH003601
10.2174/1871520617666170327143148
2. Popova E.A., Trifonov R.E., Ostrovskii V.A. // Arkivoc.
21.
Wang S.Q., Wang Y.F., Xu Z. // Eur. J. Med. Chem. 2019.
2012. Vol. 45. doi 10.3998/ark.5550190.0013.102
Vol. 170. P. 225. doi 10.1016/j.ejmech.2019.03.023
3. Massi M., Stagni S., Ogden M.I. // Coord. Chem. Rev.
22.
Gao C., Chang L., Xu Z., Yan X.-F., Ding C., Zhao F.,
2018. Vol. 375. P. 164. doi 10.1016/j.ccr.2017.11.017
Wu X., Feng L.-S. // Eur. J. Med. Chem. 2019. Vol. 163.
4. Aromi G., Barrios L.A., Roubeau O., Gamez P. // Coord.
P. 404. doi 10.1016/j.ejmech.2018.12.001
Chem. Rev. 2011. Vol. 255. P. 485. doi 10.1016/j.
23.
Roh J., Karabanovich G., Vlčková H., Carazo A.,
ccr.2010.10.038
Němeček J., Sychra P., Valášková L., Pavliš O.,
5. Feng Y., Cai S.-L., Gao Y., Zheng S.-R. // J. Solid
Stolaříková J., Klimešová V., Vávrová K., Pávek P.,
State Chem. 2018. Vol. 265. P. 64. doi 10.1016/j.
Hrabálek A. // Bioorg. Med. Chem. 2017. Vol. 25.
jssc.2018.05.031
P. 5468. doi 10.1016/j.bmc.2017.08.010
6. He H., Song Y., Sun F., Zhao N., Zhu G. // Cryst.
24.
Zhan P., Li Z., Liu X., Clercq D.E. // Mini Rev.
Growth Des. 2015. Vol. 15. P. 2033. doi 10.1021/acs.
Med. Chem.
2009. Vol.
9. P.
1014. doi
cgd.5b00229
10.2174/138955709788681618
7. Haiges R., Christe K.O. // Inorg Chem. 2013. Vol. 52.
25.
Кудрявцев И.Ю., Баулина Т.В., Пасечник М.П.,
P. 7249. doi 10.1021/ic400919n
Айсин Р.Р., Матвеев С.В., Петровский П.В., Ни-
8. Wang J., Deng S.-Q., Zhao T.-T., Zheng S.-R., Cai S.-L.,
фантьев Э.Е. // Изв. АН. Сер. хим. 2013. № 4. C.
Fan J., Zhang W.-G. // Dalton Trans. 2020. Vol. 4.
1085; Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
P. 12150. doi 10.1039/d0dt01666g
Matveev S.V., Petrovskii P.V., Nifant’ev E.E. // Russ.
9. Zeni W., Seifried M., Knoll C., Welch J.M., Giester G.,
Chem. Bull. 2013. Vol. 62. N 4. P. 1086. doi 10.1007/
Stöger B., Artner W., Reissner M., Müller D.,
s11172-013-0146-6
Weinberger P. // Dalton Trans. 2020. Vol. 49. P. 17183.
26.
Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
doi 10.1039/d0dt03315d
Matveev S.V., Matveeva A.G. // Phosphorus, Sulfur,
10. Kusz J., Gütlich P., Spiering H. // Top. Curr. Chem.
Silicon, Relat. Elem. 2014. Vol. 189. N 7-8. P. 946. doi
2004. Vol. 234. P. 129. doi 10.1007/b95415
10.1080/10426507.2014.904865
11. Wei W., Wang G., Zhang Y., Jiang F., Wu M., Hong M. //
27.
Matveeva A.G., Kudryavtsev I.Yu., Pasechnik M.P.,
Chem. Eur. J. 2011. Vol. 17. P. 2189. doi 10.1002/
Vologzhanina A.V., Baulina T.V., Vavina A.V.,
chem.201002246
Sukat G.Ya., Matveev S.V., Godovikov I.A., Tura-
12. Białońska A., Bronisz R., Rudolf M.F., Weselski M. //
nov A.N., Karandashev V.K., Brel V.K. // Polyhedron.
Inorg. Chem. 2012. Vol. 51. P. 237. doi 10.1021/
2018. Vol. 142. P. 71. doi 10.1016/j.poly.2017.12.025
ic201535x
28.
Turanov A.N., Matveeva A.G., Kudryavtsev I.Yu.,
13. Boland Y., Hertsens P., Marchand-Brynaert J.,
Pasechnik M.P., Matveev S.V., Godovikova M.I., Bauli-
Garcia Y. // Synthesis. 2006. Vol. 9. P. 1504. doi
na T.V., Karandashev V.K., Brel V.K. // Polyhedron.
10.1055/s-2006-926439
2019. Vol. 161. P. 276. doi 10.1016/j.poly.2019.01.036
14. Giraud M., Andreiadis E.S., Fisyuk A.S., Demadrille R.,
29.
Kudryavtsev I.Y., Bykhovskaya O.V., Matveeva A.G.,
Pécaut J., Imbert D., Mazzanti M. // Inorg. Chem. 2008.
Baulina T.V., Pasechnik M.P., Matveev S.V.,
Vol. 47. P. 3952. doi 10.1021/ic8005663
Vologzhanina A.V., Turanov A.N., Karandashev V.K.,
15. Островский В.А., Трифонов Р.Е., Попова Е.А. // Изв.
Brel V.K. // Monat. Chem. 2020. Vol. 151. P. 1705. doi
АН. Сер. хим. 2012. № 4. С. 765; Ostrovskii V.A.,
10.1007/s00706-020-02702-6
Trifonov R.E., Popova E.A. // Russ. Chem. Bull. 2012.
30.
Кудрявцев И.Ю., Баулина Т.В., Хрусталев В.Н., Пе-
Vol. 61. P. 768. doi 10.1007/s11172-012-0108-4
тровский П.В., Пасечник М.П., Нифантьев Э.Е. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021
1626
БАУЛИНА и др.
Докл. АН. 2013. T. 448. № 6. С. 657. doi 10.7868/
Commun. 2020. Vol. 121. P. 108193. doi 10.1016/j.
S0869565213060121; Kudryavtsev I.Yu., Bauli-
inoche.2020.108193
na T.V., Khrustalev V.N., Petrovskii P.V., Pasechnik M.P.,
36. Nakamoto K. Infrared and Raman Spectra of Inorganic
Nifant’ev E.E. // Doklady Chem. 2013. Vol. 448. N 2.
and Coordination Compounds. Hoboken: J. Wiley &
P. 55. doi 10.1134/S0012500813020092
Sons, Inc. 2009. Pt B. 408 p.
31. Baulina T.V., Pasechnik M.P., Kudryavtsev I.Yu.,
37. Armarego W.L.F. Purification of Laboratory Chemicals.
Bykhovskaya O.V., Sukat G.Ya., Smol’yakov A.F.,
Amsterdam: Elsevier, 2017. doi 10.1016/B978-0-12-
Anikina L.V., Brel V.K. // J. Mol. Struct. 2020. Vol. 1217.
805457-4.50008-2
P. 128324. doi 10.1016/j.molstruc.2020.128324
38. Гельман Н.Е., Терентьева Е.А., Шанина Т.М., Кипа-
32. Livant P.D., Mao J., Webb T.R. // Acta Crystallogr. 1996.
ренко Л.М. Методы количественного органического
Vol. 52. P. 2924. doi 10.1107/S0108270196008906
элементного микроанализа. М.: Химия, 1987. C. 296.
33. Baulina T.V., Kudryavtsev I.Y., Smolyakov A.F.,
39. Sheldrick G.M. // Acta Crystalogr. (A). 2015. Vol. 71.
Pasechnik M.P., Brel V.K. // Heteroatom Chem. 2018.
N 1. P. 3. doi 10.1107/S2053273314026370
P. e21454. doi 10.1002/hc.21454.
40. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
34. Матвеева Н.А., Сушко Н.И., Макаревич Н.И., Гапо-
ник П.Н., Ивашкевич О.А., Корень А.О. // Ж. прикл.
N 1. P. 3. doi 10.1107/S2053229614024218
спектр. 1992. Т. 57. № 5-6. С. 442.
41. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
35. Al-Janabi A.S.M., Alheety M.A., Al-Samrai O.A.Y.,
ward J.A.K., Puschman H. // J. Appl. Cryst. 2009.
Shaaban S., Kibar B., Cacan E. // Inorg. Chem.
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
Tripodal Phosphine Oxide Ligand with Tetrazole Functionality
T. V. Baulina*, I. Yu. Kudryavtsev, O. V. Bykhovskaya, M. P. Pasechnik,
L. V. Anikina, A. V. Vologzhanina, V. A. Kochmarik, and V. K. Brel
Nesmeyanov Institute of Organoelement Compounds of the Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: zaq@ineos.ac.ru
Received July 31, 2021; revised July 31, 2021; accepted August 19, 2021
Tris[2-(3′-cyanopropoxy)phenyl]phosphine oxide was obtained by the alkylation of tris(2-hydroxyphenyl)phos-
phine oxide with 4-bromobutyronitrile in the presence of K2CO3. The terminal cyano groups in the obtained
phosphine oxide were converted into tetrazole rings by the click-reaction with NH4N3 to give a new hybrid
tripodal propeller ligand. Palladium(II) complexes of the prepared ligand and its short-linker analog were syn-
thesized. Structure of tris[2-(3′-cyanopropoxy)phenyl]phosphine oxide was established by X-ray diffraction
study. Composition and structure of the prepared ligand and the complexes were established by vibrational (IR,
Raman) and multinuclear (1H, 13C, 31P) NMR spectroscopy, and elemental analysis. Cytotoxicity of the ligands
and their Pd(II) complexes was studied.
Keywords: tetrazole tripodal ligands, palladium(II) complexes, crystal structure
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 10 2021