ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 12, с. 1874-1886
К 100-летию со дня рождения М.Г. Воронкова
УДК 546.281:661.452.2:544.43
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ И
РОДСТВЕННЫХ СОЕДИНЕНИЙ ДИОКСИДОМ
ХЛОРА
© 2021 г. С. А. Грабовский*, Н. Н. Кабальнова
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: stas_g@anrb.ru
Поступило в Редакцию 30 мая 2021 г.
После доработки 19 июня 2021 г.
Принято к печати 23 июня 2021 г.
Проведено окисление триэтилсилана, трет-бутилдиметилсилана, диметилфенилсилана, трифенилси-
лана, 1,1,1,2,2-тетраметил-2-фенилдисилана, трис(триметилсилил)силана, гексаметилдисилана, тетра-
(триметилсилил)силана, 1,1,3,3-тетраизопропилдисилоксана диоксидом хлора. Продуктами реакции
триорганосиланов с диоксидом хлора в растворе ацетонитрила являются соответствующие силанолы
и силоксаны. Предложен механизм реакции, объясняющий их образование и закономерности процесса
окисления. Выполнен термохимический анализ возможных направлений процесса в газовой фазе с
использованием методов G4, G3, M05 и в растворе ацетонитрила методом SMD-M05, который мо-
жет протекать с участием как ионных, так и радикальных интермедиатов, в зависимости от строения
субстрата и среды.
Ключевые слова: триорганосиланы, дисиланы, диоксид хлора, окисление, квантово-химические расчеты
DOI: 10.31857/S0044460X21120064
Силанолы и силоксаны находят широкое при-
ски незащищенных субстратов [18], поэтому сила-
менение в органическом синтезе [1, 2] и в про-
нолы, склонные к конденсации, получают гидро-
мышленности [3]. Кроме того, интерес к этим
лизом силилгалогенидов при контролируемой pH
соединениям вызван наличием у кремнийорга-
[19]. Возможно и прямое окисление связи Si-H ре-
нических соединений, включая силанолы, биоло-
агентами такими, как диоксираны [10], пероксид
гической активности [4, 5]. Основными метода-
водорода-2,2,2-трифторацетофенон [20] и система
ми синтеза силанолов являются окисление связи
пероксид водорода-мочевина в присутствии ката-
Si-H и гидролиз галогенсиланов. Для окисления
литических количеств метилтриоксорения [12].
применяются озон [6], соли серебра [7], перман-
Диоксид хлора является одним из доступ-
ганат калия [8], пероксибензойная кислота [9],
ных окислителей, применяемым в промышлен-
диоксираны [10] и оксазиридины [11], а также
ных масштабах [21], например, для дезинфекции
каталитические методы оксифункционализации.
питьевой воды [22]. Он сочетает в себе высокую
Последние основаны на использовании соедине-
окислительную способность с низким выходом
ний никеля, палладия, хрома, родия, меди, рения и
побочных продуктов хлорирования. В некоторых
нанопористых серебряных катализаторов [12-17].
странах диоксид хлора применяется для дезин-
Силоксаны, как правило, образуются в качестве
фекции поверхностей и зданий. К сожалению,
побочных продуктов, особенно в случае стериче-
как окислитель в органических средах он изучен
1874
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1875
Таблица 1. Продукты окисления триорганосиланов в растворе ацетонитрила при 25°C ([окислитель]0/[силан]0 = 1/1;
[окислитель]0= 0.4 M.)
Выход, %а
Конверсия,
Силан
Окислитель, условия
Время, ч
%
≡SiOH
≡SiOSi≡
≡SiCl
Et3SiH
ClO2
300
60
19
81
-
Et3SiH
HOClб
~ 0.003
95
87
3
8
Me2Si(t-Bu)H
ClO2
12
50
59
-
41
24
67
50
-
50
48
80
45
-
50
Me2Si(Ph)H
ClO2
200
60
15
75
-
Me2Si(Ph)H
ClO2, F3CCOOH (1%)
125
92
-
94
-
Ph3SiH
ClO2
200
92
93
-
6
Ph3SiH
HOClб
~ 0.003
98
91
-
4
(i-Pr2SiH)2O
ClO2в
330
43
79 (20)г
a Выход приведен в расчете на израсходованный субстрат.
б Растворитель - ацетонитрил-вода, 10:1 (по объему).
в 2 экв.
г Выход силоксанола и силоксандиола (приведен в скобках) соответственно.
мало. Имеются работы по его использованию для
для понимания механизма окисления диоксидом
окисления сульфидов [23], спиртов, альдегидов и
хлора [1, 25, 26]. В данной работе с целью изуче-
фенолов [24]. Однако, вопрос о механизме окис-
ния механизма взаимодействия диоксида хлора с
ления органических соединений с его участием
кремнийорганическими соединениями проведено
остается открытым. Соединения, содержащие ато-
окисление ряда силанов, установлено строение
мы кремния, могут служить хорошим объектом
продуктов и выполнено квантово-химическое мо-
делирование некоторых стадий процесса.
Изучение окисления силанов 1-9 (схема
1)
диоксидом хлора проводили при комнатной тем-
пературе в растворе ацетонитрила. Основными
7
продуктами окисления соединений 1-4 являются
Et
SiH
3
силанол, силилхлорид и силоксан (табл. 1). По-
следний может образоваться по реакции силилхло-
5
Et SiOH3
рида с силанолом или при димеризации силанола
(Et Si) O32
[1]. Для трифенилсилан 4, имеющего объемные
заместители, образование силоксана не наблюда-
3
ется из-за низкой скорости димеризации. Кинети-
ка накопления продуктов реакции триэтилсилана с
1
Et
SiCl
ClO2 представлена на рис. 1. Вначале наблюдается
3
преимущественное образование силанола, далее
2.0
4.0
6.0
его накопление замедляется и начинается расхо-
t×10-5, c
дование. Образование силоксана продолжается
до полного расходования силанола. Накопление
Рис. 1. Кинетика расходования триэтилсилана при
силилхлорида в концентрациях соизмеримых с
взаимодействии с диоксидом хлора и накопления про-
дуктов при эквимольном соотношении реагентов при
силанолом не наблюдается, по-видимому, вслед-
2°C, стрелкой показан момент расходования диоксида
ствие его реакции с последним с образованием
хлора на 95%.
HCl, который катализирует димеризацию силано-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1876
ГРАБОВСКИЙ, КАБАЛЬНОВА
Схема 1.
Схема 2.
Me
Me
Me
Si H
Si H
Si H
Me3SiO Si
OH Me3SiO Si
Cl
Me3Si Si
Cl
Ph
Ph
Ph
1
2
3
35 (54)
21 (33)
4 (7)
Me
Me
Me
Si
OSiMe3
Me3SiO Si
H
Me3Si Si O
Si H
(Me3Si)3Si H
Ph
Ph
Ph
Si Si H
6
2 (5)
5 (0)
4
5
6 происходит значительно быстрее; так, для сила-
Me3Si SiMe3 (Me3Si)4Si
H
Si
Si H
O
на 6 при концентрациях ClO2 >0.6 М. окисление
7
8
протекает со взрывом, но образуются те же про-
9
дукты и в том же соотношении, что и при более
низких концентрациях ClO2 (табл. 2). Для силанов
5 и 6, помимо продуктов, наблюдаемых для три-
ла после полного расходования ClO2 (рис. 1). Так-
органосиланов (табл. 1), обнаружены силоксаны и
же возможен гидролиз силилхлорида водой, обра-
силоксанолы. Продукты окисления 1,1,1,2-тетра-
зующейся при димеризации силанола. Добавление
каталитических количеств сильной кислоты, такой
метил-2-фенилдисилана 5 диоксидом хлора в аце-
как трифторуксусная, приводит к образованию в
тонитриле ([ClO2]:[5] = 2:1, [ClO2]0 = 0.4 M., 25°С)
случае диметилфенилсилана 3 единственного про-
представлены на схеме 2. Выход (%) приведен
дукта - 1,1,3,3-тетраметил-1,3-дифенилсилоксана,
при конверсии силана 90% и в скобках - при 30%.
что подтверждает предположение об образовании
Продукты окисления трис(триметилсилил)силана
силоксанов из силанолов под действием кислоты в
6 диоксидом хлора в ацетонитриле при 25°С при-
условиях эксперимента.
ведены на схеме 3.
Окисление 1,1,3,3-тетраизопропилдисилоксана
Состав продуктов свидетельствует о том, что
9 протекает по обеим связям Si-H, которые после-
изучаемая реакция имеет радикальный механизм.
довательно вступают в реакцию. Продуктами в
Это предположение основано на образовании си-
этом случае являются соответствующие силокса-
локсанов (схемы 2, 3) в результате типичной изо-
нол и силоксан-1,3-диол (табл. 1).
меризации силилоксильных радикалов [26-28].
Взаимодействие с
1,1,1,2,2-тетраметил-2-фе-
Инициирование можно представить, как отрыв
нилдисиланом 5 и трис(триметилсилил)силаном
H-атома от силана диоксидом хлора [схема 4, реак-
Схема 3.
Me3Si
Cl
Me3Si Cl
Me3SiO OH
Me3SiO
OH
Si
Si
Si
Si
Me3Si
SiMe3
Me3Si H
Me3SiO
SiMe3
Me3SiO
OSiMe3
10
11
12
13
Me3SiO
SiMe3
Me3SiO
OSiMe3
Me3SiO
H
Me3Si OH
Si
Si
Si
Si
Me3SiO
OSiMe3
Me3SiO
OSiMe3
Me3SiO
OSiMe3
Me3Si
SiMe3
14
15
16
17
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1877
Таблица
2. Продукты окисления трис(триметилсилил)силана
6 в растворе ацетонитрила при
25°C
([окислитель]0/[6]0 = 1.3/1; [окислитель]0= 0.4 M.)
Выход, %
Окислитель
Время, ч
Конверсия, %
10
11
12
13
14
15
16
17
ClO2
0.5
99
55
6
8
18
5
5
2
-
ClO2 (NaHCO3)
0.5
90
2
-
29
35
-
-
-
33
HOClа
0.002
80
63
-
14
9
11
3
-
-
а Растворитель - ацетонитрил–вода, 10:1 (по объему).
Таблица 3. Энтальпии реакций в системе ClO2-силан, рассчитанные методами G4, G3, M05/MG3S в газовой фазе и
с учетом неспецифической сольватации методом SMD(MeCN)-M05/MG3S
∆H298, ккал/моль
Реакция
R1
R2
R3
G4
G3
M05/MG3S
SMD(MeCN)-M05/MG3S
4.1
Me
Me
Me
22.1
22.0
25.7
21.4
Me3C
Me
Me
21.9
25.6
21.5
Me3Si
Me
Me
18.0
21.3
17.3
4.2
Me
Me
Me
174.5
175.2
170.5
58.4
Me3C
Me
Me
142.5
35.4
Me3Si
Me
Me
131.9
27.6
5.1
Me
Me
Me
-87.0
-89.5
-77.8
-79.4
Me3C
Me
Me
-90.1
-77.6
-78.9
Me3Si
Me
Me
-85.5
-72.8
-73.4
5.2
Me
Me
Me
-62.1
-63.0
-54.3
-56.9
Me3Si
Me
Me
-57.5
-49.0
–50.8
5.3
Me
Me
Me
30.8
32.0
25.6
26.5
Et
Et
Et
32.8
25.4
24.7
Me3C
Me
Me
32.5
24.5
17.8
Me3Si
Me
Me
27.3
19.8
9.5
5.4
Me
Me
Me
2.6
3.9
0.9
1.4
Me3Si
Me
Me
5.5
2.5
2.1
5.6
Me
Me
Me
-1.9
-0.8
0.7
-2.7
Me3C
Me
Me
-0.9
0.5
-2.6
Me3Si
Me
Me
-4.8
-3.8
-6.8
ция (4.1)]. Также следует принимать во внимание
В газовой фазе энтальпия реакции (4.2) для Me3SiH
реакцию переноса электрона от силана к молеку-
равна 170.5 ккал/моль, а в MeCN и воде 58.4 и
ле диоксида хлора с образованием нестабильного
45.8 ккал/моль соответственно, что должно при-
ион-радикального комплекса, который быстро рас-
водить к увеличению вклада реакции (4.2) с по-
падается на силильный радикал и HClO2 [схема 4,
вышением полярности растворителя. Кроме того,
реакция (4.2)] [24].
на направление процесса может влиять строение
Энтальпия реакции отрыва атома водоро-
субстрата [реакции (4, 4.2)]. Так, электронодонор-
да диоксидом хлора от Me3SiH в MeCN равна
ные группы (t-Bu, Me3Si и др.) стабилизируют по-
21.4 ккал/моль [табл. 3; реакция (4.1)], раствори-
ложительный заряд на реакционном центре, при
тель слабо влияет на энергетику этого процесса.
этом энтальпия образования ионной пары стано-
При образовании ионной пары [реакция (4.2)] среда
вится близкой к таковой у реакции (4.1), предпо-
может оказывать существенное влияние (табл. 3).
лагающей отрыв атома водорода (табл. 3). В свя-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1878
ГРАБОВСКИЙ, КАБАЛЬНОВА
Схема 4.
ное состояние (ПС) имеет геометрию, типичную
R3Si
+ H2ClO
(4.1)
для отрыва атома водорода, а энергетический про-
2
филь и его геометрические параметры (длины свя-
O
зей и углы ближе к величинам, характерным для
R3SiH
+ Cl
продуктов, чем для реагентов) свидетельствуют
O
O
о позднем переходном состоянии реакции. При
R3SiH
Cl
(4.2)
этом энтальпия активации для прямой реакции со-
O
ставляет 20.8 ккал/моль, а обратной реакции всего
2.9 ккал/моль. Можно говорить о том, что равнове-
сие в данной реакции смещено в сторону образо-
зи с этим, для соединений, содержащих группы,
вания исходных реагентов. По-видимому, это один
способствующие стабилизации катион-радикала,
из факторов, определяющих низкую скорость ре-
нельзя исключать протекание процесса через об-
акции окисления триорганосиланов.
разование ионных интермедиатов.
Дальнейшие возможные превращения силиль-
Для получения дополнительной информации о
ного радикала приведены на схеме 5. Для анали-
взаимодействия диоксида хлора с триорганосила-
за вероятности протекания отдельных реакций в
рамках радикального механизма мы оценили эн-
нами было проведено квантово-химическое моде-
лирование с использованием метода M05/MG3S,
тальпии наиболее интересных реакций (5.1), (5.3)
и (5.4) методами G4, G3 и M05. Результаты, полу-
позволяющего с достаточной точностью рассчи-
ченные различными методами, хорошо согласуют-
тывать системы со значительной делокализацией
неспаренного электрона [29]. Расчеты проводи-
ся между собой (табл. 3).
лась с учетом неспецифического влияния раство-
Реакция диоксида хлора с силильным радика-
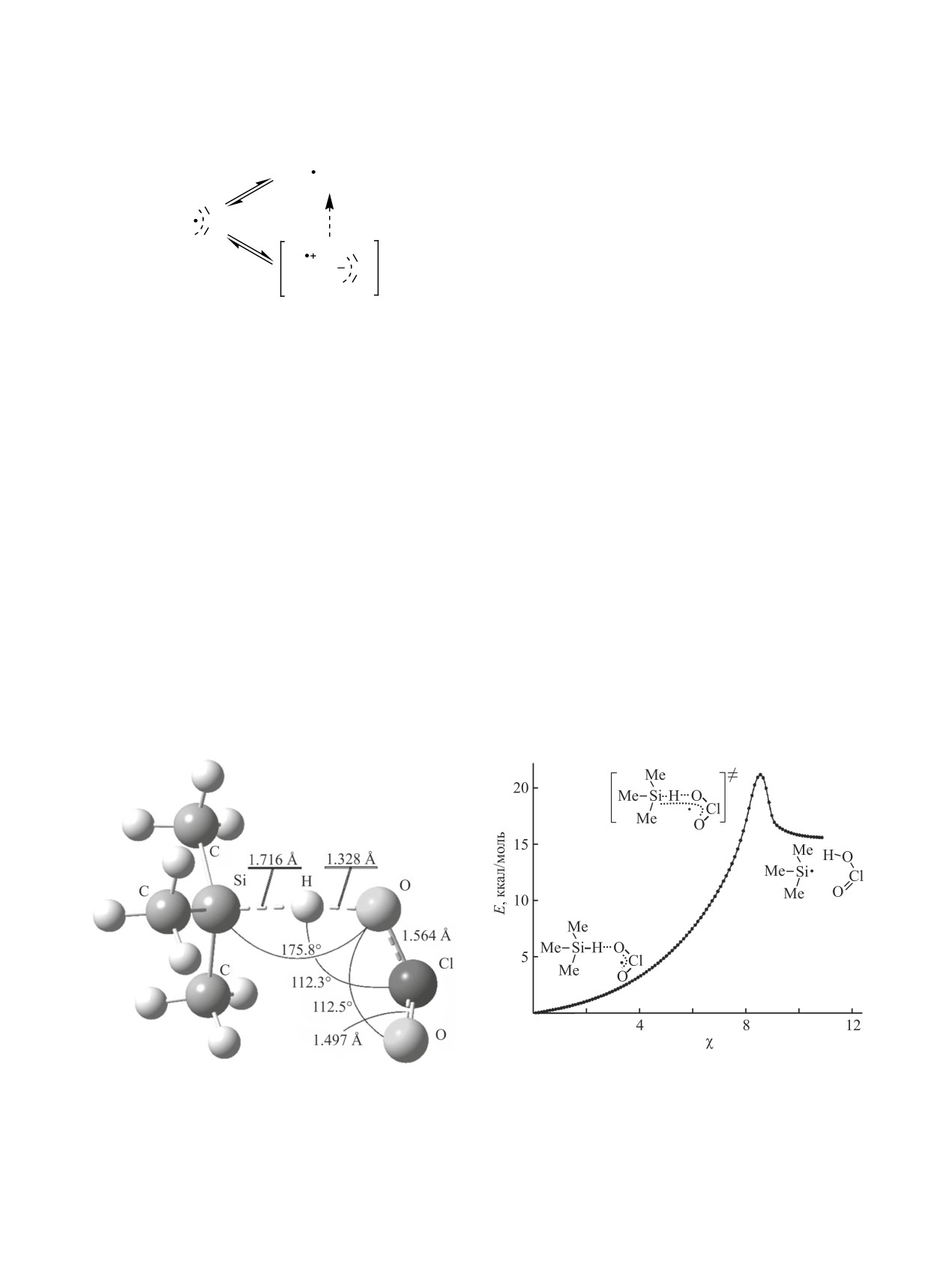
рителя [30]. Полученная геометрия переходного
лом энтальпийно более выгодна, чем реакция с
состояния и энергетический профиль поверхно-
молекулярным кислородом [табл. 3, реакции (5.1)
сти потенциальной энергии вдоль координаты
и (5.2)]. При проведении окисления соотношение
реакции [31] диоксида хлора с триметилсиланом
концентраций
[ClO2]0/[O2]0 составляло
~100/1.
приведены на рис. 2 и 3 соответственно. Переход-
Экспериментально установлено, что присутствие
Рис. 3. Энергетический профиль поверхности потен-
Рис. 2. Геометрия переходного состояния реакции ди-
циальной энергии вдоль координаты реакции диокси-
оксида хлора с триметилсиланом рассчитанная мето-
да хлора с триметилсиланом, рассчитанный методом
дом SMD(MeCN)-M05/MG3S.
SMD(MeCN)-M05/MG3S.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1879
Схема 5.
R3
R3
Si
+ ClO2
Si
O
(5.1)
R2
R2
Cl
R1
R1
O
R3
R3
Si
+ O2
SiOO
(5.2)
R2
R2
R1
R1
R3
R3
Si
O
SiO
+ ClO
R2
R2
(5.3)
Cl
R1
R1
O
R3
R3
H2O
Si
O
SiOH
+ HClO2
R2
R2
(5.4)
1
Cl
R
R1
O
R3
R3
R3
R3
SiO
+ HSi
SiOH
+
Si
R2
R2
R2
R2
(5.5)
R1
R1
R1
R1
R3
R3
ClO
+ HSi
HOCl
+
Si
(5.6)
R2
R2
R1
R1
кислорода не влияет на распределение продуктов
распада Me3SiO-ClO, по данным расчетов G4, она
и время реакции. Поэтому реакцией радикалов с
составляет 37.9 э. е.
кислородом можно пренебречь и принять констан-
В газовой фазе прочность связи SiO-ClO
ту скорости кросс-рекомбинации радикалов R3Si•
[табл. 3, реакция (5.3)] при переходе от пентаме-
с ClO2 приблизительно равной константе скорости
тилдисилилового к триметилсилиловому эфи-
реакции силильного радикала с кислородом [26]
ру увеличивается на 4.7 ккал/моль (G3), а с уче-
т. е. >108 л/(моль·с).
том неспецифической сольватации возрастает до
Продуктом реакции диоксида хлора c R3Si•
15.2 ккал/моль. В растворе наблюдается умень-
радикалом является силиловый эфир хлористой
шение прочности связи в случае диметил-трет-
кислоты. В литературе нет данных по устойчи-
бутилсилилового эфира на 8.7 ккал/моль относи-
вости подобных эфиров. Одним из направлений
тельно Me3SiO-ClO. Растворитель не оказывает
их распада может быть гомолиз по слабой связи
существенного влияния на энтальпию диссоциа-
SiO-ClO. Энтальпия диссоциации этой свя-
ции связи в Me3SiO-ClO и Et3SiO-ClO. Эти дан-
зи невелика [табл. 3, реакция (5.3)], она мень-
ные позволяют объяснить различие в скорости
ше, чем у связи O-O в пероксидах. Так, напри-
окисления триэтилсилана и диметил-трет-бу-
мер, в ди-трет-бутилпероксиде она составляет
тилсилана (табл. 1), несмотря на близкую проч-
38.2 ккал/моль [32]. Кроме того, энтропия реакции
ность связи Si-H в этих силанах (94.6±1.0 [1] и
распада эфиров хлористой кислоты на два ради-
93.4 ккал/моль, по данным метода G3, соответ-
кала должна иметь положительное значение. Для
ственно). Самыми медленными стадиями, лимити-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1880
ГРАБОВСКИЙ, КАБАЛЬНОВА
рующими общую скорость процесса, являются ре-
акция диоксида хлора с силаном, скорость которой
зависит от прочности связи Si-H и распад эфира
хлористой кислоты, который зависит от прочности
связи SiO-ClO [табл. 3, реакция (5.3)].
Таким образом, увеличение скорости окисле-
ния трет-бутилдиметилсилана 2 по сравнению
с триэтилсиланом 1 связано с уменьшением ста-
бильности соответствующего силилового эфира
хлористой кислоты. Увеличение скорости окис-
ления при переходе к соединениям 5 и 6, содер-
жащим одну или несколько триметилсилильных
групп, может быть обусловлено снижением ста-
бильности соответствующих хлоритов. В случае
Рис. 4. Геометрия переходного состояния реакции от-
соединения 9, содержащего три триметилсилиль-
рыва H-атома от триметилсилана монооксидом хлора
ные группы, прочность связи Si-H связи мень-
полученная методом SMD(MeCN)-M05/MG3S.
ше, чем для остальных изученных нами силанов
и составляет 83.7±1.0 ккал/моль [1]; кроме того,
силильные группы стабилизируют положитель-
ный заряд, увеличивая вероятность протекания
более детальной оценки мы рассчитали энергети-
процесса через ионные интермедиаты (табл. 3).
ческие параметры реакций отрыва атома водорода
Оба фактора должны приводить к увеличению
от триметилсилана радикалами ClO• и MeO• мето-
скорости инициирования в реакции силана с диок-
дом SMD(MeCN)-M05/MG3S. Полученные значе-
сидом хлора и, как следствие, сокращению общего
ния для реакции Me3SiH с ClO• составили: ΔH≠298 =
времени процесса.
1.2 ккал/моль, ΔG≠298 = 10.8 ккал/моль, ΔH298 =
Другим направлением расходования силилово-
-2.7 ккал/моль, и для реакции с MeO•: ΔH≠298 =
го эфира хлористой кислоты может быть его ги-
3.2 ккал/моль, ΔG≠298 = 15.1 ккал/моль, ΔH298 =
дролиз. С точки зрения термодинамики [табл. 3,
-10.0 ккал/моль. Экспериментальные значе-
реакция (5.4)], такой процесс вполне вероятен, од-
ния для последней реакции составляют: ΔH≠298 =
нако добавление воды в количестве до 5% (в слу-
2.0 ккал/моль, ΔG≠298 = 8.2 ккал/моль, k298 6.2×
чае окисления Et3SiH) не оказывает существенно
106 л/(моль·с) [33]. Энергетический барьер обе-
влияния на скорость и состав продуктов. Вероят-
их реакций невелик, он ниже энергии, присущей
но, скорость данной реакции существенно мень-
молекулам при комнатной температуре. Реак-
ше, чем реакции (5.3).
ция с MeO• более экзотермична, чем с ClO•, т. е.
Реакция силилоксильного радикала с силаном
монооксид хлора и силильный радикал будут нахо-
протекает в растворе с высокой скоростью [26] с
дится в равновесии, а константы скорости прямой
образованием силильного радикала, который ре-
и обратной реакции будут иметь значения того же
агирует с диоксидом хлора, продолжая цепь, или
порядка, что и реакция MeO• с Me3SiH. Принимая
гибнет в реакциях рекомбинации.
во внимание высокие концентрации силанов в экс-
периментах и константы скорости силильного ра-
Образующиеся при распаде эфира хлористой
дикала с диоксидом хлора, равновесие будет сдви-
кислоты радикалы ClO• участвуют в реакциях
нуто в сторону образования продуктов и отрыв
рекомбинации, либо отрывают атом водорода от
атома водорода, по-видимому, является главным
силана, приводя к силильным радикалам и HOCl.
Отрыв атома водорода радикалом ClO• должен
каналом расходования ClO•.
протекать очень быстро. Геометрия переходного
Известно, что HOCl - это сильный окисли-
состояния для реакции Me3SiH c ClO• (рис. 4) сви-
тель, способный взаимодействовать с органиче-
детельствует о раннем переходном состоянии. Для
скими соединениями, поэтому мы провели окис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1881
Схема 6.
MeCN
(Me3Si)2
+
ClO2
Me3Si SiMe3 ClO2
-ClO
Me3Si
SiMe3
O
99 %
(Me3Si)4Si
+
3ClO
2
MeCN-Et2O (1:1)
OSiMe3
Me3Si
(Me3SiO)4Si
+
Si
(58%)
Me3Si
OSiMe3
(14%)
Me3Si
OH
Me3SiO OH
+
Si
+
(Me3Si)3SiCl
Si
Me3SiO OSiMe3
Me3SiO OSiMe3
(2%)
(21%)
(4%)
ление силанов 1, 4, и 9 хлорноватистой кислотой
ми связи Si-H, приводит к образованию продуктов
в смеси ацетонитрил-вода (10:1 об.). Основными
внедрения атома кислорода из ClO2 по связи Si-Si
продуктами окисления для силанов 1 и 4 были со-
с хорошим выходом за 24 ч (схема 6). Время реак-
ответствующие силанолы, и обнаружены неболь-
ции окисления соединения 8 намного больше, чем
шие количества силилхлоридов. В случае силана
силана 6 в аналогичных условиях. В данном случае
9, главным продуктом реакции с HOCl является
реакция может протекать по механизму переноса
силилхлорид. Если окисление диоксидом хлора
электрона, с дальнейшей трансформацией ионной
соединения 6 проводить в присутствии NaHCO3
пары в силоксан и монооксид хлора. Последний,
(табл. 2), наблюдается снижение выхода продуктов
по-видимому, гибнет в реакции гоморекомбина-
оксихлорирования, так как образующийся гипо-
ции. Энтальпия образования ионной пары в рас-
хлорит натрия менее активен, чем кислота.
творе ацетонитрила из (Me3Si)2 и диоксида хло-
Образование R3SiCl в реакции силанов с диок-
ра составляет 23.0 ккал/моль (SMD-M05/MG3S),
сидом хлора можно объяснить взаимодействием
т. е. такой процесс вполне может идти с неболь-
с хлорноватистой кислотой. Низкий выход си-
шой скоростью при комнатной температуре.
лилхлоридов в экспериментах по окислению сила-
Образование силоксанов из силанов 5 и
6
нов 1 и 4 HOCl может быть, связан с их быстрым
(схемы 2, 3; табл. 2) по реакции внедрения атома
гидролизом в водном ацетонитриле, но не исклю-
кислорода из ClO2, как это происходит при окис-
чено, что направление реакции с HOCl зависит
лении соединений 7 и 8, маловероятно, так как
от строения силана, и в случае триорганосиланов
окисление силанов 5 и 6 протекает значительно
образуются преимущественно силанолы. Этот во-
быстрее. Для этих соединений образование силок-
прос требует проведения отдельного исследова-
санов может быть объяснено в рамках известно-
ния.
го радикального механизма (схема 7) с миграцией
Взаимодействие ClO2 с гексаметилдисиланом 7
триметилсилильных групп от атома кремния к ато-
и тетра(триметилсилил)силаном 8, не содержащи-
му кислорода [28, 34]. Образование тетра(триме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1882
ГРАБОВСКИЙ, КАБАЛЬНОВА
Схема 7.
Me3Si
Me3Si
Si
+
ClO2
Si
O
R1
R1
R2
Cl O
R2
Me3Si
Me3Si
Si
O
SiO
+
ClO
R1
R1
R2
Cl O
R2
Me3Si
Me3SiO
Si
O
Si
R1
R1
R2
R2
ClO2
ClO
(Me3SiO)3Si
(Me3SiO)3SiO
(Me3SiO)3SiOH + (Me3Si)3Si
+ 6
(Me3SiO)3SiO
(Me3SiO)4Si + (Me3Si)2SiH
тилсилил)ортосиликата, по-видимому, происходит
тетраметил-3-фенилдисилоксанол и 1,3-диметил-
в результате межмолекулярной миграции триме-
1-триметилсилил-3-триметилсилокси-1,3-
тилсилильной группы при взаимодействии ради-
дифенилдисилоксан.
кала (Me3SiO)3SiO• с силаном 6 [26].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Таким образом, окисление ряда триорганоси-
ланов диоксидом хлора приводит к образованию
Растворители сушили молекулярными ситами
силанолов, силилхлоридов и силоксанов, соотно-
Å4 и перегоняли непосредственно перед исполь-
шение которых зависит от строения окисляемого
зованием. Коммерчески доступные силаны (96-
субстрата, при этом силоксан является продук-
98%), хлорат калия (≥99%), щавелевую (≥99%)
том димеризации силанола, либо конденсации
и серную (95-97%) кислоты (Aldrich, Fluka или
силанола с силилхлоридом. В случае дисиланов
Carlo Erba) использовали без дополнительной
образуются силоксаны по реакции внедрения
очистки. Хлорноватистую кислоту получали непо-
кислорода в связь Si-Si, или в результате изоме-
средственно перед экспериментом из 15% водного
ризации их силоксильных радикалов при наличии
раствора гипохлорита натрия и соляной кислоты
связи Si-H в субстрате. Основываясь на данных
(Aldrich).
по термохимии возможных путей и продуктов
ГЖХ-Анализ выполнен на хроматографе HP
реакции можно утверждать, что окисление про-
5890 Series II с использованием капиллярной ко-
текает по радикальному механизму. Для силанов
лонки HP5 (30 м × 0.25 мм × 0.25 мкм) и декана
с электронодонорными заместителями, особен-
в качестве внутреннего стандарта. Спектры ЯМР
но Me3Si, возможно включение в радикальный
1Н, 13С записывали на приборе Varian Mercury
процесс стадий с ион-радикальными интерме-
400 МГц в растворах CDCl3, ацетона-d6 и
диатами. Среди продуктов окисления 1,1,1,2,2-
бензола-d6. Масс- и хромато-масс-спектры запи-
тетраметил-2-фенилдисилана диоксидом хлора в
сывали на приборе Finnigan MAT GCQ, оборудо-
растворе ацетонитрила впервые идентифицирова-
ванном датчиком прямого ввода DIPTM, или на
ны 1,1,1,2-тетраметил-2-фенилдисиланол, 1,1,1,3-
приборе HP 5890 Series II с масс-селективным де-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1883
тектором HP5972, колонка HP5 (60 м × 0.25 мм ×
силилхлорид, гексаэтилдисилоксан,
1,1,1,3-
0.25 мкм). ИК спектры записаны на приборе
тетраметил-3-фенилдисилоксан,
1,1,1,3-тетраме-
PerkinElmer Spectrum BX FT-IR. УФ видимые
тил-3-фенилдисилоксихлорид, 1,1,1,2-тетраметил-
спектры записывали на спектрометре PerkinElmer
2-фенилдисилилхлорид,
1,3-диметил-1,3-бис-
UV/vis Spectrometr lambda 20 с термостатируе-
(триметилсилокси)-1,3-дифенилдисилоксан были
мым блоком PerkinElmer PTP-6 Peltier System.
идентифицированы спектрально, их характери-
Элементный анализ выполнен на приборе CHNS
стики совпали с описанными ранее в литературе.
Euro EA3000 (Hekatech). Показатель преломления
1,1,1,2-Тетраметил-2-фенилдисиланол. Бес-
измеряли на рефрактометре ИРФ-22. Выделение
цветное масло, n20 1.5237. ИК спектр, ν, см-1: 3606
веществ методом препаративной газовой хромато-
(SiOH), 3085, 3069, 3052, 3020, 3010, 2998, 2953,
графии проводили на приборе Fractovap P (Carlo
2894, 1428, 1400, 1247, 1110, 836. Спектр ЯМР 1H
Erba), колонка 18 мм × 6 м заполненная хромато-
(ацетон-d6), δ, м. д.: 0.082 с (9H, SiМе3), 0.432 с (3H,
ном N-АW с 5% SE-30.
OSiМе), 4.723 с (1H, OH), 7.30-7.42 м (3H, аром.),
Диоксид хлора получали реакцией KClO3
7.52-7.62 м (2H, ArH). Спектр ЯМР 13C (ацетон-d6),
(8.4 г) со щавелевой кислотой (8 г) в 22 мл 4.5 М.
δС, м. д.: -2.309 (SiМе3), 0.109 (OSiМе), 128.26
раствора H2SO4 при 35-45°C [35]. Полученную га-
(Ph), 129.30 (Ph), 129.67 (Ph), 133.59 (Ph), 141.73
зовую смесь Ar-ClO2 пропускали над P2O5 и далее
(Ph). Масс-спектр, m/z (Iотн, %): 210 (5) [M]+, 209
через охлажденную до 0°C колонку, заполненную
(10), 195 (21), 179 (5), 137 (100), 135 (45), 132 (17),
силикагелем L40/100, где ClO2 абсорбировался. В
119 (18), 117 (36), 105 (16), 91 (11), 78 (26), 75 (31),
адсорбированном состоянии ClO2 стабилен и мо-
61 (6), 59 (10), 51 (13). Найдено, %: С 56.99; Н 8.64.
жет долгое время хранится при ~0°C. Для десорб-
C10H18OSi2. Вычислено, %: С 57.08; Н 8.62; O 7.60;
ции колонку нагревали до 30-35 °C и ClO2 удаляли
Si 26.69.
потоком аргона в ловушку, заполненную раствори-
1,1,1,3-Тетраметил-3-фенилдисилокса-
телем [36]. Концентрацию ClO2 в растворе опреде-
нол. Бесцветное масло, n20 1.4804. ИК спектр, ν,
ляли иодометрически по методу Брея [37] и спек-
см-1: 3401 (SiOH), 3071, 2958, 2925, 2835, 1637,
трофотометрически [38].
1258, 1123, 1065, 887, 842, 787. Спектр ЯМР 1H
Окисление силанов 1-9 диоксидом хлора.
(ацетон-d6), δ, м. д.: 0.109 с (9H, OSiМе3), 0.263
Раствор ClO2 в атмосфере аргона выдерживали при
с (3H, CH3), 5.544 с (1H, OH), 7.34-7.38 м (3H,
25°С в течение 5 мин до добавления силана. К рас-
аром.), 7.61-7.64 м (2H, ArH). Спектр ЯМР 13C
твору диоксида хлора (0.01-0.6 M.) в ацетонитриле
(ацетон-d6), δС, м. д.: -0.48 (CH3), 1.80 (OSiМе),
при комнатной температуре добавляли необходи-
128.24 (Ph), 128.34 (Ph), 129.38 (Ph), 130.07 (Ph),
мое количество силана. За ходом реакции следили с
133.68 (Ph), 134.04 (Ph). Масс-спектр m/z (Iотн, %):
помощью ГЖХ или хромато-масс-спектрометрии.
226 (0.05) [M]+, 211 (53) [M+ - Me], 195 (7), 193 (5),
После завершения реакции растворитель удаля-
181 (2), 165 (2), 137 (6), 133 (100), 119 (5), 115 (3),
ли, продукты разделяли методом препаративной
98 (7), 91 (7), 89 (14), 77 (6), 75 (13). Найдено, %: С
газовой хроматографии или на колонке, элюент -
53.10; Н 8.08. C10H18O2Si2. Вычислено, %: С 53.05;
гексан-диэтиловый эфир. Известные соедине-
Н 8.01; O 14.13; Si 24.81.
ния (Me3Si)3SiCl, (Me3Si)2SiH(Cl), (Me3Si)3SiOH,
(Me3Si)2O, (Me3SiO)4Si, (Me3SiO)2Si(OH)SiMe3,
1,3-Диметил-1-триметилсилил-3-триметил-
(Me3SiO)3SiH, (Me3SiO)3SiOH, (Me3SiO)3SiSiMe3,
силокси-1,3-дифенилдисилоксан. Бесцветное
1,1,3,3-тетраизопропилдисилоксан-1,3-диол,
масло, n20 1.5174. ИК спектр, ν, см-1: 3070, 3052,
1,1,3,3-тетраизопропил-1,3-дихлордисилоксан,
3023, 3012, 3003, 2957, 2895, 1429, 1409, 1258, 1124,
1,1,3,3-тетраизопропил-1-хлордисилоксан,
1110, 1053, 998, 841, 786, 755, 731, 713, 699. Спектр
1,1,3,3-тетраизопропил-1-хлордисилоксан, диме-
ЯМР 1H (ацетон-d6), δ, м. д.: 0.054 с (9H, SiМе3),
тилфенилсиланол, диметилфенилсилилхлорид,
0.092 с (9H, SiМе3), 0.333 с (3H, SiМе), 0.489 с (3H,
1,1,3,3-тетраметил-1,3-дифенилдисилоксан,
SiМе), 3.35-3.40 м (6H, Ph), 7.54-7.58 м (2H, Ph),
трет-бутилдиметилсиланол,
трет-бутилди-
7.59-7.62 м (2H, Ph). Спектр ЯМР 13C (ацетон-d6),
метилсилилхлорид, триэтилсиланол, триэтил-
δС, м. д.: -2.259 (SiSiМе3), 0.238 (OSi(CH3)SiMe3),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1884
ГРАБОВСКИЙ, КАБАЛЬНОВА
0.594 (OSi(Ме)O), 1.862 (SiOSiМе), 128.44 (Ph),
выполнена с привлечением оборудования Центра
128.52 (Ph), 129.77 (Ph), 133.71 (Ph), 133.94 (Ph).
коллективного пользования «Химия» Уфимского
Найдено, %: С 57.31; Н 8.20. C20H34O2Si4. Вычис-
института химии Уфимского федерального иссле-
лено, %: С 57.35; Н 8.18; O 7.64; Si 26.82.
довательского центра РАН.
Квантово-химические расчеты выполнены с
ФОНДОВАЯ ПОДДЕРЖКА
использованием пакета программ Gaussian 09 [39]
с полной оптимизацией геометрии с использова-
Работа выполнена в рамках научно-ис-
нием композитных методов: G4 [40], позволяюще-
следовательских работ Уфимского институ-
го получать термохимические величины близкие к
та химии Уфимского федерального исследо-
экспериментальным, и G3 [41], также показываю-
вательского центра РАН
(№ госрегистрации
щего хорошие результаты. Кроме того, использо-
AAAA-A20-120012090025-2).
ван метод M05/MG3S [42], показывающий хоро-
КОНФЛИКТ ИНТЕРЕСОВ
шие совпадение с экспериментом для расчетов в
газовой фазе и с использованием континуальной
Авторы заявляют об отсутствии конфликта
модели SMD [43] при учете неспецифической
интересов.
сольватации. Природа оптимизированных струк-
тур определялась с помощью анализа собствен-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
ных значений матрицы Гессе - матрицы вторых
Дополнительные материалы для этой статьи
производных энергии по координатам, которые
доступны по doi 10.31857/S0044460X21120064 для
рассчитывались аналитически. Энергии, получен-
авторизованных пользователей.
ные методом M05/MG3S, корректировали с уче-
том энергий нулевых колебаний c поправочным
СПИСОК ЛИТЕРАТУРЫ
коэффициентом 0.977 [44]. Прочность связи Si-H
1. The Chemistry of Organic Silicon Compounds / Eds
в t-BuSi(H)Me2 {dSi-H[t-BuSi(H)Me]} рассчитыва-
S. Rappoport, Y. Apeloig. New York: Wiley, 1998.
ли, используя энтальпию реакции (ΔH°r) по урав-
Vol. 2. 2758 p. doi 10.1002/0470857250
нению (1).
2. Colvin E.W. Silicon Reagents in Organic Synthesis.
London: Academic Press, 1988. 147 p.
dSi-H[t-BuSi(H)Me2] = ΔHr° + dSi-H(Me3SiH).
(1)
3. Lickiss P.D. // Adv. Inorg. Chem. 1995. Vol. 42. P. 147.
Здесь прочность Si-H связи в молекуле Me3SiH,
doi 10.1016/S0898-8838(08)60053-7
dSi-H(Me3SiH) 93.5±1.2 ккал/моль [1]. Для расчета
4. Fessenden R.J., Fessenden J.S. // Adv. Organomet.
Chem. 1980. Vol. 18. P. 275. doi 10.1016/S0065-
ΔHr° пользовались данными, полученными компо-
3055(08)60310-X
зитным методом G3.
5. Tacke R., Linoh H., Ernst L., Moser U., Mutschler E.,
Спектральные данные, геометрические харак-
Sarge S., Cammenga H.K., Lambrecht G. // Chem.
теристики молекул и их энергии приведены в До-
Ber. 1987. Vol. 120. N. 7. P. 1229. doi 10.1002/
полнительных материалах.
cber.19871200719
6. Spialter L., Pazdernik L., Bernstein S., Swansiger W.A.,
ИНФОРМАЦИЯ ОБ АВТОРАХ
Buell G.R., Freeburger M.E. // J. Am. Chem. Soc. 1971.
Vol. 93. N. 22. P. 5682. doi 10.1021/ja00751a018
Грабовский Станислав Анатольевич, ORCID:
7. Duffaut N., Calas R., Macé J.-C. // Bull. Soc. Chim.
France. 1959. P. 1971.
Кабальнова Наталья Нурулловна, ORCID:
8. Lickiss P.D., Lucas R. // J. Organomet. Chem. 1995.
Vol. 521. N 1-2. P. 229. doi 10.1016/0022-
328X(95)06068-8
БЛАГОДАРНОСТЬ
9. Sommer L.H., Arie Ulland L., Parker G.A. // J. Am.
Chem. Soc. 1972. Vol. 94. N. 10. P. 3469. doi 10.1021/
Авторы выражают благодарность К. Kатгили-
ja00765a036
алоглу (Институт органического синтеза и фото-
10. Grabovskii S.A., Kabal’nova N.N., Shereshovets V.V.,
активности, Болонья, Италия) за предоставлен-
Chatgilialoglu C. // Organometallics. 2002. Vol. 21.
ные силаны и обсуждение результатов. Работа
N. 17. P. 3506. doi 10.1021/om0200095
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ОКИСЛЕНИЕ ТРИОРГАНОСИЛАНОВ
1885
11.
Cavicchioli M., Montanari V., Resnati G. // Tetrahedron
28.
Zaborovskiy A.B., Lutsyk D.S., Prystansky R.E.,
Lett. 1994. Vol. 35. N 34. P. 6329. doi 10.1016/S0040-
Kopylets V.I., Timokhin V.I., Chatgilialoglu C. // J.
4039(00)73424-1
Organomet. Chem. 2004. Vol. 689. N 18. P. 2912. doi
10.1016/j.jorganchem.2004.06.030
12.
Adam W., Mitchell C.M., Saha-Möller C.R., Weichold O. //
J. Am. Chem. Soc. 1999. Vol. 121. N. 10. P. 2097. doi
29.
Tishchenko O., Truhlar D.G. // J. Phys. Chem. Lett.
2012. Vol. 3. N 19. P. 2834. doi 10.1021/jz3011817
10.1021/ja9826542
30.
Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys.
13.
Sommer L.H., Lyons J.E. // J. Am. Chem. Soc. 1969.
Chem. B. 2009. Vol. 113. N 18. P. 6378. doi 10.1021/
Vol. 91. N. 25. P. 7061. doi 10.1021/ja01053a028
jp810292n
14.
Matarasso-Tchiroukhine E. // J. Chem. Soc. Chem.
31.
Fukui K. // Acc. Chem. Res. 1981. Vol. 14. N 12. P. 363.
Commun. 1990. P. 681. doi 10.1039/C39900000681
doi 10.1021/ar00072a001
15.
Egger C., Schubert U. // Z. Naturforsch. (B). 1991.
32.
Sahetchian K.A., Rigny R., De Maleissye J.T., Batt L.,
Vol. 46. N 6. P. 783. doi 10.1515/znb-1991-0614
Khan M.A., Mathews S. // Symp. Int. Combust.
16.
Schubert U., Lorenz C. // Inorg. Chem. 1997. Vol. 36.
Proc. 1992. Vol. 24. N 1. P. 637. doi 10.1016/S0082-
N. 6. P. 1258. doi 10.1021/ic961134+
0784(06)80078-0
17.
Li Z., Zhang C., Tian J., Zhang Z., Zhang X., Ding Y. //
33.
Lee Y.E., Choo K.Y. // Int. J. Chem. Kinet. 1986. Vol. 18.
Catal. Commun. 2014. Vol. 53. P. 53. doi 10.1016/j.
N 2. P. 267. doi 10.1002/kin.550180211
catcom.2014.04.009
34.
Lalevée J., Blanchard N., Graff B., Allonas X.,
18.
Riedel E., Janiak C. Anorganische Chemie. Berlin: de
Fouassier J.P. // J. Organomet. Chem. 2008. Vol. 693.
Gruyter, 2011. 963 p. doi 10.1515/9783110225679
N 24. P. 3643. doi 10.1016/j.jorganchem.2008.08.039
19.
Harris G.I. // J. Chem. Soc. 1963. P. 5978. doi 10.1039/
35.
Jeanes A., Isbell H.S. // J. Res. Natl. Bur. Stand. 1941.
JR9630005978
Vol. 27. N 2. P. 125. doi 10.6028/jres.027.004
20.
Limnios D., Kokotos C.G. // ACS Catal. 2013. Vol. 3.
36.
Ганиева Е.С., Ганиев И.М., Грабовский С.А., Кабаль-
N 10. P. 2239. doi 10.1021/cs400515w
нова Н.Н. // Изв. АН. Сер. хим. 2008. № 11. C. 2283;
Ganieva E.S., Ganiev I.M., Grabovskiy S.A., Kabalno-
21.
Sales Monteiro M.K., Sales Monteiro M.M., de Melo
va N.N. // Russ. Chem. Bull. 2008. Vol. 57. N 11.
Henrique A.M., Llano J., Saez C., Dos Santos E.V.,
P. 2328. doi 10.1007/s11172-008-0330-2
Rodrigo M.A. // Curr. Opin. Electrochem. 2021. Vol. 27.
37.
Standard methods for the examination water and
100685. doi 10.1016/j.coelec.2020.100685
wastewater / Ed. M.A.H. Franson. Washington:
22.
Granderson C.W., Pifer A.D., Fairey J.L. // J. Am. Water
American Public Health Association, 1992. P. 4. doi
Works Ass. 2013. Vol. 105. N 3. P. 45. doi 0.5942/
10.2105/SMWW.2882.080
jawwa.2013.105.0016
38.
Masschelein W.J. In: Chlorine Dioxide, Chemistry and
23.
Кучин А.В., Рубцова С.А., Судариков Д.В., Демако-
Environmental Impact of Oxychlorine Compounds / Ed.
ва М.Я. // Изв. АН. Cер. хим. 2013. № 1. С. 1; Kut-
R.G. Rice. Collingwood: Ann Arbor Science Publishers,
chin A.V., Rubtsova S.A., Sudarikov D.V., Demako-
1979. 190 p.
va M.Ya. // Rus. Chem. Bull. 2013. Vol. 62. P. 1. doi
39.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
10.1007/s11172-013-0001-9
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
24.
Kabalnova N.N., Grabovskiy S.A. In: Chlorine:
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Properties, Applications and Health Effects / Eds
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
R. Mangione, D. Carlyle. New York: Nova Science
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Publishers, 2011. P. 125.
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
25.
Семёнов В.В. // Вестн. РАН. 2016. Т. 86. № 11.
Honda Y., Kitao O., Nakai H., Vreven T., Jr. Montgo-
mery J.A., Peralta J.E., Ogliaro F., Bearpark M.,
С. 998; Semenov V.V. // Her. Russ. Acad. Sci. 2016. Vol. 86.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
N 6. P. 466. doi 10.1134/S1019331616060071
Kobayashi R., Normand J., Raghavachari K., Ren-
26.
Chatgilialoglu C. Organosilanes in radical chemistry.
dell A., Burant J.C., Iyengar S.S., Tomasi J.,
Chichester: John Wiley & Sons, 2004. 227 p. doi
Cossi M., Rega N., Millam J.M., Klene M., Knox J.E.,
10.1002/0470024755
Cross J.B., Bakken V., Adamo C., Jaramillo J., Gom-
27.
Chatgilialoglu C., Guarini A., Guerrini A., Seconi G. //
perts R., Stratmann R.E., Yazyev O., Austin A.J.,
J. Org. Chem. 1992. Vol. 57. N 8. P. 2207. doi 10.1021/
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
jo00034a001
Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1886
ГРАБОВСКИЙ, КАБАЛЬНОВА
Dannenberg J.J., Dapprich S., Daniels A.D., Farkas Ö.,
42. Zhao Y., Schultz N.E., Truhlar D.G. // J. Chem. Phys.
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
2005. Vol. 123. P. 161103. doi 10.1063/1.2126975
Gaussian 09, Revision C.01, Gaussian, Inc., Wallingford
43. Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys.
CT, 2010.
Chem. (B). 2009. Vol. 113. N 18. P. 6378. doi 10.1021/
40. Curtiss L.A., Redfern P.C., Raghavachari K. // J. Chem.
jp810292n
Phys. 2007. Vol. 126. P. 084108. doi 10.1063/1.2436888
44. Alecu I.M., Zheng J., Zhao Y., Truhlar D.G. // J. Chem.
41. Curtiss L.A., Raghavachari K., Redfern P.C., Ras-
solov V., Pople J.A. // J. Chem. Phys. 1998. Vol. 109.
Theory Comput. 2010. Vol. 6. N 9. P. 2872. doi 10.1021/
P. 7764. doi 10.1063/1.477422
ct100326h
Oxidation of Triorganosilanes and Related Compounds
by Chlorine Dioxide
S. A. Grabovskiy* and N. N. Kabal’nova
Ufa Institute of Chemistry Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: stas_g@anrb.ru
Received May 30, 2021; revised June 19, 2021; accepted June 23, 2021
Oxidation of triethylsilane, tert-butyldimethylsilane, dimethylphenylsilane, triphenylsilane, 1,1,1,2,2-tetra-
methyl-2-phenyldisilane, tris(trimethylsilyl)silane, hexamethyldisilane, tetrakis(trimethylsilyl)silane,
1,1,3,3-tetraisopropyldisiloxane by chlorine dioxide was carried out. The reaction products of studied trior-
ganosilanes with chlorine dioxide in an acetonitrile solution were the corresponding silanols and siloxanes. A
mechanism explaining the formation of products and the observed regularities of the oxidation of silanes by
chlorine dioxide has been proposed. A thermochemical analysis of some possible pathways in the gas phase using
methods G4, G3, M05 and in an acetonitrile solution by the SMD-M05 method was carried out. The oxidation
process can occur both with the participation of ionic and radical intermediates, depending on the structure of
the oxidized substrate and medium.
Keywords: triorganosilanes, disilanes, chlorine dioxide, oxidation, quantum-chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021