ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 167-189
ОБЗОРНАЯ
СТАТЬЯ
УДК 547.72
2(5Н)-ФУРАНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН:
РЕАКЦИИ И СИНТЕЗЫ НА ИХ ОСНОВЕ
© 2021 г. Л. А. Бадовская, В. В. Посконин*, З. И. Тюхтенева, Н. Д. Кожина
Кубанский государственный технологический университет, ул. Московская 2, Краснодар, 350072 Россия
*e-mail: vposkonin@mail.ru
Поступило в Редакцию 4 октября 2020 г.
После доработки 3 декабря 2020 г.
Принято к печати 10 декабря 2020 г.
В обзоре приведены результаты исследований малоизученных или не изученных реакций 2(5Н)-фура-
нона, 5-гидрокси-2(5Н)-фуранона, некоторых других замещенных гидрофуранонов и условия синтезов
на их основе функционально-замещенных гидрофуранонов, перспективных для химии реактивов и
биологически активных веществ.
Ключевые слова: окисление, комплексообразование, присоединение, изомеризация, енамины, заме-
щение
DOI: 10.31857/S0044460X21020013
1. Введение
167
2. Реакции 2(5Н)-фуранона и синтез функционально-замещенных гидрофуранонов
168
3. Реакции 5-гидрокси-2(5Н)-фуранона и синтезы на их основе
181
4. Заключение
185
1. ВВЕДЕНИЕ
ранона и 5-гидрокси-2(5Н)-фуранона на основе
реакций промышленно доступного фурфурола с
Химия 2(5Н)-фуранона и 5-гидрокси-2(5Н)-фу-
пероксидом водорода, проводимых в различных
ранона на протяжении многих лет привлекает к
условиях [7-13]. В обзорах и статьях, посвящен-
себе внимание исследователей. Это связано с вы-
ных химии фуранонов, широко рассматривается
сокой реакционной способностью гидрофурано-
ряд реакций нуклеофильного и сопряженного при-
нов, что позволяет синтезировать на их основе пер-
соединения, Дильса-Альдера, альдольной конден-
спективные реагенты для органического синтеза, в
сации с карбонильными соединениями, гидриро-
том числе для получения биологически активных
вания, отдельные реакции Михаэля и фотохимии,
веществ. Известен ряд обзоров, посвященных син-
тезу и свойствам указанных гидрофуранонов и их
некоторые другие. В то же время ряд реакций
производных [1-6]. В большинстве случаев в син-
оказался не описанным или недостаточно рас-
тезах используется конденсация функциональных
смотренным. Для 2(5Н)-фуранона это окисление
групп производных алифатических и циклических
и 1,3-диполярное циклоприсоединение, прямое
соединений, которые нельзя назвать достаточно
арилирование, реакции с енаминами, СН-кислота-
доступными. Наиболее перспективными и эколо-
ми, аминами. Для 5-гидрокси-2(5Н)-фуранона это
гичными являются способы получения 2(5Н)-фу-
конденсация и олигомеризация, таутомеризация,
167
168
БАДОВСКАЯ и др.
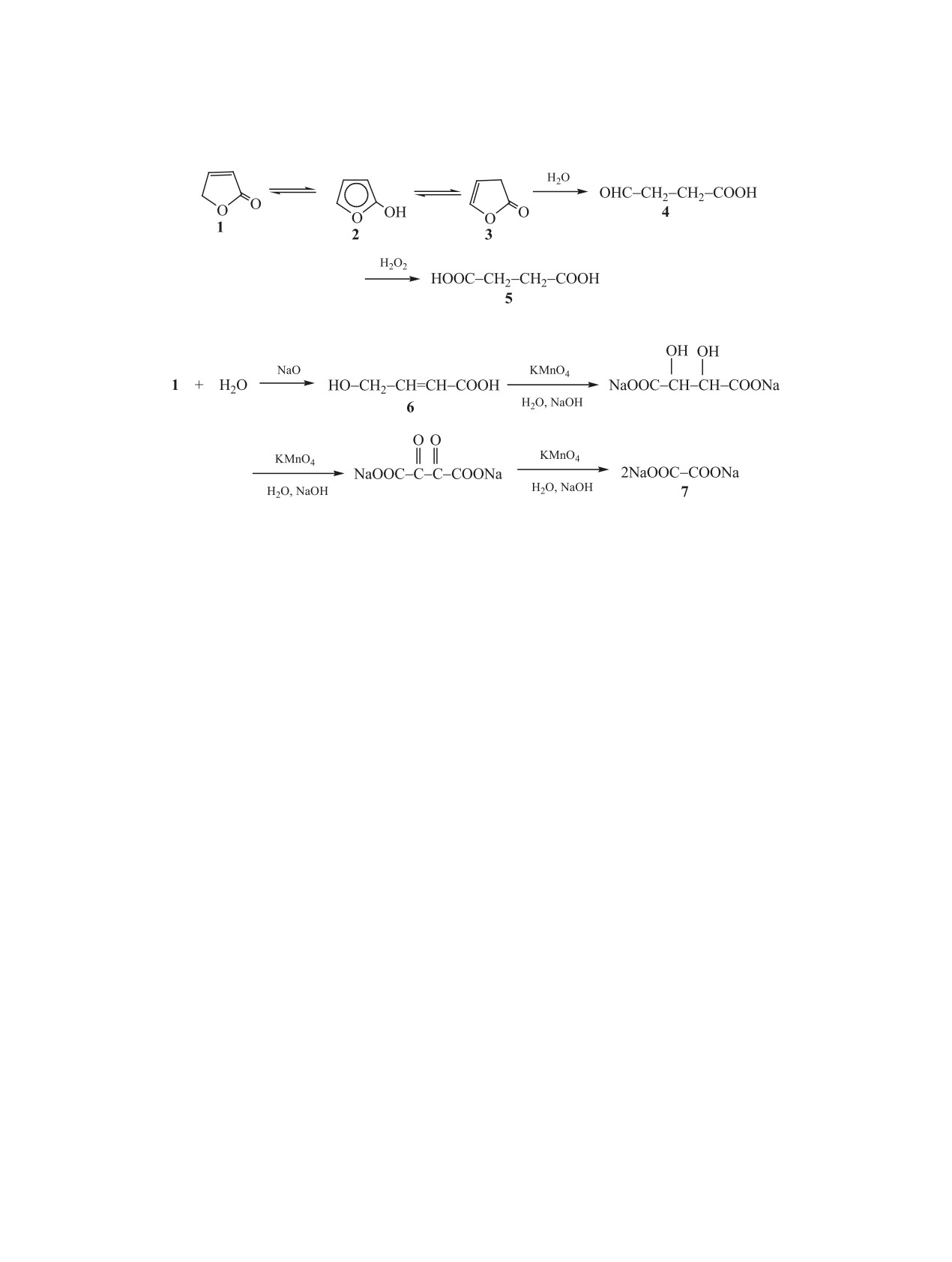
Схема 1.
Схема 2.
электрохимические реакции. Именно этим не из-
пероксида водорода при мольном соотношении
ученным или малоизученным реакциям 2(5Н)-фу-
лактон 1-Н2О2, равном 1:1.5, при 25°С за 5 ч пре-
ранона и 5-гидрокси-2(5Н)-фуранона, а также из-
вращается в янтарную кислоту с выходом 60% [15]
учению некоторых свойств продуктов их реакций
(схема 1). Эти факты согласуются с тем, что в ре-
посвящен настоящий обзор.
акции фурфурола с Н2О2 наибольшие выходы фу-
ранона 1 достигаются при проведении процесса в
2. РЕАКЦИИ 2(5Н)-ФУРАНОНА И СИНТЕЗ
сильнокислых средах [16], в которых он устойчив.
ФУНКЦИОНАЛЬНО-ЗАМЕЩЕННЫХ
ГИДРОФУРАНОНОВ
Отмеченные факты можно объяснить с учетом
таутомерных и гидролитических превращений
2.1. Реакции окисления. В работе [14] сооб-
2(5Н)-фуранона. Как установлено ранее [11, 17],
щается, что взаимодействие 2(5Н)-фуранона 1 с
между формами гидрофуранона 1-3 существует
атомарным хлором в присутствии О2 сопровожда-
таутомерно-изомерное равновесие (схема 1), на
ется образованием смеси продуктов - муравьиной
которое влияет рН среды. В нейтральной и сла-
кислоты и ее хлорангидрида, малеиновой кисло-
бощелочной средах изомер 1 частично переходит
ты, фосгена и нескольких неидентифицирован-
в изомер 3, который легко гидролизуется до аль-
ных продуктов. Предполагается, что окисление
дегидокислоты 4, окисляющейся пероксидом во-
фуранона 1, образующегося в реакции фурфурола
дорода в янтарную кислоту 5. Это приводит к до-
с Н2О2, в присутствии гетерогенного катализато-
полнительному смещению равновесия в сторону
ра - сульфоновой кислоты на полимерной основе
изомера 3 и последующему образованию кислоты
(SMOPEX-101) - приводит к его частичному пре-
5 в процессе окисления 2(5Н)-фуранона водным
вращению в малеиновую кислоту [12]. При изуче-
пероксидом водорода при рН 7-8.
нии реакции фуранона 1 с Н2О2 установлено [9],
что он не окисляется водным пероксидом водоро-
Окислительные превращения 2(5Н)-фуранона
да в сильнокислых средах (рН 1-2) в исследован-
под действием перманганата калия отличаются
ном диапазоне температур (от 25 до 100°С). Даже
от его химического поведения в рассмотренной
при совместном присутствии Н2О2 и соединений
выше системе Н2О2-Н2О. В кислых и нейтраль-
d-металлов(V)/(VI) в кислых средах его конверсия
ных водных растворах фуранон 1 не претерпевает
за 50 ч при 60 0С не превышает 50%. В то же время
каких-либо превращений под действием KMnO4.
в нейтральной и слабощелочной средах (рН 7-8)
В то же время в щелочной среде при высоких зна-
2(5Н)-фуранон под действием водного раствора
чениях рН (~12) проходит его интенсивное окис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
169
Схема 3.
ление избытком перманганата калия до оксалата
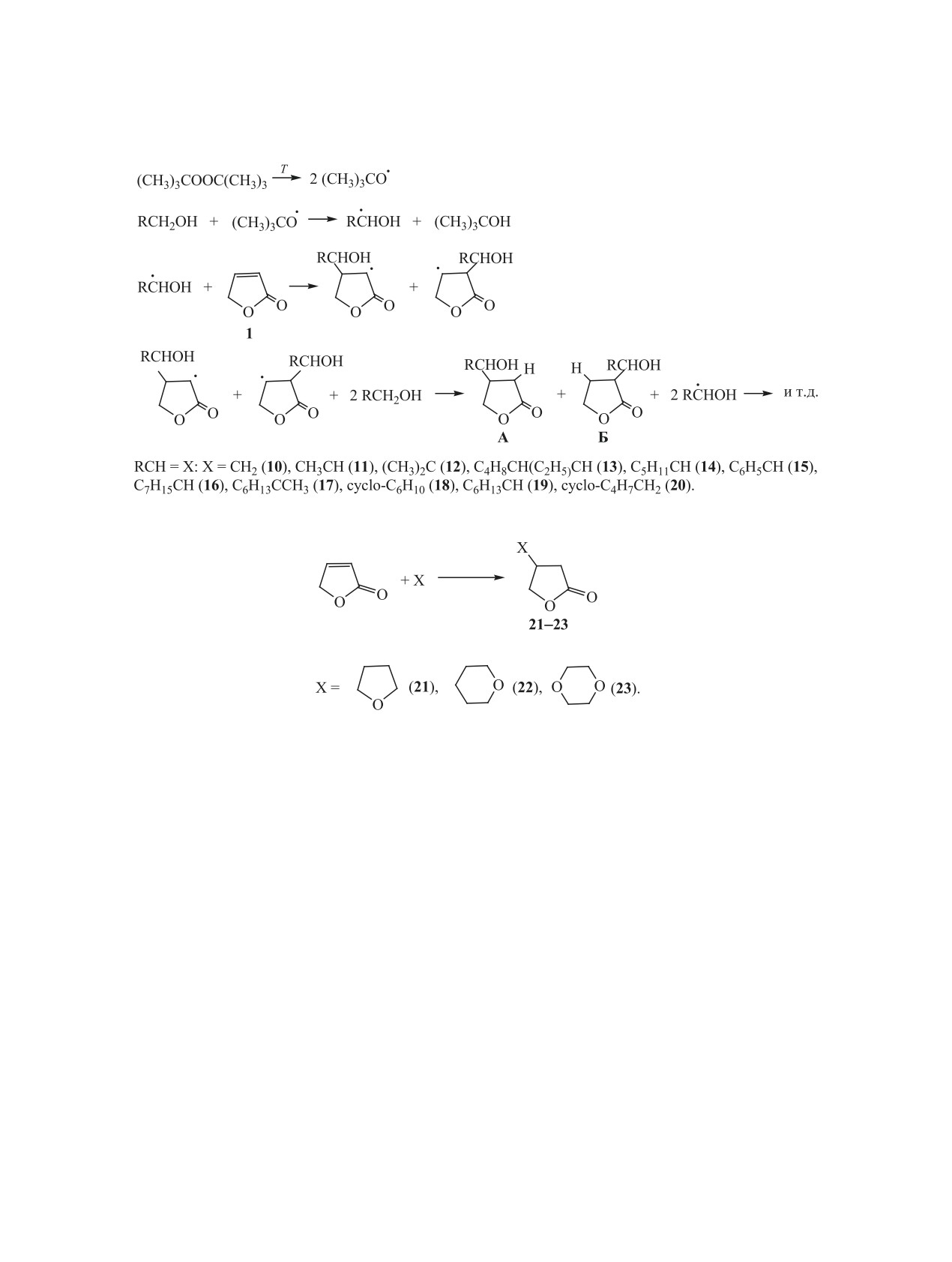
2.3. Свободнорадикальное присоединение
натрия 7 (схема 2), который образуется с количе-
простых эфиров и спиртов. О реакциях 2(5Н)-фу-
ственным выходом [9]. По всей вероятности, окис-
ранона 1, протекающих по радикальному механиз-
лению подвергается не фуранон 1, а гидроксикис-
му, мало известно. Возможно, радикалы образуют-
ся в реакциях его фотолиза в газовой фазе [18] и
лота 6, которая легко образуется [9] в результате
при фотооблучении [19]. В то же время довольно
его гидролиза в сильнощелочной среде, и далее
подробно изучены реакции радикального присое-
процесс проходит по схеме 2.
динения к фуранону 1 спиртов и простых эфиров.
Установлено, что в щелочных растворах сте-
В работах [20, 21] впервые описаны свободно-
пень гидролиза фуранона 1 достигает 100% [9], в
радикальные реакции 2(5Н)-фуранона с цикли-
то время как его гидролиз в кислых и нейтральной
ческими простыми эфирами и алифатическими,
средах не происходит, и в этом случае гидролизу-
алициклическими и ароматическими спиртами
ется его изомер - 2(3Н)-фуранон 3 (схема 1).
различного строения, проводимые в присутствии
Сам фуранон 1 в растворах с рН < 7 не подвер-
ди-трет-бутилпероксида (DTBP).
гается электрофильному окислению ни перокси-
Реакции с циклическими простыми эфирами и
дом водорода, ни перманганатом калия. По всей
спиртами, имеющими температуру кипения ниже
вероятности, это происходит из-за низкой электро-
150°С, проводят в автоклаве при давлении до 15
нодонорности его кратной связи, сопряженной с
атм. Взаимодействие с простыми эфирами прохо-
электроноакцепторной сложноэфирной группой.
дит при 145-150°С и мольном соотношении фура-
Как видно, в рассмотренных выше реакциях
нон 1:эфир:DTBP = 1:20:0.2, а взаимодействие со
окислению подвергаются не 2(5Н)-фуранон 1 или
спиртами - при 150-160°С и мольном соотноше-
изомерный ему 2(3Н)-фуранон 3, а продукты их
нии 1:15:0.2 [14-17]. В обоих случаях происходит
присоединение простых эфиров и спиртов по крат-
гидролиза 4 и 6 (схемы 1, 2).
ной связи 2(5Н)-фуранона с образованием смеси
2.2. Комплексообразование с солями d-ме-
изомерных аддуктов типа А и Б (схема 4), среди
таллов. В работе [9] рассмотрены реакции ком-
которых преобладает (55-95 %) продукт присое-
плексообразования 2(5Н)-фуранона 1 с ацетатом
динения по атому С4 фуранона 1 (аддукт А). Ана-
меди(II) и ацетатом кобальта(II), которые, как из-
логично происходит присоединение к фуранону 1
вестно, образуют достаточно термодинамически
простых циклических эфиров (схема 5).
устойчивые комплексы с кислород- и азотсодер-
Преобладающее образование изомера типа А
жащими лигандами. Комплексные соединения 8 и
(схема 4) объясняется наиболее пониженной элек-
9 (схема 3) получены при добавлении к растворам
тронной плотностью в положении С4 молекулы
указанных солей в этаноле спиртового раствора
фуранона 1 и нуклеофильностью свободных ради-
фуранона 1 при их мольном соотношении 1:4 с по-
калов, образующихся из спиртов и простых эфи-
следующим кипячением этой смеси в течение 1 ч
ров, а также стабилизацией образующегося в этом
до образования кристаллов.
случае промежуточного радикала вследствие со-
Строение комплексных соединений 8 и 9 под-
пряжения в нем неспаренного электрона со слож-
тверждено данными ИК спектроскопии, деривато-
ноэфирной группой.
графии в интервале температур 20-500°С и атом-
Побочное образование изомера типа Б, очевид-
но-адсорбционной спектроскопии [9].
но, обусловлено его стабилизацией за счет обра-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
170
БАДОВСКАЯ и др.
Схема 4.
Схема 5.
зования внутримолекулярной водородной связи
Суммарный выход продуктов рассмотренных
между спиртовой и сложноэфирной группами,
свободнорадикальных реакций зависит от строе-
существование которой доказано спектральными
ния спиртов и простых эфиров, а также от усло-
методами [20]. Это подтверждается и тем, что в ре-
вий проведения реакций, и составляет 40-97%.
акциях фуранона 1 с простыми эфирами аддукт Б,
Наименьшие выходы продуктов присоединения
в котором внутримолекулярная водородная связь
отмечаются в реакциях с низкомолекулярными
отсутствует, образуется в незначительном количе-
спиртами и простыми эфирами, которые проводят
стве.
под давлением. Это, очевидно, связано с гибелью
радикалов на стенках автоклава и протеканием их
На основе рассмотренных выше реакций син-
побочных реакций. К снижению выходов приво-
тезирован широкий ряд ранее не описанных ги-
дит также наличие объемных заместителей в ги-
дроксиметилтетрагидрофуранонов 10-20 и окса-
дроксиметильной группе.
метилтетрагидрофуранонов 21-23 [20, 21]. При
этом образуется смесь изомеров А и Б (схема 4),
Синтезированные гидроксиметилзамещенные
с преобладанием изомера А. Разделение изомеров
тетрагидрофураноны представляют интерес как
проводят на колонке с силикагелем марки КСМ
реагенты для получения соединений разных клас-
при элюировании смесью толуол-этанол (20:3), их
сов. Их дегидратацией получен ряд 4-алкенилпро-
строение подтверждено данными ИК и ЯМР 13С
изводных тетрагидрофуранонов (схема 6) [20, 22].
спектроскопии [14].
Процесс проводят при 100-150°С без растворите-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
171
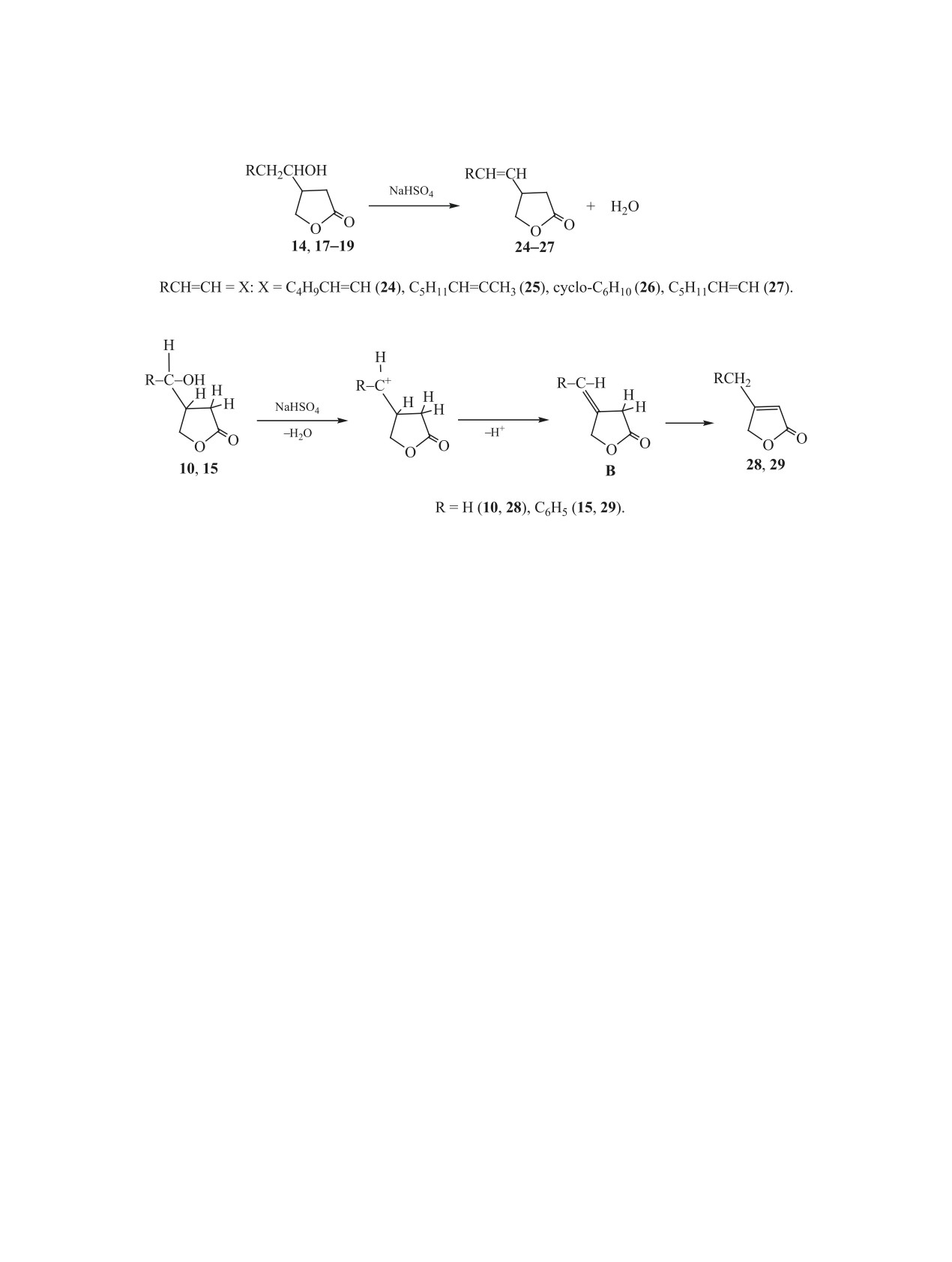
Схема 6.
Схема 7.
ля в присутствии гидросульфата натрия с отводом
ся отщеплением протона из положения 4 цикла
образующейся воды. Используется массовое соот-
фуранона с образованием алкенилпроизводных
ношение дегидратируемого вещества и гидросуль-
типа В. По всей вероятности, эти соединения изо-
фата в пределах (20-40):1.
меризуются в значительно энергетически более
Из соединений 14, 17-19 (схема 4) получены
устойчивые изомеры 28 и 29, так как в молекулах
соответствующие продукты их дегидратации 24-
последних существует сопряжение между кратной
27 (схема 6), их строение подтверждено методами
связью и сложноэфирной группой.
ИК и ЯМР 1Н спектроскопии [20, 22]. При этом из
Синтезированные соединения 10-29 являются
смеси изомерных гидроксиметилзамещенных те-
не только высокоактивными реагентами для полу-
трагидрофуранонов А и Б в реакцию дегидратации
чения новых производных гидрофуранонов, но и
вступают только 4-замещенные тетрагидрофура-
высокоэффективными биологически активными
ноны (изомеры А). В изомерных им 3-замещенных
веществами. Среди них выявлены регуляторы ро-
соединениях Б внутримолекулярная водородная
ста растений, пестициды, антисептики древесины,
связь между гидрокси- и сложноэфирной группа-
соединения с фармакологической активностью,
ми препятствует этой реакции.
стимуляторы роста прудовых рыб и др.
Особый случай представляют собой реакции
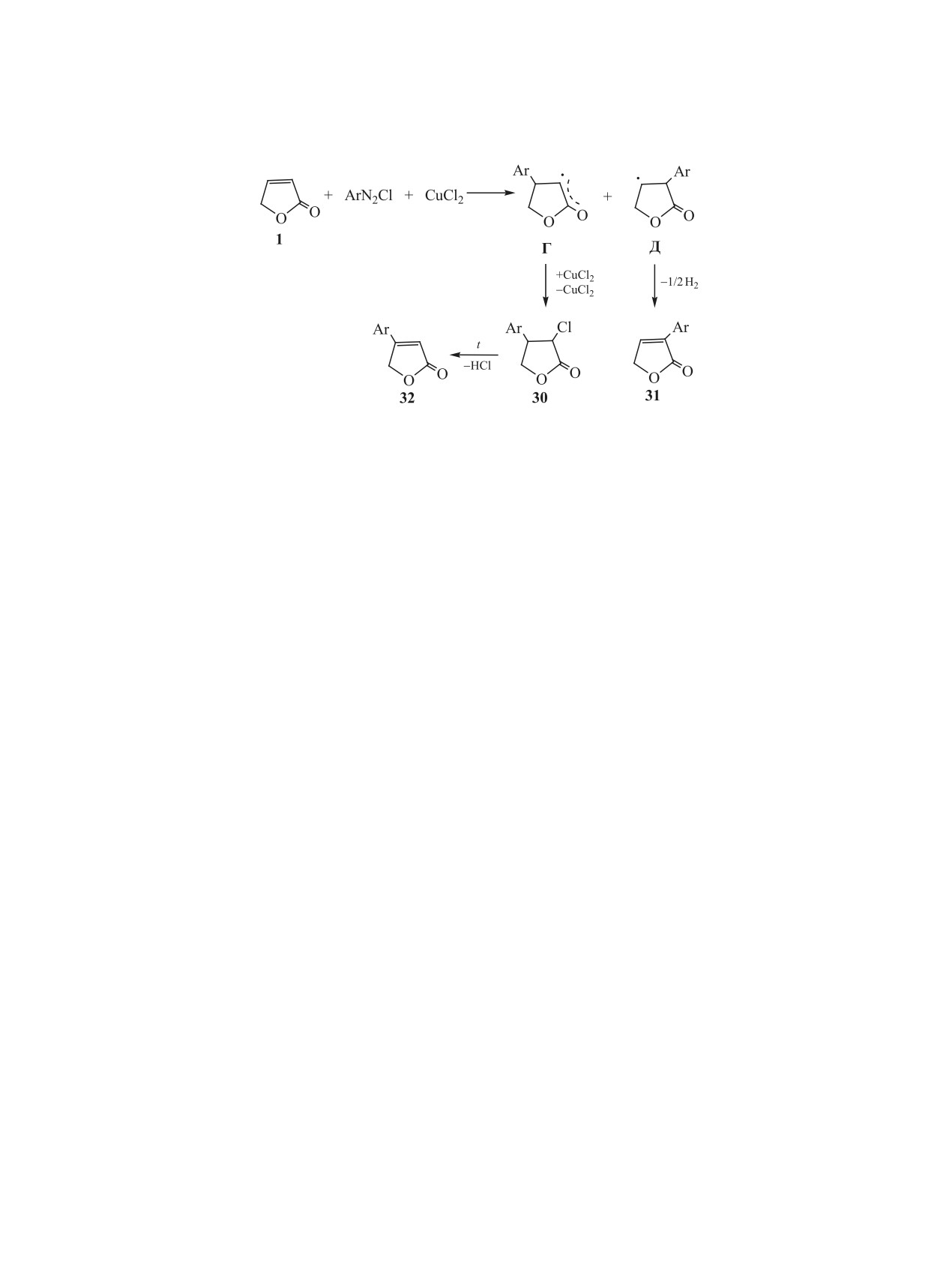
2.4. Арилирование в условиях реакции Ме-
дегидратации аддуктов фуранона 1 с метано-
ервейна. Арилирование 2(5Н)-фуранона (1) со-
лом и бензиловым спиртом (соединения 10 и 15,
лями диазония в присутствии катализатора CuCl2
схема 4), продуктами которых являются 4-ме-
тил-2(5Н)-фуранон 28 и 4-бензил-2(5Н)-фуранон
впервые описано в работах [24, 25]. Оптимальные
29 соответственно [23] (схема 7). Эти реакции
условия арилирования фуранона 1 определены на
проводят в вакууме при 160-180°С и 40-60 мм.
примере его реакции с хлор- и бромфенилдиазо-
рт. ст. до прекращения выделения образующейся
нием. Лучшие результаты получены при мольном
воды. Образование в данном случае не алкенилза-
соотношении фуранона, соли диазония и ката-
мещенных тетрагидрофуранонов, а 4-замещенных
лизатора, равном 1:2:0.2, проведении процесса в
2(5Н)-фуранонов можно объяснить следующими
водно-ацетоновой среде (объемное соотношение
превращениями (схема 7).
5:1), рН 3-5 и 20-25°С. Продуктами реакции яв-
При протонировании гидроксигруппы образу-
ляются 3-хлор-4-п-бромфенилтетрагидрофуранон
ется карбкатион, который может стабилизировать-
30 и 3-п-бромфенил-2(5Н)-фуранон 31. При на-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
172
БАДОВСКАЯ и др.
Схема 8.
гревании в вакууме соединение 30 превращается в
(10 мм. рт. ст.) концентрированных эфирных экс-
4-п-бромфенил-2(5Н)-фуранон 32 (схема 8).
трактов продуктов арилирования 2(5Н)-фуранона.
В соответствии с существующими представле-
В условиях реакций получения соединений
ниями о механизме реакции Меервейна, в реакци-
30-32 синтезирован широкий ряд арилзамещен-
онной системе фуранон 1-ArN2Cl-CuCl2, по всей
ных гидрофуранонов 30-47 (см. таблицу), строе-
вероятности, образуется комплекс, включающий
ние которых подтверждено методами ИК и ЯМР
все эти соединения. Способность 2(5Н)-фуранона
1Н спектроскопии. Суммарный выход гидрофу-
образовывать комплекс с солями d-металлов была
ранонов 30-42, одновременно образующихся в
показана в разделе 2.2.
реакциях арилирования 2(5Н)-фуранона, в расче-
Образующееся в процессе арилирования ком-
те на фуранон составляет 45-80 % (см. таблицу)
плексное соединение превращается в радикалы Г
и зависит от характера заместителя в бензольном
и Д в результате присоединения бромфенильного
ядре исходного диазосоединения. Как видно, наи-
радикала по кратной связи фуранона 1 (схема 8).
больший выход достигается в тех случаях, когда
Радикал Г относительно устойчив вследствие
заместитель образует с бензольным ядром сопря-
наличия в нем, в отличие от радикала Д, систе-
женную систему. Это обеспечивает относитель-
мы сопряжения. Последний быстро стабили-
ную устойчивость арильного радикала и приводит
зируется отщеплением водорода и переходом в
к увеличению выхода продуктов арилирования и
3-арил-2(5Н)-фуранон 31. В качестве побочных
уменьшению выхода образующихся побочных за-
продуктов в рассматриваемой реакции арилиро-
мещенных бензолов.
вания образуются в незначительных количествах
4-Арил-2(5Н)-фураноны 32, 43–47 (см. табли-
бромбензол и бромхлорбензол.
цу) образуются в результате реакций дегидрох-
Соединение 32 в реакции арилирования не обра-
лорирования арилхлорфуранонов 30, 33-37. Их
зуется и выделено только при нагревании в вакуу-
получают при нагревании в вакууме (180-190°С,
ме продуктов этой реакции или индивидуального
10 мм. рт. ст.) либо индивидуальных соединений
соединения 30 в результате его дегидрохлориро-
30, 33-37, либо сконцентрированных продуктов,
вания. Соединения 30 и 31 выделены при пропу-
образующихся при арилировании 2(5Н)-фуранона.
скании смеси продуктов реакции, растворенной в
хлороформе, через колонку с силикагелем и под-
Для получения различных арилгидрофурано-
вижной фазой бензол-хлороформ в соотношении
нов ранее не использовалась реакция Меервей-
1:1. Другим вариантом выделения этих соедине-
на. Их получали каталитической конденсацией
ний является перегонка с водяным паром эфирных
функциональных производных ацетилена, либо из
экстрактов продуктов арилирования. Соединение
функционально-замещенных фуранонов [2], либо
32 получают перегонкой в вакууме при 180-190°С
по многостадийной реакции Реформатского с не-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
173
Арилзамещенные гидрофураноны, полученные в результате арилирования 2(5Н)-фуранона (схема 8)
№
Хa
Выход, %
№
Хa
Выход, %
№
Хa
Выход, %б
30
4-Br
36
31
4-Br
37
32
4-Br
86
33
4-CH3
23
38
4-CH3
17
43
4-CH3
78
34
Н
22
39
Н
23
44
Н
86
35
4-Cl
39
40
4-Cl
36
45
4-Cl
89
36
4-NO2
41
41
4-NO2
39
46
4-NO2
82
37
3-NO2
28
42
3-NO2
31
47
3-NO2
82
а Х - заместитель в фенильном кольце соответствующего арилзамещенного гидрофуранона (схема 8): соединения 33-37 - аналоги
соединения 30; соединения 38-42 - аналоги соединения 31; соединения 43-47 - аналоги соединения 32.
б Выход соединений 32-47 дан в расчете на соответствующие 3-хлор-4-арилтригидрофураноны (соединения 30-37), из которых
они образуются, выходы остальных соединений даны в расчете на 2(5Н)-фуранон.
высокими выходами из малодоступных метокси-
трия в растворе избытка СН-кислоты, служившей
или ацетоксиарилфенолов [26].
одновременно растворителем. Взаимодействие
Описанные арил-2(5Н)-фураноны (схема 8, см.
2(5Н)-фуранона с нитроалканами удалось осуще-
таблицу) представляют интерес как химические
ствить только в условиях межфазного катализа.
реагенты и нетоксичные биологически активные
При проведении процесса в присутствии алко-
вещества. Среди них выявлены соединения с фар-
голятов лучшие результаты получены при моль-
макологической и рострегулирующей активностью.
ном соотношении 2(5Н)-фуранона, СН-кислоты и
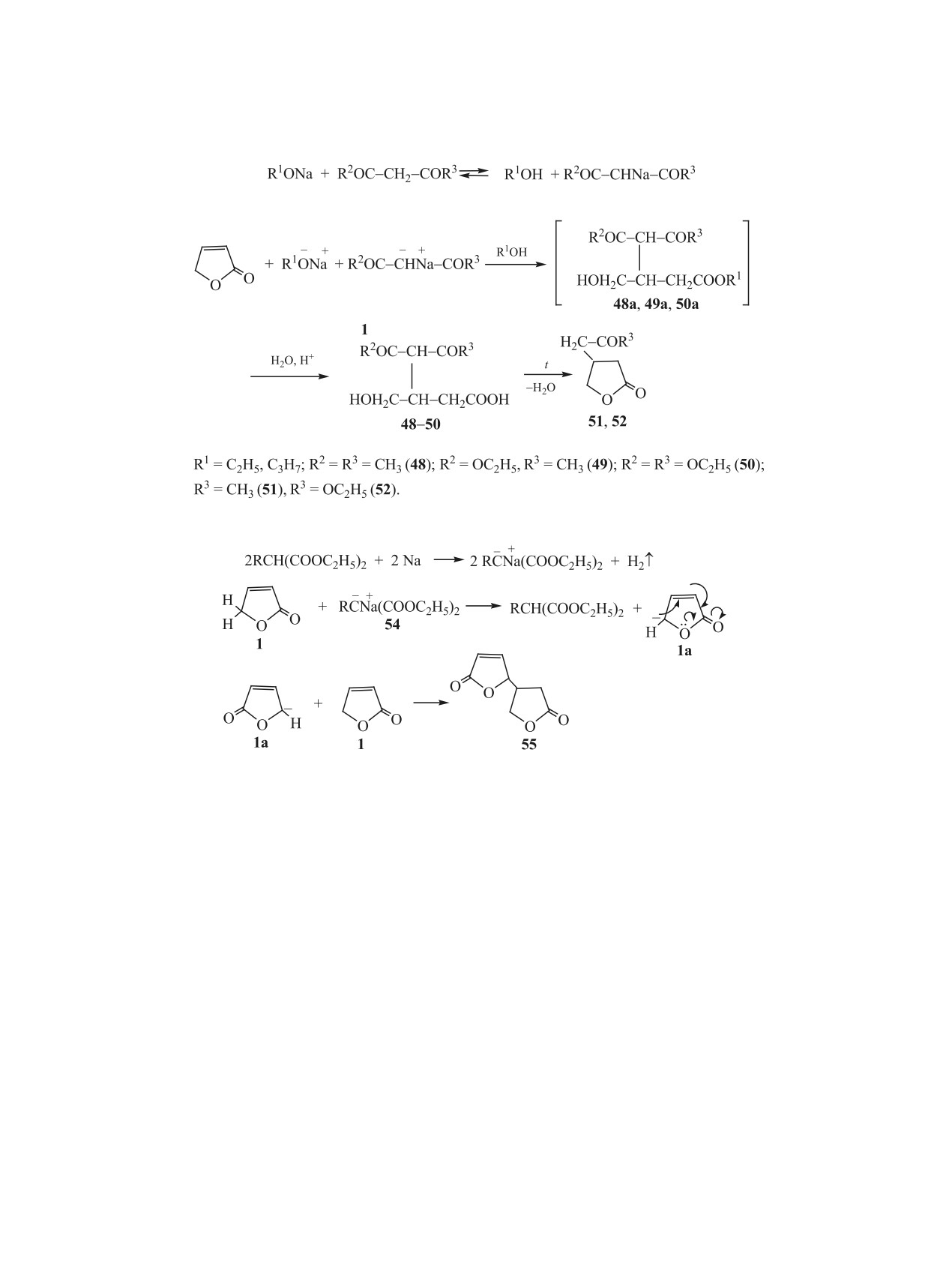
2.5. Реакции с СН кислотами. Ранее описаны
алкоголята натрия, равном 1:2:0.5, и 30°С. Продук-
реакции различных 5-замещенных 2(5Н)-фурано-
ты выделены их экстрагированием хлороформом
нов с тиофенолами, проходящие в присутствии
из нейтрализованной реакционной среды с после-
триэтиламина при комнатной температуре [5],
дующей перегонкой экстрактов в вакууме [33]. В
реакции силилирования 2(5Н)-фуранона
1
[27,
этих случаях получали смеси соответствующих
28], сопряженного присоединения к нему пирро-
гидроксибутановых кислот 48-50 и 4-замещенных
лидона в присутствии производных мочевины в
тетрагидрофуранонов 51, 52 (схема 9), которые
качестве катализатора [29], а также реакции этого
разделяли на колонке с силикагелем при элюиро-
фуранона с некоторыми другими соединениями с
вании смесью хлороформ-ацетон в объемном со-
активной метиленовой группировкой [30], кото-
отношении 30:1.
рые не рассматриваются в настоящем обзоре. Во
Образование гидроксибутановых кислот явля-
всех этих случаях имеет место стереоселективное
ется результатом одновременной нуклеофильной
присоединение по связи С=С фуранонов по типу
атаки сложноэфирного фрагмента 2(5Н)-фуранона
реакции Михаэля. Аналогично проходит присо-
анионом алкоголята и атома С4 по связи С=С более
единение литийтиодифенилфосфида [5]. В то же
объемным анионом СН-кислоты. Это приводит к
время СН-кислотами являются и сами фураноны.
образованию эфиров этих кислот 48а, 49а и 50а
В случаях образования анионов по положению С5
(схема 9), которые при подкислении реакционной
из молекул 2(5Н)-фуранонов эти анионы присое-
среды и вакуумной перегонке превращаются в
диняются к кратным связям молекул непредель-
кислоты 48-50. Последние в условиях выделения
ных соединений с образованием аддуктов Миха-
эля [5, 31, 32].
продуктов реакции частично превращаются в ги-
дрофураноны 51, 52 (схема 9). При этом, наряду с
В настоящем разделе обзора рассматриваются
циклизацией гидроксикислот, происходит расще-
реакции незамещенного 2(5Н)-фуранона 1 с ацето-
пление дикарбонильной группировки в радикалах
уксусным и малоновым эфирами, ацетилацетоном
присоединенных СН-кислот.
и нитроциклогексаном [33, 34]. Авторами исследо-
ваны два варианта условий проведения реакции: в
Для полного перевода гидроксибутановых кис-
присутствии алкоголятов натрия в среде абсолют-
лот 48-50 в гидрофураноны 51, 52 подкисленную
ного спирта и в присутствии металлического на-
реакционную среду перед перегонкой кипятят 10-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
174
БАДОВСКАЯ и др.
Схема 9.
Схема 10.
12 ч [26]. Выходы гидрофуранонов 51, 52 достига-
Очевидно, в результате реакции аниона малоновой
ют 60-90%.
кислоты 54 с фураноном 1 образуется сопряжен-
Исключить раскрытие лактонного цикла в реак-
ный анион 1а, взаимодействие которого с соедине-
ции 2(5Н)-фуранона с малоновым эфиром удалось
нием 1 приводит к димеру 55 (схема 10). По всей
в случае ее проведения в присутствии металли-
видимости, образование из 2(5Н)-фуранона анио-
ческого натрия при 0-5°С. Оптимальное мольное
на обусловлено возможностью его существования
соотношение СН-кислоты, металлического натрия
в виде сопряженного аниона 1а (схема 10).
и 2(5Н)-фуранона составляет 2:(0.1-0.2):1. В этом
случае образуется соединение 53 - аддукт эфира
Образованию димера 55 способствует исполь-
с фураноном 1, в котором сохраняются лактон-
зование в реакции алкилзамещенных малоновых
ный цикл и эфирные группы малонового эфира
эфиров (R = CH3, C3H7), а также уменьшение
с выходом 90%. Реакция ацетоуксусного эфира и
мольного соотношения алкилмалонового эфира и
ацетилацетона с фураноном 1 в присутствии ме-
2(5Н)-фуранона до 1:1 и повышение температуры
таллического натрия оказалась малоэффективной
до 25°С. Именно из-за конкурентной реакции ди-
из-за самоконденсации. Примечательно, что в ука-
меризации фуранона 1 не проходит присоединение
занных условиях обнаружено проявление фурано-
ном свойств СН-кислоты, вследствие чего побоч-
к нему изопропилмалонового эфира в присутствии
но образуется димер 2(5Н)-фуранона (схема 10).
металлического натрия.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
175
Схема 11.
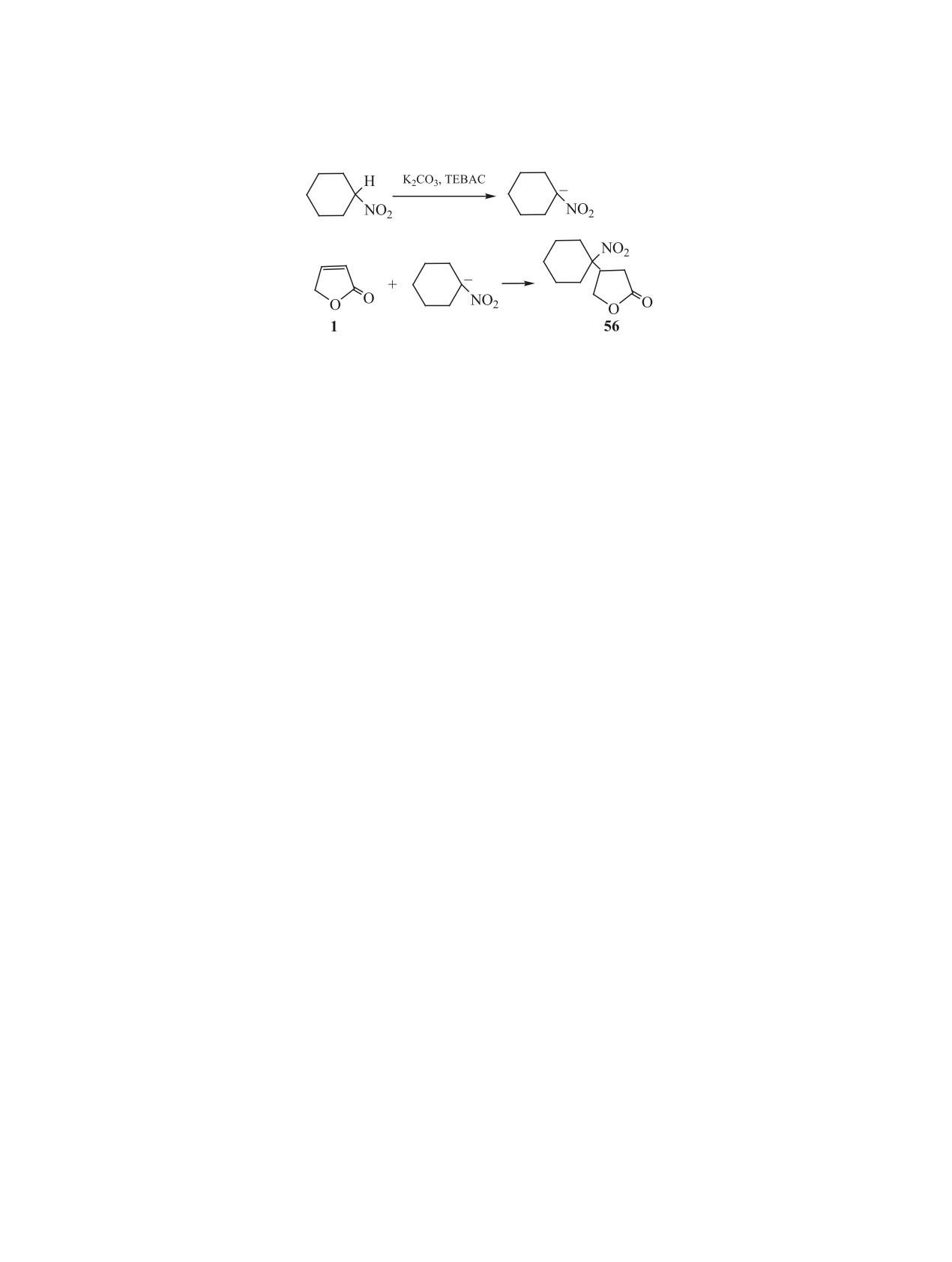
Особый случай представляют реакции присо-
раноном 1 в результате их нуклеофильного присо-
единения к 2(5Н)-фуранону таких СН-кислот, как
единения к атому С4 кратной связи фуранона 1.
нитроалканы. Реализовать эти реакции в рассмо-
Осуществить реакцию в традиционных для по-
тренных выше условиях не удалось. Вероятно, это
добных процессов условиях [29] с использовани-
связано с устойчивостью анионов аци-формы ни-
ем в качестве растворителя толуола или этанола
троалканов. Присоединение к 2(5Н)-фуранону ни-
не удалось из-за осмоления. Проведение процесса
троциклогексана оказалось возможным в условиях
в растворе ДМФА или ДМСО при мольном соот-
межфазного катализа, при этом получен аддукт 56
ношении 2(5Н)-фуранона и третичного енамина,
(схема 11). Процесс проводили в системе твердая
равном 1:2, позволило получить ранее не опи-
фаза-жидкость (карбонат калия-толуол) в при-
санные соединения 60 и 61 с выходами 78 и 60%
сутствии в качестве катализатора межфазного пе-
(схема 12). Их строение доказано методами ИК,
реноса хлорида триэтилбензиламмония (TEBAC)
ЯМР 1Н и ЯМР 13С спектроскопии, рентгенострук-
при мольном соотношении K2CO3:TEBAC:нитро-
турным анализом и масс-спектрометрически [28].
гексан:2(5Н)-фуранон = 1:0.01:1:1.
При этом в реакции и с пиперидинилциклогек-
Как видно из вышеприведенных данных, ре-
сеном, и с морфолинилциклогексеном получено
акции 2(5Н)-фуранона с СН-кислотами имеют
одно и то же вещество 60 (схема 12).
ряд специфических особенностей, связанных с
Объяснить образование соединений 60 и 61
наличием в его молекуле лабильного лактонного
вместо ожидаемых продуктов присоединения
цикла, электрофильной связи С=С, возможностью
енаминов к фуранону 1 можно, исходя из обнару-
образования сопряженного промежуточного анио-
женных у 2(5Н)-фуранона свойств СН-кислоты.
на и проявлением свойств СН-кислоты самим фу-
Как было показано в разделе 2.5, СН-кислотность
раноном 1. Рассмотренные реакции (схемы 9-11)
проявляет метиленовая группировка у атома С5
позволяют получать ряд функционально-замещен-
фуранона 1. Образующийся из него в присутствии
ных тетрагидрофуранонов и продуктов на их осно-
веществ с основными свойствами сопряженный
ве, перспективных для химии реактивов и биоло-
анион может существовать в виде относительно
гически активных веществ.
стабильного аниона гидроксифурана 1а (схема 12).
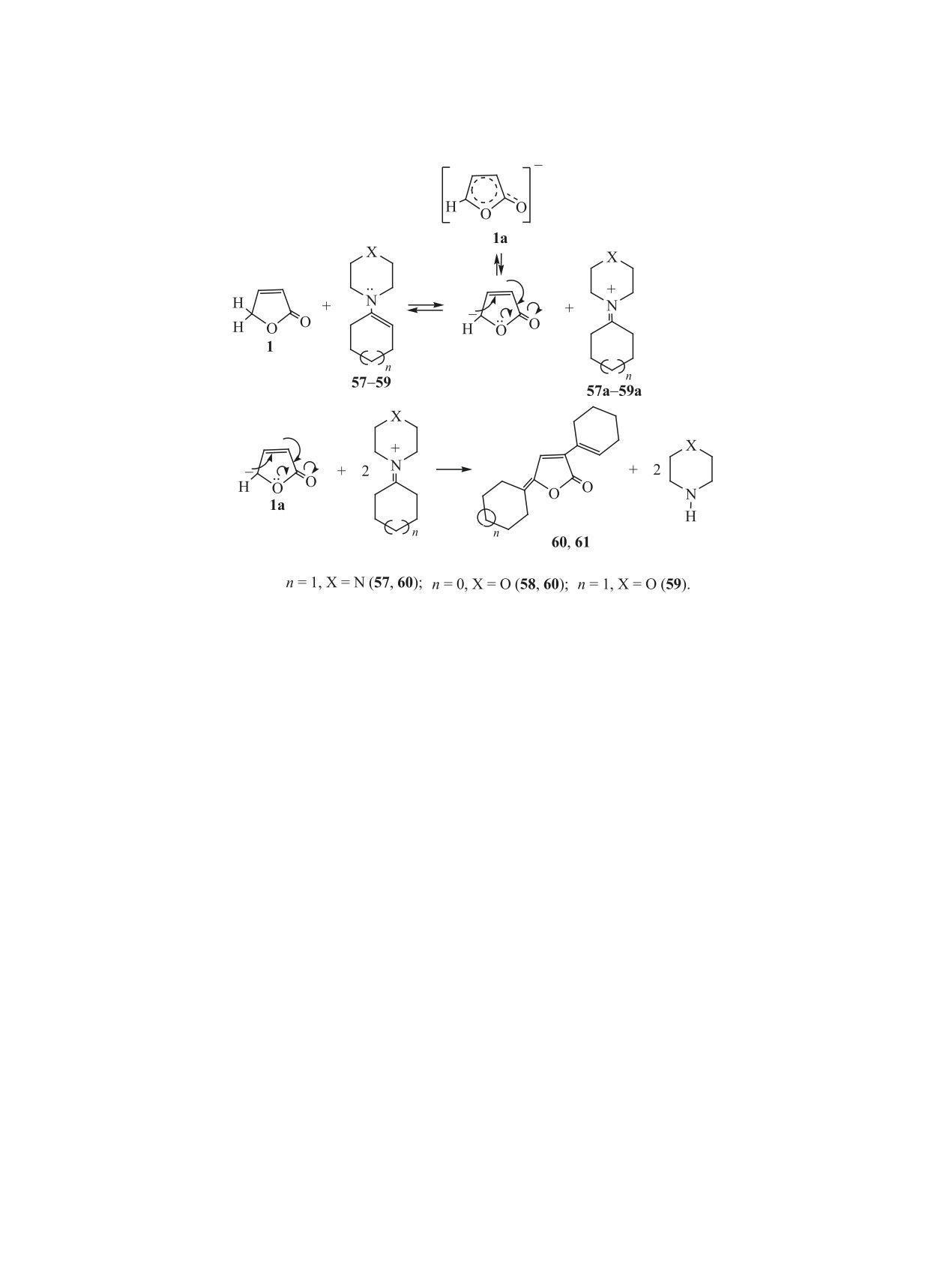
2.6. Реакции с циклическими третичными
Реакция фуранона 1 с енаминами, как мы по-
енаминами. В работе [35] рассматривается впер-
лагаем [35], проходит через такой анион, перво-
вые установленное необычное протекание реак-
начально образующийся при действии на сое-
ции 2(5Н)-фуранона с циклическими третичными
динение 1 нуклеофильного енамина, последний
енаминами. В качестве енаминов были использо-
превращается в соответствующий иминиевый
ваны 1-пиперидиноциклогексен 57, 1-морфоли-
катион 57а-59а (схема 12). Последующая атака
ноциклопентен 58 и 1-морфолиноциклогексен 59.
аниона 1а сильным электрофилом - иминиевым
В соответствии с известными данными о реакции
катионом приводит к замещению атома водорода
циклических енаминов с различными α,β-непре-
в положениях 3 и 5 цикла этого аниона с образо-
дельными карбонильными соединениями
[36],
ванием веществ 60 или 61, стабилизированных
ожидалось образование аддуктов енаминов с фу-
наличием в их молекулах высокоразвитой систе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
176
БАДОВСКАЯ и др.
Схема 12.
мы сопряжения. Предполагается, что этот процесс
пиперидина [30, 31]. В этих реакциях также про-
проходит через предварительное присоединение
является СН-кислотность 2(5Н)-фуранона и пред-
иминиевого катиона в указанные положения ани-
полагаемое образование промежуточного аниона
она 1а с образованием промежуточного аддукта
гидроксифурана 1а.
[35]. Последний при отщеплении циклического
В пользу предполагаемого механизма (схема 12)
амина в результате аллильной перегруппировки
образования в рассматриваемой реакции соедине-
превращается в соединение 60 или 61. На этой
ний 60 и 61 говорит изменение окраски реакцион-
стадии существенную роль играет растворитель.
ной смеси в ходе реакции от желтой через красную
Используемые в реакции ДМФА и ДМСО, явля-
до зеленой, а в конце реакции - до светло-желтой.
ясь слабыми СН-кислотами, образуют достаточно
Это может быть связано с последовательным об-
сильные сопряженные им основания, которые спо-
разованием в реакции ряда соединений с изменя-
собствуют отщеплению амина в промежуточных
ющейся системой сопряжения в их молекулах, что
интермедиатах.
отражает схема 12. Такое явление наблюдается и в
Предполагаемый механизм образования в рас-
реакциях фуранона 1 с ароматическими альдеги-
сматриваемой реакции 3-циклогексенил-5-гекси-
дами [37].
лиденфуран-2(5Н)-фуранонов 60 и 61 согласуется
Реакция 2(5Н)-фуранона с циклическими ена-
с тем установленным фактом, что 5-замещенные
минами представляет интерес для получения био-
2(5Н)-фураноны в реакцию с енаминами не всту-
логически активных веществ. Как установлено,
пают. Это, по-видимому, связано с пространствен-
ее продукты 60 и 61 проявляют антимикробную,
ным экранированием этими заместителями у ато-
противовоспалительную, анальгетическую, про-
ма С5 цикла фуранона. В то же время образование
тивогрибковую активности на уровне, равном или
соединений 60 и 61 согласуется с обнаруженным
превышающем активность эталонов.
нами фактом образования 5-илиден-2(5Н)-фура-
нонов в реакциях 2(5Н)-фуранона с фурановыми
2.7. Реакции с аминами. Описаны реакции
и ароматическими альдегидами в присутствии
2(5Н)-фуранона с аминами различного строения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
177
Схема 13.
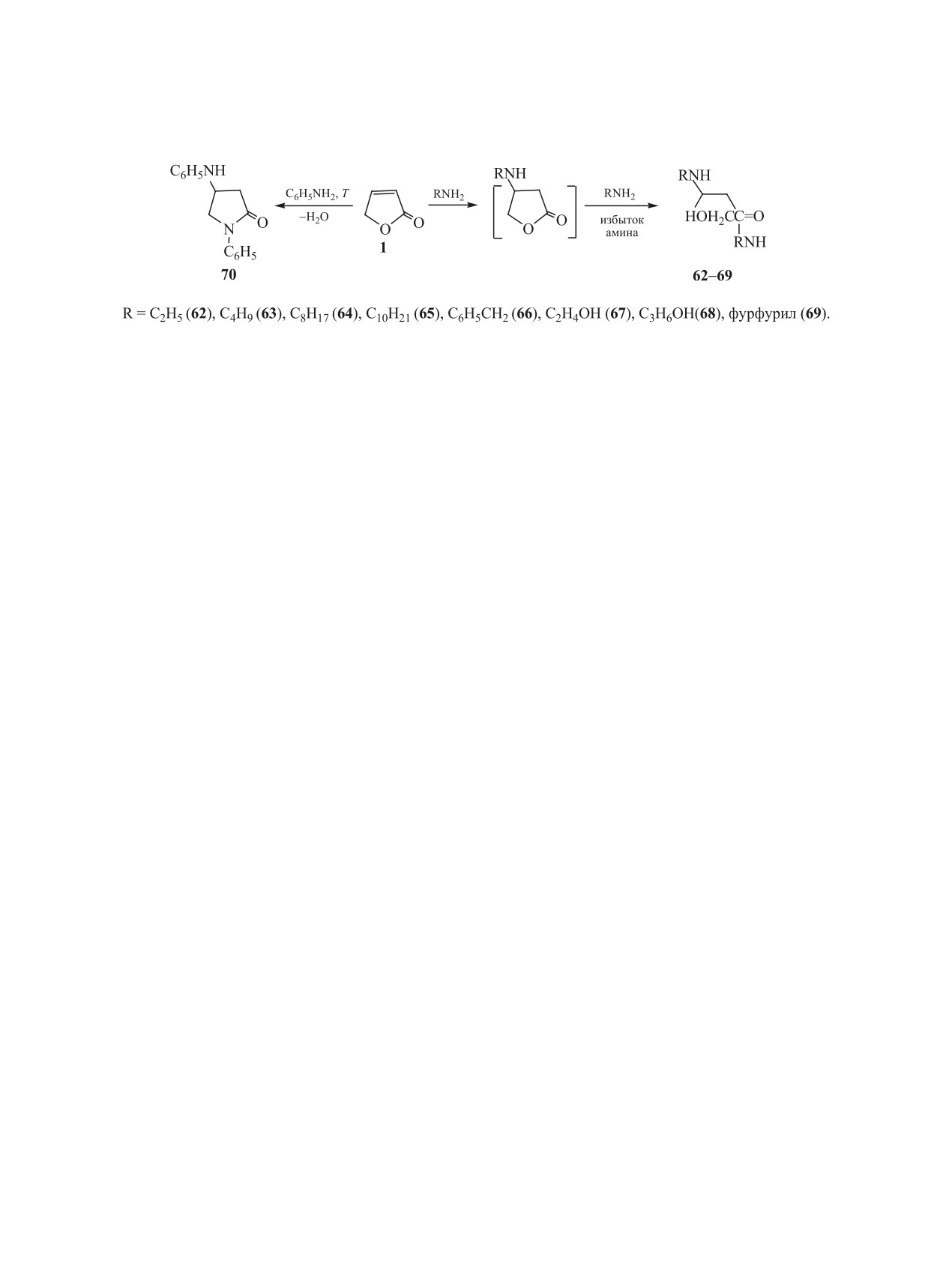
[38]. Взаимодействие фуранона 1 с первичными
являются уникальными реактивами для синтеза
алифатическими аминами, а также с бензилами-
другим путем труднодоступных гетероцикличе-
ном и фурфуриламином проходит легко при из-
ских соединений: 2-оксазолидонов, иминооксазо-
бытке амина, их мольном соотношении 1:(2-5)
лидинов, иминотиазолидинов, морфолин-2,3-дио-
нов и их производных.
при комнатной температуре. В ряде случаев реак-
ция сопровождается выделением тепла. Продук-
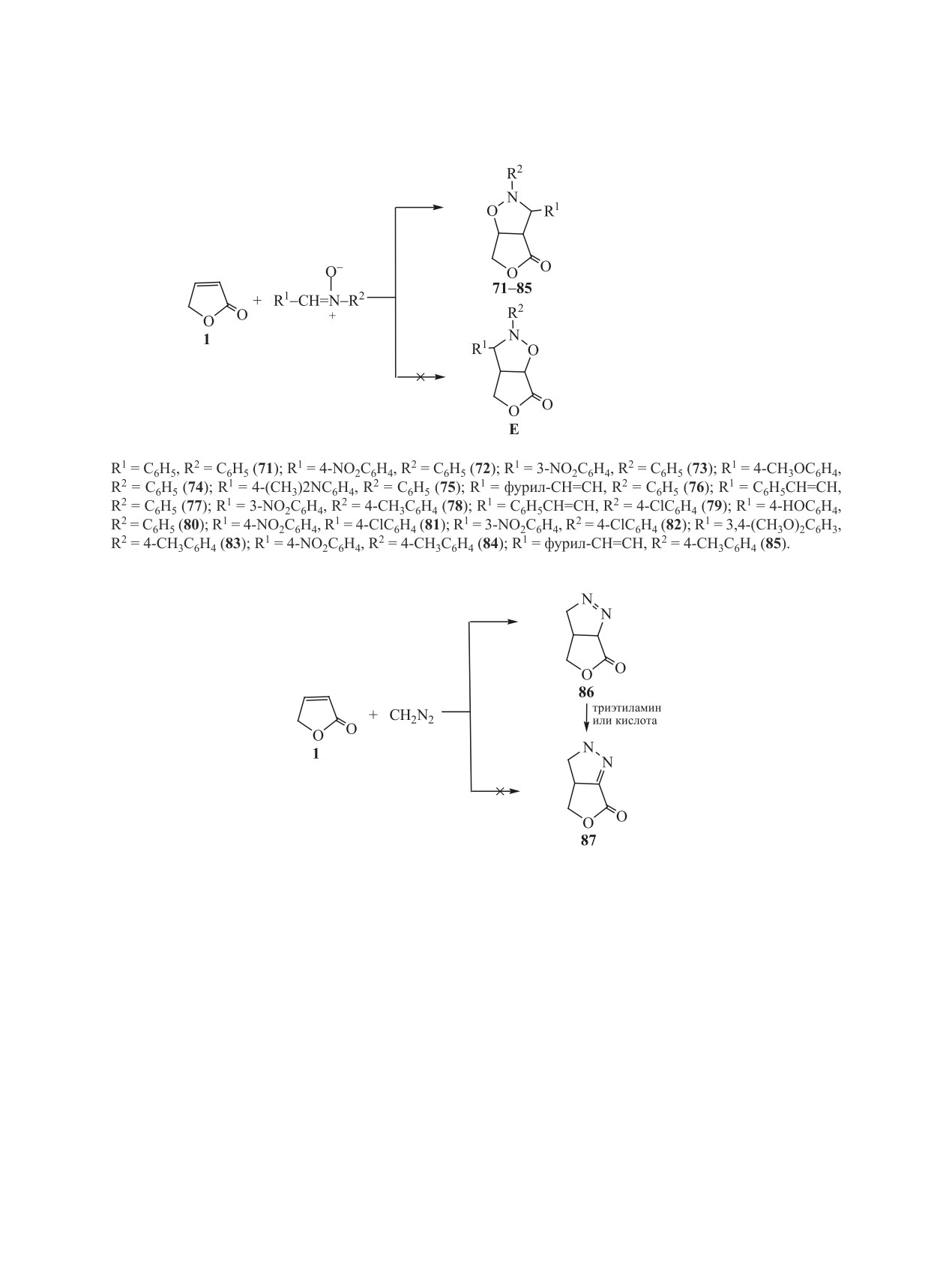
2.8. Реакции 1,3-диполярного циклоприсое-
тами реакции являются соответствующие амиды
динения и синтезы на основе их аддуктов функ-
ционально-замещенных тетрагидрофуранонов.
3-N-алкил(бензил)амино-4-гидроксибутановых
Широко описаны реакции циклоприсоединения к
кислот 62-69 (схема 13).
функциональным производным
2(5Н)-фуранона
Соединения 62-66, 69 образуются с выходами
[5]. Это реакции Дильса-Альдера и 1,3-диполяр-
90-96 %, а соединения 67 и 68 - с выходами 23 и
ного циклоприсоединения, позволяющие получать
50% соответственно. Их образование является ре-
циклоаддукты, обладающие биологической актив-
зультатом присоединения аминов по атому С4 фу-
ностью. Относительно 2(5Н)-фуранона данные
ранона 1 и одновременного аминолиза его слож-
об этих реакциях немногочисленны и в основном
ноэфирной группы. По всей видимости, процесс
касаются стереохимии этих реакций. Сообщалось
проходит через предварительное нуклеофильное
о реакции Дильса-Альдера с циклопентадиеном
присоединение амина по кратной связи фуранона
[41], о циклопропанировании фуранона 1 с помо-
с образованием промежуточного 4-аминотетраги-
щью комплексов гликоновых карбенов [42]. Опи-
дрофуранона (схема 13). Это согласуется с извест-
саны реакции
1,3-диполярного присоединения
ными данными о более высокой электрофильно-
нитрилоксидов к 2(5Н)-фуранонам, имеющим в
сти кратной связи в молекуле 2(5Н)-фуранона по
положении С5 различные заместители [5].
сравнению с углеродом сложноэфирной группы.
Об использовании самого 2(5Н)-фуранона в
Реакция 2(5Н)-фуранона с анилином в течение
качестве диполярофила ранее имелись немно-
6 ч в указанных выше условиях не проходит, что
гочисленные сообщения лишь о его реакциях с
связано с пониженной нуклеофильностью ами-
некоторыми нитронами [43-44], 3,4,5,6-тетраги-
ногруппы в его молекуле. Эту реакцию удалось
дропиридин-1-оксидом [45], диазоалканами, диа-
осуществить только при нагревании до 170-180°С
зоэфирами, диазокетонами [47].
смеси фуранона 1 с 5-кратным избытком анилина.
В наших работах [21, 47-51] приведены ре-
Продуктом реакции является 1-фенил-4-фенил-
зультаты всесторонних исследований ранее не
амино-2-пирролидон
70. Строение соединений
описанных реакций 2(5Н)-фуранона с нитронами,
62-70 подтверждено методами ИК и ЯМР 1Н спек-
диазометаном и нитрилоксидами, рассмотрены их
троскопии.
стереохимия и направления использования обра-
Ранее не описанные замещенные амиды бута-
зующихся продуктов в органическом синтезе.
новой кислоты 62-69 и пирролидон 70, получен-
В реакции 2(5Н)-фуранона с нитронами [47]
ные в реакциях 2(5Н)-фуранона с аминами, прояв-
использованы ароматические нитроны различно-
ляют разнообразную биологическую активность.
го строения (схема 14). Процесс проводили при
Кроме того, как установлено [38-40], амиды 62-69
кипячении в растворе бензола фуранона 1 и соот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
178
БАДОВСКАЯ и др.
Схема 14.
Схема 15.
ветствующего нитрона, взятых в мольном соотно-
(-32.8 э. е.). Эти данные указывают на синхрон-
шении 2:1. Строение аддуктов 71-85 нитронов с
ный многоцентровый механизм 1,3-диполярного
фураноном установлено методами УФ, ИК, ЯМР
циклоприсоединения нитронов к 2(5Н)-фуранону,
1Н, 13С спектроскопии и масс-спектрометрии [47].
который характерен и для других реакций цикло-
Механизм этой реакции изучен на примере вза-
присоединения [5]. На основании анализа спек-
имодействия фуранона с С,N-дифенилнитроном.
тров ЯМР 1Н и 13С синтезированных аддуктов
При избытке лактона реакция имеет первый поря-
71-85, в молекулах которых изоксазолидиновый
док по нитрону и псевдонулевой по 2(5Н)-фурано-
цикл аннелирован с циклом тетрагидрофурано-
ну, характеризуется низкими значениями энергии
на, установлено [47], что исследуемая реакция
активации (71.4 кДж/моль), предэкспоненциаль-
проходит цис-стереоспецифично с образованием
ного множителя (1.4×106 с-1) и значительным от-
единственного изомера (схема 14). При этом име-
рицательным значением энтропии активации
ет место экзо-подход транс-нитрона к молекуле
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
179
Схема 16.
Схема 17.
2(5Н)-фуранона. Физико-химические характери-
88-97, в молекулах которых аннелированы циклы
стики аддуктов 71-85 и результаты их спектраль-
тетрагидрофуранона и изоксазола (схема 16).
ного исследования приведены в работе [47].
Таким образом, реакции 1,3-диполярного ци-
Реакция 2(5Н)-фуранона с диазометаном ра-
клоприсоединения к 2(5Н)-фуранону позволяют
нее была использована только для алкилиро-
получить другим путем труднодоступные бици-
вания гидрофуранонов [5]. Однако проведение
клические соединения 71-97 (схемы 14-16), пер-
этой реакции в эфирном растворе при комнатной
спективные в качестве биологически активных
температуре позволяет остановить его на стадии
веществ и химических реактивов.
образования соединения 86 (схема 15), в котором
Полученные циклоаддукты 2(5Н)-фуранона с
пиразолиновый цикл аннелирован с циклом тетра-
нитронами, диазометаном и нитрилоксидами ис-
гидрофуранона [48].
пользованы для синтеза ранее не описанных функ-
Доказано, что при этом образуется только один
ционально-замещенных тетрагидрофуранонов.
изомер 86, имеющий структуру ∆1-пиразолина,
Так, восстановлением циклоаддуктов 71, 72, 77, 81
который превращен в изомерный ∆2-пиразолин 87
и 82 2(5Н)-фуранона с нитронами (схема 14) водо-
нагреванием раствора соединения 86 в хлорофор-
родом или гидразингидратом в присутствии нике-
ме в присутствии триэтиламина. Строение соеди-
ля Ренея получены соответствующие замещенные
нений 86 и 87 изучено методами спектроскопии
тетрагидрофураноны - 4-гидрокси-3-ариланили-
УФ, ИК, ЯМР и масс-спектрометрии [48]. Для со-
нометилтетрагидрофураноны 98-102 (схема 17).
единения 86 наблюдается цис-сочленение циклов.
Процесс восстановления проводят в спирте при
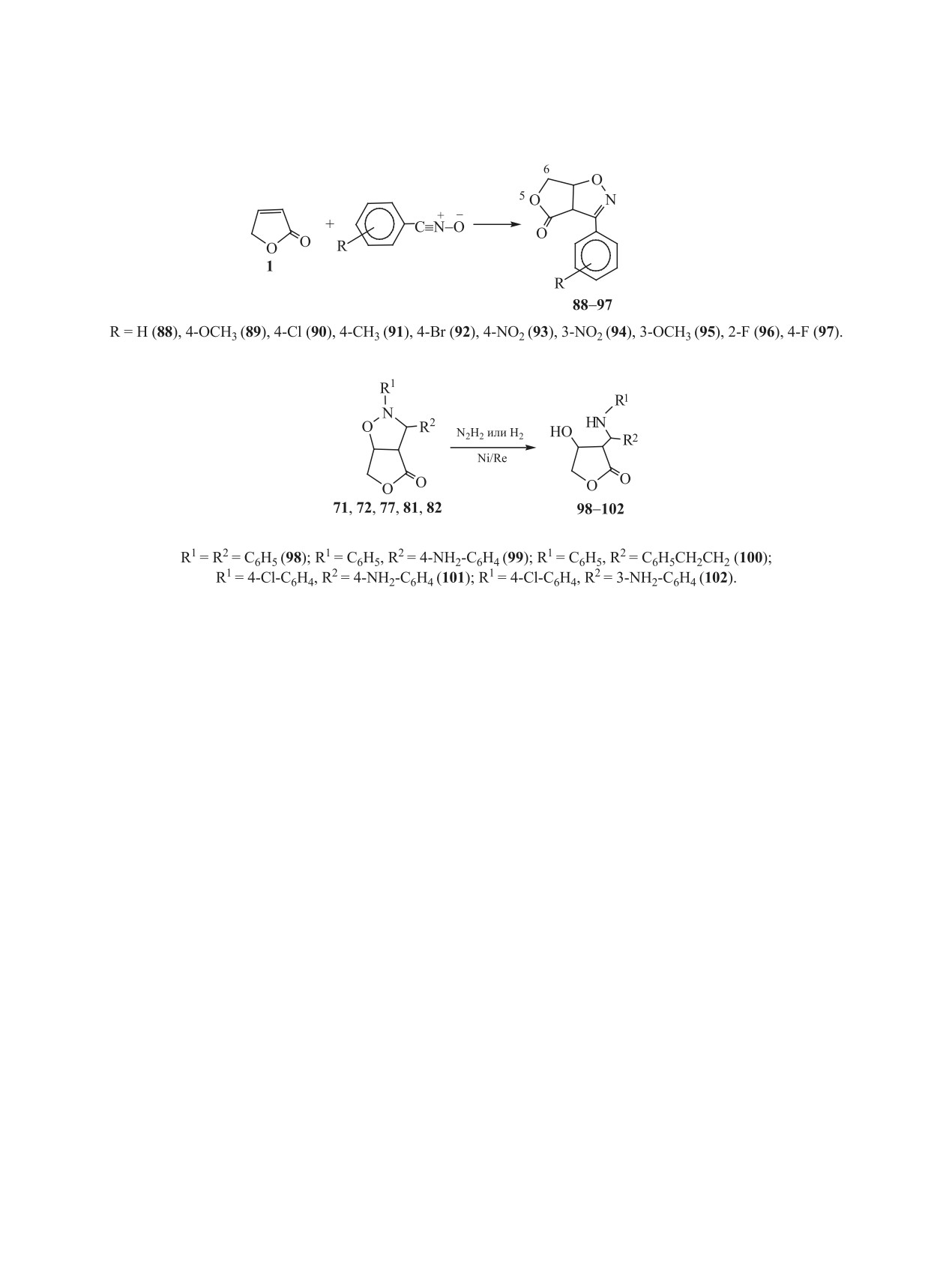
В работе [40] рассматривается 1,3-диполярное
30-40°С и мольном соотношении исходного ад-
циклоприсоединение к 2(5Н)-фуранону широкого
ряда бензонитрилоксидов. Установлено, что эти
дукта и восстановителя, равном 1:(2-2.5). В дан-
реакции также проходят исключительно регио-
ных условиях проходит восстановление не только
селективно и приводят к образованию аддуктов
изоксазолидинового цикла, но и нитрогрупп или
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
180
БАДОВСКАЯ и др.
Схема 18.
Схема 19.
Схема 20.
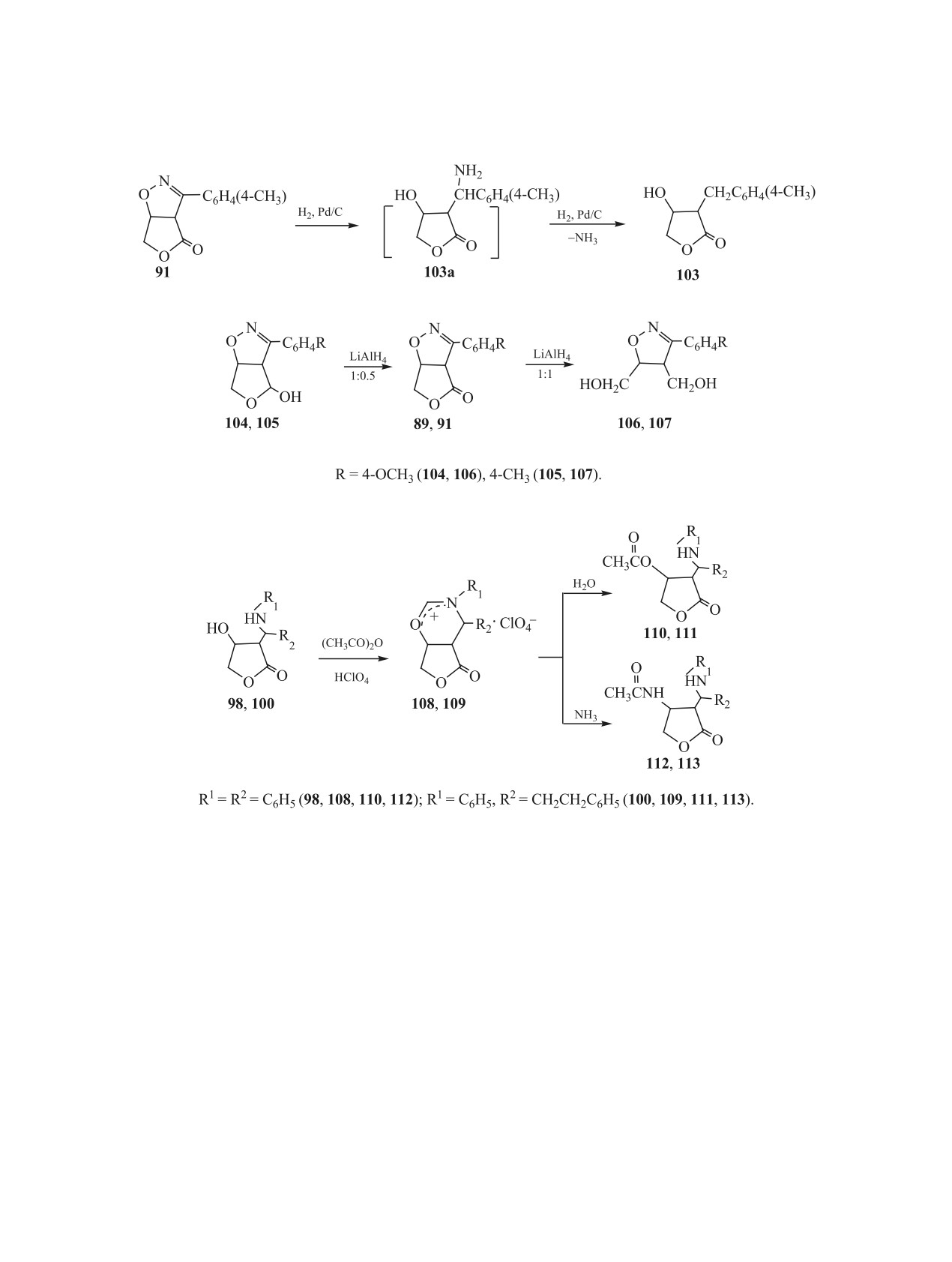
непредельных фрагментов, находящихся в фе-
Процесс восстановления аддуктов 89 и 91 алю-
нильном заместителе R2 исходных соединений 72,
могидридом лития затрагивает только фрагмент
77, 81, 82.
тетрагидрофуранона [51]. При мольном соотноше-
Восстановление циклоаддуктов 2(5Н)-фурано-
нии аддуктов 89, 91 и LiAlH4, равном 1:0.5, обра-
на с нитрилоксидами позволяет получать различ-
зуются соединения 104 и 105 с выходом до 68%, а
ные продукты в зависимости от типа восстановите-
при увеличении мольного соотношения реагентов
ля и условий процесса [51]. Так, при гидрировании
до 1:1 образуются соединения 106 и 107 (схема 19).
изоксазолинтетрагидрофуранона 91 в присутствии
Таким образом, аддукты
2(5Н)-фуранона с
катализатора Pd/C получен 3,4-замещенный тетра-
бензонитрилоксидами открывают синтетический
гидрофуранон 103 (схема 18). Вероятно, в этом
путь к ранее труднодоступным аннелированным
случае реакция проходит через восстановительное
дезаминирование промежуточно образующегося
гидрокситетрагидрофуранизоксазолинам 104, 105
соединения 103а.
и замещенным изоксазолинам 106, 107.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
181
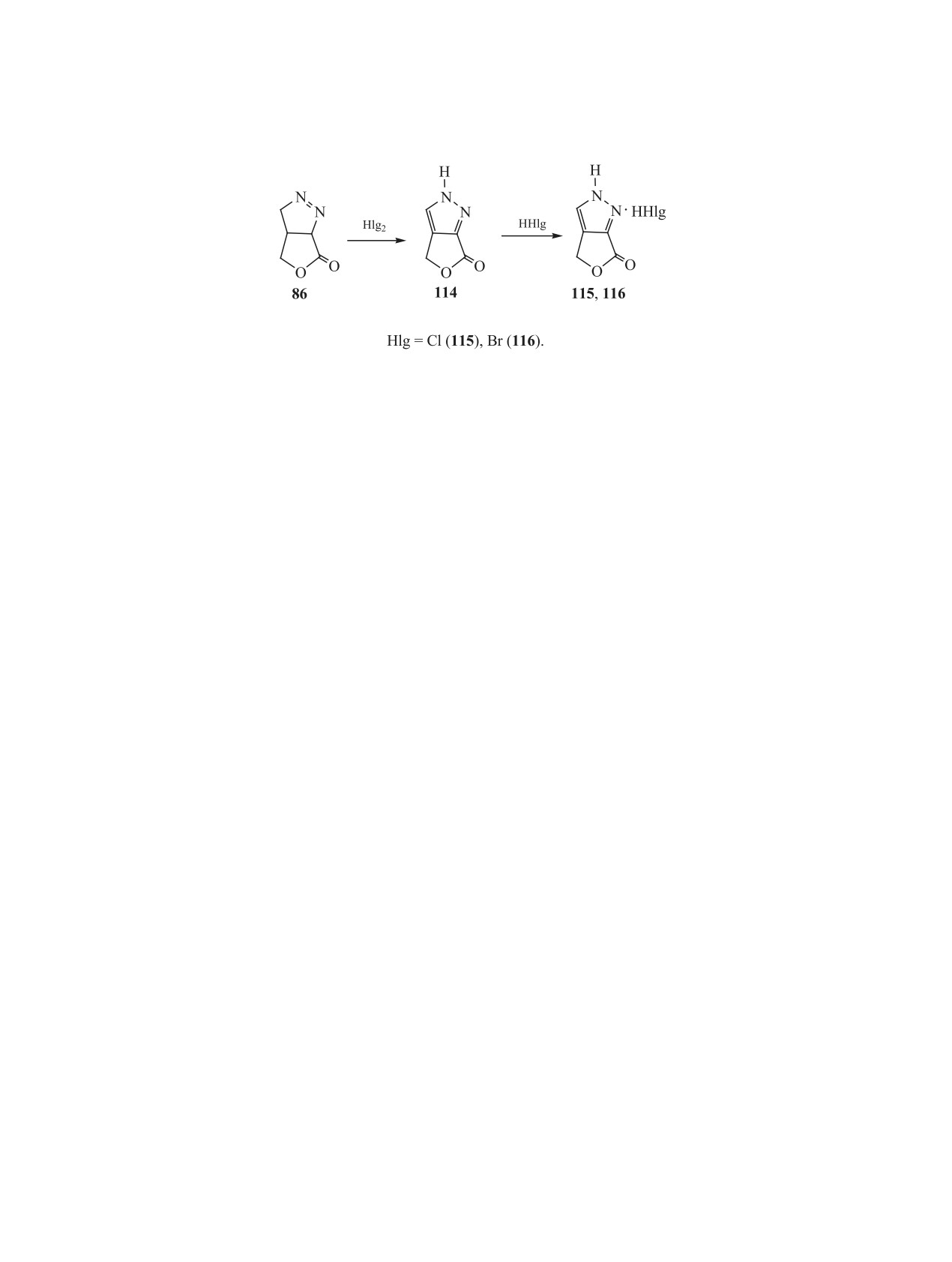
Схема 21.
4-Гидрокси-3-анилинотетрагидрофураноны
10 мин образуется гидрохлорид 115 этого пиразо-
98 и 100, полученные восстановлением циклоад-
ла. Гидробромид 116 пиразола 114 синтезирован
дуктов 2(5Н)-фуранона с нитронами (схема 17),
дробным добавлением брома в хлороформе к рас-
использованы также для синтеза ряда ранее не
твору 1-пиразолина 86.
описанных функциональных производных тетра-
Спектрально установлено, что рассмотренные
гидрофуранона и бициклических гетеросоедине-
процессы в указанных условиях проходят через
ний [41] (схема 20).
изомерное превращение 1-пиразолина 86 в более
термодинамически устойчивый 2-пиразолин
87
При взаимодействии 4-гидрокси-3-анилиноме-
[52]. Превращение соединения 86 в изомерный
тилтетрагидрофуранонов 98 и 100 с эквивалент-
2-пиразолин 87 (схема 15) происходит в кислых и
ным количеством хлорной кислоты в избытке
основных средах.
уксусного ангидрида при 0°С в течение 0.5 ч полу-
чены перхлораты 1,3-оксазиния 108, 109, в моле-
3. РЕАКЦИИ 5-ГИДРОКСИ-2(5Н)-ФУРАНОНА
кулах которых оксазиниевый цикл аннелирован с
И СИНТЕЗЫ НА ИХ ОСНОВЕ
циклом тетрагидрофуранона (схема 20). Их харак-
Функционально-замещенные 2(5Н)-фураноны
теристики, интерпретация результатов спектраль-
привлекают к себе внимание возможностью полу-
ного изучения их строения и механизм образова-
чать на их основе, за счет реакций их функциональ-
ния приведены в работе [50]. Изучено поведение
ных групп, различные производные с сохранением
полученных солей оксазиния в присутствии таких
цикла 2(5Н)-фуранона. Многие из таких соедине-
нуклеофилов, как вода и аммиак [50]. Нагревание
ний имеют структуру природных фрагментов, не-
соединений 108, 109 в смеси воды и хлороформа
сущих разнообразную (противораковую, инсекти-
(1:5) приводит к раскрытию оксазиниевого цикла с
цидную, широкую антибиотическую) активность.
образованием продуктов О-ацилирования 110, 111
Сообщается о антивоспалительной и антимикроб-
(схема 20). При пропускании сухого аммиака че-
ной активности (5S)-ментилокси- и 5-(-)-борни-
рез суспензию этих солей оксазиния в хлорофор-
локси-2(5Н)-фуранонов соответственно [53, 54].
ме также происходит раскрытие их оксазиниевого
Сульфаниловые прозводные 5-гидрокси-2(5Н)-фу-
цикла, но с образованием продуктов N-ацилиро-
ранона известны своим противораковым действи-
вания - ранее не известных амидозамещенных те-
ем [55]. 4-Амино-5-гидрокси-2(5Н)-фураноны пер-
трагидрофуранонов 112, 113 (схема 20).
спективны как антибиотики широкого действия
На основе аддукта 2(5Н)-фуранона с диазо-
[56, 57]. Установлена инсектицидная активность
метаном (соединение 86) получено [52] соедине-
новых 5-алкокси-2(5Н)-фуранонов [58]. В рабо-
ние 114 с аннелированными циклами пиразола и
тах [59, 60] сообщается о синтезе биологически
тетрагидрофуранона, а также его соли 115, 116
активных природных соединений - клевиолида и
(схема 21).
(+)-мускарина, исходя из 5-замещенных 2(5Н)-фу-
При окислении 1-пиразолина 86 сухим хлором
ранонов в качестве базовых реагентов.
в растворе хлороформа в течение 30 мин получен
Важное место в синтетической и теоретической
пиразол 114, а при кипячении соединения 86 в рас-
химии занимает 3,4-дигалоген-5-гидроксипроиз-
творе этанола с концентрированной HCl в течение
водные 2(5Н)-фуранонов, в частности, 5-гидрок-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
182
БАДОВСКАЯ и др.
Схема 22.
си-3,4-дихлор-2(5Н)-фуранон и его алкоксипроиз-
нон 117, 5-алкокси- и 5-ацилокси-2(5Н)-фураноны
водные, а также тиопроизводные 2(5Н)-фуранона
регио- и стереоселективно вступают в реакции
[61].
1,3-диполярного циклоприсоединения с участи-
ем нитрилоксидов, нитронов, этилдиазоацетата и
В связи с большим практическим значением
азометина, азидов и тиоэфиров [5, 70-76]. Указан-
5-замещенных 2(5Н)-фуранонов разработаны и
ные 5-замещенные гидрофураноны использованы
продолжают разрабатываться разнообразные под-
также в реакциях 1,4-присоединения по типу Ми-
ходы к синтезу родоначальников этого класса сое-
хаэля [5], Дильса-Альдера [5, 77], присоединения
динений - 5-гидрокси- и 5-алкокси-2(5Н)-фурано-
хиральных аминоспиртов или борной кислоты по
нов. Большинство методов посвящено получению
более устойчивых алкоксизамещенных гидрофу-
связи С=С [78, 79].
ранонов. В обзоре [62] рассматриваются методы
Для 5-гидрокси-(25Н)-фуранонов характерны
синтеза производных 5-гидрокси-2(5Н)-фуранона
также и другие реакции: замещение гидроксиль-
117, основанные на реакциях 2-оксокарбоновых
ной группы на алкокси- [69, 80], ацилоксигруппу
кислот, формилировании или карбоксилировании
[69, 81] или третичную аминогруппу [81], ката-
функционально-замещенных ароматических или
литическое присоединение борной кислоты по
гетероциклических соединений, превращениях
связи С=С [82], каталитическое окисление кисло-
производных фурана. Реакции окисления послед-
родом до малеатов [83], взаимодействие с амина-
них до 5-гидрокси- и 5-алкокси-2(5Н)-фуранонов
ми [84], этантиолом [85, 86] и металлоорганиче-
получили широкое распространение. Cообщается
скими соединениями, приводящее к получению
о фотоинициированном окислении фурфурола,
5-N-, 5-S- или 5-С-замещенных 2(5Н)-фуранонов
фурана, фуран-2-карбоновой кислоты до 5-ги-
[87], каталитическое взаимодействие с некоторы-
дрокси- и 5-алкокси-2(5Н)-фуранонов кислоро-
ми циклическими и ациклическими винилогич-
дом либо H2O2 в метаноле или этаноле [63-65], об
ными амидами и 1,3-дикарбонильными соедине-
окислении замещенного 2-этоксифурана в системе
ниями, приводящее к образованию производных
MnO-HCl до производного указанного гидрокси-
пиррола, фурана, тетрагидроиндола и тетрагид-
фуранона [66], об анодном окислении фурфурола
робензофурана [88]. Оптические изомеры 5-мен-
и фуран-2-карбоновой кислоты водой до фуранона
тилокси-2(5Н)-фуранона используются в синтезе
117 в присутствии галогенидов переходных метал-
хиральных продуктов, в частности, циклопропа-
лов или на Pb- и PbO2-электродах в разбавленных
новых производных бутиролактона [89]. Интерес-
растворах H2SO4 [67, 68]. Наиболее удобный путь
ным представляется сообщение о переэтерифи-
к синтезу 5-гидрокси-2(5Н)-фуранона 117 и его
кации некоторых 5-ацилокси-2(5Н)-фуранонов с
важнейших производных - 5-этокси-, 5-ацеток-
высокой энантиоселективностью в присутствии
си-, 5-ацетамидо-2(5Н)-фуранонов основывается
липазных катализаторов [90]. Аллильное замеще-
на каталитических и электрохимических реакци-
ние энантиомерно чистого 5-ацетокси-2(5Н)-фу-
ях фурфурола с пероксидом водорода [10-12, 69].
ранона на палладиевом катализаторе приводит к
Эти методы позволяют более широко использо-
почти полному сохранению конфигурации в обра-
вать указанные фураноны в органическом синтезе.
зующемся 5-этокси-2(5Н)-фураноне [91].
Сообщается о использовании гидроксифурано-
В то же время некоторые реакции замещения и
на 117 и его производных в реакциях различного
конденсации указанных 5-замещенных фуранонов,
типа. Наиболее часто эти соединения использо-
а также их таутомерные превращения, олигомери-
ваны в реакциях присоединения. Гидроксифура-
зация и анодное окисление пероксидом водорода в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
183
Схема 23.
Схема 24.
перечисленных работах не рассматриваются, хотя
протонированных форм кислоты 118 предполагае-
эти реакции и их продукты представляют очевид-
мого строения 119 и 120.
ный интерес. Данные превращения обсуждаются в
Детальное исследование поведения 5-гидрок-
настоящем обзоре.
си-2(5Н)-фуранона 117 в водных средах позволило
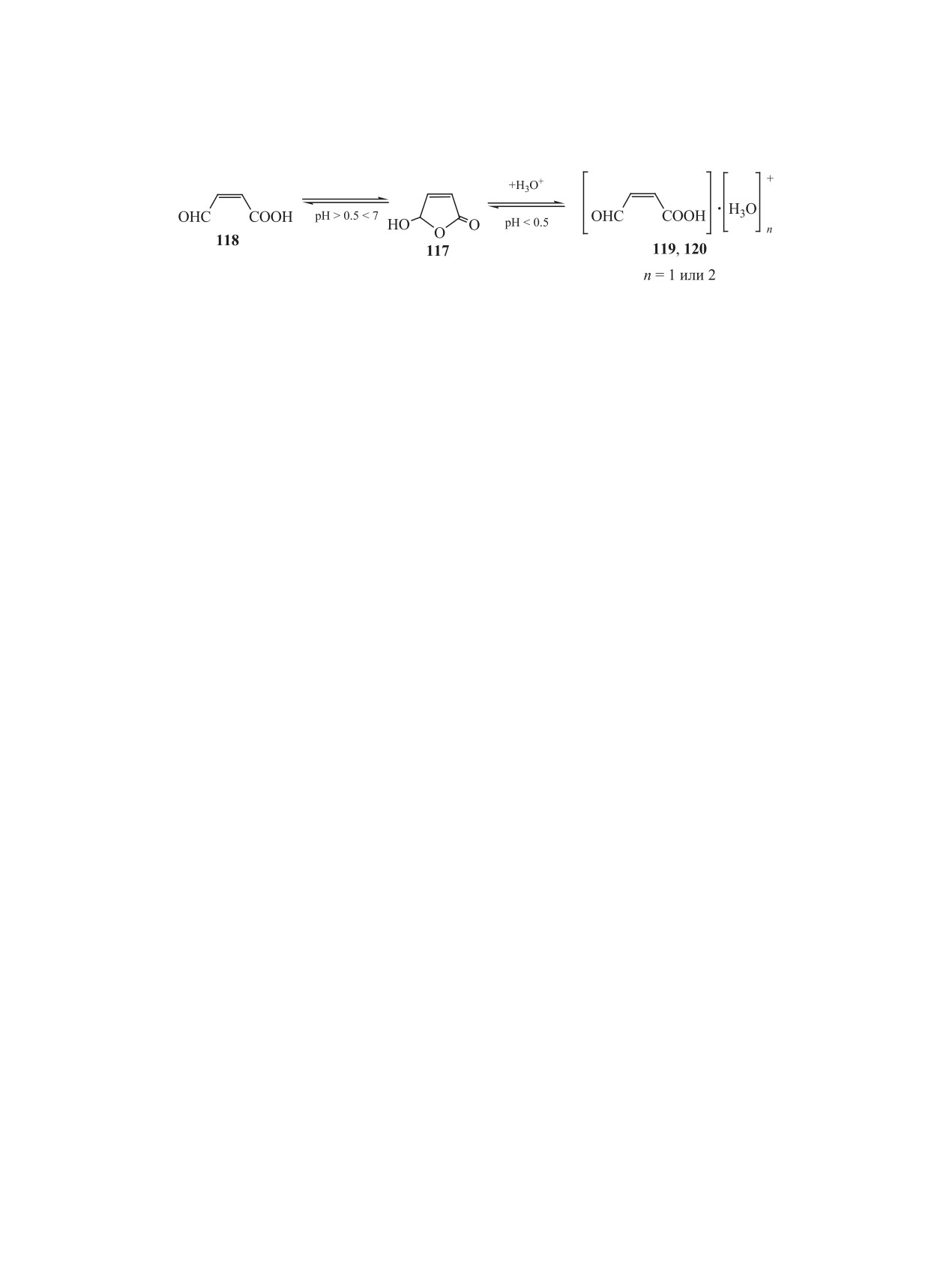
3.1. Таутомерные превращения. Ранее было
установить факт его превращения в янтарную кис-
установлено, что 5-гидрокси-2(5Н)-фуранон 117
лоту 5 [11, 95]. Нагревание нейтрального водного
представляет собой циклическую таутомерную
раствора гидроксифуранона 117 при 60°С в тече-
форму цис-β-формилакриловой кислоты 118 [92,
ние 3 ч приводит к его превращению в кислоту 5
93]. Полярографическим методом установлено,
всего на 3%. После 24 ч нагрева выход кислоты 5
что в водных растворах между таутомерами 117 и
увеличивается до 13%. При снижении рН раство-
118 существует подвижное равновесие, контроли-
ра до значений 1-3 внесением хлорной кислоты
руемое величиной рН среды (схема 22) [11, 94].
это превращение резко замедляется. Напротив, в
В нейтральной среде фуранон 117 почти полно-
растворах NaOH с рН 9-10 в течение нескольких
стью находится в виде таутомера 118, который по
минут происходит практически полное превраще-
мере подкисления раствора до рН не ниже 0.5 пре-
ние соединения 117 в кислоту 5, которая выделена
вращается в лактол 117 на 30-60%. При рН < 0.5
препаративно, ее характеристики соответствуют
цикл таутомера 117 раскрывается с образованием
литературным данным [95]. Обнаруженное пре-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
184
БАДОВСКАЯ и др.
Схема 25.
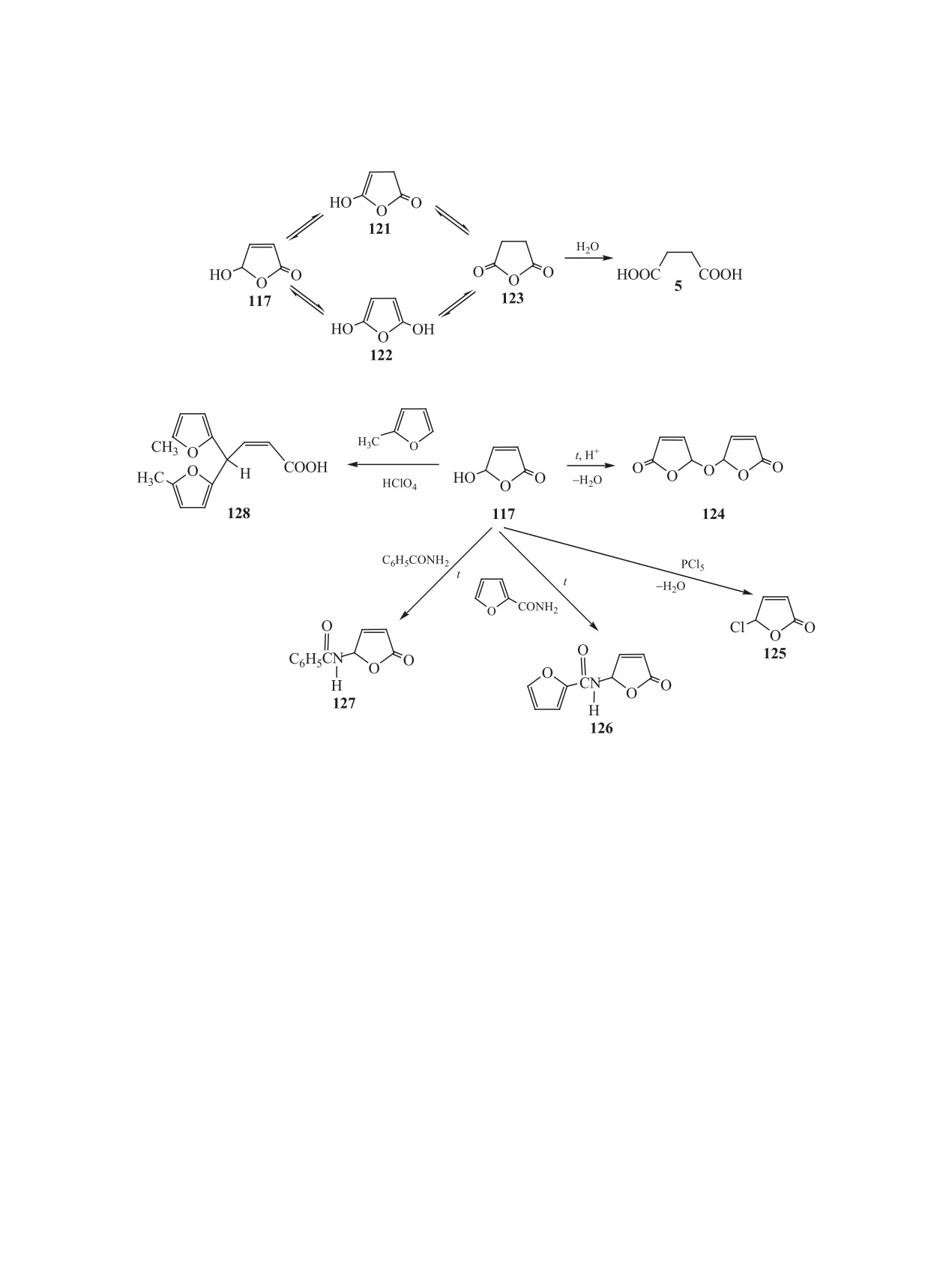
вращение гидроксифуранона 117 в кислоту 5 мож-
его выхода (до 72%) достигнуто взаимодействием
но объяснить схемой 23.
соединения 117 (без его выделения из смеси про-
дуктов окисления фурфурола [10, 11, 69]) с пен-
Очевидно, что при рН > 7 фуранон 117 находит-
ся в равновесии с неустойчивыми таутомерными
тахлоридом фосфора при комнатной температуре
формами 121 и 122, которые превращаются в ян-
[96].
тарный ангидрид 123. Последний гидролизуется
5-Ацетамидо-2(5Н)-фуранон 126 с выходом не
до кислоты 5, в сторону которой смещается под-
более 20-40% получают взаимодействием ацета-
вижное равновесие в рассматриваемой системе.
мида с лактолом 20, либо c 5-этокси-2(5Н)-фура-
3.2. Замещение и конденсация. На основе ре-
ноном, либо c 5-бромфураноном [100–103]. Синтез
акций замешения и конденсации с участием гидро-
амидофуранона 126 и 5-бензоиламидо-2(5Н)-фу-
фуранона 117 (без его выделения из реакционной
ранона 127 с выходами 48 и 55% соответственно
среды, полученной каталитическим окислением
осуществлен нагреванием смеси гидроксифурано-
фурфурола Н2О2 [69]) получены 5-замещенные
на 117 и амида фуран-2-карбоновой или бензойной
2(5Н)-фураноны и 2-бутеновые кислоты 124-128
кислот (мольное соотношение 1:1) при 70°С в те-
[96] (схема 24).
чение 4-7 ч [96].
5,5′-Оксади-2(5Н)-фуранон (124) ранее обнару-
Реакция фуранона 117 с 2-метилфураном (моль-
живали в составе продуктов реакции фуранона 117
ное соотношение 1:2.2) в растворе серного эфира
с тионилхлоридом [97] и фотосенсибилизирован-
при комнатной температуре в присутствии ката-
ного окисления 2-фурфурилового спирта в ацетоне
литических количеств хлорной кислоты в течение
[98]. Препаративный синтез димера 124 осущест-
5 ч привела к образованию гем-бис-4,4-(5-метил-
влен нами [96] при кипячении раствора фуранона
2-фурил)-2-бутеновой кислоты 128 с выходом 13%
117 в хлороформе в присутствии кислотных ката-
[96]. Методом спектроскопии ЯМР 1Н установ-
лизаторов (муравьиной или малеиновой кислот,
лено, что остаток акриловой кислоты в молекуле
катионита в Н+-форме) с азеотропной отгонкой
продукта 128 имеет цис-конфигурацию протонов
выделяющейся воды, выход вещества 124 соста-
при связи С=С.
вил 40%.
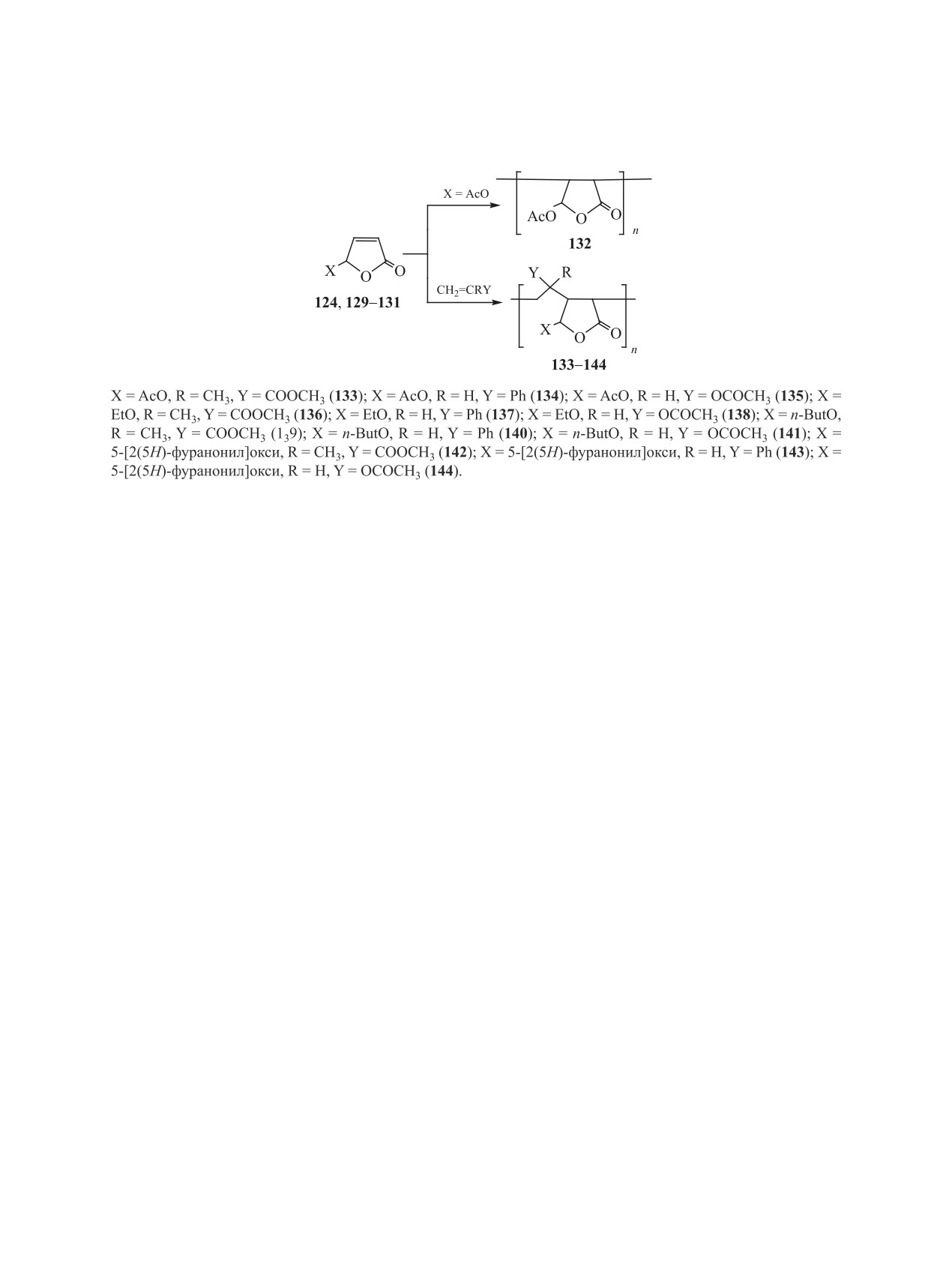
3.3. Олигомеризация. Нами впервые изучена
5-Хлор-2(5Н)-фуранон 125, известный как про-
возможность использования соединения 117 и его
тивомикробное средство, ранее получали взаимо-
производных - 5-ацетокси-, 5-этокси-, 5-буток-
действием фуранона 117 с тионилхлоридом с вы-
си-2(5Н)-фуранонов 129-131, а также 5,5′-окса-
ходом около 30% [99]. Значительное повышение
ди-2(5Н)-фуранона 124 в качестве мономеров.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
185
Схема 26.
Катионная или свободнорадикальная полиме-
соотношение реагентов 1:5, графитовые элект-
ризация фуранона 117 оказалась неэффективной
роды, LiClO4 в качестве фонового электролита,
вследствие сильного осмоления мономера. В то
50°С, 0.03 А) основным продуктом этой реакции
же время использование фуранонов 124, 129-131
является малеиновая кислота 145 с выходом 63%
с защищенной гидроксильной группой в условиях
(схема 26) [69, 106].
свободнорадикальной сополимеризации привело
4. ЗАКЛЮЧЕНИЕ
к образованию высокомолекулярных продуктов.
В качестве сомономеров использованы виниловые
Особенность строения молекулы 2(5Н)-фурано-
на придает ему специфические свойства. Наличие
соединения - метилметакрилат, стирол и вини-
сопряжения между связью С=С и сложноэфирной
лацетат. Реакции проводили в отсутствие раство-
группой, возможность образовывать сравнительно
рителя при 80-85°С при мольном соотношении
стабильные сопряженные промежуточные радика-
фуранонов 124, 129-131, винилового соединения
лы и ионы, пространственная доступность атома
и пероксида бензоила в качестве инициатора, рав-
С5 в цикле обусловливают его способность высту-
ном (1-3):1:(0.01-0.03) до максимального превра-
пать в роли СН-кислоты, специфичность его реак-
щения реагентов [104, 105] (схема 25).
ций с енаминами и определенную направленность
Соединения 132-144 представляют собой бес-
реакций присоединения по кратной связи. Как по-
цветные порошкообразные вещества с нечеткой
казано в обзоре, 2(5Н)-фуранон обладает высокой
температурой плавления в диапазоне от 115 до
активностью в реакциях комплексообразования,
200°С, их выходы составляют 28-75%. Молеку-
арилирования, радикального, нуклеофильного и
лярные массы соединений 133-144, определенные
диполярного присоединения нитронов, нитрилок-
криоскопическим методом в бензоле или 1,4-диок-
сидов и диазометана по кратной связи.
сане, находятся в пределах 1860-6460 у. е., и толь-
Одновременное наличие в молекуле 2(5Н)-фу-
ко в случае вещества 132 она значительно меньше
ранона сопряженных кратной и сложноэфирной
(594 у. е.). Количество элементарных звеньев в мо-
связей обусловливает, в зависимости от условий
лекулах этих продуктов находится в диапазоне от
и строения реагентов, несколько направлений в
7 до 42, что указывает на их олигомерную природу.
реакциях с аминами: присоединение, аминолиз,
Примечательно, что молекулярная масса соеди-
трансформация лактонного цикла в пирролидоно-
нений 132-144 растет с уменьшением используе-
вый. Это позволяет получать на основе указанных
мых в реакции количеств фуранона и инициатора,
реакций различные полифункциональные азотсо-
и их наибольший выход достигается при моль-
держащие соединения, обладающие биологиче-
ном соотношении исходных компонентов, равном
ской активностью и являющиеся основой для син-
1:1:0.03.
теза гетероциклов.
Как оказалось, при использовании стирола и
2(5Н)-Фуранон является синтоном для полу-
метилметакрилата в качестве сомономеров содер-
чения ранее не описанных или труднодоступных
жание мономерного звена фуранона в макромо-
функционально-замещенных тетрагидрофурано-
лекулах полученных олигомеров незначительно
нов, перспективных для химии реактивов и биоло-
(4-5%), тогда как в случае сополимеризации с ви-
гически активных веществ. Специфической осо-
нилацетатом оно достигает 33-60%.
бенностью 5-гидрокси-2(5Н)-фуранона является
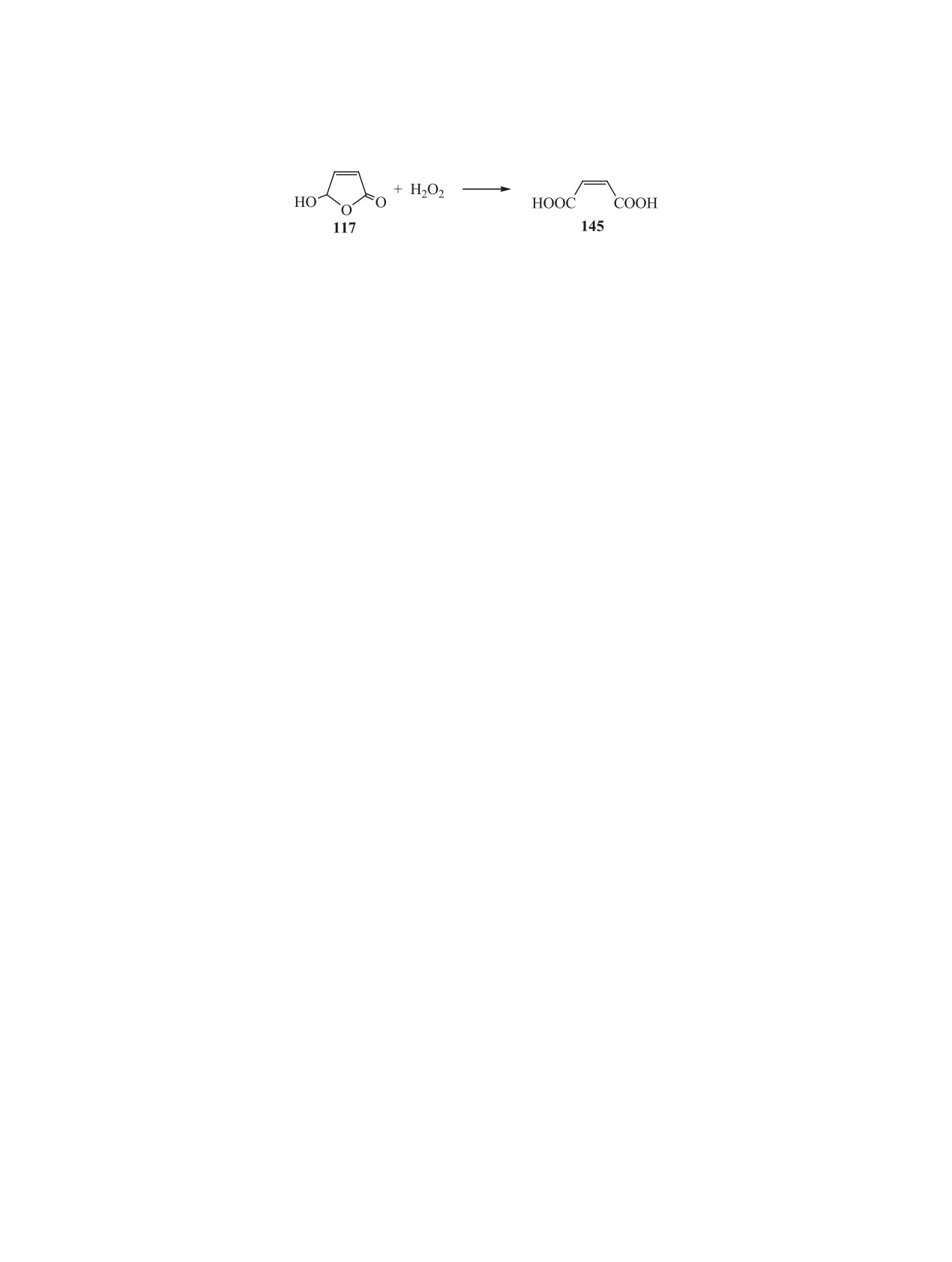
3.4. Анодное окисление. Нами впервые
его способность участвовать в кольчато-цепных
осуществлено анодное окисление
5-гидрок-
и кето-енольных таутомерных превращениях. С
си-2(5Н)-фуранона
117 пероксидом водорода.
одной стороны, это расширяет возможности его
Установлено, что в данных условиях (мольное
использования в качестве реагента по сравнению
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
186
БАДОВСКАЯ и др.
с 2(5Н)-фураноном, но с другой стороны, требует
12.
Murzin D.Yu., Bertrand E., Tolvanen P., Devyatkov S.,
Wärnå J.J., Salmi T. // Ind. Eng. Chem. Res. 2020.
тщательного подбора условий для направленного
Vol. 59. P. 13516. doi 10.1007/978-3-642-28418-2_6
синтеза целевых продуктов. Синтезы функцио-
13.
Zvarych V., Nakonechna A., Marchenko M., Khudyi O.,
нально-замещенных гидрофуранонов на основе
Lubenets V., Khuda L., Kushniryk O., Novikov V. // J.
2(5Н)-фуранона и
5-гидрокси-2(5Н)-фуранона
Agric. Food Chem. 2019. Vol. 67. P. 3114. doi 10.1021/
открывают путь к широкой доступности этих со-
acs.jafc.8b06284
единений и их использованию в органическом
14.
Ausmeel S., Andersen C., Nielsen O.J. // J. Phys.
синтезе, в том числе при получении олигомерных
Chem. (A). 2017. Vol. 121. P. 4123. doi 10.1021/acs.
веществ.
jpca.7b02325
15.
Пономаренко Р.И., Бадовская Л.А., Латашко В.М. //
КОНФЛИКТ ИНТЕРЕСОВ
ХГС. 2002. T. 28. C. 1204; Ponomarenko R.I.,
Badovskaya L.A., Latashko V.M. // Chem. Heterocycl.
Авторы заявляют об отсутствии конфликта
Compd.
2002. Vol.
38. P.
1049. doi
интересов.
10.1023/A:1021240828432
СПИСОК ЛИТЕРАТУРЫ
16.
Бадовская Л.А., Посконин В.В., Пономаренко Р.И. //
ЖОХ. 2014. Т. 84. С. 952; Badovskaya L.A., Poskonin
1. Knight D.W. // Contemp. Org. Synth. 1994. Vol. 1. N 4.
V.V., Ponomarenko R.I. // Russ. J. Gen. Chem. 2014.
P. 287. doi 10.1039/co9940100287
Vol. 84. P. 1133. doi 10.1134/S1070363214060140
2. Villamizar-Mogotocoro A.-F., León-Rojas A.-F., Urbina-
17.
Бадовская Л.А., Посконин В.В. // ЖОХ. 2018. Т. 88.
González J.-M. // Mini-Rev. Org. Chem. 2020. Vol. 17.
С. 1245; Badovskaya L.A., Poskonin V.V. // Russ.
P. 1. doi 10.2174/1570193X17666200220130735
J. Gen. Chem. 2018. Vol. 88. P. 1568. doi 10.1134/
3. Rao V.S. // Chem. Rev. 1976. Vol. 76. P. 625. doi
S1070363218080030
10.1021/cr60303a004
18.
Krull I.S., Arnold D.R. // Tetrahedron Lett. 1969. Vol.
4. Аветисян А.А., Дангян М.Т. // Усп. хим. 1977. Т.
10. N 16. P. 1247. doi 10.1016/S0040-4039(01)87854-0
46. С. 1250; Avetisyan A.A., Dangyan M.T. // Russ.
19.
Miranda M.A., Fillol L., Morera I.M., Sheikh H. //
Chem. Rev. 1977. Vol. 46. P. 643. doi 10.1070/
Heterocycles. 1990. Vol. 31. Р. 751. doi 10.3987/REV-
RC1977v046n07ABEH002162
89-411
5. Hashem A., Kleinpeter E. // Adv. Heterocycl.
20.
Музыченко Г.Ф., Глуховцев В.Г., Бадовская Л.А., Ко-
Chem. 2001. Vol. 81. P. 107. doi 10.1016/S0065-
жина Н.Д., Игнатенко А.В., Кульневич В.Г., Кравчен-
2725(01)81011-4
ко О.Б., Никишин Г.И. // ЖОрХ. 1981. Т. 17. С. 481.
6. Kumar S., Garg R., Kabra A. // WJPRT Chandigarh
21.
Бадовская Л.А., Посконин В.В., Тюхтенева З.И., Со-
Univ. 2013. Vol. 1. P. 83.
роцкая Л.Н., Кожина Н.Д. // Тезисы докл. III Меж-
7. Кульневич В.Г., Бадовская Л.А., Латашко В.М., Му-
дунар. научн. конф. «Новые направления в химии
зыченко Г.Ф., Абрамянц С.В. А. с. 470516 СССР
гетероциклических соединений», Пятигорск, 2013.
(1975) // Б. И. 1975. № 18.
C. 100.
8. Ruzhen C., Chong L., Lunzu L. // Prep. Proced. Int.
22.
Музыченко Г.Ф., Кожина Н.Д., Глуховцев В.Г., Куль-
1996. N 2. P. 215. doi 10.1080/00304949609356524
невич В.Г., Никишин Г.И., Игнатенко А.В., Бадов-
9. Бадовская Л.А., Латашко В.М., Посконин В.В., Грун-
ская Л.А. А. с. 806683 СССР (1981) // Б. И. 1981.
ская Е.П., Тюхтенева З.И., Рудакова С.П., Пестуно-
№ 7.
ва С.А., Саркисян А.В. // ХГС. 2002. C. 1194;
23.
Музыченко Г.Ф., Бадовская Л.А., Кожина Н.Д.,
Badovskaya L.A., Latashko V.M., Poskonin V.V.,
Глуховцев В.Г., Игнатенко А.В. А. с. 929640 СССР
Grunskaya E.P., Tyukhteneva Z.I., Rudakova S.P.,
(1982) // Б. И. 1982. № 19.
Pestunova S.A., Sarkisyan A.V. // Chem. Heterocycl.
24.
Бадовская Л.А., Челлар Н.С. А. с. 924042 СССР
Compd.
2002. Vol.
38. P.
1040. doi
(1982) // Б. И. 1982. № 16.
10.1023/A:1021288711593
25.
Челлар Н.С., Бадовская Л.А., Игнатенко А.В. //
10. Бадовская Л.А., Посконин В.В., Поварова Л.А. // Изв.
ЖОрХ. 1984. Т. 20. С. 1944.
АН. Сер. хим. 2017. P. 593; Badovskaya L.A., Posko-
26.
Rathke M.W. In: Organic reactions / Ed.: R. Adams.
nin V.V., Povarova L.A. // Russ. Chem. Bull. 2017.
New York; London: J. Wiley & Sons, 1975. Vol. 22.
Vol. 66. P. 593. doi 10.1007/s11172-017-1778-8
P. 458.
11. Бадовская Л.А., Посконин В.В. Каталитические го-
27.
Nguen B.N., Hii K.K., Shimanski W., Janssen D.B. //
могенные реакции фурановых альдегидов с перок-
Science of Synthesis: Stereoselective Synthesis. 2011.
сидом водорода и синтезы функциональных произ-
Vol. 1. P. 679.
водных фурана на их основе. Краснодар: КубГТУ,
28.
Delvos L.B, Oestreich M. // Science of Synthesis:
2019. 127 с.
Stereoselective Synthesis. 2017. Vol. 1. P. 122.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
187
29.
Sohtome Y., Tanatani A., Hashimoto Y., Nagasawa K. //
Kulnevich V.G. // Chem. Heterocycl. Compd. 1977.
Chem. Pharm. Bull. 2004. Vol. 52. P. 477. doi 10.1002/
Vol. 13. P. 1283. doi 10.1007/BF00469882
chin.200437109
49.
Fisera L., Kozhina N.D., Badovskaya L.A., Stibranyi L. //
30.
Inokuma T., Takemoto Y. // Science of Synthesis:
Chem. Pap. 1986. Vol. 40. P. 685.
Asymmetric Organocatalysis. 2012. Vol. 2. P. 451.
50.
Тюхтенева З.И., Бадовская Л.А., Косулина Т.П., Куль-
31.
Trost B.M., Hitce J. // Synfacts. 2009. Vol. 7. P. 0747.
невич В.Г. // ЖОрХ. 1991. Т. 27. С. 1709.
doi 10.1055/s-00000131
51.
Кожина Н.Д., Бадовская Л.А., Фишера Л., Штибра-
32.
Lopes D.T., Hoye T.R., Alvarenga E.S. // Magn. Reson.
ни Л. // ЖОрХ. 1994. Т. 30. С. 1006.
Chem. 2020. Vol. 310. P. 655. doi 10.1002/mrc.5073
52.
Тюхтенева З.И., Бадовская Л.А. // ЖОрХ. 2002.
33.
Найденов Ю.В., Бадовская Л.А., Игнатенко А.В. //
Т. 38. С. 1085; Tyukhteneva Z.I., Badovskaya L.A. //
ЖОрХ. 1982. Т. 18. С. 1200.
Russ. J. Org. Chem. 2002. Vol. 38. P. 1042. doi
34.
Найденов Ю.В., Бадовская Л.А., Дедова М.А. А. с.
10.1023/A:1020818116077
1077890 СССР (1984) // Б. И. 1984. № 9.
53.
Конг Х.Х., Сибгатуллина Р.Р., Хабибрахманова A. M.,
35.
Найденов Ю.В., Бадовская Л.А., Беленький Л.И.,
Зиганшина Л.Е. // Казан. мед. ж. 2017. Т. 98. С. 211.
Стручков Ю.Т., Лозовский Л.А., Чернега А.Н., Ан-
doi 10.17750/KMJ2017-211
типин М.Ю. // ЖОрХ. 1991. Т. 27. С. 1715.
54.
Sharafutdinov I., Pavlova A., Khabibrakhmanova A.M.,
36.
Stork G., Brizzolara A., Landesman H., Smuskowicz J. //
Kayumov A.R. // Abstr. 42nd FEBS Congress, Jerusalem,
J. Am. Chem. Soc. 1963. Vol. 85. P. 207. doi 10.1021/
Israel, 2017. Vol. 284. S. 1.
ja077679s
55.
Ordonez M., Borikar S.P., Paul V., Rivera S.L. //
37.
Сороцкая Л.Н., Бадовская Л.А., Каклюгина Т.Я.,
Synthesis. 2011. Vol. 10. P. 1595. doi 10.1055/s-0030-
Беленький Л.И., Игнатенко А.В., Крутошихова А.В.,
1260004
Паниева Л.А. // ЖОрХ. 1989. Т. 25. С. 175.
56.
Lattmann E., Dunn S., Niamsanit S., Sattayasai N. //
38.
Тюхтенева З.И., Бадовская Л.А., Козловская И.Н.,
ChemInform. 2005. Vol. 36. P. 25. doi 10.1002/
Музыченко Г.Ф. // ХГС. 1985. С. 1629; Tyukhtene-
chin.200525106
va Z.I., Badovskaya L.A., Kozlovskaya I.N., Muzichen-
57.
Козьминых В.А., Буканова Е.В., Беляев Е.В.,
ko G.F. // Chem. Heterocycl. Compd. 1985. Vol. 21.
Козьминых Е.Н. // ХГС. Т. 39. 2003. С. 1255;
P. 1339. doi 10.1007/BF00842956
Kozminykh V., Bukanova E.V., Belyaev A.O., Kozmi-
39.
Тлехусеж М.А., Бадовская Л.А., Тюхтенева З.И. //
nykh E.N. // Chem. Heterocycl. Compd. 2003. Vol. 39.
ХГС. 1996. С. 711; Tlekhusezh M.A., Badovskaya L.A.,
P. 1255. doi 10.1023/B:COHC.0000008276.09983.6d.
Tyukhteneva Z.I. // Chem. Heterocycl. Compd. 1996.
58.
WangX., Li J., Wang G., Tian Z. // Chem. Res. Chin.
Vol. 32. P. 613. doi 10.1007/BF01164796
Univ. 2019. Vol. 35. P. 5. doi 10.1007/s40242-019-
40.
Посконин В.В., Бадовская Л.А., Сороцкая Л.Н., По-
9122-5
варова Л.В., Дедикова Т.Г., Тлехусеж М.А., Кожи-
59.
Голованов A.A., Oдин И.С., Злотский С.С. // Усп.
на Н.Д., Митрофанова С.П. // Тезисы докл. Меж-
хим. 2019. C. 280; Golovanov A.A., Odin I.S., Zlots-
дунар. конгр. по химии гетероцикл. соед., посвящ.
kiy S.S. // Russ. Chem. Rev. 2019. Vol. 88. P. 280. doi
100-летию проф. А. Коста, МГУ, 2015. С. 162.
10.1070/RCR4808
41.
Sbai A., Branchadell V., Oliva A. // J. Org. Chem. 1996.
60.
Kang K.H., Cha M.Y., Pae A.N., Chung B.Y. //
Vol. 61. P. 421. doi 10.1021/jo950541k
Tetrahedron Lett. 2000. Vol. 41. P. 8137. doi 10.1016/
42.
Otto F., Dötz K.H. // Synthesis. 2008. Vol. 14. P. 2183.
S0040-4039(00)01435-0
doi 10.1055/s-2008-1067151
61.
Латыпова Л.З., Чмутова Г.А., Курбангалиева А.Р.,
43.
Tufariello J.J., Tette J.P. // J. Org. Chem. 1975. Vol. 40.
Янилкин В.В. // Изв. АН. Сер. хим. 2019. C. 313;
P. 3866. doi 10.1021/acs.joc.0c00510
Latypova L.Z., Chmutova G.A., Kurbangalieva A.R.,
44.
Benz A., Cardona F., Goti A. // Synlett. 2011. Vol. 2.
Yanilkin V.V. // Russ. Chem. Bull. 2019. Vol. 68. P. 313.
P. 231. doi 10.1055/s-0040-1706475
doi 10.1007/s11172-019-2387-5
45.
Cid P., de March P., Figueredo M., Font J., Milan S. //
62.
Федосеев С.В., Беликов М.И. // ХГС. 2018. С. 759;
Tetrahedron Lett. 1992. Vol. 33. P. 667. doi 10.1016/
Fedoseev S.V., Belikov M.Y. // Chem. Heterocycl.
S0040-4039(00)92338-4
Compd. 2018. Vol. 54. P. 8. doi 10.1007/s10593-018-
46.
Pelletier S.W., Djarmati Z., Lajsic S.D., Yang D.T.C. //
2345-4
Tetrahedron. 1975. Vol. 31. P. 1659. doi 10.1016/0040-
63.
Tu Y., Frohn M., Wang Z.-X., Shi Y. // Org. Synth. 2003.
4020(75)85083-6
Vol. 80. P. 1. doi 10.15227/orgsyn.080.0001.
47.
Павленко З.И., Бадовская Л.А., Торочешников В.Н.,
64.
Gollnick K., Griesbeck A. // Tetrahedron. 1985. Vol. 41.
Кульневич В.Г. // ЖОрХ. 1981. Т. 17. С. 1093.
P. 2057. doi 10.1007/978-1-4613-0709-9_9
48.
Павленко З.И., Бадовская Л.А., Кульневич В.Г. //
65.
Кисленко В.Н., Берлин А.А. // Усп. хим. 1991.
ХГС. 1977. С. 1610; Pavlenko Z.I., Badovskaya L.A.,
Т. 60. С. 949; Kislenko V.N., Berlin A.A. // Russ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
188
БАДОВСКАЯ и др.
Chem. Rev. 1991. Vol. 60. P. 470. doi 10.1070/
87.
Wiesner K., Tsai Y.R., Kumar R., Sivaramakrishnan H. //
RC1991v060n05ABEH001089
Helv. Chem. Acta. 1984. Vol. 67. P. 1128. doi 10.1002/
66.
Yadav J.S., Valluri M., Rama Rao A.V. // Tetrahedron
hlca.19840670427
Lett. 1994. Vol. 35. P. 3609. doi 10.1016/S0040-
88.
Yuste F., Sanchez-Obregón R. // J. Org. Chem. 1982.
4039(00)73254-0
Vol. 47. N 19. doi 10.1021/jo00140a015
67.
Wu H., Song J., Liu H., Han B. // Chem. Sci. 2019.
Vol. 10. P. 4692. doi 10.1039/c9sc00322c
89.
Kang H., Bai J., Xi Z., Zou D. // Chinese J. Org. Chem.
68.
Tanaka H., Kobayasi Y., Torii S. // J. Org. Chem. 1976.
2016. Vol. 36. P. 1915. doi 10.6023/cjoc201601040
Vol. 41. P. 3482. doi 10.1021/jo00883a039
90.
Van der Deen A. H., Robert P., Kellogg R.M. // Tet-
69.
Badovskaya L.A., Poskonin V.V., Povarova L.V. In:
rahedron Lett. 1998. Vol. 35. doi 10.1016/S0040-
Furan: Chemistry, Synthesis and Safety / Ed. I. Bailey.
4039(00)74428-5
New York: Nova Science Publishers, 2019. P. 1.
91.
Van der Deen А. H., Van Oeveren A., Kellogg R.M.,
70.
Oravec P., Fišera L., Gažo R. // Monatsh. Chem. 1991.
Feringa B.L. // Tetrahedron Lett. 1999. Vol. 40.
Vol. 122. P. 165. doi 10.1007/BF00809361
P. 1755. doi 10.1016/S0040-4039(98)02683-5
71.
Keller E., de Feringa B. // Tetrahedron. 1993. Vol. 49.
92.
Андреев В.М., Кугатова-Шемякина Г.П., Каза-
P. 39. doi 10.1016/S0040-4020(01)81909-8
рян С.А. // Усп. хим. 1968. Т. 37. С. 559; Andre-
72.
Farina F., Martin M.R., Martin M.V., de Guerenu A.M. //
ev V.M., Kugatova-Shemyakina G.P., Kazaryan S.A. //
Heterocycles. 1994. Vol. 38. P. 1307. doi 10.3987/com-
Russ. Chem. Rev. 1968. Vol. 37. P. 254. doi 10.1070/
19-s(f)26
RC1968v037n04ABEH001632.
73.
Fišera L., Oravec P. // Collect. Czechoslovak Chem.
93.
Валтер Р.Э. // Усп. хим. 1973. Т. 42. С. 1060;
Commun. 1987. Vol. 52. P. 1315. doi 10.1135/
Valter R.E. // Russ. Chem. Rev. 1973. Vol. 42. P. 464.
cccc19871315
doi 10.1070/RC1973v042n06ABEH002641
74.
de Lange B., Feringa B.L. // Tetrahedron Lett. 1988.
94.
Стрижов Н.К., Посконин В.В., Бадовская Л.А.,
Vol. 29. P. 5317. doi 10.1016/S0040-4039(00)80747-9
Купина Е.П. // ЖОрХ. 2002. Т. 38. С. 273; Stri-
75.
Bertrand S., Hoffmann N., Pete J.-P. // Tetrahedron.
zhov N.K., Poskonin V.V., Badovskaya L.A., Kupi-
1997. Vol. 54. P. 4873. doi 10.1016/S0040-
na E.P. // Russ. J. Org. Chem. 2002. Vol. 38. P. 251.
4020(98)00171-9
doi 10.1023/A:1015578003374
76.
Keller E., de Lange B., Rispens M.T., Feringa B.L. //
95.
Посконин В.В., Бадовская Л.А. // ХГС. 2003. С. 688;
ChemInform. 2010. Vol. 25. P. 2. doi 10.1002/
Poskonin V.V., Badovskaya L.A. // Chem. Heterocycl.
chin.199402068
Compd. 2003. Vol. 39. P. 594. doi 10.1023/
77.
de Jong J.C., van Bolhuis F., Feringa B.L. // Tetrahedron
A:1025137914137
Asym. 1991. Vol. 2. P. 247. doi 10.1016/S0957-
96.
Посконин В.В., Бадовская Л.А., Бутин А.В. //
4166(00)80024-5
ЖОрХ. 1997. Т. 33. С. 574.
78.
Feringa L.B., de Lange B., Kok J., Faber W.S. //
97.
Schroeter S., Appel R., Brammer R., Schenk G.O. //
Tetrahedron. 1994. Vol. 50. P. 4775. doi 10.1016/S0040-
Lieb. Ann. Chem. 1966. Vol. 697. P. 42. doi 10.1002/
4020(03)00461-7
jlac.19666970104
79.
Bos M., Buttard F., Valee A., Riquet E. // Synthesis.
98.
Kuo Y.-H., Kuo P.-C. // Chem. Express. 1987. Vol. 2.
2019. Vol. 51. P. 3151. doi 10.1055/s-00000084
P. 471.
80.
Doerr I.L., Willete R.E. // J. Org. Chem. 1973. Vol. 38.
99.
Заявка 2538771 ФРГ (1978) // РЖХим. 1978. 5 О
P. 3878. doi 10.1021/jo00962a014
392П.
81.
Gassama A., Ernenwein C., Hoffmann N. / /
100.
Kubota Y., Tatsuro T. // Chem. Pharm. Bull. 1971. Vol. 19.
ChemSusChem. 2009. Vol. 2. P. 1130. doi 10.1002/
P. 1226. doi 10.1248/cpb.19.1226
cssc.201300378
82.
Smith L.H.S., Coote S.C., Procter D.J. // Science of
101.
White E.P. // J. Chem. Soc. 1967. P. 346.
Synthesis Knowledge Updates. 2010. Vol. 3. P. 490.
102.
Gratz J.A., Cook C.E., Wall M.E. // Org. Prep. Proc. Int.
83.
Van Heck R., Crockatt M., Urbanus J., Latsuzbaia R.
1970. Vol. 2. P. 51. doi 10.1080/00304947009458418
Pat. WO 2020/130832 A1 (2020).
103.
Burkhardt H.J., Lundin R.E., McFadden W.H. // Tet-
84.
Yamamoto M., Izukawa H., Saiki M., Yamada K. // J.
rahedron. 1968. Vol. 24. P. 1225. doi 10.1016/0040-
Chem. Soc. Chem. Commun. 1988. P. 560. doi 10.1039/
4020(68)88071-8
C39880000560
104.
Посконин В.В., Бадовская Л.А., Серединов М.В.,
85.
Farina F., Parellada M.D. // J. Org. Chem. 1988.
Ковардаков В.А. // ЖОрХ. 1997. Т. 33. С. 579.
Vol. 53. P. 3330. doi 10.1021/jo00249a037
105.
Посконин В.В., Яковлев Д.Н., Ковардаков В.А.,
86.
Farina F., Martin M.V., Martin-Aranda R.M., de
Бадовская Л.А. // ЖОрХ. 1999. Т. 35. С. 744.
Guerenu A.M. // Synth. Commun. 1993. Vol. 23. P. 459.
106.
Посконин В.В., Яковлев М.М. // Бутлеровск. сообщ.
doi 10.1002/chin.199414155
2018. Т. 54. С. 56.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
2(5Н)-ФУР
АНОН И 5-ГИДРОКСИ-2(5Н)-ФУРАНОН
189
2(5H)-Furanone and 5-Hydroxy-2(5H)-furanone:
Reactions and Syntheses Based on Them
L. A. Badovskaya, V. V. Poskonin*, Z. I. Tyukhteneva, and N. D. Kozhina
Kuban State Technological University, Krasnodar, 350072 Russia
*e-mail: vposkonin@mail.ru
Received October 4, 2020; revised December 3, 2020; accepted December 10, 2020
The review presents the results of studies of poorly studied or unexplored reactions of 2(5H)-furanone,
5-hydroxy-2(5H)-furanone, some other substituted hydrofuranones and the conditions for synthesizing func-
tionally substituted hydrofuranones on their basis, promising for organic synthesis and chemistry of biologically
active compounds.
Keywords: oxidation, complexation, addition, isomerization, enamines, substitution
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021