ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 190-204
УДК 547.461.3:547.824:547.825:547.831.3:547.876
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
НОВЫХ ГЕТЕРОЦИКЛИЧЕСКИХ ПРОИЗВОДНЫХ
ЦИАНОТИОАЦЕТАМИДА
© 2021 г. И. В. Бибикa, Е. Ю. Бибикb, В. В. Доценкоb,c,*, К. А. Фроловb, С. Г. Кривоколыскоb,
Н. А. Аксеновc, И. В. Аксеноваc, С. В. Щербаковc, С. Н. Овчаровc
a Белгородский государственный национальный исследовательский университет, Белгород, 308015 Россия
b Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
*е-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 16 декабря 2020 г.
После доработки 16 декабря 2020 г.
Принято к печати 28 декабря 2020 г.
Взаимодействием цианотиоацетамида с ароматическими альдегидами и 1,3-дикарбонильными соеди-
нениями с последующим аминометилированием либо S-алкилированием получена серия гетероцикли-
ческих производных производных с фрагментом 1,2,3,4-тетрагидропиридина или 1,4,5,6,7,8-гексагид-
рохинолина. Полученные соединения были исследованы на наличие анальгетической активности in
vivo. Обнаружены соединения, показавшие антиноцицептивное действие, превосходящее таковое для
кеторолака в динамике.
Ключевые слова: цианотиоацетамид, реакция Манниха, пиридо[2,1-b][1,3,5]тиадиазины, 2-оксо-3-циано-
1,4,5,6-тетрагидропиридин-2-тиолаты, анальгетики
DOI: 10.31857/S0044460X21020025
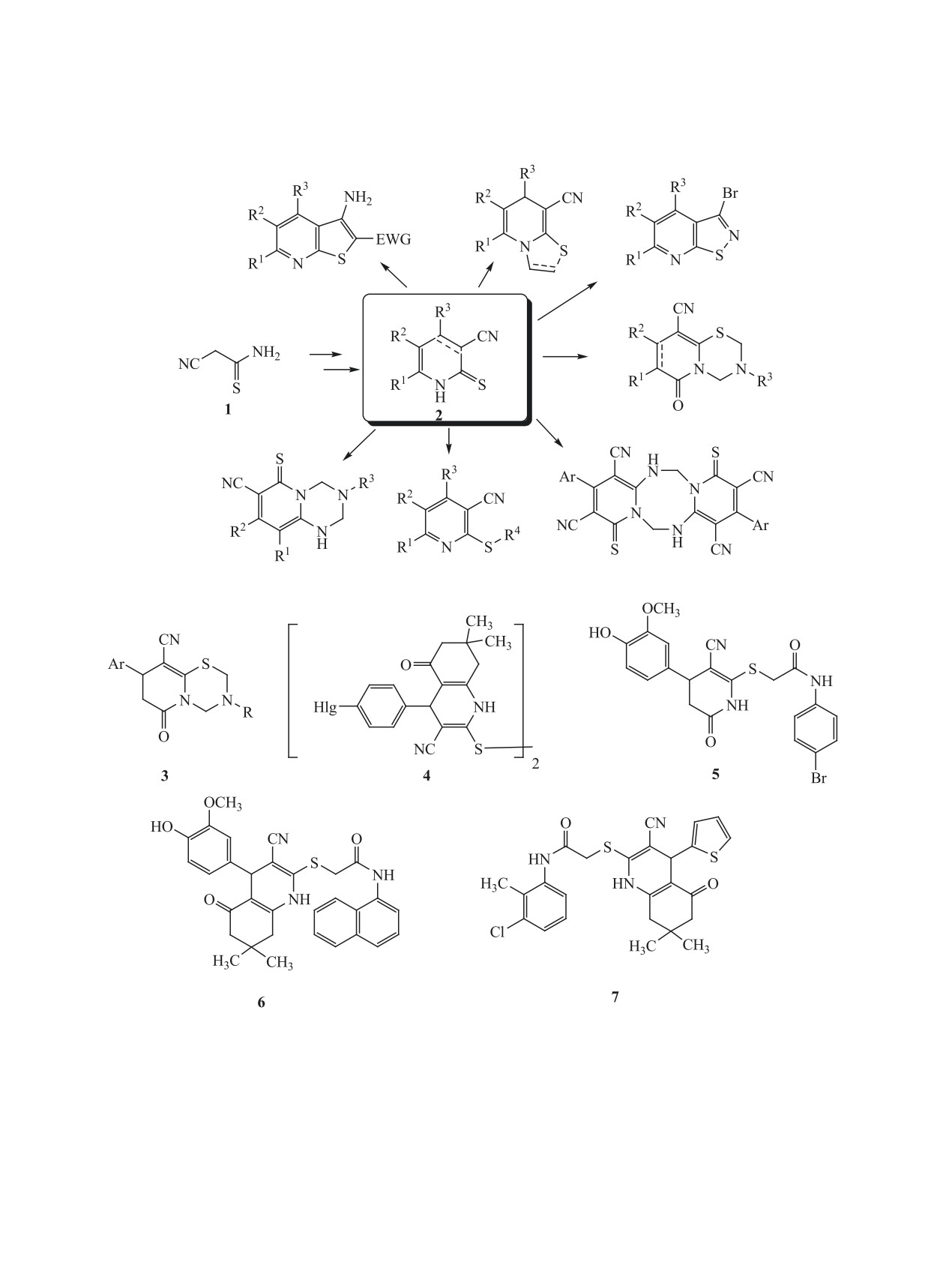
Цианотиоацетамид 1 является легкодоступным
ства. В частности, производные пиридо[2,1-b]-
и полифункциональным реагентом, широко ис-
[1,3,5]тиадиазина с общей структурой 3 (схема 2)
пользуемым в синтетической органической химии
обладают высокой активностью в отношении ви-
[1-4]. Одним из основных направлений использо-
руса клещевого энцефалита и вируса Повассан
вания тиоамида 1 является получение широкого
[41], обнаруживают выраженный противовоспа-
круга S,N-гетероциклических соединений, к важ-
лительный эффект [42], аналептический эффект
нейшим из которых следует отнести 3-цианопири-
[43], адаптогенное действие [44]. Дисульфиды
дин-2(1Н)-тионы 2 [5-11] (схема 1). Соединения
4 (Hlg = F, Br) обладают умеренной анти-ВИЧ-
2 являются удобной платформой для получения
активностью [45], соединения 5 и 6 являются ин-
широкого круга соединений ряда тиено[2,3-b]пи-
гибиторами аутотаксина [46], гексагидрохинолин
ридина [12-20], тиазоло[3,2-а]пиридина [21-29],
7 обнаруживает свойства ингибитора образования
пиридо[2,1-b][1,3,5]тиадиазина [30-34], дипири-
бета-амилоидного пептида [47], считающегося од-
до[1,2-а:1’2’-е][1,3,5,7]тетразоцина
[35], пири-
ним из основных факторов развития болезни Аль-
до[1,2-а][1,3,5]триазина [36], изотиазоло[5,4-b]пи-
цгеймера.
ридина [37-40] и других би- и полициклических
Широкий спектр биологической активности,
структур.
обнаруживаемый частично насыщенными произ-
Многие из полученных таким образом соеди-
водными никотинонитрила, легко доступными из
нений обнаруживают практически важные свой-
α-цианотиоацетамида, стимулирует дальнейшие
190
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
191
Схема 1.
Схема 2.
исследования в области поиска новых биологиче-
Выбор производных цианотиоацетамида для ис-
ски активных субстанций в данном ряду.
следований осуществлялся путем оценки in silico
Целью данной работы являлся синтез новых
параметров биодоступности и потенциальных ми-
структурных аналогов соединений 3-7 и изучение
шеней с использованием открытых программных
их анальгетической активности in vivo (крысы).
пакетов OSIRIS Property Explorer [48], SwissAD-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
192
БИБИК и др.
Схема 3.
ME [49], SwissTargetPrediction [50], Molinspiration
сокими выходами к целевым пиридо[2,1-b][1,3,5]-
Property Calculation Service [51] и admetSAR [52].
тиадиазинам 8а-в.
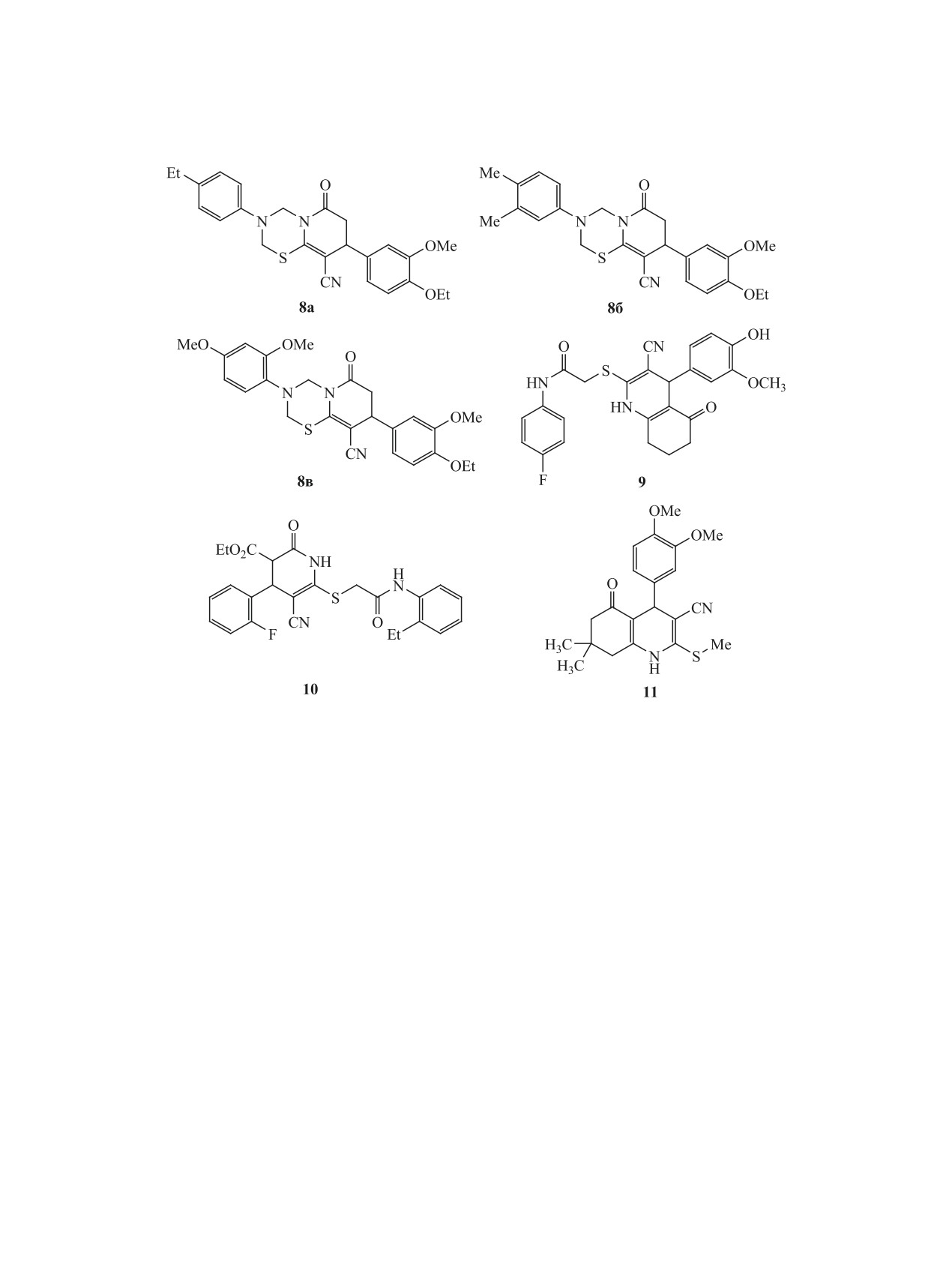
Так, из небольшой (250+ соединений) библиотеки
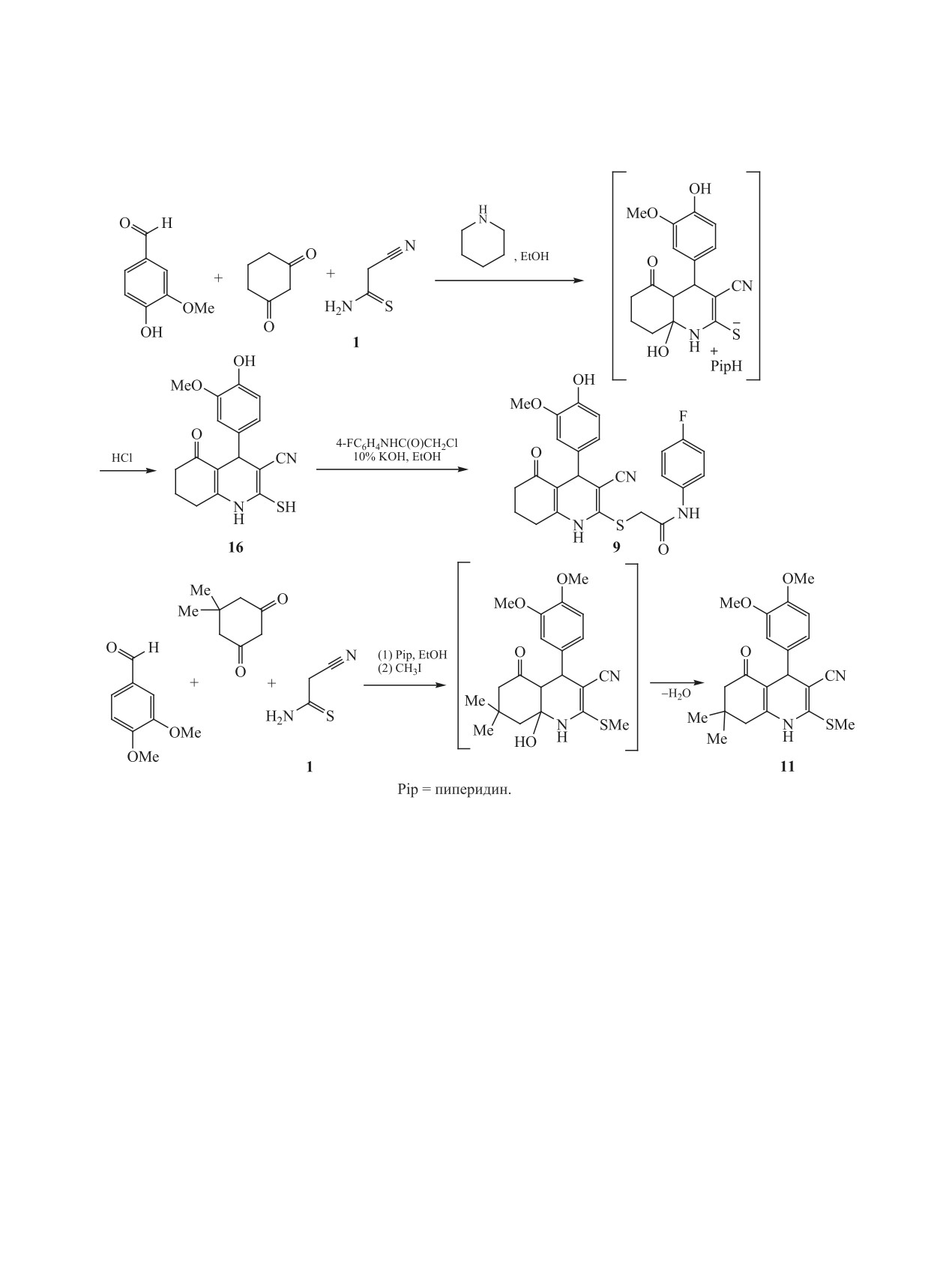
Соединение 9 было синтезировано из цианоти-
структурных аналогов соединений 3-7 нами было
оацетамида 1, циклогексан-1,3-диона и ванилина
отобрано 6 новых соединений - пиридо[2,1-b]-
в три стадии по аналогии с известной методикой,
[1,3,5]тиадиазины 8а-в, α-(гетарилтио)ацетанили-
с промежуточным выделением меркаптохинолина
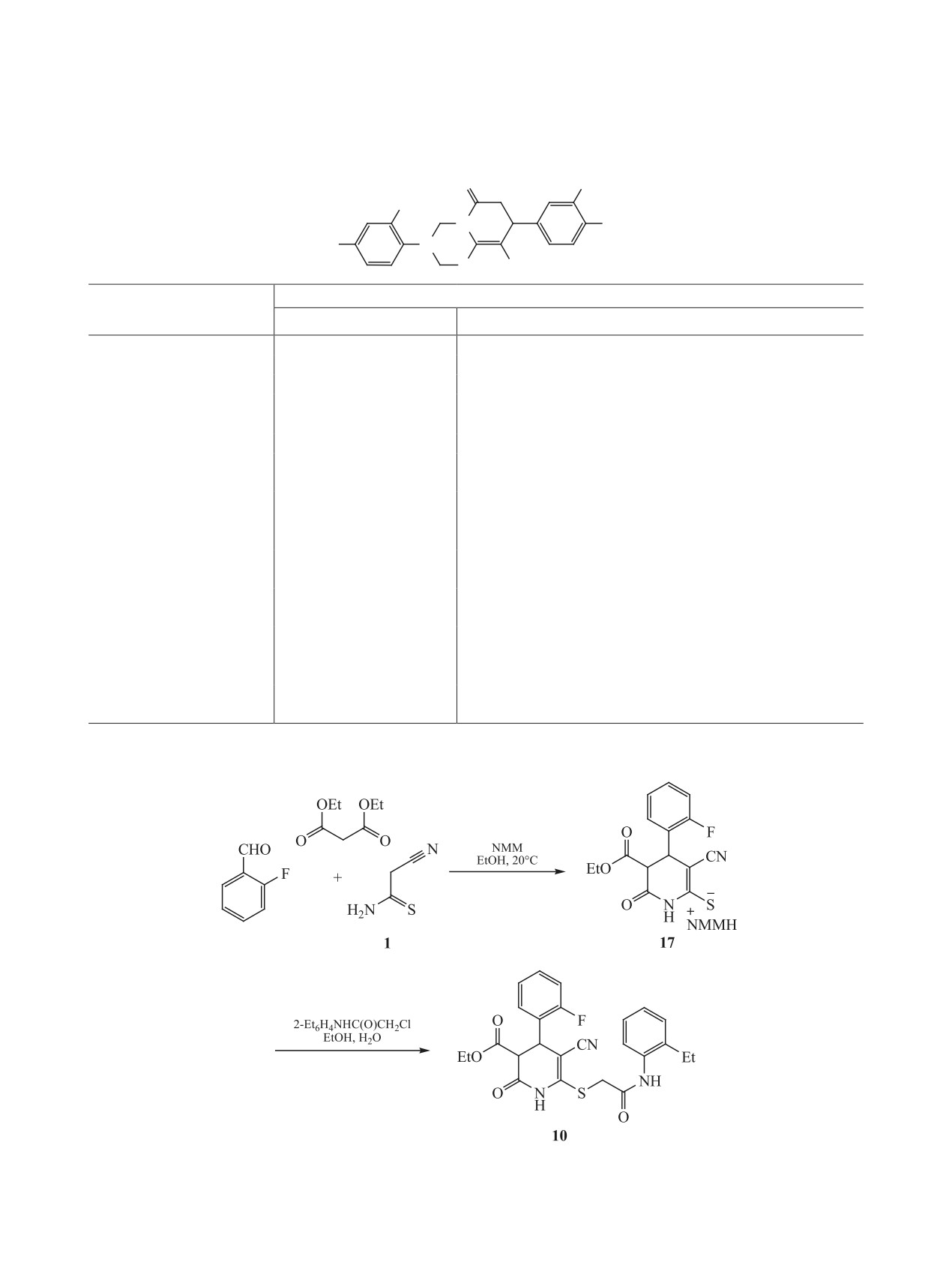
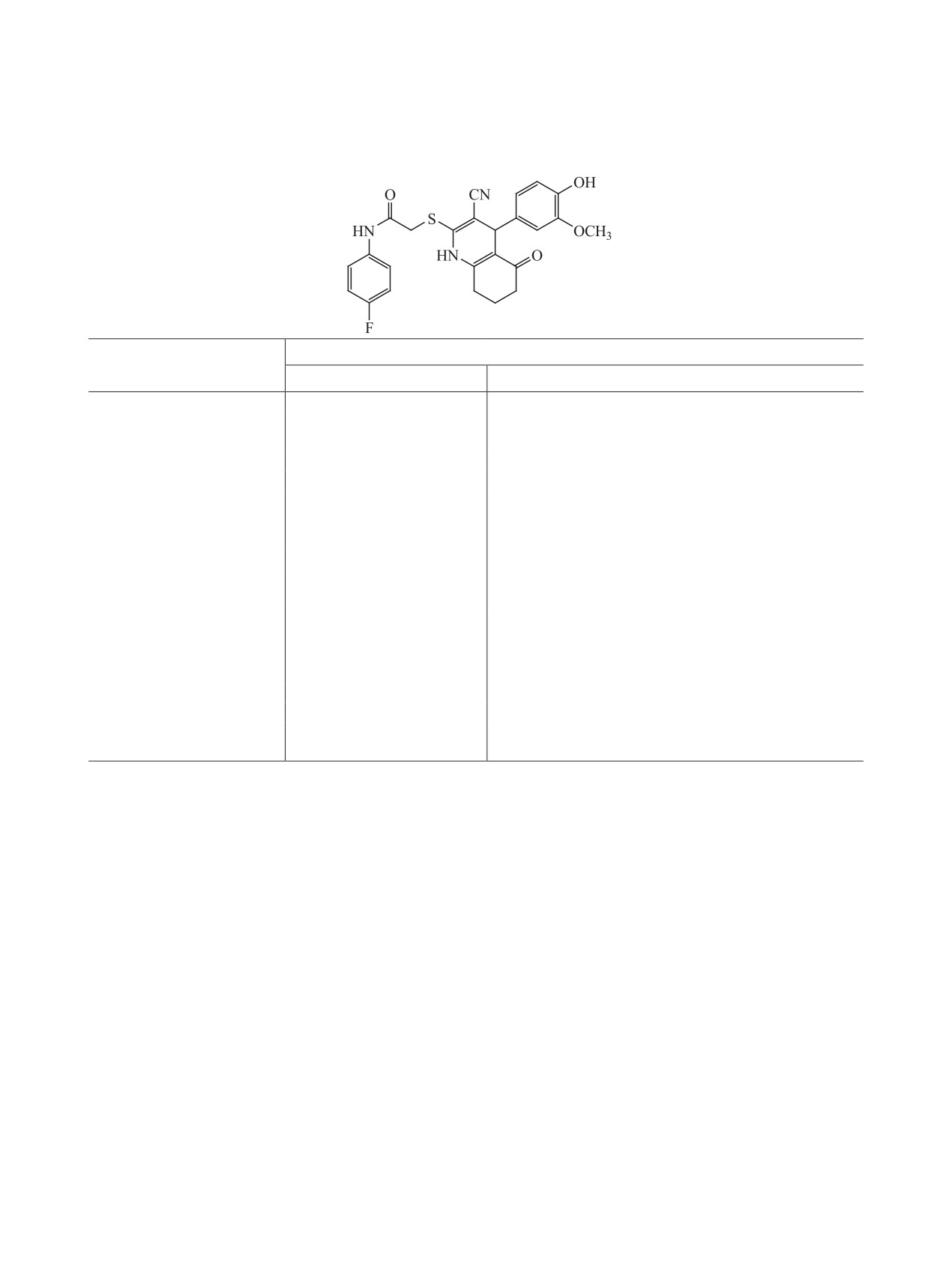
ды 9 и 10, гексагидрохинолин 11 (схема 3).
16 [53] (схема 5). Гексагидрохинолин 11 был полу-
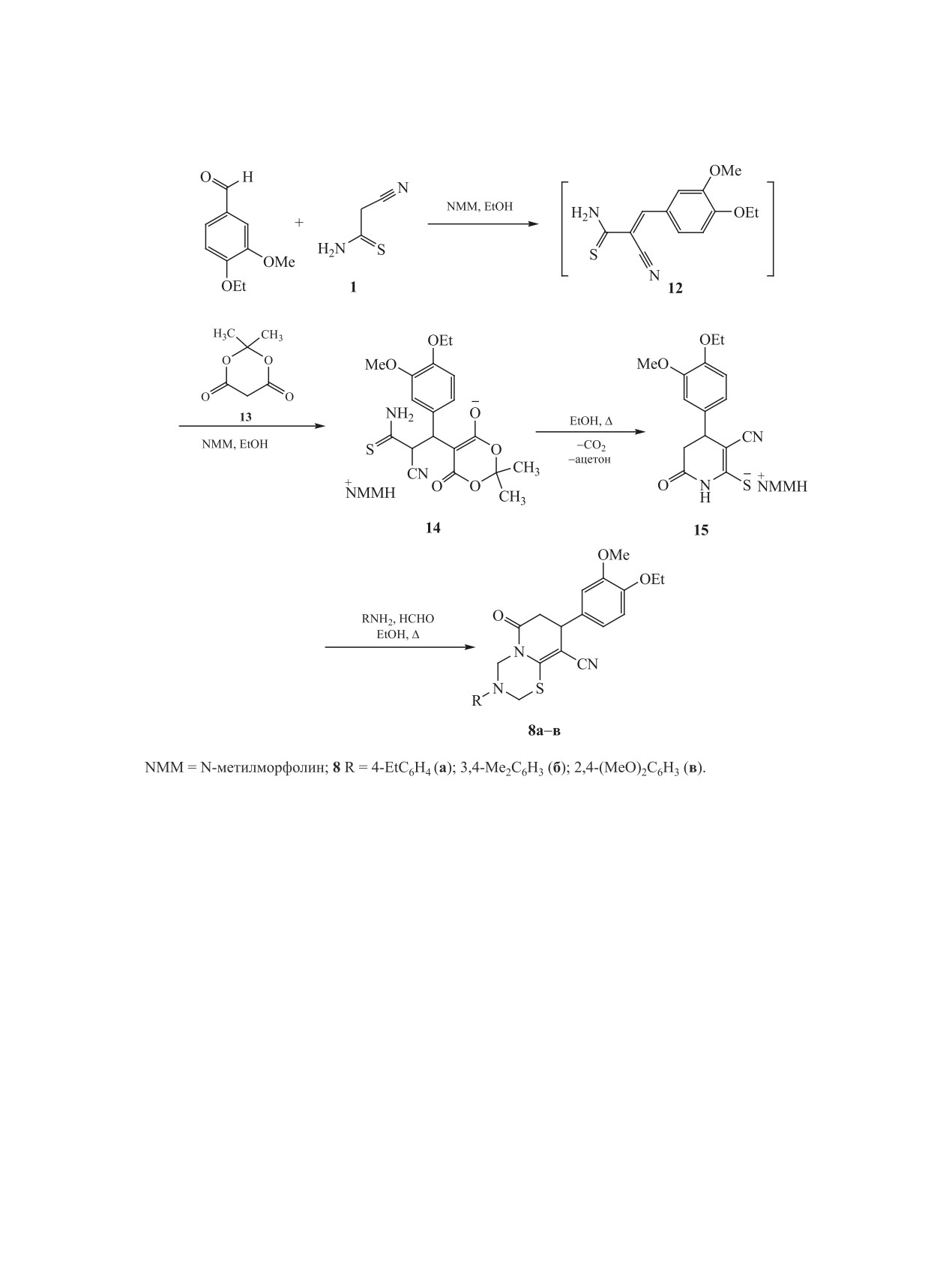
Синтез соединений 8-11 представлен на схемах
чен по модифицированному способу, описанному
4-6. Так, структурные аналоги соединений 3, пи-
в работе [54]. Наконец, тетрагидропиридин 10 был
ридо[2,1-b][1,3,5]тиадиазины 8а-в (схема 4) были
синтезирован по аналогии с методом, представ-
синтезированы в 4 стадии, исходя из цианотиоа-
ленным в работах [55, 56] (схема 6).
цетамида 1. Реакцией тиоамида 1 с 3-метокси-4-
Соединения 8а-в, 9-11 представляют собой
этоксибензальдегидом был получен тиоакриламид
мелкокристаллические вещества белого или бе-
12, который без выделения вводили в реакцию с
жевого цвета, плохо растворимые в EtOH и эфи-
кислотой Мельдрума 13. Образующийся аддукт
ре, растворимые в ацетоне и ДМСО. Их строение
Михаэля 14 при кипячении в этаноле циклизо-
подтверждено комплексом спектральных данных
вался с отщеплением ацетона и СО2 и образова-
ЯМР 1Н, 13С DEPTQ, ИК спектроскопии, а так-
нием тетрагидропиридин-2-тиолата 15. Обработка
же масс-спектрометрии высокого разрешения
последнего первичными аминами в присутствии
(HRMS). Строение соединений 8в и 9 также до-
избытка НСНО в мягких условиях приводит с вы-
полнительно изучено с помощью комплекса ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
193
Схема 4.
тодов двумерной спектроскопии ЯМР (1Н-13С
Результаты исследований по определению
HSQC, 1Н-13С HMBC) (табл. 1, 2). Полный набор
анальгетической активности показали, что наи-
наблюдаемых корреляций и отнесение сигналов
более выраженную болеутоляющую активность
представлены в Дополнительных материалах.
проявляют гексагидрохинолины 9 (10.15 с) и 11
(10.90 с). Умеренной анальгетической активно-
Анальгетическую активность соединений 8-11
изучали in vivo по известной методике тепловой
стью обладают все три пиридо[2,1-b][1,3,5]тиади-
азина 8а-в, которые более чем в два раза увеличи-
иммерсии хвоста [57-60], а также в классическом
вают время отдергивания хвоста в тесте тепловой
тесте формалин-индуцированной орофациальной
иммерсии. Производное пиридина 10 анальгети-
тригеминальной боли [61-65]. Средние численные
ческих свойств не обнаруживает.
значения времени отдергивания хвоста из сосуда с
горячей водой у крыс без фармакокоррекции, при-
Результаты исследования анальгетической ак-
веденные в табл. 3, составляют 3.57 с. Предвари-
тивности в тесте орофациальной тригеминальной
тельное введение кеторолака крысам референтной
боли представлены в табл. 4. Так, за 10 мин нами
группы достоверно более чем троекратно увели-
зарегистрировано в среднем 173 чесательных дви-
чивает его до 10.92 с.
жения орофациальной области у крыс контроль-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
194
БИБИК и др.
Схема 5.
ной группы. За 15 мин этот показатель составил
ли соединения 9 и 11, а сравнимую с эффектом
250, а за 20 мин - 294 движения. У крыс референт-
от применения препарата-референта (кеторолака)
ной группы, получавших анальгетик кеторолак, за
проявили соединения 8а, б. В течение 15-минут-
10 мин наблюдения выявлено снижение частоты
ного интервала после введения альгогена лидером
чесательных движений на 41.04% в сравнении с
по анальгетической активности оказалось сое-
контролем (табл.
4).
15-минутный промежуток
динение 11, которое на 19.3% был эффективнее
времени после введения альгогена в область ви-
кеторолака. Производное гексагидрохинолина
брисс у крыс этой группы обнаружил уменьшение
9 за этот промежуток времени показало актив-
этого показателя на 46.6%. За 20 мин частота чеса-
ность, превосходящую таковую для кеторолака на
тельных движений снизилась на 43.23% по срав-
14.66%. Активность на уровне кеторолака найде-
нению с показателем, зарегистрированным у лабо-
на для соединения 8б. Наконец, за 20-минутный
раторных животных контрольной группы.
интервал после введения раствора формалина в
Наиболее высокую анальгетическую актив-
область вибрисс максимальная анальгетическая
ность в тесте орофациальной тригеминальной
активность установлена для гексагидрохинолинов
боли уже за первые 10 мин наблюдения показа-
9 и 11. Последние превосходят по анальгетической
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
195
Таблица 1. Корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC соединения 8в
O
OMe
OMe
N
OEt
MeO
N
S
CN
δС, м. д.
δН, м. д.
1H-13C HSQC
1H-13C HMBC
1.30 т (3Н, OCH2CH3)
14.8* (CH3CH2O)
63.6 (CH3CH2O)
2.69 д. д (1H, цис-С7H)
38.2 (C7H2)
37.3* (C8H), 88.7 (C9), 132.1 (C1 C-Ar), 167.3 (C=O)
3.02 д. д (1H, транс-С7H)
38.2 (C7H2)
37.3* (C8H), 88.7 (C9), 132.1 (C1 C-Ar), 167.3 (C=O)
3.71 с (3H, MeO)
55.3* (CH3O C-Ar)
149.0 (C3-OMe C-Ar)
3.74 с (3H, MeO)
55.4* (4-CH3O N-Ar)
157.1 (C4-OMe N-Ar)
3.79 с (3H, MeO)
55.7* (2-CH3O N-Ar)
152.8 (C2-OMe N-Ar)
3.83-3.85 м (1H, С8H)
37.3* (C8H)
38.2 (C7H2), 88.7 (C9), 111.0* (C2H C-Ar), 117.9 (C≡N), 132.1
(C1 C-Ar), 149.3 (C9a), 167.3 (C=O).
3.96 к (OCH2CH3)
63.6 (CH3CH2O)
14.8* (CH3CH2O), 147.3 (C4-OEt C-Ar)
5.10-5.28 м (4Н,
54.7 (C2H2), 60.4 (C4H2)
54.7 (C2H2), 60.4 (C4H2), 127.3 (C1 N-Ar), 149.3 (C9a), 167.3
NСН2NCH2S)
(C=O)
6.42-6.48 м (2H, H5 N-Ar,
104.2* (C5H N-Ar, 118.2*
37.3* (C8H), 100.0* (C3H N-Ar), 111.0* (C2H C-Ar), 127.3
H6 C-Ar)
(C6H C-Ar)
(C1 N-Ar), 147.3 (C4-OEt C-Ar), 157.1 (C4-OMe N-Ar)
6.60 д (1H, H3 N-Ar)
100.0* (C3H N-Ar)
104.2* (C5H N-Ar), 127.3 (C1 N-Ar), 152.8 (C2-OMe N-Ar),
157.1 (C4-OMe N-Ar)
6.75 д (1H, H5 C-Ar)
112.6* (C5H C-Ar)
132.1 (C1 C-Ar), 149.0 (C3-OMe C-Ar)
6.79 д (1H, H2 C-Ar)
111.0* (C2H C-Ar)
37.3* (C8H), 118.2* (C6H C-Ar), 147.3 (C4-OEt C-Ar), 149.0
(C3-OMe C-Ar)
7.01 д (1H, H6 N-Ar)
121.0* (C6H N-Ar)
127.3 (C1 N-Ar), 152.8 (C2-OMe N-Ar), 157.1 (C4-OMe
N-Ar)
Схема 6.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
196
БИБИК и др.
Таблица 2. Корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC соединения 9
δС, м. д.
δН, м. д.
1H-13C HSQC
1H-13C HMBC
1.75-1.93 м (2Н, C7H2)
20.7 (C7H2)
151.3 (C8a), 194.9 (C=O)
2.21-2.25 м (2Н, C6H2)
36.7 (C6H2)
20.7 (C7H2), 26.3 (C8H2), 194.9 (C=O)
2.49-2.59 м (2Н, C8H2)
26.3 (C8H2)
20.7 (C7H2), 109.2 (C4a), 151.3 (C8a)
3.70 с (3H, MeO)
55.5* (OMe)
147.4 (C5-OMe Ar)
3.90 к (2H, SCH2)
36.8 (SCH2)
142.1 (C2), 166.6 (C(O)NH)
4.40 с (1H, H4)
38.6* (C4H)
92.0 (C3), 109.2 (C4a), 111.5* (C2H Ar), 119.4* (C6H Ar),
136.1 (C1 Ar), 142.1 (C2), 151.3 (C8a), 194.9 (C=O)
6.53 д. д (1H, H6 Ar)
119.4* (C6H Ar)
38.6* (C4H), 111.5* (C2H Ar), 145.5 (C4-OH Ar)
6.64 д (1H, H5 Ar)
115.4* (C5H Ar)
136.1 (C1 Ar), 145.5 (C4-OH Ar), 147.4 (C5-OMe Ar)
6.70 д (1H, H2 Ar)
111.5* (C2H Ar)
38.6* (C4H), 119.4* (C6H Ar), 136.1 (C1 Ar), 145.5 (C4-
OH Ar), 147.4 (C5-OMe Ar)
7.14-7.18 м (2H, H3, H5
115.5* д (С3H, C5H 4-FC6H4)
115.5* д (С3H, C5H 4-FC6H4), 134.8 д (С1 4-FC6H4),
4-FC6H4)
158.3 д (С4 4-FC6H4)
7.52-7.56 м (2H, H2, H6
121.4* д (С2H, C6H 4-FC6H4)
121.4* д (С2H, C6H 4-FC6H4), 134.8 д (С1 4-FC6H4),
4-FC6H4)
158.3 д (С4 4-FC6H4)
8.86 с (1H, OH)
-
115.4* (C5H Ar), 145.5 (C4-OH Ar), 147.4 (C5-OMe Ar)
9.99 с (1H, N1H)
-
26.3 (C8H2), 92.0 (C3), 109.2 (C4a), 151.3 (C8a)
10.39 с [1H, C(O)NH]
-
121.4* д (С2H, C6H 4-FC6H4), 134.8 д (С1 4-FC6H4),
166.6 [C(O)NH]
активности препарат сравнения на 24.4 и 16.5%,
Таким образом, реакцией α-цианотиоацета-
соответственно. Анальгетическая активность сое-
мида с альдегидами и 1,3-дикарбонильными сое-
динения 8б также несколько превышает таковую у
динениями с последующей функционализацией
кеторолака.
(аминометилирование либо S-алкилирование ин-
Производное пиридотиадиазина 8в в тесте оро-
термедиатов) нами были получены новые гете-
фациальной тригеминальной боли показало низ-
роциклические соединения, содержащие тетра-
кую анальгетическую активность, достоверных
гидропиридиновый или гексагидрохинолиновый
отличий в сравнении с показателями у контроль-
фрагменты, и изучено их анальгетическое действие.
ной группы животных нами выявлено не было.
Проведенный скрининг показал наличие макси-
Соединение 10 в аналогичной дозе анальгетиче-
мально выраженной анальгетической активности,
ского действия не обнаружило, так как ни в один
в дозе 5 мг/кг превосходящую таковую у кеторо-
из указанных временных промежутков соединение
лака, у двух соединений: 2-{[4-(4-гидрокси-3-ме-
не снижало число чесательных движений, которое
токсифенил)-5-оксо-3-циано-1,4,5,6,7,8-гекса-
оставалось на уровне зафиксированных в кон-
гидрохинолин-2-ил]тио}-N-(4-фторфенил)аце-
трольной группе. Полные данные по биологиче-
тамида и
7,7-диметил-2-метилтио-4-(3,4-диме-
скому действию соединений 8-11 представлены в
токсифенил)-5-оксо-1,4,5,6,7,8-гексагидрохи-
Дополнительных материалах.
нолин-3-карбонитрила. Также болеутоляющую
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
197
Таблица 3. Результаты исследования соединений 8-11 в тесте тепловой иммерсии хвоста у крыс
Результаты измерения времени отдергивания хвоста, сек
Соединение
стандартное
среднее
медиана
ра
отклонение
Контроль
3.57
1.16
3.85
-
Кеторолак
10.92
2.36
10.10
0.03
8а
8.68
2.79
8.45
0.03
8б
9.20
4.74
10.00
0.03
8в
7.60
2.65
7.50
0.03
9
10.15
2.67
10.75
0.03
10
3.52
1.61
3.40
0.92
11
10.90
3.96
8.95
0.03
а р -достоверность результатов в сравнении с контрольной группой животных.
Таблица 4. Результаты исследования соединений 8-11 в тесте орофациальной тригеминальной боли
10 мин
15 мин
20 мин
Соединение
среднее
COа
медиана
рб
среднее
COа
медиана
рб
среднее
COа
медиана
рб
Контроль
173.50
35.77
183.00
-
250.83
40.89
243.50
-
294.33
61.78
296.50
-
Кеторолак
102.33
20.78
98.50
0.03
133.50
34.05
124.50
0.03
166.33
45.31
167.00
0.03
8а
121.00
40.77
102.00
0.17
156.00
55.43
131.50
0.04
199.50
59.78
184.00
0.03
8б
103.17
24.60
99.50
0.03
133.83
26.92
135.00
0.03
161.67
30.50
161.00
0.03
8в
152.67
33.24
151.50
0.46
219.67
84.08
196.00
0.46
276.33
106.59
262.00
0.60
9
84.00
24.71
87.00
0.03
113.50
30.68
120.50
0.03
138.67
23.69
144.50
0.03
10
173.67
26.25
172.00
0.75
240.67
32.57
239.50
0.69
287.50
31.69
290.00
0.83
11
87.50
27.04
89.00
0.03
107.33
23.63
104.50
0.03
125.50
28.59
116.50
0.03
а CO - стандартное отклонение.
б р - достоверность результатов в сравнении с контрольной группой животных.
активность, сравнимую с таковой после приме-
Цианотиоацетамид 1 [72] и кислоту Мельдрума
нения кеторолака, проявили производные пири-
13 [73] получали по известным методикам, осталь-
до[2,1-b][1,3,5]тиадиазина.
ные реагенты - коммерчески доступны.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общаяметодика синтеза3-арил-8-(3-метокси-
4-этоксифенил)-6-оксо-2,3,4,6,7,8-гексагидро-
ИК спектры получали на спектрофотометре
пиридо[2,1-b][1,3,5]тиадиазин-9-карбонитри-
Bruker Vertex 70 с приставкой НПВО методом
лов 8а-в. К смеси 3-метокси-4-этоксибензальде-
нарушенного полного внутреннего отражения на
гида (1.8 г, 10 ммоль) и цианотиоацетамида 1 (1.0,
кристалле алмаза, погрешность ± 4 см-1. Спектры
10 ммоль) в 15 мл этанола при перемешивании
ЯМР регистрировали на приборе Bruker Avance III
добавляли 2 капли N-метилморфолина. Смесь пе-
HD 400MHz [400.17 (1Н), 100.63 МГц (13С)] в рас-
ремешивали до полной конверсии, при этом на-
творе ДМСО-d6, в качестве стандарта использова-
блюдалось образование желто-оранжевого осадка
ли остаточные сигналы растворителя. Масс-спек-
продукта конденсации по Кнёвенагелю - 3-(3-ме-
тры высокого разрешения (HRMS) записывали на
токси-4-этоксифенил)-2-цианотиоакриламида
12.
приборе Bruker maXis Impact quadrupole TOF mass
spectrometer в системе MeCN-вода, калибровка
К суспензии тиоакриламида 12 добавляли 1.50 г
по HCO2Na-HCO2H, метод ионизации - ESI-TOF.
(10.4 ммоль) кислоты Мельдрума 13, еще 10 мл
Индивидуальность полученных образцов контро-
этанола и 1.65 мл (15 ммоль) N-метилморфолина.
лировали методом ТСХ на пластинах Silufol UV-
Суспензию перемешивали до полного превраще-
254, элюент - ацетон-гексан (1:1), проявитель -
ния тиоакриламида 12 в аддукт Михаэля 14 (кон-
пары иода, УФ детектор.
троль по ТСХ, изменение окраски суспензии с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
198
БИБИК и др.
оранжевой на белую). Суспензию аддукта Миха-
8.3 Гц), 6.78 д (1H, H-Ar, 4J 2.0 Гц), 7.00 д (2H,
эля 14 при интенсивном перемешивании кипяти-
H-Ar, 3J 8.6 Гц), 7.16 д (2H, H-Ar, 3J 8.6 Гц). Спектр
ли до образования прозрачного желто-оранжевого
ЯМР 13С DEPTQ, δC, м. д.: 14.8* (CH3CH2O), 15.6*
раствора и далее еще 30 мин до завершения реак-
(CH3CH2Ar), 27.2 (CH3CH2Ar), 37.4* (C8H), 38.1
ции. Горячую реакционную массу упаривали до
(C7H2), 52.6 (C2H2), 55.4* (CH3O), 57.8 (C4H2),
1/3 объема в вакууме, при этом кристаллизуется
63.6 (CH3CH2O), 89.3 (C9), 111.1* (CH Ar), 112.7*
4-(3-метокси-4-этоксифенил)-6-оксо-3-циано-
(CH Ar), 116.5* (2C, C2, C6 4-EtC6H4), 117.6 (C≡N),
1,4,5,6-тетрагидропиридин-2-тиолат
128.8* (2C, C3, C5 4-EtC6H4), 131.9 (C Ar), 136.8 (C
N-метилморфолиния 15 в виде светло-желто-
Ar), 141.5 (C Ar), 147.3 (C4-OEt C-Ar), 148.8 (C3-
го мелкокристаллического порошка. Выход 2.8 г
OMe C-Ar), 149.1 (C9a), 167.3 (C=O). Здесь и далее
(69%). Тиолат 15 вводили далее в реакцию без до-
звездочкой обозначены сигналы в противофазе.
полнительной очистки. Спектр ЯМР 1Н, δ, м. д.:
Масс-спектр (HRMS ESI-TOF), m/z:
472.1663
1.29 т (3Н, OCH2CH3, 3J 7.0 Гц), 2.35 д. д (1H, цис-
[M
+ Na]+ (вычислено для C25H27N3NaO3S:
С5H, 2J 16.1, 3J 4.4 Гц), 2.66 д. д (1H, транс-С5H, 2J
472.1665),
540.1553
[M
+ HCOONa
+ Na]+
16.1, 3J 6.9 Гц), 2.78 с (3H, NCH3), 3.13-3.22 м (4H,
(вычислено для C26H28N3Na2O5S: 540.1545).
CH2NCH2), 3.56 д. д (1H, С4H, 3J 6.9, 3J 4.4 Гц),
3-(3,4-Диметилфенил)-8-(3-метокси-4-эток-
3.71 с (3H, MeO), 3.71-3.80 м (4H, CH2OCH2), 3.95
сифенил)-6-оксо-2,3,4,6,7,8-гексагидропири-
к (OCH2CH3, 3J 7.0 Гц), 6.64 д. д (1H, H-Ar, 3J 8.1,
до[2,1-b][1,3,5]тиадиазин-9-карбонитрил
(8б).
4J 1.6 Гц), 6.78 д (1H, H-Ar, 4J 1.6 Гц), 6.83 д (1H,
Выход 87%, бесцветные кристаллы. ИК спектр,
H-Ar, 3J 8.1 Гц), 8.55 уш. с (1H, NH), 9.61 очень уш.
ν, см-1: 2191 с (С≡N), 1689 с (С=О). Спектр ЯМР
с (1Н, NH+).
1Н, δ, м. д.: 1.30 т (3Н, OCH2CH3, 3J 7.0 Гц), 2.16
Тиолат 15 (0.5 г, 1.2 ммоль) растворяли при на-
с (3H, Me-Ar), 2.17 с (3H, Me-Ar), 2.70 д. д (1H,
гревании в 10 мл 70%-ного этанола и фильтровали
цис-С7H, 2J 16.1, 3J 5.0 Гц), 2.99 д. д (1H, транс-
через бумажный фильтр для получения прозрач-
С7H, 2J 16.1, 3J 7.1 Гц), 3.68 с (3H, MeO), 3.79 д. д
ного раствора. К полученному раствору добавля-
(1H, С8H, 3J 7.1, 3J 5.0 Гц), 3.96 к (2H, OCH2CH3,
ли соответствующий замещенный анилин в ко-
3J 7.0 Гц), 5.29-5.44 м (4Н, NСН2NCH2S), 6.43 д. д
личестве 1.2 ммоль и избыток 37%-ного водного
(1H, H-Ar, 3J 8.1, 4J 2.0 Гц), 6.76-6.79 м (2H, H-Ar),
НСНО (1 мл, 13.3 ммоль). Смесь кипятили при
6.91 д (1H, H-Ar, 4J 2.5 Гц), 7.06 д (1H, H-Ar, 3J
интенсивном перемешивании 2-3 минуты до нача-
8.3 Гц). Спектр ЯМР 13С DEPTQ, δC, м. д.: 14.8*
ла кристаллизации продукта реакции, затем охла-
(CH3CH2O), 18.4* (CH3Ar), 19.9* (CH3Ar), 37.4*
ждали до комнатной температуры и выдерживали
(C8H), 38.1 (C7H2), 52.6 (C2H2), 55.4* (CH3O), 57.9
6 ч. Осадок фильтровали, промывали водой, ох-
(C4H2), 63.6 (CH3CH2O), 89.1 (C9), 111.1* (CH Ar),
лажденным этанолом и диэтиловым эфиром. При
112.7* (CH Ar), 113.9* (CH Ar), 117.6 (C≡N), 117.8*
необходимости очищали перекристаллизацией из
(CH Ar), 118.3* (CH Ar), 129.2 (C Ar), 130.4* (CH
ацетона.
Ar), 132.0 (C Ar), 137.2 (C Ar), 141.6 (C Ar), 147.3
8-(3-Метокси-4-этоксифенил)-3-(4-этилфе-
(C4-OEt C-Ar), 148.9 (C3-OMe C-Ar), 149.1 (C9a),
167.3 (C=O). Масс-спектр (HRMS ESI-TOF), m/z:
нил)-6-оксо-2,3,4,6,7,8-гексагидропиридо[2,1-b]-
472.1656 [M + Na]+ (вычислено для C25H27N3Na-
[1,3,5]тиадиазин-9-карбонитрил
(8а). Выход
O3S: 472.1665), 540.1520 [M + HCOONa + Na]+
87%, бесцветные кристаллы. ИК спектр, ν, см-1:
(вычислено для C26H28N3Na2O5S: 540.1545).
2193 с (С≡N), 1691 с (С=О). Спектр ЯМР 1Н, δ,
м. д.: 1.16 т (3Н, ArCH2CH3, 3J 7.6 Гц), 1.30 т (3Н,
3-(2,4-Диметоксифенил)-8-(3-метокси-4-
OCH2CH3, 3J 7.0 Гц), 2.55 к (ArCH2CH3, 3J 7.6 Гц),
этоксифенил)-6-оксо-2,3,4,6,7,8-гексагидро-
2.70 д. д (1H, цис-С7H, 2J 16.0, 3J 5.1 Гц), 3.00 д.
пиридо[2,1-b][1,3,5]тиадиазин-9-карбонитрил
д (1H, транс-С7H, 2J 16.0, 3J 7.1 Гц), 3.69 с (3H,
(8в). Выход 91%, бежевый мелкокристалличе-
MeO), 3.80 д. д (1H, С8H, 3J 7.1, 3J 5.1 Гц), 3.96
ский порошок. ИК спектр, ν, см-1: 2201 с (С≡N),
к (2H, OCH2CH3, 3J 7.0 Гц), 5.33 д (1Н, СН2S, 2J
1684 с (С=О). Спектр ЯМР 1Н, δ, м. д.: 1.30 т (3Н,
12.5 Гц), 5.39-5.42 м (3Н, СН2NCH2S), 6.45 д. д
OCH2CH3, 3J 7.0 Гц), 2.69 д. д (1H, цис-С7H, 2J
(1H, H-Ar, 3J 8.3, 4J 2.0 Гц), 6.73 д (1H, H-Ar, 3J
16.1, 3J 4.8 Гц), 3.02 д. д (1H, транс-С7H, 2J 16.1, 3J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
199
7.1 Гц), 3.71 с (3H, MeO), 3.74 с (3H, MeO), 3.79 с
2189 с (С≡N), 1672 с (С=О), 1651 с [С(O)NH].
(3H, MeO), 3.83-3.85 м (1H, С8H), 3.96 к (2H, OCH-
Спектр ЯМР 1Н, δ, м. д.: 1.75-1.93 м (2Н, C7H2),
2
CH3, 3J 7.0 Гц), 5.10-5.28 м (4Н, NСН2NCH2S),
2.21-2.25 м (2Н, C6H2), 2.49-2.59 м (2Н, C8H2),
6.45-6.48 м (2H, H4 N-Ar + H6 C-Ar), 6.60 д
3.70 с (3H, MeO), 3.90 к (2H, SCH2, 2J 14.7 Гц), 4.40
(1H, H3N-Ar, 4J 2.3 Гц), 6.75 д (1H, H5 C-Ar, 3J
с (1H, H4), 6.53 д. д (1H, H6 Ar, 3J 8.1, 4J 1.7 Гц),
8.3 Гц), 6.79 д (1H, H2 C-Ar, 4J 1.4 Гц), 7.01 д (1H,
6.64 д (1H, H5 Ar, 3J 8.1 Гц), 6.70 д (1H, H2 Ar, 4J
H6N-Ar, 3J 8.7 Гц). Спектр ЯМР 13С DEPTQ, δC,
1.7 Гц), 7.14-7.18 м (2H, H3, H5 4-FC6H4), 7.52-
м. д.: 14.8* (CH3CH2O), 37.3* (C8H), 38.2 (C7H2),
7.56 м (2H, H2, H6 4-FC6H4), 8.86 с (1H, OH), 9.99 с
54.7 (C2H2), 55.3* (CH3O C-Ar), 55.4* (4-CH3O
(1H, N1H), 10.39 с [1H, C(O)NH]. Спектр ЯМР 13С
N-Ar), 55.7* (2-CH3O N-Ar), 60.4 (C4H2),
63.6
DEPTQ, δC, м. д.: 20.7 (C7H2), 26.3 (C8H2), 36.7
(CH3CH2O), 88.7 (C9), 100.0* (C3H N-Ar), 104.2*
(C6H2), 36.8 (SCH2), 38.6* (C4H), 55.5* (OMe),
(C5HN-Ar), 111.0* (C2H C-Ar), 112.6* (C5H C-Ar),
92.0 (C3), 109.2 (C4a), 111.5* (C2H Ar), 115.4* (C5H
117.9 (C≡N), 118.2* (C6H C-Ar), 121.0* (C6H N-Ar),
Ar), 115.5* д (С3H, C5H 4-FC6H4, 2JCF 22.4 Гц),
127.3 (C1 N-Ar), 132.1 (C1 C-Ar), 147.3 (C4-OEt
119.1 (C≡N), 119.4* (C6H Ar), 121.4* д (С2H, C6H
C-Ar), 149.0 (C3-OMe C-Ar), 149.3 (C9a), 152.8 (C2-
4-FC6H4, 3JCF 8.1 Гц), 134.8 д (С1 4-FC6H4, 4JCF
OMe N-Ar), 157.1 (C4-OMe N-Ar), 167.3 (C=O).
2.4 Гц), 136.1 (C1 Ar), 142.1 (C2), 145.5 (C4-OH Ar),
Масс-спектр (HRMS ESI-TOF), m/z:
504.1552
147.4 (C5-OMe Ar), 151.3 (C8a), 158.3 д (С4 4-FC6H4,
[M
+ Na]+ (вычислено для C25H27N3NaO5S:
1JCF 240.6 Гц), 166.6 [C(O)NH], 194.9 (C=O). Масс-
504.1564),
572.1417
[M
+ HCOONa
+ Na]+
спектр (HRMS ESI-TOF), m/z: 502.1201 [M + Na]+
(вычислено для C26H28N3Na2O7S: 572.1444).
(вычислено для C25H22FN3NaO4S: 502.1207).
2-{[4-(4-Гидрокси-3-метоксифенил)-5-ок-
Этиловый эфир
2-оксо-4-(2-фторфенил)-
со-3-циано-1,4,5,6,7,8-гексагидрохинолин-2-ил]-
5-циано-6-[(2-{(2-этилфенил)амино}-2-оксо-
тио}-N-(4-фторфенил)ацетамид
(9). Цианоти-
этил)тио]-1,2,3,4-тетрагидропиридин-3-карбо-
оацетамид 1 (2.0 г, 20 ммоль) и ванилин (3.04 г,
новой кислоты (10). Смесь цианотиоацетамида
20 ммоль) перемешивали в 25 мл этанола в при-
1 (2.0 г, 20 ммоль), 2-фторбензальдегида (2.1 мл,
сутствии 3 капель пиперидина до полной кон-
20 ммоль) и диэтилмалоната (3.05 мл, 20 ммоль)
версии исходных реагентов и образования оран-
перемешивали в 25 мл этанола в присутствии
жевого продукта конденсации Кнёвенагеля. К
избытка N-метилморфолина (25 ммоль) 7 сут.
полученной суспензии добавляли 1,3-циклогек-
Осадок тетрагидропиридин-2-тиолата 17 отфиль-
сандион (2.24 г, 20 ммоль) и пиперидин (2.5 мл,
тровывали, промывали ацетоном и сушили на воз-
25 ммоль). Смесь перемешивали 8 ч, после чего
духе. Выход 44%, порошок белого цвета. Тиолат
подкисляли 10%-ной HCl в этаноле до рН 5. Через
17 использовали в дальнейших превращениях без
12 ч осадок отфильтровывали и промывали охлаж-
дополнительной очистки.
денным спиртом. Получали 4-(4-гидрокси-3-ме-
Смесь тиолата 17 (2 ммоль) и α-хлор-N-(2-
токсифенил)-2-меркапто-5-оксо-1,4,5,6,7,8-гек-
этилфенил)ацетамида (2 ммоль) нагревали в 15 мл
сагидрохинолин-3-карбонитрил 16 (выход 67%),
85%-ного этанола до полного растворения исход-
который использовали на следующей стадии без
ных реагентов и образования прозрачного рас-
дополнительной очистки.
твора. Через 24 ч выкристаллизовавшийся про-
2-Меркаптохинолин 16 (660 мг, 2 ммоль) су-
дукт 10 отфильтровывали, промывали этанолом
спендировали в 15 мл 85%-ного этанола, после-
и петролейным эфиром. Выход 83%, бежевый
довательно добавляли водный 10%-ный раствор
порошок. ИК спектр, ν, см-1: 3325 c (N-H), 2208
KОН (1.05 мл, 2 ммоль) и N-(4-фторфенил)-α-
с (С≡N), 1732 с (С=О), 1693 с [С(O)NH], 1655 с
хлорацетамид (375 мг, 2 ммоль). Смесь пере-
[С(O)NH]. Спектр ЯМР 1Н, δ, м. д.: 0.97 т (3Н,
мешивали 12 ч при 25°С, осадок соединения 9
ArCH2CH3, 3J 7.8 Гц), 1.12 т (3Н, OCH2CH3, 3J
отфильтровывали, для аналитических целей пере-
7.1 Гц), 2.59 к (2Н, ArCH2CH3, 3J 7.8 Гц), 3.97-4.04
кристаллизовывали из смеси ацетон-этанол. Вы-
м (5Н, SCH2, H4, OCH2), 4.55 д (1Н, Н3, 3J 10.8 Гц),
ход 86%, бежевый порошок. ИК спектр, ν, см-1:
7.18-7.22 м (3Н, H-Ar), 7.24-7.27 м (2Н, H-Ar),
3433 c, 3309 c, 3282 cл, 3221 cл, 3095 (O-H, N-H),
7.31-7.42 м (3Н, H-Ar), 9.79 с (1H, NHAr), 11.28 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
200
БИБИК и др.
(1H, NH). Спектр ЯМР 13С DEPTQ, δC, м. д.: 13.7*
50.1 (C6H2), 55.4* (OMe), 55.5* (OMe), 90.3 (C3),
(CH3CH2Ar), 14.83* (CH3CH2O), 23.6 (CH3CH2Ar),
108.2 (C4a), 110.8* (C2H C-Ar), 111.8* (C5H C-Ar),
35.3 (SCH2), 36.8* д (С4Н, 3JCF 1.7 Гц), 52.1* (С3),
118.95* (C6H C-Ar), 118.99 (C≡N), 137.7 (C1 C-Ar),
61.2 (CH3CH2O), 91.2 (C5), 115.9* д (С3H 2-FC6H4,
144.5 (C8a), 147.7 (COMe), 148.6 (COMe), 149.6
2JCF 21.5 Гц), 116.7 (C≡N), 123.7 д (С1 2-FC6H4,
(C2), 194.6 (C=O). Масс-спектр (HRMS ESI-TOF),
2JCF 13.4 Гц), 124.9* д (С5H 2-FC6H4, 4JCF 3.1 Гц),
m/z: 407.1393 [M + Na]+ (вычислено для C21H24N-
126.01* (СH N-Ar), 126.04* (СH N-Ar), 126.3*
NaO3S: 407.1400).
2
(СH N-Ar), 128.6* (СH N-Ar), 129.6* д (С6H
Исследование анальгетической активно-
2-FC6H4, 3JCF 3.3 Гц), 130.5* д (С4H 2-FC6H4, 3JCF
сти проводили на 56 белых беспородных поло-
8.4 Гц), 134.8 (C2 N-Ar), 138.2 (C1 N-Ar), 147.2 (C6),
возрелых крысах обоего пола массой 160-200 г
160.2 д (С2 2-FC6H4, 1JCF 246.3 Гц), 165.2 [C(O)
в осенне-зимний период. На протяжении всего
NH], 166.8 [C(O)NH], 167.3 (CO2Et). Масс-спектр
эксперимента животные находились в услови-
(HRMS ESI-TOF), m/z: 504.1354 [M + Na]+ (вычис-
ях вивария, рацион питания был стандартным, в
лено для C25H24FN3NaO4S: 504.1364).
клетке находилось не более 6 особей, что соответ-
7,7-Диметил-2-метилтио-4-(3,4-диметок-
ствует правилами и требованиям, содержащимся
сифенил)-5-оксо-1,4,5,6,7,8-гексагидрохино-
в методических рекомендациях по этической экс-
лин-3-карбонитрил (11). Смесь цианотиоацета-
пертизе биомедицинских исследований [74, 75].
мида 1 (200 мг, 2 ммоль), вератрового альдегида
В предэкспериментальный период был проведен
(333 мг, 2 ммоль) и пиперидина (1 капля) пере-
тщательный осмотр животных, особое внимание
мешивали 5 мин в 5 мл этанола до образования
уделялось их весу, возрасту, двигательной актив-
оранжевого осадка продукта конденсации Кнёв-
ности и состоянию шерстяного покрова. На ос-
енагеля. К полученной суспензии добавляли при
новании этих данных лабораторные крысы были
интенсивном перемешивании димедон
(5,5-ди-
равномерно распределены на группы: интактную,
метилциклогексан-1,3-дион)
(280 мг, 2 ммоль) и
контрольную (с моделируемой орофациальной
пиперидин (0.25 мл, 2.5 ммоль). Смесь перемеши-
тригеминальной болью и тепловой иммерсией
вали до растворения, фильтровали через бумаж-
хвоста), референтную (кеторолак) и 6 опытных
ный фильтр и оставляли на 24 ч; при этом может
групп по количеству исследуемых оригинальных
наблюдаться образование белого мелкокристалли-
производных α-цианотиоацетамида.
ческого осадка аддукта Михаэля. К реакционной
Исходя из принципов гуманности, экспери-
смеси добавляли иодметан (0.15 мл, 2.4 ммоль) и
мент проводили с минимально допустимым для
4 мл 70%-ного этанола. Смесь медленно нагре-
статистической обработки и получения достовер-
вали до кипения при перемешивании, кипятили
ных результатов количеством животных (по 6 в
10 мин, затем фильтровали через бумажный
группе), а также минимальным для достижения
фильтр и оставляли для кристаллизации. Осадок
поставленных целей и задач количеством экспери-
хинолина 11 отфильтровывали, промывали этано-
ментальных групп. Определение анальгетической
лом, петролейным эфиром и сушили на воздухе.
активности проводили в тесте орофациальной три-
Выход 74%, порошок бежевого цвета. ИК спектр,
геминальной боли, которую моделировали под-
ν, см-1: 3252, 3173 сл (N-H), 2195 с (С≡N), 1606
кожным введением 0.1 мл 5%-ного раствора фор-
уш. с (С=О, С=С). Спектр ЯМР 1Н, δ, м. д.: 0.91 с
малина в область вибрисс у лабораторных крыс
(3Н, С7СН3), 1.02 с (3Н, С7СН3), 2.02 д (1Н, С6Н2,
[75]. В течение 20 мин (за 10-, 15- и 20-минутный
2J 16.4 Гц, часть АВ-системы), 2.21 д (1Н, С6Н2, 2J
срок) после введения альгогена подсчитывали
16.4 Гц, часть АВ-системы), 2.43 к (2Н, С8Н2, 2J
количество чесательных движений передними
17.6 Гц), 2.48 с (3Н, SCH3), 3.67 с (3Н, OCH3), 3.69
лапами орофациальной области. В качестве пре-
с (3Н, OCH3), 4.38 с (1Н, H4), 6.63 д. д (1H, H6 Ar,
парата сравнения для референтной группы крыс
3J 8.3, 4J 2.0 Гц), 6.69 д (1H, H2 Ar, 4J 2.0 Гц), 6.86 д
использовали кеторолак в дозе 0.1 мг/кг; 6 образ-
(1H, H5 Ar, 3J 8.3 Гц), 9.61 с (1H, NH). Спектр ЯМР
цов оригинальных производных пиридина вводи-
13С DEPTQ, δC, м. д.: 15.8* (SCH3), 26.3* (C7CH3),
ли внутрижелудочно в дозе 5 мг/кг за 1.5 часа до
29.1* (C7CH3), 32.0 (C7), 38.6* (C4H), 39.3 (C8H2),
введения используемого альгогена (формалина).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
201
Для оценки термической боли нами была вы-
СПИСОК ЛИТЕРАТУРЫ
брана методика тепловой иммерсии хвоста, осно-
1.
Abdel-Galil F.M., Sherif S.M., Elnagdi M.H. //
ванная на спинальном флексорном рефлексе в от-
Heterocycles. 1986. Vol. 24. N 7. P. 2023. doi 10.3987/
вет на погружение хвоста в горячую воду. Болевое
R-1986-07-2023
раздражение моделировали при погружении хво-
2.
Литвинов В.П. // Усп. хим. 1999. Т. 68. № 9. С. 817;
ста в сосуд с водой, нагретой до 50-54°С, измеряя
Litvinov V.P. // Russ. Chem. Rev. 1999. Vol. 68. N 9.
при этом величину латентного периода реакции.
P. 737. doi 10.1070/RC1999v068n09ABEH000533
Анальгетическую активность оценивали по удли-
3.
Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. // Усп.
хим. 2018. Т. 87. № 9. С. 1. doi 10.1070/RCR4760?lo-
нению времени реакции отдергивания хвоста.
catt=label:RUSSIAN; Dyachenko V.D., Dyachenko I.V.,
Статистическую обработку полученных ре-
Nenajdenko V.G. // Russ. Chem. Rev. 2018. Vol. 87.
зультатов проводили в среде обработки данных
N 1. P. 1. doi: 10.1070/RCR4760
Statistica 10.0. Поскольку исследование было про-
4.
Магеррамов А.М., Шихалиев Н.Г., Дяченко В.Д.,
ведено на возможно минимальном количестве ла-
Дяченко И.В., Ненайденко В.Г. α-Цианотиоацетамид.
бораторных животных, при анализе численных ре-
М.: Техносфера, 2018. 224 с.
зультатов экспериментальной части работы были
5.
Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A., Shes-
topalov A.M., Senning A. // J. Sulfur Chem. 1992. Vol.
использованы непараметрические методики. С
13. N 1. P. 1. doi 10.1080/01961779208048951.
целью определения достоверности отличий при
6.
Litvinov V.P. // Phosphorus, Sulfur, Silicon
статистической обработке данных применяли не-
Relat. Elem. 1993. Vol. 74. N 1. P. 139. doi
параметрический тест согласованных пар Уилкок-
10.1080/10426509308038105
сона с предварительным определением валидных
7.
Литвинов В.П. // Изв. АН. Сер. хим. 1998. № 11.
интервалов значений по каждому из исследуемых
С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998. Vol.
показателей. При этом выборки оценивались как
47. N 11. P. 2053. doi 10.1007/BF02494257
непрерывные, достаточные по вариативности при-
8.
Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7. С. 645;
знака [76]. Достоверность отличий между значе-
Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75. N 7.
ниями контрольной и опытных групп вычисляли
P. 577. doi 10.1070/RC2006v075n07ABEH003619
на основании полученных данных (медианные,
9.
Литвинов В.П., Промоненков В.К., Шаранин Ю.А.,
Шестопалов А.М.. // Итоги науки и техники. Серия
квартильные, средние значения, стандартное от-
Органическая химия. М.: ВИНИТИ, 1989. Т. 17.
клонение).
С. 72.
Работа выполнена с соблюдением всех приме-
10.
El-Sayed H.A., Moustafa A.H., Said S.A., Assy M.G.,
нимых международных, национальных и институ-
Amr A.E.-G.E. // Synth. Commun. 2018. Vol. 48. N 20.
циональных руководящих принципов по уходу и
P. 2615. doi 10.1080/00397911.2018.1496262
использованию животных.
11.
Salem M.A., Helel M.H., Gouda M.A., Ammar Y.A.,
El-Gaby M.S.A. // Synth. Commun. 2018. Vol. 48. N 4.
ФОНДОВАЯ ПОДДЕРЖКА
P. 345. doi 10.1080/00397911.2017.1394468
Работа выполнена при финансовой поддерж-
12.
Доценко В.В., Бурый Д.С., Лукина Д.Ю.,
ке Кубанского научного фонда в рамках научного
Кривоколыско С.Г. // Изв. АН. Сер. хим. 2020.
№ 10. С. 1829; Dotsenko V.V., Buryi D.S., Lukina D.Yu.,
проекта МФИ-20.1-26/20 (заявка № МФИ-20.1/45),
Krivokolysko S.G. // Russ. Chem. Bull. 2020. Vol. 69.
а также Министерства образования и науки Рос-
N 10. P. 1829. doi 10.1007/s11172-020-2969-2
сийской Федерации (тема 0795-2020-0031).
13.
Доценко В.В., Кривоколыско С.Г., Кривоколыско Б.С.,
КОНФЛИКТ ИНТЕРЕСОВ
Фролов К.А. // ЖОХ. 2018. Т. 88. № 4. С. 599; Dotsen-
ko V.V., Krivokolysko S.G., Krivokolysko B.S., Frolov
Авторы заявляют об отсутствии конфликта ин-
K.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 4. P. 682.
тересов.
doi 10.1134/S1070363218040114
14.
Бурый Д.С., Доценко В.В., Аксенов Н.А., Аксенова
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
И.В. // ЖОХ. 2019. Т. 89. № 9. С. 1327; Buryi D.S.,
Дополнительные материалы для этой статьи
Dotsenko V.V., Aksenov N.A., Aksenova I.V. // Russ. J.
доступны по doi
10.31857/S0044460X21020025
Gen. Chem. 2019. Vol. 89. N 9. P. 1744. doi 10.1134/
для авторизованных пользователей.
S1070363219090032
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
202
БИБИК и др.
15.
Бурый Д.С., Доценко В.В., Аксенов Н.А., Аксено-
25.
Краузе А., Дубурс Г. // ХГС. 1996. № 8. С. 1134;
ва И.В., Кривоколыско С.Г., Дядюченко Л.В. // ЖОХ.
Krauze A., Duburs G. // Chem. Heterocycl. Compd.
2019. Т. 89. № 8. С. 1182; Buryi D.S., Dotsenko V.V.,
1996. Vol. 32. N 8. P. 986. doi 10.1007/BF01176979
Aksenov N.A., Aksenova I.V., Krivokolysko S.G., Dy-
26.
Дяченко В.Д. // ЖОрХ. 2007. Т. 43. № 2. С. 278; Dy-
adyuchenko L.V. // Russ. J. Gen. Chem. 2019. Vol. 89.
achenko V.D. // Russ. J. Org. Chem. 2007. Vol. 43. N 2.
P. 271. doi 10.1134/S1070428007020194
N 8. P. 1575. doi 10.1134/S1070363219080061
27.
Шестопалов А.М., Родиновская Л.А., Шара-
16.
Чигорина Е.А., Беспалов А.В., Доценко В.В. // ЖОХ.
нин Ю.А., Литвинов В.П. // ЖОХ. 1988. Т. 58. № 4.
2019. Т. 89. № 10. С. 1520; Chigorina E.A., Bespa-
С. 840; Shestopalov A.M., Rodinovskaya L.A., Sharanin
lov A.V., Dotsenko V.V. // Russ. J. Gen. Chem. 2019.
Yu.A., Litvinov V.P. // J. Gen. Chem. USSR. 1988. Vol.
Vol. 89. N 10. P. 2018. doi 10.1134/S1070363219100062
58. N 4. P. 745.
17.
Бурый Д.С., Доценко В.В., Левашов А.С., Луки-
28.
Родиновская Л.А., Белухина Е.В., Шестопалов А.М.,
на Д.Ю., Стрелков В.Д., Аксенов Н.А.,
Литвинов В.П. // Изв. АН. Сер. Хим. 1994. № 3.
Аксенова И.В., Нетреба Е.Е. // ЖОХ. 2019. Т.
С. 489; Rodinovskaya L.A., Belukhina E.V., Shestopa-
89. № 5. С. 690; Buryi D.S., Dotsenko V.V., Le-
lov A.M., Litvinov V.P. // Russ. Chem. Bull. 1994.
vashov A.S., Lukina D.Yu., Strelkov V.D., Ak-
Vol. 43. N 3. P. 449. doi 10.1007/BF01169725
senov N.A., Aksenova I.V., Netreba E.E. / /
29.
Шаранин Ю.А., Гончаренко М.П., Шестопалов А.М.,
Russ. J. Gen. Chem. 2019. Vol. 89. N 5. P. 886. doi
Литвинов В.П., Туров А.В. // ЖОрХ. 1991. Т. 27.
10.1134/S1070363219050050
№ 9. С. 1996; Sharanin Yu.A., Goncharenko M.P., Shes-
18.
Dotsenko V.V., Buryi D.S., Lukina D.Yu., Stolyaro-
topalov A.M., Litvinov V.P., Turov A.V. // J. Org. Chem.
va A.N., Aksenov N.A., Aksenova I.V., Strelkov V.D.,
USSR. 1991. Vol. 27. N 9.2. P. 1767.
Dyadyuchenko L.V. // Monatsh. Chem. 2019. Vol. 150.
30.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
N 11. P. 1973. doi 10.1007/s00706-019-02505-4
Изв. АН Сер. Хим. 2012. № 1. С. 129; Dotsenko V.V.,
19.
Stroganova T.A., Vasilin V.K., Dotsenko V.V., Aksenov
Krivokolysko S.G., Litvinov V.P. // Russ. Chem. Bull.
N.A., Krapivin G.D. // Tetrahedron Lett. 2019. Vol. 60.
2012. Vol. 61. N 1. P. 131. doi 10.1007/s11172-012-
P. 997. doi 10.1016/j.tetlet.2019.03.012
0018-5
20.
Доценко В.В., Муравьев В.С., Лукина Д.Ю., Стрел-
31.
Фролов К.А., Доценко В.В., Кривоколыско С.Г.,
ков В.Д., Аксенов Н.А., Аксенова И.В., Крапи-
Литвинов В.П. // ХГС. 2012. № 7. C. 1197; Fro-
вин Г.Д., Дядюченко Л.В. // ЖОХ. 2020. Т. 90. № 6.
lov K.A., Dotsenko V.V., Krivokolysko S.G., Litvi-
С. 843; Dotsenko V.V., Muraviev V.S., Lukina D.Yu., Strel-
nov V.P. // Chem. Heterocycl. Compd. 2012. Vol. 48.
kov V.D., Aksenov N.A., Aksenova I.V., Krapivin G.D.,
N 7. P. 1117. doi 10.1007/s10593-012-1109-9
Dyadyuchenko L.V. // Russ. J. Gen. Chem. 2020.
32.
Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
ХГС. 2015. Т. 51. № 2. С. 109; Dotsenko V.V., Fro-
Vol. 90. N 6. P. 948. doi 10.1134/S1070363220060043
lov K.A., Krivokolysko S.G. // Chem. Heterocycl.
21.
Кажока Х., Краузе А., Bилюмс М., Чернова Л., Силе Л.,
Compd. 2015. Vol. 51. N 2. P. 109. doi 10.1007/s10593-
Дубурс Г. // ХГС. 2007. Т. 43. № 1. С. 59; Kažoka H.,
015-1668-7
Krauze A., Viļums M., Černova L., Sīle L., Duburs G. //
33.
Доценко В.В., Фролов К.А., Чигорина Е.А.,
Chem. Heterocycl. Compd. 2007. Vol. 43. N 1. P. 50.
Хрусталева А.Н., Бибик Е.Ю., Кривоколыско С.Г. //
doi 10.1007/s10593-007-0007-z
Изв. АН. Сер. хим. 2019. № 4. С. 691; Dotsen-
22.
Калашник И.Н., Дяченко В.Д. // ЖОХ. 2020. Т. 90.
ko V.V., Frolov K.A., Chigorina E.A., Khrustaleva A.N.,
№ 3. С. 371; Kalashnik I.N., Dyachenko V.D. // Russ.
Bibik E.Yu., Krivokolysko S.G. // Russ. Chem. Bull.
J. Gen. Chem. 2020. Vol. 90. N 3. P. 357. doi 10.1134/
2019. Vol. 68. N 4. P. 691. doi 10.1007/s11172-019-
S1070363220030068
2476-5
23.
Дяченко В.Д., Матусов И.О., Дяченко И.В.,
34.
Dotsenko V.V., Chigorina E.A., Papaianina E.S., Fro-
Ненайденко В.Г. // ЖОрХ. 2018. Т. 54. № 12. С. 1763;
lov K.A., Krivokolysko S.G. // Macroheterocycles. 2015.
Dyachenko V.D., Matusov I.O., Dyachenko I.V., Nenaj-
Vol. 8. N 3. P. 310. doi 10.6060/mhc150870d
denko V.G. // Russ. J. Org. Chem. 2018. Vol. 54. N 12.
35.
Доценко В.В., Суйков С.Ю., Пехтерева Т.М.,
P. 1777. doi 10.1134/S1070428018120060
Кривоколыско С.Г. // ХГС. 2013. № 7. C. 1082; Do-
24.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П.,
tsenko V.V., Suikov S.Yu., Pekhtereva T.M., Krivokolys-
Чернега А.Н. // ХГС. 2007. № 5. C. 716; Dotsen-
ko S.G. // Chem. Heterocycl. Compd. 2013. Vol. 49.
ko V.V., Krivokolysko S.G., Litvinov V.P., Chernega A.N. //
N 7. P. 1009. doi 10.1007/s10593-013-1339-5
Chem. Heterocycl. Compd. 2007. Vol. 43. N 5. P. 599.
36.
Доценко В.В., Суйков С.Ю., Пехтерева Т.М.,
doi 10.1007/s10593-007-0094-x
Кривоколыско С.Г. // ХГС. 2013. № 7. C. 1082; Do-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
203
tsenko V.V., Suikov S.Yu., Pekhtereva T.M., Krivokolys-
46.
Norman D.D., Ibezim A., Scott W.E., White S., Par-
ko S.G. // Chem. Heterocycl. Compds. 2013. Vol. 49. N
rill A.L., Baker D.L. // Bioorg. Med. Chem. 2013.
7. P. 1009. doi 10.1007/s10593-013-1339-5
Vol. 21. N 17. P. 5548. doi 10.1016/j.bmc.2013.05.061
37.
Gewald K., Schäfer H., Schlegel U. // J. Prakt.
47.
Mullan M. J., Paris D., Bakshi P. Pat. WO 2008070875
Chem. 1976. Vol. 318. N 5. P. 779. doi 10.1002/
(2008).
prac.19763180509
48.
Sander T. OSIRIS Property Explorer. http://
38.
Краузе А.А., Бомика З.А., Пелчер Ю.Э., Мажейка И.Б.,
Дубур Г.Я. // ХГС. 1982. Т. 18. № 4. С. 508; Krauze A.A.,
Pharmaceuticals Ltd, Switzerland.
Bomika Z.A., Pelcher Y.É., Mazheika I.B., Dubur G.Ya. //
49.
Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
Chem. Heterocycl. Compd. 1982. Vol. 18. N 4. P. 385.
Vol. 7. Article N 42717. doi 10.1038/srep42717
doi 10.1007/BF00503559
50.
Gfeller D., Grosdidier A., Wirth M., Daina A., Michie-
39.
Пароникян Е.Г., Норавян А.С., Джагацпанян
lin O., Zoete V. // Nucl. acids Res. 2014. Vol. 42. N W1.
И.А., Назарян И.М., Пароникян Р.Г. // Хим.-фарм.
P. W32. doi 10.1093/nar/gku293
ж. 2002. Т. 36. № 9. С. 8; Paronikyan E.G., Nora-
51.
Molinspiration Property Calculation Service. www.
vyan A.S., Dzhagatspanyan I.A., Nazaryan I.M., Paron-
molinspiration.com. Molinspiration Cheminformatics,
ikyan R.G. // Pharm. Chem. J. 2002. Vol. 36. N 9. P. 465.
Slovak Republic, 2002.
doi 10.1023/A:1021836504036
52.
Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
40.
Моряшова С.И., Саламандра Л.К., Федоров А.Е.,
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
Родиновская Л.А., Шестопалов А.М., Семенов В.В. //
N 11. P. 3099. doi 10.1021/ci300367a
Изв. АН. Сер. хим. 1998. № 2. С. 365; Moryashova
53.
Литвинов В.П., Кривоколыско С.Г., Руcанов Э.Б. //
S.I, Salamandra L.K., Fedorov A.E., Rodinovskaya L.A.,
Докл. АН. 2001. Т. 377. № 4. С. 493; Litvinov V.P.,
Shestopalov A.M., Semenov V.V. // Russ. Chem. Bull.
Krivokolysko S.G., Rusanov E.B. // Doklady
1998. Vol. 47. N 2. P. 357. doi 10.1007/BF02498968
Chem.
2001. Vol.
377. N
4-6. P.
94. doi
41.
Osolodkin D.I., Kozlovskaya L.I., Dueva E.V., Dotsen-
10.1023/A:1019205013304.
ko V.V., Rogova Y.V., Frolov K.A., Krivokolysko S.G.,
54.
Кривоколыско С.Г., Дяченко В.Д., Чернега А.Н.,
Romanova E.G., Morozov A.S., Karganova G.G.,
Литвинов В.П. // Изв. АН. Сер. Хим. 2000. № 4.
Palyulin V.A., Pentkovski V.M., Zefirov N.S. // ACS
С. 733; Krivokolysko S.G., Dyachenko V.D., Cher-
Med. Chem. Lett. 2013. Vol. 4. N 9. P. 869. doi 10.1021/
nega A.N., Litvinov V.P. // Russ. Chem. Bull. 2000.
ml400226s
Vol. 49. N 4. P. 736. doi 10.1007/BF02495493
42.
Бибик Е.Ю., Ярошевская О.Г., Девдера А.В., Демен-
55.
Кривоколыско С.Г., Дяченко В.Д., Нестеров В.Н.,
ко А.В., Захаров В.В., Фролов К.А., Доценко В.В.,
Шаранин Ю.А., Стручков Ю.Т. // ЖОрХ. 1999.
Кривоколыско С.Г. // Хим.-фарм. ж. 2017. Т. 51. № 8.
Т.35. № 6. С. 966; Krivokolysko S.G., Dyachenko V.D.,
С. 16; Bibik E.Yu., Yaroshevskaya O.G., Devdera A.V.,
Nesterov V.N., Sharanin Yu.A., Struchkov Yu.T. // Russ.
Demenko A.V., Zakharov V.V., Frolov K.A., Dotsenko
J. Org. Chem. 1999. Vol. 35. N 6. P. 942.
V.V., Krivokolysko S.G. // Pharm. Chem. J. 2017. Vol.
56.
Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П. //
51. N 8. P. 648. doi 10.1007/s11094-017-1669-1
Изв. АН. Сер. хим. 2000. № 3. С. 485; Krivokolys-
43.
Bibik E.Yu., Saphonova A.A., Yeryomin A.V., Frolov K.A.,
ko S.G., Dyachenko V.D., Litvinov V.P. // Russ.
Dotsenko V.V., Krivokolysko S.G. // Res. Results
Chem. Bull. 2000. Vol. 49. N 3. P. 487. doi 10.1007/
Pharmacol. 2017. Vol. 3. N 4. P. 20. doi 10.18413/2313-
BF02494780
8971-2017-3-4-20-25
57.
Ramabadran K., Bansinath M., Turndorf H., Puig M.M.
44.
Бибик Е.Ю., Некраса И.А., Деменко А.В., Фролов К.А.,
// J. Pharm. Methods. 1989, Vol. 21. N 1. P. 21. doi
Доценко В.В., Кривоколыско С.Г. // Бюлл. Сиб. Мед.
10.1016/0160-5402(89)90019-3
2019. Т. 18. № 3. С. 21. doi 10.20538/1682-0363-
58.
Sewell R.D.E., Spencer P.S.J. // Neuropharmacology.
2019-3-21-28; Bibik E.Yu., Nekrasa I.A., Demenko A.V.,
1976. Vol. 15. N 11. P. 683. doi 10.1016/0028-
Frolov K.A., Dotsenko V.V., Krivokolysko S.G. // Bull.
3908(76)90037-X
Sib. Med. 2019. Vol. 18. N 3. P. 21. doi 10.20538/1682-
59.
Kotlinska J.H., Gibula-Bruzda E., Witkowska E.,
0363-2019-3-21-28
Chung N.N., Schiller P.W., Izdebski J. // Peptides. 2013.
45.
Rice W.G., Turpin J.A., Schaeffer C.A., Graham L.,
Vol. 39. P. 103. doi 10.1016/j.peptides.2012.11.008
Clanton D., Buckheit R.W., Zaharevitz D., Sum-
60.
Hamura H., Yoshida M., Shimizu K., Matsukura T.,
mers M.F., Wallqvist A., Covell D.G. // J. Med. Chem.
Suzuki H., Narita M., Suzuki T. // Jap. J. Pharmacol.
1996. Vol. 39. N 19. P. 3606. doi 10.1021/jm960375o
2000. Vol. 83. N 4. P. 286. doi 10.1254/jjp.83.286
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
204
БИБИК и др.
61. Raboisson P., Dallel R. // Neurosci. Biobehav.
67. Нестерова И.Н., Шахназаров A.K., Позняк A.M.,
Rev. 2004. Vol. 28. N 2. P. 219. doi 10.1016/j.
Лакоза М.И., Шемерянкин Б.В., Граник В.Г. //
neubiorev.2003.12.003
Хим.-фарм. ж. 1994. Т. 28. № 8. С. 41; Nestero-
62. Pereira P.J.S., Dornelles F.N., Santos D.S.,
va I.N., Shanazarov A.K., Poznyak A.M., Lakoza M.I.,
Calixto J.B., Morrone F.B., Campos M.M. // Int.
Immunopharmacol. 2009. Vol. 9. N 1. P. 80. doi
Shemeryankin B.V., Granik V.G. // Pharm. Chem. J.
10.1016/j.intimp.2008.10.001
1994. Vol. 28. N 8. P. 583. doi 10.1007/BF02219035
63. Le Bars D., Gozariu M., Cadden S.W. // Ann. Fr. Anesth.
68. Каркищенко Н.Н., Грачев С.В. Альтернативы биоме-
Reanim. 2001. Vol. 20. N 4. P. 347. doi 10.1016/S0750-
дицины. Руководство по лабораторным животным и
7658(01)00381-1
альтернативным моделям в биомедицинских техно-
64. Krzyzanowska A., Avendaño C. // Brain Behav. 2012.
Vol. 2. N 5. P. 678. doi 10.1002/brb3.85
логиях М.: Профиль, 2010, С. 26.
65. Clavelou P., Dallel R., Orliaguet T., Woda A., Rabois-
69. Хабриев Р.У. Руководство по экспериментальному
son P. // Pain. 1995. Vol. 62. N 3. P. 295. doi
(доклиническому) изучению новых фармакологиче-
10.1016/0304-3959(94)00273-H
ских средств. М.: Медицина, 2005. С. 338.
66. Brunskill J.S.A., De A., Ewing D.F. // J. Chem. Soc.
70. Кобзарь А.И. Прикладная математическая статистика.
Perkin Trans. 1. 1978. N 6. P. 629. doi 10.1039/
P19780000629
М.: Физматлит, 2006. C. 454.
Synthesis and Analgesic Activity of New Heterocyclic
Cyanothioacetamide Derivatives
I. V. Bibika, E. Yu. Bibikb, V. V. Dotsenkob,c,*, K. A. Frolovb, S. G. Krivokolyskob, N. A. Aksenovc,
I. V. Aksenovac, S. V. Shcherbakovc, and S. N. Ovcharovc
a Belgorod State National Research University, Belgorod, 308015 Russia
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
*e-mail: victor_dotsenko_@mail.ru
Received December 16, 2020; revised December 16, 2020; accepted December 28, 2020
The reaction of cyanothioacetamide with aromatic aldehydes and 1,3-dicarbonyl compounds followed by
aminomethylation or S-alkylation gave a series of heterocyclic derivatives with a 1,2,3,4-tetrahydropyridine or
1,4,5,6,7,8-hexahydroquinoline fragment. The resulting compounds were tested for analgesic activity in vivo.
Some of the prepared compounds showed an antinociceptive effect superior to that of ketorolac in dynamics.
Keywords: cyanothioacetamide, Mannich reaction, pyrido[2,1-b][1,3,5]thiadiazines, 2-oxo-3-cyano-1,4,5,6-tet-
rahydropyridine-2-thiolates, analgesics
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021