ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 205-211
УДК 547.391.1;547.414.8;547.442;547.72
ОПТИМИЗАЦИЯ СИНТЕЗА
БЕНЗО[b]ФУРАН-3-КАРБОКСИЛАТОВ НА ОСНОВЕ
АЛКИЛ-3-БРОМ-3-НИТРОАКРИЛАТОВ
© 2021 г. В. В. Пелипкоa, Р. И. Байчуринa, Е. В. Кондрашовb, С. В. Макаренкоa,*
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
b Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
Иркутск, 664033 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 5 ноября 2020 г.
После доработки 5 ноября 2020 г.
Принято к печати 20 ноября 2020 г.
Оптимизированы условия синтеза 4-оксо-4,5,6,7-тетрагидро-1-бензофуран-3-карбоксилатов на основе ре-
акций алкил-3-бром-3-нитроакрилатов с представителями циклических СН-кислот - циклогексан-1,3-ди-
оном, 5,5-диметилциклогексан-1,3-дионом. Проведена оценка возможных направлений взаимодействия с
использованием квантово-химических расчетов [B3LYP/6-311+G(d,p) с учетом эффектов растворителя].
Ключевые слова: нитроакрилат, 3-бром-3-нитроакрилат, тандемный процесс, циклогексан-1,3-дионы,
бензо[b]фуран-3-карбоксилаты
DOI: 10.31857/S0044460X21020037
Конденсированные производные фурана при-
золсодержащих субстратов [6-12], формирования
влекают к себе большое внимание благодаря
бензольного кольца при фурановом цикле [13,
широкому распространению в природе и воз-
14], введением сложноэфирной функции в бензо-
можности их практического использования. Так,
фурановую структуру [15-17] и некоторыми дру-
производные бензо[b]фурана встречаются в ка-
гими путями [18, 19]. В свою очередь, 4,5,6,7-те-
менноугольной смоле, нефти, продуктах их пере-
трагидробензофуранкарбоксилаты [20-22] и их
работки [1]. Большое содержание производных
4-оксопроизводные
[23-28] получаются путем
бензо[b]фурана обнаруживается у высших расте-
циклизации неароматических субстратов или
ний, например, сложноцветных [2]. Вместе с тем,
ароматизации
2,3,4,5,6,7-гексагидроформ. По-
среди соединений, содержащих в своей структуре
следнее направление реализуется и при взаимо-
бензофурановый фрагмент, найдены представите-
действии представителя гем-галогеннитроалке-
ли, оказывающие противовоспалительное и про-
нов - 2-(5-нитрофуран-2-ил)-1-бром-1-нитроэтена
тивоопухолевое действие, проявляющие цитоток-
с циклогексан-1,3-дионом (дигидрорезорцином) и
сическую, антибактериальную, антиоксидантную,
5,5-диметилциклогексан-1,3-дионом (димедоном),
противопаразитарную, противовоспалительную
и завершается получением 4-оксо-4,5,6,7-тетраги-
активность, кроме того, известны соединения об-
дробензофуранов [29].
ладающие действием против вируса гепатита С и
Использование представителя функциона-
ВИЧ [3, 4].
лизированных гем-галогеннитроалкенов
- ме-
Бензо[b]фуран-3-карбоксилаты [5] получаются
тил-3-бром-3-нитроакрилата 1a - в реакции с
преимущественно путем гетероциклизации бен-
дигидрорезорцином и димедоном позволило по-
205
206
ПЕЛИПКО и др.
Схема 1.
лучить метил-4-оксо-4,5,6,7-тетрагидро-1-бензо-
оценка барьеров образования и термодинамиче-
фуран-3-карбоксилаты c выходом 60 и 84% соот-
ской устойчивости возможных конфигурационных
ветственно при кипячении в безводном метаноле
изомеров промежуточных гексагидробензофу-
в течение 6 ч в присутствии ацетата калия (экви-
рановых (Б) и циклопропановых (Г) структур на
мольное соотношение реагентов) [30]. Вовлечение
примере взаимодействия метил-3-бром-3-нитроа-
этил-3-бром-3-нитроакрилата 1б в реакцию с ди-
крилата 1a с дигидрорезорцином. Квантово-хими-
медоном в вышеуказанных условиях привело к по-
ческие расчеты проводили методом функционала
лучению смеси двух продуктов, согласно данным
плотности B3LYP в базисе 6-311+G(d,p) с учетом
ЯМР 1Н, разделить которую не удалось (схема 1).
эффектов растворителя в приближении поляри-
Теоретически, данное взаимодействие могло
зационного континуума (PCM) с использованием
привести к образованию тетрагидробензофуран-
программного пакета Gaussian 09.
карбоксилатов В по аналогии с работой [29], их
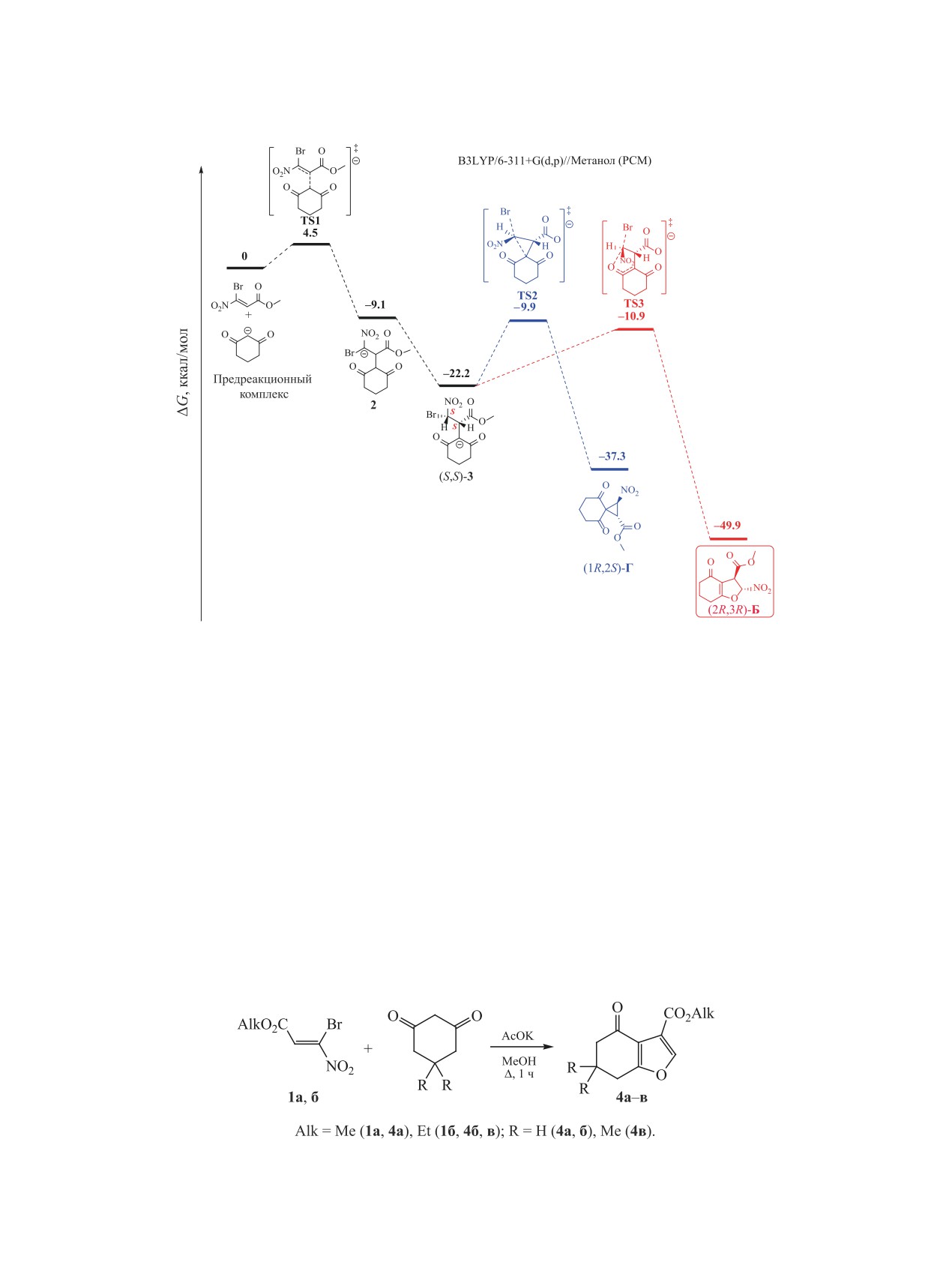
В результате проведенных исследований ока-
гексагидронитропредшественников Б в соответ-
залось, что направление реакции контролируется
ствии с работами [31-35] или спироциклопропан-
термодинамической устойчивостью гексагидрони-
карбоксилатов Г подобно описанным в работе [36].
тробензофуранкарбоксилатов Б. Так, циклизация
Анализ спектра ЯМР 1Н полученной смеси по-
промежуточного аниона (аддукт 3 S,S- или S,R-кон-
зволил выделить сигналы этил-6,6-диметил-4-ок-
фигурации) может протекать через стадию образо-
со-4,5,6,7-тетрагидробензофуран-3-карбоксилата
вания близких по энергии переходных состояний
(структура В, синглет при 7.88 м. д.) и, вероятно,
TS2, TS3 (12.3, 11.3 ккал/моль) или TS4, TS5 (15.3,
этил-6,6-диметил-2-нитро-4-оксо-2,3,4,5,6,7-гек-
15.8 ккал/моль) (рис. 1, 2). Однако формирование
сагидробензофуранкарбоксилата
(структура
гексагидробензофурановых продуктов (2R,3R)-Б
Б, два дублета при 4.29 и 6.29 м. д., 3J 2.1 Гц).
и (2S,3R)-Б энергетически более предпочтительно
Действительно, в спектрах ЯМР 1Н близких по
на 12.6 и 13.5 ккал/моль соответственно по сравне-
структуре
3-арил-6,6-диметил-2-нитро-4-оксо-
нию с циклопропанами (1R,2S)-Г и (1S,2S)-Г.
2,3,4,5,6,7-гексагидробензофуранов, получаемых
При этом, как и следовало ожидать, энергии
при взаимодействии гем-галогеннитростиролов с
переходных состояний TS4 и TS5, приводящих к
циклогексан-1,3-дионами, присутствуют два ду-
продуктам с цис-расположением заместителей,
блета метиновых протонов дигидрофуранового
оказались на 3-4.5 ккал/моль выше соответствую-
цикла в областях 4.5-4.7 и 5.9-6.2 м. д. (3J 1.7-
щих барьеров (TS2 и TS3) образования транс-про-
2.1 Гц) [31-35].
дуктов вследствие стерического влияния замести-
Для предсказания регионаправленности вну-
телей. По этой же причине относительные энергии
тримолекулярной циклизации нами проведена
цис-продуктов (1S,2S)-Г и (2S,3R)-Б выше на 2.6-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
ОПТИМИЗАЦИЯ СИНТЕЗА БЕНЗО[b]ФУР
АН-3-КАРБОКСИЛАТОВ
207
Рис. 1. Диаграмма изменения свободной энергии в реакции метил-3-бром-3-нитроакрилата 1a с дигидрорезорцином на
примере циклизации (S,S)-диастереомера аддукта 3 по данным B3LYP/6-311+G(d,p) в метаноле в приближении PCM.
3.5 ккал/моль по сравнению с транс-продуктами
Вместе с тем, увеличение количества исполь-
(1R,2S)-Г и (2R,3R)-Б.
зуемого плавленого ацетата калия (бромнитро-
акрилат:СН-кислота:AcOK = 1:1:1.5) позволило
Таким образом, литературные данные
получить индивидуальные тетрагидробензофу-
и результаты квантово-химических расче-
тов подтверждают возможность получения
ранкарбоксилаты 4a-в с высокими выходами (69-
95%), при этом время реакции удалось сократить
транс-2-нитро-4-оксо-6,6-диметил-2,3,4,5,6,7-гек-
до 1 ч (схема 2).
сагидробензофуранкарбоксилата и этил-4-ок-
со-6,6-диметил-4,5,6,7-тетрагидробензофуран-3-
Отметим, что соединения 4б, в ранее были по-
карбоксилата (соотношение 4:1, по данным ЯМР
лучены другими методами с выходами от 10 до
1Н) в реакции этил-3-бром-3-нитроакрилата 1б с
96% [23-26]. Физико-химические характеристи-
дигидрорезорцином при использовании эквимоль-
ки полученных нами образцов 4a-в согласуются
ного соотношения реагентов (схема 1).
с литературными данными [23, 26, 30], при этом
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
208
ПЕЛИПКО и др.
Рис. 2. Диаграмма изменения свободной энергии в реакции метил-3-бром-3-нитроакрилата 1a с дигидрорезорцином на
примере циклизации (S,R)-диастереомера аддукта 3 по данным B3LYP/6-311+G(d,p) в метаноле в приближении PCM.
отнесение сигналов в спектрах ЯМР 1Н и 13С вы-
и С7а фуранового цикла образуют кросс-пики С2H/
полнено нами на основании результатов экспери-
C2 (7.86 м. д./147.92 м. д.) в спектре 1Н-13С HMQC,
ментов 1Н-13С HMQC и HMBC. Так, для соедине-
С2H/C3 (7.86 м. д./117.52 м. д.), С2H/C3a (7.86 м. д./
ния 4б сигналы протона С2Н и атомов С2, С3, С3а
118.80 м. д.) и С2H/C7а (7.86 м. д./168.49 м. д.) в
спектре 1Н-13С HMBC (рис. 3). Мультиплетный
сильнопольный сигнал протонов С6Н2 шестичлен-
ного цикла, закономерно, дает кросс-пики с сигна-
лами атомов С5, С7, С7а и С4 (2.13-2.19 м. д./38.79,
23.70, 168.49 и 192.21 м. д.), слабопольный три-
плет протонов С7Н2 имеет кросс-пики с атома-
ми С5, С6, С3а, С7а (2.89 м. д./38.79, 22.25, 118.80,
168.49 м. д.), а мультиплетный сигнал протонов
С5Н2 образует ожидаемые кросс-пики с сигналами
атомов С6, С7, С3а и С4 (2.50-2.56 м. д./22.25, 23.70,
118.80 и 192.21 м. д.) в спектре 1Н-13С HMBC; при
этом такие сочетания кросс-пиков дополнительно
подтверждают принятое нами отнесение протонов
метиленовых групп кольца циклогексенона. Также
Рис. 3. Основные корреляции с непротонированными
следует отметить наблюдаемый в спектре 1Н-13С
атомами углерода в спектре 1Н-13С HMBC соединения
4б.
HMBC кросс-пик протонов ОСН2 и карбонильного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
ОПТИМИЗАЦИЯ СИНТЕЗА БЕНЗО[b]ФУР
АН-3-КАРБОКСИЛАТОВ
209
атома углерода сложноэфирной группы (4.31 м. д./
(0.95 ммоль) бромнитроакрилата 1a в 5 мл безво-
162.01 м. д.). Аналогичные закономерности на-
дного метанола. Полученную смесь кипятили в
блюдаются и в спектрах 1Н-13С HMQC и HMBC
течение 1 ч, затем выливали на измельченный лед
экспериментов для соединений 4a, в.
и экстрагировали хлороформом (3×20 мл). Экс-
Полученные нами данные УФ спектроскопии
тракт сушили сульфатом магния. После удаления
для этилфуранкарбоксилатов 4б, в, закономерно,
растворителя получали кристаллический продукт.
оказались близки таковым для известных метило-
Выход 0.176 г (95%), т. пл. 93-94°С (п-C6H14)
вых эфиров [30].
(т. пл. 93-94°С [30]).
Таким образом, нами разработаны оптималь-
Этил-4-оксо-4,5,6,7-тетрагидро-1-бензофу-
ные условия получения тетрагидробензофу-
ран-3-карбоксилат (4б) получали аналогично из
ран-3-карбоксилатов на основе взаимодействия
0.150 г (1.34 ммоль) циклогексан-1,3-диона, 0.197
алкил-3-бром-3-нитроакрилатов с циклогек-
г (2.01 ммоль) плавленого ацетата калия и 0.300 г
сан-1,3-дионами. Маршрут образования фурано-
(1.34 ммоль) бромнитроакрилата 1б. Растворитель
вых структур и альтернативных продуктов обо-
упаривали при пониженном давлении, получали
снован квантово-химическими расчетами.
0.248 г (89%) сырого масла, которое хроматогра-
фировали (п-С6H14:EtOAc = 2:1). Выход 0.190 г
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(69%), т. пл. 41-44°С (п-C6H14) (т. пл. 58°С [26]).
Спектры ЯМР 1Н, 13С{1H}, 1Н-13С HMQC,
ИК спектр, ν, см-1: 1687 пл, 1693 с, 1735 с (C=O).
1Н-13С HMBC зарегистрированы в CDCl3 на спек-
УФ спектр (EtOH), λmax, нм [ε, л/(моль·см)]: 257
трометре Jeol ECX400A с рабочими частотами
[6300]. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.34 т
399.78 (1H) и 100.53 (13С) МГц. В качестве стандар-
(3Н, CH3CH2O, 3J 7.1 Гц), 2.13-2.19 м (2Н, Н6),
та использованы остаточные сигналы недейтери-
2.50-2.56 м (2Н, Н5), 2.89 т (2Н, Н7, 3J 6.3 Гц), 4.31
рованного растворителя. Колебательные спектры
к (2H, CH3CH2O, 3J 7.1 Гц), 7.86 с (1Н, Н2). Спектр
записаны на ИК Фурье-спектрометре Shimadzu
ЯМР 13C (CDCl3), δС, м. д.: 14.29 (CH3CH2O),
IRPrestige-21 в СHCl3 (с 20 мг/мл). Электронные
22.25 (С6), 23.70 (С7), 38.79 (С5), 61.06 (CH3CH2O),
спектры поглощения записаны на спектрофотоме-
117.52 (C3), 118.80 (С3а), 147.92 (С2), 162.01 (C=O),
тре Shimadzu UV2401PC в неразборных кварцевых
168.49 (С7а), 192.21 (C4=O). Найдено, %: С 63.02;
кюветах (l 0.101 cм) в этаноле. Элементный ана-
H 5.71. C11H12O4. Вычислено, %: С 63.45; H 5.81.
лиз проведен на анализаторе EuroVector EA3000
Этил-6,6-диметил-4-оксо-4,5,6,7-тетраги-
(CHN Dual). Соединения 4б, в выделены методом
дро-1-бензофуран-3-карбоксилат
(4в) получа-
колоночной хроматографии на силикагеле MN
ли аналогично из 0.187 г (1.34 ммоль) 5,5-диме-
Kieselgel 60 (140-270 меш) c использованием сме-
тилциклогексан-1,3-диона, 0.197 г (2.01 ммоль)
си растворителей п-С6Н14-EtOAc. Контроль за хо-
плавленого ацетата калия и 0.300 г (1.34 ммоль)
дом реакций и чистотой полученных соединений
бромнитроакрилата
1б. Растворитель упарива-
осуществлен методом ТСХ на пластинах Silufol
ли при пониженном давлении, получали 0.284 г
UV-254 в системе п-С6Н14-EtOAc (2:1), проявле-
(90%) сырого масла, которое хроматографировали
ние в УФ свете (λ 254 нм).
(п-С6H14:EtOAc = 3:1). Выход 0.240 г (84%), Rf 0.67
Квантово-химические расчеты проведены с ис-
(п-С6H14:EtOAc = 3:1). ИК спектр, ν, см-1: 1687
пользованием программного комплекса Gaussian
с, 1734 с (C=O). УФ спектр (EtOH), λmax, нм [ε,
09 [37].
л/(моль·см)]: 258 [5600]. Спектр ЯМР 1Н (CDCl3),
Алкил-3-бром-3-нитроакрилаты 1a, б получали
δ, м. д.: 1.11 с (6Н, СН3), 1.33 т (3Н, CH3CH2O,
по модифицированной нами методике [38].
3J 7.1 Гц), 2.41 с (2Н, Н5), 2.74 с (2Н, Н7), 4.30 к
Метил-4-оксо-4,5,6,7-тетрагидро-1-бензо-
(2H, CH3CH2O, 3J 7.1 Гц), 7.88 с (1Н, Н2). Спектр
фуран-3-карбоксилат (4a). К раствору 0.107 г
ЯМР 13C (CDCl3), δС, м. д.: 14.30 (CH3CH2O), 28.46
(0.95 ммоль) циклогексан-1,3-диона и 0.140 г
(2CH3), 35.02 (С6), 37.58 (С7), 53.19 (С5), 61.03
(1.43 ммоль) плавленого ацетата калия в 5 мл
(CH3CH2O), 117.38 (C3), 117.71 (С3а), 148.45 (С2),
безводного метанола добавляли раствор 0.200 г
161.99 (C=O), 167.64 (С7а), 191.75 (C4=O). Найде-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
210
ПЕЛИПКО и др.
но, %: С 66.31; H 6.81. C13H16O4. Вычислено, %: С
10.
Сахабутдинова Г.Н., Раскильдина Г.З., Злот-
66.09; H 6.83.
ский С.С., Султанова Р.М. // ЖОрХ. 2018. Т. 54.
№ 12. С. 1758; Sakhabutdinova G.N., Raskil’dina G.Z.,
БЛАГОДАРНОСТЬ
Zlotskii S S., Sultanova R.M. // Russ. J. Org.
Chem. 2018. Vol. 54. N 12. P. 1772. doi 10.1134/
Физико-химические исследования выполнены
S1070428018120059
с использованием оборудования Центра коллек-
11.
Zhou L., Shi Y., Zhu X., Zhang P. // Tetrahedron
тивного пользования факультета химии Россий-
Lett. 2019. Vol. 60. N 30. P. 2005. doi 10.1016/j.
ского государственного педагогического универ-
tetlet.2019.06.054
ситета им. А. И. Герцена.
12.
Khan F., Fatima M., Shirzaei M., Vo Y., Amarasiri M.,
ФОНДОВАЯ ПОДДЕРЖКА
Banwell M.G., Ma C., Ward J.S., Gardiner M.G. // Org.
Lett. 2019. Vol. 21. N 16. P. 6342. doi 10.1021/acs.
Работа выполнена при финансовой поддерж-
orglett.9b02235
ке Министерства просвещения России (проект №
13.
Rosa C.D., Kneeteman M.N., Mancini P.M.E. //
FSZN-2020-0026).
Tetrahedron Lett. 2005. Vol. 46. N 50. P. 8711. doi
10.1016/j.tetlet.2005.10.042
КОНФЛИКТ ИНТЕРЕСОВ
14.
Huang W., Xu J., Liu C., Chen Z., Gu Y. // J. Org.
Авторы заявляют об отсутствии конфликта ин-
Chem. 2019. Vol. 84. N 5. P. 2941. doi 10.1021/acs.
тересов.
joc.9b00270
15.
Cao Y.-F., Li L.-J., Liu M., Xu H., Dai H.-X. // J. Org.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Chem. 2020. Vol. 85. N 6. P. 4475. doi 10.1021/acs.
Дополнительные материалы для этой статьи
joc.0c00198
доступны по doi
10.31857/S0044460X21020037
16.
He W., Zhang Y., Bao J., Deng X., Batara J., Casey S.,
Guo Q., Jiang F., Fu L. // Bioorg. Med. Chem. 2017.
для авторизованных пользователей.
Vol. 25. N 4. P. 1341. doi 10.1016/j.bmc.2016.12.030
СПИСОК ЛИТЕРАТУРЫ
17.
Shigeno M., Sasaki K., Nozawa-Kumada K., Kondo Y.
// Org. Lett. 2019. Vol. 21. N 12. P. 4515. doi 10.1021/
1. Cagniant P., Cagniant D. // Adv. Heterocycl.
acs.orglett.9b01386
Chem. 1975. Vol. 18. P. 337. doi 10.1016/S0065-
18.
Sha Q., Liu H. // Org. Biomol. Chem. 2019. Vol. 17.
2725(08)60132-4
2. Miao Y.-h., Hu Y.-h., Yang J., Liu T., Sun J., Wang X.-j.
P. 7547. doi 10.1039/c9ob01422e
19.
Huang W., Xu J., Liu C., Chen Z., Gu Y. // J. Org.
// RSC Adv. 2019. Vol. 9. N 47. P. 27510. doi 10.1039/
Chem. 2019. Vol. 84. N 5. P. 2941. doi 10.1021/acs.
C9RA04917G
3. Shamsuzzaman H.K. // Eur. J. Med. Chem. 2015. Vol.
joc.9b00270
97. P. 483. doi 10.1016/j.ejmech.2014.11.039
20.
Gabriele B., Mancuso R., Maltese V., Veltri L., Saler-
no G. // J. Org. Chem. 2012. Vol. 77. N 19. P. 8657. doi
4. Dawood K.M. // Expert Opinion on Therapeutic
Patents
2019. Vol.
29. N
11. P.
841. doi
10.1021/jo301628n
10.1080/13543776.2019.1673727
21.
Zhou Z., Walleser P.M., Tius M.A. // Chem. Comm.
5. Литвинова В.А., Тихомиров А.С. // ХГС. 2019. Т. 55.
2015. Vol. 51. P. 10858. doi 10.1039/C5CC04051E
№ 8. С. 689; Litvinova V.A., Tikhomirov A.S. // Chem.
22.
Bakshi D., Singh A. // Org. Biomol. Chem. 2017.
Heterocycl. Compd. 2019. Vol. 55. N 8. P. 689. doi
Vol. 15. N 15. P. 3175. doi 10.1039/C7OB00248C
10.1007/s10593-019-02520-7
23.
Lee Y.R., Yoon S.H. // Synth. Commun. 2006. Vol. 36.
6. Melkonyan F.S., Golantsov N.E.. Karchava A.V. //
N 14. P. 1941. doi 10.1080/00397910600631957
Heterocycles. 2008. Vol. 75. N 12. P. 2973. doi 10.3987/
24.
24 Ranu B.C., Adak L., Banerjee S. // Tetrahedron
COM-08-11458
Lett. 2008. Vol. 49. N 31. P. 4613. doi 10.1016/j.
7. Kusakabe T., Sekiyama E., Ishino Y., Motodate S.,
tetlet.2008.05.083
Kato S., Mochida T., Kato K. // Synthesis. 2012. Vol. 44.
25.
Ghazvini M., Shahvelayati A.S., Sabri A., Nasra-
N 12. P. 1825. doi 10.1055/s-0031-1290805
badi F.Z. // Chem. Heterocycl. Compd. 2016. Vol. 52.
8. Liu Y., Wang H., Wan J.-P. // J. Org. Chem. 2014.
N 3. P. 161. doi 10.1007/s10593-016-1854-2
Vol. 79. N 21. P.10599. doi 10.1021/jo5017508
26.
Peng Y., Luo J., Feng Q., Tang Q. // Eur. J. Org. Chem.
9. Sun P., Gao S., Yang C., Guo S., Lin A., Yao H. // Org.
2016. N 30. P. 5169. doi 10.1002/ejoc.201600975
Lett. 2016. Vol. 18. N 24. P. 6464. doi 10.1021/acs.
27.
Ballini R., Gabrielli S., Palmieri A. // Synlett. 2010.
orglett.6b03355
N 16. P. 2468. doi 10.1055/s-0030-1258031
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
ОПТИМИЗАЦИЯ СИНТЕЗА БЕНЗО[b]ФУР
АН-3-КАРБОКСИЛАТОВ
211
28.
Vojacek S., Schulig L., Wössner N., Geist N., Langel W.,
36.
Barkov A.Y., Korotaev V.Y., Sosnovskikh V.Y. //
Jung M., Schade D., Link A. // ChemMedChem 2019.
Tetrahedron Lett. 2013. Vol. 54. N 32. P. 4181. doi
Vol. 14. N 8. P. 853. doi 10.1002/cmdc.201900054
10.1016/j.tetlet.2013.05.129
29.
Берестовицкая В.М., Макаренко С.В., Лысенко К.А.,
37.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Елисеенко С.С., Байчурин Р.И. // ЖОрХ. 2015. Т. 51.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Вып. 9. С. 1312; Berestovitskaya V.M., Makarenko S.V.,
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Lyssenko K.A., Eliseenko S.S., Baichurin R.I. // Russ. J.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Org. Chem. 2015. Vol. 51. N 9. P. 1286. doi 10.1134/
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fuku-
S1070428015090134
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
30.
Пекки А.И., Макаренко С.В., Алтухов К.В., Бере-
Kitao O., Nakai H., Vreven T., Montgomery J.A. Jr.,
стовицкая В.М. // ЖОХ. 2010. Т. 80. Вып. 5. С. 877;
Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
Pekki A.I., Makarenko S.V., Altukhov K.V.,
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
Berestovitskaya V.M. // Russ. J. Gen. Chem. 2010. Vol. 80
N 5. P. 1048. doi 10.1134/S1070363210050361
Normand J., Raghavachari K., Rendell A., Burant J.C.,
31.
Dauzonne D., Demerseman P.J. // Heterocycl.
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
Chem. 1990. Vol. 27. N 6. P. 1581. doi 10.1002/
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
jhet.5570270611
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
32.
Трухин Е.В., Макаренко С.В., Берестовицкая В.М. //
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
ЖОрХ. 1998. Т. 34. Вып. 1. С. 72; Trukhin E.V.,
Martin R.L., Morokuma K., Zakrzewski V.G.,
Makarenko S.V., Berestovitskaya V.M. // Russ. J. Org.
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
Chem. 1998. Vol. 34. P. 59.
Daniels A.D., Farkas Ö., Foresman J.B., Ortiz J.V.,
33.
Трухин Е.В., Шеремет Е.А., Берестовицкая В.М. //
Cioslowski J., Fox D.J. Gaussian 09, Revision C.01,
Изв. АН. Сер. хим. 2009. № 10. С. 1973; Trukhin E.V.,
2010, Gaussian, Inc., Wallingford, CT.
Sheremet E.A., Berestovitskaya V.M. // Russ. Chem.
38.
Саркисян З.М., Садиков К.Д., Смирнов A.C., Ку-
Bull. 2009. Vol. 58. N 10. P. 2035. doi 10.1007/s11172-
жаева A.A., Макаренко С.В., Анисимова H.A.,
009-0278-x
Дейко Л.И., Берестовицкая В.М. // ЖОрХ. 2004.
34.
Fan L.-P., Li P., Li X.-S., Xu D.-C., Ge M.-M., Zhu W.-D.,
Т. 40. Вып. 6. С. 944; Sarkisyan Z.M., Sadikov K.D.,
Xie J.-W. // J. Org. Chem. 2010. Vol. 75. N 24. P. 8716.
doi 10.1021/jo101935k
Smirnov A.S., Kuzhaeva A.A., Makarenko S.V.,
35.
Xie J.-W., Li P., Wang T., Zhou F.-T. // Tetrahedron
Anisimova N.A., Deiko L.I., Berestovitskaya V.M. //
Lett. 2011. Vol. 52. N 18. P. 2379. doi 10.1016/j.
Russ. J. Org. Chem. 2004. Vol. 40. N 6. P. 908. doi
tetlet.2011.02.093
10.1023/B:RUJO.0000044559.83690.b4
Optimization of the Synthesis of Benzo[b]furan-3-carboxylates
Based on Alkyl 3-Bromo-3-nitroacrylates
V. V. Pelipkoa, R. I. Baichurina, E. V. Kondrashovb, and S. V. Makarenkoa,*
a Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
bA. E. Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk, 664033 Russia
*e-mail: kohrgpu@yandex.ru
Received November 5, 2020; revised November 5, 2020; accepted November 20, 2020
The conditions were optimized for the synthesis of 4-oxo-4,5,6,7-tetrahydro-1-benzofuran-3-carboxylates
based on the reactions of alkyl 3-bromo-3-nitroacrylates with cyclic СН-acids such as cyclohexane-1,3-dione
and 5,5-dimethylcyclohexane-1,3-dione. Possible reaction pathways were estimated using quantum chemical
calculations [B3LYP/6-311+G(d,p) taking into account solvent effects].
Keywords: nitroacrylate, 3-bromo-3-nitroacrylate, tandem process, cyclohexane-1,3-diones, benzo[b]fu-
ran-3-carboxylates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021