ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 212-220
УДК 546.224-31:547.388.2:547.281.1
АМИНОМЕТАНСУЛЬФОКИСЛОТЫ -
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ В СИСТЕМАХ
SO2-NH2Alk-CH2O-H2O: СИНТЕЗ И СТРОЕНИЕ
© 2021 г. Р. Е. Хомаa,b,*, В. О. Гельмбольдтc, В. Н. Баумерd, А. А. Эннанa, С. В. Водзинскийa,b,
Ю. В. Ишковb, И. М. Ракиповe
a Физико-химический институт защиты окружающей среды и человека Национальной академии наук Украины,
ул. Преображенская 3, Одесса, 65082 Украина
b Одесский национальный университет имени И. И. Мечникова, Одесса, 65082 Украина
c Одесский национальный медицинский университет, Одесса, 65082 Украина
d Научно-технический комплекс «Институт монокристаллов Национальной академии наук Украины»,
Харьков, 61001 Украина
e Физико-химический институт имени А. В. Богатского Национальной академии наук Украины,
Одесса, 65080 Украина
*e-mail: rek@onu.edu.ua
Поступило в Редакцию 13 ноября 2020 г.
После доработки 13 ноября 2020 г.
Принято к печати 22 ноября 2020 г.
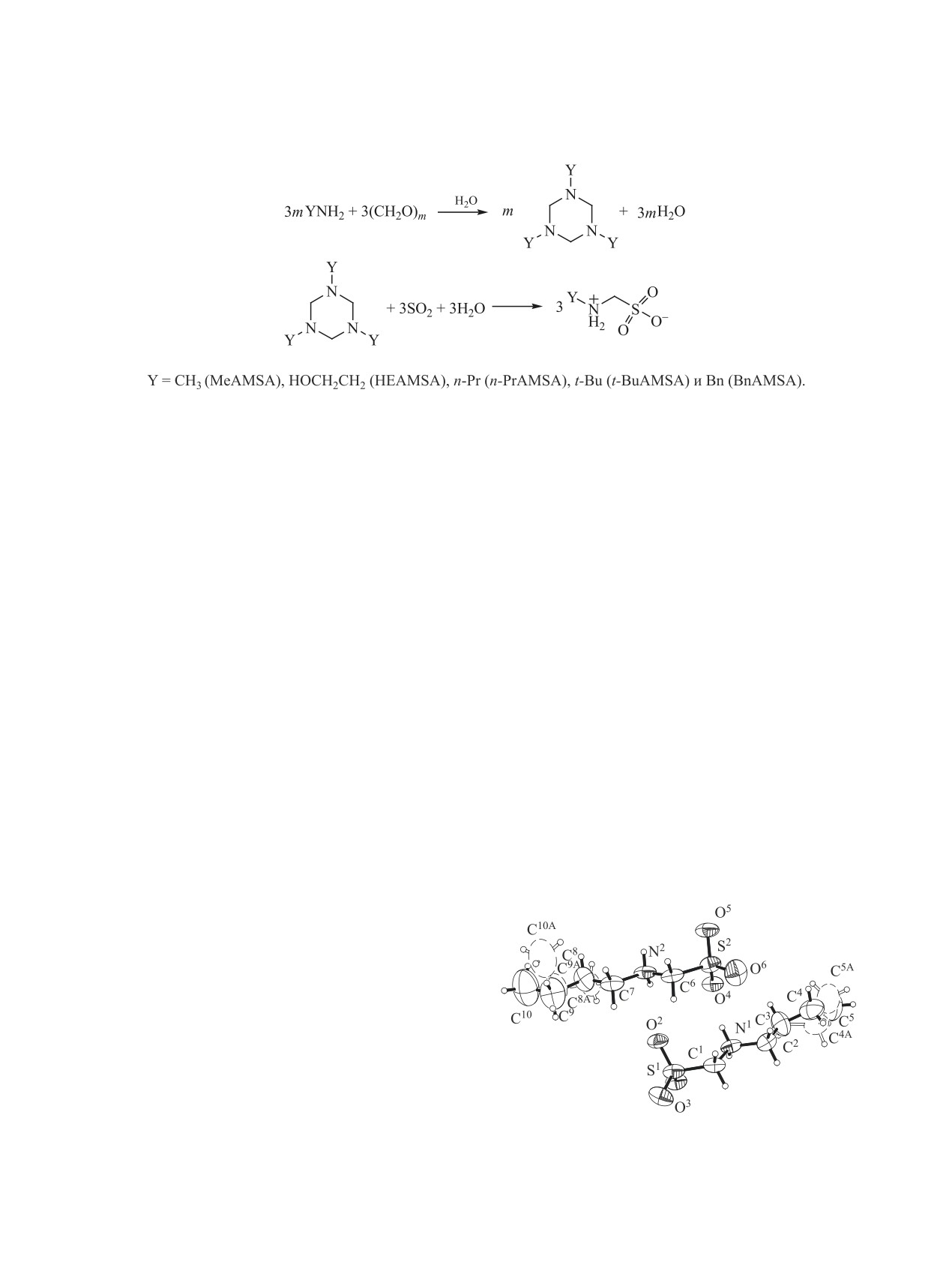
Предложена оригинальная методика синтеза ряда аминометансульфокислот AlkNHCH2SO3 (Alk =
n-Bu, n-Hept, n-Oct, Bn) и N-трис(гидроксиметил)метиламмония гидроксиметансульфоната. Строение
полученных соединений изучено методами элементного анализа, рентгеноструктурного анализа, ИК
спектроскопии и масс-спектрометрии.
Ключевые слова: аминоалкансульфокислоты, оксид серы(IV), параформ, алкиламин, конденсация
DOI: 10.31857/S0044460X21020049
Аминоалкансульфокислоты, в том числе ами-
были охарактеризованы структурно в отличие от
нометансульфокислота (AMSA) и ее N-алкили-
N-бензильного аналога [12].
рованные производные (YAMSA) обладают спец-
Настоящая работа является продолжением ис-
ифическими физико-химическими свойствами,
следований, начатых в работах [5, 12-14], и по-
широким спектром биологической активности
священа синтезу, изучению строения и спектраль-
[1-4] и низкой токсичностью [5], что позволяет
ных характеристик N-(бутил)- (1), N-(гептил)- (2),
рассматривать эти соединения в качестве перспек-
N-(октил)- (3), N-бензиламинометансульфокислот
тивных кандидатов в лекарственные препараты и
(4) и N-трис(гидроксиметил)метиламмония ги-
компонентов буферных систем для медико-биоло-
дроксиметансульфоната (5) - продуктов взаимо-
гических исследований [6-11].
действия в системах оксид серы(IV)-первичный
Ранее с использованием оригинальной ме-
алкиламин-формальдегид-вода.
тодики нами был синтезирован и спектрально
Строение соединений 1-5 доказано методом
охарактеризован ряд новых производных амино-
рентгеноструктурного анализа. Основные кри-
метансульфокислоты [5, 12-14] (схема 1). N-Ме-
сталлографические данные и результаты уточ-
тил- [15], N-2-гидроксиэтил- [13], N-н-пропил- [5]
нения структур соединений 1-5 представлены в
и N-трет-бутильные [14] производные AMSA
табл. 1, 2. Координаты атомов, структурные фак-
212
АМИНОМЕТАНСУ
ЛЬФОКИСЛОТЫ
213
260
Схема 1.
торы и все результаты уточнения депонированы в
Н-связями (табл. 2), упакованы в слои в плоско-
Кембриджском банке структурных данных.
стях (101). Водородные связи сшивают как моле-
Базисной единицей соединений 1-4 является
кулы в слое, так и слои друг с другом. Аналогично
цвиттер-ион (Alk)N+H2CH2SO–. В независимой ча-
соединению 1, связи N1-H1B···O1 и N1-H1B···O2
сти ячейки соединений 1 и 4 находятся два цвит-
являются вилочковыми. Таким образом, в данной
тер-иона, в молекулах соединений 2 и 3 - один.
структуре образуется двухмерная сетка Н-связей в
Общим для структуры аминометансульфокислот
плоскости z = 0.25 (рис. 4).
1-4 является как характер водородных связей (они
В структуре соединения 3 (рис. 5, 6) плоским
образуются между атомами азота и кислородными
с точностью 0.046 Å является только углеродный
атомами сульфогрупп соседних молекул), так и
остов алкильного фрагмента, аммониометансуль-
способ упаковки: полярные части молекул образу-
фонильный (AMS) фрагмент повернут вокруг свя-
ют слои, снаружи которых находятся неполярные
зи С2-С3 и значительно отклоняется от плоскости
части молекул, хотя расположение водородных
остова [торсионный угол N1C2C3C4 равен -65.3(5)°
связей в слоях несколько различается.
против 179.61(12)° в молекуле 2]. AMS-Фрагмен-
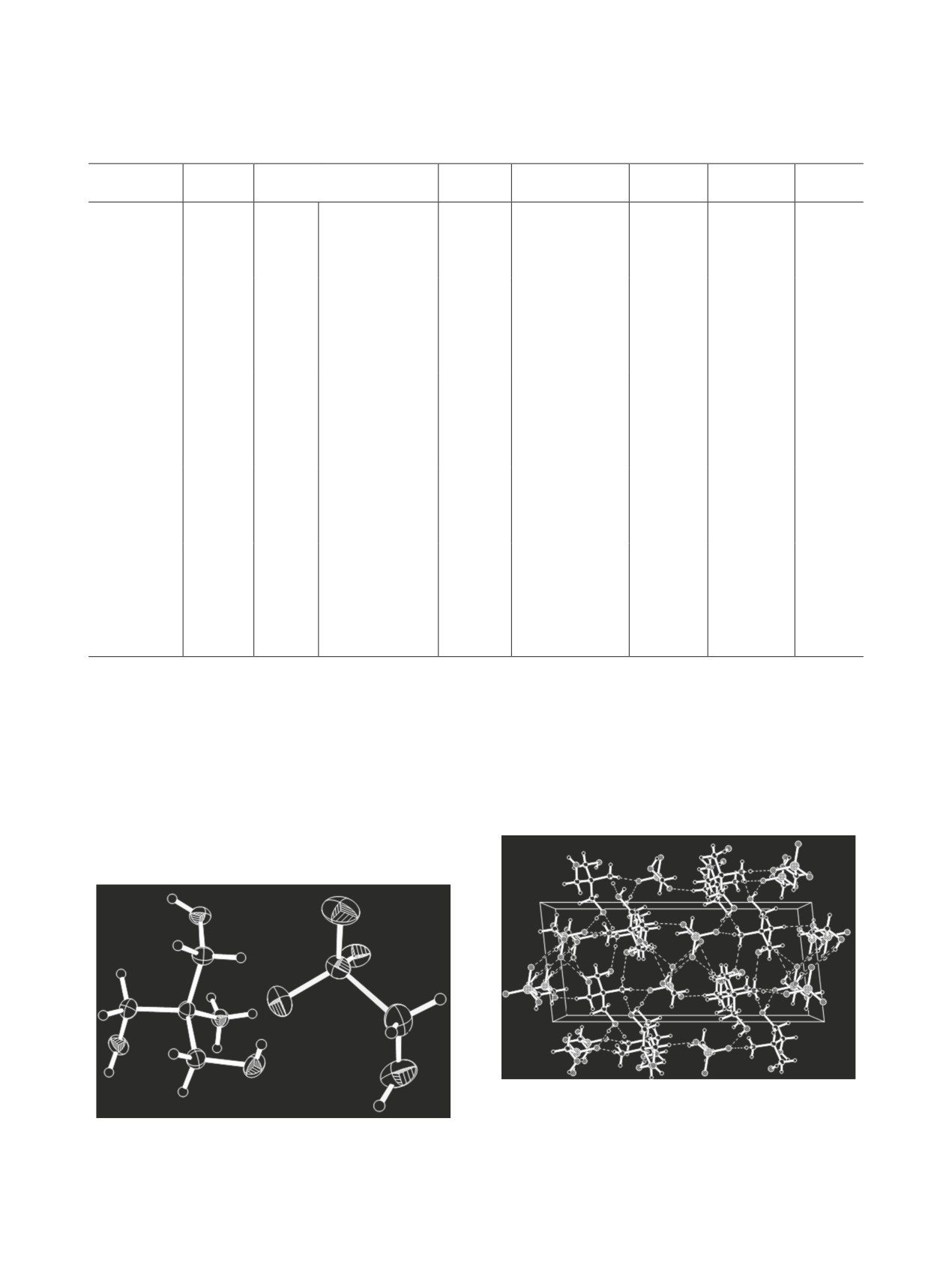
Строение аминометансульфокислоты 1 показа-
ты в кристалле упакованы в плоскости х = 0.5
но на рис. 1. Для обеих базисных молекул наблю-
(рис. 6) и связаны друг с другом зигзагообразными
дается разупорядочение концевых атомов в непо-
цепочками Н-связей, вытянутыми вдоль оси [010].
лярной части, тогда как полярные части молекул
В структуре соединения 4 (рис. 7, 8) два ба-
связаны между собой Н-связями и плотно упакова-
зисных цвиттер-иона n-C6H5CH2N+H2CH2SO– за
ны. Цепочечный каркас каждой молекулы (атомы
счет Н-связей являются парой, с которой соседние
серы, азота и углерода) имеет строение, близкое
к плоскому. Эти цепочки расположены в плоско-
стях y = 0 и y = 0.5 и образуют слои, которые свя-
заны друг с другом двухмерной сеткой Н-связей
(рис. 2), вытянутых вдоль оси b, из которых свя-
зи N1-H1B···O1, N1-H1B···O5, N2-H2C···O4, N2-
H2C···O2 являются вилочковыми.
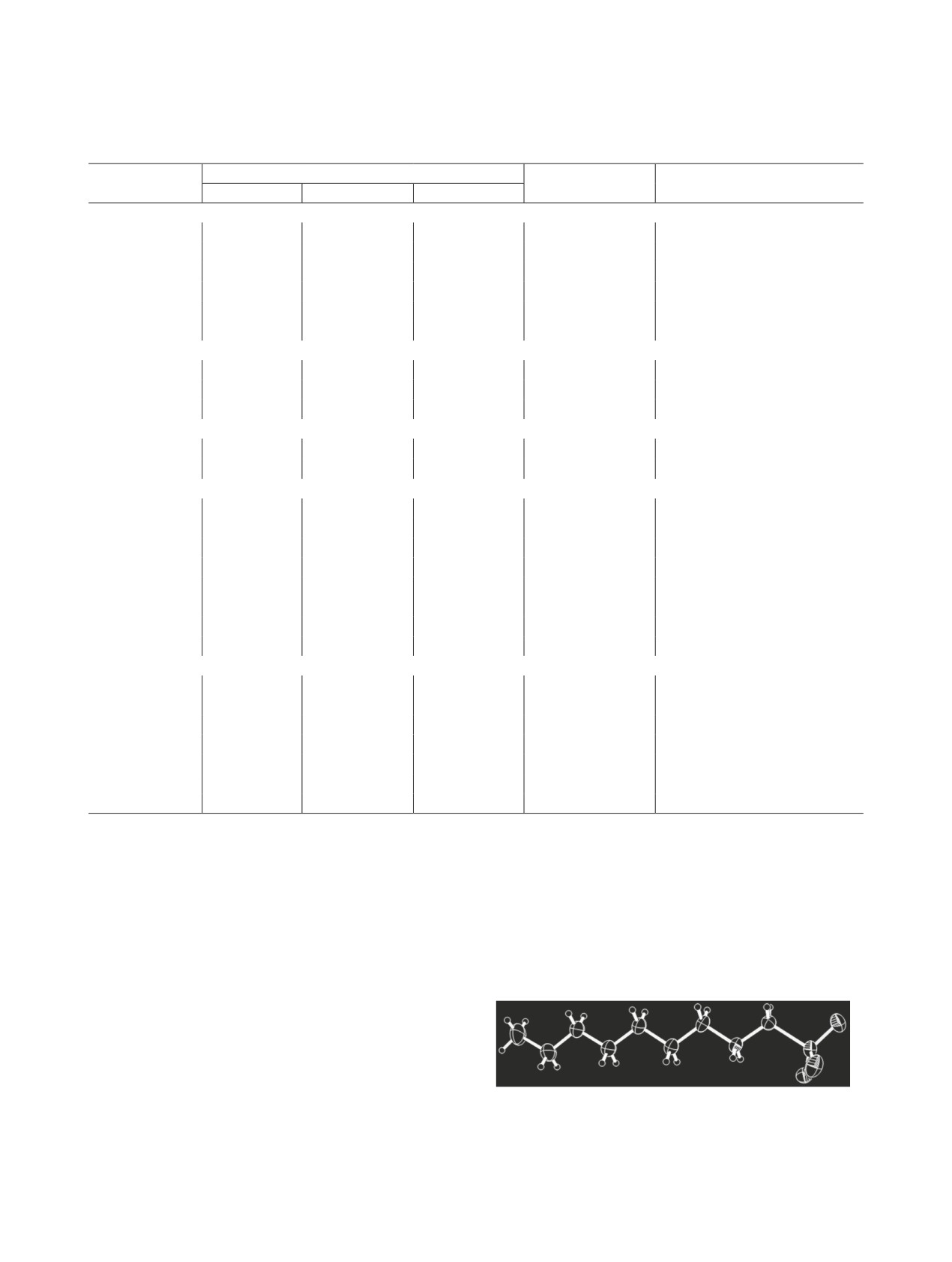
Строение базисной единицы в структуре соеди-
нения 2 n-C7H15N+H2CH2SO– показано на рис. 3.
Атомы N1, C1-C8 лежат в одной плоскости с точ-
ностью 0.018 Å, отклонение атомов сульфогруппы
от этой плоскости составляет -0.223(2), 1.050(2),
-1.252(3) и -0.650(2) Å для атомов S1, О1, О2 и О3
Рис. 1. Общий вид молекулы соединения 1 в кристалле.
соответственно. В кристалле молекулы, связанные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
214
ХОМА и др.
Таблица 1. Кристаллографические данные и результаты уточнения структур соединений 1-5
Параметр
1
2
3
4
5
CCDC
2040821
2040822
2040824
2040837
2040838
Формула
C5H13NO3S
C8H19NO3S
C9H21NO3S
C8H11NO3S
C5H15NO7S
Mr
167.22
209.30
223.33
201,24
233,24
T, K
293(2)
293(2)
293(2)
293(2)
293(2)
Сингония
Моноклинная
Моноклинная
Моноклинная
Моноклинная
Моноклинная
Пространственная группа
С2/с
P21/n
P21/c
P21
P21/с
a, Å
24.608(13)
5.4164(3)
17.748(4)
5.2699(5)
8.1634(6)
b, Å
7.9776(19)
30.8675(15)
5.4192(7)
28.105(3)
6.3494(4)
c, Å
17.811(7)
6.5500(4)
12.9508(16)
6.4061(8)
18.4863(12)
β, град
94.63(4)
98.850(7)
93.355(15)
93.606(10)
96.132(5)
V, Å3
3485(2)
1082.06(11)
1243.5(4)
946.93(17)
952.71(11)
Z
16
4
4
4
4
dвыч, г/см3
1.275
1.285
1.193
1.412
1.626
μ(MoKα), мм-1
0.328
0.278
0.246
0.316
0.355
Интервал θ, град
3.49-26.00
3.22-26.00
3.42-25.99
3.50-26.00
3.17-29.00
Размеры кристалла, мм
0.60×0.02×0.015
0.60×0.03×0.02
0.50×0.20×0.03
0.25×0.20×0.03
0.45×0.25×0.20
F000
1440
456
455
424
496
Коэффициент пропускания
0.827/0.995
0.851/0.995
0.887/0.993
0.925/0.991
0.857/0.932
Тmin/Тmax
Число отражений
измеренных
8838
6662
5395
5908
6560
независимых
3696
2092
2323
3135
2174
наблюдаемых с Ihkl > 2σ(I)
801
1612
1461
2388
1815
Rint
0.2553
0.0552
0.0746
0.0564
0.0250
Полнота охвата, %
95.6
98.3
95.1
98.4
98.9
Число уточняемых параме-
202
126
135
237
151
тров
RF/wR2 по наблюдаемым от-
0.0769/0.1162
0.0373/0.0865
0.0685/0.1557
0.0504/0.0646
0.0324/0.0880
ражениям
RF/wR2 по независимым от-
0.3365/0.2035
0.0563/0.0940
0.1060/0.1782
0.0799/0.0714
0.0414/0.0940
ражениям
S
0.950
0.943
0.981
0.987
0.979
Δρmin/Δρmax, е/Å3
-0.218/0.239
-0.262/0.304
-0.216/0.051
-0.251/0.437
-0.351/0.314
(a)
(б)
b
0
a
c
Рис. 2. Кристаллическая упаковка соединения 1: (а) - расположение молекул в слое; (б) - взаимное расположение слоев
и система водородных связей. Водородные связи изображены штриховыми линиями. Разупорядочение концевых атомов
не показано.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
АМИНОМЕТАНСУ
ЛЬФОКИСЛОТЫ
215
Таблица 2. Характеристики водородных связей D-H···A в соединениях 1-5
Расстояние, Å
D-H···A
Угол DHA, град
Преобразование атома А
d(D-H), Å
d(H···A), Å
d(D···A), Å
1
N1-H1A···O4
0.90
1.90
2.762(7)
159.5
N1-H1B···O1
0.90
2.14
2.957(8)
150.5
-x+1, y, -z+1/2
N1-H1B···O5
0.90
2.34
2.932(7)
123.2
x, y+1, z
N2-H2C···O4
0.90
2.14
2.933(8)
147.2
-x+1, y, -z+1/2
N2-H2C···O2
0.90
2.42
2.957(7)
118.8
N2-H2D···O1
0.90
2.02
2.840(7)
150.7
x, y-1, z
2
N1-H1A···O2
0.844(16)
2.018(16)
2.8252(15)
159.8(15)
x+1/2, -y+1/2, z+1/2
N1-H1B···O1
0.823(15)
2.329(15)
2.8971(15)
126.7(14)
x-1/2, -y+1/2, z-1/2
N1-H1B···O2
0.823(15)
2.487(14)
2.9222(15)
114.1(12)
3
N1-H1N···O2
0.839(5)
2.046(7)
2.881(3)
173(3)
-x+1, y+1/2, -z+3/2
N1-H2N···O1
0.840(5)
2.075(15)
2.838(3)
151(2)
-x+1, y-1/2, -z+3/2
4
N1-H1A···O4
0.89
2.57
3.141(4)
122.6
N1-H1A···O5
0.89
2.53
3.165(4)
129.3
x, y, z-1
N1-H1B···O4
0.89
2.59
3.033(4)
111.5
x+1, y, z
N1-H1B···O6
0.89
2.04
2.847(4)
150.8
N2-H2A···O1
0.89
2.04
2.848(4)
149.5
N2-H2A···O2
0.89
2.59
3.038(4)
111.8
x-1, y, z
N2-H2B···O2
0.89
2.52
3.106(4)
123.6
N2-H2B···O3
0.89
2.55
3.175(4)
127.8
x, y, z+1
5
O1-H1···O6
0.818(17)
1.913(17)
2.7219(12)
169.4(17)
x+1, y, z
O2-H2···O3
0.821(19)
1.882(19)
2.6945(13)
170.1(18)
x, y-1, z
O3-H3···O5
0.81(2)
1.94(2)
2.7491(14)
170.8(18)
O7-H7···O5
0.886(19)
2.020(19)
2.8517(16)
155.8(17)
-x+1, -y+1, -z+1
N1-H1A···O6
0.886(15)
1.994(15)
2.8781(14)
174.7(14)
-x+1, y-1/2, -z+1/2
N1-H1B···O2
0.856(16)
1.976(16)
2.8208(13)
168.9(14)
-x+1, y+1/2, -z+1/2
N1-H1C···O1
0.852(16)
2.108(16)
2.9415(13)
165.8(14)
-x+2, y+1/2, -z+1/2
пары также связаны водородными связями, обра-
пы, поэтому наблюдаемая здесь система Н-связей
зуя, таким образом, одномерные зигзагообразные
является трехмерной (рис. 10).
цепочки вдоль оси [010], подобные наблюдаемым
В результате термической деструкции амино-
в молекуле соединения 3.
метансульфокислот 1-4 в условиях регистрации
В отличие от аминометансульфокислот 1-4
масс-спектров (EI FAB) происходит разложение
базисными единицами в структуре соединения
С8
С1
O3
5 являются N-трис(гидроксиметил)метиламмо-
С4
С2
С6
S1
ний-ион [(HOCH2)3CNH3]+ и гидроксиметансуль-
N1
С5
С3
фонат-ион HOCH2SO–, строение которых показано
С7
на рис. 9. В образовании Н-связей (табл. 2) уча-
O2
O1
ствуют не только аммонийная группа и кислород-
Рис. 3. Общий вид молекулы соединения 2 в кристалле.
ные атомы сульфогруппы, но и все гидроксо груп-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
216
ХОМА и др.
(а)
(б)
c
b
0
a
Рис. 4. Кристаллическая упаковка соединения 2: (а) - расположение молекул в слое; (б) - взаимное расположение слоев и
система водородных связей. Водородные связи изображены штриховыми линиями.
продуктов, что сопровождается выбросом SO3 (1-
5 проявляются в виде дублета с максимумами при
3, аналогично MeAMSA, HEAMSA и t-BuAMSA
3440 и 3230 см-1. Колебания ν(NH) аминогрупп,
[12-14]). Разложение соединения
1, подобно
включенных в систему H-связей, зафиксированы
n-PrAMSA и t-BuAMSA [5, 14], сопровождается
для всех синтезированных соединений в области
элиминированием NH3.
3470-3020 см-1. В ИК спектрах N-производных
AMSA 1-4 и соли 5 колебания νas(SО2) проявля-
В масс-спектре соли 5 наблюдается пик иона
[MTRIS - CH2OH]+. с максимальной интенсивно-
стью - характерного продукта фрагментации эта-
ноламинов [16].
Результаты анализа ИК спектров соединений
1-5 приведены в табл. 3. Отнесение колебаний про-
ведено с использованием данных [17, 18]. Валент-
ные колебания ОН-групп в ИК спектре соединения
b
O1
0
a
S1
c
C8
O2
O3
C6
N1
C8
C9
C4
C7
C5
C2
C3
Рис. 6. Кристаллическая упаковка соединения 3. Во-
дородные связи изображены штриховыми линиями.
Рис. 5. Общий вид молекулы соединения 3 в кристалле.
O3
S1
C1
2
C
C14
N1
C8
C15
3
c
O2
O1
C
C16
C7
C13
11
C4
b
C
O4
0
O6
C12
C10
5
a
C
N2
C9
S2
C6
O5
Рис. 8. Кристаллическая упаковка и система водород-
ных связей в соединении 4. Водородные связи изобра-
Рис. 7. Общий вид молекулы соединения 4 в кристалле.
жены штриховыми линиями.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
АМИНОМЕТАНСУ
ЛЬФОКИСЛОТЫ
217
Таблица 3. Волновые числа (см-1) максимумов полос поглощения в ИК спектрах соединений 1-5
δs(NH3+),
Соединение
ν(ОH)
ν(NH+), ν(СH)
ν(NH+)
νas(SО2)
νs(SО2)
ν(S-О)
δs(NH2+)
1
3320 ср,
2963 пл, 2953 с,
2427 сл,
1679 пл, 1601
1235 пл,
1081 д.
557 ср
3123 пл,
2922 о. с, 2870 с
2352 сл
пл, 1592 с, 1501
1206 д. с
сл, 1051 с,
3083 с,
с, 1493 с
1046 с
3032 с
2
3322 с,
3025 с, 2965 пл,
2352 сл
1625 ср, 1542
1241 д. с
1090 сл,
551 ср
3205 с
2957 о. с,
сл, 1504 ш. сл,
1080 сл,
2942 о. с, 2926
1491 ш. сл,
1076 пл,
о. с, 2872 с,
1469 с
1054 с
2855 с
3
3470
3013 ш. о. с,
2570 cр,
1626 с, 1565 с,
1244 ср.
1079 пл,
580 сл
ш. о. с,
2950 ш. о. с,
2492 пл
1542 пл, 1538
1203 с,
1056 с
3412 ш.
2878 ш. о. с,
ср, 1506 пл,
о. с
2837 ш. о. с,
1498 ш. ср
2816 ш. о. с
4
3044 с,
2780 пл, 2605
1555 c
1237 с,
1056 с,
589 с
2940 пл,
ср, 2316 сл
1217 с
1032 сл,
2847 ср,
1016 ср
2819 ср
5
3440 ср.
3039 пл,
2748 ср, 2694
1631 с,
1133 пл
1035 с
526 с
ш,
2991
ср, 2601 ср,
1552 с,
3230 с
пл, 2942
2468 ср, 2382
1516 сл
пл,
сл, 2296 сл
2891 пл,
2835 ср
ются в области 1270-1130 см-1, νs(SО2) - в области
соединений 1-4 не подвержены существенному
1183-1023 см-1, ν(S-О) - в виде полос сильной (4
смещению, что указывает на сохранение их цвит-
и 5), средней (1 и 2) и слабой (3) интенсивности в
тер-ионного строения.
области 590-525 см-1.
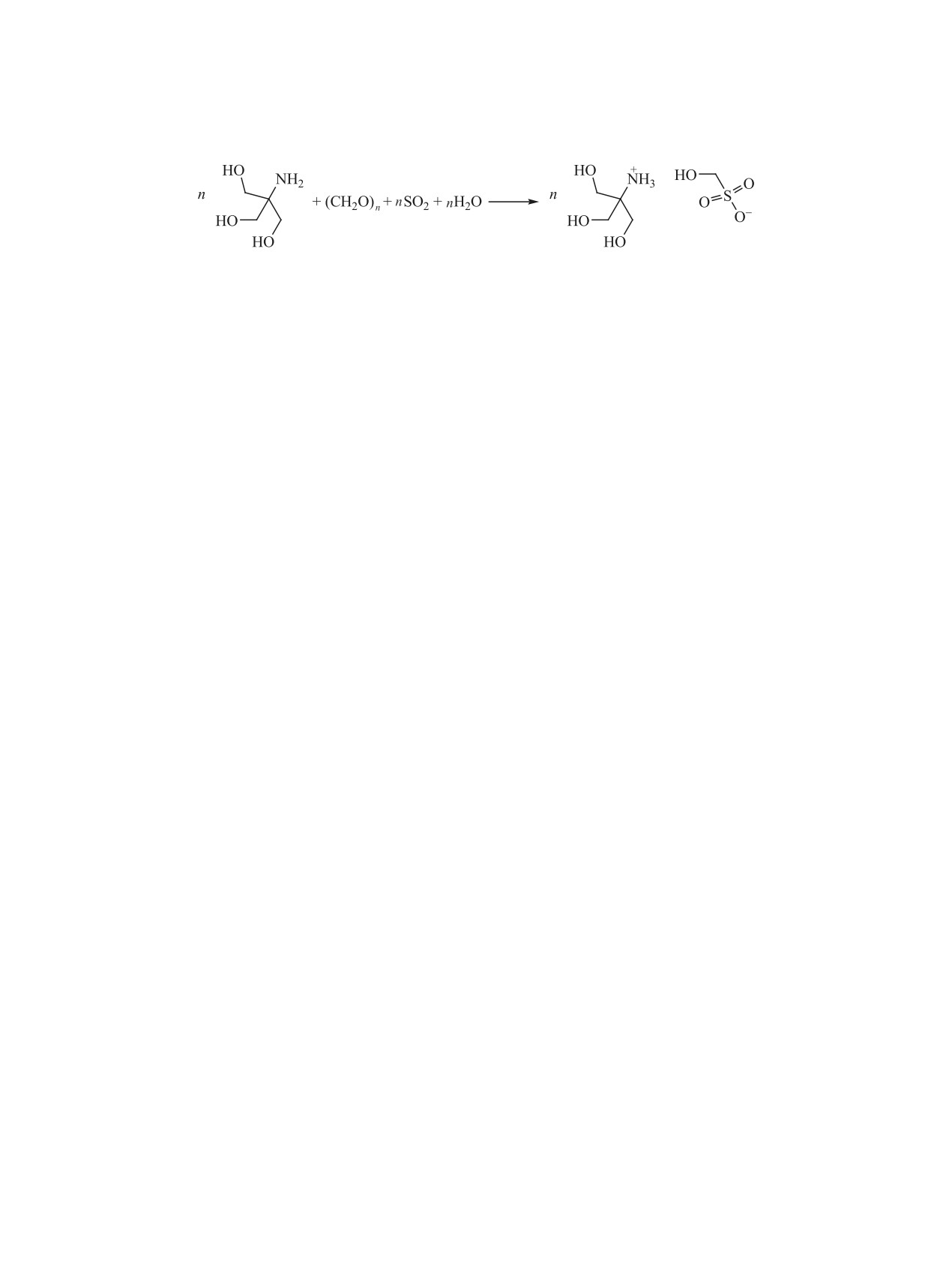
Можно констатировать, что взаимодействие
Отметим, что, как и в случае ранее изучен-
в системах SO2-YNH2-CH2O-H2O [где Y = Alk,
ных AMSA [19] и ее производных [5, 12-14], по-
кроме (HOCH2)3C] включает процесс конденса-
ложения полосы колебания ν(NH) в ИК спектрах
ции, сопровождаемой окислением S(IV)→S(VI),
O2
a
O4
C3
S1
O6
C1
C2
0
c
N1
O5
b
C5
O1
C4
O3
O7
Рис. 10. Кристаллическая упаковка и система водород-
ных связей в соединении 5. Водородные связи изобра-
жены штриховыми линиями.
Рис. 9. Общий вид молекулы соединения 5 в кристалле.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
218
ХОМА и др.
Схема 2.
с образованием N-алкилированных производных
нием программ SHELXT, SHELXL-16 и WinGX
AMSA. Причем, выход целевого продукта суще-
[21-23]. Атомы водорода найдены из разностного
ственно зависит от строения N-заместителя. В ряду
синтеза и уточнены по модели наездника. Водо-
N-заместителей СH3 (~ 100% [12]) - HOCH2CH2
родные атомы, участвующие в образовании водо-
(~ 100% [13]) - n-C3H7 (~100% [5]) - n-C4H9 (~
родных связей в структурах 2, 3 и 5 уточнены в
92.3%) - n-C7H15 (~ 67.3%) - n-C8H17 (~ 56.2%) с
изотропном приближении.
увеличением углеводородного заместителя, начи-
В работе использовали коммерческий оксид
ная с С4, выход (указан в скобках) целевого про-
серы(IV) после предварительной очистки и осуш-
дукта уменьшается, что, вероятно, обусловлено
ки согласно методике [24]. n-BuA, n-HpА, n-ОcА
развитием побочных процессов гидролиза произ-
и TRIS, бензиламин и параформ классификации Ч
водных AMSA [20]. В частности, в случае системы
являлись коммерческими реактивами и использо-
с участием TRIS выделен продукт гидролиза целе-
вались без предварительной очистки.
вого соединения - N-трис(гидроксиметил)метил-
N-(Бутил)аминометансульфокислота (1). К
аммонийгидроксиметансульфонат, как и в ранее
25 мл водной эмульсии, содержащей 0.10 моль
описанном примере (схема 2) [8].
н-бутиламина, прибавляли эквимолярное количе-
В заключение отметим, что, с учетом ранее по-
ство параформа при охлаждении (≤ 10°C) и остав-
лученных результатов [5, 12], охарактеризованные
ляли на 24 ч, затем через полученный раствор
в настоящей работе производные аминометансуль-
барботировали SO2 до рН ≤ 1.0 с последующей
фокислоты могут представлять интерес в качестве
выдержкой реакционной смеси при комнатной
объектов дальнейших фармакологических иссле-
температуре до полного испарения воды. Выход
дований как потенциальные противовирусные и
15.43 г (выход ~ 92.3%), кристаллы белого цвета,
антибактериальные агенты.
т. пл. 136-139°С (т. пл. 135-137°С [20]). Масс-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
спектр (FAB), m/z (Iотн, %): 168 (8) [M - NH3 + H]+,
166 (7) [M - NH3 - H]+, 138 (14), 137 (43), 136 (55),
Анализ содержания углерода, водорода и азота
89 (12), 86 (23) [M - NH3 - SO3 - H]+, 77 (8), 57 (7),
проводили с использованием элементного СНN-
55 (7), 43 (11), 42 (9), 41 (7). Найдено, %: C 35.25;
анализатора, серы - по Шенигеру. ИК спектры реги-
H 8.26; N 8.62; S 19.57. C5H13NO3S. Вычислено, %:
стрировали на спектрометре Spectrum BX II FT-IR
C 35.91; H 7.84; N 8.38; S 19.17. М 167.23.
System (PerkinElmer) в области 4000-350 см-1, об-
разцы готовили в виде таблеток с KBr. Масс-спек-
N-(Гептил)аминометансульфокислота
(2)
тры (EI) регистрировали на приборе МХ-1321
получена аналогично 0.10 моль н-гептиламина.
(прямой ввод образца в источник, энергия ионизи-
Полученную белую пенообразную массу отфиль-
рующих электронов - 70 эВ). Масс-спектры (FAB)
тровывали, полученный фильтрат выдерживали на
снимали на приборе VG 7070, десорбцию ионов из
воздухе до полного испарения воды и образования
жидкой матрицы осуществляли пучком атомов ар-
белых кристаллов. Выход 14.09 г (~ 67.3%). Масс-
гона с энергией 8 кэВ, в качестве матрицы исполь-
спектр (FAB), m/z (Iотн, %): 128 (6) [M - SO3 - H]+,
зовали м-нитробензиловый спирт.
117 (5), 116 (100) [M - SO3 - CH2 - H]+, 57 (6), 40
(9). Найдено, %: C 45.63; H 8.83; N 6.43; S 15.67.
Рентгеноструктурный анализ выполнен на
C8H19NO3S. Вычислено, %: C 45.91; H 9.15; N 6.69;
дифрактометре Xcalibur-3 (Oxford Diffraction Ltd.),
S 15.32. М 209.31.
(MoKα-излучение, графитовый монохроматор,
CCD-детектор Sapphire-3). Расшифровка, уточне-
N-(Октил)аминометансульфокислота
(3)
ние и анализ структуры выполнены с использова-
получена аналогично из 0.10 моль н-октиламина.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
АМИНОМЕТАНСУ
ЛЬФОКИСЛОТЫ
219
Выход 13.11 г (~ 56.2%). Масс-спектр (FAB), m/z
нологии. 2019. № 6. С. 255. doi 10.32434/0321-4095-
(Iотн, %): 142 (30) [M - SO3 - H]+, 137 (6), 136 (8),
2019-127-6-255-262
131 (22), 130 (100) [M - SO3 - CH2 - H]+, 128 (6),
6.
Yu Q., Kandegedara A., Xu Y., Rorabacher D.B. //
71 (6), 57 (7), 42 (6), 40 (5). Найдено, %: C 48.11; H
Analyt. Biochem. 1997. Vol. 253. N 1. P. 50. doi
10.1006/abio.1997.2349
9.11; N 6.49; S 14.02. C9H21NO3S. Вычислено, %: C
48.40; H 9.48; N 6.27; S 14.36. М 233.34.
7.
Goldberg R.N., Kishore N., Lennen R.M. // J. Phys.
Chem. Ref. Data. 2002. Vol. 31. N 2. P. 231. http://
N-Бензиламинометансульфокислота
(4)
dx.doi.org/10.1063/1.1416902
синтезирована по методике [5] с использованием
8.
Long R.D., Hilliard N.P., Chhatre S.A. Timofeeva T.V.,
0.05 моль бензиламина. Выход 10.00 г (~ 100%),
Yakovenko A.A., Dei D.K., Mensah E.A. // Beilstein J.
кристаллы белого цвета, т. пл. 144-145°C. Масс-
Org. Chem. 2010. Vol. 6. N. 31. doi 10.3762/bjoc.6.31
спектр (EI), m/z (Iотн, %): 91 (100) [C7H7]+., 77 (15)
9.
Khali M.M., Mahmoud R.K., Babiker S.E. // J. Chem.
[C6H5]+., 64 (50) [SO2]+., 48 (21) [SO]+.. Найдено,
Sci. Techn. 2014. Vol. 3. N 2. P. 49. doi 10.1002/
%: C 45.90; H 5.95; N 7.20; S 15.55. C8H11NO3S.
adic.200490119
Вычислено, %: С 47.75; H 5.51; N 6.96; S 15.93. М
10.
Ferreira C.M.H., Pinto I.S.S., Soares E.V., So-
201.25.
ares H.M.V.M. // RSC Adv. 2015. Vol. 5. N 39. P. 30989.
N-Трис(гидроксиметил)метиламмония ги-
doi 10.1039/c4ra15453c
дроксиметансульфонат (5) получен аналогично
11.
Хома Р.Е. // ЖФХ. 2017. Т. 91. № 1. С. 79; Kho-
ma R.E. // Russ. J. Phys. Chem. 2017. Vol. 91. N 1.
соединению 1 с использованием 0.05 моль TRIS.
P. 76. doi 10.1134/S0036024417010125
Выход 11.66 г (~ 100%), кристаллы белого цвета,
12.
Хома Р.Е., Гельмбольдт В.О., Эннан А.А., Гриди-
т. пл. 82-83°C. Масс-спектр (EI), m/z (Iотн, %): 118
на Т.Л., Федчук А.С., Лозицкий В.П., Ракипов И.М.,
(12), 114 (10), 104 (14), 102 (29), 100 (36), 90 (100)
Владыка А.С. // Хим.-фарм. ж. 2019. Т. 53. № 5.
[MTRIS - CH2OH]+., 83 (21), 73 (11), 72 (11), 71 (31),
С. 28; Khoma R.E., Gelmboldt V.O., Ennan А.А.,
70 (35), 64 (31) [SO2]+., 60 (60), 56 (15), 54 (13),
Gridina T.L., Fedchuk A.S., Lozitskiy V.P., Rakipov I.M.,
48 (13) [SO]+., 43 (12), 42 (70), 41 (20), 30 (54), 29
Vladika А.S. // Pharm. Chem. J. 2019. Vol. 53. N 5.
(20). Найдено, %: C 32.58; H 8.29; N 7.42; S 17.89.
P. 436. doi 10.1007/s11094-019-02016-w
C5H15NO7S. Вычислено, %: С 32.42; H 8.16; N 7.56;
13.
Хома Р.Е., Гельмбольдт В.О., Шишкин О.В., Бау-
S 17.31. М 185.07.
мер В.Н., Короева Л.В. // ЖОХ. 2013. Т. 83. № 5.
С. 834; Khoma R.E., Gelmboldt V.O., Shishkin O.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Baumer V.N., Koroeva L.V. // Russ. J. Gen. Chem. 2013.
Авторы заявляют об отсутствии конфликта
Vol. 83. N 5. P. 969. doi 10.1134/S1070363213050149
интересов.
14.
Хома Р.Е., Гельмбольдт В.О., Эннан А.А., Бау-
мер В.Н., Пузан А.Н. // ЖОХ. 2015. Т. 85. № 10.
СПИСОК ЛИТЕРАТУРЫ
С. 1650; Khoma R.E., Gelmboldt V.O., Ennan A.A.,
1. Grygorenko O.O., Biitseva A.V., Zhersh S. //
Baumer V.N., Puzan A.N. // Russ. J. Gen. Chem. 2015.
Tetrahedron. 2018. Vol. 74. N 13. P. 1355. doi 10.1016/j.
Vol. 85. N 10. P. 2282. doi 10.1134/S1070363215100102
tet.2018.01.033
15.
Cameron T.S., Chute W.J., Knop O. // Canadian J. Chem.
2. Benoit R.L., Boulet D., Frechette M. // Can. J. Chem.
1984. Vol. 62. N 3. P. 540. doi10.1139/v84-090
1988. Vol. 66. P. 3038. doi 10.1139/v88-470
16.
Вульфсон Н.С., Заикин В.Г., Микая А.И. Масс-спек-
3. Bickerton J., MacNab J.I., Skinner H.A., Pilcher G. //
трометрия органических соединений. М.: Химия,
Thermochimica Acta. 1993. Vol. 222. N 1. P. 69. doi
1986. 312 c.
10.1016/0040-6031(93)80540-Q
17.
Socrates G. Infrared and Raman Characteristic Group
4. Badeev Yu.V., Korobkova V.D., Ivanov V.B., Pozde-
Frequencies. Tables and Charts. New York: John Wiley
ev O.K., Gil’manova G.Kh., Batyeva É.S., Andre-
& Sons, 2001. 347 p.
ev S.V. // Pharm. Chem. J. 1991. Vol. 25. N 4. P. 272. doi
18.
Larkin P.J. Infrared and Raman Spectroscopy: Principles
10.1007/bf00772113
and Spectral Interpretation. New York: Elsevier, 2011.
5. Khoma R.E., Baumer V.N., Antonenko P.B., Snihach
228 p.
A.O., Godovan V.V., Ennan A.A., Dlubovskii R.M.,
19.
Хома Р.Е., Шестака А.А., Шишкин О.В., Бау-
Gelmboldt V.O. // Вопросы химии и химической тех-
мер В.Н., Брусиловский Ю.Э., Короева Л.В.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
220
ХОМА и др.
Эннан А.А., Гельмбольдт В.О. // ЖОХ. 2011. Т. 81.
21. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
N 1. P. 3. doi 10.1107/s2053273314026370
№ 3. С. 525; Khoma R.E., Shestaka A.A., Shishkin O.V.,
22. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Baumer V.N., Brusilovskii Yu.E., Koroeva L.V.,
P. 3. doi 10.1107/S2053229614024218
Ennan A.A., Gelmboldt V.O. // Rus. J. Gen. Chem. 2011.
23. Farrugia L.J. // J. Appl. Cryst. 1999. Vol. 32. N 4.
Vol. 81. N 3. P. 620. doi 10.1134/S1070363211030352
P. 837. doi 10.1107/s0021889899006020
20. McMillan F.H., Pattison I.C. // J. Pharm. Sci. 1969.
24. Гордон А., Форд Р. Спутник химика. М.: Мир, 1976.
Vol. 58. N 6. P. 730. doi 10.1002/jps.2600580618
C. 438.
Aminomethanesulfonic Acids as Reaction Products
in SO2-NH2Alk-CH2O-H2O Systems: Synthesis and Structure
R. E. Khomaa,b,*, V. O. Gelmboldtc, V. N. Baumerd, A. A. Ennana, S. V. Vodzinskiia,b,
Yu. V. Ishkovb, and I. M. Rakipove
a Physico-Chemical Institute of Environment and Human Protection, Odessa, 65082 Ukraine
b Odessa I.I. Mechnikov National University, Odessa, 65082 Ukraine
c Odessa National Medical University, Odessa, 65082 Ukraine
d Institute of Single Crystals of the National Academy of Sciences of Ukraine, Kharkov, 61001 Ukraine
e A.V. Bogatsky Physico-Chemical Institute of National Academy of Science of Ukraine, Odessa, 65080 Ukraine
*e-mail: rek@onu.edu.ua
Received November 13, 2020; revised November 13, 2020; accepted November 22, 2020
An original procedure for the synthesis of a series of aminomethanesulfonic acids AlkNHCH2SO3 (Alk = n-Bu,
n-Hept, n-Oct, Bn) and N-tris(hydroxymethyl)methylammonium hydroxymethanesulfonate was proposed. Struc-
ture of the obtained compounds was studied by the methods of elemental analysis, X-ray structural analysis, IR
spectroscopy and mass spectrometry.
Keywords: aminoalkanesulfonic acids, sulfur(IV) oxide, paraform, alkylamine, condensation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021