ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 221-230
УДК 547.26’118
НОВЫЕ БИС[N-АЛКИЛ-
N-(2-ДИФЕНИЛФОСФИНИЛЭТИЛ)]АМИДЫ
ДИГЛИКОЛЕВОЙ КИСЛОТЫ: СИНТЕЗ И ДАННЫЕ
СПЕКТРОСКОПИИ ЯМР 1Н, 13С, 31Р
© 2021 г. Н. А. Бондаренкоa,b,*, К. В. Царьковаa,b, С. К. Белусьb, О. И. Артюшинc, А. С. Перегудовc
a Институт химических реактивов и особо чистых химических веществ Национального исследовательского
центра «Курчатовский институт», ул. Богородский вал 3, Москва, 3107076 Россия
b Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
c Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
Москва, 119991 Россия
*e-mail: bond039@mail.ru
Поступило в Редакцию 2 ноября 2020 г.
После доработки 2 ноября 2020 г.
Принято к печати 22 ноября 2020 г.
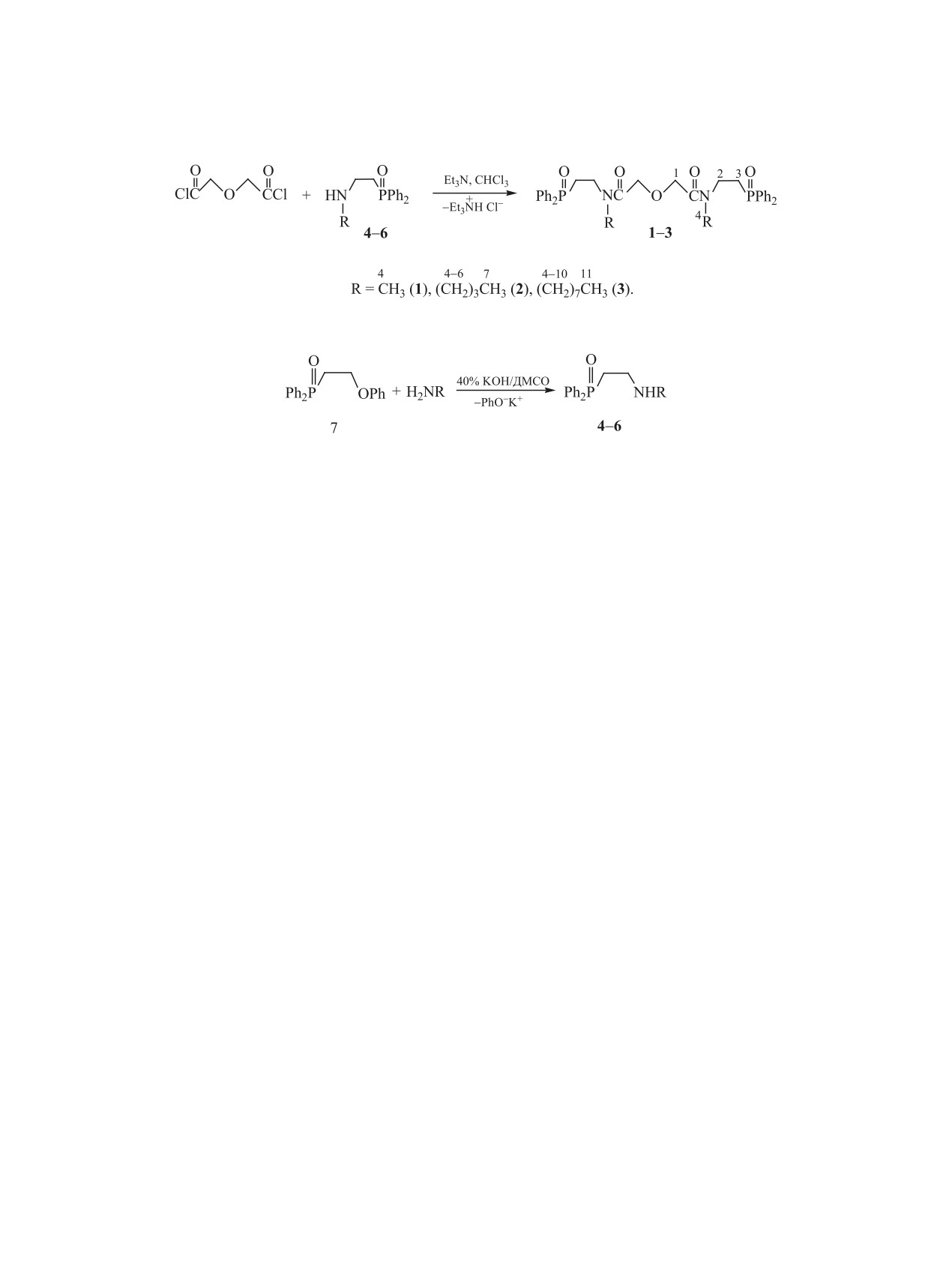
Синтезированы пентадентатные бис[N-алкил-N-(2-дифенилфосфинилэтил)]амиды дигликолевой
кислоты [Ph2P(O)CH2CH2N(R)C(O)CH2]2O, где R = Me, Bu, Oct реакцией хлорангидрида дигликолевой
кислоты с N-алкил-N-(2-дифенилфосфинилэтил)аминами, полученными взаимодействием дифенил-
(2-феноксиэтил)фосфиноксида с первичными алкиламинами в ДМСО в присутствии водной щелочи.
Строение полученных соединений изучено с помощью спектроскопии ЯМР 1H, 13C и 31P .
Ключевые слова: дигликольамиды, амидирование, O-триметилсилилдифенилфосфинит, дифенил(2-
феноксиэтил)фосфиноксид, N-алкил-N-(2-дифенилфосфинилэтил)амины, пентадентатные бис[N-алкил-
N-(2-дифенилфосфинилэтил)]амиды дигликолевой кислоты, спектроскопия ЯМР
DOI: 10.31857/S0044460X21020050
В настоящее время одним из самых перспек-
онных методов переработки высокоактивных от-
тивных классов экстрагентов для переработки
ходов (ARTIST, SANEX и т. д.) [3, 4].
рудных тел лантаноидов, а также для выделения
Вместе с тем, TODGA и другие диамиды дигли-
минорных актинидов из высокоактивных отходов,
колевой кислоты обладают весьма существенным
являются диамиды дигликолевой кислоты. Связа-
недостатком - низкой экстракционной емкостью,
но это с тем, что они обладают комплексом ценных
что приводит к образованию третьей фазы уже
в научном и практическом плане свойств: они вы-
при экстракции лишь 10% от теоретического коли-
сокоэффективны, хорошо растворимы в органиче-
чества ионов металла. В этом случае необходимо
ских разбавителях, относительно дешевы и, глав-
использование фосфорорганических солюбилиза-
ное, их экстракционная способность зависит от
торов, например, трибутилфосфата [4]. Различные
степени окисления экстрагируемого металла, что
модификации молекулы TODGA алкильными за-
уникально для нейтральных молекул [1]. Впервые
местителями, триподальными структурами и даже
предложенные в 1991 году [2], эти соединения
каликс[4]ареновыми платформами не дали желае-
за прошедшие годы интенсивно исследовались,
мых результатов [5-7].
и в результате на основе одного из самых актив-
Ранее нами были синтезированы модифици-
ных тетраоктилдиамида дигликолевой кислоты
рованные бидентатные аналоги тетрабутилдиг-
(TODGA) были разработаны несколько инноваци-
ликольамида, в молекуле которого одна из двух
221
222
БОНДАРЕНКО и др.
Схема 1.
Схема 2.
Bu2NС(О)-групп заменена на R2P(O)-группу (R =
амина [9-11]. Однако в нашем случае оказалось,
Bu, Ph), показавшие заметно более высокую экс-
что избыток фосфорилсодержащих аминов 4-6
тракционную способность по отношению к ионам
невозможно удалить из реакционной смеси ни
лантанидов при использовании синергетической
отогонкой в вакууме, ни экстракцией разбавлен-
смеси с 4-бензоил-3-метил-1-фенил-5-пиразоло-
ной HCl. Кроме того, их присутствие осложняет
ном по сравнению как с TODGA, так и с карба-
очистку диамидов на колонке с SiO2, существенно
моилметилфосфиноксидами [8]. При аналогичной
снижая их выход. Напротив, использование не-
замене второй Bu2NC(O)-группы этот эффект воз-
большого избытка дихлорангидрида (~6-7%) по-
растает [8].
зволяет легко очистить целевые продукты от при-
Нами использован другой способ модификации
меси моноамида промывкой раствором KHCO3
диамидов дигликолевой кислоты путем введения
или K2СO3.
диарил(алкил)фосфорильных фрагментов в один
Попытка провести амидирование дигликоле-
из алкильных заместителей при атоме азота с со-
вой кислоты триамидофосфитом, полученным из
хранением скелетной структуры молекулы диами-
аминов 4-6 и PCl3 в присутствии триэтиламина
да дигликолевой кислоты, что позволяет не только
в сухом толуоле по описанному методу [12] без
увеличить дентатность диамидов дигликолевой
его выделения, оказалась неудачной из-за плохой
кислоты с трех до пяти, но и повысить его экстрак-
растворимости как триамидофосфита, так и об-
ционную емкость и растворимость образующихся
разующегося диамида 1-3 даже при температуре
комплексов.
100-110°С.
В настоящем исследовании синтезированы
Исходные вторичные амины 4-6 были полу-
фосфорилзамещенные модифицированные пен-
чены взаимодействием первичных алкиламинов
тадентатные диамиды дигликолевой кислоты 1-3,
содержащие 2-дифенилфосфинилэтильные груп-
с дифенил(2-феноксиэтил)фосфиноксидом
7 в
пы в амидной части молекулы. Синтез этих соеди-
ДМСО в присутствии водного KОН [13] (схема 2)
нений был осуществлен амидированием коммер-
аналогично реакциям нуклеофильных реагентов
чески доступного дихлорангидрида дигликолевой
с более трудно доступными 2-гидрокси- и 2-эток-
кислоты вторичными N-алкил-N-(2-дифенилфос-
сиэтилдифенилфосфиноксидами [14, 15]. Следует
финилэтил)аминами 4-6 в присутствии Et3N в
отметить, что синтезированные амины 4 и 6 имеют
хлороформе (схема 1).
температуры плавления на 33 и 45°С выше тако-
Следует отметить, что для амидирования
вых у полученных ранее другими способами. Их
дихлорангидрида дигликолевой кислоты обычно
строение подтверждено данными ЯМР 1H, 13C и
используют
1.5-2-кратный избыток вторичного
31Р (табл. 1).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
НОВЫЕ БИС[N-АЛКИЛ-N-(2-ДИФЕНИЛФОСФИНИЛЭТИЛ)]АМИДЫ
223
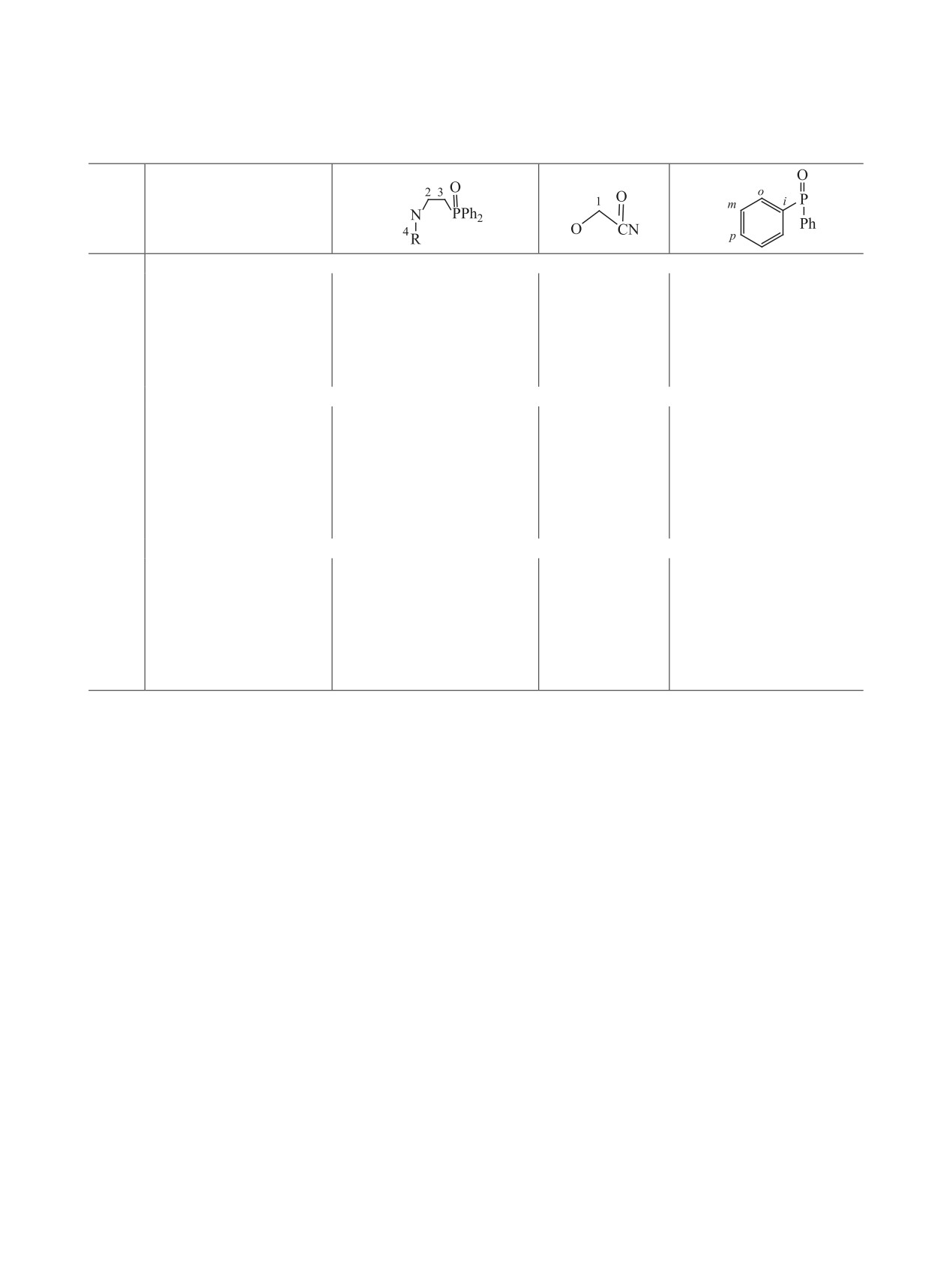
Таблица 1. Данные спектроскопии ЯМР 1H, 13C{1H} и 31P{1H} растворов вторичных аминов 4-6 в CDCl3
δ, м. д. (J, Гц)
№
R
31P{1H}
1H (300.28 МГц)
13C{1H} (75.51 МГц)
(121.56 МГц)
4
Me
1.68 уш. c (1H, NH), 2.36 с (3H, CH3), 2.48 д. т (2H,
30.33 д (PCH2, 1JСP
71.1),
36.36
31.4
PCH2, 3JHH
7.4, 2JHP
11.3), 2.89 д. т (2H, CH2N,
(CH3), 45.12 д (CH2N, 2JСP
2.0),
3JHH
7.4, 3JHP 11.4), 7.41-7.54 м (6H, мета-CH +
128.86 д (мета-CH, 3JСP
11.6),
пара-CH), 7.72 д. д. д (4H, орто-CH, 3JHH 7.9, 4JHH
130.85 д (орто-CH,
2JСP
9.4),
1.6, 3JHP 11.5)
131.96 д (пара-CH, 4JСP 2.7), 133.12
д (ипсо-C, 1JСP 98.6)
5
Bu
0.84 т (3H, CH3, 3JHH 7.2), 1.25 секстет (2H, CH2Me,
14.09 (CH3), 20.52 (CH2Me), 30.50
31.6
3JHH 7.3), 1.37 квинтет (2H, CH2Et, 3JHH 7.2), 1.73 с
д (PCH2, 1JСP 71.0), 32.19 (CH2Et),
(1H, NH), 2.49 д. т (2H, PCH2, 3JHH 7.5, 2JHP 11.2),
43.05 д (CH2N, 2JCP
2.1),
49.54
2.52а т (2H, CH2Pr, 3JHH 7.0), 2.92а д. т (2H, CH2N,
(CH2Pr), 128.82 д (мета-CH, 3JCP
3JHH
7.4, 3JHP 11.3), 7.40-7.53 м (6H, мета-CH +
11.7), 130.84 д (орто-CH, 2JСP 9.4),
пара-CH), 7.72 д. д. д (4H, орто-CH, 3JHH 7.8, 4JHH
131.92 д (пара-CH, 4JСP 2.8), 133.15 д
1.7, 3JHP 11.5)
(ипсо-C, 1JСP 98.8)
6
Oct
0.86 т (3H, CH3, 3JHH
6.5), 1.17-1.35 м (10H,
14.09 (CH3), 22.64 (CH2Me), 27.28
31.2
(CH2)5Me), 1.41 квинтет (2H, CH2Hex, 3JHH 6.7),
(CH2Pent), 29.22 с (CH2Pr), 29.48
2.51 д. т (2H, PCH2, 3JHH 7.2, 2JHP 11.2), 2.55а т
(CH2Bu), 30.01 (CH2Hex), 30.43 д
(2H, CH2Hept, 3JHH 7.1), 2.95а д. т (2H, CH2N, 3JHH
(PCH2, 1JСP
71.0), 31.81 (CH2Et),
7.4, 3JHP 11.0), 7.41-7.55 м (6H, мета-CH + па-
42.89 д (CH2N, 2JСP
1.4),
49.78
ра-CH), 7.73 д. д. д (4H, орто-CH, 3JHH
7.9, 4JHH
(CH2Hept),
128.68 д (мета-CH,
1.7, 3JHP 11.5)
3JСP 11.7), 130.70 д (орто-CH, 2JСP
9.4), 131.78 д (пара-CH, 4JСP 2.7),
133.04 д (ипсо-C, 1JСP 98.7)
а Перекрывающиеся сигналы.
Исходный феноксиэтильный фосфиноксид 7
соединений в CDCl3, для отнесения сигналов в ко-
синтезирован реакцией 2-феноксиэтилхлорида с
торых были применены двумерные гомо- (1H-1H,
O-триметилсилилдифенилфосфинитом
8, кото-
COSY) и гетероядерные (1H-13С, HSQC и HMBC)
рый был получен взаимодействием дифенилфос-
корреляционные методики. Полученные резуль-
финистой кислоты с гексаметилдисилазаном [16]
таты позволяют предположить, что в растворах в
и использован без выделения (схема 3). Ранее
CDCl3 молекулы амидов 1-3 представлены в двух
аналогичная реакция была успешно проведена с
конформерных формах (M и m), отличающихся
этилхлорацетатом [15], а также дигалогенпроизво-
пространственным расположением атомов скелета
дными и дитозилатами олигоэтиленгликолей [17].
молекулы (1-3), алкильных заместителей при ато-
Следует отметить, что в реакции, по данным
ме азота (4-11) и двух Ph2P(O)-групп. В молекуле
ЯМР 1Н и 31Р, в качестве побочного продукта об-
минорного конформера протоны, ядра 13С и 31Р
разуется тетрафенилэтилендифосфиндиоксид
9
являются магнитно неэквивалентными (m1 и m2).
(6-8%).
Так, в спектрах ЯМР 31Р амидов 1-3 наблюдаются
Для подтверждения строения полученных
три сигнала: синглет атома фосфора M-конформе-
соединений 1-7, 9 были использованы данные
ра и пара синглетных сигналов m1 и m2 одинако-
спектроскопии ЯМР 1H, 13C и 31Р растворов этих
вой интенсивности магнитно неэквивалентных
Схема 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
224
БОНДАРЕНКО и др.
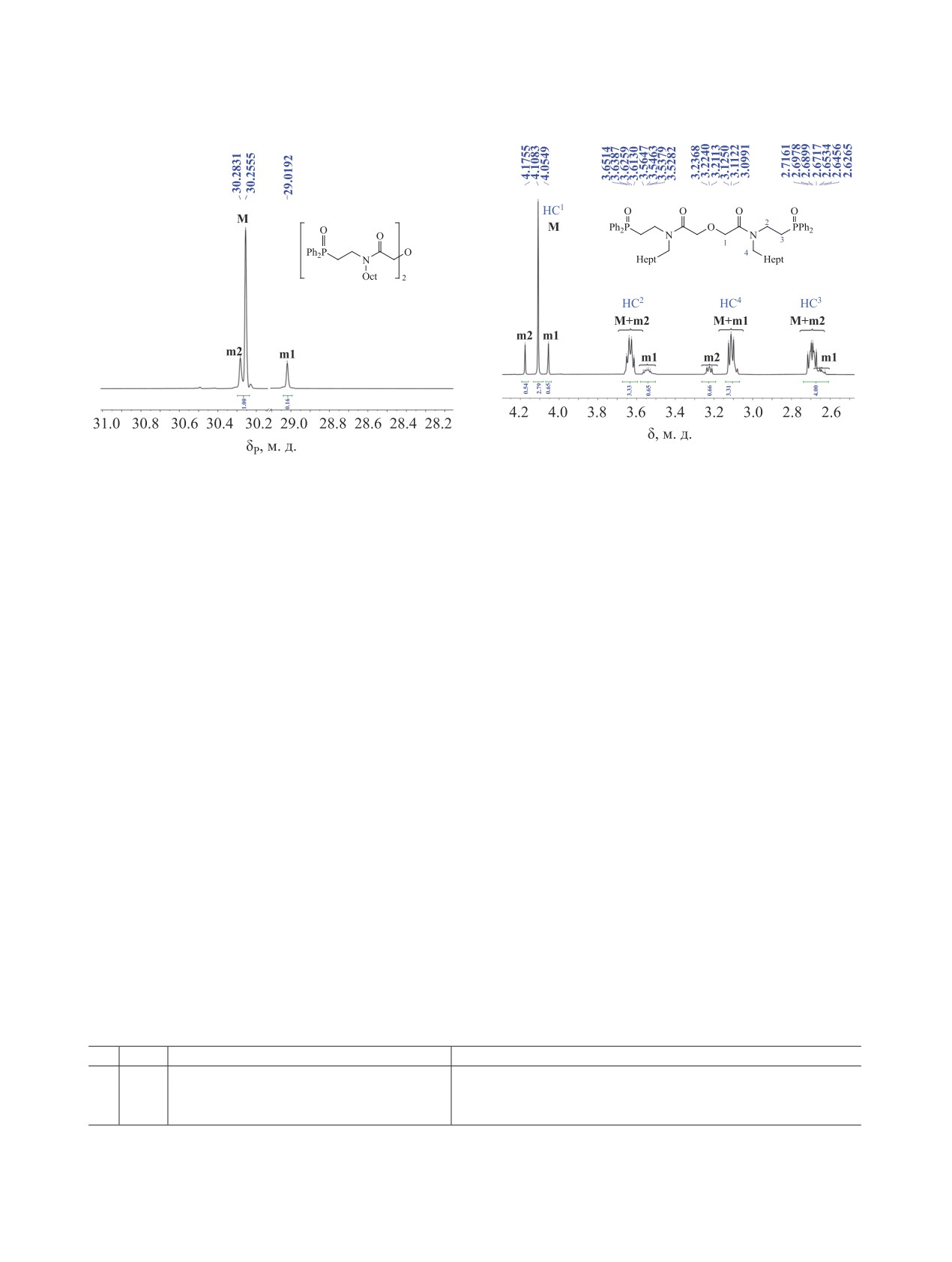
Рис. 2. Фрагмент спектра 1H раствора диамида 3 в
Рис. 1. Спектр 31P{1H} раствора диамида 3 в CDCl3.
CDCl3.
атомов фосфора m-конформера (рис. 1, табл. 2).
2.87 м. д. соответственно М и m конформеров. По-
Соотношение интегральных интенсивностей
следние содержат магнитно неэквивалентные про-
сигналов M и m1+m2 составляет примерно 1.8:1
тоны m1 и m2. Протоны остальных метиленовых
(R = Me) и 2.6:1 (R = Bu, Oct). Следует отметить,
групп H2C4N и H2C3P всех трех амидов в спектрах
что соотношение конформеров не зависит от спо-
ЯМР 1Н представлены только мультиплетными
соба получения амидов 1-3, а нагревание их рас-
сигналами (рис. 2, табл. 3).
творов в ДМФА-d6 до 70°С и охлаждение до -30°С
Следует отметить, что данные спектров ЯМР
не приводит к каким-либо изменениям в соотно-
1Н, зарегистрированных в режиме полной шу-
шении наблюдаемых сигналов.
мовой развязки от 31Р, подтверждают наличие
В спектрах ЯМР 1Н растворов амидов 1-3 в
спин-спинового взаимодействия протонов H2C2
CDCl3 количество сигналов соответствует чис-
и H2C3 с атомом фосфора. Такое отнесение под-
лу неэквивалентных протонов, а положение сиг-
тверждают данные гомоядерных спектров COSY
налов протонов N-метильного (4), N-бутильного
1H-1H амидов 1-3, по которым были установлены
(4-7) и N-октильного (4-11) фрагментов в обла-
спиново-связанные протоны соседних метилено-
сти 0.50-3.25 м. д. являются характерными для
вых групп 2 и 3 между атомами N и Р, метилено-
их структуры. Наличие двух конформеров в рас-
вых групп 4-7 в бутильном и 4-11 в октильном
творах подтверждается существованием двух или
заместителях при атоме азота, а также группы
трех протонных сигналов CH3, CH2, и СНPh групп
H2C1O между атомами N и O.
скелета молекул и заместителей при атоме азота
Кроме того, подтверждением отнесения сиг-
диамидов 1-3.
налов 1Н (M и m) групп Н2С2N и H2C4N является
Протонам H2C1P-группы диамидов 1-3, а так-
наличие их кросс-пиков с 13С сигналом С=О груп-
же H3C4N-группы диамида 1, принадлежат по три
пы, а также 1Н сигналов Н2С3P-групп с сигналами
синглетных сигнала в области 3.90-4.20 и 2.82-
ядер ипсо-13С фенильного фрагмента в спектрах
Таблица 2. Данные спектроскопии ЯМР 31Р{1Н} (202.47 МГц) растворов диамидов 1-3 в CDCl3
№
R
δР, м. д.
Соотношение интенсивностей сигналов 31Р М и m форм
1
Me
29.0 (m1), 30.1 (M), 30.2 (m2)
1.8:1
2
Bu
29.1 (m1), 30.2 (M + m2)
2.6:1
3
Oct
29.0 (m1), 30.28 (M), 30.26 (m2)
2.6:1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
НОВЫЕ БИС[N-АЛКИЛ-N-(2-ДИФЕНИЛФОСФИНИЛЭТИЛ)]АМИДЫ
225
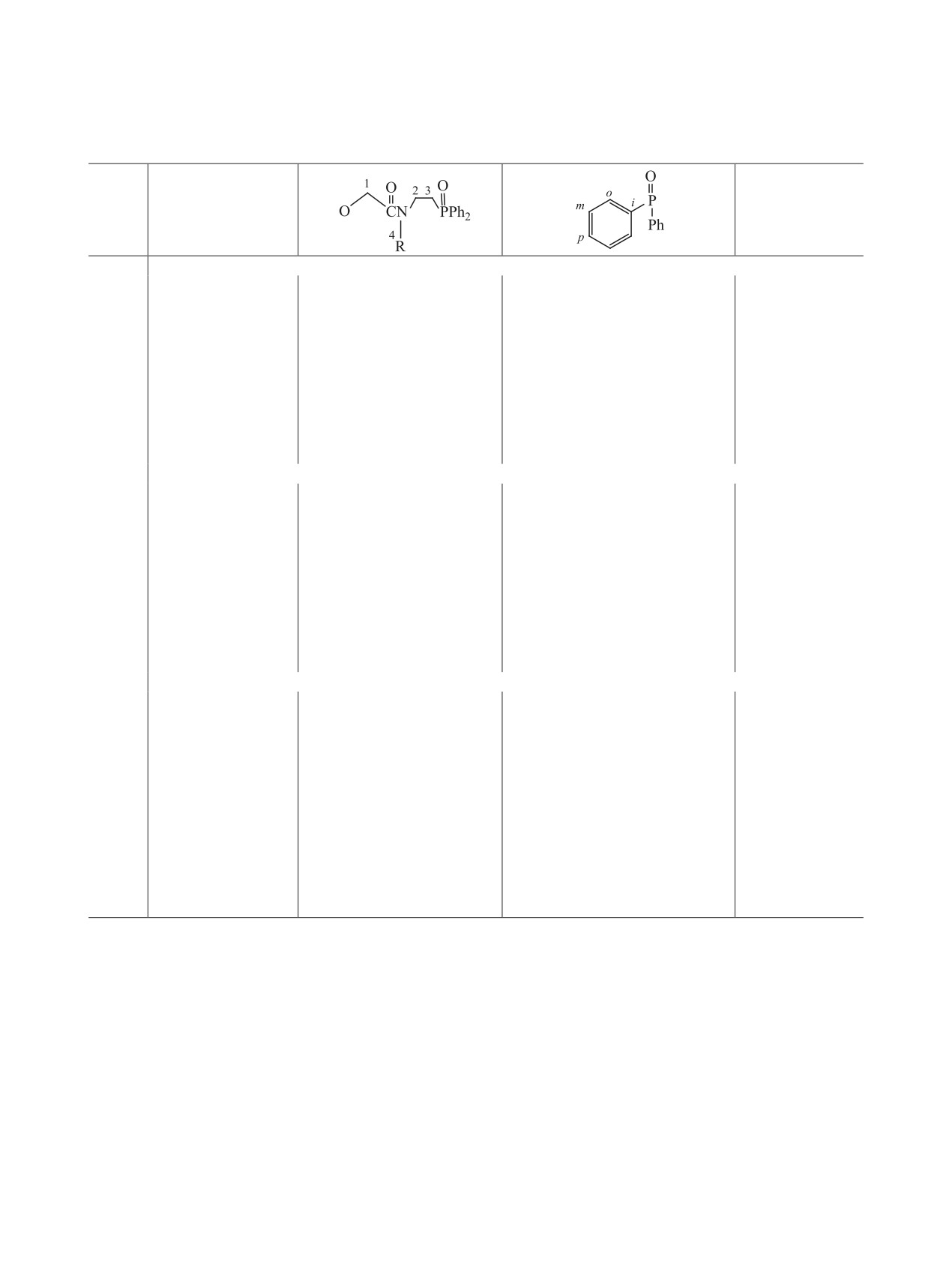
Таблица 3. Данные спектроскопии ЯМР 1Н (600.22 МГц, δ, м. д,) растворов диамидов 1-3 в CDCl3
R
R
Me
Мажорный конформер (М) 66.7% + минорный конформер (m) 33.3%
2.82 c [3H, Н3С4N (m1)],
2.60-2.67 м [8Н, Н2С3P
3.97 c [2Н, Н2С1
7.40-7.56 м [8H, мета-СН
2.86 c [3H, Н3С4N (m2)],
(M+m1+m2)], 3.52-3.62 м
(m1)], 4.02 c [4H,
(M) + 8H, мета-СН (m) +
2.87 c [6H, Н3С4N (M)]
[2H, Н2С2N (m1)], 3.62-3.69
Н2С1 (M)], 4.18 c
4H, пара-СН (M) + 4H,
м (6H, Н2С2N (M+m2)]
[2Н, Н2С1 (m2)]
пара-СН (m)], 7.70-7.82 м
[8H, орто-СН (M) + 8H,
орто-СН (m)]
Bu
Мажорный конформер (М) 72.2% + минорный конформер (m) 27.8%
0.81-0.92 м [12Н, Н3С7
2.60-2.75 м [8Н, Н2С3P
4.04 c 2H, Н2С1
7.38-7.67 м [8Н, мета-СН
(M+m)], 1.18-1.28 м [8Н,
(M+m1+m2)], 3.04-3.17 м
(m1)], 4.09 c [4H,
(M) + 8H, мета-СН (m) +
Н2С6(M+ m)], 1.38-1.50 м
[6Н, Н2С4N (M+m1)], 3.17-
Н2С1 (M)], 4.16 c
4H, пара-СН (M) + 4H,
[8Н, Н2С5 (M+m)]
3.26 м [2Н, Н2С4N (m2)],
[2H, Н2С1 (m2)]
пара-СН (m)], 7.67-7.92 м
3.46-3.56 м [2Н, Н2С2N
[8Н, орто-СН (M) + 8Н,
(m1)], 3.56-3.68 м [6Н,
орто-СН (m)]
Н2С2N (M+m2)]
Oct
Мажорный конформер (М) 72.2% + минорный конформер (m) 27.8%
0.84-0.90 м [12Н, Н3С11
2.61-2.74 м [8Н, Н2С3Р
4.05 c [2H, Н2С1
7.42-7.56 м [8Н, мета-СН
(M+m)], 1.28-1.31 м [40Н,
(M+m1+m2)], 3.08-3.14 м
(m1)], 4.11 c [4H,
(M) + 8H, мета-СН (m) +
Н2С6-Н2С10 (M+m)], 1.40-
[6Н, Н2С4N (M+m1)], 3.20-
Н2С1 (M)], 4.18 c
4H, пара-СН (M) + 4H,
1.51 м [8Н, Н2С5 (M+m)]
3.25 м [2Н, Н2С4N (m2)],
[2H, Н2С1 (m2)]
пара-СН (m)], 7.76-7.85 м
3.49-3.58 м [2Н, Н2С2N
[16Н, орто-СН (M + m)]
(m1)], 3.60-3.68 м [6Н,
Н2С2N (M+m2)]
НМВС, отражающих вицинальное и геминальное
мультиплетный сигнал относится к орто-1Н фе-
взаимодействие ядер. Для сигналов протонов (M,
нильных заместителей (M + m) (табл. 3).
m1 и m2) Н2С1О групп найдены все три кросс-пи-
На основании данных HSQC 1H-13С экспери-
ка с соответствующими сигналами ядер 13С.
мента было сделано отнесение сигналов в спек-
Соотношение интегральных интенсивностей
трах ЯМР 13C амидов 1-3 и определены значения
индикаторных сигналов 1H и 13C в группах H2C1Р,
химических сдвигов для ядер 13C всех групп в ске-
H2C2N, H2C4N примерно соответствует таковому в
лете молекулы, в алкильных заместителях при ато-
спектрах 31Р. Следует отметить, что N,N,N’,N’-те-
ме азота и фенильных радикалах при атоме фосфо-
трабутилдиамид дигликолевой кислоты, не содер-
ра (табл. 4).
жащий фосфорильной группы в амидной части
В спектрах
13С{1H}, снятых в режиме
молекулы, по данным ЯМР 1Н, существует в виде
JMODECHO, углеродные ядра всех групп CH2 и
двух конформеров, соотношение которых состав-
С=О амидов 1-3 представлены тремя сигналами
ляет 1:1 [18].
конформеров M и m, за исключением групп H2C3Р
В спектрах ЯМР 1Н амидов 1-3 в области
в амидах 1-3 и H2C4N в амиде 3, в которых ядрам
7.34-7.90 м. д. наблюдаются два мультиплетных
13С принадлежат два синглета (табл. 4). Следует
сигнала, первый из которых принадлежит мета- и
отметить, что в спектрах амидов 2, 3 абсолютное
пара-протонам фенильных заместителей при ато-
значение разницы химических сдвигов для сигна-
ме фосфора обоих конформеров (M + m). Второй
лов ядер 13С углеводородных заместителей при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
226
БОНДАРЕНКО и др.
Таблица 4. Данные спектроскопии ЯМР 13С (150.925 МГц, δС, м. д., J, Гц) растворов диамидов1-3 в CDCl3
R
R
C=O
Me
Мажорный конформер (М) 66.7% + минорный конформер (m) 33.3%
32.97 [С4 (m1)],
27.44 д [C3, (M+m1), 1JСP
128.76 д [мета-СH (M+m1), 3JCP
168.42 (m1),
35.15 [C4 (m2)],
69.5], 29.15 д [C3, (m2), 1JСP
11.7], 128.86 д [мета-СH (m2),
68.65 (m2),
35.20 [С4 (M)]
67.6], 42.98 [C2 (m1)], 43.23
3JCP 11.6], 130.52 д [орто-СH
69.02 (M)
[C2 (m2)], 43.29 [C2 (M)],
(M+m1), 2JCP 9.4], 130.60 д
69.06 [C1 (M)], 69.12 [C1
[орто-СH (m2), 2JCP 10.9],
(m1)], 69.74 [C1 (m2)]
131.90 д [пара-СH (M+m1), 4JCP
2.7], 132.12 д [пара-СH (m2), 4JCP
2.8], 132.20 д [ипсо-С (m1), 1JCP
94.0], 132.68 д [ипсо-С (M+m2),
1JCP 99.4]
Bu
Мажорный конформер (М) 72.2% + минорный конформер (m) 27.8%
13.77 [C7 (M+m)],
27.82 д [C3, (M+m1), 1JСP
128.74 д [мета-СH (M+m1), 3JCP
168.13 (m1),
19.89 [C6 (M+m1)],
69.0], 29.66 д, [C3 (m2), 1JСP
11.7], 128.86 д [мета-СH (m2),
168.56 (m2),
20.07 [C6 (m2)],
68.2], 40.64 [C2 (m1)], 41.20
3JCP 11.9], 130.57 д [орто-СН
168.88 (M)
31.12 [C5 (M+m)]
[C2 (m2)], 41.27 [C2 (M)],
(M+m1), 2JCP 9.5], 130.63 д
45.13 [C4 (m2)], 45.19 [C4
[орто-СН (m2), 2JCP 9.8], 131.86
(m1)], 47.79 [C4 (M)], 68.80
д [пара-СH (M+m1), 4JCP 2.7],
[C1 (m1)], 68.90 [C1 (M)],
132.11 д [пара-СH (m2), 4JCP
69.77 [C1 (m2)]
2.6], 132.20 д [ипсо-С (m1), 1JCP
99.3], 132.74 д [ипсо-С (M+m2),
1JCP 99.5]
Oct
Мажорный конформер (М) 72.2% + минорный конформер (m) 27.8%
14.10 [C11 (M+ m)],
27.14 [C3 (m1), 1JСP 74.7],
128.76 д [мета-СH (М+m1), 3JCP
168.12 (m1),
22.60 [C10 (M+m1)],
27.80 д [C3 (M+m2), 1JСP
11.3], 128.88 д [мета-СH (m2),
168.57 (m2),
22.64 [C10 (m2)],
69.1], 40.67 [C2 (m1)], 41.23
3JCP 11.8], 130.58 д [орто-СН
168.93 (M)
26.70 [C7 (M+m1)],
[C2 (m2)], 41.28 [C2 (M)],
(M+m1), 2JCP 9.6], 130.65 д
26.72 [C7 (m2)],
45.52 [C4 (m1)], 48.04 [C4
[орто-СН (m2), 2JCP 10.3],
29.12 [C5 (M+m1)],
(M+m2)], 68.80 [C1 (m1)],
131.88 д [пара-СH (M+m1), 4JCP
29.22 [C5 (m2)],
68.92 [C1 (M)], 69.78 [C1
2.7], 132.15 д [пара-СH (m2), 4JCP
29.19
(m2)]
2.6], 132.18 д [ипсо-С (m1), 1JCP
[C8 (M+m)], 29.29
99.6], 132.71 д [ипсо-С (M+m2),
[C9 (M+m)], 31.70
1JCP 99.4]
[C6 (M+m1), 31.77
[C6 (m2)]
атоме азота конформеров M и m ΔδС = δС (M) - δС
личие от дублетных сигналов этих ядер, наблюдае-
(m) последовательно уменьшается при переходе
мых в спектрах вторичных аминов (табл. 1) [20, 21],
от NС4Н2-группы к конечной группе СН3. Это по-
а также N-алкил-N-(2-дифенилфосфинилэтил)-
зволило сделать отнесение сигналов метиленовых
амидах дифенилфосфинилуксусной кислоты [19].
групп 9 и 10 в спектрах ЯМР 13С амида 3 (табл. 4)
В области 128-133 м. д. наблюдаются по две
[19]. Кроме того, у сигналов 13С ядер β-C2H2-групп
пары дублетных сигналов (M + m1, m2) ядер 13С
отсутствует расщепление на атоме фосфора, в от-
фенильных заместителей при атоме фосфора с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
НОВЫЕ БИС[N-АЛКИЛ-N-(2-ДИФЕНИЛФОСФИНИЛЭТИЛ)]АМИДЫ
227
КССВ для орто- (3JCP 9.4-10.9 Гц), мета- (2JCP
11.3-11.9 Гц), пара- (4JCP 2.6-2.8 Гц) и (m1, M +
m2) для ипсо-13С (1JCP 99.0-99.6 Гц) (рис. 3, табл. 4).
Углеродным ядрам С=О групп амидов 1-3 при-
надлежат три синглетных сигнала (M, m1и m2) в
области 168.40-169.00 м. д. (табл. 4). Сделанное
отнесение сигналов 1Н и 13С, значения химических
сдвигов которых приведены в табл. 3 и 4, подтвер-
ждаются наличием соответствующих кросс-пиков
в корреляционных спектрах НМВС.
Таким образом, реакцией хлорангидрида дигли-
колевой кислоты со вторичными N-алкил-N-(2-ди-
фенил-фосфинилэтил)аминами
синтезированы
пентадентатные диамиды дигликолевой кислоты
[Ph2P(O)CH2CH2N(R)C(O)CH2]2O, где R = Me, Bu,
Рис. 3. Фрагмент спектра 13С{1H} раствора диамида
Oct. По данным ЯМР 1H, 13C и 31P, в растворах
3 в CDCl3.
CDCl3 полученные соединения находятся в виде
двух конформеров в соотношении 1.8:1 (R = Me)
и 2.6 : 1 (R = Bu, Oct). В молекуле минорного кон-
2-Феноксиэтанол. К нагретому до 80°С рас-
формера протоны, ядра 13С и 31Р являются магнит-
твору фенолята натрия, приготовленному из 19.9 г
но неэквивалентными.
(212 ммоль) фенола и 11.0 г (275 ммоль) NaOH в
17 мл H2O, прибавили по каплям при перемешива-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
нии 17.9 г (15 мл, 223 ммоля) этиленхлоргидрина
Спектры ЯМР 1Н, 13С{1H} и 31Р{1H} растворов
в течение 30 мин. Гетерогенную смесь нагревали
реакционных смесей и исследованных соедине-
при 90-95°С в течение 20 мин, затем охлаждали.
ний в CDCl3 зарегистрированы на спектрометрах
Маслянистую жидкость темно-вишневого цве-
Advance III NanoBay и Bruker AvanceTM 500 и 600.
та декантировали и промывали водой (2×10 мл).
Рабочая частота составляет 300.28, 500.13 600.22
Осадок растворяли в 15 мл воды, раствор экстра-
МГц (1Н), 75.51, 125.77 и 150.925 МГц (13С) и
гировали CHCl3 (3×10 мл). Экстракт, объединен-
121.495, 202.46 и 242.974 МГц (31Р) соответствен-
ный с маслянистой жидкостью, сушили Na2SO4
но. Для отнесения сигналов в спектрах ЯМР 1Н
и упаривали в вакууме, остаток 24.6 г (84%) пе-
и 13С были применены двумерные гомо- (1Н-1Н)
регоняли. Выход 20.0 г (68%), т. кип. 134-136°С
и гетеро- (1Н-13С) корреляционные методики из
(18 мм рт. ст.) {т. кип. 128-130°С (20 мм рт. ст.)
стандартной библиотеки программ Bruker, ис-
[23]}. Спектр ЯМР 1H (300.28 МГц, CDCl3), δ, м. д.
пользующие импульсные полевые градиенты -
(J, Гц): 2.57 уш. с (1H, OH), 3.98 м (2H, СH2OH),
gs-COSY, gs-HSQC и gs-HMBC. Масс-спектры
4.10 м (2H, CH2OPh), 6.95 д (2H, oрто-CH, 3JHH
растворов полученных соединений в метаноле
7.6), 7.00 т (1H, пара-CH, 3JHH 7.4), 7.32 д. д (2H,
зарегистрированы на масс-спектрометре AmaZon
мета-CH, 3JHH 7.2, 3JHH 7.4 Гц). Спектр ЯМР
Bruker Daltonik GmbH, режим сканирования Ultra-
13C{1H} (75.50 МГц, CDCl3), δC, м. д.:
61.59
Scan положительной ионизации, диапазон реги-
(CH2OH),
69.29 (CH2OPh),
114.76 (oрто-CH),
стрируемых элементов m/z 70-2200. Температуры
121.34 (пара-CH), 129.74 (мета-CH), 158.78 (ипсо-C).
плавления измерены укороченными термометрами
2-Феноксиэтилдифенилфосфиноксид
(7).
Аншютца в специальном блоке с использованием
Смесь 30.0 г (148 ммоль) дифенилфосфинистой
капилляров.
кислоты [24] и 48 мл (37.1 г, 230 ммоль) гексаме-
Дихлорангидрид
дигликолевой
кислоты
тилдисилазана перемешивали при 120°С в течение
(Aldrich) был использован без дополнительной
1 ч, а затем при той же температуре в токе аргона
очистки. Органические растворители высушены
прибавляли по каплям 19.7 г (126 ммоль) 2-фе-
известными методами [22].
ноксиэтилхлорида [23] в течение 30 мин. Смесь
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
228
БОНДАРЕНКО и др.
нагревали при 180-200°С в течение 3 ч, отгоняя
и 21.88 д. д (CH2P, 1JСP = 2JСP = 31.4, два конформе-
триметилхлорсилан (т. паров 57-97°С). После ох-
ра), 128.86 два перекрывающихся дублета (мета-
лаждения смесь разбавляли CCl4 (70 мл) и CHCl3
CH, 3JСP 5.9), 130.77 два перекрывающихся ду-
(30 мл) и перемешивали при 40-50°С в течение
блета (орто-CH,
2JСP
4.8),
131.89 д (ипсо-C,
3 ч. К смеси добавляли 50 мл воды, органический
1JСP 100.2), 132.09 с (пара-CH). Спектр 31Р{1H}
слой отделяли, промывали последовательно на-
(121.56 МГц, CDCl3): δР 32.8 м. д. Масс-спектр,
сыщенным раствором K2CO3 (5×10 мл)1, H2O (2×
m/z (Iотн, %): 431 (20) [M + H]+, 453 (100) [M + Na]+.
10 мл), 5%-ным раствором HCl (10 мл), H2O (2×
N-Метил-N-(2-дифенилфосфинилэтил)амин
10 мл), сушили Na2SO4 и упаривали в вакууме. К
(4). Смесь 4.00 г (12.4 ммоль) дифенил-(2-фенок-
остатку (39.2 г, масло желтого цвета) добавляли
сиэтил)фосфиноксида 7, 4.3 мл 40%-ного раство-
50 мл Et2O, кристаллы отфильтровывали (38 г).
ра (3.86 г, 124.0 ммоль) метиламина и 50%-ного
По данным ЯМР 31P{1H}, продукт содержит 94%
водного раствора 1.1 г (18 6 ммоль) KOH в 10 мл
фосфиноксида 7 и 6% диоксида 9. Кристалличе-
ДМСО перемешивали в течение 1 ч при 70°С. Сте-
ский продукт смешивали с EtOAc (100 мл), ге-
пень превращения исходного оксида 7 контроли-
терогеннную смесь пропускали через колонку с
ровали методом ЯМР 31Р. Смесь разбавляли 10 мл
30 г SiO2 и промывали EtOAc (10×50 мл). Элюат
воды, экстрагировали CHCl3 (3×15 мл), экстракт
упаривали в вакууме. Остаток 35.5 г (88%) с т. пл.
тщательно промывали 30%-ным раствором KOH
103-105°С перекристаллизовали из EtOAc. Выход
(3×10 мл), сушили Na2SO4 и упаривали в вакууме.
34.9 г (86%), т. пл.105-106°С (т. пл. 105-106°С
Остаток выдерживали2 при 50°С (1 мм рт. ст.) в те-
[25]). Спектр ЯМР 1H (300.28 МГц, CDCl3), δ, м. д.
чение 1 ч и растворяли в 16 мл 5%-ного раствора
(J, Гц): 2.86 д. т (2H, PCH2, 3JHH 7.4, 2JHP 11.7), 4.34
HCl. Раствор промывали бензолом (3×10), подще-
д. т (2H, CH2O, 3JHH 7.4, 3JHP 9.3), 6.73 д (2H, oрто-
лачивали насыщенным раствором K2CO3 до pH 12
CHOPh, 3JHH 8.6), 6.91 т (1Н, пара-CHOPh, 3JHH 7.4),
и экстрагировали CHCl3 (3×10 мл). Экстракт про-
7.21 д. д (2H, мета-CHOPh, 3JHH 7.3 Гц), 7.44-7.58
мывали насыщенным раствором K2CO3 (10 мл),
м (6H, мета-CHPPh + пара-CHPPh), 7.78 д. д. д (4H,
сушили Na2SO4 и упаривали в вакууме. Остаток
oрто-CHPPh, 3JHH 7.9, 4JHH 1.6, 3JHP 11.7). Спектр
очищали на колонке с SiO2 марки Fluka (70-230
ЯМР 13C{1H} (75.50 МГц, CDCl3), δС, м. д. (J, Гц):
меш, 60 Å) в системе CHCl3-CH3OH, 20:2. Выход
30.56 д (PCH2, 1JСP 70.7), 61.58 (CH2O), 114.65
2.80 г (87%), т. пл. 61-63°C (т. пл. 28-30°С [26]).
(oрто-COPh), 121.28 (пара-COPh), 128.96 д (мета-
Данные ЯМР 1H, 13C и 31P приведены в табл. 1.
CPPh, 3JСP 12.0), 129.64 (мета-COPh), 130.99 д (oрто-
Масс-спектр, m/z (Iотн, %): 260 (100) [M + H]+, 282
CPPh, 2JСP 9.6), 132.25 д (пара-CPPh, 4JСP 3.1) 132.63 д
(12) [M + Na]+, 519 (94) [2M + H]+, 541 (80) [2M +
(ипсо-CPPh, 1JСP 100.6), 158.18 (ипсо-COPh). Спектр
Na]+. Найдено, %: C 69.29; H 7.11; N 5.42; P 12.00.
ЯМР 31Р{1H} (121.56 МГц, CDCl3): δР 29.9 м. д.
C15H18NOP. Вычислено, %: C 69.48; H 7.00; N 5.40;
Масс-спектр, m/z (Iотн, %): 323 (23) [M + H]+, 345
P 11.95.
(95) [M + Na]+, 667 (34) [2M + Na]+.
N-Бутил-N-(2-дифенилфосфинилэтил)-
Оставшееся на колонке вещество элюировали
амин (5) получали аналогично из 6.0 г 18.6 ммоль)
метанолом, элюат упаривали в вакууме, остаток
фосфиноксида 7 и 13.6 г (18 мл, 186.0 ммоль)
2.1 г (6%) с т. пл. 265-268°C перекристаллизова-
н-бутиламина, 50%-ного водного раствора 1.6 г
ли из этанола. Получено 1.4 г (4%) диокиси 9 с т.
(27.9 ммоль) KOH и 15 мл ДМСО. Выход 5.0 г
пл. 268-269°С (т. пл. 269-279°С [14]). Спектр ЯМР
(89%), т. пл. 67-68°C (т. пл. 64-65°С [27]). Дан-
ные ЯМР 1H, 13C и 31P приведены в табл. 1. Масс-
1H (CDCl3, 600.22 МГц), δ, м. д. (J, Гц): 2.49 с и
спектр, m/z (Iотн, %): 302 (100) [M + H]+, 324 (33)
2.50 с (4H, CH2P, два конформера), 7.42 д. д (8H,
[M + Na]+, 340 (9) [M + K]+, 603 (18) [2M + H]+, 625
мета-CH, 3JHH = 4JHP = 7.5), 7.47 д. д (4H, па-
(11) [2M + Na]+.
ра-CH, 3JHH = 5JHP = 7.4), 7.68 д. т (8H, орто-CH,
3JHH = 4JHP = 6.9, 3JHP 5.2). Спектр ЯМР 13C{1H}
N-Октил-N-(2-дифенилфосфинилэтил)-
(150.925 МГц, CDCl3), δС, м. д. (J, Гц): 21.44 д. д
амин (6) получали аналогично из 6.2 г (19.1 ммоль)
1 Органический слой промывали до тех пор, пока при под-
2 Для удаления остатков ДМСО в ловушку, охлаждаемую
кислении промывных вод не перестала выпадать Ph2P(O)OH.
жидким азотом.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
НОВЫЕ БИС[N-АЛКИЛ-N-(2-ДИФЕНИЛФОСФИНИЛЭТИЛ)]АМИДЫ
229
фосфиноксида 7 и 14.8 г (19 мл, 114.6 ммоль)
Бис[N-октил-N-(2-дифенилфосфинилэтил)]-
н-октиламина, 50%-ного водного раствора 1.6 г
амид дигликолевой кислоты (3) получали анало-
(28.6 ммоль) KOH и 15 мл ДМСО (70°С, 3 ч). По-
гично из 2.11 г (5.9 ммоль) амина 6, 0.91 г (1.3 мл,
сле очистки на колонке амин 6 (5.6 г, 82%) пере-
9.0 ммоль) Et3N и 0.54 г (0.4 мл, 3.2 ммоль) дихло-
кристаллизовывали из EtOAc. Выход 5.0 г (74%),
рангидрида дигликолевой кислоты. Выделено 2.40
т. пл. 79.5-80.5°C (т. пл. 35°С [21]). Данные ЯМР
г масла желтого цвета, после очистки которого на
1H, 13C и 31P приведены в табл. 1. Масс-спектр, m/z
колонке с SiO2 в системе CHCl3-MeOH 40:0.2-40:2
(Iотн, %): 358 (99) [M + H]+, 380 (40) [M + Na]+, 715
получено 1.95 г (85%) диамида 3 в виде густого
(12) [2M + H]+, 737 (13) [2M + Na]+. Найдено, %: C
бесцветного масла. Данные спектров ЯМР 1H, 13C
73.99; H 8.99; N 4.01; P 8.47. C22H32NOP. Вычисле-
и 31P приведены в табл. 2 и 3. Найдено, %: C 68.66;
но, %: C 73.92; H 9.02; N 4.00; P 8.66.
H 8.34; N 3.15; P 7.49. C48H66N2O5P2 ×1.5H2O . Вы-
Бис[N-метил-N-(2-дифенилфосфинилэтил)]-
числено, %: C 68.66; H 8.28; N 3.34; P 7.38.
амид дигликолевой кислоты (1). К раствору
ФОНДОВАЯ ПОДДЕРЖКА
2.90 г (11.2 ммоль) N-метил-N-(2-дифенилфосфи-
Работа выполнена при поддержке Министер-
нилэтил)амина 4 и 1.81 г (2.5 мл, 17.8 ммоль) Et3N
ства науки и высшего образования Российской Фе-
в 20 мл безводного CHCl3 при -10-0°C очень мед-
ленно прибавляли по каплям при перемешивании
дерации с использованием научного оборудования
Центра коллективного пользования Национально-
в токе аргона 1.02 г (6.0 ммоль) дихлорангидрида
дигликолевой кислоты в 4 мл безводного CHCl3.
го исследовательского центра «Курчатовский ин-
Смеси дали нагреться до комнатной температуры
ститут» и Центра исследования строения молекул
Института элементоорганических соединений им.
(1.5 ч), а затем нагревали при 40-50°С в течение
4 ч и оставляли на ночь. Смесь разбавляли 20 мл
А.Н. Несмеянова РАН.
воды и 10 мл CHCl3, слои разделяли. Водный слой
КОНФЛИКТ ИНТЕРЕСОВ
экстрагировали хлороформом (2×10 мл), объе-
Авторы заявляют об отсутствии конфликта
диненный экстракт промывали 2%-ной соляной
интересов.
кислотой (2×15мл), затем насыщенным раствором
K2CO3 (2×15мл), сушили Na2SO4 и упаривали в ва-
СПИСОК ЛИТЕРАТУРЫ
кууме. Остаток 3.50 г (101%), масло желтого цве-
1. Ansari S.A., Pathak P., Mohapatra P.K., Manchan-
та, очищали методом колоночной хроматографии
da V.K. // Chem. Rev. 2012. Vol. 112. N 3. P.1751. doi
на силикагеле марки (Aldrich, 13-270 меш, 60 Å) в
10.1021/cr200002f
системе CHCl3-MeOH, 20:1-20:2. Получено 3.00 г
2. Stephan H., Gloe K., Beger J., Muhl P. // Solv.
(89%) диамида 1 в виде густого бесцветного мас-
Extr. Ion Exch. 1991. Vol. 9. N 3. P. 459. doi
ла. Данные спектров ЯМР 1H, 13C и 31P приведены
10.1080/07366299108918064
в табл. 2 и 3. Найдено, %: C 63.82; H 6.82; N 4.29;
3. Sasaki Y., Suzuki S., Tachimori S., Kimura T. // Proc. Int.
P 9.91. C34H38N2O5P2 ×1.3H2O. Вычислено, %: C
Conf. Global. New Orlean, 2003. Vol. 2. P. 1266.
63.81; H 6.40; N 4.38; P 9.68.
4. Sypula M., Wildem A., Schreinemachers C., Modolo G. //
Proc. First ACSEPT Int. Workshop, Lisbon, 2010. http://
Бис[N-бутил-N-(2-дифенилфосфинилэтил)]-
амид дигликолевой кислоты (2) получали анало-
5. Leoncini A., Mohapatra P.K., Bhattacharyya A.,
гично из 1.70 г (5.6 ммоль) амина 5, 0.86 г (1.18 мл,
Raut D.R., Senqupta A., Verma P.K., Tiwari N.,
8.5 ммоль) Et3N и 0.51 г (3.0 ммоль) дихлоран-
Bhattacharyya D., Jha S., Wonda A.M., Huskens J.,
гидрида дигликолевой кислоты. Выделено 2.40 г
Verboom W. // Dalton Trans. 2016. Vol. 45. N 6. P. 2476.
густого масла желтого цвета, после очистки кото-
doi 10.1039/C5DT04729C
рого на колонке с SiO2 получено 1.52 г (77%) диа-
6. Mohapatra P.K., Senqupta A., Iqbal M., Huskens J.,
мида 2 в виде густого бесцветного масла. Данные
Verboom W. // Inorg. Chem. 2013. Vol. 52. N 5. P. 2533.
спектров ЯМР 1H, 13C и 31P приведены в табл. 2
doi 10.1021/ic302497k
и 3. Найдено, %: C 66.73; H 7.64; N 4.02; P 8.98.
7. Iqbal M., Huskens J., Verboom W., Sypula M., Modolo G. //
C40H50N2O5P2 × H2O. Вычислено, %: C 66.84; H
Supramol. Chem. 2010. Vol. 22. N 11-12. P. 827. doi
7.29; N 3.90; P 8.62.
10.1080/10610278.2010.506553
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
230
БОНДАРЕНКО и др.
8.
Turanov A.N., Karandashev V.K., Kharlamov A.V.,
Ion Exch.
2019. Vol.
37. N
1. P.
65. doi
Bondarenko N.A. // Solv. Extr. Ion Exch. 2014. Vol. 32.
10.1080/07366299.2019.1592923
N 5. P. 492. doi 10.1080/07366299.2014.908584
19.
Бондаренко Н.А., Белусь С.К. , Артюшин О.И., Пере-
9.
Skinner W.A., Rosentreter U., Elward T. // J. Pharm. Sci.
гудов А.С. // ЖОХ. 2020. Т. 90. Вып. 12. С. 1867;
1982. Vol. 71. N 7. P. 837. doi 10.1002/jps.2600710735
Bondarenko N.A., Belus’ S.K., Artyushin O.I., Peregu-
10.
Narita H., Yaita T., Tamura K., Tachimori S. // J.
dov A.S. // Russ. J. Gen. Chem. 2020. Vol. 90. N 12.
Radioanal. Nucl. Chem. 1999. Vol. 239. N 2. P. 381.
P. 2273. doi 10.1134/S1070363220120099
doi 10.1007/BF02349516
20.
Rahman M.S., Steed J.W., Hii R.R. // Synthesis. 2000.
11.
Liu J.-F., Yang H.-J.,Wang W., Li Zh. // J. Chem. Eng.
N 9. P. 1320. doi 10.1055/s-2000-6422
Data. 2008. Vol. 53. N 9. P. 2189. doi 10.1021/je800434j
21.
Matveeva E.V., Petrovskii P.V., Klemenkova Z.S.,
12.
Швецов И.К., Трухляев П.С., Калистратов В.А., Ку-
Bondarenko N.A., Odinets I.L. // Comptes Rendus
лажко В.Г., Харитонов А.В., Антошин А.Э., Цветков
Chimie. 2010. Vol. 13. N 8-9. Р. 964. doi 10.1016/j.
Е.Н. // Радиохимия. 1989. Т. 3. № 2. С. 63.
crci.2010.03.005
13.
Бондаренко Н.А., Царькова К.В., Белусь С.К., Артю-
22.
Гордон A.Д., Форд Р.A. Спутник химика. М.: Мир,
шин О.И. // Тезисы докл. научн. конф., посвященной
1976. 541 с.; Gordon A.J., Ford R.A. The Chemists
115-летию со дня рождения академика Б.А. Арбузо-
Companion: A Handbook of Practical Date, Techniques
ва. Казань, 2018. С. 72.
and References, Wiley, New York, 1972.
14.
Бондаренко Н.А., Рудомино М.В., Цветков Е.Н. //
23.
Földeák S., Czombos J., Matkovics B., Pórszász J. //
Изв. АН СССР. Сер. хим. 1990. № 9. С. 2180;
Acta Phys. Chem. Szeged. 1963. Vol. 9. N 3–4. P. 134.
Bondarenko N.A., Rudomino M.V., Tsvetkov E.N. //
24.
Бондаренко Н.А., Харламов А.В., Вендило А.Г. // Изв.
Russ. Chem. Bull. 1990. Vol. 39. N 9. P. 1989. doi
АН. Сер. хим. 2009. № 9. С. 1814; Bondarenko N.A.,
10.1007/BF00958287
Kharlamov A.V., Vendilo A.G. // Russ. Chem. Bull. 2009.
15.
Бондаренко Н.А. // ЖОХ. 1999. Т. 69. Вып. 7. С. 1058;
Vol. 58. N 9. P. 1872. doi 10.1007/s11172-009-0256-3
Bondarenko N.A. // Russ. J. Gen. Chem. 1999. Vol. 69.
25.
Shutt J.R., Trippett S. // J. Chem. Soc. (C). 1969. N 15.
N 7. C. 1016.
P. 2038. doi 10.1039/J39690002038
16.
Бондаренко Н.А., Цветков Е.Н. // ЖОХ. 1989. Т. 59.
26.
Туранов А.Н., Карандашев В.К., Бондаренко Н.А.,
Вып. 7. С. 1533.
Уринович Е.М., Цветков Е.Н. // ЖНХ. 1996. Т. 41.
17.
Евреинов В.И., Баулин В.Е., Вострокнутова З.Н.,
№ 10. С. 1742; Turanov A.N., Karandashev V.K.,
Цветков Е.Н. // Изв. АН. Сер. хим. 1993. № 3.
С. 518; Evreinov V.I., Baulin V.E., Vostroknutova Z.N.,
Bondarenko N.A., Urinovich E.M., Tsevtkov E.N. //
Tsvetkov E.N. // Russ. Chem. Bull. 1993. Vol. 42. N 3.
Russ. J. Inorg. Chem. 1996. Vol. 41. N 10. P. 1658.
P. 472. doi 10.1007/BF00 698434
27.
Horner L., Lindel H. // Phosphorus, Sulfur, Silicon,
18.
Turanov A.N., Karandashev V.K., Kharlamov A.N.,
Relat. Elem. 1984. Vol. 20. N 2. P. 161. doi
Bondarenko N.A., Khvostikov V.A. // Solv. Extr.
10.1080/03086648408077624
Novel Bis[N-Alkyl-N-(2-diphenylphosphinylethyl)]diglycolamides:
Syntheses and NMR Spectroscopy Studies
N. A. Bondarenkoa,b,*, K. V. Tcarkovaa,b, S. K. Belys’b, O. I. Artyushinc, and A. S. Peregudovc
a Institute of Chemical Reagents and High Purity Chemical Substances of National Research Centre “Kurchatov Institute”,
Moscow, 107076 Russia
b National Research Centre “Kurchatov Institute”, Moscow, 123182 Russia
c A.N. Nesmeyanov Institute of Organoelement Compounds of Russian Academy of Sciences, 119991 Moscow, Russia
*e-mail: bond039@mail.ru
Received November 2, 2020; revised November 2, 2020; accepted November 22, 2020
Pentadentate bis[N-alkyl-N-(2-diphenylphosphinylethyl)]diglycolamides [Ph2P(O)CH2CH2N(R)C(O)CH2]2O,
where R Me, Bu, Oct, were synthesized by reaction of diglycolyl chloride with N-alkyl-N-(2-diphenylphos-
phinylethyl)amines Ph2P(O)CH2CH2NHR obtained by reacting diphenyl(2-phenoxyethyl)phosphine oxide with
primary alkylamines in DMSO in the presence of an aqueous alkali. Structure of the prepared compounds was
studied by 1H, 13C and 31P NMR spectroscopy.
Keywords: diglycolamides, amidation, O-trimethylsilyldiphenylphosphinite, diphenyl(2-phenoxyethyl)phos-
phine oxide, N-alkyl-N-(2-diphenylphosphinylethyl)amines, pentadentate bis-[N-alkyl-N-(2-diphenylphosphiny-
lethyl)]diglycol-amides, NMR spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021