ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 231-237
УДК 547.979.057:661.7.091
СИНТЕЗ И СВОЙСТВА
ПЕНТАЦЕН-2,3-ДИКАРБОНОВЫХ КИСЛОТ И
МЕТАЛЛОПОРФИРАЗИНОВ НА ИХ ОСНОВЕ
© 2021 г. С. А. Знойко*, Т. В. Кустова, Е. И. Павлова, Е. А. Данилова,
А. В. Борисов
Научно-исследовательский институт химии макрогетероциклических соединений Ивановского государственного
химико-технологического университета, пр. Шереметевский 7, Иваново, 153000 Россия
*e-mail: znoykosa@yandex.ru
Поступило в Редакцию 21 октября 2020 г.
После доработки 21 октября 2020 г.
Принято к печати 10 ноября 2020 г.
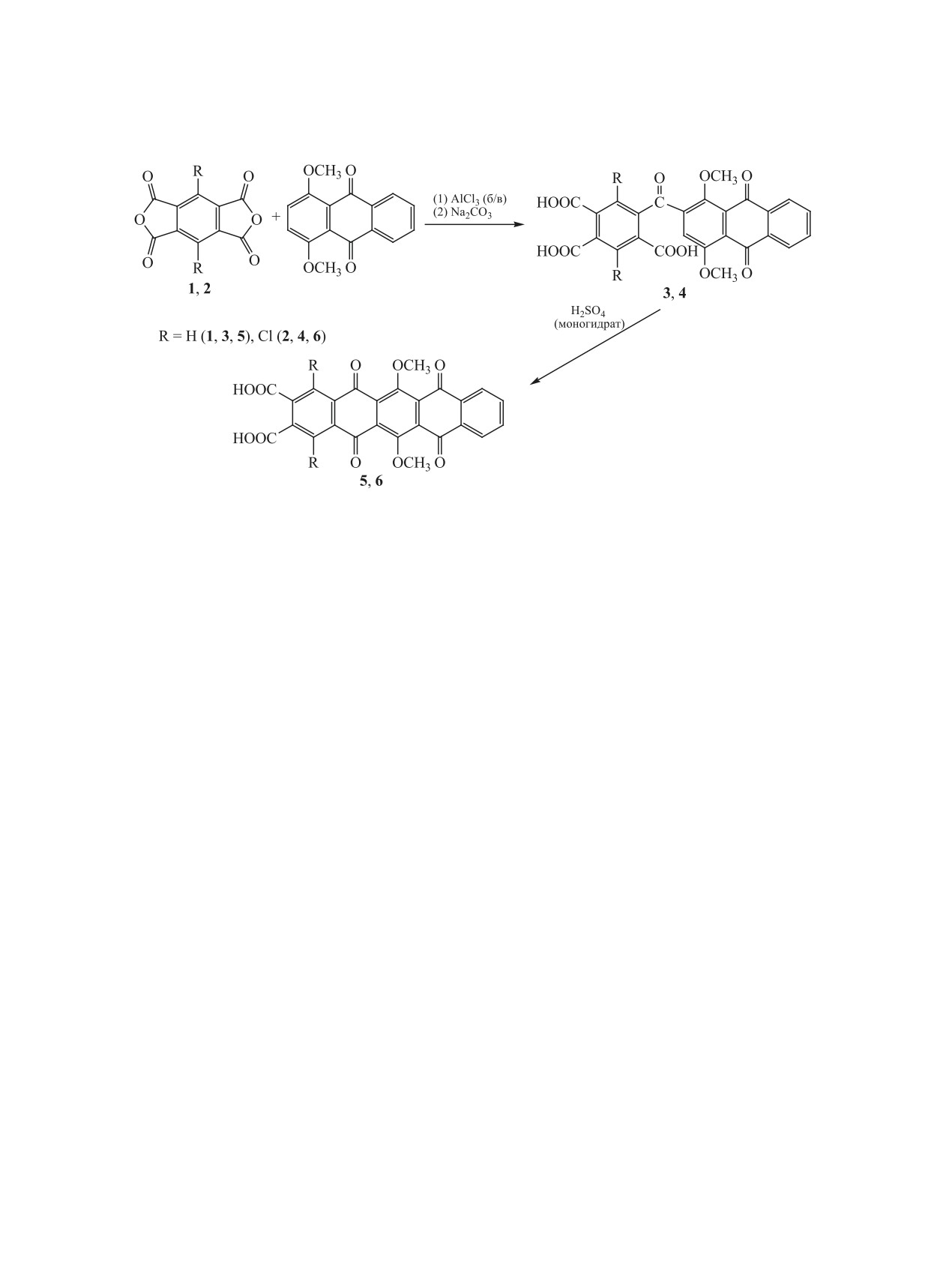
Впервые синтезированы 6,13-диметокси-5,7,12,14-тетраоксо-5,7,12,14-тетрагидропентацен-2,3-дикарбо-
новая кислота и ее 1,4-дихлорпроизводное. При нагревании этих соединений с ацетатами никеля или
кобальта в присутствии мочевины получены соответствующие порфиразины никеля и кобальта. Обсуж-
даются спектральные свойства новых соединений.
Ключевые слова: пентацен-2,3-дикарбоновые кислоты, порфиразины, тетраантрахинонпорфиразины,
электронные спектры поглощения
DOI: 10.31857/S0044460X21020062
Аннелированные фталоцианины с расширен-
вания
1,4-диметоксиантрахинона пиромеллито-
ной сопряженной π-электронной системой обла-
вым диангидридом 1 и его дихлорпроизводным
дают уникальными электронооптическими свой-
2 с последующей внутримолекулярной цикли-
ствами [1, 2], в частности, поглощением в ближней
зацией интермедиатов
-
5-(антраценилкарбо-
ИК области [3], химической и термической стойко-
нил)бензол-1,2,4-трикарбоновых кислот 3, 4 - в
стью, что позволяет рассматривать эти соединения
6,13-диметокси-5,7,12,14-тетраоксо-5,7,12,14-те-
в качестве новых материалов для нанотехнологии
трагидропентацен-2,3-дикарбоновую кислоту 5 и
и других областей [4, 5]. Ранее были получены
ее 1,4-дихлорпроизводное 6 (схема 1).
9,10-диоксо-9,10-дигидроантрацен-2,3-дикарбо-
Реакцию
1,4-диметоксиантрахинона с пиро-
новые кислоты с различными заместителями в
меллитовым диангидридом 1 или с его дихлор-
антрахиноновом ядре и тетраантрахинонпорфи-
производным 2 проводили в присутствии катали-
разины на их основе, которые проявляют свойства
затора - безводного хлорида алюминия - в среде
кубовых, прямых красителей [6], жидкокристал-
гептана при комнатной температуре. Соединения
лических материалов [7-9].
3, 4 подвергали внутримолекулярной циклизации
Информация о тетраантрахинонпорфирази-
при 120°С в течение 8 ч в присутствии моногидра-
нах, аннелированных с ароматическими хино-
та H2SO4. Кислоты 3-6 охарактеризованы на осно-
нами, отсутствует. В связи с этим нами проведен
вании данных элементного анализа, электронной,
синтез и исследованы физико-химические свой-
ИК и ЯМР 1Н спектроскопии, хромато-масс-спек-
ства металлопорфиразинов на основе 6,13-ди-
трометрии.
метокси-5,7,12,14-тетраоксо-5,7,12,14-тетраги-
дропентацен-2,3-дикарбоновой кислоты и ее
По данным элементного анализа, кислоты 3-6
1,4-дихлорпроизводного. В основу синтеза поло-
существуют в форме гидратов, на каждую карбок-
жена методика [6], включающая стадии ацилиро-
сигруппу приходится по 3 молекулы воды. В ИК
231
232
ЗНОЙКО и др.
Схема 1.
спектрах трикарбоновых кислот 3, 4 обнаружены
Сигнал протона Н3′ диметоксиантрахинонового
характерные для всех замещенных тримеллито-
фрагмента в соединениях 3 и 4 находится при 8.36
вых кислот полосы, соответствующие колебаниям
м. д. Сигналы протонов Н6′,9′ незамещенного бен-
связей О-Н в области 3450-3550 см-1, а также свя-
зольного кольца
1,4-диметоксиантрахинонового
зей С=О при 1700-1710 см-1 [6, 10]. Кроме того,
фрагмента фиксируются в области 8.18-8.21 м. д. в
присутствуют полосы поглощения, соответству-
виде дублета, а протонов Н7′,8′ - при 7.70-7.40 м. д.
ющие колебаниям связей С-Н метильных групп
в виде мультиплета.
в области 2850-2930 см-1. В спектре соединения
В спектрах ЯМР 1Н дикарбоновых кислот 5, 6
4 наблюдается полоса валентных колебаний связи
отсутствует сигнал протона Н3′ диметоксиантра-
С-Cl при 767 см-1.
хинонового фрагмента, что свидетельствует об
ИК спектры пентацен-2,3-дикарбоновых кис-
успешном протекании реакции внутримолекуляр-
лот 5, 6 подобны ИК спектрам трикарбоновых кис-
ной циклизации. Сигналы протонов Н8,11 и Н9,10
лот 3 и 4, однако полоса поглощения связи О-Н
(Н6′,9′ и Н7′,8′ в спектре соединений 3, 4) фиксиру-
менее интенсивна. В спектре 1,4-дихлорпроизво-
ются в области 8.18-8.21 и 8.60-8.36 м. д. соответ-
дного 6 присутствует полоса валентных колеба-
ственно.
ний связи С-Сl при 777 см-1, смещенная в область
На хроматограмме соединения 5 наблюдается
бóльших длин волн по сравнению с исходным
один пик, что указывает на индивидуальность сое-
соединением 4. В ИК спектрах соединений 5 и 6
сохраняются полосы валентных колебаний С-Н
динения. Судя по масс-спектру, соединение 5 в ходе
связей метильных групп (2800-2900 см-1) и связей
эксперимента подверглось деструкции, поскольку
С=О (1700-1720 см-1).
пик молекулярного иона с m/z 486, отсутствует.
Наблюдаются пики продуктов его фрагментации:
В спектрах ЯМР 1Н кислот 3-6 в области наи-
пик с m/z 446 соответствует продукту декарбок-
более слабого поля обнаружены сигналы протонов
карбоксигрупп, введение атомов хлора (соедине-
силирования пентацен-2,3-дикарбоновой кислоты
(удаление одной карбоксигруппы); пик с m/z 426
ния 4, 6) приводит к сдвигу этих сигналов в область
более слабого поля (12-13 м. д.) по сравнению с
принадлежит пентацен-2,3-дикарбальдегиду с од-
соединениями 3, 5 (10.6-10.8 м. д.). В спектрах со-
ной метоксигруппой; наиболее интенсивный пик
единений 3-6 в области сильного поля (2.00-2.50
с m/z 355 принадлежит осколочному иону 2-ме-
м. д.) находятся сигналы протонов метоксигрупп
тил-5,7,12,14-тетрагидропентацен-5,7,12,14-те-
1,4-диметоксиантрахинонового фрагмента.
траона.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И СВОЙСТВА ПЕНТАЦЕН-2,3-ДИКАРБОНОВЫХ КИСЛОТ
233
Положения полос поглощения в электронных спектрах поглощения соединений 3-8
λ, нм (lgε)
№
М
CHCl
3
ДМФА
NaOH
H2SO4
3
-
442 (5.06)
438 (4.88)
-
509, 551
4
-
437 (5.02)
434 (4.90)
-
509, 551
5
-
440 (5.02)
436 (4.89)
541, 571
510, 550
6
-
437 (5.00)
433 (4.90)
543, 570
509, 550
7а
Со
-
562, 681
-
762
7b
Ni
-
562, 683
-
767
8а
Со
-
560, 679
-
760
Благодаря растворимости соединений 3-6 в
ные характеристики соединений 3, 4 аналогичны.
ДМФА, хлороформе и в концентрированной сер-
Следовательно, введение атомов хлора и переход
ной кислоте были получены их электронные спек-
от 5-(антраценилкарбонил)бензол-1,2,4-трикарбо-
тры поглощения (ЭСП) (см. таблицу). Светопогло-
новых кислот к полученным на их основе пента-
щение синтезированных соединений обусловлено
цен-2,3-дикарбоновым кислотам 5, 6 не оказывает
наличием фрагмента 1,4-диметоксиантрахинона.
влияния на положение полос в ЭСП. Соединения
Ацилирование 1,4-диметоксиантрахинона пиро-
3, 4 способны окрашивать полимерные материалы
меллитовым диангидридом и его дихлопроизво-
в оранжевый цвет, придавая образцам полистиро-
дным, как и аннелирование остатком с нафтохинон-
ла равномерную яркую окраску.
дикарбоновой кислоты, приводят к батохромному
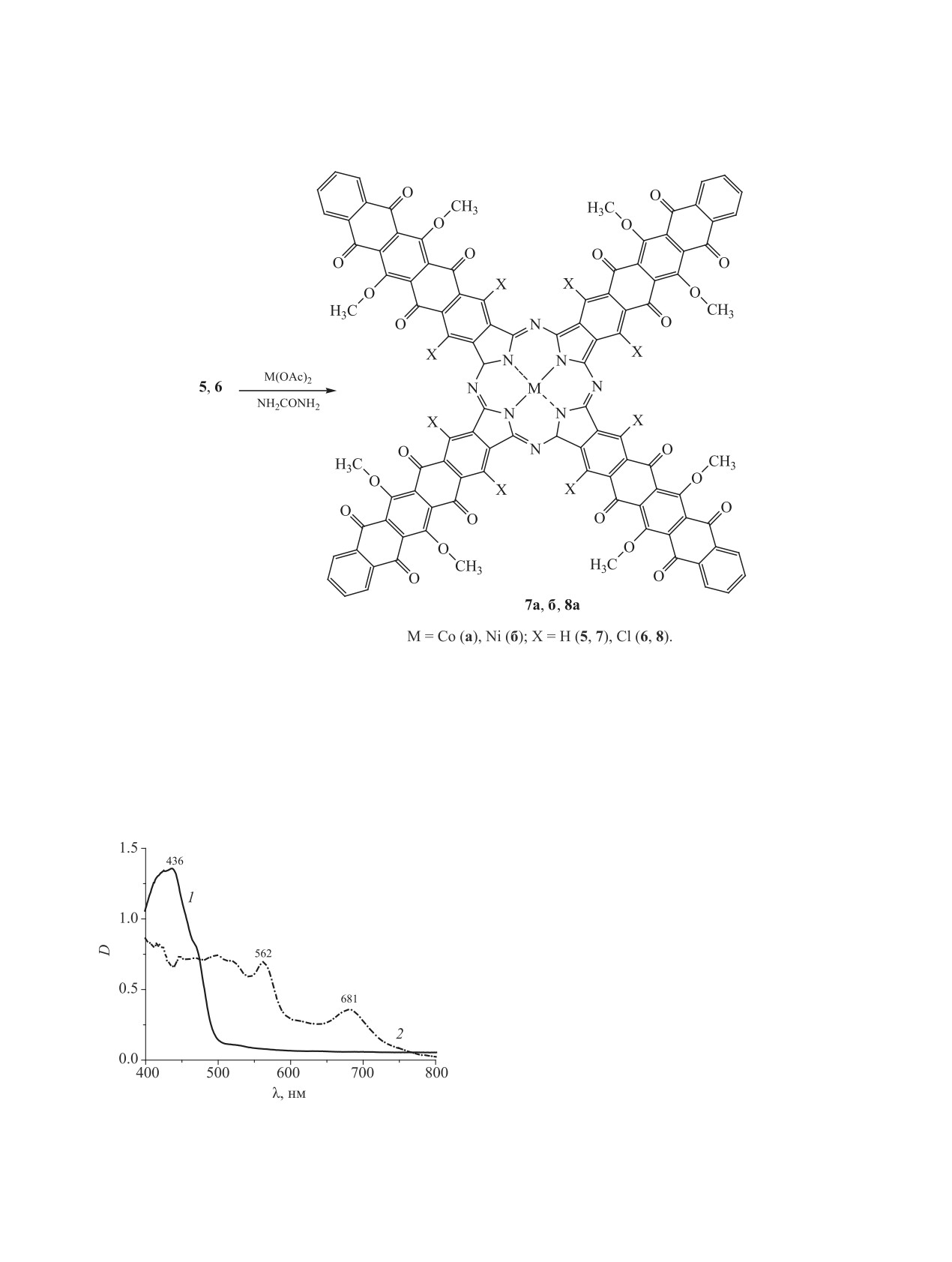
Синтез металлопорфиразинов
7а, б,
8а
смещению полосы поглощения на 3-5 нм.
из
6,13-диметокси- или из
6,13-диметокси-
В ЭСП соединений 3, 4 в ДМФА присутству-
5,7,12,14-тетраоксо-1,4-дихлор-5,7,12,14-
ет полоса поглощения в видимой области при
тетрагидропентацен-2,3-дикарбоновых кислот 5,
483-488 нм (см. таблицу, рис. 1). Положение полос
6 проводили «мочевинным» методом (схема 2).
поглощения в ЭСП трикарбоновых кислот 3, 4 и
Соединения 5 или 6 сплавляли с ацетатом кобаль-
пентацен-2,3-дикарбоновых кислот 5, 6 практиче-
та или никеля в присутствии мочевины, хлорида
ски идентично.
и молибдата аммония, используемых в качестве
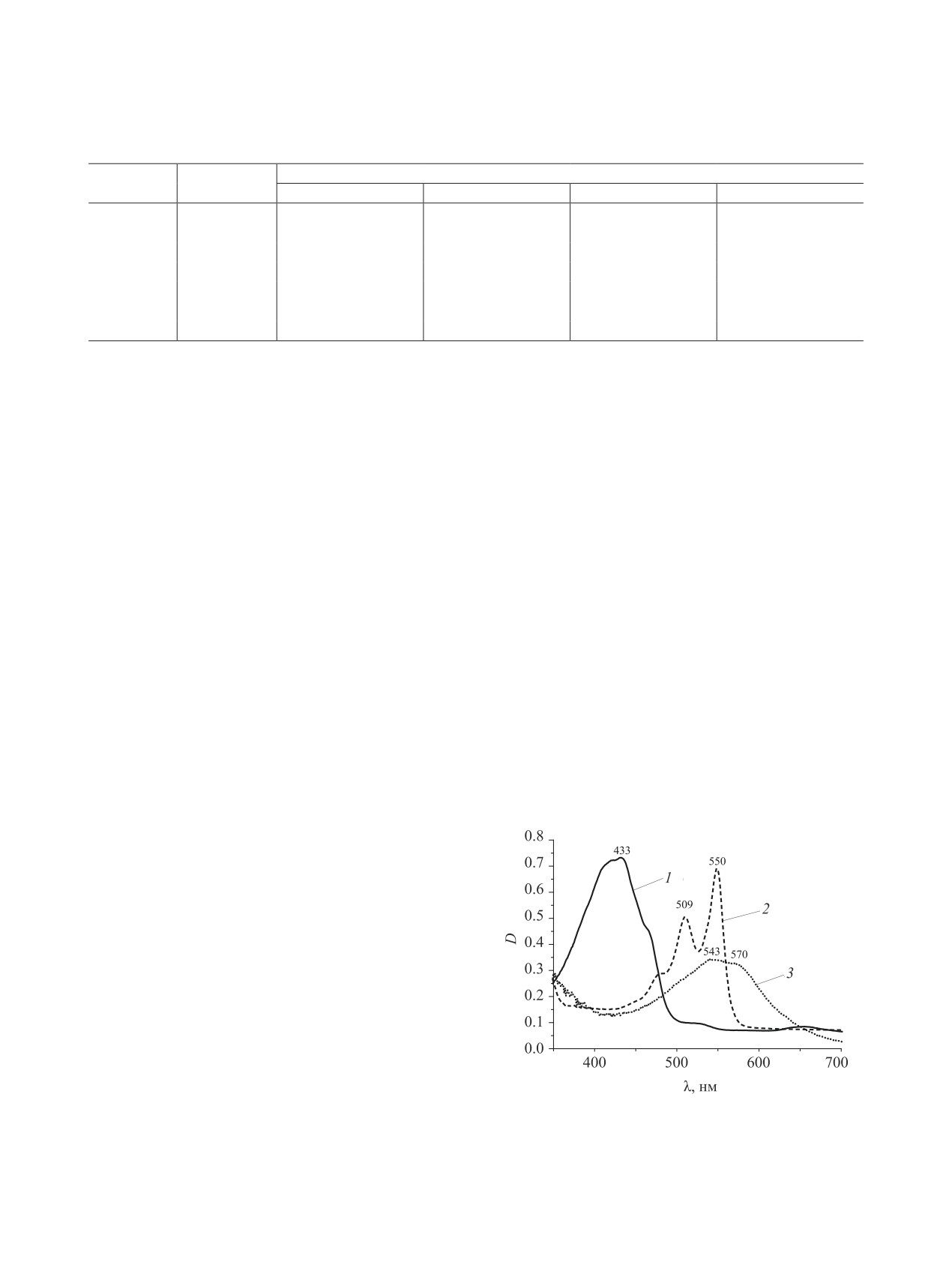
В концентрированной серной кислоте проис-
катализаторов, при 195°С в течение 2 ч. Получить
ходит значительный батохромный сдвиг основной
соединение 8б, также как и подобные комплексы с
полосы поглощения, связанный с протонировани-
медью, не удалось.
ем пентаценового фрагмента по атомам кислорода
[11], появляются две интенсивные разрешенные
полосы поглощения при 509 и 550 нм с колеба-
тельным спутником при 462 нм (рис. 1). Известно,
что в спектре хинизарина в конц. H2SO4 также при-
сутствуют три полосы при 485, 522 и 565 нм [11],
т. е. аннелирование этого соединения с фрагмен-
тами 5,6-диоксо-5,6-дигидронафталин-2,3-дикар-
боновой кислоты или ее 1,4-дихлорпроизводного
сопровождается гипсохромным сдвигом длинно-
волновых полос поглощения.
Таким образом, в ЭСП синтезированных соеди-
нений в видимой области наблюдается уширенная
полоса поглощения, претерпевающая батохром-
ный сдвиг в зависимости от природы растворите-
Рис. 1. ЭСП соединения 6 в различных растворителях:
1 - ДМФА, 2 - конц. H2SO4, 3 - 10%-ный NH4OH.
ля в ряду ДМФА < H2SO4 < NH4OH. Спектраль-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
234
ЗНОЙКО и др.
Схема 2.
Комплексы 7а, б, 8а - темно-фиолетовые по-
ИК спектры металлопорфиразинов 7а, б, 8а
рошки, нерастворимые в воде, хлороформе и аце-
аналогичны спектрам соответствующих дикарбо-
тоне, ограниченно растворимые в ДМСО и ДМФА,
новых кислот 5, 6, но в них появляются полосы
валентных колебаний фталоцианинового скеле-
хорошо растворимые в конц. H2SO4. По данным
та [12]. В спектре ЯМР 1Н соединения 7б в дей-
элементного анализа, они представляют собой
терированном диметилсульфокcиде отсутствует
кристаллогидраты, содержащие до 8 молекул воды
сигнал в области наиболее слабого поля (10-13
на каждую молекулу металлопорфиразина.
м. д.), зафиксированный в спектре исходной пен-
тацен-2,3-дикарбоновой кислоты 5 и принадлежа-
щий протонам карбоксигрупп, что указывает на
отсутствие в исследуемом образце примеси исход-
ного соединения 5. Сигналы протонов Н8,11 и Н9,10
незамещенных бензольных циклов наблюдаются
при 8.20-8.03 и 7.90-7.58 м. д. соответственно.
В ЭСП металлопорфиразинов 7а, б, 8а в длин-
новолновой области (680-682 нм) появляется по-
лоса Q, а в коротковолновой области - полоса,
вызванная электронными переходами в хромо-
форной системе пентацена (рис. 2). Поглощение
соединения 7а в области 400-500 нм заметно от-
личается от ЭСП исходной кислоты 5, появляется
Рис. 2. ЭСП соединений 5 (1) и 7а (2) в ДМФА.
новая полоса при 562 нм. В ЭСП в конц. H2SO4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И СВОЙСТВА ПЕНТАЦЕН-2,3-ДИКАРБОНОВЫХ КИСЛОТ
235
батохромный сдвиг полосы Q на ~80 нм связан с
ния и отгонки растворителя смесь обрабатывали
протонированием мезо-атомов азота порфирази-
200 мл насыщенного раствора соды для разложе-
нового макрокольца (см. таблицу). Его глубина
ния комплексов кислот 3 и 4 с хлористым алюми-
несколько меньше, чем для незамещенного фтало-
нием. Осадок отфильтровывали и промывали конц.
цианина, но заметно превышает величину сдвига,
HCl до появления бесцветных фильтратов, сушили
зафиксированную для тетраантрахинонопорфира-
при 60°С на воздухе. Продукт реакции экстрагиро-
зинов [6-9]. Положение полосы поглощения пен-
вали ацетоном, после чего растворитель удаляли.
таценовых фрагментов практически не изменяется
Соединения 3, 4 представляли собой темно-крас-
по сравнению с исходным соединением 5.
ные порошки, не растворимые в соляной кислоте,
воде и в водно-щелочных средах, хорошо раство-
Таким образом, на основе двух новых пента-
римые в ацетоне, хлороформе и ДМФА.
цен-2,3-дикарбоновых кислот получены
3 ме-
таллокомплекса пентаценаннелированных пор-
5-[(1,4-Диметокси-9,10-диоксо-9,10-дигидро-
фиразинов с кобальтом и никелем. Обнаружен
антрацен-2-ил)карбонил]бензол-1,2,4-трикар-
небольшой батохромный сдвиг длинноволновых
боновая кислота (3) получена с использованием
полос поглощения пентацендикарбоновых кислот
10 г пиромеллитового диангидрида 1. Выход 25.0 г
по сравнению со спектром 1,4-диметоксиантрахи-
(83%), т. разл. 251-253°С. ИК спектр, ν, см-1: 3299
нона в органических растворителях и гипсохром-
(О-Н), 2985, 2867 (СН3), 1712 (С=О). Спектр ЯМР
ный сдвиг в конц. H2SO4. В ЭСП металлопорфи-
1Н, δ, м. д.: 2.46 с (6H, CH3), 7.74-7.46 м (2Н, Н7′,8′),
разинов наблюдается поглощение как четырех
8.14-8.12 м (2Н, Н6′,9′), 8.28-8.24 м (2Н, Н3,6), 9.71
аннелированных фрагментов 1,4-диметоксиантра-
с (1Н, Н3′), 10.21 с (3Н, COOH). Найдено, %: С
хинона, так и полосы Q порфиразинового хромо-
47.87; Н 5.23. С26Н16О11∙9Н2О. Вычислено, %:
фора.
С 46.85; Н 5.14. (вычислено для С26Н16О11, %: С
62.03; Н 2.98).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5-[(1,4-Диметокси-9,10-диоксо-9,10-дигидро-
Электронные спектры поглощения в органи-
антрацен-2-ил)карбонил]-3,6-дихлорбензол-
ческих растворителях регистрировали на спек-
1,2,4-трикарбоновая кислота (4) синтезирована с
трофотометре Hitachi U-2001 при комнатной тем-
использованием 13 г дихлорпиромеллитового ди-
пературе в диапазоне длин волн 400-900 нм. ИК
ангидрида 2. Выход 28.7 г (79%), т. разл. 286-288°С.
спектры записывали на спектрофотометре Avatar
ИК спектр, ν, см-1: 3520 (О-Н), 2929, 2850 (СН3),
360 FT-IR в области 4000-400 см-1 в таблетках
1707 (С=О), 767 (C-Cl). Спектр ЯМР 1Н, δ, м. д.:
с бромидом калия. Спектры ЯМР 1Н растворов
2.44 с (6Н, СН3), 7.74-7.55 м (2Н, Н7′,8′), 8.16-8.14
соединений в ДМСО-d6 и в CDCl3 сниамли на
м (2Н, Н6′,9′), 8.26 c (1Н, Н3′), 12.74 c (3Н, COOH).
приборе Bruker DRX-500, внутренний стандарт -
Найдено, %: С 40.78; Н 4.40. С26Н14Cl2О11∙9Н2О.
ТМС. Данные элементного анализа регистриро-
Вычислено, %: С 42.46; Н 4.39 (вычислено для
вали на элементном анализаторе FlashEATM 1112.
С26Н14Cl2О11, %: С 54.47: Н 2.46).
Хромато-масс-спектр регистрировали на хрома-
Общая методика синтеза соединений 5, 6.
то-масс-спектрометре Saturn 2000K.
50 мл моногидрата H2SO4 нагревали до 130°С,
Общая методика синтеза соединений 3, 4.
после чего вносили при интенсивном перемеши-
Смесь 0.046 моль пиромеллитового диангидри-
вании в течение 15 мин 5 г соединения 3 или 4.
да 1 или его дихлорпроизводного 2 и 0.051 моль
Полученную смесь выдерживали 5 ч при 150°С,
(13.7 г)
1,4-диметоксиантрахинона растворя-
после чего реакционную массу охлаждали. Осадок
ли в 25 мл гептана, затем прибавляли 0.12 моль
растворяли при нагревании в 100 мл концентриро-
(16.12 г) безводного хлорида алюминия и вы-
ванного раствора соды, фильтрат подкисляли HCl.
держивали 2 ч при комнатной температуре, ин-
Осадок отфильтровывали, промывали водой до
тенсивно перемешивая до появления ярко-оран-
нейтральной среды и отсутствия сульфат-анионов.
жевой окраски. Реакционную массу нагревали 8
Соединения 5, 6 экстрагировали ДМФА, раствори-
ч при 80°С, затем кипятили 4 ч. После охлажде-
тель отгоняли, остаток сушили при 80-90°С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
236
ЗНОЙКО и др.
6,13-Диметокси-5,7,12,14-тетраоксо-
0.009 г ацетата никеля дигидрата. Выход 0.072 г
5,7,12,14-тетрагидропентацен-2,3-дикарбо-
(73%). ИК спектр, ν, см-1: 2984, 2875 (СН3), 1707
новая кислота (5). Выход 4.51 г (93 %), т. разл.
(С=О). Спектр ЯМР 1Н, δ, м. д.: 2.00 с (24H, СН3),
225-228°С. ИК спектр, ν, см-1: 3351 (О-Н), 2990,
7.90-7.58 м (8H, Н9,10), 8.20-8.03 м (8H, Н8,11), 9.43
2875 (СН3), 1710 (С=О). Спектр ЯМР 1Н, δ, м. д.:
с (8Н, Н1,4). Найдено, %: С 67.36; H 3.65; N 5.87.
1.48 с (6Н, СН3), 7.78-7.60 м (2Н, Н9,10), 8.12 с (2Н,
C104H48N8NiO24∙8H2O. Bычислено, %: С 67.44; H
Н8,11), 8.24-8.18 м (Н1,4), 10.45 с (2Н, COOH). Най-
3.61; N 6.05.
дено, %: С 52.35; Н 4.55. C26H14O10∙4Н2О. Вычис-
Тетра[4,5](6,13-диметокси-5,7,12,14-тетраок-
лено, %: C 55.92; H 3.97.
со-1,4-хлор-5,7,12,14-тетрагидропентацен)пор-
6,13-Диметокси-5,7,12,14-тетраоксо-
фиразин кобальта (8а) получен из 0.111 г сое-
1,4-дихлор-5,7,12,14-тетрагидропентацен-2,3-
динения 6 и 0.026 г ацетата кобальта гексагидра-
дикарбоновая кислота (6). Выход 4.40 г (90 %),
та. Выход 0.064 г (58%). ИК спектр, ν, см-1: 2945,
т.разл. 300-302 оС. ИК спектр, ν, см-1: 3527 (О-Н),
2820 (СН3), 1700 (С=О), 776 (C-Cl). Найдено, %:
2957, 2920, 2866 (СН3), 1702 (С=О), 777 (C-Cl).
С 55.30; Н 3.28; N 5.19. C104H40Cl8CoN8O24∙8H2O.
Спектр ЯМР 1Н, δ, м.д.: 1.43 с (6Н, СН3), 8.08-8.00
Bычислено, %: С 55.07; Н 3.19; N 5.27.
м (2Н, Н9,10), 8.18 с (2Н, Н8,11), 12.82 с (2Н, COOH).
ФОНДОВАЯ ПОДДЕРЖКА
Найдено: С 47.55; Н 4.35. С26Н12Cl2О10∙4Н2О.
Вычислено, %: С 49.78; Н 3.21 (вычислено для
Работа выполнена при поддержке Министер-
С26Н12Cl2О10, %: С 56.26; Н 2.18).
ства образования и науки РФ в рамках государ-
ственного задания (тема № FZZW-2020-0008) с
Металлопорфиразины
7а, б,
8а получа-
использованием оборудования Центра коллектив-
ли сплавлением 0.2 ммоль соединения 5, 6 с
ного пользования Ивановского государственного
0.4 ммоль ацетата кобальта или никеля в присут-
химико-технологического университета.
ствии 300 мг (0.5 ммоль) мочевины и 0.4 ммоль
(0.02 г) хлорида и 0.01 ммоль (0.02 г) молибдата
КОНФЛИКТ ИНТЕРЕСОВ
аммония. Реакционную смесь нагревали 2 ч при
Авторы заявляют об отсутствии конфликта
195°С до полного затвердевания реакционной
интересов.
массы, после охлаждения промывали 10%-ным
раствором соляной кислоты, затем водой до исчез-
СПИСОК ЛИТЕРАТУРЫ
новения положительной реакции на хлорид-ионы.
1. Donders C. A., Shi-Xia Liu, Loosli C., Sanguinet L.,
Фталоцианины экстрагировали ДМФА и хрома-
Neels A., Decurtins S. // Tetrahedron. 2006. Vol. 62.
тографировали на колонке с силикагелем М 60,
N 15. P. 3543. doi 10.1016/j.tet.2006.01.098
элюент - ДМФА. После удаления растворителя
2. Ikeue T., Sawada N., Matsumoto N., Miyazaki A.,
получили темно-фиолетовые порошки, не раство-
Sugimori T., Koikawa M., Hiromitsu I., Yoshino K.,
Mikuriya M., Kataoka Y., Handa M. // J. Porph.
римые в воде, хлороформе и ацетоне, ограниченно
Phthal. 2014. Vol. 18. N. 8-9. P. 708. doi 10.1142/
растворимые в ДМСО и ДМФА, хорошо раствори-
S1088424614500485
мые в конц. H2SO4.
3. de la Torre G., Bottari G., Hahn U., Torres T. In:
Тетра[4,5](6,13-диметокси-5,7,12,14-тетра-
Functional Phthalocyanine Molecular Materials / Ed.
оксо-5,7,12,14-тетрагидропентацен)порфира-
J. Jiang. Berlin: Springer, 2010. p. 1.
зин кобальта (7а) получен из 0.098 г соединения
4. de Souza F.M., Torres F. C., Homem-de-Mello A.P.,
5 и 0.026 г ацетата кобальта гексагидрата. Выход
Ribeiro A.O. // Dyes Pigments. 2020. Vol. 172. 107824.
0.092 г (93%). ИК спектр, ν, см-1: 2984, 2875 (СН3),
doi 10.1016/j.dyepig.2019.107824
5. Freyer W., Stiel H., Leupold D. J. // Inform. Record.
1707 (С=О). Найдено, %: С 67.30; H 3.26; N 5.85.
2000. Vol. 25. N 1-2. P. 95.
C104H48CoN8O24∙8H2O. Вычислено, %: С 67.43; H
6. Борисов А.В., Майзлиш В.Е., Шапошников Г.П. //
3.62; N 6.05.
ЖОХ. 2005. Т. 75. Вып. 10. С. 1656; Borisov A.V.,
Тетра[4,5](6,13-диметокси-5,7,12,14-тетраок-
Maizlish V.E., Shaposhnikov G.P. // Russ. J. Gen. Chem.
со-5,7,12,14-тетрагидропентацен)порфиразин
2003. Vol. 75. N 10. P. 1579. doi 10.1007/s11176-005-
никеля (7б) получен из 0.098 г соединения 5 и
0470-0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ И СВОЙСТВА ПЕНТАЦЕН-2,3-ДИКАРБОНОВЫХ КИСЛОТ
237
7. Криушкина М.А., Борисов А.В., Шапошников Г.П. //
Korzhenevskii A.B., Shikova T.G., Sokolova V.V.,
Изв. вузов. Сер. хим. и хим. технол. 2009. Т. 52. Вып.
Koifman O.I. // Russ. J. Gen. Chem. 2012. Vol. 82.
7. С. 21.
N 10. P. 1740. doi 10.1134/S1070363212100180
8. Жарникова М.А., Быкова В.В., Ананьева Г.А., Усоль-
10. Pretsch E., Bullmann F., Affolter C. Structural
цева Н.В., Борисов А.В., Майзлиш В.Е., Шапошни-
Determination of Organic Compounds. Tables of
ков Г.П. // Жидкие кристаллы и их практическое
Spectral Data. Dordrecht: Springer, 2006. 438 p.
использование. 2004. Вып. 1. С. 18.
11. Корнев М. С. Дисс… канд. хим. н. Кемерово. 2003.
9. Борисов А.В., Майзлиш В.Е., Шапошников Г.П.,
Корженевский А.Б., Шикова Т.Г., Соколова В.В.,
165 с.
Койфман О.И. // ЖОХ. 2012. Т. 82. Вып. 10.
12. Сидоров А.Н., Котляр, И.П. // Оптика и спектр. 1961.
С. 1742; Borisov A.V., Maizlish V.E., Shaposhnikov G.P.,
Т. 11. № 2. С. 175.
Synthesis and Some Properties of Pentacene-2,3-dicarboxylic
Acids and Metal Porphyrazins Based on Them
S. A. Znoiko*, T. V. Kustova, E. I. Pavlova, and E. A. Danilova, and
A.V. Borisov
Research Institute of Chemistry of Macroheterocyclic Compounds, Ivanovo State University of Chemical Technology,
Ivanovo, 153000 Russia
*e-mail: znoykosa@yandex.ru
Received October 21, 2020; revised October 21, 2020; accepted November 10, 2020
For the first time 6,13-dimethoxy-5,7,12,14-tetraoxo-5,7,12,14-tetrahydropentacene-2,3-dicarboxylic acid
and its 1,4-dichloro derivative were synthesized. Heating these compounds with nickel or cobalt acetates in
the presence of urea gave the corresponding nickel and cobalt porphyrazines. The spectral properties of new
compounds are discussed.
Keywords: pentacene-2,3-dicarboxylic acids, porphyrazines, tetranthraquinone porphyrazines, electronic
absorption spectra
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021