ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 245-259
УДК 621.039.85;546.185;546.681
КОМПЛЕКСООБРАЗОВАНИЕ СКАНДИЯ С
ОКСАБИС(ЭТИЛЕННИТРИЛО)-
ТЕТРАМЕТИЛЕНФОСФОНОВОЙ КИСЛОТОЙ.
ПЕРВИЧНАЯ ОЦЕНКА КОМПЛЕКСА
[44Sc]Sc-ОБЭФ В КАЧЕСТВЕ ОСТЕОТРОПНОГО
РАДИОФАРМАЦЕВТИЧЕСКОГО ПРЕПАРАТА
© 2021 г. Ю. А. Митрофанова, А. А. Ларенкова,b,*, Г. Е. Кодинаa
a Государственный научный центр Российской Федерации «Федеральный медицинский биофизический центр
имени А. И. Бурназяна» Федерального медико-биологического агентства России, Живописная ул. 46, Москва,
123182 Россия
b Московский государственный университет имени М. В. Ломоносова, Москва, 119991 Россия
*e-mail: anton.larenkov@gmail.com
Поступило в Редакцию 12 ноября 2020 г.
После доработки 12 ноября 2020 г.
Принято к печати 22 ноября 2020 г.
Методами потенциометрического титрования и спектроскопии ЯМР изучены закономерности комплек-
сообразования скандия с оксабис(этиленнитрило)тетра(метиленфосфоновой кислотой) (ОБЭФ), активно
применяемой в клинической практике для синтеза остеотропных радиофармацевтических препаратов.
Константа устойчивости полностью депротонированного комплекса (20.25±0.74 в 0.1 M. растворе
NaClO4, 25°С) и диапазон pH эффективного связывания скандия с ОБЭФ (от 3 до 9) сравнимы с тако-
выми характеристиками аналогичных комплексов лантаноидов. Показана возможность эффективного
синтеза комплекса [44Sc]Sc-ОБЭФ без носителя с радиохимической чистотой не менее 98%. Проведена
первичная оценка функциональной пригодности комплекса [44Sc]Sc-ОБЭФ в качестве остеотропного ра-
диофармацевтического препарата для ПЭТ-диагностики метаболических поражений скелета. Накопление
[44Sc]Sc-ОБЭФ в очаге метаболичекого поражения скелета в 3.0-3.5 раза больше, чем в интактной кости.
Ключевые слова: скандий-44, оксабис(этиленнитрило)тетра(метиленфосфоновая кислота), остеотроп-
ные радиофармпрепараты, полифосфоновые кислоты, Оксабифор, комплексообразование
DOI: 10.31857/S0044460X21020086
Ремоделирование костной ткани - результат
Остеопороз - заболевание, приводящее к слабости
активности остеокластов и остеобластов, ответ-
и хрупкости костей за счет уменьшения плотности
ственных за резорбцию и формирование костной
костной ткани, - в настоящее время признается
ткани соответственно. Равновесие между этими
одной из основных проблем для миллионов лю-
процессами регулируется системой местных и
дей во всем мире. Костная ткань часто подверга-
системных факторов. У пациентов с различными
ется метастатическому поражению практически
доброкачественными и злокачественными забо-
при всех видах раковых заболеваний, причем в
леваниями костей (остеопороз, болезнь Паджета,
65-75% случаев это метастазы опухолей молочной
остеолиз и ассоциированная с опухолью гипер-
и предстательной желез [1-5]. Метастатические
кальциемия и др.) данное равновесие нарушено.
злокачественные поражения костей оказывают
245
246
МИТРОФАНОВ и др.
Таблица 1. Принятые обозначения индексов констант (стехиометрическая матрица) и соответствующие равновес-
ные реакции
Вид
Равновесие
Обозначение
m
l
n
p
r
константы
mM + lL + n,p,-rH ↔ MmLlHn,p,-r
β01n
β011
0
1
1
-
-
L8- + H+ → LH7-
6-
β
012
0
1
2
-
-
L8- + 2H+ ← LH2
β013
0
1
3
-
-
L8- + 3H+ ← LH5-
β014
0
1
4
-
-
L8- + 4H+ ← LH4-
β015
0
1
5
-
-
L8- + 5H+ ← LH3-
β016
0
1
6
-
-
L8- + 6H+ ← LH2-
β017
0
1
7
-
-
L8- + 7H+ ← LH–
β018
0
1
8 = N
-
-
L8- + 8H+ ← LH8
Kai
Ka8
LH7- →L8- + H+
Ka
7
LH6- ← LH7- + H+
Ka6
LH5- ← LH6- + H+
Ka5
LH4- ← LH5- + H+
Ka4
LH5- ← LH4- + H+
Ka3
LH2- ← LH3- + H+
Ka2
LH– ← LH2- + H+
Ka1
LH8 ← LH7- + H+
βm0r
β101
1
0
-
-
1
M3+ + H2O ← MOH2+ + H+
β102
1
0
-
-
2
M3+ + 2H2O ← M(OH)+ + 2H+
β103
1
0
-
-
3
M3+ + 3H2O ← M(OH)3 + 3H+
β104
1
0
-
-
4
M3+ + 4H2O ← M(OH)– + 4H+
β202
2
0
-
-
2
2M3+ + 2H2O ← M2(OH)+ + 2H+
β305
3
0
-
-
5 = R
3M3+ + 5H2O ← M3(OH)+ + 5H+
β11p
β110
1
1
-
0
-
M3+ + L8- ← ML5-
β111
1
1
-
1
-
M3+ + L8- + H+ ← MLH4-
β112
1
1
-
2
-
M3+ + L8- + 2H+ ← MLH3-
β113
1
1
-
3
-
M3+ + L8- + 3H+ ← MLH2-
β114
1
1
-
4
-
M3+ + L8- + 4H+ ← MLH-
β115
1
1
-
5
-
M3+ + L8- + 5H+ ← MLH
β116
1
1
-
6 = P
-
M3+ + L8- + 6H+ ← MLH+
негативное влияние на качество жизни пациента,
лютеция-177 с ЭДТФ в качестве терапевтического
вызывая болевой синдром, повышая вероятность
радиофармацевтического препарата [12-15].
патологических переломов, гиперкальциемии и
Полифосфоновые кислоты образуют прочные
компрессии спинного мозга.
комплексы с поливалентными металлами. Лога-
Для радионуклидной диагностики и терапии
рифмическая константа устойчивости lgβ1101 ком-
метастатических поражений скелета в 1970-е годы
плекса Sm-ЭДТФ при 25°С в среде 0.1 М. раствора
было предложено использование комплексов ради-
KCl составляет 22.4, в среде 0.15 M. раствора NaCl -
20.7 [16], для 1 M. раствора NaClO4 приведено зна-
онуклидов металлов с полифосфоновыми кислота-
чение 18.1, а для комплекса индия эта величина
ми (полифосфонатами). Cамая известная из них -
составляет 22.9 [17]. Образование прочного ком-
этилендиаминтетра(метиленфосфоновая кислота)
плекса необходимо для предотвращения обмена
(ЭДТФ, схема 1). На основе комплекса ЭДТФ с
лигандами радионуклида с белками плазмы крови
самарием-153 [6] препарат с коммерческим на-
(альбумин, трансферрин и т. п.). В большей степени
званием Quadramet (IBA, Бельгия) применяется
для паллиативной терапии [7-11]. В ряде исследо-
1 Обозначения констант, принятые в данной работе, приведены
ваний сообщается о перспективности комплекса
в табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
247
Схема 1.
это касается «легких» элементов (Sc, Ga, In), кото-
к уменьшению количества форм комплекса, одно-
рые по сравнению с лантаноидами проявляют высо-
временно существующих в растворе и к возраста-
кое сродство к металл-связывающим белкам плаз-
нию устойчивости комплекса [21]. Оксабис(эти-
мы крови [18-20]. Поиск новых лигандов привел к
леннитрило)тетра(метиленфосфоновая кислота)
синтезу аналога ЭДТФ - оксабис(этиленнитрило)-
используется в качестве исходного соединения
тетра(метиленфосфоновой кислоты) (ОБЭФ, ком-
в производстве лиофилизата для приготовления
мерческое название Оксабифор).
радиофармацевтического препарата Технефор,
99mТс, применяемого в диагностике поражений
Константы комплексообразования, полученные
скелета, а также в составе радиофармацевтическо-
при ионной силе I 1 M. раствора NaClO4, свиде-
го препарата Самарий-Оксабифор, 153Sm [22-23]
тельствуют о более эффективном связывании ок-
для радионуклидной терапии костных метастазов
сабис(этиленнитрило)тетра(метиленфосфоновой
и ревматоидных артритов. Оба препарата успешно
кислоты) c Ga, In и Sm (lgβ110 = 22.5, 25.8 и 19.9
применяются в отечественной ядерной медицине
соответственно) по сравнению с ЭДТФ (lgβ110 =
уже более 30 лет [24-29].
21.3, 22.9 и 18.1 соответственно) [17]. При иссле-
довании комплексообразования индия с ОБЭФ
С развитием ПЭТ-технологий и методик про-
найдено, что увеличение конформационной гиб-
изводства позитрон-излучающих радионуклидов,
кости лиганда (по сравнению с ЭДТФ) приводит
таких как 68Ga и 44Sc, возросла актуальность ис-
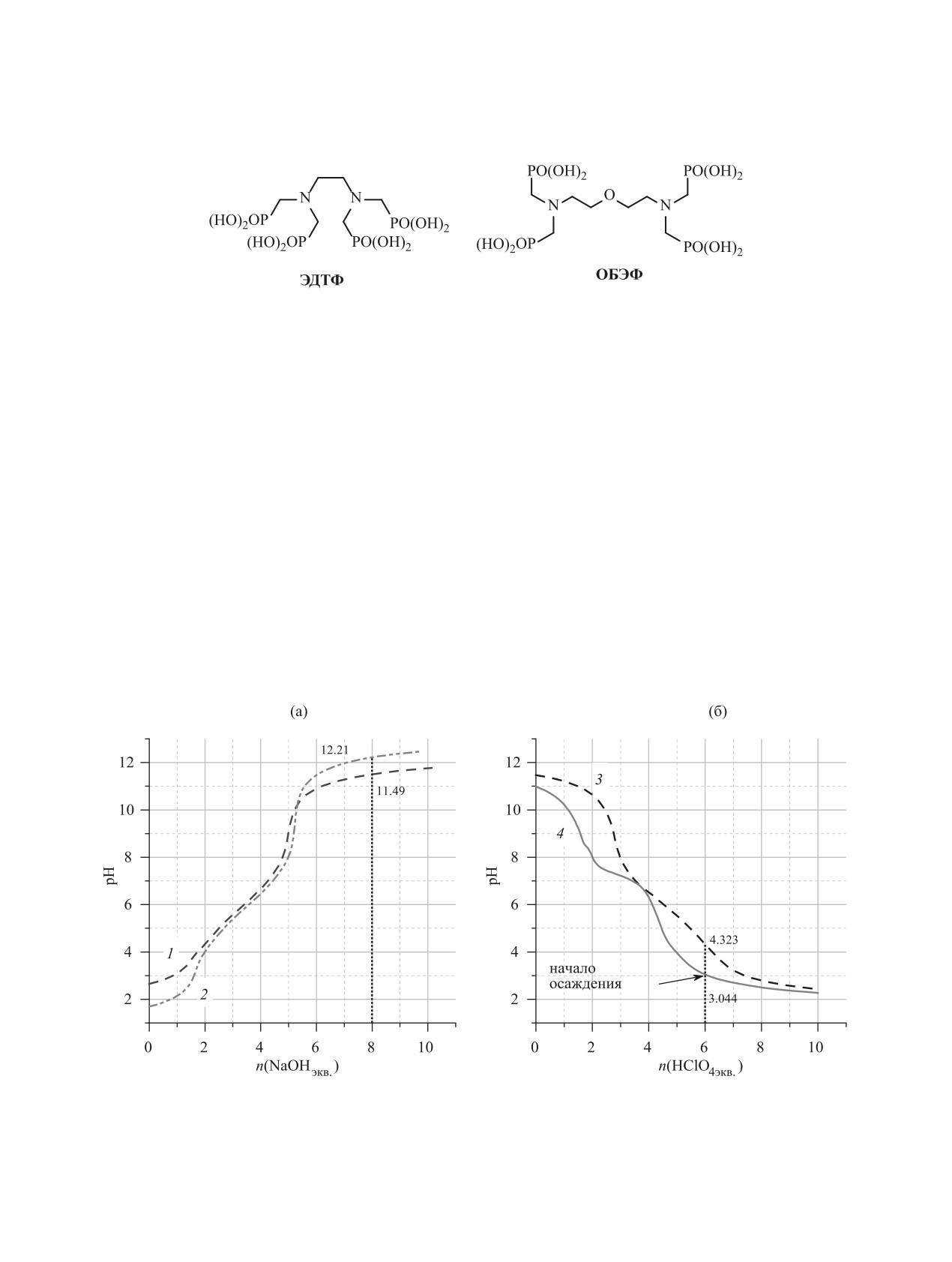
Рис. 1. Экспериментальные зависимости pH от количества эквивалентов NaOH (а) и HClO4 (б). Прямое титрование окса-
бис(этиленнитрило)тетра(метиленфосфоновой кислоты) (ОБЭФ), cL 1.4 (1) и 14.0 ммоль/л (2); обратное титрование ОБЭФ
(3) и комплекса Sc-ОБЭФ (4), cL = cSc = 1.0 ммоль/л.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
248
МИТРОФАНОВ и др.
Для обработки результатов титрования рас-
творов
оксабис(этиленнитрило)тетра(метилен-
фосфоновой кислоты) (с 1.0-14.0 ммоль/л) 0.1 M.
растворами NaOH и HClO4 (рис. 1) использованы
графический метод [39] и программа ChemEqui
для моделирования равновесий в растворах [41,
42]. Была проведена серия прямых и обратных ти-
трований. Последние были необходимы, так как
в области низких значений pH в смеси ОБЭФ с
хлоридом скандия выпадал осадок, медленно рас-
творяющийся при повышении pH даже до 9. При
обратном титровании осадок образуется при pH
3.0-3.3.
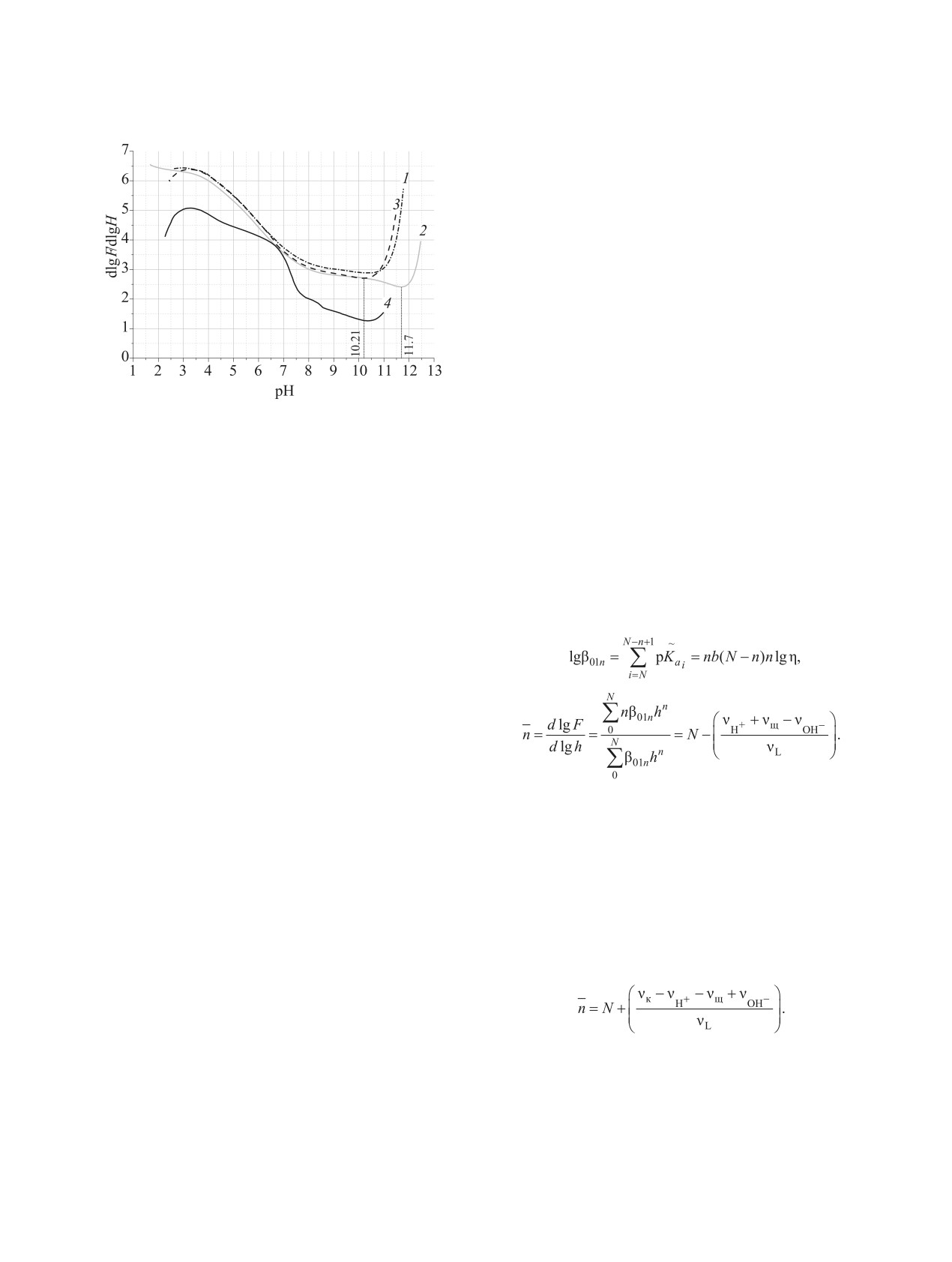
Рис. 2. Экспериментальные кривые функции прото-
Графическое интегрирование. Суть графи-
нирования ОБЭФ и комплекса Sc-ОБЭФ. 1 - прямое
ческого метода состоит в нахождении параме-
титрование лиганда (сL 1.4 ммоль/л); 2 - прямое титро-
вание лиганда (cL 14.0 ммоль/л); 3 - обратное титрова-
тров η и b уравнения (1), где lg β01n - логарифм
ние лиганда (cL 1.0 ммоль/л); 4 - обратное титрование
условной константы протонирования, n - ступень
= 1.0 ммоль/л).
комплекса Sc-ОБЭФ (cSc = cL
протонирования лиганда, N - число диссоциирую-
щих протонов. Для этого необходимо построение
следований комплексов с этими элементами [30].
и последующее интегрирование функции прото-
Радионуклид скандий-44 находится в зоне повы-
нирования (функции Бьеррума) [43, 44], которую
шенного интереса среди специалистов, занятых
можно вывести из материального баланса ионов
разработкой радиофармацевтических препаратов:
удобные для ПЭТ-исследований ядерно-физиче-
водорода (2).
ские характеристики скандия-44 (T½ 3.97 ч; <Eβ+>
632 кэВ (94%); Eγ 1157 кэВ [31]), возможность эф-
(1)
фективной наработки как на циклотроне [32-34],
так и получения из радионуклидного генератора
[35, 36] на основе пары 44Ti/44Sc (а также наличие
терапевтического радионуклида 47Sc) усиливают
(2)
интерес к созданию радиофармацевтических пре-
паратов 44Sc [33, 37, 38].
Нами исследовано комплексообразование
скандия с оксабис(этиленнитрило)тетра(метилен-
Здесь νL - количество титруемой кислоты (лиган-
фосфоновой кислотой) и проведена первичная
да), νH - наблюдаемое (измеренное) количество
оценка функциональной пригодности комплекса
ионов водорода в растворе, νOH - наблюдаемое ко-
[44Sc]Sc-ОБЭФ как остеотропного радиофарма-
личество гидроксид-анионов в растворе, νщ - ко-
цевтического препарата для ПЭТ-диагностики.
личество добавленной щелочи.
Диссоциация лиганда. Достоверность полу-
При титровании из щелочной области в кислую
ченных констант устойчивости в значительной
выражение (2), согласно материальному балансу,
мере зависит от выбора констант диссоциации
принимает вид (3).
(протонирования) лиганда. Сведения о константах
протонирования оксабис(этиленнитрило)тетра-
(3)
(метиленфосфоновой кислоты) мало доступны [39,
40]. За много лет метод ее синтеза, а также предпри-
Здесь νщ = const = N·νL, для нахождения количества
ятие-производитель изменились. С целью уточне-
νOH в расчетах pKw было принято равным 13.79.
ния констант протонирования нами вновь выпол-
нено потенциометрическое титрование растворов
Полученные зависимости -n
= f(pH) представ-
оксабис(этиленнитрило)тетра(метиленфосфоно-
лены на рис. 2. В конце титрования (pH > 10)
вой кислоты).
функции протонирования имеют минимум, соот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
249
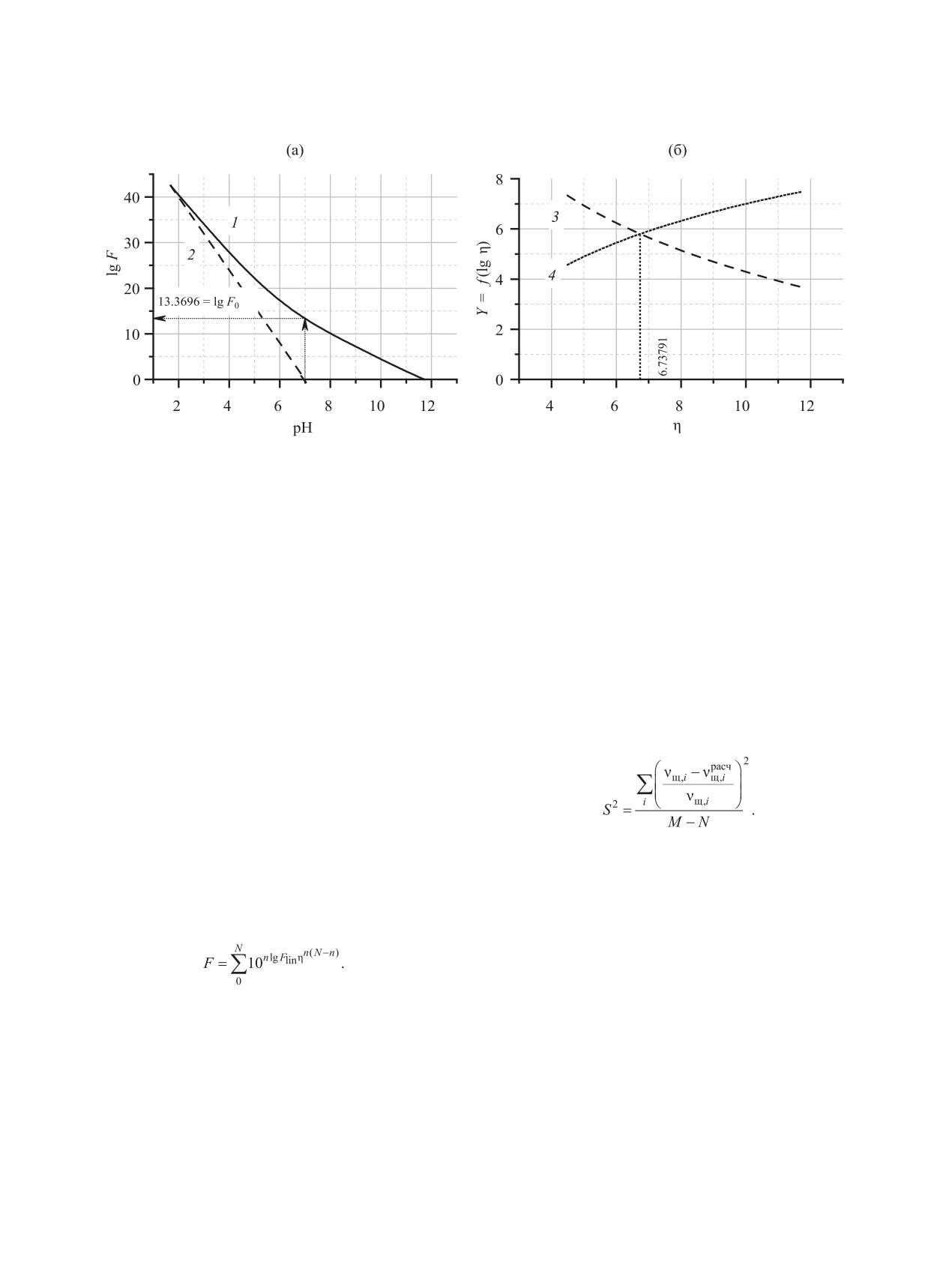
Рис. 3. Нахождение параметров b и η уравнения (1) через интегральную кривую lgF = f(pH) (a) и дополнительную функцию
Y = f(η) (б). 1 - зависимость lgF от pH, полученная для титрования ОБЭФ (14.0 ммоль/л); 2 - прямая lgFlin; 3 и 4 - функции
от параметра η (см. текст).
ветствующий теоретической точке эквивалентно-
чески находим параметр η - абсциссу пересечения
сти. Например, при n(NaOH)/n(L) = 8 для прямого
двух зависимостей, полученных при разложении
титрования оксабис(этиленнитрило)тетра(мети-
суммы (4) (рис. 3, 3 и 4).
ленфосфоновой кислоты) (с = 14.0 ммоль/л) pH =
Таким образом, из проведенных экспериментов
12.21 (рис. 1, 2), а минимум -n наблюдается при pH
была вычислена серия пар параметров, с помощью
11.7 (рис. 2, 2). Так как разность - (νщ - νOH)/ νL
которых найдены lgβ01n, а затем pKai (например,
показывает количество эквивалентов прореагиро-
при титровании раствора ОБЭФ с концентрацией
вавших гидроксид-ионов, то возрастание функции
1.0 ммоль/л b = 6.74025, а η = 4.45189).
протонирования объясняется тем, что вблизи точ-
Для проверки правильности полученного набо-
ки эквивалентности прекращается расход гидрок-
ра констант диссоциации использовали фактор S2
сид-анионов, и при дальнейшем добавлении ще-
(5).
лочи последнее слагаемое в уравнении (2) вносит
существенный вклад в общую величину.
Интегрирование проводили до минимального
(5)
значения функции протонирования, которое ука-
зывает на достижение точки эквивалентности. На
Здесь νщ,i - νрасчщ,i - разность между эксперимен-
рис. 3 показана интегральная кривая титрования
тальным и расчетным количеством щелочи, затра-
раствора ОБЭФ (с 14.0 ммоль/л).
ченным к i-му шагу титрования. Расчетное коли-
По «методу двух параметров» получаем выра-
чество щелочи можно найти из уравнений (2) и
жение (4).
(3), подставляя 10-pH в качестве активности ионов
(4)
водорода h. Полученные таким образом константы
и значения S2 представлены в табл. 2. Для сравне-
ния также приведены значения, полученные ранее.
На кривой lgF-pH необходимо найти lgF0
(lgFlin = 0) из значения pH (lgF = 0), при котором
Полученные константы протонирования ок-
прямая с наклоном -N будет проходить через инте-
сабис(этиленнитрило)тетра(метиленфосфоновой
гральное значение lgFmax (lgFlin = -8·pH + d, рис. 3,
кислоты) подтверждают известные результаты,
2). Найденное значение рН численно равно пара-
полученные в среде 1 М. NaClO4, несмотря на раз-
метру b, необходимому для уравнения (1). Из зна-
ницу в величине ионной силы раствора. Из дан-
чения lgF0 (при lgFlin = 0) по уравнению (4) графи-
ных, представленных в табл. 2, видно, что новые
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
250
МИТРОФАНОВ и др.
Таблица 2. Константы диссоциации ОБЭФ, рассчитанные методом графического интегрирования (для растворов в
0.1 М. NaClO4), в сравнении с данными, опубликованными ранее [39, 40] (для растворов в 1.0 М. NaClO4)
cL,
pKa8
pKa7
pKa6
pKa5
pKa4
pKa3
pKa2
pKa1
S2
ммоль/л
1.0
11.46
10.17
8.87
7.57
6.28
4.98
3.68
2.39
18.34
1.4
11.59
10.26
8.92
7.59
6.26
4.92
3.59
2.26
5.18
14.0
12.38
10.81
9.23
7.65
6.07
4.49
2.91
1.33
270.4
<pKai>
11.81
10.41
9.02
7.63
6.23
4.84
3.45
2.05
[39]
11.31
10.02
8.74
7.45
6.14
4.87
3.58
2.30
0.025
[40]
10.7
10.1
7.5
6.4
5.7
4.7
3.7
1.5
0.03
Таблица 3. Константы диссоциации ОБЭФ, рассчитанные методом компьютерного моделирования в программе
ChemEqui
cL, ммоль/л
~
pKai = lgβ01(N-i+1) - lgβ01(N-i)
<pKai> ± SD
1.00
1.4
14.0
pKa8
4.03
2.47
4.01
3.99 ± 0.75
pKa7
17.82
19.03
19.81
18.32 ± 2.64
pKa6
10.26
10.37
9.08
10.01 ± 0.47
pKa5
7.03
7.14
6.62
7.00 ± 0.34
pKa4
6.08
6.00
5.92
5.98 ± 0.13
pKa3
5.14
4.91
4.69
4.94 ± 0.15
pKa2
3.24
3.36
2.39
3.09 ± 0.94
pKa1
-20.23
-9.87
-9.78
-8.72 ± 4.19
S2
9.41
1.44
253.85
значения критерия S2 значительно превосходят
тов, в которых была использована одна и та же мо-
величину, представленную ранее [39]. Это может
дель равновесий, но входные данные изменялись
быть связано с большим вкладом относительной
различными способами для ускорения расчетов
ошибки расчетного количества щелочи на началь-
(например, изменялись последовательность расче-
ном этапе титрования. При отбрасывании первых
та констант или количество одновременно рассчи-
точек при расчете критерия S2 его значение умень-
тываемых констант).
шается на 2-4 порядка.
Средние значения констант находим по форму-
Компьютерное моделирование. На первом
ле (7).
этапе оценки констант диссоциации с помощью
программы ChemEqui подбираются значения
lgβ01nj (n = 1,N; j = 1, k·m) для получения мини-
мальной разности между экспериментальными
(7)
и расчетными величинами pH (при pH-метрии).
Для k титрований возможно нахождение k·m на-
боров констант и столько же значений R-факторов
Ошибку определения констант диссоциации
Гамильтона (6).
находим как стандартное отклонение по выборке
из k·m значений i-й константы. Так были получены
15 наборов констант по трем проведенным экспе-
(6)
риментам, из которых вычислены средние значе-
ния и стандартные отклонения, а также критерий
S2 для каждого опыта (табл. 3).
Здесь j = 1, k·m, m - количество использованных ал-
Из представленных данных видно, что констан-
горитмов (градиентный, симплекс, Монте-Карло,
ты, полученные методом графического интегриро-
генетический) или количество успешных расче-
вания и компьютерного моделирования, сходятся
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
251
100
H8L
H6L2-
H3L5-
80
H2L6- HL7-
H7L-
H5L3-
H4L4-
L8-
60
40
20
0
2
4
6
8
10
12
pH
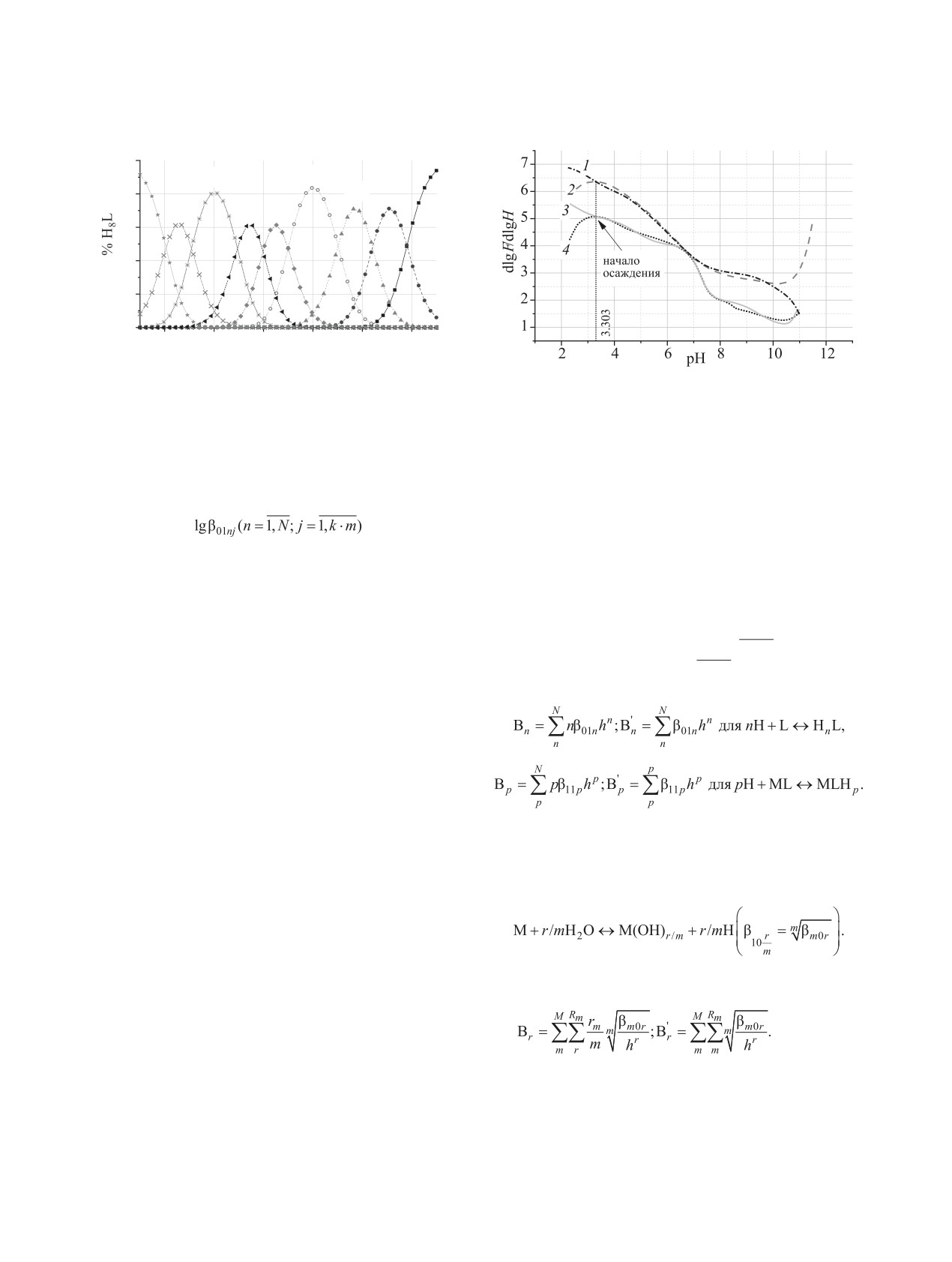
Рис. 4. Диаграмма распределения химических форм
Рис. 5. Функции протонирования ОБЭФ: теоретическая
ОБЭФ, построенная с использованием смешанного
(1) и экспериментальная (2) в отсутствие скандия; тео-
набора констант диссоциации (25°С, cL 1.4 ммоль/л,
ретическая (3) и экспериментальная (4) в присутствии
ионная сила 0.1 M. раствора NaClO4).
1.0 ммоль/л ScCl3.
только при pKa2-pKa5, а крайние значения кажутся
воспользоваться методом наименьших квадратов
сомнительными. Следует подчеркнуть, что край-
относительно функции протонирования и ее тео-
ние значения
(при n = 1,
ретического аналога для данного набора экспери-
2 и 8) недостоверны вследствие относительно низ-
ментальных точек. Для нахождения теоретической
ких концентраций образующихся депротонирован-
кривой функции протонирования, которая зависит
ных и полностью протонированной формы ОБЭФ.
от значений pH, констант устойчивости депрото-
При подборе значений констант диссоциации по
нированного комплекса β110 и комплексов с раз-
методу наименьших квадратов критерий S2 умень-
личной степенью протонирования β11p (p = 1, P),
шается с возрастанием pKa6 и pKa7 и с уменьшени-
протонирования лиганда β01n (p = 1, N) и гидролиза
ем pKa8, однако, с химической точки зрения, это не
металла βm0r (m = 1, M, r = 1, Rm ) обозначим сле-
имеет смысла ввиду нарушения второго правила
дующим образом:
Полинга. При использовании «химически верных»
первой и трех последних констант диссоциации,
(8, 8.1)
найденных графическим методом, а остальных -
с помощью компьютерного моделирования, мож-
но получить диаграмму распределения (рис. 4) с
(9, 9.1)
последовательностью депротонирования, которую
можно интерпретировать следующим образом:
Гидролиз mM + rH2O ↔ Mm(OH)r + rH c констан-
малое количество LH– по сравнению со смежными
той βm0r представим в виде
формами объясняется, вероятно, легкостью отрыва
первых двух (наиболее удаленных друг от друга)
протонов от молекулы оксабис(этиленнитрило)-
тетра(метиленфосфоновой кислоты) с последу-
ющим полным депротонированием фосфоновых
групп и атомов азота [21].
Тогда:
Изучение комплексообразования скандия
с ОБЭФ. Программы для моделирования равно-
(10, 10.1)
весий реакций комплексообразования чувстви-
тельны к начальным приближениям констант,
и при большом отклонении начальных прибли-
Константы гидролиза скандия βm0r взяты из
жений констант от «истинных» расчет не удает-
работы [45]. Пусть h, OH, L и M - равновесные
ся. Для поиска начального приближения можно
концентрации ионов водорода, гидроксид-ионов,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
252
МИТРОФАНОВ и др.
Таблица 4. Константы комплексообразования и прото-
Для построения теоретических кривых и вы-
нирования комплекса Sc-ОБЭФ для различных набо-
числения констант устойчивости комплексов с
ров констант протонирования ОБЭФ (при ионной силе
различной степенью протонирования использова-
)
0.1 M. раствора NaClO4
ны три набора полных констант протонирования
смеш
lgβ11p
pKaiграф
pKaiкомп
pKai
лиганда (табл. 4), а именно: полученных методом
lgβ110
19.41 ± 0.75
20.25 ± 0.74
20.00 ± 0.41
графического интегрирования lgβ01nграф, компью-
lgβ111
32.42 ± 0.15
32.40 ± 0.04
32.37 ± 0.11
терного моделирования lgβ01nкомп и смешанный
lgβ112
41.99 ± 0.01
41.93 ± 0.07
41.93 ± 0.07
набор lgβ01nсмеш, в котором первые три и послед-
lgβ113
47.92 ± 0.14
48.03 ± 0.21
47.94 ± 0.08
няя найдены графическим методом, а средние кон-
lgβ114
56.45 ± 0.11
56.41 ± 0.17
56.39 ± 0.17
станты - с помощью ChemEqui.
lgβ115
61.40 ± 0.36
61.40 ± 0.44
61.34 ± 0.42
lgβ116
63.95 ± 0.70
63.99 ± 0.76
63.90 ± 0.76
Функции протонирования при pH ниже 3.0-3.3
37.86
66.10
37.88
недостоверны из-за выпадения осадка. По этой же
причине критерии достоверности были рассчита-
ны для значений функций Бьеррума, начиная с pH,
соответствующего выпадению осадка.
депротонированного лиганда и металла; сH, cOH, cL -
Найденные значения пересекаются в преде-
полные концентрации ионов водорода, гидроксид-
лах стандартных отклонений, однако для набора
ионов и лиганда. Тогда, выражая равновесную
констант, полученных через lgβ01nкомп, характер-
концентрацию металла через концентрацию свя-
на наибольшая сумма обратных R-факторов, что
занных гидроксид-ионов в системе уравнений ма-
свидетельствует о наибольшей сходимости мо-
териального баланса, получаем (11).
дели с экспериментальными данными. Разность
lgβ113 - lgβ112 существенно ниже lgβ114 - lgβ113
(6.10 и 8.38 соответственно), что свидетельствует
(11)
о недостоверности третьей константы, несмотря
на низкую разность между экспериментальными
и теоретическими значениями. При подборе этих
Экспериментальная зависимость -nэксп строится
констант с целью сохранения второго правила По-
по уравнению (3). На рис. 5 приведены зависимо-
линга критерии S2 и R возрастают в десятки раз, а
сти функции протонирования оксабис(этиленни-
теоретическая кривая -n приобретает прямолиней-
трило)тетра(метиленфосфоновой кислоты) как в
ный характер и пересекает экспериментальную в
отсутствие, так и в присутствии 1.0 ммоль/л хло-
точке перегиба (pH ~7.25).
рида скандия.
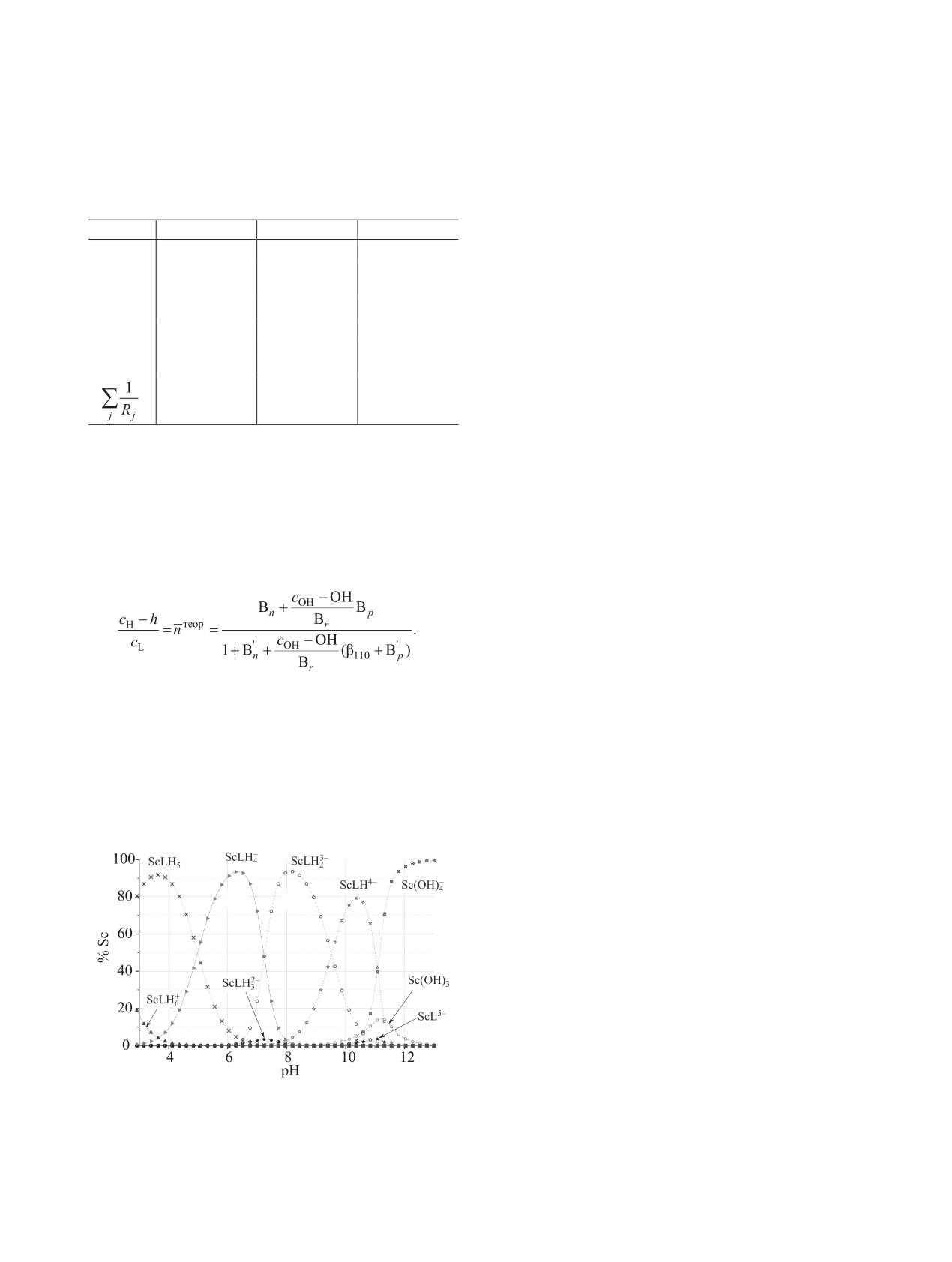
По константам lgβ11p (lgβ01nкомп) построена диа-
грамма распределения химических форм скандия
в зависимости от pH раствора (рис. 6). При pH 10
скандий подвергается гидролизу и при pH 11.5
более 80% процентов скандия находится в фор-
ме Sc(OH)–. Форма ScLH2- образуется в незначи-
тельном количестве, что соответствует быстрому
присоединению двух протонов к ScLH3- с пони-
жением pH и скачку функции Бьеррума (рис. 5, pH
6.5-8.0).
Полученные константы комплексообразова-
ния согласуются с известными для комплексов с
полиаминокарбоновыми кислотами. Среди ком-
Рис. 6. Диаграмма распределения Sc-ОБЭФ в зависи-
плексов трехвалентных элементов наибольшие
мости от pH (cSc = cL = 1.0 ммоль/л, ионная сила 0.1 M.
величины lgβ110 наблюдаются для комплексов ин-
раствора NaClO4, 25°C).
дия [46-49], а величины lgβ110 комплексов скандия
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
253
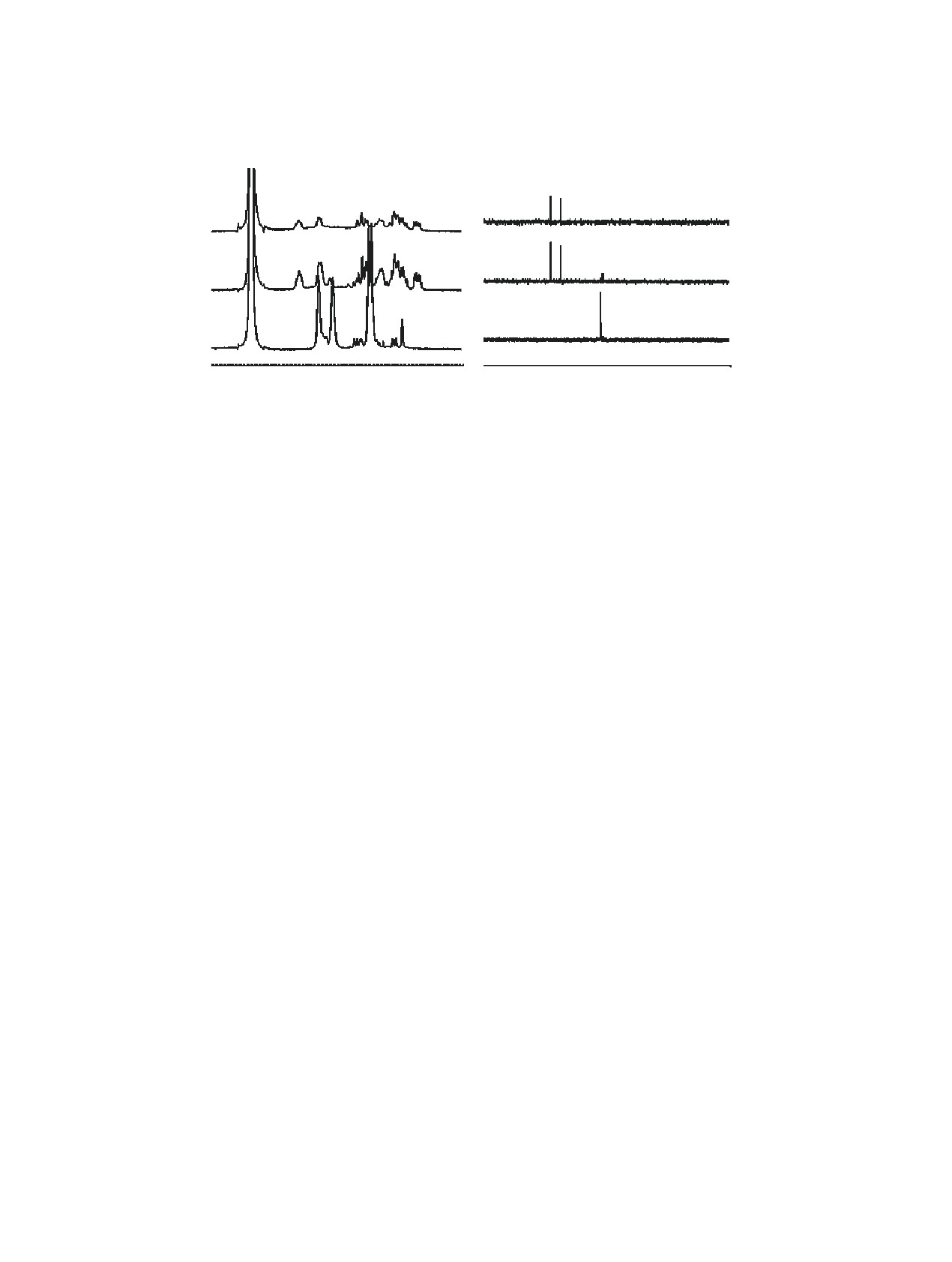
(а)
(б)
1
1
2
2
3
3
δ, м. д.
δ, м. д.
Рис. 7. Спектры ЯМР 1Н (а) и 31Р (б) образцов при pH 9: 1 - cSc:cL = 1:1; 2 - cSc:cL = 1:2; 3 - спектры лиганда, cL 10 ммоль/л.
занимают промежуточное положение между соот-
дия была уменьшена в 2 раза, чтобы по возмож-
ветствующими значениями для комплексов индия
ности нивелировать этот эффект. Однако и в этих
и лантаноидов. Для комплексов индия и самария
условиях наблюдалась опалесценция растворов.
с оксабис(этиленнитрило)тетра(метиленфосфоно-
Так как в исходных растворах ScCl3 и ОБЭФ та-
вой кислотой) lgβML составляет 25.8 и 19.9 соот-
кой эффект не наблюдался, можно предположить,
ветственно [17], а для карбоксилатного аналога -
что в осадок в данном случае выпадает комплекс
оксабис(этиленнитрило)тетрауксусной кислоты
Sc-ОБЭФ.
lgβInL = 25.5, lgβSmL = 18.1 [48]. Значение lgβ110 для
При рН 9 в спектрах ЯМР 1Н комплекса (рис. 7а)
Sc-ОБЭФ (20.25 ± 0.74) попадает в интервал, ожи-
наблюдается увеличение количества сигналов, что
даемый для данного комплекса.
свидетельствует о потере молекулой симметрии, и
Исследование координации ионов Sc3+ c ок-
две ее ранее симметричные части становятся маг-
сабис(этиленнитрило)тетра(метиленфосфоно-
нитно-неэквивалентными (соотношение сSc:сL не
вой кислотой) методом ЯМР. Спектры ЯМР 1H
влияет на строение комплекса). В спектрах ЯМР
ОБЭФ при pH 3, 5, 7 и 9 использованы в качестве
31Р (рис. 7б) появляются два сигнала равной интен-
спектров сравнения при изучении координации с
сивности, смещенные в слабое поле по сравнению
ионами Sc3+. При различных значениях рН наблю-
со спектром оксабис(этиленнитрило)тетра(мети-
даются незначительные изменения в шкале хими-
ленфосфоновой кислоты) на 13.15 и 10.47 м. д., что
ческого сдвига, вызванные, вероятно, смещением
соответствует переносу электронной плотности с
равновесия между формами ОБЭФ с различной
атомов фосфора на координированный ион скан-
степенью протонирования.
дия. В спектре образца с соотношением сSc:сL =
Для приготовления раствора оксабис(этилен-
1:2 виден небольшой по интенсивности сигнал,
нитрило)тетра(метиленфосфоновой кислоты) с
соответствующий свободному лиганду.
концентрацией 10 ммоль/л навеску лиганда рас-
При рН < 7 образуется осадок, и при уменьше-
творяли в D2O, а для приготовления растворов
нии рН усиливается опалесценция растворов из-за
Sc-ОБЭФ использовали ScCl3 и ОБЭФ в мольном
образования коллоида. При уменьшении концен-
соотношении 1:1 или 1:2 с постоянной концен-
трации лиганда опалесценция исчезает, однако для
трацией по лиганду (с 10 ммоль/л). Уровень рН
исследования образцов методом ЯМР минимально
растворов регулировали добавлением NaOD. Ис-
необходимая концентрация 10 ммоль/л. Поэтому
пользование комплексов с различным стехиоме-
спектры ЯМР надосадочных растворов при рН 7,
трическим соотношением Sc и ОБЭФ обусловлено
5, 3 не отличаются от спектров ОБЭФ.
тем, что при их подготовке в соотношении 1:1 на-
блюдали опалесценцию, которая усиливалась при
В спектрах ЯМР комплексов индия [21] с ок-
понижении рН. В связи с этим концентрация скан-
сабис(этиленнитрило)тетра(метиленфосфоновой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
254
МИТРОФАНОВ и др.
разца. При pH < 9 хроматограммы [44Sc]Sc-аце-
[⁴⁴Sc]Sc-ацетат рН 3.0
6
[⁴⁴Sc]Sc-ОБЭФ рН 3.0
тат не отличаются от хроматограмм смеси 44Sc
5
[⁴⁴Sc]Sc-ОБЭФ рН 9.0
с ОБЭФ (Rf несвязанного скандия и комплекса
4
[44Sc]Sc-ОБЭФ равны 0.9-1.0). При pH 9 наблюда-
3
ется разделение химических форм 44Sc, а именно:
несвязанный скандий-44 движется с фронтом рас-
2
творителя, а комплекс остается на старте хромато-
1
граммы.
0
Эффективное разделение несвязанного 44Sc и
комплекса [44Sc]Sc-ОБЭФ в образцах с pH 3-9 так-
же наблюдается в системе Б (Rf 0.9-0.1 и 0 для ком-
плекса [44Sc]Sc-ОБЭФ и несвязанного скандия-44
соответственно). Причем вид хроматограмм в си-
стеме Б не изменяется в исследованном диапазоне
Рис. 8. Результаты биораспределения препаратов скан-
дия-44 через 2 ч после внутривенного ВВЕДЕНИЯ
pH. Система Б применяется для анализа радиохи-
(*эпифизы бедренной кости, **черепная коробка без
мической чистоты препарата самария - 153Sm Ок-
нижней челюсти).
сабифора [22] и с несколько иным соотношением
растворителей (H2O-EtOH-Py, 4:2:1) используется
кислотой), как и в комплексах скандия, атомы фос-
для анализа радиохимической чистоты препаратов
фора магнитно-неэквивалентны, в то время как в
самария-153 с ЭДТФ [12, 51-55].
комплексе самария [50] фосфоновые группы вно-
Таким образом, 44Sc связывается с оксабис(эти-
сят одинаковый вклад в комплексообразование.
леннитрило)тетра(метиленфосфоновой кислотой)
Можно предположить, что в растворе комплекса
как при pH 3, так и pH 9, однако хроматографи-
Sc-ОБЭФ существует смесь нескольких форм
ческое поведение продуктов реакции различает-
комплекса, различающихся степенью протони-
ся. Как было отмечено выше, при pH 9 растворы
рования и характером взаимодействия металла с
являются истинными, в то время как при pH 3
атомами азота и кислорода. Низкое (по сравнению
наблюдается выпадение осадка. Такое различие
с комплексом In-ОБЭФ) значение lgβ110 может
в поведении продуктов взаимодействия 44Sc с ок-
свидетельствовать о существенном влиянии элек-
сабис(этиленнитрило)тетра(метиленфосфоновой
тронной структуры ионов при их близких ионных
кислотой) может привести к различному биорас-
радиусах (0.75 и 0.80 Å у Sc3+ и In3+ соответственно).
пределению, поэтому для дальнейших исследова-
Связывание 44Sc c оксабис(этиленнитрило)
ний были выбраны именно эти образцы.
тетра(метиленфосфоновой кислотой). Одной из
Биораспределение. Исследование потенци-
основных характеристик любого радиофармпре-
альной пригодности комплекса [44Sc]Sc-ОБЭФ в
парата является радиохимическая чистота, которая
качестве основы для остеотропного радиофарма-
определяется как процентное отношение активно-
цевтического препарата предполагает изучение
сти радионуклида в форме комплекса к активности
биораспределения препарата в организмах лабо-
радионуклида в препарате. Если дополнительная
раторных животных. В качестве модели патологии
очистка реакционной смеси не проводится, ради-
был выбран закрытый перелом в стадии активного
охимическая чистота равна величине радиохими-
ческого выхода реакции комплексообразования.
формирования костной мозоли. Для исследования
Для оценки радиохимической чистоты препаратов
биораспределения [44Sc]Sc-ОБЭФ были приготов-
со скандием-44 использовали метод тонкослойной
лены образцы с pH 3 и 9 (радиохимическая чисто-
хроматографии. В ходе подбора хроматографи-
та ˃ 95%). В качестве образца сравнения исполь-
ческой системы для анализа смесей 44Sc с ОБЭФ
зовали исходный раствор 44Sc в ацетате аммония
было обнаружено, что в системе А наблюдаемая
([44Sc]Sc-ацетат) с рН 3, который вводили живот-
хроматографическая картина зависит от pH об-
ным контрольной группы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
255
Таблица 5. Коэффициенты дифференциального накопления комплексов [44Sc]Sc-ОБЭФ
Орган
[44Sc]Sc-ОБЭФ, рН 3
[44Sc]Sc-ОБЭФ, рН 9
Перелом/интактная кость
3.3
3.5
Перелом/кровь
0.9
2.9
На рис. 8 представлены результаты биорас-
Важно отметить, что полученные в данной ра-
пределения [44Sc]Sc-ОБЭФ, полученные методом
боте результаты позволяют сделать первичную
прямой радиометрии, через 120 мин после вве-
оценку пригодности комплекса [44Sc]Sc-ОБЭФ в
дения. Накопление обоих образцов в очаге пато-
качестве остеотропного радиофармпрепарата для
логии в 3.3-3.5 раза выше, чем в интактой кости:
ПЭТ-диагностики.
5.16 ± 0.26 %/г (очаг) против 1.49 ± 0.22 %/г (нор-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ма) и 4.11 ± 0.18 %/г (очаг) против 1.23 ± 0.28 %/г
Использованные в работе реактивы относятся к
(норма) для [44Sc]Sc-ОБЭФ при рН 9 и рН 3 со-
классу фармацевтических и особо чистых (Sigma-
ответственно. Накопление несвязанного с ОБЭФ
Aldrich, Panreac). Титан-44 в форме 44TiCl4 в 4 M.
скандия-44 в очаге костной мозоли гораздо ниже
растворе HCl приобретен у ЗАО «Циклотрон»
(0.97 ± 0.16 %/г) и сопоставимо с накоплением в
(Обнинск, Россия), оксабис(этиленнитрило)те-
интактой кости (0.67 ± 0.18 %/г). Значительное от-
тра(метиленфосфоновая кислота) (ОБЭФ)
- у
личие профилей биораспределения несвязанного
ООО «Диамед». Твердофазный экстрагент TEVA
скандия-44 и образцов [44Sc]Sc-ОБЭФ позволяет
был любезно предоставлен доктором С. Хаппелем
говорить об определенной стабильности послед-
(TrisKem International).
них in vivo.
Растворы 44Sc получали с помощью лабора-
При сопоставимом уровне накопления в оча-
торной модели генератора 44Ti/44Sc. Генератор
ге костной патологии, образцы [44Sc]Sc-ОБЭФ с
(1.5 МБк 44Ti) изготовлен по концепции [56] с
рН 3 и 9 показали существенное различие уров-
одним усовершенствованием: для удержания 44Ti
ней накопления в крови. Через 120 мин после
вместо анионообменной смолы Dowex 1×8 ис-
введения накопление в крови
[44Sc]Sc-ОБЭФ
пользован твердофазный экстрагент TEVA, также
(рН 3) составило 4.40 ± 0.65%/г, тогда как для
проявляющий анионообменные свойства. 44Sc из
[44Sc]Sc-ОБЭФ (рН 9) - 1.76 ± 0.51%/г. Коэффи-
генератора элюировали 0.1 М. раствором щавеле-
циент дифференциального накопления очаг/кровь
вой кислоты в 0.2 М. соляной кислоте (количество
для [44Sc]Sc-ОБЭФ (рН 9) составил ~2.9 (что мож-
элюента 1 мл). Выход скандия-44 85-90%. Про-
но считать удовлетворительным значением), а
скок титана-44 в элюат не превышал 1.0×10-5 %
для [44Sc]Sc-ОБЭФ (рН 3) - лишь ~0.9. Посколь-
(определяли с помощью гамма-спектрометра с по-
ку накопление в крови несвязанного скандия-44 в
лупроводниковым гамма-детектором из сверхчи-
~2 раза ниже (2.14 ± 0.65%/г), с учетом различ-
стого германия GR3818 (Canberra Ind., США). Для
ного поведения образцов Sc-ОБЭФ при различ-
удаления щавелевой кислоты элюат упаривали
ных рН, видимо, из-за изменения заряда молеку-
досуха, затем добавляли 1 мл 30%-ного раствора
лы, растворимости и липофильности комплексы
перекиси водорода и снова упаривали досуха [57].
[44Sc]Sc-ОБЭФ при рН 3 проявляют более высо-
44Sc растворяли в 250 мкл 1.0 М. соляной кислоты,
кое связывание с белками плазмы крови. Для до-
затем добавляли 800 мкл 0.5 М. раствора ацетата
стоверного объяснения данного различия между
аммония. Полученный раствор 44Sc (рН 3.0-3.5)
образцами [44Sc]Sc-ОБЭФ с рН 3 и 9 необходимы
использовали для дальнейших исследований.
более детальные исследования. Величины коэффи-
Определение радиохимической чистоты.
циентов дифференциального накопления (табл. 5)
Для исследования связывания 44Sc с ОБЭФ и его
позволяют говорить о возможности эффектив-
хроматографического поведения к раствору скан-
ной визуализации очагов поражений скеле-
дия-44 добавляли раствор ОБЭФ (с = 50 ммоль/л),
та методом ПЭТ при использовании комплекса
необходимый уровень pH достигали, добавляя
[44Sc]Sc-ОБЭФ с рН 9.
растворы NaOH и HCl (конечная концентрация
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
256
МИТРОФАНОВ и др.
ОБЭФ 5 ммоль/л). Полученные образцы инкуби-
трия гидрофосфат, 27.5 ммоль/кг, калия дигидро-
ровали 15 мин, перемешивая при 25°С. Контроль-
фосфат, 20 ммоль/кг, pH 7.00; натрия тетраборат,
ные образцы ([44Sc]Sc-ацетат) готовили по той же
10 ммоль/кг, pH 9.18).
методике, но без добавления ОБЭФ. Распределе-
Спектры ЯМР на ядрах 1Н и 31Р зарегистри-
ние химических форм скандия-44 в полученных
рованы на спектрометре Bruker Avance
300
образцах анализировали методом ТСХ с после-
(300.13 МГц). Химические сдвиги в спектрах ЯМР
дующими авторадиографическим исследованием
1Н определяли относительно остаточного сигнала
и радиометрическим детектированием. Для ана-
растворителя D2O, а в спектрах ЯМР 31Р по внеш-
лиза были выбраны системы А и В. В системе А
нему стандарту (85%-ная H3PO4 водный раствор).
неподвижная фаза - полоски стекловолокна, им-
Биораспределение. Исследование распреде-
прегнированного силикагелем ITLC-SG (Aligent
ления меченых соединений in vivo выполнено на
Technologies, Inc., США), элюент - 0.1 М. буфер-
лабораторных мышах линии BALB/c. Животные
ный раствор натрия цитрата (pH 4.0); в системе В
получены из питомника КролИнфо. Эксперимен-
неподвижная фаза - хроматографическая бумага
ты проводили с соблюдением норм и правил об-
Ватман №2, элюент - смесь H2O-EtOH-Py, 4:1:2.
ращения с позвоночными животными, предназна-
Авторадиографическое исследование проводили
ченными для научных исследований [58].
на приборе Cyclone Plus Storage Phosphor System
(PerkinElmer, США), результаты обрабатывали с
Для создания очагов патологии животных нар-
помощью программного обеспечения OptiQuant.
котизировали путем внутрибрюшинного введения
Радиометрическое детектирование хроматогра-
раствора хлоралгидрата в физиологическом рас-
фических полосок проводили на сканере для
творе из расчета 400 мг на 1 кг массы тела. После
тонкослойной радиохроматографии miniGita Star
наркотизации без разреза мягких тканей произво-
(Raytest Isotopenmeβgerate GmbH, Германия).
дили внешнее воздействие на голень мыши (пер-
Потенциометрическое титрование. Для оцен-
пендикулярно оси кости до перелома). Формиро-
ки констант диссоциации оксабис(этиленнитрило)-
вание костной мозоли происходило без внешней
тетра(метиленфосфоновой кислоты) из навесок
фиксации. В течение последующих 10 дней фор-
ОБЭФ готовили растворы с концентрациями 1.4-
мировалась костная мозоль, которая служила мо-
14 ммоль/л в 0.1 M. растворе NaClO4, которые за-
делью метаболического поражения костной ткани.
тем титровали раствором 0.1 M. NaOH.
Препараты [44Sc]Sc-ОБЭФ и [44Sc]Sc-ацетат
Для оценки констант устойчивости комплек-
вводили животным через хвостовую вену в объе-
са со скандием проведено обратное титрование
ме 0.1 мл (~150 кБк на животное, 3 животных на
раствора оксабис(этиленнитрило)тетра(метилен-
препарат). Через 120 мин после введения препа-
фосфоновой кислоты) и смеси растворов ОБЭФ
рата животных умерщвляли методом частичной
и скандия хлорида в диапазоне pH 11.5-2.3 0.1 М.
декапитации (под наркозом), после чего отбирали
раствором HClO4. Для этого из навески ОБЭФ го-
пробы крови, а также извлекали органы и ткани
товили 50 мМ. раствор натриевой соли (ОБЭФ-
для исследования. Отобранные органы и тканы
NaOH, 1:8), 1 мл полученного раствора помещали
промывали физиологическим раствором, взвеши-
в 48 мл 0.1 М. раствора NaClO4, затем к этому рас-
вали и проводили прямую радиометрию с исполь-
твору добавляли 1 мл 50 мМ. раствора ScCl3.
зованием автоматического γ-счетчика Wizard 2480
Титрование проводили в термостатируе-
(PerkinElmer, США). Накопление активности вы-
мой ячейке при 25°С в инертной атмосфере.
ражали в процентах от активности введенной дозы
Измерения pH проводили на приборе Sartorius
(АID), отнесенных к массе органа/ткани (%AID/г).
PP-20-P11-pHметр/кондуктометр профессиональ-
ФОНДОВАЯ ПОДДЕРЖКА
ный, который перед каждой серией измерений
калибровали по четырем стандартным буферным
Работа выполнена при частичной финансовой
растворам (калия тетраоксалат, 50 ммоль/кг, pH
поддержке Российского фонда фундаментальных
1.68; калия гидрофталат, 50 ммоль/кг, pH 4.01; на-
исследований (проект № 19-03-00262).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
257
КОНФЛИКТ ИНТЕРЕСОВ
17.
Кодина Г.Е., Малышева А.О., Клементьева О.Е. //
Изв. АН. Сер. хим. 2016. № 2. С. 350; Kodina G.E.,
Авторы заявляют об отсутствии конфликта
Malysheva A.O., Klement’eva O.E. // Russ. Chem. Bull.
интересов.
2016. Vol. 65. N 2. P. 350. doi 10.1007/s11172-016-
1308-0
СПИСОК ЛИТЕРАТУРЫ
18.
Harris W.R., Yang B., Abdollahi S., Hamada Y. // J. In-
1.
Zheng Y., Zhou H., Dunstan C.R., Sutherland R.L.,
org. Biochem. 1999. Vol. 76. N 3-4. P. 231. doi 10.1016/
Seibel M.J. // J. Bone Oncol. 2013. Vol. 2. N 1. P. 47.
S0162-0134(99)00150-6
doi10.1016/J.JBO.2012.11.002
19.
Harris W.R., Chen Y., Wein K. // Inorg. Chem. 1994.
2.
Wood S., Salawu A., Kroening H., D’Oronzo S., Brown J.
Vol. 33. N 22. P. 4991. doi 10.1021/ic00100a024
In: Encyclopedia of Endocrine Diseases. Elsevier, 2019.
20.
Li H., Sadler P.J., Sun H. // Eur. J. Biochem. 1996.
Vol. 4. P. 310. doi 10.1016/B978-0-12-801238-3.64945-0
Vol. 242. N 2. P. 387. doi 10.1111/j.1432-
3.
Gdowski A.S., Ranjan A., Vishwanatha J.K. // J. Exp.
1033.1996.0387r.x
Clin. Cancer Res. 2017. Vol. 36. N 1. P. 1. doi 10.1186/
21.
Коневская Н.Д., Климова Т.П., Лазукова Л.Б., Ба-
s13046-017-0578-1
бушкина Т.А., Кодина Г.Е., Медведева Е.И., Рудоми-
4.
Macedo F., Ladeira K., Pinho F., Saraiva N., Bonito N.,
но М.В., Чурилина Н.В. // Коорд. хим. 1985. Т. 11.
Pinto L., Gonçalves F. // Oncol. Rev. 2017. Vol. 11.
№ 11. С. 1509.
N 1. P. 321. doi 10.4081/oncol.2017.321
22.
Кодина Г.Е., Громова Н.П., Тронова И.Н., Ин-
5.
Hensel J., Thalmann G.N. // Urology. 2016. Vol. 92.
кин А.А., Дроздовский Б.Я., Крылов В.В. Пат. 2162714
P. 6. doi 10.1016/j.urology.2015.12.039
(2006). РФ
6.
Rheinstein P.H., Akbari B. // Am. Fam. Physician. 1998.
23.
Каталог радиофармацевтических препаратов. http://
Vol. 57. N 11. P. 2865.
karpovipc.ru/index.php/katalogrfp 16.04.2020
7.
Kim E.E. // J. Nucl. Med. 2008. Vol. 49. N 6. P. 1028.
24.
Солодянникова О.И., Даниленко В.В., Сукач Г.Г.,
doi 10.2967/jnumed.108.050393
Саган Д.Л., Трацевский В.В. // Укр. радіол. ж. 2014.
8.
Кодина Г.Е., Кулаков В.Н., Шейно И.Н. // Радиаци-
Т. 22. № 3. С. 109.
онная медицина. 2014. Т. 10. № 4. С. 849.
25.
Цыб А.Ф., Крылов В.В., Дроздовский Б.Я., Каря-
9.
Mishiro K., Hanaoka H., Yamaguchi A., Ogawa K. //
кин О.Б., Бирюков В.А., Медведев В.Н., Смирно-
Coord. Chem. Rev. 2019. Vol. 383. P. 104. doi 10.1016/j.
ва И.А., Воробьева С.Л. // Сиб. онкол. ж. 2006. Т. 3.
ccr.2018.12.005
№ 19. С. 8.
10.
Amoroso A.J., Fallis I.A., Pope S.J.A. // Coord.
26.
Крылов В.В., Дроздовский Б.Я., Смирнова И.А. //
Chem. Rev. 2017. Vol. 340. P. 198. doi 10.1016/j.
Медицинские науки. Клиническая медицина. 2007.
ccr.2017.01.010
Т. 2. С. 13.
11.
Lange R., ter Heine R., Knapp R. (FF), de Klerk J.M.H.,
27.
Цыб А.Ф., Дроздовский Б.Я., Крылов В.В., Пекши-
Bloemendal H.J., Hendrikse N.H. // Bone. 2016. Vol. 91.
на Т.В. // Научно-практическая ревматология. 2000.
P. 159. doi 10.1016/j.bone.2016.08.002
№ 2. С. 79.
12.
Sohaib M., Ahmad M., Jehangir M., Perveen A. // Can-
28.
Распулова Н.В., Арыбжанов Д.Т., Любшин В.И.,
cer Biother. Radiopharm. 2011. Vol. 26. N 2. P. 159. doi
Каррэр Р., Бартл А., Шимон В., Крылов В.В., Ход-
10.1089/cbr.2010.0846
жибеков М.Х. // Креативная хирургия и онкология.
13.
Chakraborty S., Das T., Unni P.R., Sarma H.D.,
2014. № 1-2. С. 32. doi 10.24060/2076-3093-2014-0-
Samuel G., Banerjee S., Venkatesh M., Ramamoorthy
1-2-32-38
N., Pillai M.R.A. // Nucl. Med. Commun. 2002. Vol. 23.
N 1. P. 67. doi 10.1097/00006231-200201000-00011
29.
Елишев В.Г., Синельников М.М. // Акад. ж. западной
14.
Chakraborty S., Balogh L., Das T., Polyák A., Andócs G.,
Сибири. 2016. Т. 12. № 4. С. 46.
Máthé D., Király R., Thuróczy J., Chaudhari P.,
30.
Coenen H.H., Ermert J. // Nucl. Med. Biol. 2020. doi
Jánoki G., Jánoki G., Banerjee S., Pillai M.R.A. // Curr.
10.1016/j.nucmedbio.2020.07.003.
Radiopharm. 2015. Vol. 9. N 1. P. 64. doi 10.2174/187
31.
4471008666150312164255
nuclear-data-table/ 23.10.2020.
15.
Sepini L., Jansen D., Jarvis N., Zeevaart J.R. // Poly-
32.
Carzaniga T.S., Braccini S. // Appl. Radiat. Isot. 2019.
hedron. 2016. Vol. 106. P. 101. doi 10.1016/j.po-
Vol. 143. P. 18. doi 10.1016/j.apradiso.2018.10.015
ly.2015.12.044
33.
Huclier-Markai S., Alliot C., Kerdjoudj R., Mougin-
16.
Kálmán F.K., Király R., Brücher E. // Eur. J. Inorg.
Degraef M., Chouin N., Haddad F. // Cancer Biother.
Chem. 2008. Vol. 2008. N 30. P. 4719. doi 10.1002/
Radiopharm. 2018. Vol. 33. N 8. P. 316. doi 10.1089/
ejic.200800582
cbr.2018.2485
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
258
МИТРОФАНОВ и др.
34.
Sitarz M., Szkliniarz K., Jastrzębski J., Choiński J.,
47.
Harris W.R., Martell A.E. // Inorg. Chem. 1976. Vol. 15.
Guertin A., Haddad F., Jakubowski A., Kapinos K.,
N 3. P. 713. doi 10.1021/ic50157a044
Kisieliński M., Majkowska A., Nigron E., Rostampour M.,
48.
Tuck D.G. // Pure Appl. Chem. 1983. Vol. 55. N 9.
Stolarz A., Trzcińska A., Walczak R., Wojtkowska J.,
P. 1477. doi 10.1351/pac198355091477
Zipper W., Bilewicz A. // Appl. Radiat. Isot. 2018.
49.
Anderegg G. Critical Survey of Stability Constants of
Vol. 142. P. 104. doi 10.1016/j.apradiso.2018.09.025
EDTA Complexes. Oxford: Pergamon Press, 1977. P. 1.
35.
Filosofov D. V., Loktionova N.S., Rösch F. // Radiochim.
doi 10.1016/B978-0-08-022009-3.50004-0
Acta. 2010. Vol. 98. N 3. P. 149. doi 10.1524/
50.
Цебрикова Г.С., Баулин В.Е., Калашникова И.П.,
ract.2010.1701
Рагулин В.В., Завельский В.О., Кодина Г.Е., Цивад-
36.
Radchenko V., Meyer C.A.L., Engle J.W., Naranjo C.M.,
зе А.Ю. // ЖOX. 2016. Т. 86. Вып. 3. С. 499; Tsebriko-
Unc G.A., Mastren T., Brugh M., Birnbaum E.R.,
va G.S., Baulin V.E., Kalashnikova I.P., Ragulin V.V.,
John K.D., Nortier F.M., Fassbender M.E. // J.
Zavel’skii V.O., Kodina G.E., Tsivadze A.Yu. // Russ.
Chromatogr. A. 2016. Vol. 1477. P. 39. doi 10.1016/j.
J. Gen. Chem. 2016. Vol. 86. N 3. P. 639. doi 10.1134/
chroma.2016.11.047
S107036321603021X
37.
Kostelnik T.I., Orvig C.: review-article // Chem.
51.
Luo S.Z., Pu M.F., Quao J., Liu Z.L., Zhang C.Y.,
Rev. Am. Chem. Soc. 2019. Vol. 119. N 2. P. 902.
Zhao P.J., Fu Y.B., Deng H.F. // J. Radioanal. Nucl.
doi10.1021/acs.chemrev.8b00294
Chem. Artic. 1992. Vol. 160. N 2. P. 443. doi 10.1007/
38.
Mikolajczak R., van der Meulen N.P., Lapi S.E. // J.
BF02037119
Label. Compd. Radiopharm. 2019. Vol. 62. N 10. P. 615.
52.
Louw W.K.A., Dormehl I.C., Van Rensburg A.J., Hugo N.,
doi10.1002/jlcr.3770
Alberts A.S., Forsyth O.E., Beverley G., Sweetlove M.A.,
39.
Левин В.И., Яковлев В.Г., Кодина Г.Е., Медведе-
Marais J., Lötter M.G., Van Aswegen A. // Nucl. Med.
ва Е.И., Смолин М.Д. // ЖHX. 1981. Т. 26. № 5.
Biol. 1996. Vol. 23. N 8. P. 935. doi 10.1016/S0969-
С. 1180.
8051(96)00117-5
40.
Тихонова Л.И. // ЖHX. 1969. Т. 14. № 9. С. 2368.
53.
Turner J.H., Martindale A.A., Sorby P., Hethering-
41.
Solov’ev V.P. The CHEMEQUI program for compu-
ton E.L., Fleay R.F., Hoffman R.F., Claringbold P.G. //
tations of equilibrium constants and related quantities
Eur. J. Nucl. Med. 1989. Vol. 15. N 12. P. 784. doi
from experimental results of UV-Vis, IR and NMR
10.1007/BF00255498
spectroscopy, calorimetry, potentiometry and con-
54.
Alberts A.S., Smit B.J., Louw W.K.A., van Rensburg A.J.,
van Beek A., Kritzinger V., Nel J.S. // Radiother. On-
20.07.2020.
col. 1997. Vol. 43. N 2. P. 175. doi 10.1016/S0167-
42.
Solov’ev V.P., Tsivadze A.Y. // Prot. Met. Phys. Chem.
8140(97)01912-9
Surfaces. 2015. Vol. 51. N 1. P. 1. doi 10.1134/
55.
Majali M.A., Mathakar A.R., Shimpi H.H. // J. Ra-
S2070205115010153
dioanal. Nucl. Chem. 1999. Vol. 240. N 3. P. 845. doi
43.
Бек М. Химия равновесий реакций комплексо-
10.1007/BF02349861
образования. М.: Мир, 1973. 360 с.
56.
Greene M.W., Hillman M. // Int. J. Appl. Radiat.
44.
Россотти Ф., Россотти Х. Определение констант
Isot. 1967. Vol. 18. N 7. P. 540. doi 10.1016/0020-
устойчивости и других коснтант равновесия в
708X(67)90121-4
растворах. М.: Мир, 1965. 564 с.
57.
Walter R.I. // J. Inorg. Nucl. Chem. 1958. Vol. 6. N 1.
45.
Ekberg C., Brown P.L. Hydrolysis of Metal Ions. Wein-
P. 58. doi 10.1016/0022-1902(58)80100-1
heim: Wiley-VCH Verlag GmbH & Co. KGaA, 2016.
58.
Palisaitis D., Love M., Zimmerman R., Radhakrishnan S.,
46.
Smith R.M., Martell A.E. // Sci. Total Environ. 1987.
Welsh R., Saw J., Renner S., Kells C., Schampaert E. //
Vol. 64. N 1-2. P. 125. doi 10.1016/0048-
Can. J. Cardiol. 2011. Vol. 27. N 6. P. 865. doi 10.1016/j.
9697(87)90127-6
cjca.2011.06.009
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
КОМПЛЕКСООБР
АЗОВАНИЕ СКАНДИЯ
259
Complexation of Scandium
with Oxabis(ethylenenitrilo)tetramethylenephosphonic Acid
and Applicability of Its 44Sc-Labelled Analogue
as Bone-Seeking Agent
Yu. A. Mitrofanova, A. A. Larenkova,b,*, and G. E. Kodinaa
a Russian State Research Center “Burnasyan Federal Medical Biophysical Center” of the Federal Medical and Biological
Agency of Russia, Moscow, 123182 Russia
b Lomonosov Moscow State University, Moscow, 119991 Russia
*e-mail: anton.larenkov@gmail.com
Received November 12, 2020; revised November 12, 2020; accepted November 22, 2020
The regularities of complexation of scandium with oxabis(ethylenenitrilo)tetramethylenephosphonic acid
(OBEP), which is actively used today in clinical practice for the synthesis of bone-seeking radiopharmaseuti-
cals, were studied using potentiometric titration and NMR spectroscopy. The stability constant of the complex
(lgβ110 = 20.25 ± 0.74, 0.1 M NaClO4, 25°C) and the pH range of effective binding of scandium to OBEP
(from 3 to 9) are comparable to those of similar lanthanide complexes. The possibility of effective synthesis
of [44Sc]Sc-OBEP complexes without an isotopic carrier with radiochemical purity of at least 98% is shown.
Preliminary evaluation of the applicability of [44Sc]Sc-OBEP complex as a bone-seeking radiopharmaceutical
for PET-visualization of metabolic skeletal lesions was performed. The accumulation of [44Sc]Sc-OBEP in the
bone lesion is 3.0-3.5 times higher than that of intact bone.
Keywords: scandium-44, PET, [44Sc]Sc-OBEP, bone-seeking radiopharmaceuticals, polyphosphonic acids,
Oxabifore, complexation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021