ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 260-268
УДК 547.455.522:546.59
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА НА ОСНОВЕ
3-МЕРКАПТОПРОПИОНИЛГИДРАЗОНОВ
6-ДЕЗОКСИ- И 2-(АЦЕТИЛАМИНО)АЛЬДОЗ
© 2021 г. А. Ю. Ершовa,*, А. А. Мартыненковa, И. В. Лагодаb, Е. А. Якунчиковаb,
М. А. Копаницаc, И. В. Черныхс, А. В. Якиманскийa,d
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. В. О. 31, Санкт-Петербург, 199004 Россия
b Государственный научно-исследовательский испытательный институт военной медицины Минобороны РФ,
Санкт-Петербург, 195043 Россия
c Рязанский государственный медицинский университет имени И. П. Павлова, Рязань, 390026 Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*е-mail: ershov305@mail.ru
Поступило в Редакцию 31 октября 2020 г.
После доработки 31 октября 2020 г.
Принято к печати 12 ноября 2020 г.
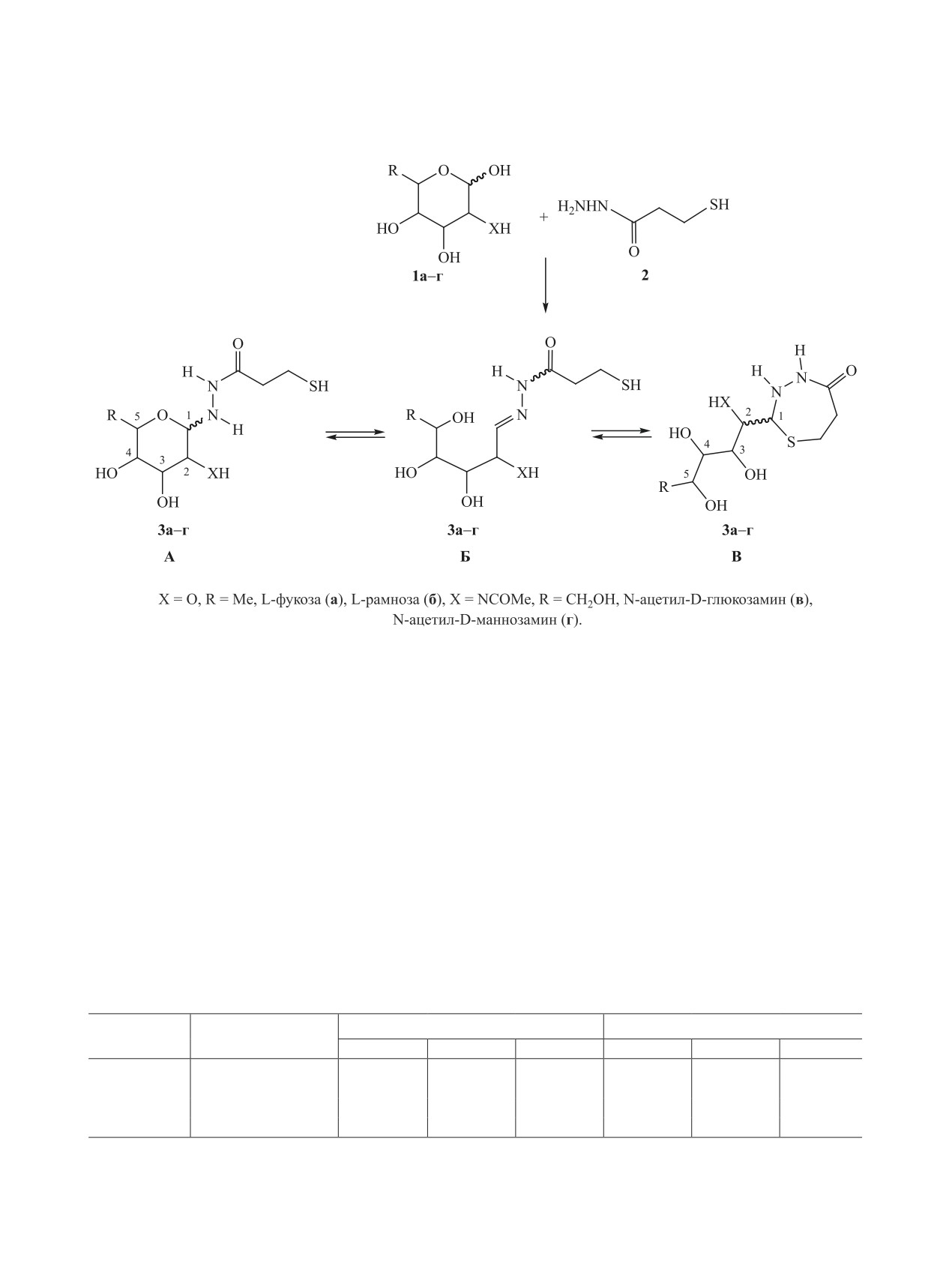
На основе легкодоступных тиолированных гликолигандов - 3-меркаптопропионилгидразонов L-фукозы,
L-рамнозы, N-ацетил-D-глюкозамина и N-ацетил-D-маннозамина - разработан метод синтеза гликона-
ночастиц золота co средним размером частиц 18-21 нм и низким значением индекса полидисперсно-
сти. Показано, что некоторые гликонаночастицы золота проявляют противоопухолевую активность, а
исходные тиолированные гликолиганды обладают высокой радиозащитной активностью, увеличивая
выживаемость смертельно облученных мышей на 50-70%.
Ключевые слова: тиолсодержащие монозы, кольчато-линейно-кольчатая таутомерия, гликонаночастицы
золота, противоопухолевая и радиозащитная активность
DOI: 10.31857/S0044460X21020098
Гликонаночастицы золота обладают свойством
с золотохлористоводородной кислотой (НAuCl4)
избирательно связываться с природными глико-
в присутствии восстанавливающих агентов раз-
протеиновыми молекулами (лектинами), находя-
личной природы. Методы синтеза исходных тиол-
щимися на поверхности клетки, а наличие в их
содержащих гликолигандов
- многостадийные
составе металлического ядра, придает им уникаль-
процессы, включающие, как правило, предвари-
ные оптические свойства [1-15]. Это определяет
тельную защиту гидроксильных групп исходного
ряд интенсивно развивающихся направлений, свя-
углевода и ее снятие на завершающей стадии про-
занных с применением гликонаночастиц Au в био-
цесса [16, 17]. Оригинальные методики синтеза
логических и биомедицинских целях: при диаг-
гликонаночастиц Au, не требующие предваритель-
ностике и лечении онкологических заболеваний
ной защиты гидроксильных групп углеводного
[8-14], в качестве иммунохимических маркеров и
фрагмента, с использованием в качестве лигандов
биосенсоров [2-4], антибактерицидных и проти-
гидразидов тиолсодержащих карбоновых кислот,
вовирусных препаратов [15].
приведены в работах [18-25].
Обычно гликонаночастицы Au получаются
Целью данной работы было изучение строения
при взаимодействии тиолсодержащих углеводов
продуктов конденсации гидразида 3-меркаптопро-
260
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
261
Схема 1.
пионовой кислоты с природными моносахаридами
3-Меркаптопропионилгидразоны альдоз 3а-г -
L-фукозой, L-рамнозой, N-ацетил-D-глюкозами-
сложные в таутомерном плане системы, способ-
ном и N-ацетил-D-маннозамином, определение их
ные к циклизации как в пиранозную форму А, так
и в 1,3,4-тиадиазепиновую форму В, являющейся
собственной биологической активности, а также
результатом внутримолекулярного присоединения
возможности их использования в качестве лиган-
группы SH по связи С=N гидразонного фрагмента
дов для получения гликонаночастиц Au.
линейной формы Б. Ранее нами были установлены
Выбор исходных альдоз в качестве объектов
спектральные различия между всеми возможными
исследования во взаимодействии с 3-меркаптопро-
формами А, Б и В, основанные на использовании
пионилгидразином 2 обусловлен их преимуще-
метода спектроскопии ЯМР 1Н и 13С [27-31], поэ-
ственным присутствием в составе N- и О-терми-
тому в данной работе они не обсуждаются, а указы-
нальных фрагментов лектинов, находящихся на
ваются лишь общие закономерности строения сое-
клеточной поверхности и отвечающих за распоз-
динений 3а-г в различных растворителях (табл. 1).
навание и связывание клеткой гликонаночастиц Au
Интенсивность сигналов форм А, Б и В соеди-
[26] (схема 1).
нений 3а-г в спектрах ЯМР 1Н и 13С изменялась
Таблица 1. Таутомерный состав соединений 3а-г в различных растворителях (48 ч после растворения)
Форма в кристалли-
Таутомерный состав в D2O, %
Таутомерный состав в ДМСО-d6, %
Соединение
ческом состоянии
форма A
форма Б
форма В
форма A
форма Б
форма В
3a
B
45
10
45
40
35
25
3б
В
50
15
35
60
40
-
3в
A
65
10
25
50
20
30
3г
A
50
10
40
55
20
25
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
262
ЕРШОВ и др.
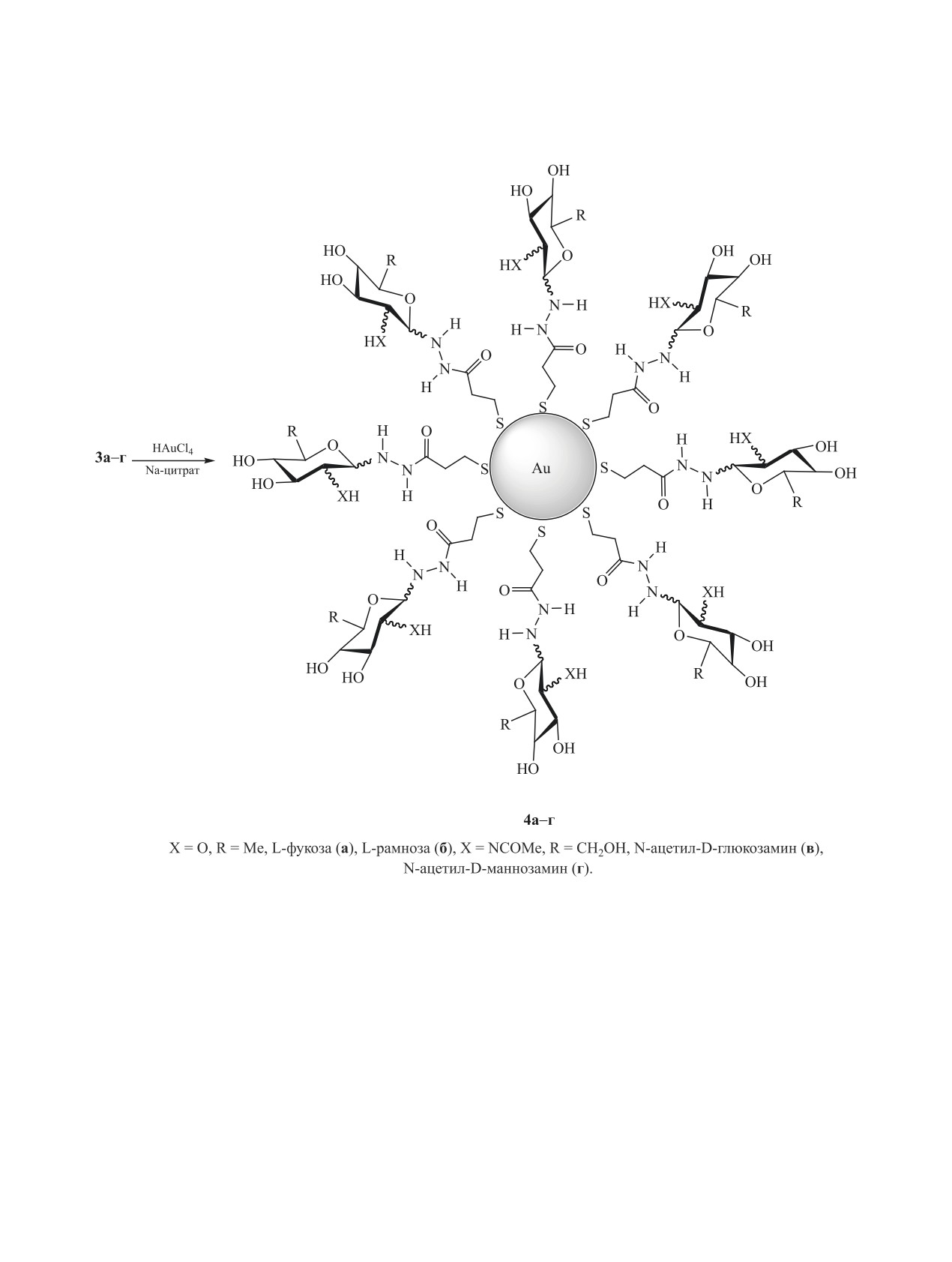
Схема 2.
во времени; через 48 ч эти изменения прекраща-
му А. Напротив, при съемке во времени спектров
лись, свидетельствуя о достижении равновесно-
ЯМР 1Н и 13С производных N-ацетил-D-глюкоза-
го состояния. При этом в спектрах ЯМР 1Н и 13С
мина 3в и N-ацетил-D-маннозамина 3г, уменьша-
производных L-фукозы 3а и L-рамнозы 3б, снятых
ется интенсивность сигналов пиранозной формы
непосредственно после растворения, интенсив-
А и возрастает интенсивность сигналов тиадиазе-
ность сигналов, принадлежащих тиадиазепиновой
пиновой формы В, что позволяет принять для этих
форме В, была существенно выше по сравнению с
соединений пиранозное строение А в кристалли-
интенсивностью этих сигналов в спектрах, снятых
ческом состоянии.
после установления равновесия. Это позволяет по-
В растворах всех используемых растворителей
лагать, что в кристаллическом состоянии соедине-
соединения 3а-г находятся в виде кольчато-линей-
ния 3а,б имеют тиадиазепиновое строение В, а в
но-кольчатого таутомерного равновесия между пи-
растворе частично переходят в пиранозную фор-
ранозной А, линейной меркаптопропионилгидра-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
263
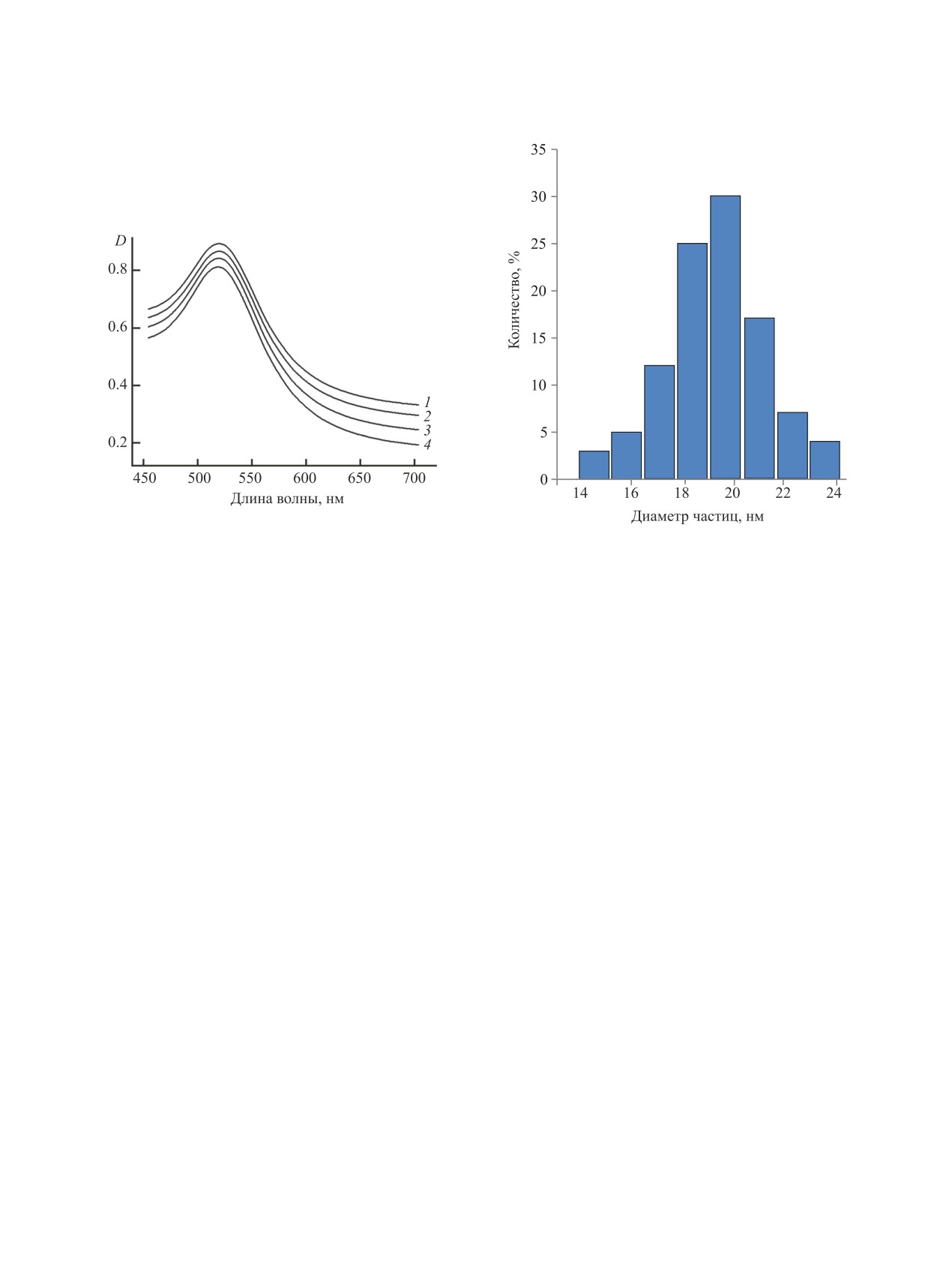
Рис. 1. Электронные спектры гликонаночастиц Au
4а-г на основе 3-меркаптопропионлгидразонов L-фу-
Рис. 2. Распределение гликонаночастицы Au на осно-
козы (1), L-рамнозы (2), N-ацетил-D-глюкозамина (3),
ве 3-меркаптопропионилгидразона L-рамнозы 4б по
N-ацетил-D-маннозамина (4).
диаметрам.
зоной Б и тиадиазепиновой В формами, при этом
вая форма В, в структуре которой не содержится
переход от D2O к полярному оснóвному ДМСО-d6
тиольной функции, не способна вступать во вза-
приводит к частичной стабилизации линейного
имодействие с коллоидными частицами золота с
таутомера Б (табл. 1). Наряду с таутомерными пе-
образованием гликонаночастиц Au. Однако, ввиду
реходами между кольчатыми формами А и В для
имеющегося в водном растворе равновесия, такое
взаимодействие осуществляется через пираноз-
соединений 3а-г в спектрах ЯМР 1Н и 13С фикси-
ную форму А. Возможность участия гидразонной
ровалось удвоение сигналов пиранозной формы А
формы Б во взаимодействии с коллоидным золотом
и 1,3,4-тиадиазепиновой формой В, обусловлен-
следует исключить из рассмотрения, поскольку для
ное наличием пространственной конфигурацион-
всех полученных гликонаночастиц Au 4а-г в спек-
ной изомерии при аномерном атоме углерода С1.
трах ЯМР 1Н не наблюдалось проявления сигнала
Поскольку для продуктов конденсации гидра-
азометиновых протонов при 7.5-8.0 м. д., а в спек-
зида 3-меркаптопропионовой кислоты с L-фуко-
трах ЯМР 13С сигналов при 145-150 м. д. (С=N),
зой, L-рамнозой, N-ацетил-D-глюкозамином и
характерных для этой формы.
N-ацетил-D-маннозамином содержание линейной
Для изучения физико-химических параметров
формы Б не превышало 40%, термин «3-меркапто-
синтезированных гликонаночастиц Au 4а-г, мы
пропионилгидразон» для подобных систем носит
использовали методы электронной спектроскопии,
условный характер.
динамического светорассеяния (ДРС) и просвечи-
Процесс образования гликонаночастиц Au 4а-г
вающей электронной микроскопии (ПЭМ) (рис. 1,
начинается через несколько часов после смешива-
2). Так, в электронных спектрах гликонаночастиц
ния растворов исходных соединений 3а-г с колло-
Au наблюдается плазмонное поглощение, макси-
идным золотом, о чем можно судить визуально по
мум которого приходится на диапазон 523-526 нм.
переходу окраски раствора от вишнево-красного в
(табл. 2)
фиолетовую и завершается через сутки (схема 2).
Агрегативная устойчивость гликонаночастиц
Очевидно, что циклическая 1,3,4-тиадиазепино-
Au 4a-г в значительной степени определяется
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
264
ЕРШОВ и др.
строением исходного моносахарида. Так, глико-
Таблица 2. Данные о размерах, полидисперсности и
наночастицы Au 4б и 4в, полученные на основе
световому поглощению водных растворов гликонаноча-
продуктов конденсации гидразида
3-меркапто-
стиц Au 4a-г (72 ч после приготовления)
пропионовой кислоты с L-рамнозой и N-аце-
Средний
тил-D-глюкозамином, оказались устойчивыми при
№
диаметр,
Индекс полидисперсности
λ, нм
нм
хранении в течение 3-4 недель и увеличение их
4а
21
0.30
523
диаметра, согласно данным ДСР, не превышало
4б
18
0.25
523
5%. С другой стороны, гликонаночастицы Au 4а и
4в
20
0.27
524
4г - производные L-фукозы и N-ацетил-D-манно-
4г
21
0.24
526
замина - претерпевают заметную агрегацию уже
через 2-3 сут после приготовления. Визуально это
можно наблюдать по переходу окраски раствора
Радиозащитную активность
3-меркаптопро-
от красной до бледно-голубой, а затем до полного
пионилгидразнов альдоз
3а-г определяли в
обесцвечивания раствора. Агрегация вышеуказан-
опытах на мышах, облученных в дозе 6.5 Гр по
ных гликонаночастиц Au подтверждается также
стандартной методике [34], при этом измеряли
данными ДСР и электронной спектроскопии по
выживаемость и среднюю продолжительность
заметному смещению полосы плазмонного резо-
жизни подвергнутых облучению животных. Наи-
нанса в длинноволновую область. Для предотвра-
большым радиозащитным действием обладают
щения агрегации полученных гликонаночастиц Au
3-меркаптопропионилгидразоны L-рамнозы 3а и
4а и 4г в качестве стабилизатора использовался
N-ацетил-D-глюкозамина 3в, увеличивающие вы-
додецилсульфат натрия, который добавляли в ре-
живаемость подопытных животных на 50-75%.
акционную смесь при синтезе гликонаночастиц Au
Таким образом, предложен простой метод син-
в количестве 10 мас% от массы исходного глико-
теза гликонаночастиц Au на основе легкодоступ-
лиганда.
ных 3-меркаптопропионилгидразонов L-фукозы,
Оценку противоопухолевой активности гли-
L-рамнозы, N-ацетил-D-глюкозамина и N-аце-
конаночастиц золота 4а-г проводили по отноше-
тил-D-маннозамина. Важно подчеркнуть, что
нию к культуре клеток аденокарциномы ободоч-
разработанный метод не предполагает предвари-
ной кишки человека по известной методике [32].
тельной защиты гидроксильных групп исходного
При этом наибольшую активность (70% поражен-
углевода, что в значительной степени упрощает
ных клеток по сравнению с контролем) проявля-
синтез тиолсодержащих сахаров и гликонаноча-
ли гликонаночастиц Au 4а, содержащие остатки
L-фукозы. Это создает предпосылки для более
стиц Au на их основе. В области практического
углубленного изучения их химиотерапевтическо-
использования полученных соединений, перспек-
го эффекта, а также механизма связывания с пора-
тивным представляется изучение возможности
женными клетками.
биомедицинского применения комбинации глико-
наночастица-гликолиганд в онкологии, в частно-
В отличие от целевых биомедицинских при-
сти, при лучевой терапии. Эффективность такой
менений гликонаночастиц Au, биологические
системы может быть обусловлена их комбини-
свойства входящих в их состав тиолсодержащих
сахаров в качестве лигандов, практически не из-
рованными свойствами, где гликонаночастицы
учены. Накопленные к настоящему моменту дан-
избирательно воздействуют на раковые клетки, а
ные свидетельствуют, что соединения, в структуре
тиолированные гликолиганды позволят защитить
которых содержатся аминные и тиольные группы,
клетки, не вовлеченных в опухолевый рост от не-
разделенные между собой 2-3 атомами углерода,
гативного лучевого воздействия. Это будет являть-
обладают высокой профилактической радиоза-
ся предметом наших дальнейших исследований.
щитной активностью [33]. В связи с этим, пред-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ставляется актуальным изучение собственной
радиопротекторной активности исходных 3-мер-
Элементный анализ проводили на анализаторе
каптопропионилгидразнов альдоз 3а-г.
Hewlett-Packard 185B. Спектры ЯМР 1Н и 13С сни-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
265
мались на спектрометре Bruker AV-400 при рабо-
(0.6Н, СН2S), 3.72 д (0.3Н, J 9.5 Гц, Н1); форма
чих частотах 400 и 100 МГц соответственно. Элек-
E,E′-Б (10%): 1.25 д (0.3Н, J 4.0 Гц, СН3), 2.84 м
тронные спектры поглощения регистрировали
(0.2Н, СН2), 3.03 м (0.2Н, СН2S), 7.36 д (0.1Н, J
на спектрофотометре СФ-2000 в диапазоне длин
6.0 Гц, HC=N); форма В (45%), 1.29 д (1.35Н, J
волн 300-750 нм в кварцевой кювете толщиной
6.0 Гц, СН3), 2.56 м (0.7Н, СН2), 2.69 м (0.7Н,
1 см. Диаметр и индекс полидисперсности по-
СН2S), 4.50 д (0.45Н, J 4.5 Гц, Н1). Спектр ЯМР
лученных гликонаночастицы Au определяли ме-
13С (D2O), δC, м. д.: форма α-А, 15.58 (CH3), 19.79
тодом динамического светорассеяния (ДРС) на
(CH2S), 37.63 (CH2), 66.02 (C5), 68.10 (C4), 72.88
анализаторе Malvern Zetasizer Nano-ZS с длиной
(C2), 73.72 (C3), 89.63 (С1), 173.65 (C=O); β-А,
волны лазерного излучения 633 нм. Для определе-
15.58 (CH3), 19.79 (CH2S), 37.50 (CH2), 66.37 (C5),
ния морфологии гликонаночастиц Au использова-
71.49 (C4), 71.56 (C2), 73.89 (C3), 90.14 (С1), 173.65
ли метод просвечивающей электронной микроско-
(C=O); форма E,E′-Б, 16.18 (CH3), 18.65 (CH2S),
пии (ПЭМ) на микроскопе Jeol JEM 100 S.
37.50 (CH2), 66.02 (C5), 69.34 (C4), 73.05 (C2), 73.80
(C3), 145.74 (C=N), 173.74 (C=O); форма В, 15.71
Изучение противоопухолевой активности сое-
(CH3), 23.83 (CH2S), 33.19 (CH2), 67.07 (C5), 70.88
динений 4а-г проводили на кафедре фармаколо-
(C4), 71.73 (C2), 71.87 (C3), 73.48 (C1), 173.65(C=O).
гии Рязанского государственного медицинского
Найдено, %: С 40.51; H 6.73; N 10.57. C9H18N2O5S.
университета им. И.П. Павлова. Исследование
Вычислено, %: С 40.59; H 6.81; N 10.52.
радиозащитной эффективности гликолигандов
3-Меркаптопропионилгидразон L-рамнозы
3а-г проводили в Государственном научно-иссле-
(3б). Выход 75%, т. пл. 134-136°С. Спектр ЯМР 1Н
довательском испытательном институте военной
(D2O), δ, м. д.: форма α-А (15%), 1.32 д (0.45Н, J
медицины Минобороны РФ. Развернутые резуль-
6.0 Гц, СН3), 2.86 м (0.3Н, СН2), 3.05 м (0.3Н, СН2S),
таты таких исследований будут представлены в
4.01 д (0.15Н, J 4.0 Гц, Н1); форма β-А (35%), 1.32
виде отдельных публикаций в специализирован-
д (1.05Н, J 6.0 Гц, СН3), 2.86 м (0.7Н, СН2), 3.05
ных журналах.
м (0.7Н, СН2S), 3.64 д (0.35Н, J 8.0 Гц, Н1); фор-
Гидразид
3-меркаптопропионовой кисло-
ма E,E′-Б (15%), 1.37 д (0.45Н, J 6.0 Гц, СН3), 2.86
ты (2) получен по известной методике [35]. Вы-
м (0.3Н, СН2), 3.05 м (0.3Н, СН2S), 7.41 д (0.15Н,
ход 80%, вязкая маслообразная жидкость. Спектр
J 6.0 Гц, HC=N); форма В (35%), 1.37 д (1.05Н, J
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.94 т (1Н, J 7.0 Гц,
6.0 Гц, СН3), 2.60 м (0.7Н, СН2), 2.73 м (0.7Н, СН2S),
SH), 2.57 м (2Н, СН2), 2.86 м (2Н, СН2S), 4.15 уш.
4.11 уш. с (0.35Н, Н1). Спектр ЯМР 13С (D2O), δC,
с (2Н, NH2), 9.87 уш. с (1Н, NHCO). Спектр ЯМР
м. д.: форма α-А, 16.88 (CH3), 18.79 (CH2S), 37.53
13C (ДМСО-d6), δС, м. д.: 23.45 (СН2S), 32.11 (СН2),
(CH2), 67.03 (C5), 70.11 (C2), 70.28 (C4), 73.26 (C3),
171.34 (C=O). Найдено, %: С 30.07; Н 6.78; N 23.28.
87.62 (С1), 172.73 (C=O); форма β-А, 16.88 (CH3),
C3H8N2OS. Вычислено, %: С 29.98; Н 6.71; N 23.31.
18.65 (CH2S), 37.69 (CH2), 68.34 (C5), 69.85 (C2),
Общая методика синтеза
3-меркаптопро-
72.15 (C4), 72.38 (C3), 86.40 (С1), 172.98 (C=O);
пионилгидразонов альдоз 3a-г. Раствор 1.20 г
форма E,E′-Б, 16.80 (CH3), 18.65 (CH2S), 37.61
(10 ммоль) гидразида
3-меркаптопропионовой
(CH2), 69.84 (C5), 69.86 (C4), 72.38 (C2), 73.38 (C3),
кислоты 2 и 10 ммоль соответствующего моно-
146.58 (C=N), 173.32 (C=O); форма В, 16.93 (CH3),
сахарида в 30 мл МеOH кипятили в течение 3 ч.
23.95 (CH2S), 33.15 (CH2), 69.23 (C5), 70.23 (C4),
После охлаждения белую кристаллическую массу
72.26 (C2), 72.87 (C3), 73.36 (C1), 173.11 (C=O).
фильтровали, сушили в вакууме и хранили в экси-
Найдено, %: С 40.51; H 6.73; N 10.57. C9H18N2O5S.
каторе над Р2О5.
Вычислено, %: С 40.59; H 6.81; N 10.52.
3-Меркаптопропионилгидразон L-фукозы
3-Меркаптопропионилгидразон N-ацетил-
(3a). Выход 85%, т. пл. 112-115°С. Спектр ЯМР 1Н
D-глюкозамина (3в). Выход 65%, т. пл. 163-166°С
(D2O), δ, м. д.: форма α-А (15%), 1.27 д (0.45Н, J
(разл.). Спектр ЯМР 1Н (D2O), δ, м. д.: форма α-А
6.0 Гц, СН3), 2.84 м (0.3Н, СН2), 3.03 м (0.3Н, СН2S),
(25%), 2.07 c (0.75Н, СН3), 2.83 м (0.5Н, СН2),
4.07 д (0.15Н, J 5.0 Гц, Н1); форма β-А (30%), 1.29
3.03 м (0.5Н, СН2S), 4.89 д (0.25Н, J 5.0 Гц, Н1),
д (0.9Н, J 6.0 Гц, СН3), 2.84 м (0.6Н, СН2), 3.03 м
9.32 уш. с (0.25Н, NHCO); форма β-А (40%), 2.09
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
266
ЕРШОВ и др.
c (1.2Н, СН3), 2.83 м (0.8Н, СН2), 3.03 м (0.8Н,
Получение раствора коллоидного золота.
СН2S), 4.56 д (0.4Н, J 9.5 Гц, Н1), 9.52 уш. с
К 200 мл 2.5×10-4 М. раствора HAuCl4 при кипя-
(0.4Н, NHCO); форма E,Z′-Б (10%), 2.07 c (0.3Н,
чении и интенсивном перемешивании добавляют
СН3), 2.83 м (0.2Н, СН2), 3.03 м (0.2Н, СН2S),
горячий раствор 0.075 г двухводного цитрата на-
7.18 д (0.1Н, J 6.0 Гц, HC=N), 10.36 уш. с (0.1Н,
трия в 10 мл Н2О. После появления ярко-красного
NHCO); форма В (25%), 2.27 c (0.75Н, СН3), 2.56
окрашивания смесь кипятят при перемешивании
м (0.5Н, СН2), 2.69 м (0.5Н, СН2S), 5.24 д (0.25Н, J
в течение 30 мин, затем охлаждают до комнатной
3.5 Гц, Н1). Спектр ЯМР 13С (D2O), δC, м. д.: форма
температуры, фильтруют и используют в синтезе
α-А, 16.13 (CH2S), 21.97 (CH3), 35.79 (CH2), 53.62
гликонаночастиц Au 4a-г. Судя по данным ДРС и
(C2), 60.88 (C6), 73.94 (C4), 74.52 (C3), 76.90 (C5),
электронной спектроскопии, полученный раствор
88.48 (С1), 172.50 (C=O), 174.73 (C=O); β-А, 16.13
содержал основную фракцию коллоидного золота
(CH2S), 22.24 (CH3), 35.79 (CH2), 54.12 (C2), 60.84
с диаметром частиц 14±1 нм и имел макcимум по-
(C6), 72.60 (C4), 75.97 (C3), 76.96 (C5), 90.87 (С1),
глощения при длине волны 520 нм.
172.50 (C=O), 174.73 (C=O); форма E,Z′-Б, 19.81
Синтез гликонаночастиц золота 4a-г. К 10 мл
(CH2S), 22.24 (CH3), 37.68 (CH2), 52.45 (C2), 61.05
раствора коллоидного золота при перемешивании
(C6), 71.69 (C4), 74.73 (C3), 76.74 (C5), 155.07 (C=N),
добавляют раствор 3×10-5 моль соединения 3а-г
168.86 (C=O), 172.80 (C=O); форма В, 22.07 (CH3),
и 2-3 мг додецилсульфата Na в 1 мл Н2О и выдер-
23.86 (CH2S), 33.23 (CH2), 56.75 (C2), 60.65 (C6),
живают при 25°С в течение 48-72 ч. Контроль за
69.89 (C4), 70.13 (C3), 70.72 (C5), 77.03 (C1), 172.50
протеканием реакции осуществляют визуально по
(C=O), 174.93 (C=O). Найдено, %: С 40.79; H 6.61;
изменению окраски раствора, а также с использо-
N 13.06. C11H21N3O6S. Вычислено, %: С 40.86; H
ванием методов ДРС, ПЭМ и электронной спек-
6.55; N 12.99.
троскопии.
3-Меркаптопропионилгидразон N-ацетил-
D-маннозамина (3г). Выход 70%, т. пл. 155-158°С
КОНФЛИКТ ИНТЕРЕСОВ
(разл.). Спектр ЯМР 1Н (D2O), δ, м. д.: форма α-А
Авторы статьи заявляют об отсутствии
(15%), 2.11 c (0.45Н, СН3), 2.84 м (0.3Н, СН2), 3.02
конфликта интересов.
м (0.3Н, СН2S), 5.08 д (0.15Н, J 4.0 Гц, Н1); фор-
ма β-А (35%), 2.15 c (1.05Н, СН3), 2.84 м (0.7Н,
СПИСОК ЛИТЕРАТУРЫ
СН2), 3.02 м (0.7Н, СН2S), 4.51 д (0.35Н, J 8.5 Гц,
1. Application of Nanotechnology in Biomedical Sciences /
Н1); форма E,Z′-Б (10%), 2.16 c (0.3Н, СН3), 2.84
Ed. F.A. Sheikh. Singapore: Springer Nature Singapore
м (0.2Н, СН2), 3.02 м (0.24Н, СН2S), 7.38 д (0.1Н,
Pte Ltd, 2020. 164 p. doi 10.1007/978-981-15-5622-7
J 5.5 Гц, HC=N); форма В (40%), 2.29 c (1.2Н,
2. Glycochemical synthesis: strategies and applications /
СН3), 2.59 м (0.8Н, СН2), 2.71 м (0.8Н, СН2S), 5.18
Eds S.-C. Hung, M.M.L. Zulueta. Hoboken: John Wiley
уш. с (0.4Н, Н1). Спектр ЯМР 13С (D2O), δС, м. д.:
& Sons, Inc., 2016, 576 p. doi 10.1002/ 9781119006435.
форма α-А, 19.87 (CH2S), 22.12 (CH3), 37.59 (CH2),
ch16
52.44 (C2), 60.66 (C6), 72.07 (C3), 72.96 (C4), 76.39
3. Engineered carbohydrate-based materials for biomedical
applications: polymers, surfaces, dendrimers, nano-
(C5), 86.81 (С1), 173.24 (C=O), 175.48 (C=O); β-А,
particles, and Hydrogels / Ed. R. Narain. New Jersey:
19.87 (CH2S), 22.13 (CH3), 37.47 (CH2), 52.06 (C2),
John Wiley & Sons, 2011. 424 p. doi 10.1002/
60.49 (C6), 72.14 (C3), 72.57 (C5), 77.87 (C4), 87.30
9780470944349.ch6
(С1), 173.24 (C=O), 175.48 (C=O); форма E,Z′-Б,
4. Carbohydrate nanotechnology / Ed. K.J. Stine.
17.52 (CH2S), 22.05 (CH3), 37.64 (CH2), 52.45 (C2),
New Jersey: John Wiley & Sons, 2016. 470 p. doi
66.76 (C6), 71.17 (C4), 71.56 (C3), 73.44 (C5), 156.91
10.1002/9781118 860212.ch3
(C=N), 169.69 (C=O), 173.26 (C=O). форма В, 22.07
5. Self-Assembled Monolayers of carbohydrate derivatives
(CH3), 23.66 (CH2S), 33.15 (CH2), 54.13 (C2), 63.12
on gold surfaces. In: Carbohydrate. / Eds M. Caliskan,
(C6), 68.90 (C4), 70.71 (C2), 72.96 (C3), 77.65 (C1),
I.H. Kavakli, G.C. Oz. Istanbul: InTech Publisher, 2017.
172.24 (C=O), 175.68 (C=O). Найдено, %: С 40.79;
164 p. doi 10.5772/66194
H 6.61; N 13.06. C11H21N3O6S. Вычислено, %: С
6. Nanobiomaterials in cancer therapy: applications of
40.86; H 6.55; N 12.99.
nanobiomaterials / Ed. A. Grumezescu. Oxford: Elsevier
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ ГЛИКОНАНОЧАСТИЦ ЗОЛОТА
267
Science Publishing Co Inc., 2016. 588 p. doi 10.1016 /
24.
Gurav D., Varghese O.P., Hamad O.A., Nilsson B.,
B978-0-323-42863-7.00002-5
Hilborn J., Oommen O.P. // Chem. Comm. 2016.
7.
Marin M.J., Schofield C.L., Field R.A., Russell D.A. //
Vol. 52. N 5. P. 966. doi 10.1039/c5cc09215a.
Analyst. 2015. Vol. 140. P. 59. doi 10.1039/
25.
Villadsen K., Martos-Maldonado M.C., Jensen K.J.,
C4AN01466A
Thygesen M.B. // ChemBioChem. 2017. Vol. 18. N 7.
8.
de la Fuente J.M., Penades S. // Biochim. Biophys.
P. 574. doi 10.1002/cbic.201600582
Acta. 2006. Vol. 1760. N 4. P. 636. doi 10.1016/j.
26.
Coulibaly F.S., Youan B.B.C. // AIMS Mol. Sci. 2017.
bbagen. 2005.12.001
Vol. 4. N 1. P. 1. doi 10.3934/ molsci.2017.1.1
9.
Barrientos A.G., de la Fuente J.M., Rojas T.C.,
27.
Васильева М.Ю., Ершов А.Ю., Байгильдин В.А.,
Fernandez A., Penades S. // Chem. Eur. J. 2003. Vol. 9.
Шабсельс Б. М., Лагода И.В., Якиманский А.В. //
N 9. P. 1909. doi 10. 1002/CHEM.200204544
ЖОХ. 2018. Т. 88. Вып. 6. С. 1027; Vasileva M.Yu.,
10.
Vetro M., Safari D., Fallarini S., Salsabila K., Lahmann M.,
Ershov A.Yu., Baygildin V.A., Shabsels B.M., Lago-
da I.V., Yakimansky A.V. // Russ. J. Gen. Chem. 2018.
Penades S., Lay L., Marradi M., Compostella F. //
Vol. 88. N 6. P. 1205. doi 10.1134/S1070 363218060257
Nanomedicine. 2017. Vol. 12. N 1. P. 13. doi 10.2217/
28.
Ершов А.Ю., Васильева М.Ю., Лагода И.В., Яки-
nnm-2016-0306
манский А.В. // ЖОХ. 2018. Т. 88. Вып. 6. С. 1020;
11.
Bor G., Mat Azmi I. D., Yaghmur A. // Ther. Deliv. 2019.
Ershov A.Yu., Vasileva M.Yu., Lagoda I.V., Yakiman-
Vol. 10. N 2. P. 113. doi 10.4155/tde-2018-0062
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 6.
12.
Singh P., Pandit S., Mokkapati V.R.S.S., Garg A.,
P. 1199. doi 10.1134/S10 70363218060245
Ravikumar V., Mijakovic I. // Int. J. Mol. Sci. 2018.
29.
Ершов А.Ю., Васильева М.Ю., Лагода И.В., Бай-
Vol. 19. N 7. e1979. doi 10.3390/ijms19071979
гильдин В.А., Наследов Д.Г., Кулешова Л.Ю., Яки-
13.
Bogart L.K., Pourroy G., Murphy C.J., Puntes V.,
манский А.В. // ЖОХ. 2018. Т. 88. Вып. 1. С. 108;
Pellegrino T., Rosenblum D., Peer D., Lévy R. //
Ershov A.Yu., Vasileva M.Yu., Lagoda I.V., Baygil-
ACS Nano. 2014. Vol. 8. N 4. P. 3107. doi 10.1021/
din V.A., Nasledov D.G., Kuleshova L.Yu., Yakiman-
nn500962q
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 1.
14.
Jazayeri M.H., Amani H., Pourfatollah A.A., Avan A.,
P. 103. doi 10.1134/S1070363218010164
Ferns G.A., Pazoki-Toroudi H. // Cancer Gene Therapy.
30.
Ершов А.Ю., Лагода И.В., Якимович С.И., Зеро-
2016. Vol. 23. P. 365. doi 10.1038/cgt.2016.42
ва И.В., Пакальнис В.В., Мокеев М.В., Шаманин В.В. //
15.
Veerapandian M., Lim S.K., Nam H.M., Kuppannan G.,
ЖОрХ. 2009. Т. 45. Вып. 5. С. 754; Ershov A.Yu.,
Yun K.S. // Analyt. Bioanalyt. Chem. 2010. Vol. 398.
Lagoda I.V., Yakimovich S.I., Zerova I.V., Pakal’-
P. 867. doi 10.1007/ s00216-010-3964-5
nis V.V., Mokeev M.V., Shamanin V.V. // Russ. J. Org.
16.
Combemale S., Assam-Evoung J.-N., Houaidji S., Bib R.,
Chem. 2009. Vol. 45. N 5. P. 740. doi 10.1002 /chin.
Barragan-Montero V. // Molecules. 2014. Vol. 19. N 1.
201008197
P. 1120. doi 10.3390/molecules19011120
31.
Ершов А.Ю., Лагода И.В., Якимович С.И., Зеро-
17.
Murakami T., Hirono R., Sato Y., Furusawa K. //
ва И.В., Пакальнис В.В., Шаманин В.В. // ЖОрХ.
Carbohyd. Res. 2007. Vol. 342. N 8. P. 1009. doi
2009. Т. 45. Вып. 10. С. 1503; Ershov A.Yu., Lago-
10.1016/j.carres. 2007.02.024
da I.V., Yakimovich S.I., Zerova I.V. Pakal’nis V.V.,
18.
Yang H., Cheng Q. // Analyst. 2017. Vol. 142. N 14.
Shamanin V.V. // Russ. J. Org. Chem. 2009. Vol. 45. N
P. 2654. doi 10.1039/c7an00428a
10. P. 1488. doi 10.1134/S10704280 0910011X
19.
Zhang J., Misra R. D. K. // Acta Biomater. 2007.
32.
Tolosa L., Donato M.T., Gomez-Lechon M.J. // Met.
Vol. 33. N 6. P. 838. doi 10.1016/j.actbio.2007.05.011
Mol. Biol. 2015. Vol. 1250. P. 333. doi 10.1007/978-1-
20.
Chuang Y.-J., Zhou X., Pan Z., Turchi C. // Biochem.
4939-2074-7_26
Biophys. Res. Comm. 2009. Vol. 389. N 1. P. 22. doi
33.
Johnke R.M., Sattler J.A., Allison R.R. // Future Oncol.
10.1016/j.bbrc. 2009.08.079
2014. V. 10. N 15. P. 2345. doi 10.2217/fon.14.175
21.
Higbee-Dempsey E.M., Amirshaghaghi A., Case M.J.,
34.
Лагода И.В., Якунчикова Е.А., Драчев И.С., Гребе-
Bouché M., Kim J., Cormode D.P., Tsourkas A. // JACS.
нюк А.Н., Мартыненков А.А., Кулешова Л.Ю., Ко-
2020. Vol. 142. P. 7783. doi 10.1021/jacs.9b13813
паница М.А., Ершов А.Ю. // Радиационная биология.
22.
Zhi Z., Powell A.K., Turnbull J.E. // Anal. Chem. 2006.
Радиоэкология. 2020. Т. 60. № 3. C. 291. doi 10.31857/
Vol. 78. N 14. P. 4786. doi 10.1021/ac060084f
S0869803120020071.
23.
Coxon T.P., Fallows T.W., Gough J.E., Webb S.J. //
35.
Costioli M.D., Berdat D., Freitag R., André X.,
Org. Biomol. Chem. 2015. Vol. 13. N 43. P. 10751. doi
Müller A.H.E. // Macromolecules. 2005. Vol. 38. N 9.
10.1039/ c5ob01591j
P. 3630. doi 10.1021/ma0484882
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
268
ЕРШОВ и др.
Synthesis of the Gold Glyconanoparticles Based on 6-Deoxy-
and 2-(Acetylamino)aldoses 3-Mercaptopropionylhydrazones
A. Yu. Ershova *, A. A. Martynenkova, I. V. Lagodab, E. A. Yakunchikovab,
M. A. Kopanitsac, I. V. Chernykhc, A. V. Yakimanskya,d
a Institute of Macromolecular Compounds of the Russian Academy of Sciences,
Bol’shoy pr. V. O. 31, St. Petersburg, 199004 Russia
b State Research Testing Institute of Military Medicine, Ministry of Defense of the Russian Federation,
St. Petersburg, 195043 Russia
c Ryazan Medical University named after I.P. Pavlov, Ryazan, 390026 Russia
d St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: ershov305@mail.ru
Received October 31, 2020; revised October 31, 2020; accepted 12 November, 2020
Based on readily available L-fucose, L-rhamnose, N-acetyl-D-glucosamine 3-mercaptopropionylhydrazones
and N-acetyl-D-mannosamine, a method for synthesis gold glyconanoparticles with an average particle size of
18-21 nm and a low polydispersity index was developed. It has been shown that some gold glyconanoparticles
exhibit antitumor activity, and the initial thiolated glycoligands have high radioprotective activity, increasing
the survival rate of mortally irradiated mice by 50-70%.
Keywords: thiol-containing monoses, ring-chain-ring tautomerism, gold glyconanoparticles, antitumor and
radioprotective activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021