ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 2, с. 274-282
УДК 547.1’13
СИНТЕЗ, СТРОЕНИЕ МЕТАКРИЛАТА И КРОТОНАТА
ТЕТРАФЕНИЛСУРЬМЫ, ИСПОЛЬЗОВАНИЕ ИХ
ДЛЯ ПОЛУЧЕНИЯ СУРЬМАСОДЕРЖАЩЕГО
ПОЛИСТИРОЛА
© 2021 г. А. В. Гущин*, А. И. Малеева, Е. В. Кипелкин, А. С. Туманян,
П. В. Андреев, Т. И. Овсецина, Н. В. Сомов
Нижегородский государственный университет имени Н. И. Лобачевского,
пр. Гагарина 23, Нижний Новгород, 603950 Россия
*e-mail: gushchin4@yandex.ru
Поступило в Редакцию 7 октября 2020 г.
После доработки 7 октября 2020 г.
Принято к печати 20 октября 2020 г.
Метакрилат тетрафенилсурьмы и кротонат тетрафенилсурьмы получены действием кислот на Ph5Sb либо
на Ph4SbBr в присутствии Et2NH. По данным рентгеноструктурного анализа, оба соединения представ-
ляют собой искаженные тетрагонально-пирамидальные комплексы сурьмы. Полимеризацией стирола с
добавками Ph4SbO2CC(CH3)=CH2 и Ph4SbO2CCH=CHCH3 синтезирован прозрачный сурьмасодержащий
полистирол, растворимый в хлороформе, дихлорметане, ТГФ.
Ключевые слова: метакрилат тетрафенилсурьмы, кротонат тетрафенилсурьмы, сурьмасодержащий
полистирол
DOI: 10.31857/S0044460X21020116
В настоящее время химия элементоорганиче-
Известно, что диакрилат трифенилсурьмы и
ских соединений V группы является актуальной
диакрилат трифенилвисмута могут быть введены
и быстро развивающейся областью химии. Кар-
в полиметилметакрилат методом полимеризаци-
боксилаты органосурьмы(V) находят широкое
онного наполнения, однако в результате получает-
ся сшитый нерастворимый в органических раство-
применение в качестве лекарственных препаратов
рителях полимер за счет участия в полимеризации
[1-13], в том числе против лейшманиоза [14, 15].
двух акрилатных групп [24]. Для нерастворимого
Отдельный интерес представляет совместная
полимера затруднительно определять характери-
полимеризация различных металлоорганических
стики полимера. Если же использовать моноакри-
соединений сурьмы (акрилатов, метакрилатов, ви-
лат тетрафенилсурьмы, то получающийся полиме-
нилбензоатов) с традиционными органическими
тилметакрилат растворяется в хлороформе [25].
мономерами (стирол, метилметакрилат), позволя-
В связи с этим в данной работе было предложено
ющая придавать полимерам требуемые свойства.
использовать неизвестные ранее производные те-
Некоторые известные сополимеры различных не-
трафенилсурьмы, включающие один остаток не-
насыщенных соединений сурьмы с органическими
предельной кислоты (метакрилат, кротонат) для
мономерами уже использованы для синтеза сурь-
получения несшитого растворимого сурьмасодер-
масодержащих органических полимеров [16-20]
жащего полистирола.
(в том числе органических стекол), проявляющих
Известно несколько методов синтеза карбок-
фунгицидную и биоцидную активность [21-23].
силатов тетрафенилсурьмы. Пентафенилсурьма
274
СИНТЕЗ, СТРОЕНИЕ МЕТАКРИЛАТА И КРОТОНАТА ТЕТРАФЕНИЛСУРЬМЫ
275
может быть дефенилирована карбоновыми кисло-
Ph4SbBr + HX + RONa → Ph4SbX + NaBr + ROH, (5)
тами с образованием Ph4SbO2CR и бензола. Реак-
R
= Me, Et. HX
=
3-F-4-MeC6H3CO2H,
4-F-2-
цию проводят без растворителя либо в толуоле при
MeC6H3CO2H,
5-F-2-MeC6H3CO2H
[49],
3-Br-6-
комнатной температуре (1).
HOC6H3CO2H,
2,4,6-Cl3C6H2CO2H,
SC4H3CO2H,
Ar5Sb + HX → Ar4SbX + PhH,
(1)
NC9H6CO2H [50], 4-HO2CC6H4CO2H [51].
Ar
= Ph, HX
= AcOH
[26], CH2=CHCO2H
[25],
Ar4SbBr + HX + Et3N → Ar4SbX + Et3NHBr,
(6)
PhOCH2CO2H
[27], PhC≡CCO2H
[28], CF2BrCO2H,
Ar = Ph, 2-MeC6H4, 3-MeC6H4, 4-MeC6H4, 4-FC6H4,
CF3CF2CF2CO2H [29, 30], PhC(O)NHCH2CO2H [31],
HX = FeC10H9CH=CHCO2H [52].
HO2CCH2CO2H
[32,
33],
HO2CCH2CH2CO2H,
В настоящей работе для синтеза метакрилата те-
HO2CCH2(OH)CH2(OH)CO2H, [33], тетрахлорфталевая
трафенилсурьмы 1 и кротоната тетрафенилсурьмы
[34];Ar = p-MeC6H4, HX = CF3CF2CO2H, CF3CF2CF2CO2H
2 нами использованы два альтернативных метода.
[29], PhC≡CCO2H, 2-NO2C6H4CO2H [35].
Первый включал действие карбоновой кислоты на
Данный метод в ряде случаев имеет ограниче-
пентафенилсурьму в толуоле при комнатной тем-
ние, связанное с образованием комплексов c участи-
пературе (7). Второй путь - реакция Ph4SbBr с кис-
ем дополнительной молекулы уксусной, муравьи-
лотой в присутствии диэтиламина при комнатной
ной, бензойной кислот. Среди них Ph4SbOAc·AcOH
температуре в бензоле (8).
[35,
31], Me4SbOAc·AcOH, Me4SbOAc·PhCO2H,
Ph5Sb + RCOOH → Ph4SbO2CR + PhH,
(7)
Me4SbO2CH·HCO2H, Me4SbO2CPh·PhCO2H [31].
R = CH2=C(CH3)C (87%), CH3CH=CH (88%);
Большое распространение получил способ син-
Ph4SbBr + RCOOH + Et2NH
теза карбоксилатов тетрафенилсурьмы по реакции
→ Ph4SbO2CR + Et2NH2Br↓,
(8)
перераспределения заместителей между пентафе-
R = CH2=C(CH3)C (89%), CH3CH=CH (93%).
нилсурьмой и дикарбоксилатом трифенилсурьмы
Для подтверждения состава и строения полу-
в толуоле при 90-100°С (2).
ченные карбоксилаты тетрафенилсурьмы были ис-
Ar5Sb + Ar3SbX2 → 2Ar4SbX,
(2)
следованы с помощью физико-химических методов
Ar = Ph, HX = CF3CH2CO2H [36], PhCH2CO2H [37],
анализа (ИК, ЯМР 1Н и 13С спектроскопии), а также
PhCO2H [38], PhC≡CCO2H [28], 4-HOC6H4CO2H
методом РСА.
[39], C10H15CO2H [40, 41, 42], OC4H3-CO2H [43],
ИК спектры cоединений 1, 2 содержат поло-
C6F5CO2H, 3,4,5-F3C6H2CO2H [44]; Ar = 4-MeC6H4,
сы поглощения средней интенсивности в области
HX = C6F5CO2H, 3,4,5-F3C6H2CO2H [44], AcOH
452-453 см-1, соответствующие валентным ко-
[45]; Ar = 4-СlC6H4, HX = AcOH [45].
лебаниям связи Sb-Ph, а также полосы при 693-
Гидроксид тетрафенилсурьмы вступает в реак-
696 см-1 относящиеся к валентным колебаниям
цию нейтрализации (3) карбоновыми кислотами
связи Sb-O. Полосы высокой интенсивности в
с образованием соли тетрафенилстибония и воды
области 1575-1585 и 1354-1360 см-1 отнесены к
(вода, 60°С).
антисимметричным и симметричным валентным
Ph4SbOH + HX → Ph4SbX + H2O,
(3)
колебаниям COO-группы соответственно. Сигна-
лы при 3061-3064 см-1 соответствуют валентным
HX = AcOH, EtCO2H [46].
колебаниям C-H связей фенильных групп.
В качестве исходного вещества для получения
В спектрах ЯМР 1H cоединений 1, 2 в области
карбоксилатов тетраарилсурьмы может использо-
слабого поля наблюдаются сигналы орто-прото-
ваться Ar4SbBr: под действием серебряных солей
нов (7.65 м. д.), а также мета- и пара-протонов
карбоновых кислот (4) либо свободных кислот в
(7.46-7.35 м. д.) фенильных групп. В области
присутствии алкоголятов натрия (5) или триэтила-
среднего поля находятся синглеты протонов тер-
мина (6) образуются соответствующие карбокси-
минальных СН2-групп у двойных связей мета-
латы тетраарилсурьмы.
крилатного лиганда (5.72, 5.15 м. д.) и протонов
Ph4SbBr + AgX → Ph4SbX + AgBr↓,
(4)
СН-групп при двойной связи кротонатного фраг-
HX = H2C2O4 [47], 2-HOC6H4CO2H, ArCH(OH)CO2H,
мента (6.55, 5.64 м. д.). В области сильного поля
ArCPh(OH)CO2H [48].
обнаружены сигналы протонов метильной группы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
276
ГУЩИН и др.
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структур кристаллов соединений
1 и 2
Параметр
1
2
Формула
C28H25O2Sb
C28H25O2Sb
Сингония
Ромбическая
Моноклинная
Пространственная группа
P212121
P21
Z
4
2
a, Å
8.6185(2)
8.2692(1)
b, Å
15.7766(3)
17.6661(3)
c, Å
17.3289(4)
8.3540(1)
β, град
90
104.312(2)
V, Å3
2356.21(9)
1182.51(3)
d, г/см3
1.452
1.447
λ, Å
MoKα, 0.71073
μ, мм-1
1.192
1.188
T, K
293(2)
293(2)
Размер кристалла, мм
0.263×0.156×0.138
0.313×0.212×0.122
Учет поглощения,
Multi-scan [10],
Multi-scan [10],
Tmin, Tmax
0.728, 1.000
0.877, 0.949
θmin, θmax, град
3.33, 26.37
3.14, 33.08
Пределы h, k, l
-10 ≤ h ≤ 10, -19 ≤ k ≤ 19, -21 ≤ l ≤ 21
-11 ≤ h ≤ 12, -26 ≤ k ≤ 25, -12 ≤ l ≤ 12
Число отражений: измеренных/
независимых (N1), RInt с I > 2σ(I)
33225/4813, 0.0358/4436
23467/8032, 0.0181/7674
(N2)
Число уточняемых параметров
281
281
R1/wR2 по N1
0.0256/0.0507
0.0202/0.0429
R1/wR2 по N2
0.0220/0.0494
0.0184/0.0423
S
1.072
1.059
Δρmax/Δρmin, Å-3
0.318/-0.246
0.264/-0.362
Программы
SHELX97 [53], WinGX [54], CrysAlis Pro [55], Mercury [56]
(1.71 м. д.) в виде синглета в случае метакрилата
результаты уточнения структур приведены в табл. 1,
1 и дублета в случае кротоната 2. Указанные зна-
геометрические характеристики координационно-
чения сигналов протонов близки к известным дан-
го полиэдра атома сурьмы - в табл. 2. Первичные
ным для акрилата тетрафенилсурьмы [25].
фрагменты атомных структур были найдены пря-
В спектрах ЯМР 13С cоединений 1, 2 присут-
мыми методами, положения неводородных атомов
ствуют сигналы атомов углерода в орто- (135.19,
определены из разностных синтезов электронной
135.14 м. д.), пара- (130.08, 130.02 м. д.) и мета-по-
плотности и уточнены в анизотропном прибли-
ложениях (128.82, 128.81 м. д.), а также атомов
жении методом наименьших квадратов по |F|2 в
углерода, непосредственно связанных с атомом
программных комплексах SHELX97 и WinGX
сурьмы (139.04, 138.59 м. д.). В карбоксилатных
[53, 54]. Положения атомов водорода определены
фрагментах наблюдаются сигналы метильных ато-
геометрически и уточнены по модели наездника.
мов углерода (19.16, 17.50 м. д.), атомов углерода
Длины химических связей C-H и фиксированные
карбоксильной группы (171.34, 170.86 м. д.), двой-
ной С=С связи кротонатного (127.82, 139.22 м. д.)
изотропные тепловые параметры задавали равны-
и метакрилатного (120.50, 141.52 м. д.) лигандов.
ми 0.96 Å и Uизо(H) = 1.5 Uэкв(C) для водородов ме-
Бесцветные прозрачные монокристаллы cоеди-
тильных фрагментов, 0.93 Å и Uизо(H) = 1.2 Uэкв(C)
нений 1, 2 были использованы для рентгенострук-
для остальных атомов водорода. Результаты рент-
турного анализа. Кристаллографические данные и
геноструктурных исследований депонированы в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ, СТРОЕНИЕ МЕТАКРИЛАТА И КРОТОНАТА ТЕТРАФЕНИЛСУРЬМЫ
277
Кембриджском банке структурных данных [CCDC
Таблица 2. Длины связей и валентные углы координа-
1133567 (1), 1849933 (2)].
ционного окружения атома сурьмы в кристаллах соеди-
нений 1 и 2
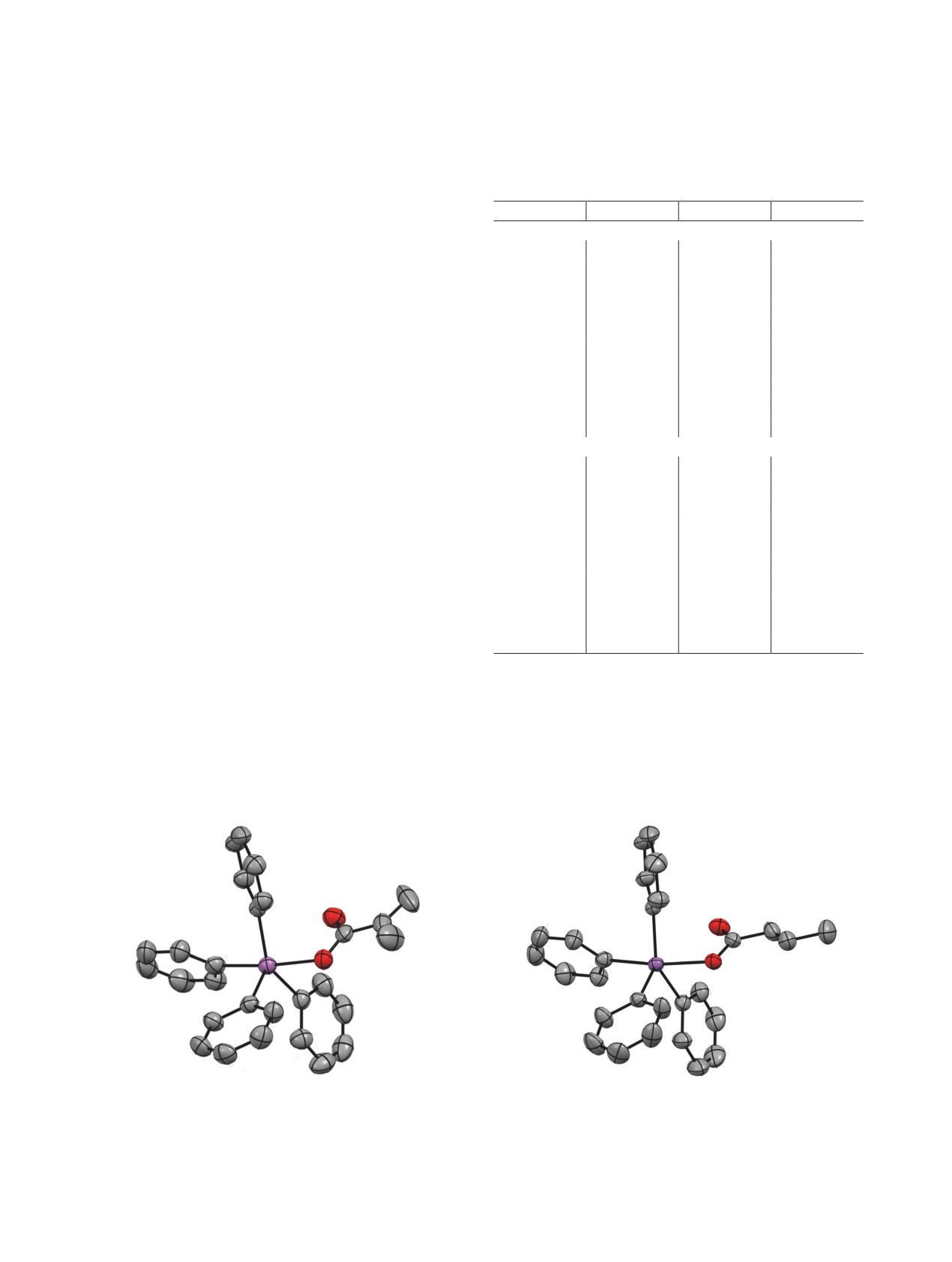
Атом сурьмы в cоединениях 1, 2 имеет сильно
Связь
d, Å
Угол
ω, град
искаженную тетрагонально-пирамидальную кон-
1
фигурацию с тремя атомами углерода фенильных
Sb1-O1
2.218(2)
O1Sb1C1
83.22(11)
групп и атомом кислорода метакрилатного или
Sb1-O2
2.876(3)
O1-Sb1-C7
87.71(11)
кротонатного лиганда в основании и четвертым
Sb1-C1
2.139(3)
O1-Sb1-C13
172.32(11)
атомом углерода фенильного кольца в вершине
Sb1-C7
2.127(3)
O1-Sb1-C19
83.27(11)
пирамиды (рис. 1, 2).
Sb1-C13
2.182(3)
C1-Sb1-C7
105.98(12)
Степень подобия координационного полиэдра
Sb1-C19
2.131(3)
C1-Sb1-C13
95.12(13)
сурьмы в структурах cоединений 1, 2 правильной
C1-Sb1-C19
144.53(13)
тетрагональной пирамиде составляет Ф1 0.38 и Ф2
C7-Sb1-C13
99.95(13)
0.36, в то время как степень подобия тригональной
C7-Sb1-C19
106.07(12)
C13-Sb1-C19
93.95(13)
бипирамиде соответственно составляет Ф1 0.31 и
2
Ф2 0.29 [57]. Степень подобия координационного
Sb1-O1
2.249(2)
O1-Sb1-C1
83.40(8)
полиэдра сурьмы в структурах cоединений 1, 2
Sb1…O2
2.762(3)
O1-Sb1-C7
88.87(8)
друг другу составляет Ф1,2 0.83. Эти результаты
Sb1-C1
2.141(3)
O1-Sb1-C13
170.92(8)
согласуются с расчетами степени тригональности
Sb1-C7
2.116(2)
O1-Sb1-C19
82.43(8)
координационного полиэдра сурьмы в структурах
Sb1-C13
2.169(2)
C1-Sb1-C7
102.44(10)
cоединений 1, 2 по методу [58], их значения рав-
Sb1-C19
2.132(2)
C1-Sb1-C13
96.37(12)
ны τ 0.41 и 0.46 соответственно. Таким образом,
C1-Sb1-C19
145.87(11)
координационный полиэдр сурьмы в каждой из
C7-Sb1-C13
100.02(9)
структур cоединений 1, 2 является искаженной те-
C7-Sb1-C19
108.15(8)
трагональной пирамидой с вершиной в атомах C7.
C13-Sb1-C19
92.94(8)
В исследуемых соединениях обнаружены вну-
тримолекулярные контакты между атомами сурь-
мы и атомами кислорода С=О групп. Расстояния
атомов (3.60 Å) [59]. Отметим, что соотношение
Sb1···O2 составляли 2.876(3) и 2.763(3) Å соответ-
расстояний Sb1···O2 и Sb1-O1 у метакрилатного
ственно для cоединений 1, 2, и это существенно
производного составляет 1.30 и несколько превы-
меньше суммы ван-дер-ваальсовых радиусов этих
шает аналогичную величину у кротоната (1.23).
C22
C22
21
C21
C23
C
23
C
27
C
C20
O2
C20
C24
C24
C26
O2
26
C28
C15
C14
C
C19
C19
C15
C14
C13
C25
C13
Sb1
25
Sb1
C
C28
C27
O1
6
C16
C18
O1
C1
C
C16
C1
C6
C7
C7
C18
C17
C17
12
C
C5
C5
C12
C8
C8
9
C4
9
C4
C
C2
C
C2
C11
C11
20
C
C3
C10
C3
Рис. 1. Общий вид молекулы метакрилата тетрафенил-
Рис. 2. Общий вид молекулы кротоната тетрафенилсу-
сурьмы 1 в кристалле.
рьмы 2 в кристалле.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
278
ГУЩИН и др.
Таблица
3. Молекулярно-массовые характеристики
Таблица
4. Молекулярно-массовые характеристики
продукта полимеризации стирола с добавками метакри-
продукта полимеризации стирола с добавками кротона-
лата тетрафенилсурьмыа
та тетрафенилсурьмыа
Ph4SbO2CC(CH3)=CH2, %
Мn×10-4
Мw×10-4
Mw/Mn
Ph4SbO2CCH=CHCH3, %
Мn×10-4
Мw×10-4
Mw/Mn
0б
8.33
24.31
2.92
0б
10.58
29.65
2.80
0в
8.79
24.40
2.78
0в
10.78
29.36
2.72
1б
8.26
25.72
3.11
1б
9.87
28.29
2.87
1в
9.65
25.70
2.66
1в
10.87
28.23
2.60
3б
8.39
25.75
3.07
3б
13.90
42.26
3.04
3в
9.80
25.78
2.63
3в
13.90
42.14
3.03
5б
8.44
25.83
3.06
5б
14.45
48.42
3.35
5в
9.89
25.84
2.61
5в
15.24
47.42
3.11
а 80°С, 0.3% дибензоилпероксида.
а 80°С, 0.3% дибензоилпероксида.
б УФ детектор.
б УФ детектор.
в Рефрактометрический детектор.
в Рефрактометрический детектор.
Молекулы в кристаллах cоединений 1, 2 свя-
cоединения 1 (1-5%) мало влияют на молекуляр-
заны между собой слабыми ван-дер-ваальсовыми
но-массовые характеристики полученного сурьма-
взаимодействиями и образуют трехмерный каркас.
содержащего полистирола. С обоими детекторами
Интересно, что расстояния между С=С связями
среднечисленные молекулярные массы состав-
ляли 82600-98900 Да, средневесовые - 244000-
соседних молекул для cоединений 1, 2 превыша-
258400 Да. Значения коэффициента полидисперс-
ют 8 Å, и в этом данные соединения существен-
ности находились в пределах от 2.63 до 3.11, что
но отличаются от изученных ранее дикротоната,
указывало на свободно-радикальный характер
диакрилата и диметакрилата трифенилсурьмы, у
процесса.
которых молекулы складываются в упаковку та-
Из табл. 4 видно, что добавки cоединения 2 (1-
ким образом, что кратные связи находятся непо-
5%) оказывают влияние на молекулярно-массовые
средственно друг под другом, и расстояния между
характеристики полученного сурьмасодержащего
параллельно расположенными С=С связями со-
полистирола. Значения среднечисленных молеку-
ставляют 3.67 [60], 3.642 [25, 61] и 3.67 Å [62, 63]
лярных масс повышаются с 98700 до 152400 Да, а
соответственно.
средневесовых - от 282300 до 484200 Да. Коэффи-
В соответствии с поставленной целью синте-
циент полидисперсности возрастает с 2.60 до 3.35.
зированные новые cоединения 1, 2 были исполь-
Таким образом, осуществлен синтез неизвест-
зованы для получения сурьмасодержащего поли-
ных ранее метакрилата и кротоната тетрафенил-
стирола. Блочную термическую полимеризацию
сурьмы, строение и состав которых подтверждены
осуществляли в дегазированных ампулах в при-
данными ИК, ЯМР спектроскопии и элементного
сутствии дибензоилпероксида в качестве иници-
анализа. Методом РСА установлено, что оба сое-
атора при 80°C при массовой доле металлоорга-
динения представляют собой искаженные тетраго-
нического соединения 1-5%. Как и ожидалось,
нально-пирамидальные комплексы сурьмы с тре-
полученные прозрачные образцы сурьмасодержа-
мя фенильными группами и одним карбоксильным
лигандом в основании и одной фенильной группой
щего полистирола оказались хорошо растворимы
в вершине пирамиды. Полимеризацией стирола в
в хлороформе, дихлорметане, ТГФ, что может сви-
присутствии
1-5% указанных сурьмаорганиче-
детельствовать об отсутствии сшивки макромоле-
ских соединений получены образцы прозрачного
кул полимера молекулами металлоорганического
растворимого в хлороформе, дихлорметане, ТГФ
соединения.
сурьмасодержащего полистирола.
Анализ молекулярно-массовых характеристик
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
полимеров проводили методом ГПХ с использо-
ванием ультрафиолетового и рефрактометриче-
ИК спектры записывали на приборе IR
ского детекторов. Как видно из табл. 3, добавки
Prestige-21 (Shimadzu, Япония) в таблетках KBr в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ, СТРОЕНИЕ МЕТАКРИЛАТА И КРОТОНАТА ТЕТРАФЕНИЛСУРЬМЫ
279
диапазоне 4000-400 см-1. Спектры ЯМР снимали в
Растворимость продукта в стироле и петролейном
дейтерохлороформе на спектрометре Agilent DD2
эфире такая же, как указана для метакрилата.
400. Для расшифровки и моделирования спек-
Синтез полистирола, содержащего 5% ме-
тров использовали программу MestReNowa 9.0.2
такрилата тетрафенилсурьмы. В стеклянную
(демонстрационная версия). Элементный ана-
ампулу помещали 0.048 г метакрилата тетрафе-
лиз проводили методом экспресс-гравиметрии на
нилсурьмы, 0.0027 г дибензоилпероксида, 0.906 г
установке пиролитического сожжения вещества в
(1 мл) стирола. Полученный раствор дегазировали.
кварцевой пробирке в токе кислорода. Рентгено-
Ампулу запаивали, нагревали при 80°C в течение
структурный анализ выполнен на дифрактометре
30 ч в термостате. Дополимеризацию осуществля-
Xcalibur, Sapphire3, GeminiS. Кристаллы размером
ли при 100°С в течение 2 ч. Аналогично получали
0.5-1 мм были выращены из смеси бензола и пе-
полистирол, содержащий 0, 1, 3% метакрилата те-
тролейного эфира методом замены растворителя.
трафенилсурьмы.
Синтез метакрилата тетрафенилсурьмы 1.
Синтез полистирола, содержащего 5% кро-
а. Из пентафенилсурьмы. В круглодонную кол-
тоната тетрафенилсурьмы. В стеклянную ам-
бу последовательно помещали 5 г (10 ммоль)
пулу помещали 0.048 г кротоната тетрафенил-
пентафенилсурьмы [64], 17 мл толуола и 0.84 мл
сурьмы, 0.0022 г дибензоилпероксида, 0.906 г
(10 ммоль) метакриловой кислоты. Колбу запол-
(1 мл) стирола. Полученный раствор дегазировали.
няли аргоном и закрывали от воздействия света.
Ампулу запаивали, нагревали при 80°C в течение
Смесь оставляли при комнатной температуре на
30 ч в термостате. Дополимеризацию осуществля-
неделю. После этого жидкую часть отконденсиро-
ли при 100°С в течение 2 ч. Аналогично получали
вали в ловушку. Выход 4.5г (87%), белые кристал-
полистирол, содержащий 0, 1, 3% кротоната тетра-
лы, т. пл. 139°С [после очистки переосаждением
фенилсурьмы.
петролейным эфиром (40-70°С) из хлороформа].
Анализ молекулярно-массового распределения
б. Из бромида тетрафенилсурьмы. К раствору
полистирола проводили методом ГПХ в ТГФ при
0.51 г (1 ммоль) Ph4SbBr [64] в 20 мл бензола до-
40°С на жидкостном хроматографе Shimadzu с ко-
бавляли 0.086 г (1 ммоль) метакриловой кислоты,
лонками, наполненными сополимером полисти-
затем в токе аргона при перемешивании в тече-
рол-дивинилбензол с размером пор 1.105-1.104 Å.
ние 10 мин по каплям приливали раствор 0.073 г
В качестве измерителей были использованы реф-
рактометрический и УФ детекторы. Хроматограм-
(1 ммоль) диэтиламина в 2 мл бензола. При этом
мы были обработаны с помощью программного
наблюдалось помутнение раствора. Через 1 ч
обеспечения LCsolution. Для калибровки приме-
капельную воронку убирали, колбу закрывали
нялся узкодисперсный стандарт полистирола.
шлифовой пробкой и смесь перемешивали 56 ч
при комнатной температуре, затем фильтровали.
БЛАГОДАРНОСТЬ
Белый осадок Et2NH2Br промывали бензолом и
Авторы выражают благодарность Е.С. Щегра-
сушили. Выход составил 92% по результатам ар-
виной (Нижегородский государственный универ-
гентометрического титрования по Фольгарду. Це-
ситет им. Н.И. Лобачевского) за снятие спектров
левой метакрилат тетрафенилсурьмы получали ис-
ЯМР и И.П. Курбатовой (Нижегородский государ-
парением бензольного раствора. Выход 89%, т. пл.
ственный педагогический университет им. К. Ми-
139°С [после очистки переосаждением петролей-
нина) за проведение элементного анализа.
ным эфиром (40-70°С) из хлороформа]. Продукт
растворяется в хлороформе (1 г на 1 мл), стироле
ФИНАНСОВАЯ ПОДДЕРЖКА
(0.2 г на 1 мл), не растворяется в петролейном эфи-
Работа выполнена при поддержке Министер-
ре (менее 0.01 г на 1 мл). Найдено, %: C 65.37; H
ства образования и науки РФ (проект 0729-2020-
4.99. С28Н25O2Sb. Вычислено, %: C 65.24; H 4.85.
0039) в рамках базовой части госзадания.
Синтез кротоната тетрафенилсурьмы 2 про-
КОНФЛИКТ ИНТЕРЕСОВ
водили аналогично. Выход 88% (метод а), 93%
(метод б), т. пл. 127°С. Найдено, %: C 64.98; H
Авторы заявляют об отсутствии конфликта
4.96. С28Н25O2Sb. Вычислено, %: C 65.24; H 4.85.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
280
ГУЩИН и др.
СПИСОК ЛИТЕРАТУРЫ
Freedman D.A., Brainard R.L. // Adv. Pattern. Mater.
Proc. XXXII. 2015. Vol. 9425. P. 94250T1. doi
1.
Mishra J., Saxena A., Singh S. // Curr. Med.
10.1117/12.2086599
Chem.
2007. Vol.
14. N
10. P.
1153. doi
21.
Leebrick J.R., Remes N.L. Pat. US 3558783A (1971) //
10.2174/092986707780362862
C. A. 1971. Vol. 74. P. 98851
2.
Islam A., Da Silva J.G., Berbet F.M., Da Silva S.M.,
22.
Leebrick J.R., Remes N.L. Pat. US 3367954A (1968) //
Rodrigues B.L., Beraldo H., Melo M.N., Frezard F.,
C. A. 1968. Vol. 68. P. 105367
Demicheli C. // Molecules. 2014. Vol. 19. N 5. P. 6009.
23.
Карраер Ч., Моран М. Металлоорганические поли-
doi 10.3390/molecules19056009
меры. М.: Мир, 1981. 121 с.
3.
Ali M.I., Rauf M.K., Badshah A., Kumar I., For-
24.
Додонов В.А., Гущин А.В., Кузнецова Ю.Л., Моруго-
syth C.M., Junk P.C., Kedzierski L., Andrews P.C. //
ва В.А. // Вестн. Нижегор. унив. им. Н.И. Лобачев-
Dalton Trans. 2013. Vol. 42. N 48. P. 16733. doi
ского. Сер. хим. 2004. Вып. 1(4). С. 86.
10.1039/c3dt51382c
25.
Гущин А.В., Шашкин Д.В., Щербакова Т.С.,
4.
Gibbons N., Sowerby D.B. // J. Organomet. Chem. 1998.
Сомов Н.В., Фукин Г.К., Шавырин А.С., Рыкалин
Vol. 555. P. 271. doi 10.1016/S0022-328X(97)00759-6
В.И., Додонов В.А. // Вестн. Нижегор. унив. им. Н.И.
5.
Shen K.W., McEwen W.E., LaPlaca L.J., Hamilton W.C.,
Лобачевского. Сер. хим. 2010. Вып. 6. С. 68.
Wolf A.P. // J. Am. Chem. Soc. 1968. Vol. 90. P. 1718.
26.
Bone S.P., Sowerby. D.B. // Phosphorus, Sulfur,
doi 10.1021/ja01009a009
Silicon, Relat. Elem. 1989. Vol. 45. N 1-2. P. 23. doi
6.
Goddard A.E. // J. Chem. Soc. 1923. Vol. 123. P. 2315.
10.1080/10426508908046072
doi 10.1039/CT9232302315
27.
Шарутин В.В., Пакусина А.П., Задачина О.П., Шару-
7.
Doak G.O., Long G.G., Freedman L.D. // J. Organomet.
тина О.К., Герасименко А.В., Пушилин М.А. // Коорд.
Chem. 1965. Vol. 4. P. 82. doi 10.1016/S0022-
хим. 2004. Т. 30. № 6. С. 426; Sharutin V.V., Pakusi-
328X(00)82370-0
na A.P., Zadachina O.P., Sharutina O.K., Gerasi-
8.
Liu R.-C., Ma Y.-Q., Yu L., Li J.-S., Cui J.-R.,
menko A.V., Pushilin M. A. // Russ. J. Coord. Chem.
Wang R.-Q. // Appl. Organomet. Chem. 2003. Vol. 17.
2004. Vol.
30. N
6. P.
397. doi
10.1023/
P. 662. doi 10.1002/aoc.491
B:RUCO.0000030159.74150.a1
9.
Wang G.C., Xiao J., Yu L., Li J.-S., Cui J.-R.,
28.
Шарутин В.В., Шарутина О.К., Котляров А.Р. //
Wang R.-Q., Ran F.X. // J. Organomet. Chem. 2004. Vol.
ЖНХ. 2015. Т. 60. № 4. С. 525; Sharutin V.V., Sharuti-
689. P. 1631. doi 10.1016/j.jorganchem.2004.02.015
10.
Yu L., Ma Y.-Q., Liu R.-C., Wang G.-C., Li J.-S.,
na O.K., Kotlyarov A.R. // Russ. J. Inorg. Chem. 2015.
Vol. 60. N 4. P. 465. doi 10.1134/S0036023615040221
Du G.-H., Hu J.-J. // Polyhedron. 2004. Vol. 23 P. 823.
29.
Шарутин В.В., Шарутина О.К., Ефремов А.Н.,
doi 10.1016/j.poly.2003.12.002
11.
Yu L., Ma Y.-Q., Wang G.-C., Li J.-S. // Heteroatom
Артемьева Е.В. // ЖНХ. 2020. Т. 65. № 4. С. 482;
Chem. 2004. Vol. 15. P. 32. doi 10.1002/hc.10208
Sharutin V.V., Sharutina O.K., Efremov A.N., Artem’e-
va E.V. // Russ. J. Inorg. Chem. 2020. Vol. 65. N 4.
12.
Leebrick J.R. Pat. US 3287210 (1966) // C. A. 1967.
Vol. 66. P. 85070
P. 502. doi 10.1134/S0036023620040178
13.
Singhal K., Mishra R., Raj P. // Heteroatom Chem.
30.
Шарутин В.В., Поддельский А.И., Шарути-
2008. Vol. 19. N 7. doi 10.1002/hc.20498
на О.К. // Коорд. хим. 2020. Т. 46. № 10. С. 579;
14.
Mishra J., Saxena A., Singh S. // Curr. Med. Chem. 2007.
Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ.
Vol. 14. P. 1153. doi 10.2174/092986707780362862
J. Coord. Chem. 2020. Vol. 46. N 10. P. 663. doi
15.
Islam A., DaSilva J.G., Berbet F.M., DaSilva S.M.,
10.31857/S0132344X20100011
Rodrigues B.L., Beraldo H., Melo M.N. // Molecules.
31.
Шарутин В.В., Шарутина О.К., Хныкина В.В. //
2014. Vol. 19. P. 6009. doi 10.3390/molecules19056009
ЖНХ. 2016. Т. 61. № 2. С. 192; Sharutin V.V., Sharuti-
16.
Naka K., Nakahashi A., Chujo Y. // Macromolecules.
na O.K., Khnykina K.A. // Russ. J. Inorg. Chem. 2016.
2007. Vol. 40. N 5. P. 1372. doi 10.1021/ma0622332
Vol. 61. N 2. P. 180. doi 10.1134/S0036023616020194
17.
Naka K., Nakahashi A., Chujo Y. // Macromolecules.
32.
Шарутин В.В., Сенчурин В.С., Шарутина О.К. //
2006. Vol. 39. N 24. P. 8257. doi 10.1021/ma061220l
ЖНХ. 2014. Т. 59. № 2. С. 115; Sharutin V.V., Senchu-
18.
Котон М.М. Металлоорганические соединения и
rin V.S., Sharutina O.K. // Russ. J. Inorg. Chem. 2014.
радикалы. М.: Наука, 1985. C. 13
Vol. 59. N 2. P. 115. doi 10.1134/S003602361402017X
19.
Yamago S. // Chem. Rev. 2009. Vol. 109. N 11. P. 5051.
33.
Шарутин В.В., Шарутина О.К. // Коорд. хим. 2014.
doi 10.1021/cr9001269
Т. 40. № 9. С. 559; Sharutin V.V., Sharutina O.K. //
20.
Passarelli J., Murphy M., Del Re R., Sortland M.,
Russ. J. Coord. Chem. 2014. Vol. 40. N 9. P. 643. doi
Dousharm L., Vockenhuber M., Ekinci Y., Neisser M.,
10.1134/S1070328414090073
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
СИНТЕЗ, СТРОЕНИЕ МЕТАКРИЛАТА И КРОТОНАТА ТЕТРАФЕНИЛСУРЬМЫ
281
34.
Шарутин В.В., Шарутина О.К. // ЖНХ. 2015. Т. 60.
2002. Т. 72. Вып. 3. С. 419; Sharutin V.V., Sharuti-
№ 3. С. 340; Sharutin V.V., Sharutina O.K. // Russ. J.
na O.K., Bondar’ E.V., Pakusina A.P., Adonin N.Yu.,
Inorg. Chem. 2015. Vol. 60. N 3. Р. 292. doi 10.1134/
Starichenko V.F. // Russ. J. Gen. Chem. 2002. Vol. 72.
S0036023615030171
N 3. P. 390. doi 10.1016/j.jfluchem.2020.109517
35.
Шарутин В.В., Шарутина О.К. // ЖНХ. 2017. Т. 62.
45.
Qin W., Kakusawa N., Wu Y., Yasuike S., Kurita J. //
№ 7. С. 925; Sharutin V.V. and Sharutina O.K. // Russ.
Chem. Pharm. Bull. 2009. Vol. 57. N 4. P. 436. doi
J. Inorg. Chem. 2017. Vol. 62. N 7. Р. 905. doi 10.1134/
10.1248/cpb.57.436
S003602361707021X
46.
Гущин А.В., Грунова Е.В., Моисеев Д.В., Моро-
36.
Шарутин В.В., Шарутина О.К., Ефремов А.Н., Ар-
зов О.С., Шавырин А.С., Додонов В.А. // Изв. АН.
темьева Е.В. // ЖНХ. 2019. Т. 64. № 10. С. 1051;
Сер. хим. 2003. № 6. С. 1302; Gushchin A.V., Gruno-
Sharutin V.V., Sharutina O.K., Efremov A.N., Artem’e-
va E.V., Moiseev D.V., Morozov O.S., Shavyrin A.S.,
va E.V. // Russ. J. Inorg. Chem. 2019. Vol. 64. N 10.
Dodonov V.A. // Russ. Chem. Bull. 2003. Vol. 52. N 6.
P. 1229. doi 10.1134/S0036023619100139
P. 1376. doi 10.1023/A:102488332886
37.
Шарутин В.В., Шарутина О.К., Сенчурин В.С. //
47.
Millington P.L., Sowerby D.B. // J. Chem. Soc. Dalton
ЖНХ. 2015. Т. 60. Вып. 9. С. 1200; Sharutin V.V.,
Trans. 1992. P. 1199. doi 10.1039/DT9920001199
Sharutina O.K., and Senchurin V.S. // Russ. J. Inorg.
48.
Singhal K., Mishra R., Raj P. // Heteroatom Chem.
Chem. 2015. Vol. 60. N 9. P. 1093.doi 10.1134/
2008. Vol. 19. N 7. P. 688. doi 10.1002/hc.20498
S0036023615060145
49.
Yin H.-D., Wen L.-Y., Cui J.-C., Li W.-K. // Polyhedron.
38.
Lyakaev D.V., Markin A.V., Smirnova N.N., Sharu-
2009. Vol. 28. P. 2919. doi 10.1016/j.poly.2009.06.065
tin V.V., Sharutina O.K. // J. Chem. Thermodyn. 2019.
50.
Quan L., Yin H., Cui J-C., Hong M., Wang D. //
Vol. 131. P. 322. doi 10.1016/j.jct.2018.11.011
J. Organomet. Chem. 2009. Vol. 694. P. 3708. doi
39.
Шарутин В.В., Шарутина О.К., Сенчурин В.С.
10.1016/j.jorganchem.2009.07.040
// ЖНХ. 2014. Т. 59. № 9. С. 1182; Sharutin V.V.,
51.
Quan L., Yin H., Cui J.-C., Cui L., Hong M., Wang D.,
Sharutina O.K., Senchurin S.V. // Russ. J. Inorg.
Yang M. // J. Organomet. Chem. 2009. Vol. 694. P. 3683.
Chem. 2014. Vol. 59. N 9. P. 951. doi 10.1134/
doi 10.1016/j.jorganchem.2009.07.041
S0036023614090174
52.
Li J.-S., Liu R.-C., Chi X.-B., Wang G.-C., Guo Q.-S. //
40.
Шарутин В.В., Сенчурин В.С.,Шарутина О.К.,
Inorg. Chim. Acta. 2004. Vol. 357. P. 2176. doi
Пакусина А.П., Смирнова С.А. // ЖОХ. 2009. Т. 79.
10.1016/j.ica.2003.12.012
Вып. 10. С. 1636; Sharutin V.V., Senchurin V.S.,
53.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Sharutina O.K., Pakusina A.P., Smirnova S.A. // Russ.
P. 112. doi 10.1107/S0108767307043930
J. Gen. Chem. 2009. Vol. 79. N 10. P. 2131. doi 10.1134/
54.
Farrugia L.J. // J. Appl. Cryst. 1999. Vol. 32. P. 837. doi
S1070363209100107
10.1107/S0021889899006020
41.
Лякаев Д.В., Маркин А.В., Хабарова Е.В., Смирно-
55.
CrysAlis CCD and CrysAlis RED. Rigaku Oxford
ва Н.Н., Князев А.В., Шарутин В.В., Шарути-
Diffraction. 2015
на О.К. // ЖФХ. 2018. Т. 92. № 9. С. 1384; Lyaka-
56.
Macrae C.F., Edgington P.R., McCabe P., Pidcock E.,
ev D.V., Markin A.V., Khabarova E.V., Smirnova N.N.,
Shields G.P., Taylor R., Towler M., van de Streek J. //
Knyazev A.V., Sharutin V.V., Sharutina O.K. // Russ.
J. Appl. Cryst. 2006. Vol. 39. P. 453. doi 10.1107/
J. Phys. Chem. (A). 2018. Vol. 92. N 9. P. 1659. doi
S002188980600731X
10.1134/S0036024418090170
57.
Сомов Н.В., Андреев П.В. // Кристаллография.
42.
Lyakaev D.V., Markin A.V., Smirnova N.N., Sharu-
2018. Т. 63. № 1. С. 38; Somov N.V., Andreev P.V. //
tin V.V., Sharutina O.K. // J. Therm. Anal. Calorim.
Crystallogr. Rep. 2018. Vol. 63. N 1. P. 32. doi 10.1134/
2017. Vol.133. N 2. P. 1143. doi 10.1007/s10973-017-
S1063774518010170
6803-5
58.
Addison A.W., Rao T.N., Reedijk J., van Rijn J.,
43.
Шарутин В.В., Пакусина А.П., Платонова Т.П.,
Verschoor G.C. // J. Chem. Soc. Dalton Trans. 1984.
Егорова И.В., Шарутина О.К., Герасименко А.В.,
N 7. P. 1349. doi 10.1039/DT9840001349
Сергиенко А.С. Герасименко Е.А. // Коорд. хим.
59.
Batsanov S.S. // Inorg. Mater.2001. Vol. 37. N 9. P. 871.
2002. Т. 28. № 11. С. 803; Sharutin V.V., Pakusina A.P.,
doi 10.1023/A:1011625728803
Platonova T.P., Egorova I.V., Sharutina O.K.,
60.
Гущин А.В., Калистратова О.С., Верховых Р.А.,
Gerasimenko A.V., Sergienko A.S., Gerasimenko E.A. //
Сомов Н.В., Шашкин Д.В., Додонов В.А. // Вестн.
Russ. J. Coord. Chem. 2002. Vol. 28. N 11. P. 753. doi
Нижегор. унив. им. Н.И. Лобачевского. Сер. хим.
10.1023/A:1021165112211
2013. Вып. 1(1). С. 86
44.
Шарутин В.В., Шарутина О.К., Бондарь Е.В., Паку-
61.
Fukin G.K., Samsonov M.A., Arapova A.V., Ma-
сина А.П., Адонин Н.Ю., Стариченко В.Ф. // ЖОХ.
zur A.S., Artamonova T.O., Khodorkovskiy M.A.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021
282
ГУЩИН и др.
Vasilyev A.V. // J. Solid State Chem. 2017. Vol. 254.
63. Фукин Г.К., Самсонов М.А., Баранов Е.В., Чер-
P. 32. doi 10.1016/j.jssc.2017.06.030
касов А.В., Румянцев Р.В., Арапова А.В. // Коорд.
хим. 2018. Т. 44. № 5. С. 325; Fukin G.K., Samso-
62. Гущин А.В., Шашкин Д.В., Прыткова Л.К., Со-
nov M.A., Baranov E.V. Cherkasov A.V., Rumyan-
мов Н.В., Баранов Е.В., Шавырин А.С., Рыкалин В.И. //
tsev R.V., Arapova A.V. // Russ. J. Coord. Chem. 2018.
ЖОХ. 2011. Т. 81. Вып. 3. С. 397; Gushchin A.V.,
Vol. 44. N 10. P. 626. doi 10.1134/S1070328418100020
Shashkin D.V., Prytkova L.K., Somov N.V., Baranov E.V.,
64. Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Ме-
Shavyrin A.S., Rykalin V.I. // Russ. J. Gen. Chem. 2011.
тоды элементоорганической химии. Сурьма, висмут.
Vol. 81. N 3. P. 493. doi 10.1134/S107036321103008X
М.: Наука, 1976. 483 с.
Synthesis and Structure of Tetraphenylantimony Methacrylate
and Crotonate, Their Use for the Production
of Antimony-Containing Polystyrene
A. V. Gushchin*, A. I. Maleeva, E. V. Kipelkin, A. S. Tumanyan,
P. V. Andreev, T. I. Ovsetsyna, and N. V. Somov
N.I. Lobachevsky State University of Nizhny Novgorod, Nizhny Novgorod ,603950 Russia
*e-mail: gushchin4@yandex.ru
Received October 7, 2020; revised October 7, 2020; accepted October 20, 2020
Tetraphenylantimony methacrylate and tetraphenylantimony crotonate were obtained by the action of acids on
Ph5Sb or on Ph4SbBr in the presence of Et2NH. According to the X-ray diffraction data, both compounds are
distorted tetragonal-pyramidal antimony complexes. Polymerization of styrene with Ph4SbO2CC(CH3)=CH2
and Ph4SbO2CCH=CHCH3 additives gave transparent antimony containing polystyrene, soluble in chloroform,
dichloromethane, THF.
Keywords: tetraphenylantimony methacrylate, tetraphenylantimony crotonate, antimony-containing polystyrene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 2 2021