ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 331-375
ОБЗОРНАЯ
СТАТЬЯ
УДК 547.551
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
© 2021 г. А. Р. Байгузина*, Р. И. Хуснутдинов
Институт нефтехимии и катализа Российской академии наук, пр. Октября 141, Уфа, 450075 Россия
*е-mail: Bayguzina2014@gmail.com
Поступило в Редакцию 9 декабря 2020 г.
После доработки 9 февраля 2021 г.
Принято к печати 15 февраля 2021 г.
В обзоре систематизированы и обобщены литературные данные о современных методах N-алкили-
рования анилинов с использованием металлокомплексных и гетерогенных катализаторов на основе
палладия, платины, родия, никеля, железа, меди, золота, нанесенных на носители, а также цеолитов,
оксидов титана, железа, меди и алюминия. Рассмотрены реакции N-алкилирования анилинов алкилга-
логенидами, спиртами, диметилкарбонатом, альдегидами, а также с помощью CO2/H2 и алкилирование
альтернативными реагентами.
Ключевые слова: анилин, N-метиланилин, N-алкилирование, гомогенные и гетерогенные катализаторы
DOI: 10.31857/S0044460X2103001X
1. Введение
331
2. N-Алкилирование анилинов алкилгалогенидами
332
3. Алкилирование анилинов спиртами
333
4. N-Метилирование анилинов диметилкарбонатом
356
5. Восстановительное N-метилирование анилинов с помощью формальдегида
359
6. N-Метилирование анилинов с помощью CO2/H
361
7. Необычные реакции N-алкилирования анилинов
364
8. Заключение
369
1. ВВЕДЕНИЕ
изводства автобензина представляет N-метилани-
лин, как антидетонационная добавка. Кроме того,
Ароматические амины являются важным клас-
N-метиланилин используется в качестве сырья для
сом органических соединений, которые находят
синтеза красителей, полимеров, гербицидов, в ка-
широкое применение в различных отраслях про-
честве растворителя, медицинских препаратов,
мышленности при производстве медицинских
стабилизаторов пироксилиновых порохов. Ни-
препаратов, красителей, взрывчатых веществ, ре-
трованием N-метиланилина нитрующей смесью
активных и ракетных топлив и стабилизаторов,
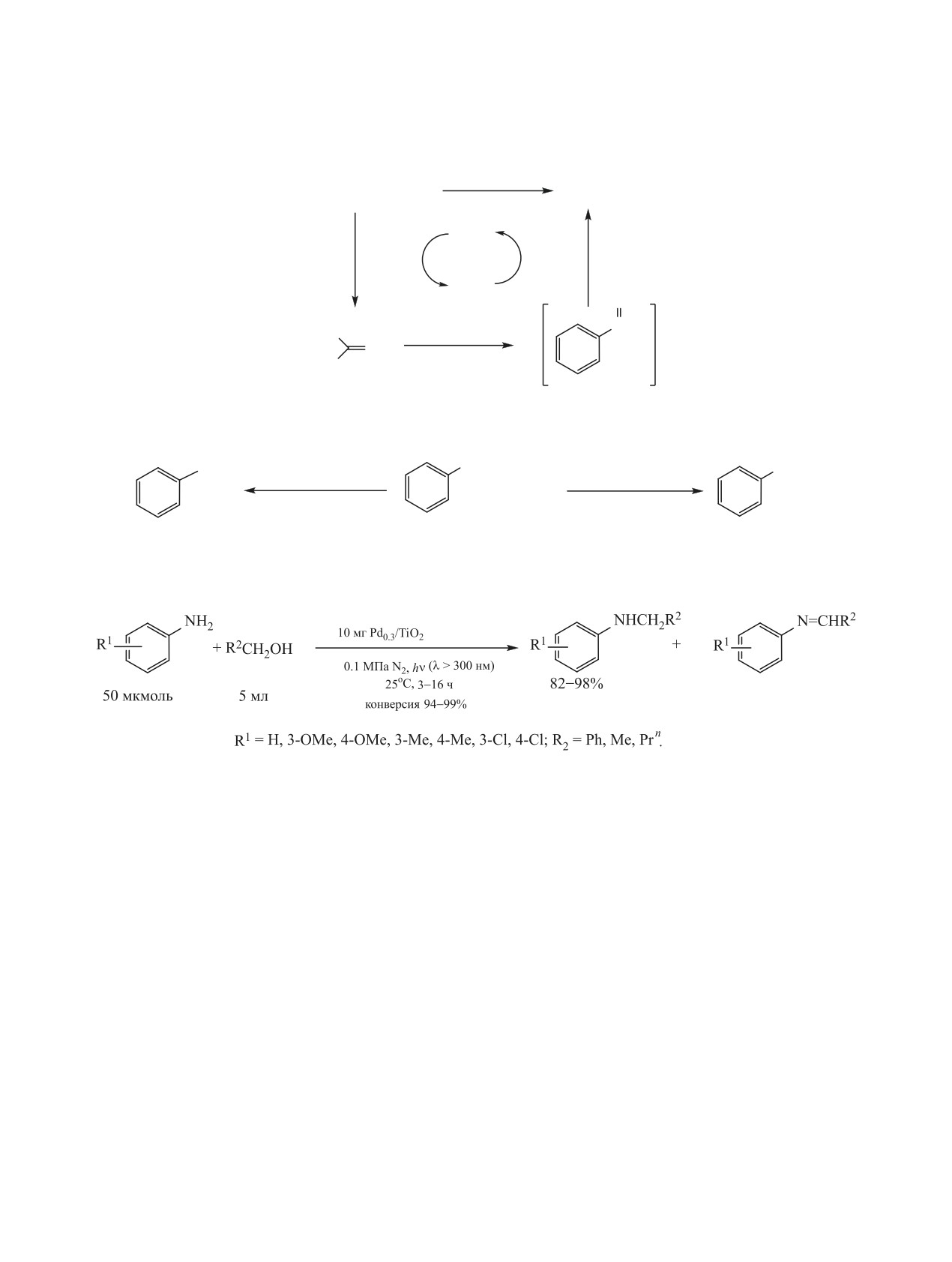
получают тетрил - бризантное взрывчатое веще-
фотоматериалов и др. В нефтеперерабатывающей
ство для капсюлей-детонаторов и промежуточных
промышленности ароматические амины использу-
детонаторов.
ются в производстве беззольных антиокислитель-
ных и антидетонационных добавок и присадок к
N,N-Диметиланилин находит применение в
топливам, маслам, полимерам и латексам. Из аро-
промышленности при производстве полиэфирных
матических аминов наибольший интерес для про-
смол, получении красителей (малахитовый зеле-
331
332
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 1.
цеолит
Br
Ar N
+
Ar N
ArNH2 +
H
PhH, 50°C, 5 ч
моно-
ди-
Ar = p-NO2C6H4
NaY, 15%, 24:1; KY, 79%, 19:1; CsY,
цеолит, общий выход (%), соотношение моно-/ди-:
3.6%, 100:1; NaX, 25%, 4.9:1; KX, 14%, 5.2:1.
ный, метиленовый голубой), взрывчатых веществ
ленности для производства широкого спектра
и в органическом синтезе [1]. Ценными проме-
химических веществ [24, 25]. N-Алкилирование
жуточными продуктами являются и другие N-ал-
(метилирование) ароматических аминов является
килзамещенные анилины, которые находят при-
сложным процессом с каталитической точки зре-
менение в производстве пластиков, взрывчатых
ния, так как ароматические амины значительно
веществ, фотореактивов, пестицидов, стабилиза-
менее активно, чем алифатические амины, вступа-
торов, красителей, лекарственных препаратов, по-
ют в реакцию N-алкилирования [26].
лимеров, растворителей [2-4].
Согласно литературным данным, методы полу-
Учитывая важное практическое значение N-мо-
чения N-алкилзамещенных анилинов можно ус-
но- и N,N-диалкиланилинов, разработка высоко-
ловно разделить на шесть групп: N-алкилирование
эффективных методов их синтеза с использова-
анилинов алкилгалогенидами, спиртами, диметил-
нием катализаторов является актуальной задачей
карбонатом, восстановительное N-метилирование
современной органической химии. Достижения и
анилинов с помощью формальдегида, CO2/H2 и
успехи в N-алкилировании анилинов частично ос-
необычные реакции N-алкилирования анилинов
вещены в монографиях и обзорах [4-23]. Как по-
под действием гетерогенных и гомогенных метал-
казывает анализ литературы, количество работ по
локомплексных катализаторов.
N-алкилированию анилинов с использованием ге-
терогенных и металлокомплексных катализаторов
2. N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
расширяется с каждым годом, что и побудило нас
АЛКИЛГАЛОГЕНИДАМИ
попытаться обобщить данные о новых достижени-
Эффективными катализаторами избирательно-
ях в этой области. Привлечение металлокомплекс-
го моно-N-алкилирования первичных ароматиче-
ных катализаторов и их импрегнированных форм
ских аминов алкилгалогенидами являются цеоли-
обусловлено тем, что с их помощью решаются за-
ты X и Y (схема 1) [27-30].
дачи снижения температуры вплоть до комнатной,
N-Алкилирование анилина алкилгалогенидами
вовлечения в реакцию функционально замещен-
RX (R = Me, Et, Bn; X = Cl, Br, I) в ацетонитриле
ных анилинов и спиртов сложного строения и уве-
осуществлено в работе [31]. Катализатором слу-
личения селективности процесса по моно- и диал-
жил цеолит Celite, промотированный с помощью
киланилинам. Это особенно важно для N-метил- и
CsF.
N,N-диметиланилинов, которые имеют близкие
температуры кипения (195.6 и 194°С), и выделе-
Цеолиты KX и NaY катализируют N-алкили-
ние их в индивидуальном виде из смеси очень за-
рование анилина с помощью BuI (схема 2) [28].
труднительно.
Реакция протекает при кипячении в бензоле в те-
В обзоре рассмотрены последние достижения
чение 14 ч. Выход смеси моно- и дибутиланили-
по использованию цеолитов различных марок,
нов составляет 58-67% в зависимости от природы
Al2O3 и комплексов Pd, Ru, Ir, Mn, Fe, Co, Ni и Cu
цеолита.
в N-алкилировании анилинов c обсуждением ме-
В работе [32] описано селективное N-алкили-
ханизмов реакции.
рование анилина бензил- и аллилбромидами под
Алкилирование является одной из важнейших
действием катализатора Al2O3-K2O (приготовлен
реакций, которая широко используется в промыш-
cмешением Al2O3 с KNO3) в ацетонитриле при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
333
Схема 2.
катализатор
PhNH2 + n-BuI
PhNHBu + PhNBu2
PhH, кипячение, 14 ч
моно-
ди-
катализатор, выход (%), соотношение моно-/ди-: KX,
67%, 97:1; NaY, 58%, 120:1.
Схема 3.
20 мас% HT5,
EtOH (водн.)
Br
ArNH2 +
Ar N
30oC, 45 мин-3 ч
10 ммоль
22 ммоль
Ar = Ph, 4-MeC6H4, 4-ClC6H4, 4-BrC6H4, 4-FC6H4, 4-MeOC6H4, 4-NO2C6H4,
4-AcC6H4, 4-HOC6H4
(44-80%); 2-CF3C6H4
(10%).
Схема 4.
30°C. Выходы N,N-дибензил- и N,N-диаллилани-
Комплекс родия Rh(cod)BF4 [Rh]-1 в сочетании
линов составили 72 (за 7 ч) и 85% (за 1 ч) соответ-
с N-гетероциклическим карбеновым лигандом L-2
ственно. Катализатор сохраняет высокую актив-
проявил высокую каталитическую активность в
ность при повторном использовании.
N-арилировании замещенных анилинов бромбен-
Магний-алюминиевые гидротальциты (HT5,
золом (схема 5) [35].
Mg/Al = 53) способствуют двукратному N-алки-
Каталитическая система CuI-пролинамид L-3
лированию анилина и его производных аллил-
использована для N-арилирования алифатических
бромидом в водном этаноле в мягких условиях
и ароматических аминов арилгалогенидами в во-
(схема 3). Гидротальциты можно легко регенери-
дных средах. Реакция проходит в мягких условиях
ровать и использовать повторно [33] .
на воздухе с участием широкого круга функцио-
Как известно, связь C-галоген в арилгалоге-
нально замещенных анилинов (схема 6) [36].
нидах является более прочной, чем в алкилгало-
3. N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
генидах. Примеры использования цеолитов для
СПИРТАМИ
N-арилирования анилинов с помощью ArХ немно-
гочисленны. Указанная проблема решена с исполь-
Более удобными алкилирующими агентами,
зованием металлокомплексных катализаторов.
чем алкилгалогениды, являются спирты, так как
Так, воздухо- и влагостойкие комплексы Ni(II)-
они дешевле и менее токсичны. При алкилиро-
(σ-арил)
[Ni]-1, стабилизированные N-гетеро-
вании аминов с их участием не образуются соли,
циклическими карбеновыми лигандами L-1, ис-
утилизация которых может быть проблематичной.
пользованы для алкилирования анилинов арилхло-
Побочным продуктом при алкилировании ами-
ридами в мягких условиях (схема 4) [34].
нов спиртами является вода. На N-алкилировании
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
334
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 5.
Cl
N N
2 мол% Rh(cod)BF4 [Rh]-1, 4 мол% L-2
Pri
Pri
ArNH2 + PhBr
ArNHPh
2 экв. ButONa, DME, 80oC, 12 ч
3 экв.
L-2
Ar = 4-ClC6H4 (81%), 4-MeOC6H4 (51%); cod = 1,5-циклооктадиен, DME = 1,2-диметоксиэтан.
Схема 6.
N
N
HN
N
0.1 экв. СuI, 0.2 экв. L-3
Ar1NH2 + Ar2X
Ar1NHAr2
Ph
3 экв. K2CO3, H2O, 100°C, 24 ч
N
O
1.5 экв.
H
L-3
Ar1 = Ph, 4-MeOC6H4, 4-NO2C6H4, 2-MeO-4-MeC6H3; X = I,
Ar2 = Ph, 4-MeOC6H4, 2-HO2CC6H4, 4-NO2C6H4 (75-78%); X = Br, Ar2 = 2-MeC6H4 (70%).
Схема 7.
[Cu], H2
PhNH2 + MeOH
PhNHMe
180-250oC, 1.0 МПа
CH3OH = CH2O + H2
CH2O + C6H5NH2 = PhN=CH2 + H2O
PhN=CH2 + H2 = PhNHCH3
PhNHCH3
+ CH
+ H2O
3
OH = PhNH(CH3)2
метанолом основано производство метиламинов
тельно, играют важную роль в управлении конвер-
из аммиака и метанола. Таким способом в мире
сией исходных субстратов и селективностью реак-
производится ~500 000 тонн/год метиламина, ди-
ции N-алкилирования анилинов спиртами [37, 38].
метиламина и триметиламина. Реакция слабо из-
Основным промышленным способом получе-
бирательная, требующая разделения указанных
ния N-метиланилина является парофазное ката-
трех продуктов. Еще один класс N-алкилирующих
литическое алкилирование анилина метанолом в
агентов, не содержащих галоген, - это эпоксиды. В
присутствии медьсодержащего гидрирующего-де-
частности, эпоксид этилена используется при про-
гидрирующего катализатора в атмосфере водоро-
изводстве этаноламинов.
да. В Российской Федерации данный процесс ре-
Успехи по N-алкилированию анилина спиртами
ализован в 1996 г. в ОАО «Волжский оргсинтез»
с помощью твердых кислотных катализаторов, та-
(г. Волжский). Механизм процесса может быть
кими как цеолиты, оксиды металлов и их модифи-
представлен схемой 7.
цированных форм обсуждаются подробно в обзоре
Недостатком этого способа является низкая
[37]. Природа, элементный состав и структурные
селективность по N-метиланилину (обычно ниже
особенности указанных катализаторов, действи-
90%), кроме того, используемые катализаторы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
335
Схема 8.
быстро теряют активность и требуется их частая
с координации метанола на кислотном центре цео-
регенерация. В качестве побочного продукта обра-
лита (стадия 1), затем метильной группы на атоме
зуется N,N-диметиланилин 2-3% [39].
кислорода (стадия 2). После стадии 3 образуется
шестичленное переходное состояние, благоприят-
В работе [40] для проведения N-метилирования
ное для выделения воды (стадия 4) за счет протона
анилина метанолом использованы мезопористые
цеолита и OH--группы от метанола. На стадии 5
молекулярные сита Al-MCM-41 с модулем Si/Al от
анилин атакует метильную группу с формирова-
15 до 40. Реакция проходит неселективно с образо-
нием нового шестичленного комплекса. Послед-
ванием смеси N-метиланилина и N,N-диметилани-
ний распадается (стадия 7) с выделением целевого
лина в соотношении (3-4):1.
N-метиланилина и протонированной формы цео-
В работе [41] для N-метилирования аминов, в
лита, который продолжает цикл. По аналогичной
частности анилина, использовали Al2O3-морде-
схеме происходит образование N,N-диметиланилина.
нит в качестве катализатора. Процесс проводили
Авторами работы
[42] осуществлен синтез
в реакторе с неподвижным слоем катализатора
N,N-диметиланилина взаимодействием анилина
при 270°С, 10 бар и соотношении метанол:амин =
c метанолом (1:3) под действием цеолита типа X
4:1. В этих условиях селективность реакции по
(RHO-цеолит) и L (цеолит S,K-LTL) при 400°С.
N,N-диметиланилину составила 57% при конвер-
Выход N,N-диметиланилина составил 95%.
сии анилина 64%.
N-Алкилирование анилина метанолом ката-
На схеме 8 приведен вероятный механизм реак-
лизирует γ-оксид алюминия [43]. Селективность
ции. По мнению авторов [41], процесс начинается
реакции зависит от температуры: ее повышение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
336
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 9.
γ-Al2O3
PhNH2
+ MeOH
PhNHMe + PhNMe2
газовая фаза
1:3
200оС конверсия 45%
90%
10%
320оС конверсия 99.5%
5%
85%
Схема 10.
1 мол% Pt/C
+ MeOH
RC6H4NHMe
RC6H4NH2
0.1 экв. NaOH, 140oС,15 ч
81-92%
1 ммоль
10 ммоль
R = H, 4-Me, 4-But, 4-MeO, 4-F, 4-Cl.
способствует образованию N,N-диметиланилина
нием альдегида. Активным катализатором метили-
(схема 9).
рования анилинов с помощью метанола является
платина на угле. Так, в работе [47] осуществлено
В работе [44] N-метилирование анилина мета-
нолом в газовой фазе в присутствии γ-Al2O3 осу-
селективное N-монометилирование анилина и
ществлено при температуре 300-400°С.
замещенных анилинов метанолом с использова-
нием наночастиц Pt, нанесенных на активирован-
Жидкофазное N-метилирование анилина мета-
ный уголь (Pt/C) в присутствии основания NaOH.
нолом обычно проводят в присутствии минераль-
Выходы соответствующих N-метиланилинов со-
ных кислот, из которых чаще всего используют
ставляют 81-92% (схема 10). Катализатор Pt/C
серную и соляную. Реакцию проводят в автокла-
сохраняет высокую селективность при повторном
вах под давлением свыше 3 МПа и при температу-
использовании.
ре 180-220°С [45, 46].
Предложен вероятный механизм реакции, ко-
В литературе имеются сведения об использо-
торый приведен на схеме 11. Вначале метанол де-
вании в процессах алкилирования анилина и его
гидрируется с выделением формальдегида и двух
производных спиртами большого семейства ге-
атомов водорода, закрепленных на поверхности
терогенных катализаторов на основе переходных
металлов: платины Pt/C [47]; палладия Pd/C [48],
Pt. Для успешного протекания реакции необхо-
димо присутствие промотора - NaOH, который
Pd/TiO2 [49, 50], PdZn/Al2O3 [51], Pd/AlO(OH) [52],
способствует дегидрированию метанола через де-
Pd/Fe2O3 [53]; никеля NiO/θ-Al2O3 [54], Ni/γ-Al2O3
[54], NiCuFeOx [55], Ni@ [56]; железа Fe3O4 [57],
протонирование. В ряде работ в качестве основа-
Fe3O4/FeO [58], Fe(ClO4)3/SiO2 [59]; серебра Ag/
ния вместо NaOH использованы NaOMe, ButOK,
Al2O3 [60], Ag/Al2O3-Ga2O3 [61], Ag6Mo10O33 [62],
NaHCO3, K3PO4, Cs2CO3. На следующей стадии
Ag/Al2O3-FeCl3∙6H2O [63], Ag/GO (оксид графе-
CH2O реагирует с амином, давая имин (стадия 2).
на) [64]; золота Аu/TiO2 [65-67] и меди Cu/SiO2
На конечной стадии происходит гидрирование
[68], CuO-Cr2O3-Al2O3
[39], СuО-ZnO-Al2O3-
имина 1 с образованием N-метиланилина. Как из-
CaO [69], Сu-Mo/TiO2 [70], Cu0.5Zn0.5Fe2O4 [71],
вестно, конденсация формальдегида с первичны-
гидротальцита (CuAl-HT) [72], Cu(OH)2-Al(OH)3
ми аминами с образованием имина 1 протекает
[73] (см. таблицу). Перечень использованных пе-
легко. Кинетические результаты в сочетании с рас-
реходных металлов неслучаен, все они обладают
четами методом теории функционала плотности
дегидрирующими и гидрирующими свойствами и
(DFT) свидетельствуют о том, что высокая эффек-
можно предположить, что ключевой стадией про-
тивность Pt/C обусловлена умеренной прочностью
цесса является дегидрирование спирта с образова-
связи металл-водород Pt [47].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
337
N-Алкилирование анилинов спиртами под действием катализаторов
Анилин
Спирт
XC6H4NHR или
XC6H5NH2,
Катализатор
Т, °С
ROH
XC6H4NR2 (выход, %)
где X
H
MeOH
Pd/C
150
12
NaOMe
-
C6H5NHMe (92)
[74]
4-Me
« «
« «
« «
« «
« «
-
4-MeC6H4NHMe (91)
« «
3-Me
« «
« «
« «
« «
« «
-
3-MeC6H4NHMe (90)
« «
2-Me
« «
« «
« «
16
« «
-
2-MeC6H4NHMe (90)
« «
4-Et
« «
« «
« «
12
« «
-
4-EtC6H4NHMe (90)
« «
4-Pri
« «
« «
« «
« «
« «
-
4-PriC6H4NHMe (91)
« «
2-Pri
« «
« «
« «
18
« «
-
2-PriC6H4NHMe (91)
« «
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H4NHMe
« «
(92)
2-MeO
« «
« «
« «
« «
« «
-
2-MeOC6H4NHMe
« «
(92)
4-F
« «
« «
« «
12
« «
-
4-FC6H4NHMe (84)
« «
4-Cl
« «
« «
« «
« «
« «
-
4-ClC6H4NHMe (70)
« «
4-Br
« «
« «
« «
« «
« «
-
4-BrC6H4NHMe (58)
« «
H
« «
Pd/C
130
« «
t-BuOK
-
C6H5NHMe (95)
[75]
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H4NHMe
« «
(96)
4-Me
« «
« «
« «
« «
« «
-
4-MeC6H4NHMe (98)
« «
H
BnOH
Pd/C
reflux
24
HCO2Na
-
C6H5NHBn (74)
[48]
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H5NHBn (88)
« «
H
MeOH
« «
« «
« «
« «
-
C6H5NHMe (63)
« «
« «
PrnOH
« «
« «
« «
« «
-
C6H5NHPrn (67)
« «
« «
BnOH
PdZn/Al2O3
110
0.5
-
1 атм. Ar
C6H5NHBn (99)
[51]
« «
CyOH
« «
« «
8
« «
« «
C6H5NHCy (84)
« «
« «
OctnOH
« «
« «
6
« «
« «
C6H5NHOct (91)
« «
« «
BnOH
Pd/AlO(OH)
90
20
« «
1 атм. H2
C6H5NHBn (84)
[52]
« «
OctnOH
Pd/Fe2O3
150
24
« «
-
C6H5NHOct (86)
[53]
« «
« «
« «
170
18
« «
-
C6H5NOct2 (95)
« «
« «
EtOH
Pd/TiO2
25
3
« «
УФ облучение
C6H5NHEt (95)
[50]
« «
BunOH
« «
« «
4
« «
« «
C6H5NHBu (91)
« «
« «
BnOH
« «
« «
6
« «
« «
C6H5NHBn (92)
« «
3-Me
« «
« «
« «
12
« «
« «
3-MeC6H4NHBn (97)
« «
4-Me
« «
« «
« «
14
« «
« «
4-MeC6H4NHBn (82)
« «
4-Cl
« «
« «
« «
12
« «
« «
4-ClC6H4NHBn (82)
« «
2-Cl
« «
« «
« «
« «
« «
« «
2-ClC6H4NHBn (95)
« «
4-MeO
« «
« «
« «
16
« «
« «
4-MeOC6H4NHBn (82)
« «
3-MeO
« «
« «
« «
12
« «
« «
3-MeOC6H4NHBn (96)
« «
H
MeOH
Pt/C
140
15
NaOH
-
C6H5NHMe (92)
[47]
4-Me
« «
« «
« «
« «
« «
-
4-MeC6H4NHMe (91)
« «
4-But
« «
« «
« «
« «
« «
-
4-ButC6H4NHMe (90)
« «
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H4NHBn (96)
« «
4-F
« «
« «
« «
« «
« «
-
4-FC6H4NHMe (88)
« «
4-Сl
« «
« «
« «
« «
« «
-
4-ClC6H4NHMe (81)
« «
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
338
БАЙГУЗИНА, ХУСНУТДИНОВ
(Продолжение)
Анилин
Спирт
XC6H4NHR или
XC6H5NH2,
Катализатор
Т, °С
ROH
XC6H4NR2 (выход, %)
где X
H
OctnOH
NiO/θ-Al2O3
144
3
-
-
C6H5NHOctn (99)
[54]
« «
« «
Ni/γ-Al2O3
« «
« «
« «
-
C6H5NHOctn (60)
« «
« «
EtOH
NiO/θ-Al2O3
« «
24
« «
-
C6H5NHEt (87)
« «
« «
BnOH
NiO/θ-Al2O3
« «
5
« «
-
C6H5NHBn (99)
[54]
« «
CyOH
« «
130
24
« «
-
C6H5NHCy (94)
« «
« «
« «
NiCuFeOx
144
« «
-
Ампула
C6H5NHCy (98)
[55]
« «
BnOH
« «
« «
« «
« «
« «
C6H5NHBn (94)
« «
4-Me
MeOH
« «
« «
« «
« «
« «
4-MeC6H4NHMe (89)
« «
H
BnOH
Ni@a
183-
6
-
-
C6H5NHBn (76)
[56]
184
« «
HexnOH
Ni@a
Reflux
« «
« «
-
C6H5NHHexn (87)
« «
« «
BnOH
Fe3O4
90
2
ButOK
-
C6H5NHBn (88)
[57]
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H4NHBn (84)
« «
H
« «
Fe3O4/FeO
40
0.5
ButOK
-
C6H5NHBn (95)
[58]
« «
Ph2CHOH
Fe(ClO4)3/SiO2
85
6
-
-
C6H5NHCHPh2 (92)
[59]
H
MeOH
CuO-Cr2O3-
240
1.4 ч-1
« «
В потоке
C6H5NHMe (97%)
[39]
Al2O3
H
BunOH
Cu/SiO2
280
0.4 ч-1
« «
« «
C6H5NHBun (96%)
[68]
H
EtOH
СuО-ZnO-
230
0.4 г/ ч
« «
В потоке/H2
C6H5NHEt (84.5)
[69]
Al2O3-CaO
H
MeOH
Сu-Mo/TiO2
25
21
« «
УФ облучение
C6H5NMe2 (46)
[70]
H
« «
Cu0.5Zn05Fe2O4
300
3.58 ч-1
« «
В потоке
C6H5NHMe (59)
[71]
4-MeO
« «
Cu0.5Zn0.5Fe2O4
« «
« «
« «
« «
4-MeOC6H4NHBn (34)
« «
H
BnOH
CuAl-HTб
160
9
K2CO3
-
C6H5NHBn (91)
[72]
4-MeO
« «
« «
« «
« «
« «
-
4-MeOC6H4NHBn (97)
« «
H
« «
Ag/Al2O3
120
1
Cs2CO3
-
C6H5NHBn (99)
[60]
« «
« «
Ag/Al2O3-
110
26
NaH
-
C6H5NHBn (82)
[61]
Ga2O3
« «
DecnOH
Ag6Mo10O33
160
20
ButOK
-
C6H5NHDecn (84)
[62]
« «
BnOH
« «
« «
12
« «
-
C6H5NHBn (93)
« «
« «
« «
Ag/GOв
100
12
Cs2CO3
-
C6H5NHBn (99)
[64]
« «
« «
Ag/Al2O3-
144
24
-
-
C6H5NHBn (94)
[63]
FeCl3∙6H2O
« «
« «
Аu/TiO2
110
14
-
5 атм. N2
C6H5NHBn (92)
[67]
« «
MeOH
« «
20
4
-
УФ облучение
C6H5NMe2 (61)
[66]
« «
EtOH
« «
« «
« «
« «
« «
C6H5NHEt (74)
« «
« «
PrnOH
« «
« «
« «
« «
« «
C6H5NHPrn (89)
« «
« «
BunOH
« «
« «
« «
« «
« «
C6H5NHBun (87)
« «
a Ni@ - наночастицы никеля;
б CuAl-HT - гидротальцит;
в GO - оксид графена.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
339
Схема 11.
PhNH2
+ CH3OH
PhNHCH3
Pt
1
3
PtH2
CH2
N
H
2
O
H
PhNH2
1
Схема 12.
NH2
NHR
NR2
0.42 мол% Pd/Fe2O3
0.42 мол% Pd/Fe2O3
+ ROH
150oC, 24 ч
170oC, 18 ч
1:3
R = Octn (86%), Decn (80%).
R = Octn (95%), Decn (85%).
Схема 13.
Катализаторы алкилирования анилинов спир-
в широком интервале температур 90-170°С (см.
тами на основе переходных металлов имеют перед
таблицу). Так, в присутствии Pd/Fe2O3 увеличение
кислотами и цеолитами три важных преимуще-
температуры до 170°С приводит к двукратному
ства: возможность проведения реакции при более
N-алкилированию анилина 1-октанолом и 1-дека-
низкой температуре, возможность управления се-
нолом даже при менее продолжительном нагрева-
лективностью и толерантность к функциональным
нии (схема 12) [53].
группам в молекулах анилинов и спиртов, что по-
Известно, что катализатор Pd/TiO2 при УФ об-
зволило вовлечь в реакцию широкий ассортимент
лучении (λ >300 нм) способствует N-моноалкили-
субстратов различного строения (см. таблицу).
рованию анилина и его производных спиртами:
Проблема селективности особенно остра для по-
этанолом, н-бутанолом и бензиловым спиртом в
лучения N-метил- и N, N-диметиланилинов, кото-
рые имеют близкие температуры кипения: 195.6 и
мягких условиях при 25°С [50]. В этих условиях
194°С и их выделение из смеси в индивидуальном
соответствующие N-метиланилины получены с
виде очень затруднительно.
количественным выходом (схема 13). В аналогич-
Катализаторы на основе палладия Pd/C,
ных условиях (Pd/TiO2, hν, 15-20 ч) метанол ре-
Pd/AlO(OH), Pd/Zn/Al2O3 и Pd/Fe2O3 проявляют
агирует с анилином, давая N,N-диметиланилин с
активность в алкилировании анилинов спиртами
выходом 81% [49].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
340
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 14.
NH2
NHR
NR2
Au/TiO
2
+ ROH
+
hν, 4 ч
R = Me (соотношение моно-/ди- = 5.5:60.7%), Et (74.4:8.9%), Prn (89.1:2.4%),
Bun (87.8:0%), Hexn (52.5:0%).
Схема 15.
NH2
NHCH2C6H4R2
0.04 г Fe
O4/FeO
3
R1
+ R2C6H4CH2OH
R1
40oC, 0.5-1 ч, 1.5 мл H2O
R2 = H, R1 = H (95%), 4-MeO (91%), 4-Ac (39%), 3-NO2 (82%), 4-NO2 (61%), 4-Br (81%), 4-Cl (69%),
4-F (39%); R1 = H, R2 = 4-Me (91%), 4-MeO (94%), 4-Cl (92%), 4-NO2 (78%), 2-NO2 (70%).
Схема 16.
Ni@ или Co@
PhNH2 + ROH
PhNHR
+ PhNR2
160-183oC
Ni@: R = Bn (соотношение моно-/ди- = 46.6:44%), Octn (38.5:15.5%), Hexn (87:3.5%);
Co@: R = Bn (36:15%).
УФ облучение активирует и золотосодержащий
Авторами работы [56] осуществлено алкилиро-
катализатор Аu/TiO2. Фотокаталитическое N-алки-
вание анилина спиртами с использованием в каче-
лирование анилина алифатическими первичными
стве катализатора наночастиц кобальта и никеля с
спиртами в присутствии Аu/TiO2 проходит в мяг-
размером менее 20 нм, способных образовывать
ких условиях (50°С, 4 ч) [66]. В случае метанола
однородный коллоидный раствор. Установлено,
основным продуктом реакции является N,N-диме-
что в ходе реакции образуются как вторичные, так
тиланилин. Этанол, н-пропанол, н-бутанол, н-гек-
и третичные амины (схема 16). Реакция проходит
санол дают моноалкилпроизводные (схема 14).
при повышенной температуре(≥150°С), и поэтому
данный способ в лабораторных условиях пригоден
Весьма активным катализатором N-алкилиро-
лишь для высококипящих спиртов и аминов.
вания анилинов бензиловым спиртом и его про-
изводными являются наночастицы Fe3O4, которые
Особое место среди катализаторов N-алкилиро-
были получены из солей Fe2+ и Fe3+ под воздей-
вания анилинов занимают циклопентадиенкарбо-
ствием внешнего магнитного поля (ЭМП). Реак-
нильные комплексы железа (комплексы Кнолкера)
ция проходит при 40°С и завершается через 0.5-
[Fe]-1-[Fe]-6, формулы которых приведены на схе-
1 ч (схема 15). Разделение катализатора и продук-
ме 17 [57, 76-83]. Oни принадлежат к уникально-
тов реакции производили с помощью внешнего
му классу комплексов, один из лигандов которых
магнита, извлекая таким образом более 95% ката-
принимает непосредственное участие в каталити-
лизатора. Катализатор сохраняет свою активность
ческом процессе на стадии переноса водорода, что
в 4 повторных опытах [58]. Аналогичная реакция
делает излишним использование дополнительного
анилина с алифатическими спиртами (метанолом
реагента - оснований, которые путем депротони-
и этанолом) протекает с умеренными выходами,
рования способствуют дегидрированию спиртов
58 и 60% (40°C, 3 ч).
с образованием альдегидов. Правда, в отсутствие
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
341
Схема 17.
Ph
C6H4CF3-p
SiMe3
O
O
O
Ph
C6H4CF3-p
SiMe3
Fe
Fe
Fe
OC
CO
OC
CO
OC
CO
CO
CO
CO
[Fe]-1 [76, 78]
[Fe]-2 [78]
[Fe]-3 [77, 80, 81]
Ph
C6H4OMe-p
Ph
Ph
N
O
O
O
Ph
N
Ph
C6H4OMe-p
Ph
Fe
Fe
Fe
OC
CO
OC
CO
CO
CO
OC COCO
[Fe]-4 [82, 83]
[Fe]-5 [82, 83]
[Fe]-6 [76]
Схема 18.
оснований приходится увеличивать расход ком-
к освобождению вакантного места в комплексе
плексов [Fe]-1-[Fe]-6 до 10 мол%. При более низ-
[Fe]-3. На следующей стадии происходит дегидри-
ких концентрациях [Fe]-1-[Fe]-6 для достижения
рование спирта 2 в альдегид 3, а акцептором одно-
высоких выходов целевых продуктов использу-
го атома водорода служит циклопентадиеноновый
ются основания, например CsOH [82], K2CO3 [83]
лиганд. Далее происходит конденсация альдегида
или ButOK [57].
с амином с образованием имина 4. Процесс завер-
Комплексы Кнолкера толерантны по отноше-
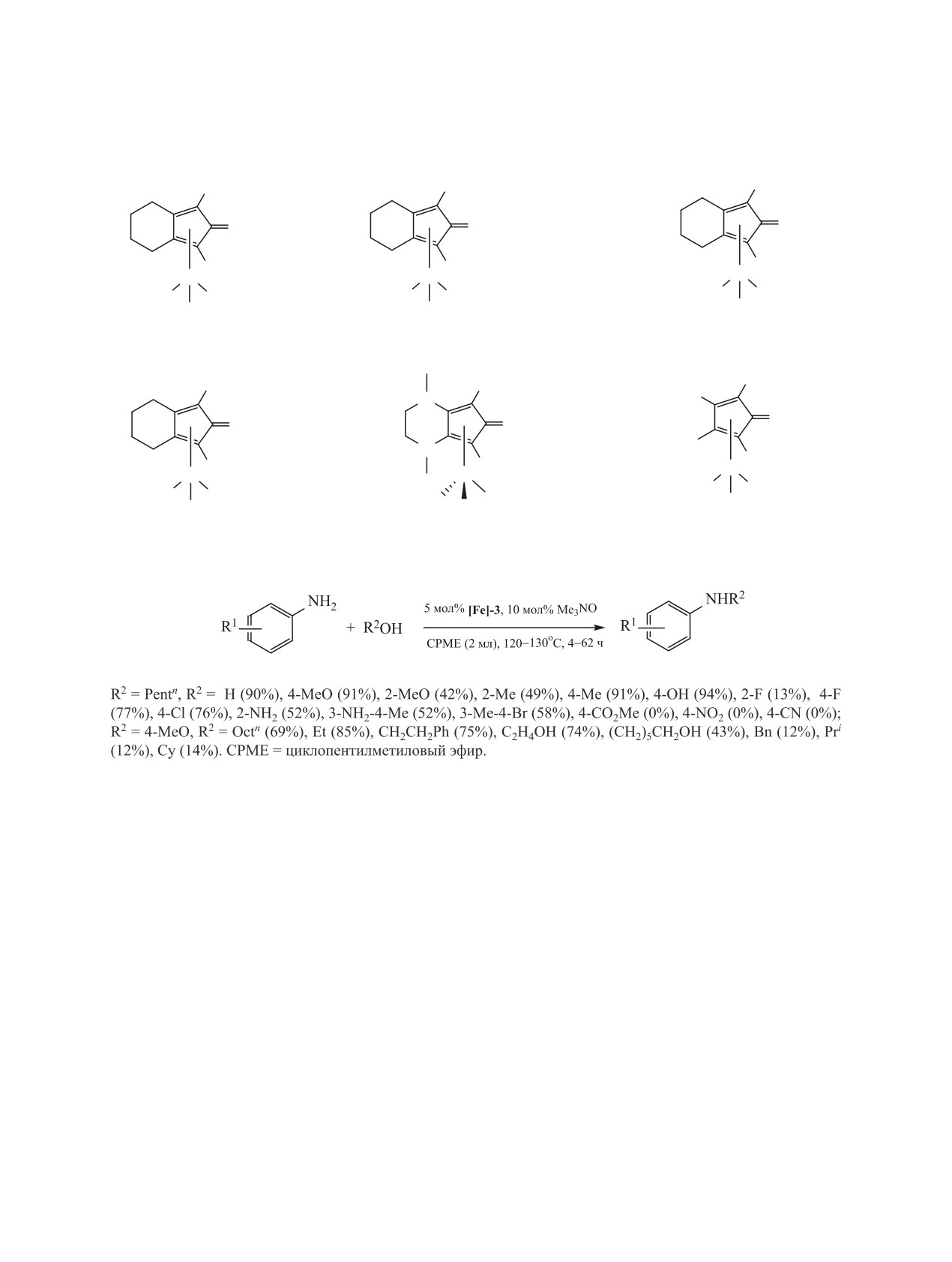
шается гидрированием имина. Донором двух ато-
нию к большинству функциональных групп как в
мов водорода служит комплекс [Fe]-7 (схема 19).
молекулах замещенных анилинов, так и спиртов,
Для успешного N-алкилирования анилина и
что позволяет ввести в реакции больший ассор-
его производных метанолом (схема 20), который
тимент указанных субстратов. Так, в работе [81]
осуществлено N-алкилирование анилинов с помо-
дегидрируется с трудом в присутствии комплекса
щью спиртов, катализируемое комплексом железа
Кнолкера [Fe]-5 требуются особые условия: при-
[Fe]-3 (схема 18).
сутствие основания (CsOH) и водорода. Согласно
На схеме 19 приведен вероятный механизм ре-
расчетам DFT, молекулярный водород действует
акции. Стартовой стадией является атака комплек-
не только как восстановитель, но и как реагент для
са [Fe]-3 оксидом триметиламина, приводящая
смещения термодинамического равновесия [82].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
342
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 19.
SiMe3
SiMe3
OH
Me3NO
O
O
-CO
R1
R2
SiMe3
SiMe3
2
Fe
Fe
OC
CO
OC
O
CO
CO
[Fe]-3
[Fe]-3a
SiMe3
R1
R2
3
LA
OH
LA
R3
N
R3NH2
NHR3
SiMe3
Fe
R1
R2
OC
H
R1
R2
CO
4
5
[Fe]-7
Схема 20.
NH2
NHMe
2 мол% [Fe]-5, 10 мол% CsOH
R
+ MeOH
R
110oC, 16 ч
(94-99%); R = 4-I, 4-CN (87%).
R = H, 4-MeO, 4-Me, 4-Br, 3-Br, 2,5-(CF3)2
Схема 21.
H
10 мол% [Fe]-3
3
N
R
NH2
OH
40 мол% AgF
+
R1
R1
R2
R2
R3
толуол,110oC, 24 ч
26-97%
5 экв.
R1 = H, 4-MeO, 2-MeO, 3-MeO, 4-Cl; R2 = Me, Et; R3 = Hexn, Me, Pri, PriCH2, Pentn, Ph,
4- MeOC6H4; R2-R3 = (-CH2-) (CyOH).
Cогласно авторам [77], фторид серебра оказы-
Высокую активность в N-алкилировании ани-
вает промотирующее действие по отношению к
лина и его производных вторичными спиртами
комплексу Кнолкера [Fe]-3. В присутствии систе-
проявил перхлорат железа, нанесенный на силика-
мы [Fe]-3-AgF удалось осуществить N-алкили-
гель Fe(ClO4)3/SiO2 (схема 23) [59].
рование анилина и его производных вторичными
Согласно работе [85], бромид железа катали-
спиртами (схема 21).
зирует N-алкилирование анилина бензиловым
Присутствие оснований не требуется при ис-
спиртом в присутствии лиганда - DL-пироглюта-
пользовании в качестве катализатора N-алки-
миновой кислоты - в среде 1,2,4-триметилбензола
лирования гидридного комплекса железа [Fe]-8
(1,2,4-ТMB) L-4. Выход N-бензиланилина соста-
(схема 22) [84].
вил 85% (схема 24).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
343
Схема 22.
Схема 23.
R2
R2
H
H
R4
NH2
R4
N
2
Fe(ClO4)3/SiO
+
HO
R3
R3
CHCl3, ∆, 2.5-6 ч
R1
H
R1
85-92%
R1 = H, Br, NO2, Cl, CN, MeO; R2
= H, NO2; R3
= Me, Ph; R4 = Me, Ph, 4-ClC6H4.
Схема 24.
Схема 25.
CCl4-MeOH (1:2)
PhNHMe + PhNMe2
140°C, 4 ч
33%
37%
FeCl3.6H2O
PhNH2
CCl4-MeOH (1:4)
+
PhNMe2
140°C, 8 (16) ч
NMe2
NMe2
92% (47%)
6% (45%)
В работе [86] синтез N-метил- и N,N-диметил-
Реакция проходит в отсутствие оснований и при
замещенных анилинов осуществлен взаимодей-
обязательном присутствии CCl4, поэтому авторы
ствием анилина с метанолом в присутствии ката-
считают, что алкилирующим агентом в исследуе-
лизатора FeCl3·6H2O в среде CCl4. Так, при 140°С
мой реакции выступает метилхлорид, образование
через 4 ч (соотношение CCl4:MeOH = 1:2) продук-
которого можно представить схемой 26.
тами реакции являются N-метил-, N,N-диметила-
В случае 1,4-бутан- и 1,5-пентандиолов реакция
нилины, которые образуются в эквимолярном ко-
также не останавливается на стадии N-алкилиро-
личестве. Через 8 ч основным продуктом реакции
вания анилинов, а завершается образованием N-
становится N,N-диметиланилин (схема 25).
арилпирролидинов и N-арилпиперидинов [87, 88].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
344
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 26.
[Fe]
MeOCl
HCHO
(1)
MeOH + CCl4
–CHCl3
-HCl
MeOH + HCl
MeCl + H2O
(2)
Схема 27.
Me
NHC3H5
BArF4
Co(acac)2-P(CH2CH2PPh2)3
N
N
PPri
2
N
N
[Co]-2 [91]
Cy2P
Co PCy2
Co
Cl
HN
N
NH
CH2SiMe
3
N PPri
2
PriP
Co PPri2
2
[Co]-4 [89]
Cp*CoI2- PCy3
Me
Cl
Cl
[Co]-5 [93]
[Co]-3 [92]
[Co]-1 [90]
Схема 28.
Схема 29.
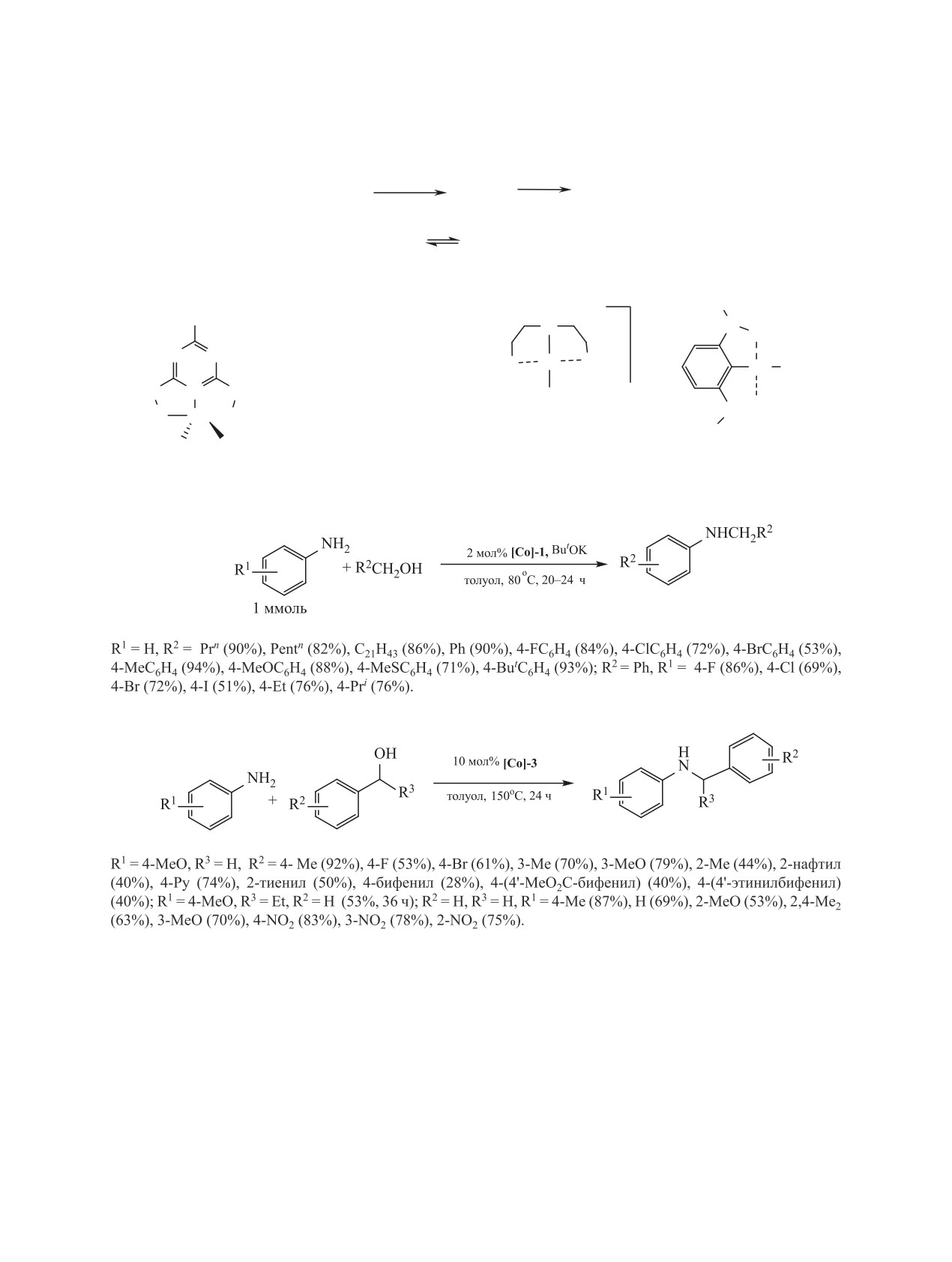
В серии работ [89-93] в качестве катализаторов
ствующих N-алкил- и N-бензиланилинов достига-
N-алкилирования анилина и его производных спир-
ют 90% (схема 28) [90].
тами использованы комплексы кобальта [Co]-1-
Комплекс [Cp*Co(PCy)3I2] [Co]-3 проявил вы-
[Co]-5, строение которых приведено на схеме 27.
сокую активность в N-алкилировании анилина и
Эффективным и селективным катализатором
его производных вторичными спиртами (схема 29)
N-алкилирования анилинов алифатическими и
[92]. Вероятный механизм реакции приведен на
бензиловыми спиртами является комплекс [Co]-1,
схеме 30. Согласно квантово-химическим расче-
в присутствии которого реакция проходит в мяг-
там, каталитически активным интермедиатом яв-
ких условиях (80°C, 20-24 ч), а выходы соответ-
ляется комплекс [Cp*CoI2]. Указанный комплекс
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
345
Схема 30.
-
[Сp*Co(PCy3)I] +I
Сp*Co(PCy3)I2
[Co]-3
[Сp*CoI2]2
-PCy3
PCy3
стадия 1
OH
Сp*CoI
2
NHPh
PhNH2+
PhNH2 +
[Co]-3.1
Ph
Ph
стадия 7
стадия 2
-
PhNH3+I
+I-
PhNH3
Cp*
Cp*
стадия 5
Co
Co
NHPh
I
Ph
PhNH2
O
I
N
O
H
Ph
-H2O
Ph
[Co]-3.5
Ph
Ph
[Co]-3.2
-PCy3
PCy3
β-элиминирование
водорода
внедрение
−PCy3
PCy3
Cp*
Cp*
стадия 6
стадия 3
Co I
Co
I
H
Cp*
Cy3P
N
Co
I
[Co]-3.3
Cy3P
O
Ph
−PCy3
PCy3
[Co]-3.7
стадия 4
Ph
Cp*
[Co]-3.6
Co
I
Cy3P
H
[Co]-3.4
легко генерируется путем диссоциации комплек-
стабилизируется с помощью PCy3 (стадия 4), затем
са [Co]-3. Ключевой стадией процесса является
принимает участие в гидрировании имина (стадия
депротонирование спирта, причем депротони-
6), который образуется по реакции ацетофенона с
рующим агентом является не основание, а сам
анилином (стадия 5). Процесс завершается пере-
анилин (стадия 2). Одновременно образуется ал-
носом протона от PhNH3+I- на комплекс [Co]-3.5
коксикомплекс кобальта [Co]-3.2, который путем
с образованием конечного продукта PhCH(Me)·
выделения ацетофенона (стадия 3), превращается
NHPh и регенерацией анилина (стадия 7). Необ-
в гидридный комплекс [Co]-3.3. Координацион-
ходимо отметить, что PCy3 принимает участие в
но-ненасыщенный гидридный комплекс [Co]-3.3
стабилизации не только гидридного комплекса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
346
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 31.
NH2
2 мол% [Co]-4
NHMe
R1
+ R2CH2OH
4 A MS, толуол,
R1
∆, 48 ч
1.2 экв.
80-95%
R1 = H, 2-MeO, 4-Cl; R2
= Ph, 4-FC6H4, Pri.
Схема 32.
Me
Me
Me
Me
N
N
N
PPri2
N
PPri
PPri
2
PPri
2
2
Cl
Co
Me
Co
CH2SiMe3
Co
Cl
Co
Cl
N PPri
2
N PPri
2
N PPri
2
2
N PPri
Me
Me
Me
Me
[Co]-5
[Co]-6
[Co]-7
[Co]-8
NHMe
NH2
2 мол% [Co]-5, 1.3 экв. ButOK
R1
+ R2CH2OH
R1
толуол, 80оС, 16 ч
72-91%
R1 = H, 4-Me, 4-MeO; R2 = Ph, 4-ClC6H4, 4-Me2NC6H4, Me2CHCH2CH2, PhCH=CHCH2.
[Co]-3.3, но и комплексов [Co]-3.2) и [Co]-3.5 (при
комплексов на основе марганца, которому мало
этом образуются комплексы [Co]-3.6 и [Co]-3.7,
характерны дегидрирующие и гидрирующие свой-
создавая условия для протекания реакции в целом.
ства. Для проведения N-алкилирования анилина
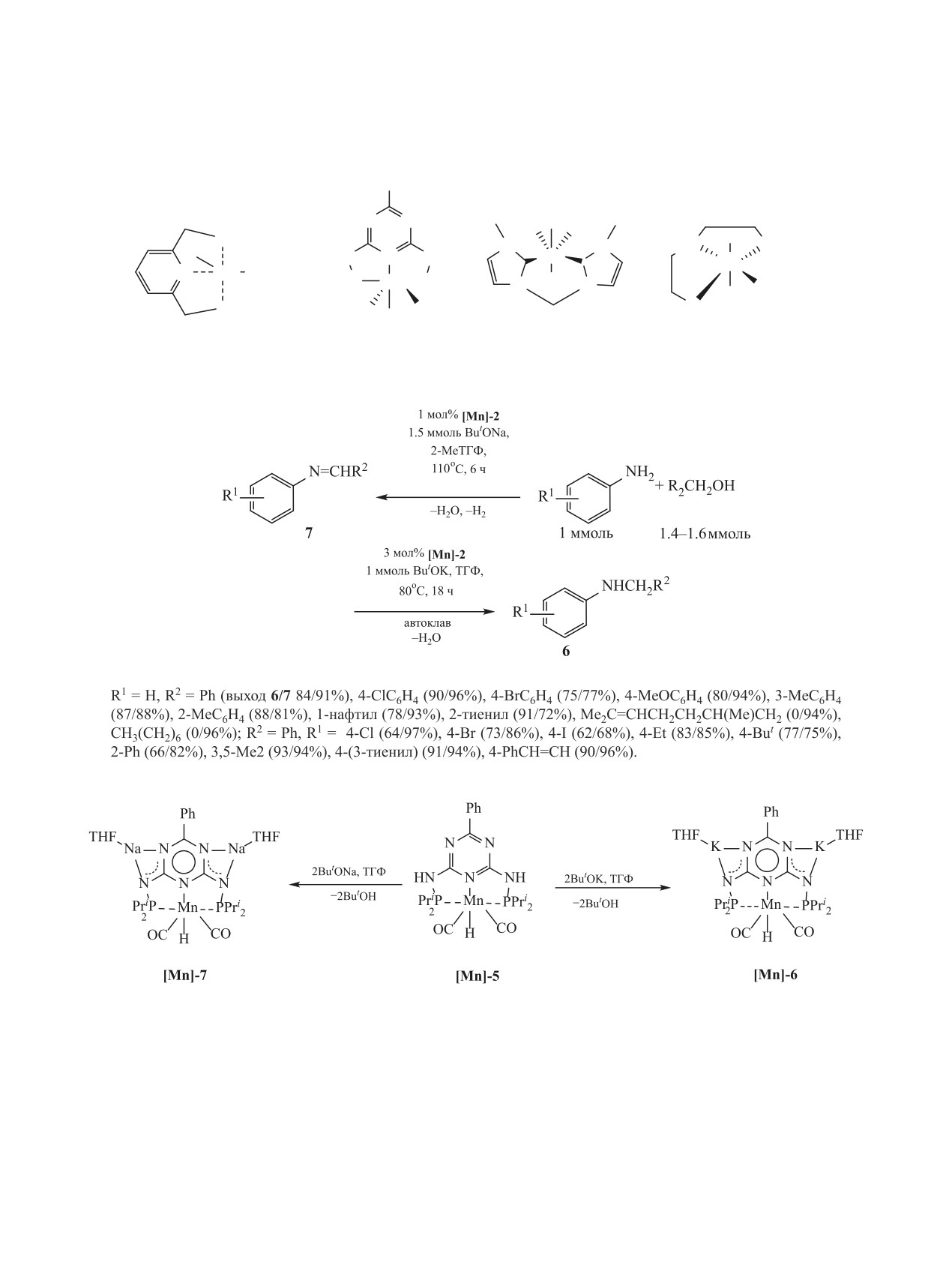
Для эффективного N-алкилирования как арома-
и его производных спиртами использованы че-
тических, так и алифатических аминов спиртами
тыре типа комплексов марганца [Mn]-1-[Mn]-4
был использован комплекс кобальта [Co]-4, содер-
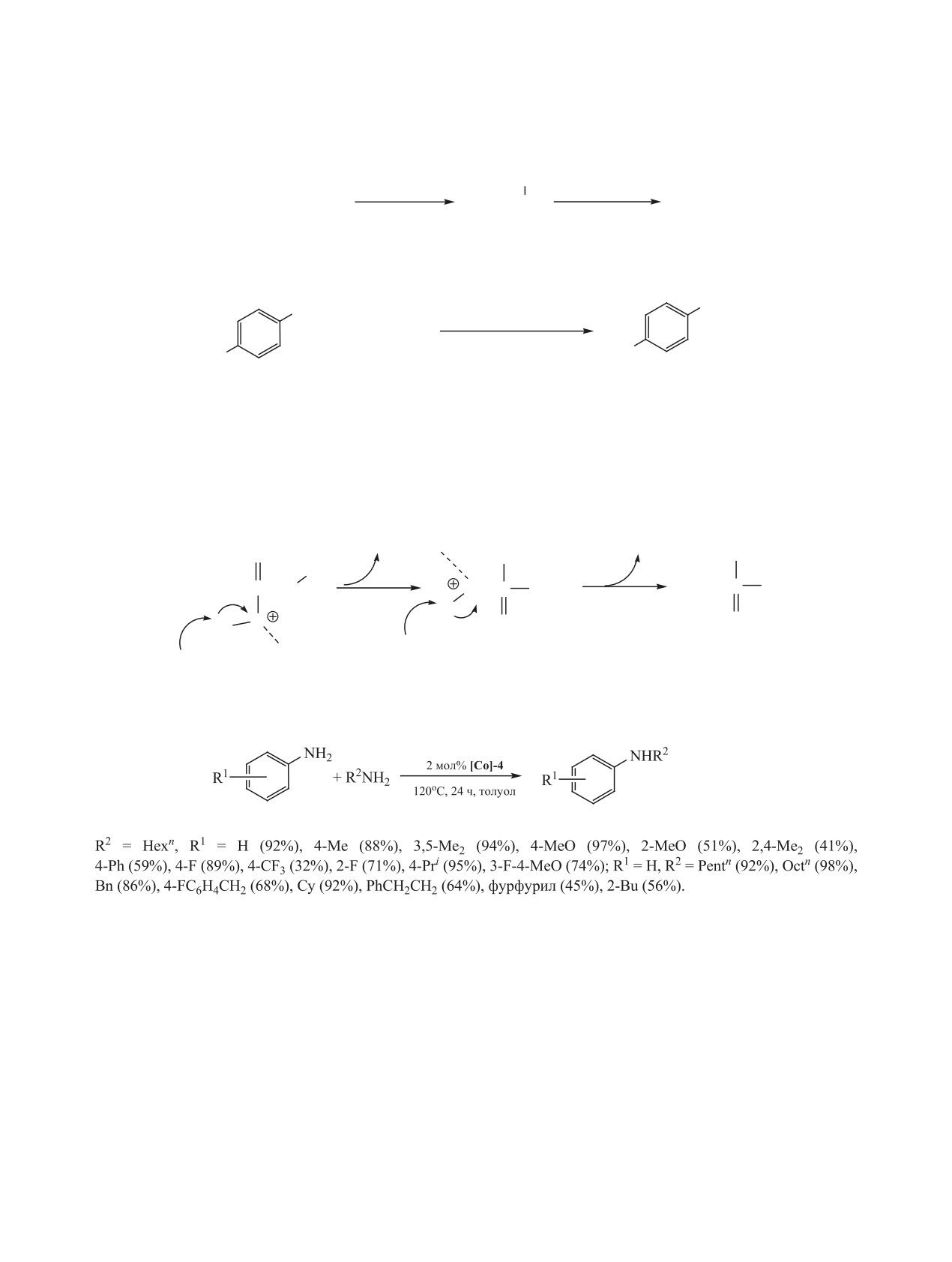
c пинцерными лигандами различной структуры
жащий в координационной сфере пинцерный ли-
(схема 33) [94-99].
ганд PNP (схема 31) [89].
Указанные комплексы [Mn]-1-[Mn]-4 проявля-
Комплексы кобальта Со(II) [Co]-5-[Co]-8, ста-
ют активность в N-алкилировании анилинов спир-
билизированные лигандом - N,N′-бис(диизопро-
тами при обязательном присутствии оснований:
пилфосфино)-N,N′-диметил-1,3-диаминобензолом
ButOK [94-99], KH [97], ButONa [98], строение и
(РСР), оказались эффективными катализаторами
природа которых оказывает решающее влияние на
N-алкилирования анилинов спиртами. Наиболь-
состав продуктов реакции. В частности, при алки-
шую активность проявил комплекс [Co]-5 в при-
сутствии которого удалось вовлечь в реакцию
лировании анилина и его производных спиртами
N-алкилирования широкий круг замещенных ани-
в присутствии комплекса [Mn]-2 с добавлением
линов и большой ассортимент первичных спиртов
ButOK основными продуктами реакции являют-
(схема 32) [93].
ся вторичные амины 6, а при замене ButOK на
Неожиданной является высокая активность
ButONa реакция останавливается на стадии обра-
в реакции N-алкилирования анилинов спиртами
зования иминов 7 (схема 34) [98].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
347
Схема 33.
Ph
N
N
OC
Br CO
PPri2
Br
N
N
HN
PPri2
Br
HN
N
NH
Mn
Mn
N Mn
CO
Pr
iP
Mn PPri2
CO
2
N
N
CO
CO
PPri
P
2
OC
Br
CO
Pri
2
[Mn]-3 [99]
[Mn]-4 [94-96]
[Mn]-1 [94-96]
[Mn]-2 [98]
Схема 34.
Схема 35.
Исследуя механизм реакции, авторы [98] уста-
с имином - N-бензилиденанилином - в 40 раз бы-
новили, что стартовым калитически активным
стрее, чем комплекс с натрием [Mn]-7, чем можно
интермедиатом является гидридный комплекс
объяснить различие в поведении ButOK и ButONa
марганца [Mn]-5, который реагирует с ButOK или
в исследованной реакции (схема 35).
ButONa, образуя комплексы [Mn]-6 и [Mn]-7. Ока-
Уникально высокой активностью в N-алки-
залось, что калиевый комплекс [Mn]-6 реагирует
лировании анилинов алифатическими спиртами,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
348
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 36.
Схема 37.
Схема 38.
NHCH2R2
NH2
10-20 мол% MnO
2
R1
+ R2CH2OH
R1
10-20 мол% K2CO3, воздух, 135oC, 24 ч
1 ммоль
1.2 ммоль
84-98%
R1 = H, 4-Me, 3-Me, 4-EtO, 4-Cl, 3-Cl, 2-Cl; R2 = Ph, 4-MeOC6H4, 4-MeC6H4.
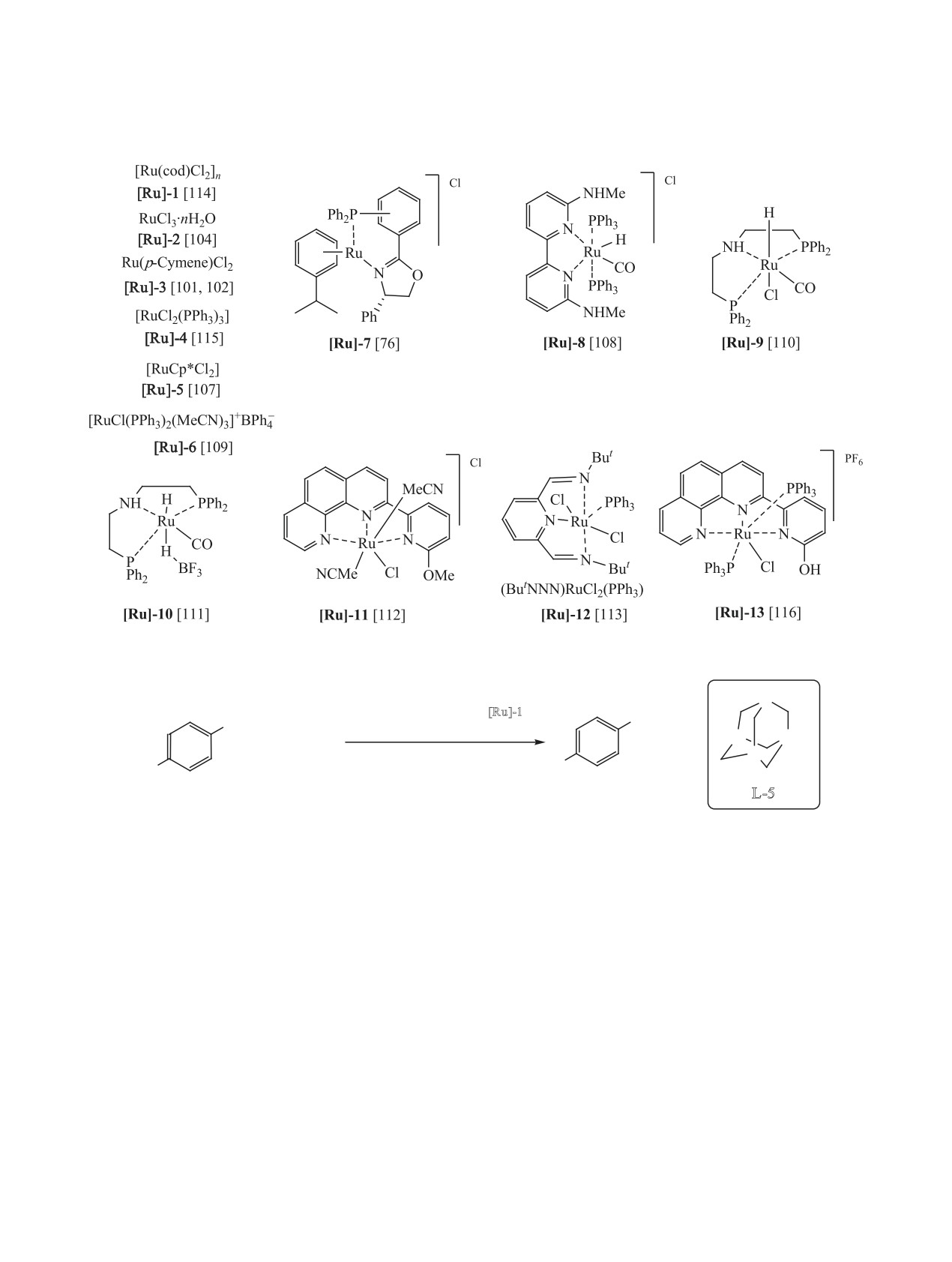
бензиловым спиртом и его производными отлича-
зованы комплексы рутения [Ru]-1-[Ru]-13, актив-
ется комплекс марганца [Mn]-3 с карбеновым ли-
ность и селективность действия которых зависят
гандом, реакция в присутствии которого проходит
от валентного состояния рутения и природы ли-
при комнатной температуре (схема 36) [99].
гандного окружения (схема 39) [101-110]. Для
успешного протекания реакции необходимо при-
В относительно мягких условиях (80°С, 24 ч)
сутствие таких оснований, как ButOK [101, 102,
проходит N-алкилирование анилина и его произ-
110, 111], ButOLi [107], K2CO3 [109], NaOMe [112],
водных спиртами под действием комплекса мар-
Na [113], которые, очевидно, принимают участие в
ганца [Mn]-4, содержащего в координационной
дегидрировании спиртов с образованием альдеги-
сфере тридентантный PNP-лиганд (схема 37) [94].
дов путем депротонирования.
N-Алкилирование анилина бензиловым спир-
Наиболее активным катализатором N-алки-
том и его производными в присутствии основания
лирования анилина, 4-хлоранилина и м-толуи-
K2CO3 катализирует диоксид марганца (схема 38).
дина алифатическими спиртами (EtOH, BunOH,
Реакция проходит на воздухе, но ее препаративная
HexnOH) и ароматическими спиртами является
ценность невелика, так как MnO2 и K2CO3 явля-
комплекс рутения [Ru(cod)Cl2]n [Ru]-1 в сочета-
ются твердыми веществами, что создает большие
нии с лигандом 1,3,5-триаза-7-фосфоадамантаном
сложности для масштабирования [100].
L-5. В присутствии указанной каталитической
В серии работ в качестве катализаторов N-ал-
системы реакция проходит при 55°С за 12-36 ч
килирования анилина и его производных исполь-
(схема 40) [114].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
349
Схема 39.
Схема 40.
P
2.5 мол% [Ru(cod)Cl2] [Ru]-1,
n
NHR2
NH2
5 мол% L-5
N
N
+ R2OH
0.16 ммоль ButOK,
N
толуол, 55oC, 12-36 ч
R1
R1
77-97%
L-5
R1 = H, 4-Cl, 3-Me; R2 = Bn, 3-ClC6H4CH2, 2-MeC6H4CH2, PhCH2CH2CH2,
4-ClC6H4CH2CH2, 4-MeOC6H4CH2CH2,Et, Bun, Hexn, фурфурил.
Большинство комплексов рутения способству-
этил-, N,N-дипропил- и N,N-дибутиланилина со-
ет N-алкилированию анилинов спиртами в интер-
ставил 74, 88 и 79%, соответственно [115].
вале температур 80-120°С при продолжительно-
Весьма активным и универсальным катализато-
сти реакции 12-36 ч. Несмотря на значительную
ром N-алкилирования анилина и его производных
продолжительность, N-алкилирование анилинов
спиртами является комплекс рутения [Ru]-12 с ли-
проходит с селективным образованием моноал-
гандом пинцерного типа (схема 41) [113]. Число
килпроизводных. Для получения диалкилпроиз-
оборотов (TON) указанного комплекса колеблет-
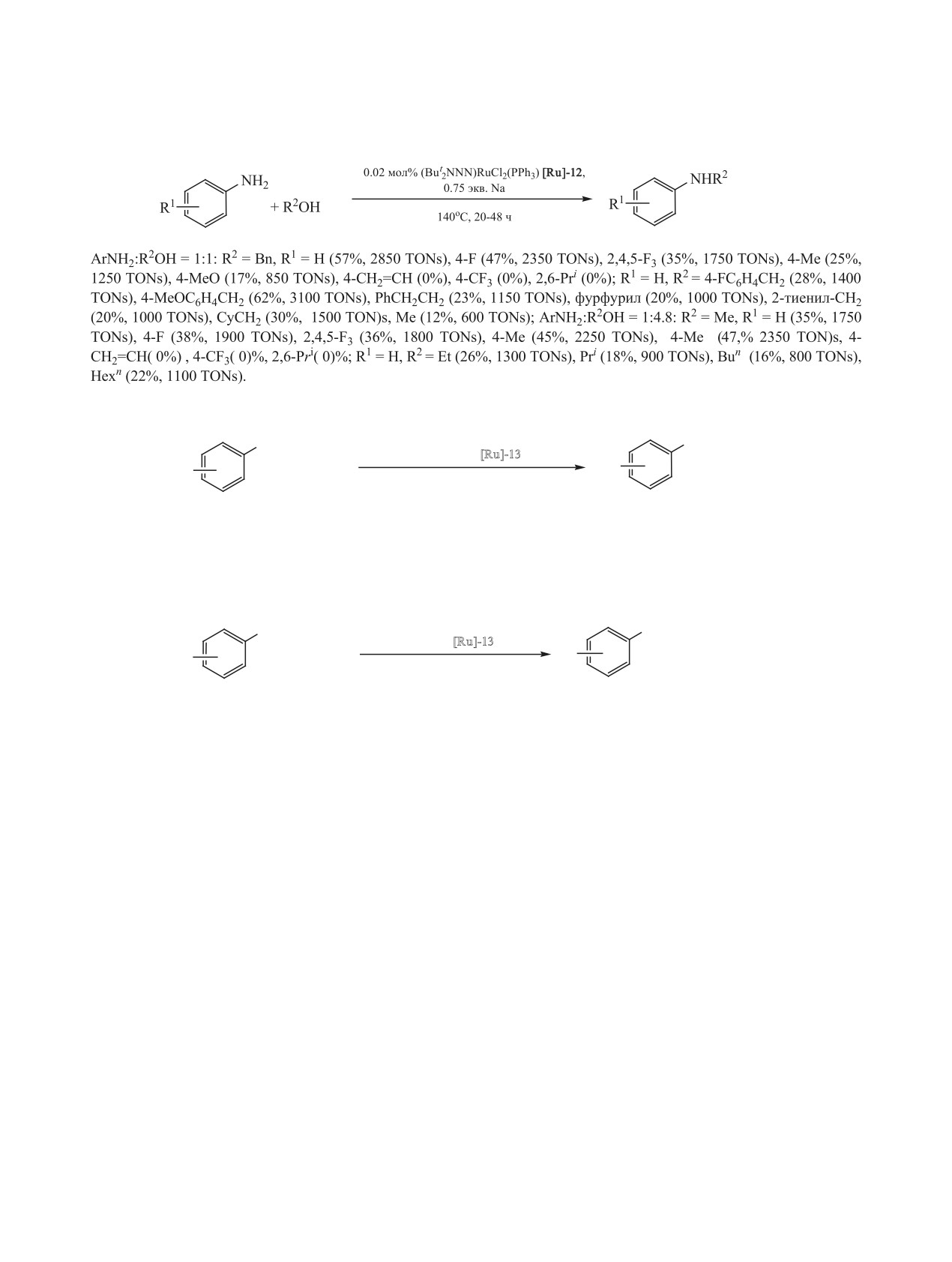
водных необходимы более жесткие условия. Так,
N-диалкилирование анилина этанолом, н-пропа-
ся в пределах 600-3100, что позволяет успешно
нолом, н-бутанолом в присутствии [RuCl2(PPh3)3]
проводить реакцию при низкой концентрации
[Ru]-4 проходит при 180°С за 5 ч. Выход N,N-ди-
(0.02 мол%).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
350
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 41.
Схема 42.
NH2
NHR2
0.2 мол% [Ru]-13
R1
+ R2OH
R1
25 мол% ButOK, диоксан, 110oC, 16 ч
R2 = Bn, R1 = H (87%), 4-Me (58%), 3-Cl (78%), 4-MeO (79%), 4-Cl (85%), 4-Br (82%), 2,4-(MeO)2 (76%);
R1 = H, R2 = 4-MeOC6H4CH2 (77%), 4-MeC6H4CH2 (71%), 4-ClC6H4CH2 (81%), 4-BrC6H4CH2 (71%),
фурфурил (67%), 2-тиенил-CH2 (66%), Bun (51%), CH2Cy (69%), 1-CH2-нафтил (83%).
NH2
NHMe
1 мол% [Ru]-13
R
+ MeOH
R
0.5 ммоль NaOMe, 110oC, 24 ч
R = H (84%), 3-Cl (81%), 4-MeO (79%), 4-Br (74%).
Уникально высокой производительностью
исследовано на примере метанола. В частности,
(TON 42840) в N-алкилировании анилинов отлича-
комплексы [Ir]-5 [121], [Ir]-6 [122], [Ir]-7 [123],
ется другой комплекс рутения [Ru]-13 с NNN-пин-
[Ir]-11 [126], [Ir]-13 [128], способствуют селектив-
церным лигандом, который содержит в молекуле
ному образованию монометиланилинов с выходом
1,10-фенантролиновый и 2-гидроксипиридиновый
до 96%. При этом выходы продуктов зависят от
фрагменты (схема 42) [116]. Комплекс [Ru]-13
природы и расположения функциональных групп
устойчив к действию воздуха и влаги.
в анилинах.
Эффективными и достаточно универсальными
N-Монометилирование ароматических ани-
катализаторами N-алкилирования анилина и его
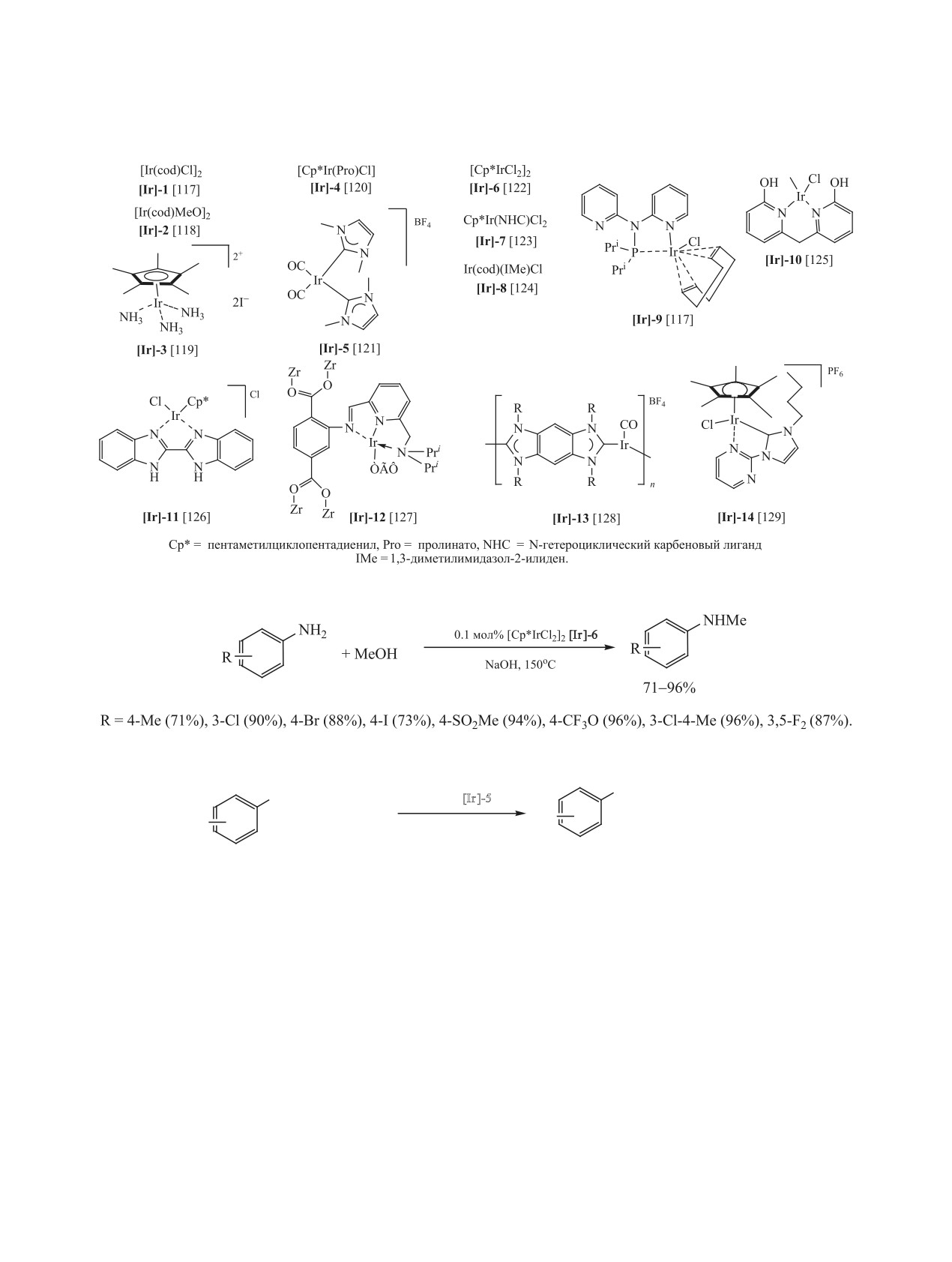
линов метанолом катализирует комплекс иридия
производных спиртами являются комплексы ири-
[Cp*IrCl2]2 [Ir]-6 в присутствии NaOH (схема 44)
дия [Ir]-1-[Ir]-14, формулы которых приведены на
[122], [130].
схеме 43.
По предположению авторов работы [121], ком-
Необходимо отметить, что большинство ука-
плексы иридия [Ir]-5 способствуют протеканию
занных катализаторов проявляют активность в
трех типов превращений: дегидрирование мета-
N-алкилировании анилинов в присутствии ос-
нола с образованием формальдегида, конденсация
нований: NaOH, KOH, ButOK, NaOMe, NaHCO3,
CH2O c анилином и гидрирование имина (схема 45).
K2CO3, K3PO4 и Cs2CO3.
Роль основания, который используется в стехио-
В ряде работ N-алкилирование анилинов спир-
метрическом количестве, заключается в депрото-
тами в присутствии Ir-содержащих катализаторов
нировании метанола.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
351
Схема 43.
Схема 44.
Схема 45.
NHMe
NH2
5 мол% [Ir]-5
+ MeOH
R
R
0.13 ммоль KOH,
120oC, 5 ч, MW
0.13 ммоль
71-96%
R = 4-MeO (95%), 4-Br (95%), 4-NO2 (60%), 4-CF3 (14%), 4-NH2 (54%), 2-Me (29%), 2,6-Me2 (1%).
Комплекс иридия [Ir]-9, полученный реакцией
который позволяет провести N-алкилирование
катализатора [Ir]-1 с P,N-лигандом Py2NPPri2 L-6,
анилина и его
4-метил-,
4-метокси-,
4-хлор-,
оказался эффективным катализатором для селек-
4-бром-, 4-карбометокси- и 4-цианопроизводных
тивного N-алкилирования анилинов бензиловым
первичными и вторичными спиртами сложного
спиртом. Реакция проходит в мягких условиях
строения (схема 47)[119].
(70°С, 24 ч) давая соответствующие N-бензилани-
В работе [132] комплекс [Cp*IrCl2]2 (5 мол%)
лины с выходом до 97% (схема 46) [117, 131].
[Ir]-6 с добавкой K2CO3 (5 мол%) использован для
Универсальным катализатором N-алкилирова-
N-алкилирования анилина бензиловым спиртом.
ния анилинов является комплекс иридия [IrCp*I2]2,
Выход бензиланилина (110°C, 17 ч) составил 88%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
352
БАЙГУЗИНА, ХУСНУТДИНОВ
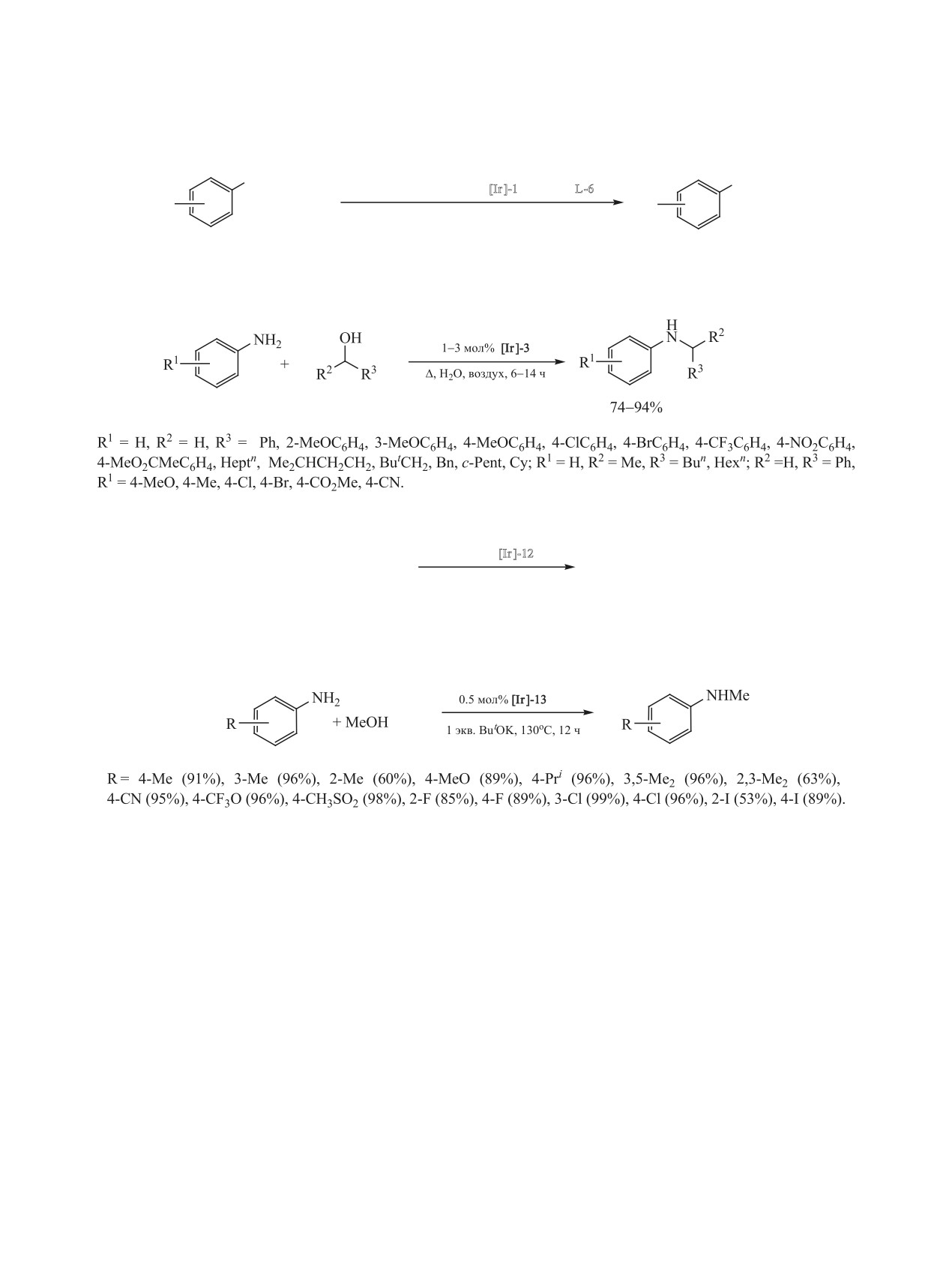
Схема 46.
NH2
NHBn
0.05-2 мол% [Ir(cod)Cl]2 [Ir ]-1, Py2NPPri L-6
R
+ BnOH
R
1.1 экв. ButOK, 0.2 мл диглим, 70оС, 24 ч
<98%
R = H, 4-MeO, 4-Cl, 3,5-Me2, 3,5-Cl2, 2-Ph, 2-Cl.
Схема 47.
Схема 48.
0.2 мол% [Ir ]-12
PhNH2 + ROH
PhNHR
автоклав
R = Bn (90%, 150oC, 2.5 ч), Et (100%, 80oC, 2 ч), But (0%, 150oC, 2 ч).
Схема 49.
N-Алкилирование анилина и его производных
Весьма активным катализатором монометили-
первичными и вторичными спиртами катализиру-
рования функционально замещенных анилинов
ет также комплекс [Cp*IrCl2]2 [Ir]-6 в присутствии
является комплекс иридия с гетероциклическим
NaHCO3 [133].
карбеновым лигандом (NHC-Ir) [Ir]-13. Приме-
чательно, что катализатор NHC-Ir имеет твердое
N-Алкилирование анилина спиртами проведе-
агрегатное состояние и он может быть легко извле-
но на многофункциональном гетерогенном ката-
чен и использован более 20 раз без потери актив-
лизаторе, представляющем собой металлооргани-
ности и селективности (схема 49) [128].
ческий каркас на основе Ir-Zr [Ir]-12. Указанный
катализатор эффективен для синтеза различных
В работе [126] для N-метилирования анили-
N-замещенных анилинов в воздухе в отсутствие
нов метанолом предложено использовать ком-
основания (схема 48). Катализатор извлекали и
плекс иридия [Ir]-11 с функциональным лигандом
использовали повторно без значительной потери
2,2′-дибензимидазолом, который наряду с ири-
активности [127].
дием принимает участие в переносе водорода от
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
353
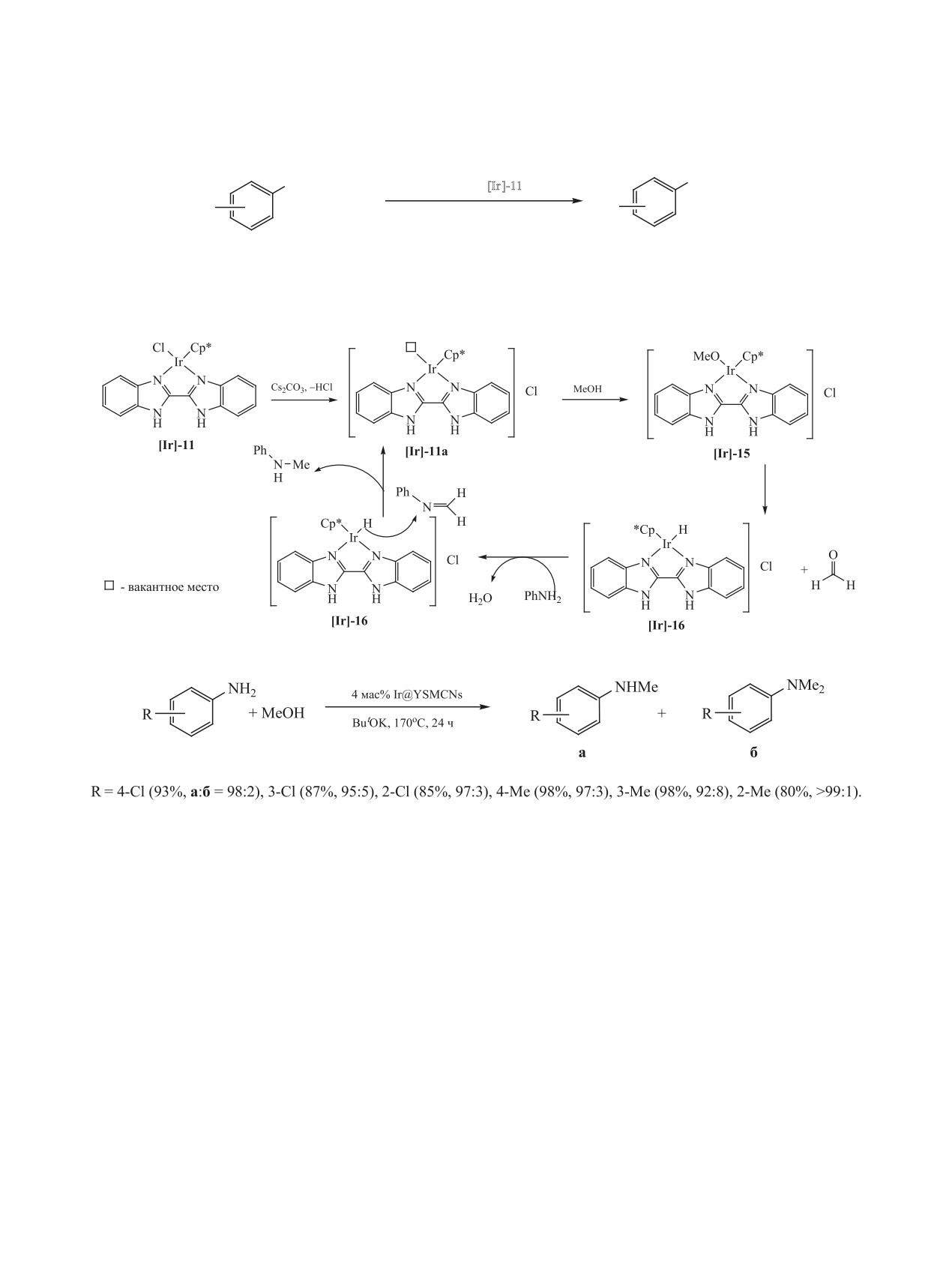
Схема 50.
NH2
NHMe
1 мол% [Ir]-11
R
+ MeOH
R
0.3-0.5 экв. Cs2CO3, 120оС, 12 ч
82-91%
R = 2-F, 3-Cl, 4-Br, 4-CN, 4-CO2Me, 3-MeO.
Схема 51.
Схема 52.
метанола на имин [Ir]-15 (схема 50). Обращает на
N-Моноалкилирование ароматических аминов
себя внимание и другая функция основания: оно
бензиловым спиртом катализирует иридийсодер-
реагирует с комплексом, освобождая координаци-
жащий комплекс [IrCl(cod)2] [Ir]-1, активирован-
онное место у иридия (схема 51).
ный P,N-лигандом. Выход N-бензиланилина соста-
Селективное N-монометилирование анилина
вил 36% [136]. В работе [129] для N-алкилирования
метанолом катализирует иридиевый нанокатали-
анилина спиртами использовали комплекс иридия
затор Ir@YSMCNs (наночастицы иридия, инкапсу-
с карбеновым лигандом [Ir]-14. Высокие выхо-
лированные в мезопористые углеродные наносфе-
ды продуктов реакции наблюдались только для
ры) (схема 52) [134]. Катализатор стабилен и не
бензилового спирта. Для успешного протекания
теряет активности при многократном использовании.
реакции требуется 50 мол% основания NaHCO3
Для метилирования анилинов метанолом ис-
(схема 54).
пользованы нанокластеры иридия размером 1-1.5
нм, стабилизированные диметилформамидом.
В работе [137] осуществлено алкилирование
ТОN для указанного катализатора составляет 310
N-метиланилина бензиловым спиртом в присут-
(схема 53) [135].
ствии 15 мол% AgOTf и 15 мол% [IrCl2Cp*(NHC)]
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
354
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 53.
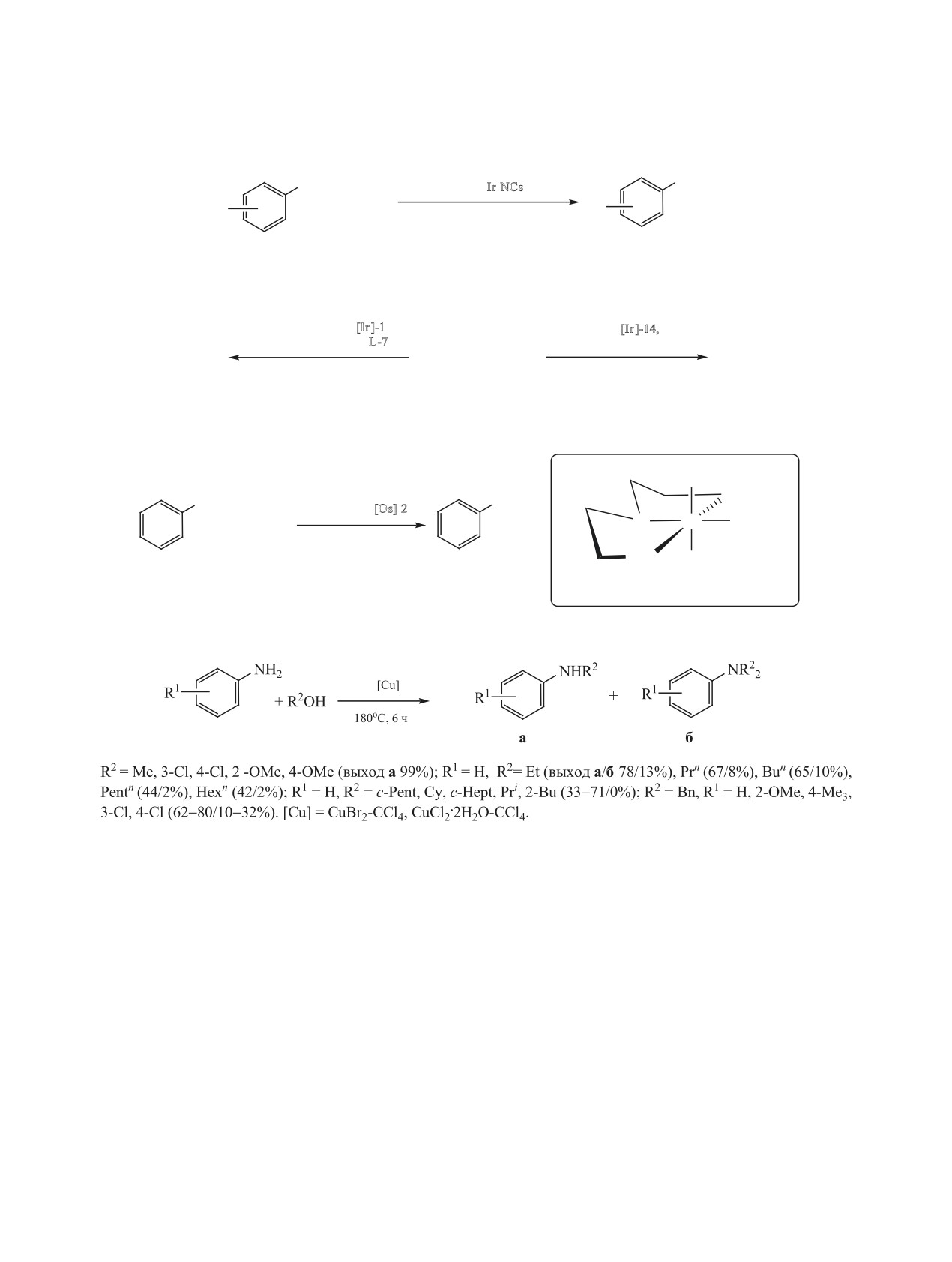
NHMe
NH2
0.1 мол% Ir NCs
R
+ MeOH
R
0.5 ммоль Cs2CO3, 150оС, 24 ч
R = H (78%), 4-Me (80%), 4-Cl (87%).
Схема 54.
5 мол% [IrCl(cod)2] [Ir]-1,
1 мол% [Ir]-14,
2 мол% PyN(Me)PPh2 L-7
50 мол% NaHCO3
PhNHBn
PhNH2 + BnOH
PhNHBn
0.01-0.5 мол% ButOK,
MS, толуол, 110оС, 45 ч
36%
98%
толуол (1 мл), 110oC, 24 ч
Схема 55.
H
PPri2
NH2
NHR
0.1 мол% [Os]-2
N
Os
CO
+ ROH
200oC, 30 ч
PriP
X
2
[Os]-1: X = Cl; [Os]-2: X = H
R = Me (60%), Et (36%), Ami (45%), Bn (37%).
Схема 56.
(110°С, 7 ч). В результате реакции с количествен-
условиях 130°С, 48 ч. Выход N-бензиланилина
ным выходом образуется N-бензилметиланилин.
составил 99%. Реакция проходит в присутствии
100 мол% ButOK в среде диоксана [139, 140].
Известны единичные примеры использования
в N-алкилировании анилинов спиртами комплек-
Осуществлен синтез N-алкил- и N,N-диалки-
сов меди, палладия, самария, осмия и золота, ко-
ланилинов реакцией анилина и замещенных ани-
торые существенно отличаются по активности.
линов с первичными и вторичными спиртами под
Так, низкую активность в N-алкилировании ани-
действием СuCl2·2Н2О и CuBr2 в присутствии
линов спиртами проявили комплексы осмия [Os]-
промотора - CCl4 (схема 56) [141]. По мнению
1 и [Os]-2. Реакция проходит в жестких условиях
авторов работы обнаружение хлороворода (кото-
(200°C, 30 ч). Несмотря на это, выходы N-алкил-
рый образуется путем гидролиза CCl4) меркуро-
(бензил)анилинов не превышают 60% (схема 55)
метрическим титрованием в реакционной массе
[138].
дает основания предположить, что HCl реагирует
Ацетат меди(II) (1 мол%) способствует N-ал-
с солями меди, давая комплексы типа Густавсона
килированию анилина бензиловым спиртом в
[CuBr2·HCl] и [СuCl2·HCl], которые являются от-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
355
Схема 57.
NH2
0.5 мол% Pd(OAc)2,
NHCH2R2
100 мол% CsOH
R1
+ 2CH2OH
R1
толуол, 150oC, 12 ч
23-98%
R1 = H, R2 = Ph, 4-MeOC6H4, 4-ClC6H4, 4-IC6H4, 3,4-(OCH2O)C6H4, 2-фурил, (CH2)5Me, Cy;
R2 = Ph, R1 = 4-MeO, 2-MeO, 4-Cl.
Схема 58.
NH2
NHBn
1 мол% PdCl2, 1 мол%
L-8
O
+ BnOH
20 мол% LiOH,
PBut
PBut
3 экв.
100оС, 24 ч
Xantphos(But)
L-8
Xantphos(But) = 4,5-бис(ди- трет-бутилфосфино)-9,9-диметилксантен.
Схема 59.
ветственными за N-алкилирование анилина мета-
составил 46000. Катализатор можно использовать
нолом с образованием N,N-диметиланилина.
повторно до 4 раз без заметного изменения харак-
В работе [142] N-алкилирование анилина и его
теристик [143].
производных спиртами различного строения осу-
В работах [144, 145] сообщается об успешном
ществлено под действием ацетата палладия(II)
использовании комплексов рения для проведе-
(схема 57).
ния N-алкилирования анилинов спиртами. Так,
Высокую эффективность в N-алкилировании
селективное моно-N-метилирование анилинов с
анилина бензиловым спиртом показал комплекс
помощью метанола катализирует комплекс рения
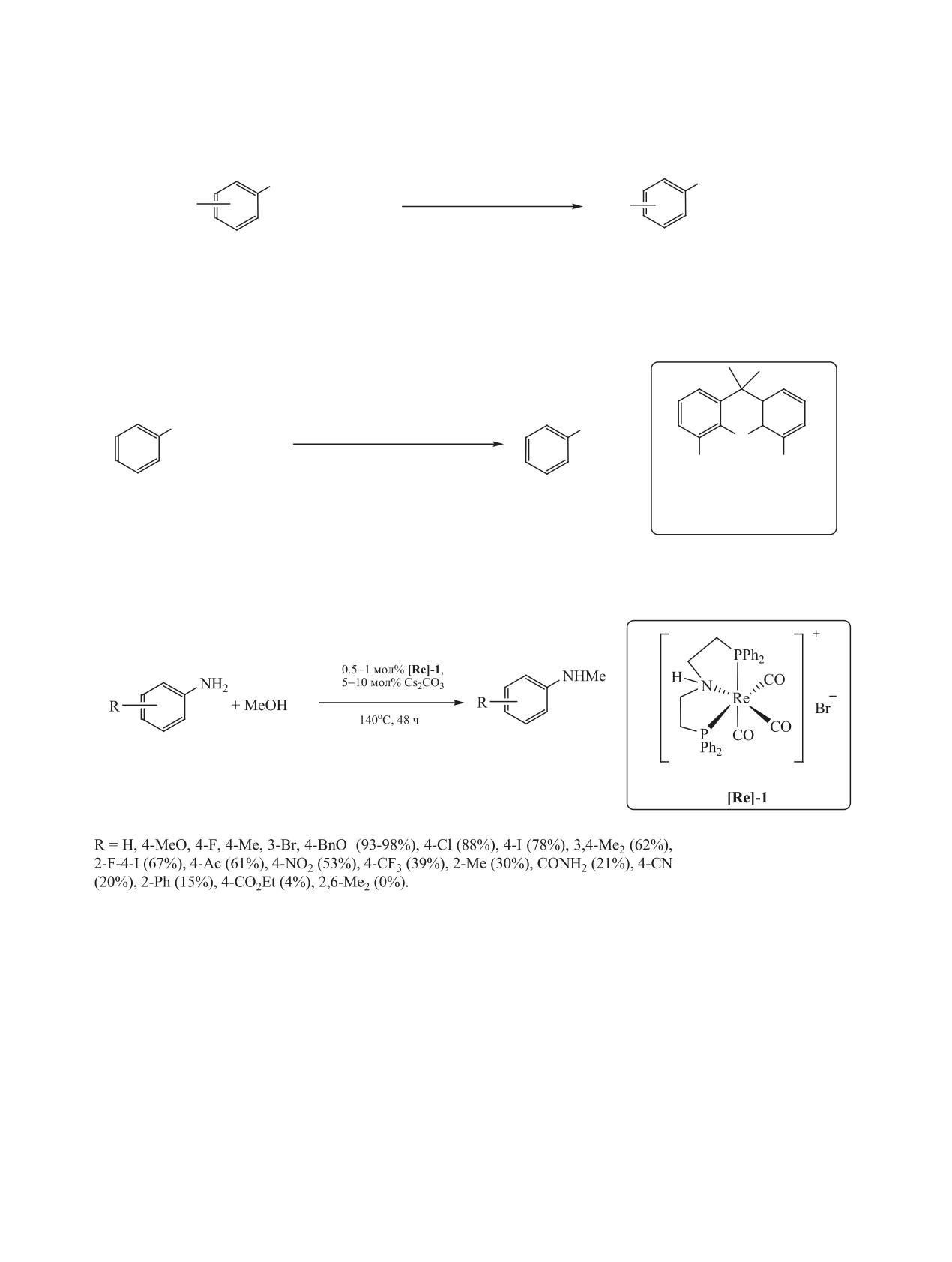
PdCl2-[Xantphos(But)] (L-8), нанесенный на сили-
[Re]-1, содержащий в координационной сфере
кагель (схема 58). При N-алкилировании аминов
тридентатный дифосфиноамино-лиганд, в присут-
для первого цикла TON для указанного комплекса
ствии основания. Под действием комплекса [Re]-1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
356
БАЙГУЗИНА, ХУСНУТДИНОВ
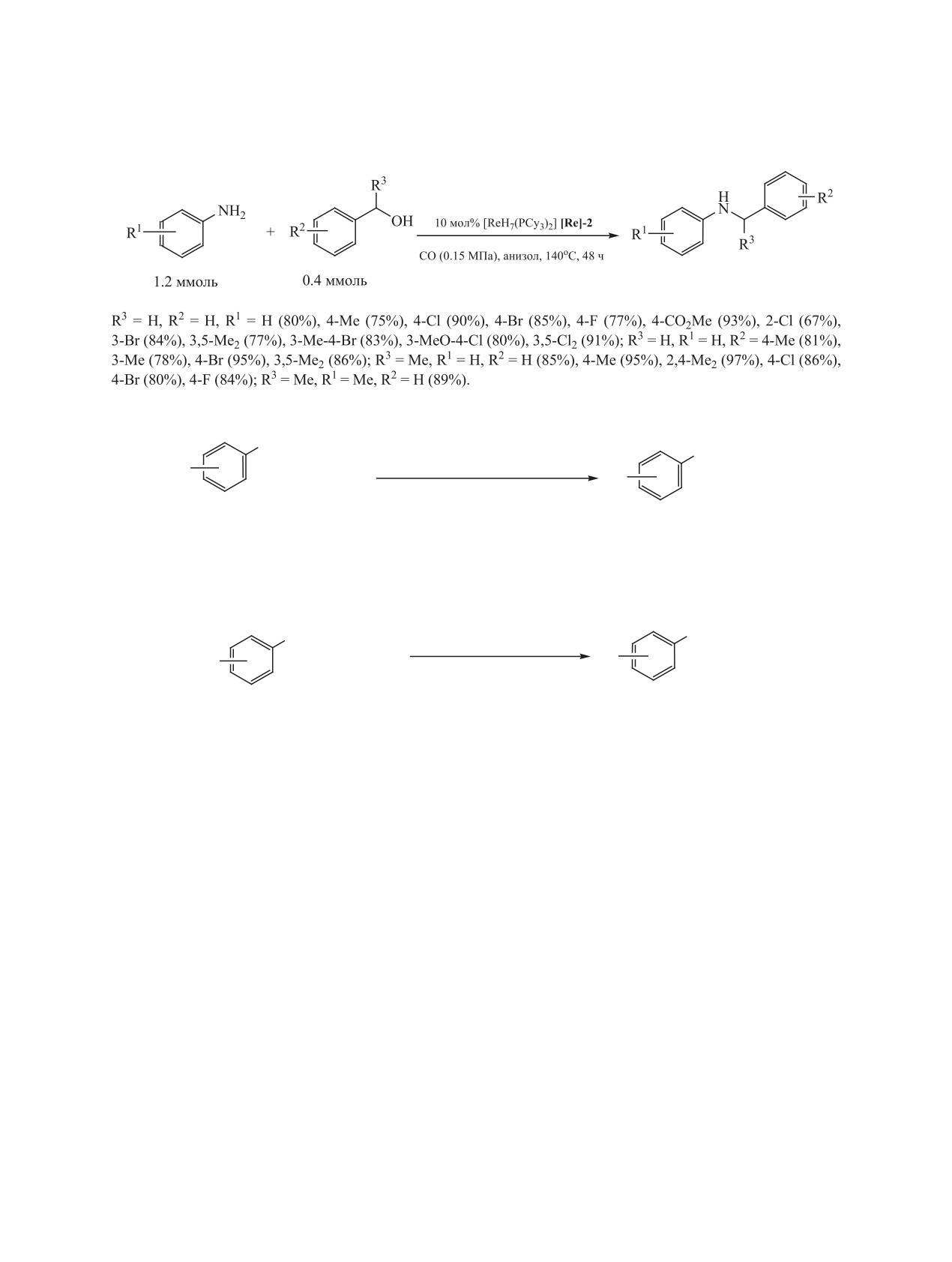
Схема 60.
Схема 61.
NH2
NHR2
3 мол% SmI2
R1
+ R2OH
R1
1 экв. ButOK, толуол, MW, 140oC, 1 ч
1.5 экв.
68-83%
R1 = H, 2,5-Me2, 4-F, 4-MeO, 4-Br; R2 = Bn, 4-MeC6H4CH2, 4-MeOC6H4CH2, 2,4-Cl2C6H3CH2.
Схема 62.
NH2
PhPAuCl/AgOTf (10%)
NHBn
R
R
+ BnOH
ButOCl, 1,4-диоксан, 100оС, 48 ч
72-90%
R = 4-Me, 2-Me, 4-MeO, 4-CF3O, 3-Cl, 4-Cl, Br.
в реакцию легко вступает большой круг замещен-
Образование N-алкиланилинов наблюдали в
ных анилинов при низких концентрациях ката-
реакции анилина с алифатическими спиртами в
лизатора (до 0.5 мол%) и основания (Cs2CO3, до
среде CCl4 под действием никельсодержащего ка-
5 мол%) (схема 59) [145].
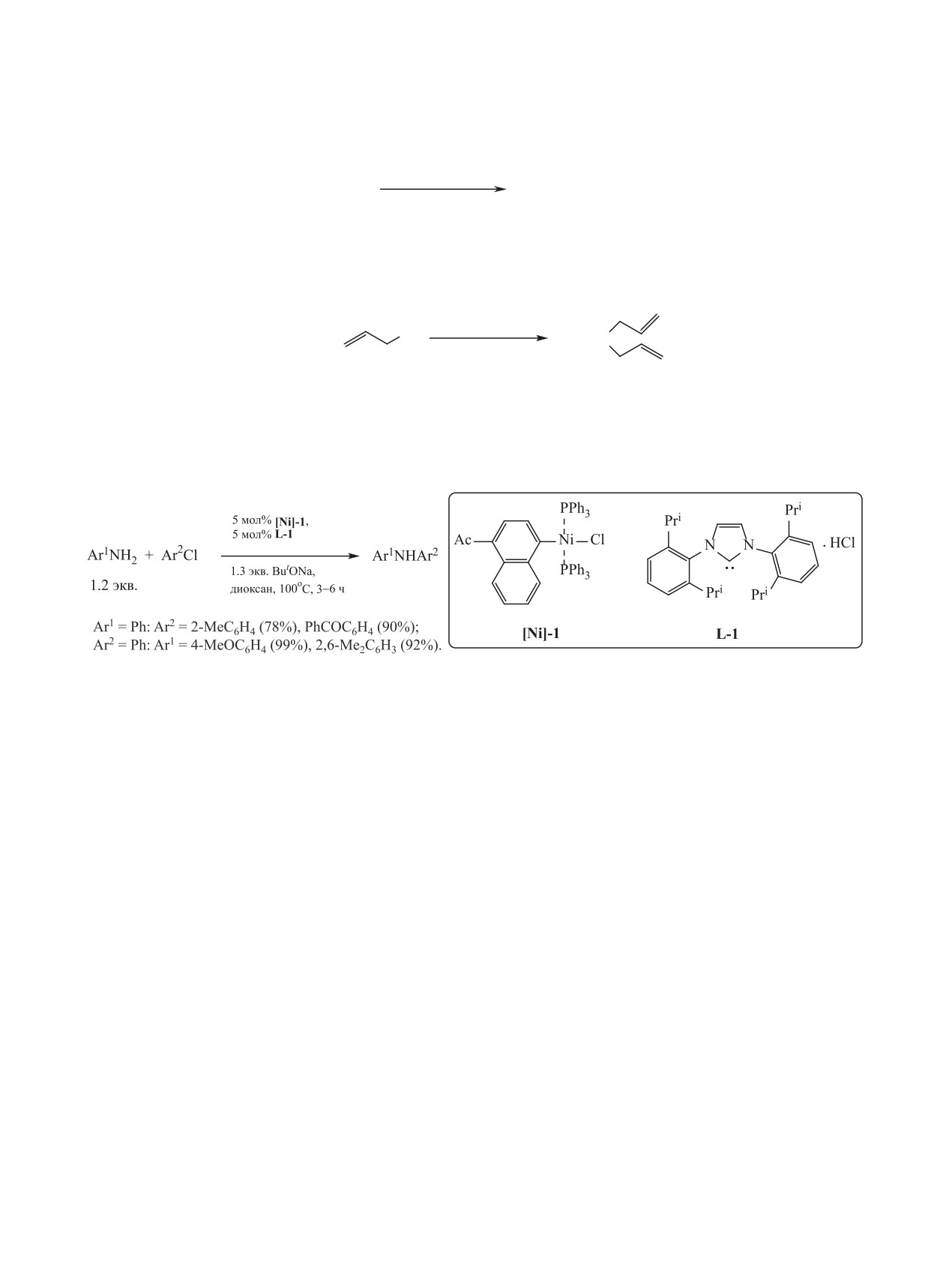
тализатора Ni(OAc)2·4H2О-Et3N (схема 63) [148].
Согласно авторам [144], N-алкилирование аро-
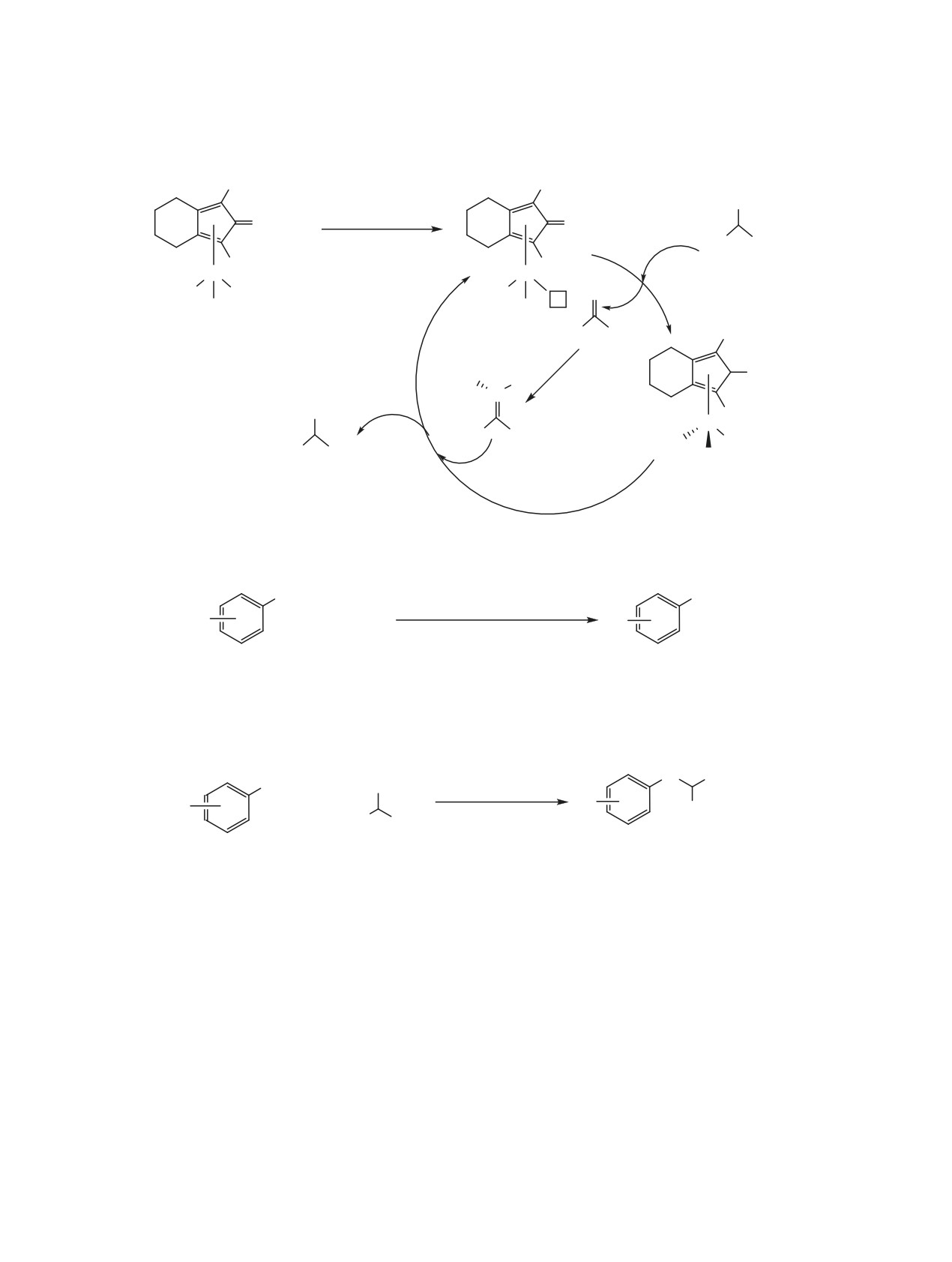
4. N-МЕТИЛИРОВАНИЕ АНИЛИНОВ
матических аминов бензиловым спиртом и его
ДИМЕТИЛКАРБОНАТОМ
производными катализирует гидридный комплекс
рения [Re]-2 (схема 60).
В последнее время необходимость создания
Иодид самария SmI2 (3 мол%) успешно исполь-
экологически малоопасных химических техноло-
зован для N-алкилирования анилинов бензиловым
гий вызывает большой интерес к диметилкарбона-
спиртом и его производными в условиях микро-
ту, как безопасному и «зеленому» метилирующе-
волнового облучения (схема 61) [146].
му агенту [8, 9, 149-151].
Высокая селективность (100°C, 48 ч) в реакции
Одна из проблем, которая ограничивает при-
N-бензилирования анилина и его производных c
менение диалкилкарбонатов и, в частности, ди-
помощью BnOH характерна Au/Ag-содержащей
метилкарбонат в качестве алкилирующих агентов
каталитической системе PhAuCl/AgOTf (схема 62)
заключается в том, что их использование должно
[147].
сочетаться с активными катализаторами, посколь-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
357
Схема 63.
R
Ni(OAc)2·4H2O-Et3N
+
+ CCl4 + RCH2CH2OH
R
R
135-145oC, 8 ч
N
N
NH2
конверсия 40-60%
26-29%
14-24%
R = H, Me, Et.
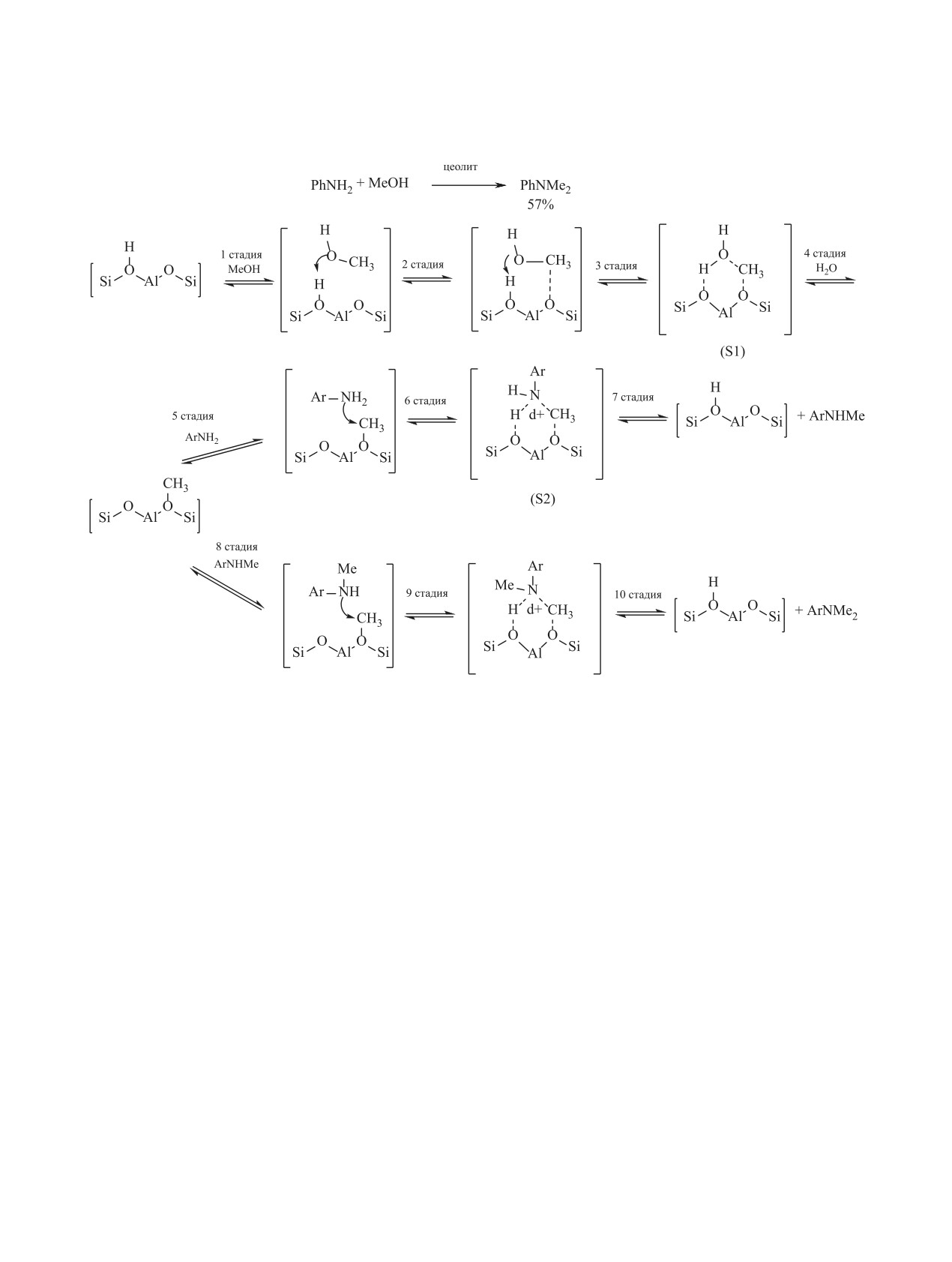
Схема 64.
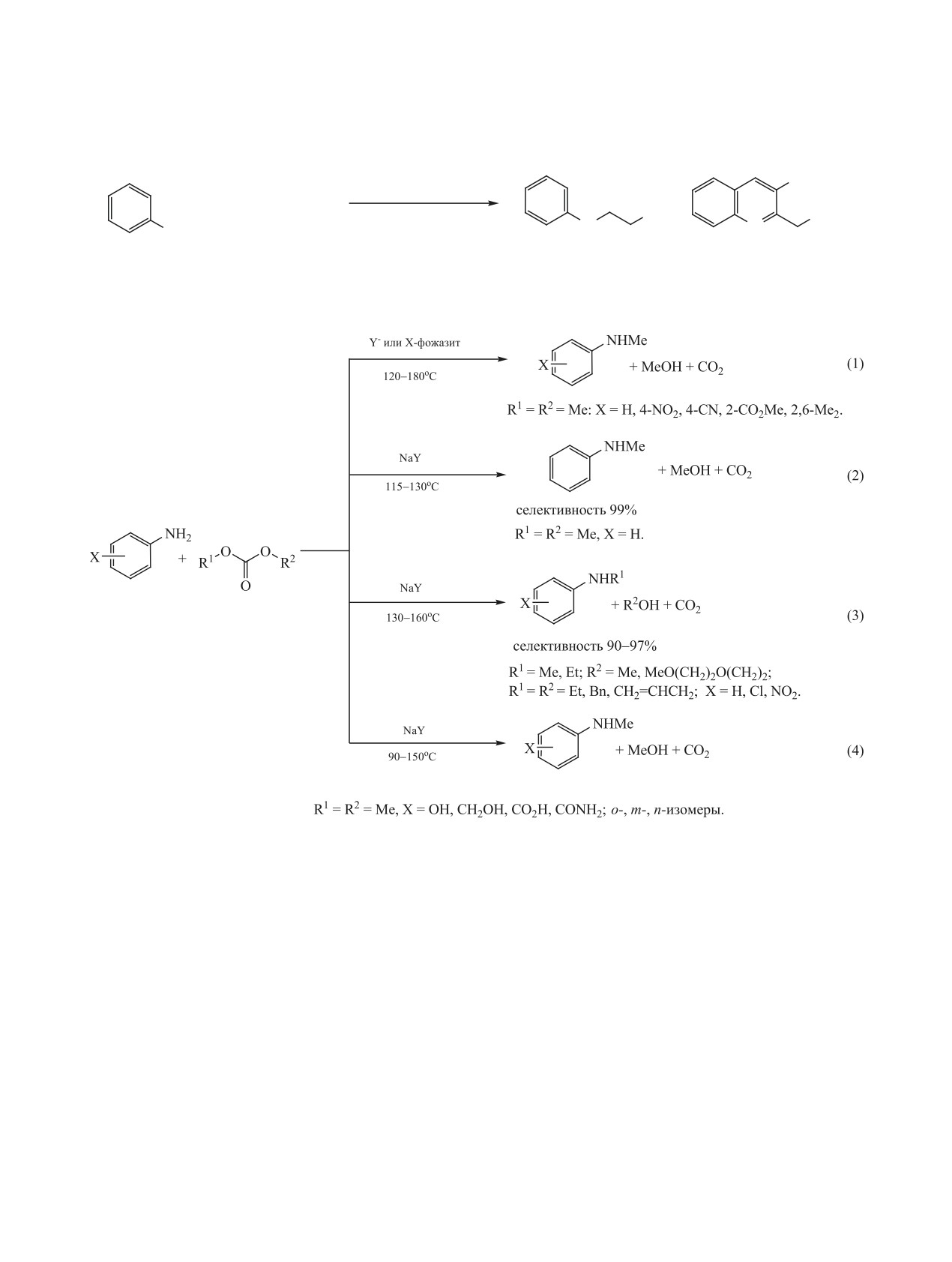
ку реакционная способность органических карбо-
В работах [150, 155-157] в качестве катализа-
натов при умеренных температурах значительно
тора N-алкилирования анилинов с помощью диме-
ниже, чем у алкилгалогенидов или диметилсуль-
тилкарбоната использованы цеолиты X и Y. При
фата.
этом селективность моно-N-метилирования соста-
вил 92-98% при конверсии анилина до 93%. Реак-
Еще одна проблема, связанная с использовани-
ции проводили как в проточном реакторе, так и в
ем диметилкарбоната, состоит в том, что реакции с
периодических условиях [схема 64, (1)].
его участием могут проходить в двух направлени-
ях: метилирование и карбоксиметилирование, что
Коммерчески доступный фожазит NaY ка-
является причиной низкой селективности реакции
тализирует N-алкилирование первичных аро-
по N-метилпроизводным [152, 153]. Поэтому для
матических аминов (п-XC6H4NH2, X = H, Cl,
проведения реакции диметилкарбоната и других
NO2) симметричными и асимметричными ди-
органических карбонатов с анилинами в направ-
алкилкарбонатами [R1OCOOR2, R1 = Me, R2 =
лении N-алкилирования необходимы селективные
MeO(CH2)2O(CH2)2; R1 = R2 = Et; R1 = R2 = бензил;
катализаторы [154].
R1 = R2 = аллил; R1 = Et, R2 = MeO(CH2)2O(CH2)2]
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
358
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 65.
NH2
NHMe
NMe2
cat (10 мас%)
+ MeOCO2Me
+
150oC, 1 ч
a
б
cat = 0.94 HY-БС (выход а/б 88/5%), NaY-БС (0/76%), 0.72 KNaX-БС (2/90%).
NH2
NHMe
FeHYmmm (5 мас%)
R
+ MeOCO2Me
R
120oC, 3 ч
R = H (99%), 4-Me (99%), 3-Me (92%), 2-Me (78%), 2-Cl (99%), 4-Cl (99%), 4-Br (99%), 4-NO2 (99%).
с высокой селективностью (90-97%) по моно-N-
Мезопористые алюмосиликаты МСМ-41, со-
алкиланилинам [схема 64, (2, 3)], благодаря ком-
держащие кислотные центры Льюиса (Zn2+, Sn4+,
бинированному молекулярно-ситовому эффекту и
Ti4+ и Zr4+), введенные ионным обменом были ис-
кислотно-основным свойствам цеолита [151].
пытаны для метилирования 2,4-диаминотолуола
Согласно [158, 159] в присутствии фожазита
диметилкарбонатом [163]. Реакция проходит с се-
NaY диметилкарбонат ведет себя как хемоселек-
лективным образованием N-монометилпроизвод-
тивный N-метилирующий агент по отношению
ного. Указанные катализаторы более активны, чем
к функционализированным анилинам, таким как
цеолит NaY. Считается, что повышенная эффек-
аминофенолы, аминобензиловые спирты, амино-
тивность указанных катализаторов обусловлена
бензойные кислоты и аминобензамиды. Реакция
сильными кислотными свойствами ионов метал-
протекает с исключительным образованием N-ме-
лов по сравнению с Na+ [163-165].
тиланилинов с селективностью до 99% при отсут-
Cелективному N-монометилированию анилина
ствии побочных процессов O-метилирования или
с помощью диметилкарбоната способствуют каль-
N-/O-метоксикарбонилирования. Диметилкарбо-
цинированные гидротальциты Mg-Al (Mg/Al = 3)
нат, который обычно способствует метилирова-
[166].
нию только при температуре >120°C, активируется
N-Метилирование анилина диметилкарбонатом
цеолитным катализатором NaY при 90°C. Реакции
в сверхкритическом CO2 в присутствии γ-Al2O3
с участием аминобензойных кислот проходят при
проходит ступенчато с образованием N-метилани-
более высокой температуре (≥130°C) [схема 64,
лина, а затем N,N-диметиланилина с количествен-
(4)] [160].
ным выходом. Реакцию проводят путем пропу-
Активными катализаторами N-метилирования
скания смеси анилина с диметилкарбонатом (1:1)
анилина с помощью диметилкарбоната являются
через слой γ-Al2O3 со скоростью 0.2 мл/мин, а CO2 -
цеолиты без связующего HY-БС, NaY-БС и KNaY-
со скоростью 1.0 мл/мин, при давлении в системе
БС. Так, реакция анилина с диметилкарбонатом
100 бар [167, 168].
(1:4) при 150°С в течение 1 ч в присутствии кис-
лотного катализатора 0.94HY-БС приводит к обра-
В работе [169] осуществлено N-метилирова-
зованию N-метиланилина и N,N-диметиланилина
ние анилинов диметилкарбонатом в присутствии
с выходами 88 и 5% соответственно [161]. В ра-
ZrOCl2·8H2O. Диметилкарбонат, который реаги-
боте [162] осуществлено селективное метилиро-
рует с анилинами при повышенной температуре
вание анилина и его производных диметилкарбо-
>120°С), в присутствии оксихлорида циркония
натом под действием железосодержащего микро-,
метилирует анилины при 90°С в аэробных усло-
макро- и мезопористого цеолита FeHY-mmm с по-
виях. Селективность по N-монометиланилину со-
лучением N-монометиланилинов (схема 65).
ставила 50-100% при конверсии анилина 40-85%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
359
Схема 66.
0.2 мол% Ru(acac)2, 3 мол% L-9,
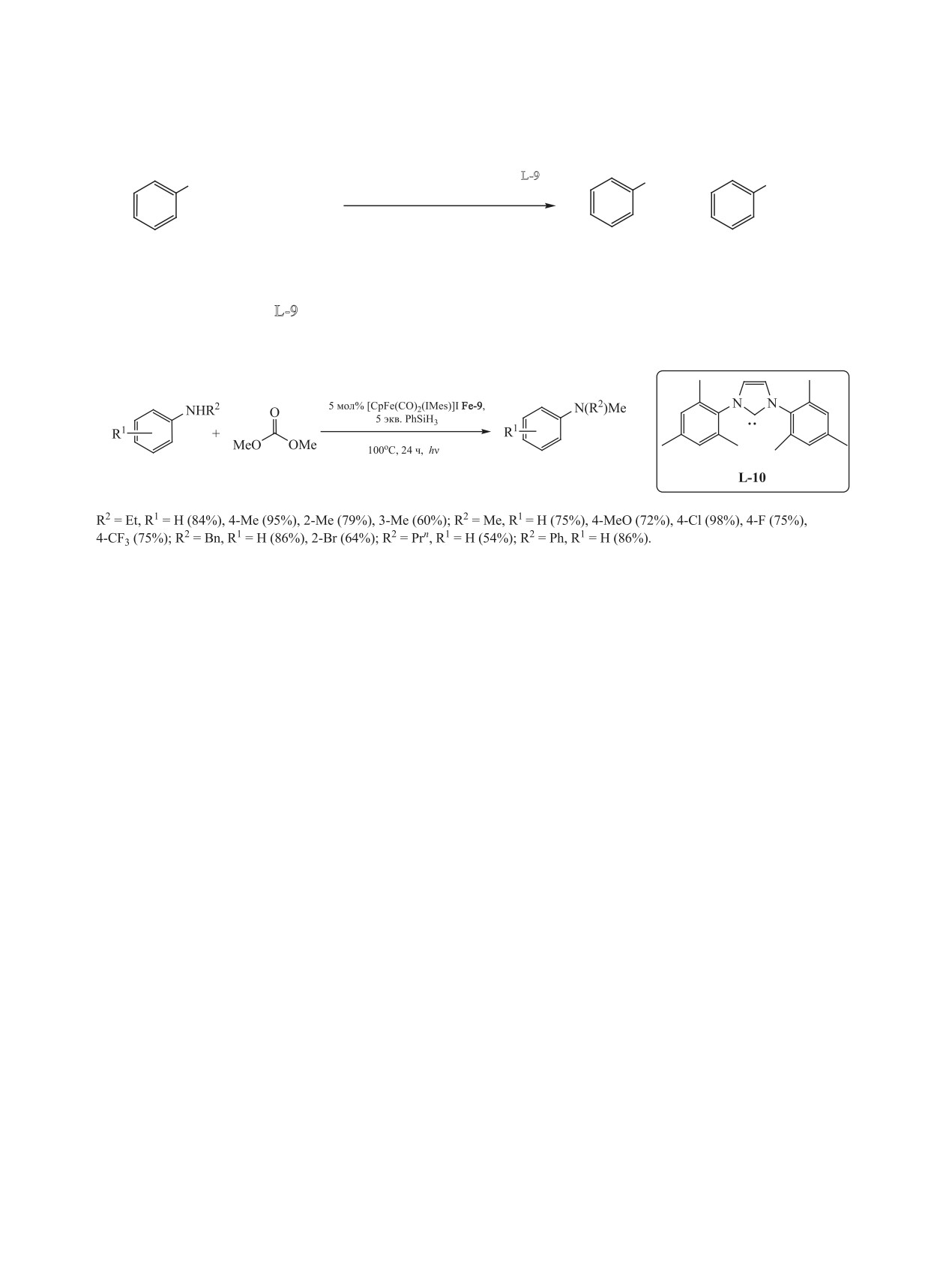
NH2
NHMe
NMe2
5 мол% добавка
+ MeOCO2Me
+
ТГФ (2 мл), H2 (6 МПа),150оС, 18 ч
0.05 ммоль
1-6 экв.
3-48%
9-95%
добавка = CH3CO2H,CF3CO2H, MeSO3H, р-TsOH, HOTf, HNTf2, LiNTf2, LiCl; растворитель = диоксан,
ТГФ, PenttOH, Bun2O; L-9 = 1,1,1-три(дифенилфосфинометил)этан (Triphos).
Схема 67.
Каталитическая активность ZrOCl2·8H2O остается
(150°С, 18 ч) и приводит к образованию N-ме-
неизменной по меньшей мере после восьми по-
тил- и N,N-диметиланилинов с выходом до 95%
вторных опытов.
(схема 66).
Согласно работе [165], селективными и актив-
Комплекс железа [Fe]-9, содержащий в коор-
ными катализаторами в N-метилировании арома-
динационной сфере N-гетероциклический карбе-
тических аминов диметилкарбонатом являются
новый лиганд - IMes = 1,3-бис-(2,4,6-триметили-
соли алюминия с терефталевой, железа и меди c
фенил)имидазол-2-илиден (L-10) способствует
1,3,5-бензолтрикарбоновой кислотами. При этом
N-метилированию диметилкарбонатом вторичных
основным направлением реакции является N-ме-
аминов в присутствии донора водорода PhSiH3
тилирование, которое превалирует над карбамои-
(схема 67) [170] .
лированием.
В работах [171, 172] приведен вероятный меха-
Активно катализируют N-метилирование ани-
низм реакции N-метилирования анилина с помо-
линов с помощью диметилкарбоната металлорга-
щью диметилкарбоната (схема 68).
нические каркасные образования (MOF), представ-
Диметилкарбонат успешно использован для
ляющие собой твердые материалы с бесконечно
N-алкилирования N-метиланилинов под действи-
протяженными кристаллическими структурами,
ем комплекса платины [Pt]-1 (схема 69) [173].
сформированными путем сшивания органических
лигандов и ионов металлов или кластеров через
5. ВОССТАНОВИТЕЛЬНОЕ
координационные связи [165].
N-МЕТИЛИРОВАНИЕ АНИЛИНОВ
С ПОМОЩЬЮ ФОРМАЛЬДЕГИДА
В литературе имеется несколько примеров ис-
пользования металлокаркасных катализаторов для
В литературе описаны способы получения
метилирования анилина и его производных ди-
N-алкилиланилинов восстановительным N-алки-
метилкарбонатом [170, 171]. Так, в работе [171]
лированием анилина и его производных альдеги-
осуществлено метилирование анилина диметил-
дами, в частности, формальдегидом. Так, в работе
карбонатом, катализируемое комплексом рутения
[174] осуществлено восстановительное N-мети-
в атмосфере водорода в качестве восстановителя.
лирование аминов формальдегидом и гидридом
Реакция проходит при повышенной температуре
кальция в качестве донора водорода (60 мол%) в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
360
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 68.
O
cat
PhNH2
N
+
O O
Ph
H
2
O
H2
O O
+ PhNH2
H
N
MeOH
Ph
-H2O
H2
-H2O
O
H
N
O
H+, H2
+ PhNH2
H
Ph
H O
N
O
-PhNH2
Ph
O
-MeOH
H
H+, H2
+ PhNH2
H
H
N
N
Ph
R
O
PhNH2
MeOH
Схема 69.
присутствии Pd/C (2 мол.) в толуоле. При 60°С за
В аналогичных условиях в присутствии [Ru]-3
16 ч конверсия анилина составила 84%, а соотно-
легко алкилируются N-метиланилины (схема 70).
шение N-монометиланилина к N,N-диметилани-
Известен пример N-алкилирования анили-
лину - 85:15. Однако использование дорогосто-
нов с альдегидами в присутствии Pd/C с участи-
ящего CaH2 в качестве восстановителя, который
ем формиата аммония как источника водорода. В
нерастворим в анилине, значительно снижает при-
частности, реакция анилина с формальдегидом и
влекательность этого метода для практического
HCO2NH4 приводит к N-метиланилину с выходом
применения.
45% (схема 71) [176].
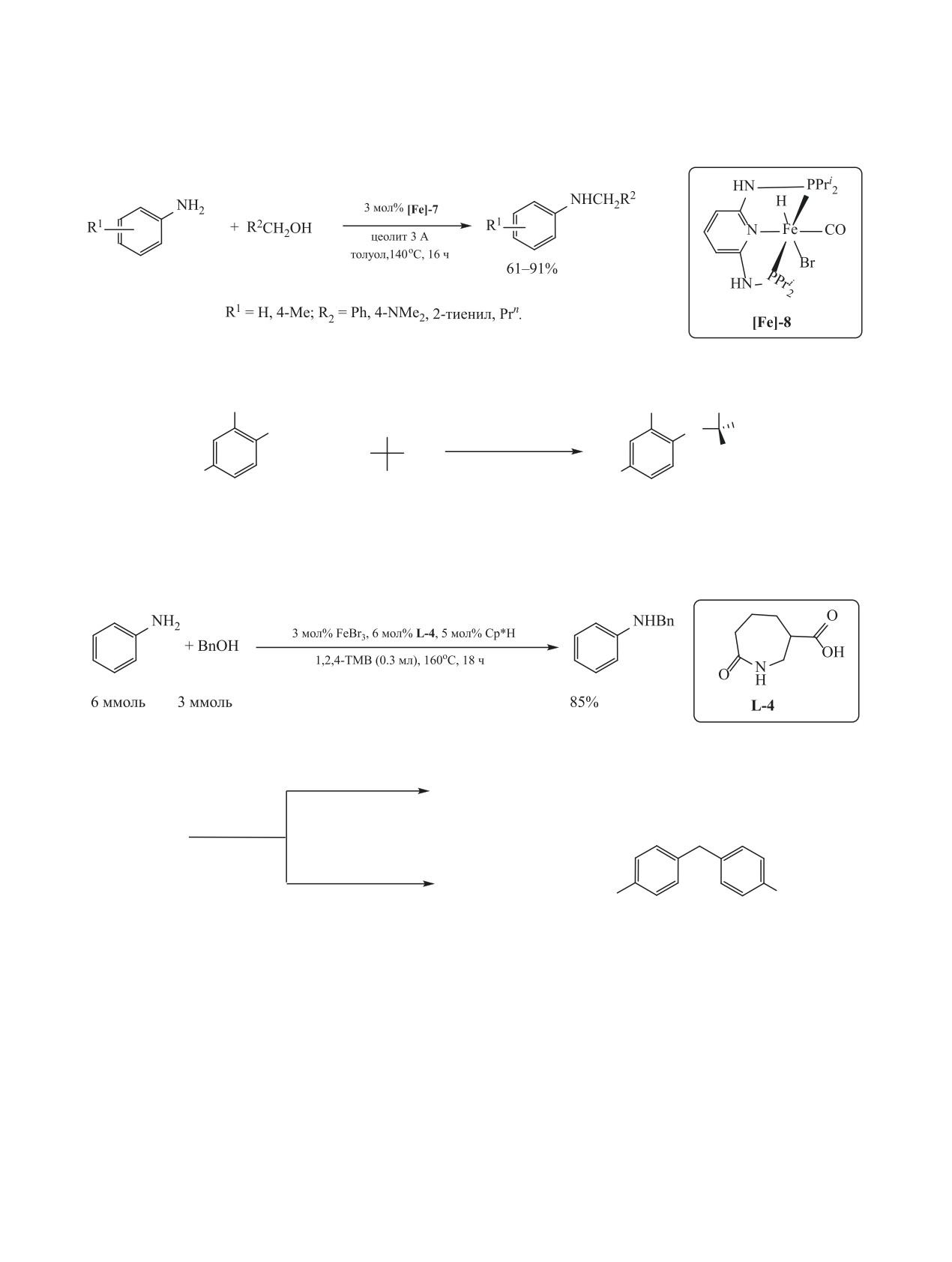
Комплекс [RuCl2(p-cymene)]2 [Ru]-3 в сочета-
N-Монометилирование анилинов параформаль-
нии с Ph2SiH2 очень эффективен для восстанови-
дегидом и молекулярным водородом (0.5 МПа) ка-
тельного N-алкилирования анилина альдегидами с
тализирует CuAlOx [177]. Выход N-метиланилина
получением вторичных аминов с хорошим выхо-
дом. Реакция проходит в мягких условиях (20°С,
составил 89% (120°С, 9 ч). Аналогичная реакция
4 ч) с высокой хемоселективностью. Катализатор
анилина и м-аминофенола с параформальдегидом
[Ru]-3 толерантен к широкому спектру функцио-
в присутствии никеля Ренея (6 мас%) в токе водо-
нальных групп в молекулах обоих субстратов, та-
рода (1.7 МПа) проходит в более жестких услови-
ких как Me, Ph, NO2, CO2Me, F, Cl, Br, OMe [175].
ях (180°С, 8 ч) [178]. Выход N,N-диметиланилина
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
361
Схема 70.
NH2
2 мол% [RuCl2(p-cymene)]2 [Ru]-3,
NHCH2R2
O
1.5 экв. Ph2SiH2
R1
+
R1
R2
H
CH2Cl2, MS 4A, 20oC, 4 ч
1.1 экв.
70-86%
R1 = H, 4-Me, 4-Br, 2-F; R2 = 4-NO2C6H4, Ph, 4-MeC6H4, But, 4-MeO2CC6H4.
Схема 71.
NH2
0.1 экв. Pd/C, 10 экв. HCO2NH
NHCH2R2
4
R1
+ R2CHO
PriOH/H2O (10:1), 10-60 мин
45-100%
R1 = H, 2-Me, 3-Me, 4-Me, 2-MeO, 3-MeO, 4-MeO, 4-F, 4-CF3, 4-CO2H, 4-CO2Et, 4-OH;
R2 = H, Me, Et, Prn, Pri, But, CH2CHMe2, Pentn, c-Pent, Cy, CH2CH2Ph, Ph, 4-MeC6H4, 4-MeOC6H4, Bun.
Схема 72.
Br
CO
N
NH2
NHR2
(1) EtOH, 100oC, 24 ч
Mn
HN
R1
+ R2CHO
R1
CO
P
(2) 2 мол% [Mn]-8, 5 мол% ButOK,
Ph2
CO
H2 (5 МПа), 50-100oC, 18-48 ч
72-98%
[Mn]-8
R1 = Ph, 4-MeOC6H4,4-MeC6H4, 4-IC6H4; R2 = Bn, 2-MeC6H4CH2, 4-MeOC6H4CH2, 3-FC6H4CH2.
и N,N-диметил-3-гидроксианилина составил 65 и
анилинов с помощью кетонов сложного строения
21% соответственно.
и водорода с образованием оптически активных
В работе [179] осуществлено N-алкилирование
аминов (схема 73) [181].
замещенных анилинов с помощью альдегидов и
6. N-МЕТИЛИРОВАНИЕ АНИЛИНОВ
молекулярного водорода в присутствии пириди-
С ПОМОЩЬЮ CO2 И ВОДОРОДА
нилфосфинового комплекса марганца в качестве
катализатора (схема 72). Очевидно, что начальной
Разработка новых синтетических подходов,
стадией процесса является конденсация анилинов
направленных на утилизацию диоксида углерода,
с альдегидами с образованием иминов, которые
является одной из важнейших задач химиков-син-
восстанавливаются водородом до амина.
тетиков. В последние годы активно проводятся
Согласно работе
[180], реакция анилина с
работы по восстановительному N-метилированию
бензальдегидом и донором водорода - 2,6-диме-
аминов, в частности анилина и его производных,
тил-3,5-дикарбоэтоксидигидропиридином - в при-
с помощью диоксида углерода и молекулярного
сутствии Ph3PAuCl-AgOTf приводит к образова-
водорода (или его доноров) в присутствии гетеро-
нию N-бензиланилина с выходом 95%.
генных и металлокомплексных катализаторов на
Комплекс иридия [Ir]-17 в присутствии хираль-
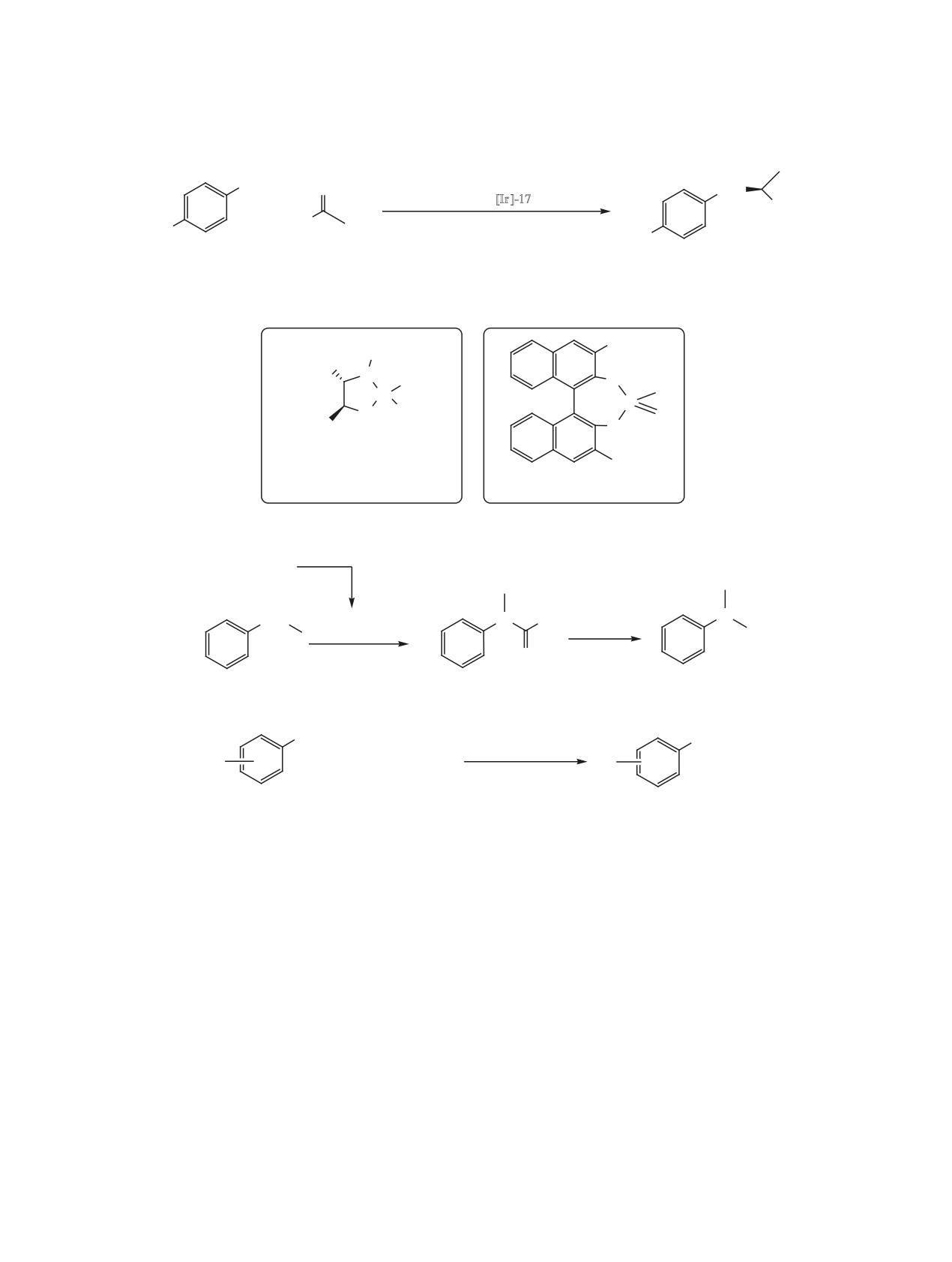
основе Pd, Ru, Rh, Cu, Re и Au [10, 11, 22, 182-
ной фосфорной кислоты 5 катализирует восста-
186]. Так, кластер Pd/CuZrOx катализирует N-ме-
новительное N-алкилирование широкого спектра
тилирование анилина с помощью СО2 (1 МПа) и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
362
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 73.
NH2
O
NH
1 мол% [Ir]-17
+
R2
2
R
R1
H2 (0.5 МПа), толуол, MS 4A, 35oC, 12-24 ч
R1
R1 = H, R2 = 4-MeOC6H4 (92%, ee 91%), Pentn (83%, ee 92%), ñ-Pr (91%, ee 92%);
R1 = Cl, R2 = Ph (86%, ee 87%).
1
Ar
SO2Ar
Ph
N
Cp*
O
Ir
OH
P
X
X=
N
O
Ph
H
O
2
[Ir]-17
Ar1
Ar = 2,3,4,5,6-(Me)5C6
Ar = 2,4,6-(Pri)3C6H2
Схема 74.
CO2 + H2
PdGa/TiO2
NH
N
H
N
HCOO-
H2
O
Схема 75.
NH2
NMe2
2 мол% Re/TiO
2
R
+ CO2 + H2
R
200 oC, 24-36 ч
1 MPa
5 MPa
78-98%
R = H, 4-Me, 4-MeO, 3-Me.
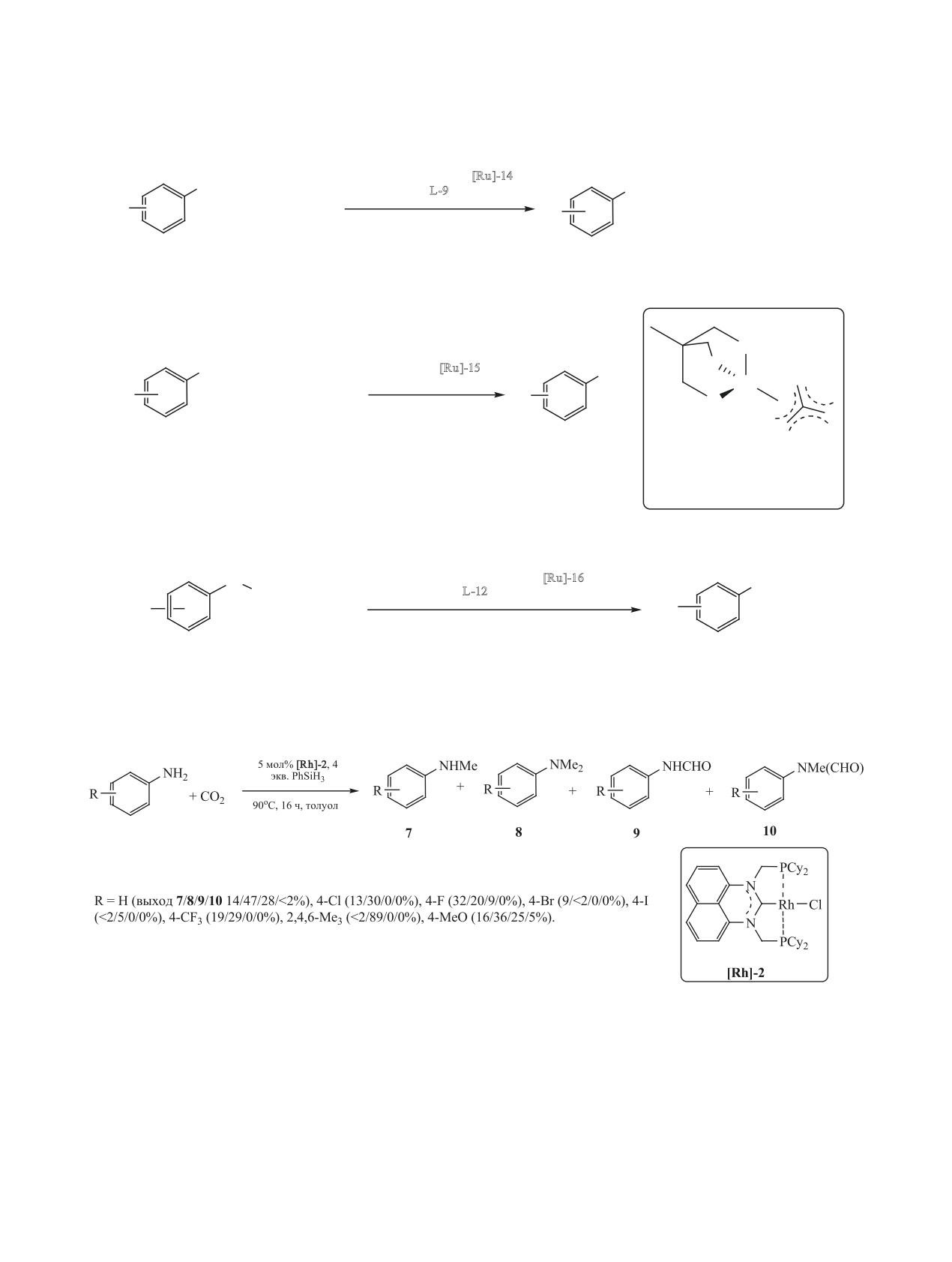
молекулярного водорода (2.5 МПа) в среде октана
В работе [190] осуществлен синтез N-мономе-
при 150°С в течение 30 ч. Выход монометиланили-
тиланилина (21%) и N,N-диметиланилина (65%)
на составил 75% [187].
под действием Au/Al2O3 (0.5 мол%) с использова-
нием CO2 (2 МПа) в качестве прекурсора метиль-
Эффективным катализатором для прямого мети-
лирования N-метиланилина с помощью CO2/H2 до
ной группы и молекулярного водорода (6 МПа).
N,N-диметиланилина является PdGa/TiO2 (схема 74).
Реакция проходит в среде гексана при 140°С за 7 ч.
Конверсия анилина в его присутствии в условиях
Эффективными катализаторами N-метили-
180°C, 5 МПа H2, 5 МПа CO2, 10 ч составила 98%,
рования анилинов с помощью CO2/H2 являются
селективность по N,N-диметиланилину - 94% [188].
комплексы рутения Ru(acac)3 [Ru]-14 - triphos L-9
Металлический рений, нанесенный на TiO2,
[184] и [Ru(triphos)(tmm)] [Ru]-15 (схема 76) [185].
катализирует N-метилирование анилинов с помо-
Так, в работе [184] осуществлено N-метилирова-
щью CO2 и H2 в жестких условиях за продолжи-
ние анилинов помощью CO2 и H2 в присутствии
тельное время (схема 75) [189].
каталитической системы Ru(acac)3-triphos L-9 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
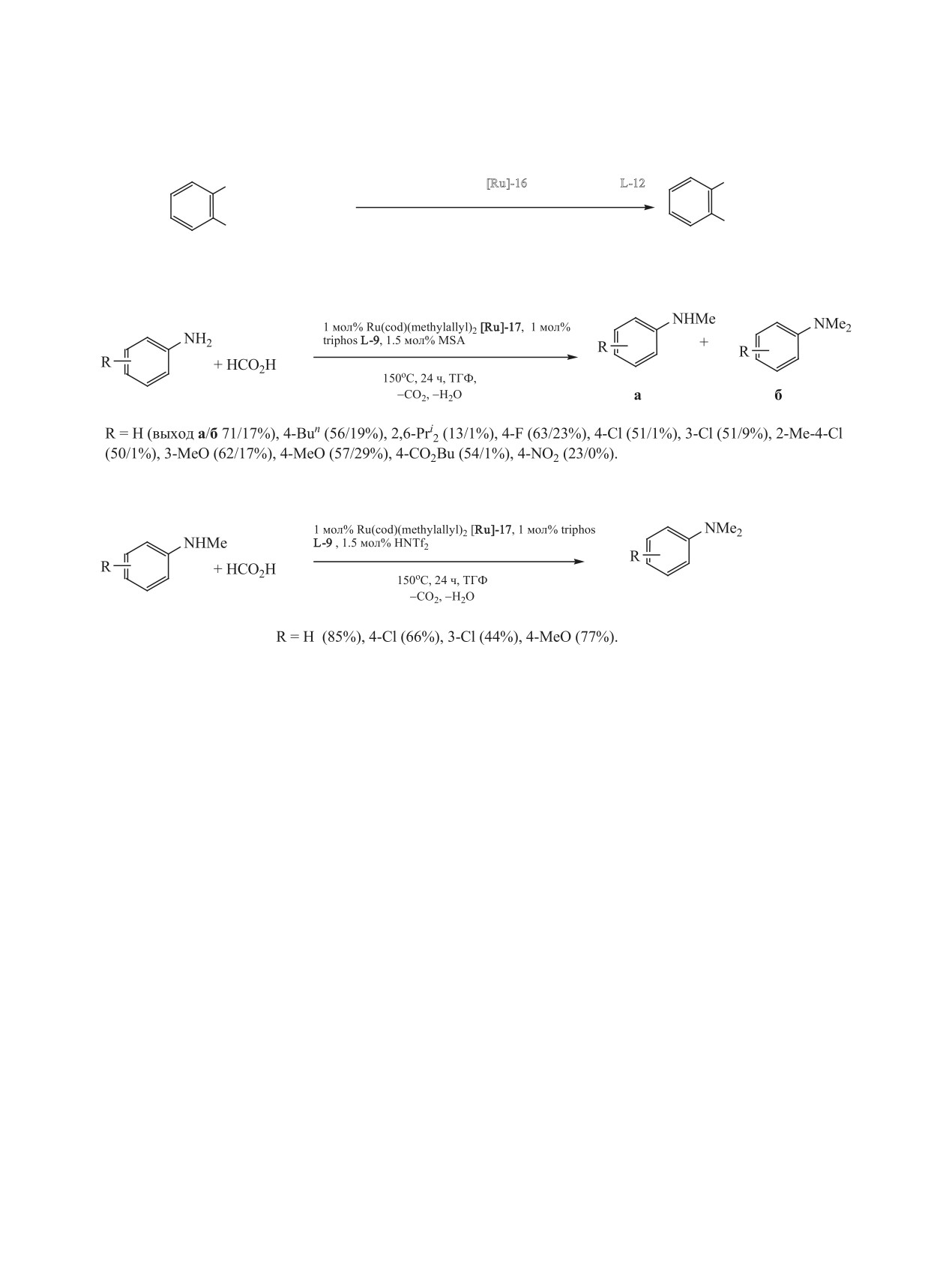
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
363
Схема 76.
1 мол% [Ru(acac)3] [Ru]-14,
NH2
2 мол% triphos L-9, 1.5 мол% MSA
NHMe
R
+ CO2
+ H2
R
TГФ, 140 oC, 5 ч
2 МПа
6 МПа
-H2O
R = H (35%), 4-MeO (90%), 4-Me (69%), 4-F (39%), 4-Cl (15%), 4-Br (13%).
PPh2
2.5 мол% [Ru]-15,
Ph2P
NH2
NMe2
5 мол% HNTf
2
Ru
R
+ CO2 + H2
R
P
ТГФ, 150 oC, 10-24 ч
Ph2
2 МПа
6 МПа
84-94%
[Ru(triphos)(tmm)]
R = H, 4-Cl, 3-CF
3-4-Me, 4-F, 2,4,6-Me3.
[Ru]-15
Схема 77.
H
2 мол% [RuCl2(dmso)4] [Ru]-16,
N
NR2Me
2
4 мол% BuPAd2 L-12, PhSiH3 (4 экв. к анилину)
R
R1
+ CO2
R1
толуол, 100oC, 10-36 ч
0.5 ммоль
3 МПа
71-97%
R1 = H, 4-Cl, 2-CF3, 4-CN, 2,6-Pri2; R2 = Bn, Me, Ph, Allyl.
Схема 78.
кислотных добавок или LiCl. Реакция проходит в
Восстановительное метилирование анили-
достаточно жестких условиях: 140°C, 5 ч при дав-
нов и метиланилинов с помощью СO2 в условиях
лении водорода 6 МПа и СО2 - 2 МПа. Комплекс
(100°С, 10 ч) удалось осуществить в присутствии
Ru-содержащих металлокомплексных катализато-
рутения [Ru(triphos)(tmm)] [Ru]-15 в аналогичных
условиях способствует двойному N-метилирова-
ров [Ru]-16 с использованием в качестве донора
ние анилинов и его производных [185].
водорода фенилсилана (схема 77) [183].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
364
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 79.
NHMe
2 мол% RuCl2(dmso)4 [Ru]-16, 4 мол% BuPAd2 L-12,
NMe2
4 экв. PhSiH3 (к амину)
+
CO2
толуол, 100oC
NH2
NMe2
0.05 ммоль
63%
Схема 80.
Восстановительное N-метилирование первич-
тоформиатом, ацетонитрилом, а также переами-
ных, вторичных, ароматических и алифатических
нированием. Разработан метод N-метилирования
аминов с помощью CO2 и фенилсилана катализи-
анилинов с использованием муравьиной кислоты
руют также комплексы Rh(I) [Rh]-2, имеющие в
и водорода в присутствии рутениевых(II) катали-
составе карбеновый лиганд (NHC) на основе пи-
заторов [Ru]-17 (схема 80) [192].
римидина. Реакция проходит неоднозначно из-за
В работе предложен вероятный механизм реак-
образования наряду с метилпроизводными фор-
ции, согласно которому образование группы NCH3
милпроизводных 9, 10 [191]. При увеличении кон-
происходит в несколько стадий, включающих ка-
центрации PhSiH3 до 8 экв. удается повысить се-
тализируемое комплексом родия [Ru]-17 разложе-
лективность реакции по монометилпроизводным
ние HCOOH с образованием CO2 и H2, формили-
7 для анилина, 2,4,6-триметиланилина и 4-меток-
рование и перенос водорода (схема 81).
сианилина до 99%, за счет снижения доли N-фор-
Известен метод N-алкилирования анилина и его
миланилинов 9 и 10 до 0% (схема 78).
производных карбоновыми кислотами. В частно-
Каталитическая система RuCl2(dmso)4 [Ru]-16-
сти, N-алкилирование анилинов с использованием
BuPAd2 L-12 способствует исчерпывающему ме-
RCOOH и фенилсилана в качестве восстановите-
тилированию N-метил-о-фенилендиамина с помо-
ля катализирует карбонильный комплекс железа
щью диоксида углерода и гидрирующего агента -
Fe2(CO)9 (схема 82) [193].
фенилсилана (схема 79) [183].
На схеме 83 приведен возможный механизм
7. НЕОБЫЧНЫЕ РЕАКЦИИ
реакции, согласно которому образование N-ал-
N-АЛКИЛИРОВАНИЯ АНИЛИНОВ
килпроизводных происходит по двум маршру-
В литературе известны методы получения
там. Первый маршрут начинается с амидирования
N-алкиланилинов алкилированием анилина ор-
кислоты. Процесс завершается восстановлением
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
365
Схема 81.
Ru
HCO2H
CO2 + H2
PhNHMe
Ru
H2O
HCO2 or H2
CO2 + H2O
H
O
Ru
Me
Me
CH3
Me
N H
N
N H
Ru
Ph
Ph
Ph
HCO2H
Схема 82.
NMe2
NH2
5 мол% Fe2(CO)9
R
+ HCO2H
R
3 ммоль PhSiH3,
100oC, 12 ч, толуол
0.5 ммоль
1.5 ммоль
R = H (70%), 4-F (28%), 4-Cl (57%), 4-Br (50%), 4-Me (53%).
NHR2
NR2Me
9
5 мол% Fe2(CO)
R1
+
HCO2H
R1
1.5 ммоль PhSiH
3,
100oC, 1 ч, толуол
0.5 ммоль
0.75 ммоль
R2 = Me, R1 = H (92%), 4-Me (89%), 4-MeO (90%), 4-F (88%), 4-Cl (94%), 2-MeO2C (8.4%);
R1 = H, R2 = Et (81%), Pri (61%), Bn (66%), Allyl (83%), CH2CH2OH (64%).
Схема 83.
R1NH2 + RCOOH
маршрут II
маршрут I
+H2O
PhSiH
3
O
−H2O
O
PhH2SiO
OSiH2Ph
R1HN R
R1NH2 +
R H
R
амид
H
+H2O
PhSiH
3
восстановление
-H2O
R1HN R
R1N R
восстановление
основание Шиффа
амида с помощью PhSiH3. Второй маршрут пред-
Шиффа. Можно предположить, что основная роль
усматривает восстановление кислоты до альдеги-
Fe2(CO)9 заключается в катализе стадий восста-
да, который реагирует с амином, давая основание
новления амида, кислоты и основания Шиффа.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
366
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 84.
NHR2
NR2Me
5 мол% Cu(OAc)2, 3 экв. PhSiH3
R1
+
HCO2H
R1
80oC, 8 ч, Bu
2O
1.5 экв.
R2 = Me, R1 = 4-MeO (92%), 4-Cl (87%), 4-NO2 (0%); R1 = H, R2 = Bn (86%), CH2CH2OH (81%).
Схема 85.
NHR2
NMe2
[Pt(CH2=CHSiMe2)2O]
[Pt]-1/dppp (1:1)
R1
+ HCO2H
R1
O
PhSiH3, 20°C, 18 ч, Bun2
R2 = H, R1 = H, 4-F, 4-Cl, 4-Br, 4-SMe, 3-Cl, 2-Cl, 2,5-Me2, 2,5-Pri2, 2-Ph (86-99%); R2 = Me,
R1 = 4-MeO, 3-MeO, 4-CO2Me, 2-CF3 (71-94%). dppp = 1,3-бис(дифенилфосфино)пропан.
Схема 86.
NH2
NMe2
0.3 мол% Pt/C, 5 экв. PhSiH3
R
+ HCO2H
R
толуол, 80oC, 15 ч
0.3 ммоль
3 экв.
R = 4-Cl (96%), 2,4,6-Me3 (36%), 2-SMe (96%), 4-MeO (95%).
Me
H
N
N
0.1 мол% Pt/C, 2.5 экв PhSiH3
R2
R2
+ HCO2H
R1
R1
толуол, 80oC, 15 ч
0.3 ммоль
2 экв.
R1 = H, R2 = Et (76%), Pri (64%), Ph (72%), CH2CH2OH (86%), CH2CH2CN (55%); R2 = Me, R1 = 4-Me
(80%), 3-Me (69%), 3-Cl (93%), 4-CO2Et (91%), 4-NO2 (61%), 4-Br (79%), 4-MeO (74%).
Восстановительное метилирование вторичных
В работе [197] N-метиланилин был получен
аминов с помощью муравьиной кислоты и фенил-
двухстадийным методом: на первой стадии анилин
силана катализирует ацетат меди(II) (схема 84)
реагирует с триэтилортоформиатом под действием
[194].
мезопористого цеолита MCM-41-SO3H с образова-
Разработан метод N-метилирования анилинов
нием промежуточного этил-N-фенилформимидата
под действием платиновых катализаторов [Pt]-1 с
8, который на второй стадии восстанавливается с
использованием муравьиной кислоты и силанов в
помощью NaBH3(OAc) (схема 87).
качестве восстановителя (схема 85). Реакция про-
В работе [198] осуществлено селективное мо-
ходит в мягких условиях (20-60°C, 18 ч) [195].
но-N-алкилирование анилина и его производных
Высокодисперсная металлическая платина, на-
с помощью диалкилфосфитов под действием со-
несенная на активированный уголь, катализиру-
единений меди, железа, цинка и индия (схема 88).
ет N-метилирование анилина, его производных и
Селективность реакции по моно-N-алкиланилину
N-алкиланилинов муравьиной кислотой в присут-
в значительной степени повышается при заме-
ствии восстановителя PhSiH3 (схема 86) [196].
не обычного нагрева на микроволновое излуче-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
367
Схема 87.
OEt
MCM-41-SO3H
NaBH3(OAc)
Ar NH2
+ HC(OEt)3
Ar N CH
Ar NHMe
3 ч
ТГФ, 3 ч
8
93%
Схема 88.
2
NHR
NH2
5 мол% cat
)2
+ HPO(OR2
MW, 120oC, 20-30 мин
R1
R1
1:0.6
R1 = Me, R2 = Et, cat = CuCl2 (17%), FeCl3 (5%), InCl3 (50% + 10% диалкиламна), ZnCl2 (20%),
Cu(OTf)2 (59%), In(OTf)3 (87%), Zn(OTf)2 (44% + 20% диалкиламина); cat = In(OTf)3,
R1 = H, Me, MeO, Cl, Br, I, CN, NO2, R2 = Me, Et, Prn (61-91%)
Схема 89.
In(OTf)3
PhNHR
PhNHR
O
OH
OH
R
H P O
O P
H
HO P
H
R
O
O
O
R
In(OTf)3
PhNH2
PhNH2
Схема 90.
ние. На схеме 89 приведен возможный механизм
Аналогичную реакцию с участием 2-пропил-,
реакции.
2-бутил- и 1-гексиламинов с анилином и его про-
Еще один метод синтеза N-алкил- и N,N-диал-
изводными катализирует палладий на угле. Ката-
лизатор может быть повторно использован не ме-
киланилинов основан на реакции переаминирова-
нее трех раз (схема 91) [200].
ния. Так, в работе [199] осуществлено катализи-
руемое комплексом кобальта [Co]-4 селективное
Каталитическая система, состоящая из четы-
N-алкилирование анилина и его производных
рехъядерного комплекса Ru-H [Ru]-18 с катехи-
первичными и вторичными аминами с получе-
новым лигандом L-12, катализирует реакцию
нием большого количества вторичных аминов
н-гексиламина и 3,4,6-триметоксибензиламина с
(схема 90).
4-хлор- и 4-метоксианилинами (схема 92) [201].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
368
БАЙГУЗИНА, ХУСНУТДИНОВ
Схема 91.
8 мол% Pd/C (10 мас%)
ArNH2 + RNH
ArNHR
2
MW (170oC, <21 атм.), 1.5 ч, ТГФ
2 экв.
Ar = Ph, R = Hexn (92%), Pri (72%), PhCH2CH2 (36%); Ar = 2,4-Me2C6H3, R = 2-Bu (86%);
Ar = 4-MeOC6H4, R = Cy (79%); R = Bun, Ar = 2-MeOC6H4 (79%), 2-OH (67%), 4-CO2Me (34%).
Схема 92.
Схема 93.
1.5 мол% Pd/C
R1C6H4NH2 + NR23
R1C6H4NHR2
MW, 175oC, 1.5 ч, толуол
2 ммоль
3 ммоль
R1 = H, R2 = Prn (92%), Bun (93%), Hexn (95%), Bn (41%); R1 = 4-Me, R2 = Pr (94%),
Oct (96%); R2 = Pr, R1 = 3-CF3 (57%), 2-F (31%), 4-F (40%), 2-But (66%), 3-Me (91%),
2-Me (92%); R2 = Hex, R1 = 2-Me (94%), 2-MeO (95%).
Схема 94.
10% Pd/C, H2
PhNH2
+ MeCN
PhNHEt
+ PhNEt2
MeOH (1 мл), 24 ч
89-92%
2-11%
В работе [202] осуществлен синтез N-алкила-
и 0-11% соответственно (схема 94). Недостатком
нилинов взаимодействием анилинов с третичными
данного метода является значительная продолжи-
аминами под действием гетерогенного Рd-содер-
тельность реакции и использование дорогостоя-
жащего катализатора (схема 93). Реакция проходит
щих катализаторов Pd/C и Rh/C.
в среде толуола при микроволновом нагревании
N-Алкиланилины можно получить взаимодей-
(175°С, 1.5 ч).
ствием арилгалогенидов с метиламином в присут-
Авторами работы [203] разработан метод полу-
ствии медного порошка (5 мол%) при 100°С за 12-
чения N-этиланилина с использованием ацетони-
48 ч. Выход N-алкиланилинов составил 56-99%
трила (алкилирующий агент) и водорода. Реакцию
(схема 95) [204]. Синтезировать дифениламин из
катализируют Pd/C и Rh/C (20°С). Выходы N-э-
анилина и бромбензола в аналогичных условиях
тиланилина и диэтиланилина составили 89-100
авторам не удалось.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
369
Схема 95.
5 мол% [Cu]
ArX + RNH2
ArNHR
H2O, 100oC, 12-48 ч
56-99%
X = Cl, Br, I; Ar = Ph, 4-ClC6H4, 3-ClC6H4, 2-ClC6H4, 4-BrC6H4, 4-HO2CC6H4,
2-HO2CC6H4, 4-NO2C6H4, 3-NO2C6H4, 2-NO2C6H4, 4-MeC6H4, 2-MeOC6H4,
4-CNC6H4, 4-AcC6H4; R = H, Me, Et, Bun, Cy.
8. ЗАКЛЮЧЕНИЕ
ного атома переходного металла и его лигандного
окружения, удается легко управлять селективно-
Из представленных в обзоре данных следует, что
стью реакции N-алкилирования анилинов. Дру-
методы синтеза N-алкилзамещенных анилинов,
гими преимуществами металлокомплексных ка-
основанные на реакциях N-алкилирования анили-
тализаторов являются возможность проведения
нов арилгалогенидами, спиртами, диметилкарбо-
реакции в мягких условиях и высокая производи-
натом, альдегидами и СО2/Н имеют много общего,
тельность. В частности, число оборотов (TON) для
в том числе и общие достоинства и недостатки.
рутенийсодержащих катализаторов N-алкилирова-
Серьезным недостатком метода N-алкилирования
ния анилина и его производных спиртами достига-
анилина и его производных алкилгалогенидами
ет 42840.
под действием цеолитов, а также комплексов Ni,
Rh и Cu является образование побочных продук-
Исследования N-алкилирования анилинов
тов: HCl, HBr, HI и необходимость их утилизации.
спиртами будут развиваться по пути повышения
Диметилкарбонат как N-метилирующий агент по
селективности и производительности металло-
отношению к анилинам из-за дороговизны и необ-
комплексных катализаторов за счет использования
ходимости проведения реакции при температуре
новых типов лигандов, комплексов и нанесенных
выше его точки кипения пока нашел ограничен-
форм катализаторов. Лучшими носителями для
ное применение. N-Метилирование анилинов с
них могут быть цеолиты различных марок, спо-
помощью формальдегида и донора водорода или
собные повлиять на селективность реакции из-за
CO2/H2 требует специального оборудования, что
молекулярно-ситового эффекта. Нанесенные фор-
также ограничивает их практическое применение
мы металлокомплексных катализаторов перспек-
как в лабораторных условиях, так и в промышлен-
тивны для использования в реакторах проточного
ности.
типа.
Наибольший интерес в препаративном и про-
ФОНДОВАЯ ПОДДЕРЖКА
мышленном плане из-за образования побочного
Работа выполнена в рамках государственного
продукта - воды - представляет метод синтеза
задания Министерства науки и высшего образова-
N-алкил-, N,N-диалкиланилинов с использова-
ния РФ (рег. № АААА-А19-119022290009-3).
нием спиртов в качестве алкилирующих агентов.
Поэтому неудивительно, что в последние годы до-
КОНФЛИКТ ИНТЕРЕСОВ
стигнуты большие успехи в N-алкилировании ани-
Авторы заявляют об отсутствии конфликта ин-
линов и его производных спиртами под действием
тересов.
металлокомплексных катализаторов на основе со-
единений и комплексов Cu, Ti, Fe, Ni, Co, Mn, Au,
СПИСОК ЛИТЕРАТУРЫ
Ru, Ir, Pd и Os. Комплексы указанных переходных
1. Gessner T., Mayer U. Triarylmethane and Diaryl-
металлов толерантны по отношению к основным
methane Dyes. In: Ullmann’s Encyclopedia of
функциональным группам в молекулах анилинов,
Industrial Chemistry. Weinheim: Wiley-VCH, 2000.
так и спиртов, что позволяет вовлечь в реакцию
P. 425. doi 10.1002/14356007.a27_179
субстраты самого сложного строения, в том числе
2. van der Vlugt J.I. // Chem. Soc. Rev. 2010. Vol. 39.
и вторичные спирты. Изменяя природу централь-
N 6. P. 2302. doi 10.1039/b925794m
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
370
БАЙГУЗИНА, ХУСНУТДИНОВ
3.
Guillaume D. // J. Nat. Prod. 2005. Vol. 68. N 11.
25.
Kleeman A., Engels J., Kutscher B., Reichert D. // Org.
P. 1715. doi 10.1021/np0582630
Proc. Res. Dev. 2002. Vol. 6. N 5. P. 739. doi 10.1021/
4.
Bähn S., Imm S., Neubert L., Zhang M., Neumann H.,
op0200423
Beller M. // Chem. Cat. Chem. 2011. Vol. 3. P. 1853. doi
26.
March J. // Appl. Organomet. Chem. 1993. Vol. 7.
10.1002/cctc.201100255.
P. 293. doi 10.1002/aoc.590070411
27.
Onaka M., Ishikawa K., Izumi Y. // Chem. Lett. 1982.
5.
Reed-Berendt B.G., Polidano K., Morrill L.C. // Org.
Vol. 11. № 11. P. 1783. doi 10.1246/cl.1982.1783
Biomol. Chem. 2019. Vol. 17. N 7. P. 1595. doi 10.1039/
28.
Onaka M., Umezono A., Kawai M., Izumi Y. // J.
c8ob01895b
Chem. Soc. Chem. Commun. 1985. N 17. P. 1202. doi.
6.
Salvatore R.N., Yoon C.H., Jung K.W. // Tetrahedron.
org/10.1039/c39850001202.
2001. Vol. 57. P. 7785. doi 10.1016/S0040-
29.
Onaka M., Ishikawa K., Izumi Y. // J. Incl. Phenom.
4020(01)00722-0
1984. Vol. 2. N 1-2. P. 359. doi 10.1007/BF00663276
7.
Natte K., Neumann H., Beller M., Jagadeesh R.V. //
30.
Onaka M., Izumi Y. // J. Synth. Org. Chem.
Angew. Chem. Int. Ed. 2017. Vol. 56. N 23. P. 6384. doi
Japan. 1989. Vol. 47. N 3. P. 233. doi 10.5059/
10.1002/anie.201612520
yukigoseikyokaishi.47.233
8.
Tundo P., Selva M. // Acc. Chem. Res. 2002. Vol. 35.
31.
Hayat S., Atta-ur-Rahman, Choudhary M.I., Khan K.M.,
N 9. P. 706. doi 10.1021/ar010076f
Schumann W., Bayer E. // Tetrahedron. 2001. Vol. 57.
9.
Selva M., Perosa A. // Green Chem. 2008. Vol. 10. N 4.
N 50. P. 9951. doi 10.1016/S0040-4020(01)00989-9
P. 457. doi 10.1039/b713985c
32.
Gawande M.B., Deshpande S.S., Satam J.R., Jaya-
10.
Tlili A., Frogneux X., Blondiaux E., Cantat T. // Angew.
ram R.V. // Catal. Commun. 2007. Vol. 8. N 3. P. 576.
Chem. Int. Ed. 2014. Vol. 53. N 10. P. 2543. doi
doi 10.1016/j.catcom.2006.08.011
10.1002/anie.201310337
33.
Shetty M.R., Kshirsagar S.W., Lanka S.V., Samant S.D. //
11.
Klankermayer J., Wesselbaum S., Beydoun K., Leit-
Green Chem. Lett. Rev. 2012. Vol. 5. N 3. P. 291. doi
ner W. // Angew. Chem. Int. Ed. 2016. Vol. 55. N 26.
10.1080/17518253.2011.624127
P. 7296. doi 10.1002/anie.201507458
34.
Chen, Yang L.-M. // J. Org. Chem. 2007. Vol. 72. N 16.
12.
Naota T., Takaya H.// Chem. Rev. 1998. Vol. 98. N 7.
P. 6324. doi 10.1021/jo0709448
P. 2599. doi 10.1021/cr9403695
35.
Kim M., Chang S. // Org. Lett. 2010. Vol. 12. N 7.
13.
Suzuki T. // Chem. Rev. 2011. Vol. 111. N 3. P. 1825. doi
P. 1640. doi 10.1021/ol100437j
10.1021/cr100378r
36.
Chakraborti G, Paladhi S., Mandal T., Dash J. // J. Org.
14.
Fujita K., Yamaguchi R. // Synlett. 2005. N 4. P. 560. doi
Chem. 2018. Vol. 83. N 14. P. 7347. doi 10.1021/acs.
10.1055/s-2005-862381
joc.7b03020
15.
Hamid M.H.S.A., Slatford P.A., Williams J.M.J. // Adv.
37.
Narayanan S., Deshpande K. // Appl. Catal. (A).
2000. Vol. 199. N 1. P. 1. doi 10.1016/S0926-
Synth. Catal. 2007. Vol. 349. N 10. P. 1555. doi 10.1002/
860X(99)00540-2
adsc.200600638
38.
Иванова И.И., Помахина Е.Б., Ребров А.И., Ванг В.,
16.
Haynes A. // Angew. Chem. Int. Ed. 2009. Vol. 48. N 33.
Хунгер М., Вейткамп Е. // Кинетика и катализ.
P. 5993. doi 10.1002/anie.200903039
2003. Т. 44. № 5. С. 764; Ivanova I.I., Pomakhina E.B.,
17.
Fujita, K., Yamaguchi R. Iridium Complexes in Organic
Rebrov A.I., Wang W., Hunger M., Weitkamp J. //
Synthesis. Weinheim: Wiley-VCH, 2008. P. 396.
Kinet. Catal. 2003. Vol. 44. N 5. P. 701. doi
18.
Nixon T.D., Whittlesey M.K., Williams J.M.J. // Dalton
10.1023/A:1026158525990
Trans. 2009. N 5. P. 753. doi 10.1039/B813383B
39.
Стыценко В.Д., Тао До Хыу, Винокуров В.А. // Ки-
19.
Dobereiner G.E., Crabtree R.H. // Chem. Rev. 2010.
нетика и катализ. 2005. Т. 46. № 3. С. 402; Stytsenko
Vol. 110. N 2. P. 681. doi 10.1021/cr900202j
V.D., Do Huu T., Vinokurov V.A. // Kinet. Catal. 2005.
20.
Guillena G., Ramón D.J., Yus M. // Chem. Rev. 2010.
Vol. 46, N 3. P. 376. doi 10.1007/s10975-005-0088-6
Vol. 110. N 3. P. 1611. doi 10.1021/cr9002159
40.
Luque R., Campelo J.M., Luna D., Marinas J.M.,
21.
Yang Q., Wang Q., Yu Z. // Chem. Soc. Rev. 2015.
Romero A.A. // J. Mol. Catal. (A). 2007. Vol. 269. N
Vol. 44. N 8. P. 2305. doi 10.1039/C4CS00496E
1-2. P. 190. doi 10.1016/j.molcata.2007.01.023
22.
Li Y., Cui X., Dong K., Junge K., Beller M. // ACS Catal.
41.
Su J., Li X., Chen Y., Cui Y.,. Xu J, Qian C., Chen X. //
2017. Vol. 7. N 2. P. 1077. doi 10.1021/acscatal.6b02715
RSC Adv. 2016. Vol. 6. N 60. P. 55643. doi 10.1039/
23.
Chen Y. // Chem. Eur. J. 2019. Vol. 25. N 14. P. 3405.
c6ra07998a
doi 10.1002/chem.201803642
42.
Garces L.J., MakwanaV.D., Hincapie B., Sacco A., Suib
24.
Spargo P. // Org. Proc. Res. Dev. 2003. Vol. 7. N 6.
S.L. // J. Catal. 2003. Vol. 217. N 1. P. 107. doi 10.1016/
P. 1084. doi 10.1021/op0341364
S0021-9517(03)00048-4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
371
43.
Valot F., Fache F., Jacquot R., Spagnol M., Lemaire M. //
Vol.
469. N
2014. P.
373. doi
10.1016/j.
Tetrahedron Lett. 1999. Vol. 40. N 19. P. 3689. doi
apcata.2013.09.044
10.1016/S0040-4039(99)00588-2
62.
Cui X., Zhang Y., Shi F., Deng Y. // Chem. Eur. J. 2011.
44.
Minakata S., Morino Y., Oderaotoshi Y., Komatsu M. //
Vol. 17. N 3. P. 1021. doi 10.1002/chem.201001915
Org. Lett. 2006. Vol. 8. N 15. P. 3335. doi 10.1021/
63.
Shimizu K., Nishimura M., Satsuma A. // ChemCatChem.
ol061182q
2009. Vol. 1. N 4. P. 497. doi 10.1002/cctc.200900209
45.
Maclean D., Hale R., Chen M. // Org. Lett. 2001. Vol. 3.
64.
Sarno M., Iuliano M., Ponticorvo E. // Mater.
N 19. P. 2977. doi 10.1021/ol0163124
Today Proc. 2020. Vol. 20. P. 16. doi 10.1016/j.
46.
Алкилирование. Исследования и промышленное
matpr.2019.08.151
оформление процесса / Под ред. Л.Ф. Голдсби., А.П.
65.
Ishida, T., Kawakita, N., Akita, T., Haruta M. // Gold
Олбрайта. М.: Химия, 1982. 366 c.
Bull. 2009. Vol. 42. N 4. P. 267.
47.
Jamil M.A.R., Touchy A.S., Rashed M.N., Ting K.W.,
66.
Stíbal D., Sá J., Bokhoven J.A. van. // Catal. Sci.
Technol. 2013. Vol. 3. N 1. P. 94. doi 10.1039/
Siddiki S.M.A.H., Toyao T., Maeno Z., Shimizu K. //
C2CY20511D
J. Catal. 2019. Vol. 371. P. 47. doi 10.1016/j.
67.
He L., Lou X.B., Ni J., Liu Y.M., Cao Y., He H.Y.,
jcat.2019.01.027
Fan K.N. // Chem. Eur. J. 2010. Vol. 16. N 47. P. 13965.
48.
Liu X., Hermange P., Ruiz J., Astruc D. / /
doi 10.1002/chem.201001848
ChemCatChem. 2016. Vol. 8. N 6. P. 1043. doi 10.1002/
68.
Zhu H., Dong X., Shi L., Sun Q. // J. Nat. Gas Chem.
cctc.201501346
2010. Vol. 19. N 1. P. 67. doi 10.1016/S1003-
49.
Zhang L., Zhang Y., Deng Y., Shi F. // RSC Adv. 2015.
9953(09)60036-0
Vol. 5. N 19. P. 14514. doi 10.1039/C4RA13848A
69.
Белов В.В., Марков В.И., Сова С.Б., Герасименко В.A.,
50.
Shiraishi Y., Fujiwara K., Sugano Y., Ichikawa S.,
Томских Т.A., Янова К. // Вопросы хим. и хим. тех-
Hirai T. // ACS Catal. 2013. Vol. 3. N 3. P. 312. doi
нол. 2008. № 3. С. 28.
10.1021/cs300756f
70.
Zhang L., Zhang Y., Deng Y., Shi F. // Catal. Sci. Technol.
51.
Furukawa S., Suzuki R., Komatsu T. // ACS Catal. 2016.
2015. Vol. 5. N 6. P. 3226. doi 10.1039/C5CY00316D
Vol. 6. N 9. P. 5946. doi 10.1021/acscatal.6b01677
71.
Vijayaraj M., Gopinath C.S. // Appl. Catal. (A). 2007.
52.
Kwon M.S., Kim S., Park S., Bosco W., Chidrala R.K.,
Vol. 320. P. 64. doi 10.1016/j.apcata.2006.12.016
Park J. // J. Org. Chem. 2009. Vol. 74. N 7. P. 2877. doi
72.
Likhar P.R., Arundhathi R., Kantam M.L., Prathima P.S. //
10.1021/jo8026609
Eur. J. Org. Chem. 2009. Vol. 2009. N 31. P. 5383. doi
53.
Zhang Y., Qi X., Cui X., Shi F., Deng Y. // Tetrahedron
10.1002/ejoc.200900628
Lett. 2011. Vol. 52. N 12. P. 1334. doi 10.1016/j.
73.
Бухтиярова М.В., Нуждин А.Л., Кардаш Т.Ю.,
tetlet.2011.01.059
Бухтияров А.В., Герасимов Е.Ю., Романенко А.В.
54.
Shimizu K.I., Imaiida N., Kon K., Hakim Siddiki S.M.A.,
// Кинетика и катализ. 2019. Т. 60. № 3. С. 364;
Satsuma A. // ACS Catal. 2013. Vol. 3. N 5. P. 998. doi
Bukhtiyarova M.V., Nuzhdin A.L., Kardash T.Y.,
10.1021/cs4001267
Bukhtiyarov A.V., Gerasimov E.Y., Romanenko A.V. //
55.
Cui X., Dai X., Deng Y., Shi F. // Chem. Eur. J. 2013.
Kinet. Catal. 2019. Vol. 60. N 3. P. 343. doi 10.1134/
Vol. 19, N 11. P. 3665. doi 10.1002/chem.201203417
S0023158419030030
56.
Попов Ю.В., Мохов В.М., Танкабекян Н.А. // ЖОХ.
74.
Jiang L., Guo F., Wang Y., Jiang J., Duan Y., Hou Z. //
2014. Т. 84. № 5. С. 733; Popov Y. V., Mokhov V.M.,
Asian J. Org. Chem. 2019. Vol. 8. N 11. P. 2046. doi
Tankabekyan N.A. // Russ. J. Gen. Chem. 2014. Vol. 84.
10.1002/ajoc.201900509
N 5. P. 826. doi 10.1134/S1070363214050065
75.
Goyal V., Gahtori J., Narani A., Gupta P., Bordoloi A.,
57.
Martínez R., Ramón D.J., Yus M. // Org. Biomol. Chem.
Natte K. // J. Org. Chem. 2019. Vol. 84. N 23. P. 15389.
2009. Vol. 7. N 10. P. 2176. doi 10.1039/b901929d
doi 10.1021/acs.joc.9b02141
58.
Rafiee E., Joshaghani M., Abadi P.G.S. // Res. Chem.
76.
Rawlings A.J., Diorazio L.J., Wills M. // Org. Lett. 2015.
Intermed. 2018. Vol. 44. N 4. P. 2503. doi 10.1007/
Vol.17. P.1086. doi 10.1021/ol503587n
s11164-017-3243-6
77.
Pan H.J., Ng T.W., Zhao Y.// Chem. Commun. 2015.
59.
Ghanimati M., Abdoli Senejani M., Isfahani T.M.,
Vol. 51. P.11907. doi 10.1039/c5cc03399c
Bodaghifard M.A. // Appl. Organomet. Chem. 2018.
78.
Brown T.J., Cumbes M., Diorazio L.J., Clarkson G.J.,
Vol. 32. N 12. P. e4591. doi 10.1002/aoc.4591
Wills M. // J. Org. Chem. 2017. Vol. 82. P.10489. doi
60.
Liu H., Chuah G.K., Jaenicke S. // J. Catal. 2012.
10.1021/acs.joc.7b01990
Vol. 292. P. 130. doi 10.1016/j.jcat.2012.05.007
79.
Plank T.N., Drake J.L., Kim D.K., Funk T.W. // Adv.
61.
Geukens I., Vermoortele F., Meledina M., Turner S.,
Synth. Catal. 2012. Vol. 354. N 4. P. 597. doi 10.1002/
Van Tendeloo G., De Vos D.E. // Appl. Catal. (A). 2014.
adsc.201100896
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
372
БАЙГУЗИНА, ХУСНУТДИНОВ
80.
Yan T., Feringa B.L., Barta K. // ACS Catal. 2016. Vol. 6.
ACS Catal. 2018. Vol. 8. N 9. P. 8525. doi 10.1021/
N 1. P. 381. doi 10.1021/acscatal.5b02160
acscatal.8b02530
81.
Yan T., Feringa B.L., Barta K. // Nat. Commun. 2014.
99.
Huang M., Li Y., Li Y., Liu J., Shu S., Liu Y., Ke Z. //
Vol. 5. N 1. P. 5602. doi 10.1038/ncomms6602
Chem. Commun. 2019. Vol. 55. N 44. P. 6213. doi
82.
Lator A., Gaillard S., Poater A., Renaud J.L. // Org.
10.1039/c9cc02989c
Lett. 2018. Vol. 20. N 19. P. 5985. doi 10.1021/acs.
100.
Yu X., Liu C., Jiang L., Xu Q. // Org. Lett. 2011. Vol.
orglett.8b02080
83.
Polidano K., Allen B.D.W., Williams J.M.J., Morrill L.C. //
13. N 23. P. 6184. doi 10.1021/ol202582c
ACS Catal. 2018. Vol. 8. N 7. P. 6440. doi 10.1021/
101.
Enyong A.B., Moasser B. // J. Org. Chem. 2014. Vol.
acscatal.8b02158
79. N 16. P. 7553. doi 10.1021/jo501273t
84.
Mastalir M., Glatz M., Gorgas N., Stöger B., Pittenauer E.,
102.
Hamid M.H.S.A., Williams J.M.J. // Chem. Commun.
Allmaier G., Veiros L.F., Kirchner K. // Chem. Eur.
2007. N 7. P. 725. doi 10.1039/b616859k
J. 2016. Vol. 22. N 35. P. 12316. doi 10.1002/
103.
Marichev K.O., Takacs J.M. // ACS Catal. 2016. Vol.
chem.201603148
6. N 4. P. 2205. doi 10.1021/acscatal.6b00175
85.
Zhao Y., Foo S.W., Saito S. // Angew. Chem. Int.
104.
Huh K.-T., Tsuji Y., Kobayashi M., Okuda F., Wata-
Ed. 2011. Vol. 50. N 13. P. 3006. doi 10.1002/
anie.201006660
nabe Y. // Chem. Lett. 1988. Vol. 17. N 3. P. 449. doi
86.
Хуснутдинов Р.И., Байгузина А.Р., Аминов Р.И. //
10.1246/cl.1988.449
ЖОрХ. 2013. Т. 49. № 10. С. 1469; Khusnutdinov R.I.,
105.
Del Zotto A., Baratta W., Sandri M., Verardo G.,
Bayguzina A.R., Aminov R.I. // Russ. J. Org.
Rigo P. // Eur. J. Inorg. Chem. 2004. Vol. 2004. N 3.
Chem. 2013. Vol. 49. N 10. P. 1447. doi 10.1134/
P. 524. doi 10.1002/ejic.200300518
S1070428013100072
106.
Kaloğlu M., Gürbüz N., Sémeril D., Özdemir İ. // Eur.
87.
Khusnutdinov R.I., Bayguzina A.R., Asylbaeva R.S.,
J. Inorg. Chem. 2018. Vol. 2018. N 10. P. 1236. doi
Aminov R.I., Dzhemilev U.M. // Arkivoc. 2014.
Vol. 2014, N 5. doi 10.3998/ark.5550190.p008.743
10.1002/ejic.201701479
88.
Пат. 2547046 (2015). РФ // С. А. 2015. Vol. 162.
107.
Dang T.T., Ramalingam B., Seayad A.M. // ACS
P. 527401.
Catal. 2015. Vol. 5. N 7. P. 4082. doi 10.1021/acs-
89.
Zhang G., Yin Z., Zheng S. // Org. Lett. 2016. Vol. 18.
catal.5b00606
N 2. P. 300. doi 10.1021/acs.orglett.5b03461
108.
Roy B.C., Debnath S., Chakrabarti K., Paul B., Maji M.,
90.
Rösler S., Ertl M., Irrgang T., Kempe R. // Angew.
Kundu S. // Org. Chem. Front. 2018. Vol. 5. N 6.
Chem. Int. Ed. 2015. Vol. 54. N 50. P. 15046. doi
P. 1008. doi 10.1039/c7qo01061c
10.1002/anie.201507955
109.
Naskar S., Bhattacharjee M. // Tetrahedron Lett. 2007.
91.
Liu Z., Yang Z., Yu X., Zhang H., Yu B., Zhao Y., Liu Z. //
Adv. Synth. Catal. 2017. Vol. 359. N 24. P. 4278. doi
Vol. 48. N 19. P. 3367. doi 10.1016/j.tetlet.2007.03.075
10.1002/adsc.201701044
110.
Ogata O., Nara H., Fujiwhara M., Matsumura K.,
92.
Emayavaramban B., Chakraborty P., Manoury E., Poli R.,
Kayaki Y. // Org. Lett. 2018. Vol. 20. N 13. P. 3866.
Sundararaju B. // Org. Chem. Front. 2019. Vol. 6. N 6.
doi 10.1021/acs.orglett.8b01449
P. 852. doi 10.1039/c8qo01389f
111.
Choi G., Hong S.H. // Angew. Chem. Int. Ed. 2018.
93.
Mastalir M., Tomsu G., Pittenauer E., Allmaier G.,
Vol. 57. N 21. P. 6166. doi 10.1002/anie.201801524
Kirchner K. // Org. Lett. 2016. Vol. 18. N 14. P. 3462.
112.
Paul B., Shee S., Chakrabarti K., Kundu S. // Chem-
doi 10.1021/acs.orglett.6b01647
94.
Elangovan S., Neumann J., Sortais J.B., Junge K.,
SusChem. 2017. Vol. 10. N 11. P. 2370. doi 10.1002/
Darcel C., Beller M. // Nat. Commun. 2016. Vol. 7.
cssc.201700503
P. 1. doi 10.1038/ncomms12641
113.
Das K., Nandi P.G., Islam K., Srivastava H.K., Kumar
95.
Bruneau-Voisine A., Wang D., Dorcet V., Roisnel T.,
A. // Eur. J. Org. Chem. 2019. Vol. 2019. N 40. P. 6855.
Darcel C., Sortais J.-B. // J. Catal. 2017. Vol. 347. P. 57.
doi 10.1002/ejoc.201901310
doi 10.1016/j.jcat.2017.01.004
114.
Jumde V.R., Gonsalvi L., Guerriero A., Peruzzini M.,
96.
Neumann J., Elangovan S., Spannenberg A., Junge K.,
Taddei M. // Eur. J. Org. Chem. 2015. Vol. 2015. N 8.
Beller M. // Chem. Eur. J. 2017. Vol. 23. N 23. P. 5410.
P. 1829. doi 10.1002/ejoc.201403636
doi 10.1002/chem.201605218
97.
Homberg L., Roller A., Hultzsch K.C. // Org. Lett. 2019.
115.
Watanabe Y., Tsuji Y., Ohsugi Y. // Tetrahedron Lett.
Vol. 21. N 9. P. 3142. doi 10.1021/acs.orglett.9b00832
1981. Vol. 22. N 28. P. 2667. doi 10.1016/S0040-
98. Fertig R., Irrgang T., Freitag F., Zander J., Kempe R. //
4039(01)92965-X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
373
116.
Maji M., Chakrabarti K., Paul B., Roy B.C., Kundu S. //
133.
Fujita K., Enoki Y., Yamaguchi R. // Tetrahedron. 2008.
Adv. Synth. Catal. 2018. Vol. 360. N 4. P. 722. doi
Vol. 64. N 8. P. 1943. doi 10.1016/j.tet.2007.11.083
10.1002/adsc.201701117
134.
Fu A., Liu Q., Jiang M., Xu G. // Asian J. Org. Chem.
117.
Blank B., Michlik S., Kempe R. // Chem. Eur. J. 2009.
2019. Vol. 8. N 4. P. 487. doi 10.1002/ajoc.201900140
Vol. 15. N 15. P. 3790. doi 10.1002/chem.200802318
135.
Oikawa K., Itoh S., Yano H., Kawasaki H., Obora Y. //
118.
Ruch S., Irrgang T., Kempe R. // Chem. Eur. J. 2014.
Chem. Commun. 2017. Vol. 53. N 6. P. 1080. doi
Vol. 20. N 41. P. 13279. doi 10.1002/chem.201402952
10.1039/C6CC09279A
119.
Kawahara R., Fujita K., Yamaguchi R. // Adv. Synth.
136.
Blank B., Madalska M., Kempe R. // Adv. Synth.
Catal. 2011. Vol. 353. N 7. P. 1161. doi 10.1002/ad-
Catal. 2008. Vol. 350. N 5. P. 749. doi 10.1002/ad-
sc.201000962
sc.200700596
120.
Wetzel A., Wöckel S., Schelwies M., Brinks M.K., Rom-
137.
Prades A., Corberán R., Poyatos M., Peris E. // Chem.
inger F., Hofmann P., Limbach M. // Org. Lett. 2013.
Eur. J. 2008. Vol. 14. N 36. P. 11474. doi 10.1002/
Vol. 15. N 2. P. 266. doi 10.1021/ol303075h
chem.200801580
121.
Campos J., Sharninghausen L.S., Manas M.G., Crab-
138.
Bertoli M., Choualeb A., Lough A.J., Moore B.,
tree R.H. // Inorg. Chem. 2015. Vol. 54. N 11. P. 5079.
Spasyuk D., Gusev D.G. // Organometallics. 2011.
doi 10.1021/ic502521c
Vol. 30. N 13. P. 3479. doi 10.1021/om200437n
122.
Li F., Xie J., Shan H., Sun C., Chen L. // RSC Adv.
139.
Martínez-Asencio A., Ramón D.J., Yus M. // Tetra-
2012. Vol. 2. N 23. P. 8645. doi 10.1039/c2ra21487c
hedron. 2011. Vol. 67. N 17. P. 3140. doi 10.1016/j.
123.
Toyooka G., Tuji A., Fujita K. // Synthesis. 2018. Vol.
tet.2011.02.075
50. N 23. P. 4617. doi 10.1055/s-0037-1610252
140.
Seyed, P. M., Behzad, S. H., Mansour S. // ChemX-
124.
Jiménez M.V., Fernández-Tornos J., González-
press. 2017. Vol. 10. N 2. P. 125.
Lainez M., Sánchez-Page B., Modrego F.J., Oro L.A.,
141.
Байгузина А.Р., Мусина Ч.Ф., Хуснутдинов Р.И. //
Pérez-Torrente J.J. // Catal. Sci. Technol. 2018. Vol. 8.
ЖОрХ. 2018. Т. 54. № 11. С. 1642; Bayguzina
N 9. P. 2381. doi 10.1039/c7cy02488f
A.R., Musina C.F., Khusnutdinov R.I. // Russ. J. Org.
125.
Deng D., Hu B., Yang M., Chen D. // Organometal-
Chem. 2018. Vol. 54. N 11.P. 1652. doi 10.1134/
lics. 2018. Vol. 37,. N 19. P. 3353. doi 10.1021/acs.
S1070428018110052
organomet.8b00575
142.
Martínez-Asencio A., Yus M., Ramón D.J. // Synthesis.
126.
Liang R., Li S., Wang R., Lu L., Li F. // Org. Lett.
2011. N 22. P. 3730. doi 10.1055/s-0030-1260238
2017. Vol. 19. N 21. P. 5790. doi 10.1021/acs.or-
143.
Dang T.T., Shan S.P., Ramalingam B., Seayad A.M. //
glett.7b02723
RSC Adv. 2015. Vol. 5. N 53. P. 42399. doi 10.1039/
127.
Rasero-Almansa A.M., Corma A., Iglesias M., Sán-
c5ra07225e
chez F. // ChemCatChem. 2014. Vol. 6. N 6. P. 1794.
144.
Abdukader A., Jin H., Cheng Y., Zhu C. // Tetrahedron
doi 10.1002/cctc.201402101
Lett. 2014. Vol. 55. N 30. P. 4172. doi 10.1016/j.tet-
128.
Chen J., Wu J., Tu T. // ACS Sustain. Chem. Eng.
let.2014.05.068
2017. Vol. 5. N 12. P. 11744. doi 10.1021/acssusche-
145.
Wei D., Sadek O., Dorcet V., Roisnel T., Darcel C.,
meng.7b03246
Gras E., Clot E., Sortais J.B. // J. Catal. 2018. Vol.
129.
Gnanamgari D., Sauer E.L.O., Schley N.D., Butler C.,
Incarvito C.D., Crabtree R.H. // Organometallics.
366. P. 300. doi 10.1016/j.jcat.2018.08.008
2009. Vol. 28. N 1. P. 321. doi 10.1021/om800821q
146.
Gour J., Gatadi S., Malasala S., Yaddanpudi M.V.,
130.
Grigg R., Mitchell T.R.B., Sutthivaiyakit S., Tongpen-
Nanduri S. // J. Org. Chem. 2019. Vol. 84. N 11. P.
yai N. // J. Chem. Soc. Chem. Commun. 1981. N 12.
7488. doi 10.1021/acs.joc.9b00717
P. 611. doi 10.1039/c39810000611
147.
Yang H., Mao R., Luo C., Lu C., Cheng G. // Tetra-
131.
Michlik S., Kempe R. // Chem. Eur. J. 2010. Vol. 16. N
hedron. 2014. Vol. 70, N 46. P. 8829. doi 10.1016/j.
44. P. 13193. doi 10.1002/chem.201001871
tet.2014.10.007
132.
Fujita K., Li Z., Ozeki N., Yamaguchi R. // Tetrahedron
148.
Хуснутдинов Р.И., Байгузина А.Р., Аминов Р.И.,
Lett. 2003. Vol. 44. N 13. P. 2687. doi 10.1016/S0040-
Джемилев У.М. // ЖОрХ. 2012. Т. 48. № 5. С. 693;
4039(03)00371-X
Khusnutdinov R.I. Baygusina A.R., Aminov R.I., Dzhe-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
374
БАЙГУЗИНА, ХУСНУТДИНОВ
milev U.M. // Russ. J. Org. Chem. 2012. Vol. 48. N 5.
165.
Dhakshinamoorthy A., Alvaro M., Garcia H. // Appl.
P. 690. doi 10.1134/S1070428012050107
Catal. (A). 2010. Vol. 378. N 1. P. 19. doi 10.1016/j.
149.
Trotta F., Tundo P., Moraglio G. // J. Org. Chem. 1987.
apcata.2010.01.042
Vol. 52. N 7. P. 1300. doi 10.1021/jo00383a024
166.
Jyothi T.M., Raja T., Talawar M.B., Sreekumar K. //
150.
Selva M., Bomben A., Tundo P. // J. Chem. Soc. Perkin
Synth. Commun. 2000. Vol. 30. N 21. P. 3929. doi
Trans. 1. 1997. N 7. P. 1041. doi 10.1039/a606684d
10.1080/00397910008086951
151.
Selva M., Tundo P., Perosa A. // J. Org. Chem. 2001.
167.
Gooden P.N., Bourne R.A., Parrott A.J., Bevinakat-
Vol. 66. N 3. P. 677. doi 10.1021/jo0006728
ti H.S., Irvine D.J., Poliakoff M. // Org. Process
152.
Delledonne D., Rivetti F., Romano U. // Appl. Catal.
Res. Dev. 2010. Vol. 14. N 2. P. 411. doi 10.1021/
(A). 2001. Vol. 221. N 1-2. P. 241. doi 10.1016/S0926-
op900307w
860X(01)00796-7
168.
Amara Z., Streng E.S., Skilton R.A., Jin J., George
153.
Ono Y. // Appl. Catal. (A). 1997. Vol. 155. N 2. P. 133.
M.W., Poliakoff M. // Eur. J. Org. Chem. 2015. Vol.
doi 10.1016/S0926-860X(96)00402-4
2015. N 28. P. 6141. doi 10.1002/ejoc.201500980
154.
Selva M., Fabris M. // Green Chem. 2009. Vol. 11. N
169.
Tayebee R., Seresht E.R., Jafari F., Rabiei S. // Ind.
8. P. 1161. doi 10.1039/b904821a
Eng. Chem. Res. 2013. Vol. 52. N 32. P. 11001. doi
155.
Fu Z., Ono Y. // Catal. Lett. 1993. Vol. 22. N 3. P. 277.
10.1021/ie4018786
doi 10.1007/BF00810375
170.
Zheng J., Darcel C., Sortais J.B. // Chem. Com-
156.
Hari Prasad Rao P.R., Massiani P., Barthomeuf D. //
mun.2014. Vol. 50. N 91. P. 14229. doi 10.1039/
Catal. Lett. 1995. Vol. 31. N 1. P. 115. doi 10.1007/
c4cc05517a
BF00817038
171.
Cabrero-Antonino J.R., Adam R., Junge K., Beller M. //
157.
Selva M. // J. Mol. Catal. (A). 2004. Vol. 222. N 1-2.
Catal. Sci. Technol. 2016. Vol. 6. N 22. P. 7956. doi
P. 273. doi 10.1016/j.molcata.2004.07.011
10.1039/c6cy01401a
158.
Selva M., Tundo P., Perosa A. // J. Org. Chem. 2002.
172.
Cabrero-Antonino J.R., Adam R., Wärnå J., Murzin
Vol. 67. N 26. P. 9238. doi 10.1021/jo026057g
D.Y., Beller M. // Chem. Eng. J. 2018. Vol. 351. P.
159.
Selva M., Tundo P., Foccardi T. // J. Org. Chem. 2005.
1129. doi 10.1016/j.cej.2018.06.174
Vol. 70. N 7. P. 2476. doi 10.1021/jo048076r
173.
Li Y., Sorribes I., Vicent C., Junge K., Beller M. //
160.
Selva M., Tundo P., Perosa A. // J. Org. Chem. 2003.
Chem. Eur. J. 2015. Vol. 21. N 47. P. 16759. doi
Vol. 68. N 19. P. 7374. doi 10.1021/jo034548a
10.1002/chem.201502917
161.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.,
174.
Guyon C., Duclos M.-C., Métay E., Lemaire M. //
Ардиева С.И., Хазипова А.Н., Кутепов Б.И. //
Tetrahedron Lett. 2016. Vol. 57. N 27-28. P. 3002. doi
ЖОХ. 2016. Т. 52. № 11. С. 1574; Khusnutdinov
10.1016/j.tetlet.2016.05.094
R.I., Shchadneva N.A., Mayakova Y.Y., Ardieva S.I.,
175.
Li B., Zheng J., Zeng W., Li Y., Chen L. // Synthe-
Khazipova A.N., Kutepov B.I. // Russ. J. Org.
sis. 2016. Vol. 49. N 6. P. 1349. doi 10.1055/s-0036-
Chem. 2016. Vol. 52. N 11. P. 1565. doi 10.1134/
1588092
S1070428016110038
176.
Byun E., Hong B., De Castro K.A., Lim M., Rhee H. //
162.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.,
J. Org. Chem. 2007. Vol. 72. N 25. P. 9815. doi
Абдрахманов А.Н., Хазипова А.Н., Кутепов Б.И. //
10.1021/jo701503q
ЖОрХ. 2019. Т. 55. № 8. С. 1172; Khusnutdinov
177.
Wang H., Huang Y., Dai X., Shi F. // Chem. Commun.
R.I., Shchadneva N.A., Mayakova Y.Y., Abdrakhman-
ov A.N., Khazipova A.N., Kutepov B.I. // Russ. J.
2017. Vol. 53. N 40. P. 5542. doi 10.1039/c7cc02314f
Org. Chem. 2019. Vol. 55. N 8. P. 1085. doi 10.1134/
178.
Ge X., Luo C., Qian C., Yu Z., Chen X.// RSC Adv.
S1070428019080049
2014. Vol. 4. N 81. P. 43195. doi 10.1039/c4ra04414b
163.
Juarez R., Padilla A., Corma A., Garcia H. // Catal.
179.
Wei D., Bruneau-Voisine A., Valyaev D.A., Lugan N.,
Commun. 2009. Vol. 10, N 5. P. 472. doi 10.1016/j.
Sortais J.B. // Chem. Commun. 2018. Vol. 54. N 34.
catcom.2008.10.009
P. 4302. doi 10.1039/c8cc01787e
164.
Rojas-Buzo S., García-García P., Corma A. // Catal.
180.
Zhang M., Yang H., Zhang Y., Zhu C., Li W., Cheng Y.,
Sci. Technol. 2019. Vol. 9. N 1. P. 146. doi 10.1039/
Hu H. // Chem. Commun. 2011. Vol. 47. N 23. P. 6605.
C8CY02235F
doi 10.1039/c1cc11201e
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
КАТАЛИТИЧЕСКОЕ N-АЛКИЛИРОВАНИЕ АНИЛИНОВ
375
181.
Li C., Villa-Marcos B., Xiao J. // J. Am. Chem. Soc.
192.
Savourey S., Lefèvre G., Berthet J.-C., Cantat T. //
2009. Vol. 131. N 20. P. 6967. doi 10.1021/ja9021683
Chem. Commun. 2014. Vol. 50. N 90. P. 14033. doi
182.
Tlili A., Blondiaux E., Frogneux X., Cantat T. // Green
10.1039/C4CC05908E
Chem. 2015. Vol. 17. N 1. P. 157. doi 10.1039/c4g-
193.
Qiao C., Yao X.Y., Liu X.F., Li H.R., He L.N. // Asian
c01614a
J. Org. Chem. 2018. Vol. 7. N 9. P. 1815. doi 10.1002/
183.
Li Y., Fang X., Junge K., Beller M. // Angew. Chem.
ajoc.201800420
Int. Ed. 2013. Vol. 52. N 36. P. 9568. doi 10.1002/
194.
Qiao C., Liu X.-F., Liu X., He L.-N. // Org. Lett. 2017.
Vol. 19. N 6. P. 1490. doi 10.1021/acs.orglett.7b00551
anie.201301349
195.
Sorribes I., Junge K., Beller M. // Chem. Eur. J. 2014.
184.
Li Y., Sorribes I., Yan T., Junge K., Beller M. // Angew.
Vol. 20. N 26. P. 7878. doi 10.1002/chem.201402124
Chem. Int. Ed. 2013. Vol. 52. N 46. P. 12156. doi
196.
Zhu L., Wang L.-S., Li B., Li W., Fu B. // Catal. Sci.
10.1002/anie.201306850
Technol. 2016. Vol. 6. N 16. P. 6172. doi 10.1039/
185.
Beydoun K., Vom Stein T., Klankermayer J., Leitner W. //
C6CY00674D
Angew. Chem. Int. Ed. 2013. Vol. 52. N 36. P. 9554.
197.
Sun N., Wang S., Mo W., Hu B., Shen Z., Hu X. // Tet-
doi 10.1002/anie.201304656
rahedron. 2010. Vol. 66. N 35. P. 7142. doi 10.1016/j.
186.
Beydoun K. , Ghattas G., Thenert K., Klankermayer J.,
tet.2010.06.091
Leitner W. // Angew. Chem. Int. Ed. 2014. Vol. 53. N
198.
Kundu S.K., Mitra K., Majee A. // RSC Adv. 2013.
41. P. 11010. doi 10.1002/anie.201403711
Vol. 3. N 23. P. 8649. doi 10.1039/c3ra40509e
187.
Cui X., Zhang Y., Deng Y., Shi F. // Chem. Com-
199.
Yin Z., Zeng H., Wu J., Zheng S., Zhang G. // ACS
mun. 2014. Vol. 50. N 88. P. 13521. doi 10.1039/
Catal. 2016. Vol. 6. N 10. P. 6546. doi 10.1021/acs-
C4CC05119J
catal.6b02218
188.
Su X., Lin W., Cheng H., Zhang C., Li Y., Liu T., Zhang B.,
200.
Linciano P., Pizzetti M., Porcheddu A., Taddei M. //
Wu Q., Yu X., Zhao F. // RSC Adv. 2016. Vol. 6. N 105.
Synlett. 2013. Vol. 24. N 17. P. 2249. doi 10.1055/s-
P. 103650. doi 10.1039/C6RA22089D
0033-1339667
189.
Toyao T., Siddiki S.M.A.H., Morita Y., Kamachi T.,
201.
Arachchige P.T.K., Lee H., Yi C.S. // J. Org. Chem.
Touchy A.S., Onodera W., Kon K., Furukawa S.,
2018. Vol. 83. N 9. P. 4932. doi 10.1021/acs.
Ariga H., Asakura K., Yoshizawa K., Shimizu K.I. //
joc.8b00649
Chem. Eur. J. 2017. Vol. 23. N 59. P. 14848. doi
202.
Lubinu M.C., De Luca L., Giacomelli G., Porched-
10.1002/chem.201702801
du A. // Chem. Eur. J. 2011. Vol. 17. N 1. P. 82. doi
190.
Du X.-L., Tang G., Bao H.-L., Jiang Z., Zhong X.-H.,
10.1002/chem.201002704
Su D.S., Wang J.-Q. // ChemSusChem. 2015. Vol. 8. N
203.
Sajiki H., Ikawa T., Hirota K. // Org. Lett. 2004. Vol.
20. P. 3489. doi 10.1002/cssc.201500486
6. N 26. P. 4977. doi 10.1021/ol047871o
191.
Lam R.H., McQueen C.M.A., Pernik I., McBurney R.T.,
204.
Jiao J., Zhang X.-R., Chang N.-H., Wang J., Wei J.-F.,
Hill A.F., Messerle B.A. // Green Chem. 2019. Vol. 21.
Shi X.-Y., Chen Z.-G. // J. Org. Chem. 2011. Vol. 76.
N 3. P. 538. doi 10.1039/c8gc03094d
N 4. P. 1180. doi 10.1021/jo102169t
Catalytic N-Alkylation of Anilines
A. R. Bayguzina* and R. I. Khusnutdinov
Institute of Petrochemistry and Catalysis of the Russian Academy of Sciences, Ufa, 450075 Russia
*e-mail: Bayguzina2014@gmail.com
Received December 9, 2020; revised February 9, 2021; accepted February 15, 2021
The review summarizes data on modern approaches to N-alkylation of anilines using metal complex and het-
erogeneous catalysts based on palladium, platinum, rhodium, nickel, iron, copper, gold supported on supports,
as well as zeolites, titanium oxides, iron, copper, and aluminum. The reactions of N-alkylation of anilines with
alkyl halides, alcohols, dimethyl carbonate, aldehydes, as well as with CO2/H2 and alkylation with alternative
reagents are considered.
Keywords: aniline, N-methylaniline, N-alkylation, homogeneous and heterogeneous catalysts
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021