ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 376-385
УДК 547.75;547.787.1;547.83
СИНТЕЗ НОВЫХ
1Н-ПИРРОЛО[3,4-с]ПИРИДИН-1,3(2Н)-ДИОНОВ
© 2021 г. С. В. Ключко, С. А. Чумаченко, О. В. Шаблыкин, В. С. Броварец*
Институт биоорганической химии и нефтехимии имени В. П. Кухаря Национальной академии наук Украины,
ул. Мурманская 1, Киев, 02094 Украина
*e-mail: brovarets@bpci.kiev.ua
Поступило в Редакцию 23 декабря 2020 г.
После доработки 23 декабря 2020 г.
Принято к печати 30 декабря 2020 г.
На основе взаимодействия 4-метокси-1,3-оксазолов с призводными малеимида в условиях реакции Диль-
са-Альдера предложен метод синтеза новых замещенных 1H-пирроло[3,4-с]пиридин-1,3(2Н)-дионов.
Ключевые слова: 4-метокси-1,3-оксазол, пирроло[3,4-c]пиридин, малеимид, реакция Дильса-Альдера
DOI: 10.31857/S0044460X21030021
Производные пиррола широко распространены
Оксазолы имеют сопряженную азaдиеновую
в природе как индивидуальные соединения, так и
систему и являются универсальными структурами
в виде фрагмента сложных биомолекул (порфины,
для исследований в качестве диеновой компоненты
аминокислоты и др.) и разнообразных фармаколо-
в реакциях Дильса-Альдера [16-20]. В результате
гически активных соединений [1-3]. Они исполь-
термических реакций с ацетиленами образуются
зуются как антиоксиданты [4], антибактериальные
фураны [21], а при присоединении к олефинам - за-
[5, 6], ионотропные [7, 8], противоопухолевые [9],
мещенные пиридины, включая аналоги витамина
противовоспалительные [10, 11] и противогрибко-
В6 [22]. В этих реакциях хорошо изучены 5-алкок-
вые агенты [12].
сиоксазолы [23, 24]. В частности, циклоприсоеди-
нение малеимидов к 5-алкоксиоксазолам приводит
Аннелирование пиридинового ядра к пир-
к замещенным
7-гидрокси-1H-пирроло[3,4-c]-
рольному циклу приводит к новому спектру
пиридин-1,3(2Н)-дионам [25-27]. Однако реакции
биологической активности полученных соеди-
4-алкоксиоксазолов с малеимидами, приводящие к
нений. Так, среди производных пирроло[2,3-d]-
пиридинов выявлены ингибиторы рецептора
6-алкоксипроизводным пирроло[3,4-c]пиридин-
1,3(2Н)-дионам, не исследованы. В связи с этим,
(IGF-1R) тирозинкиназы, связанной с различными
целью нашей работы являлось получение новых
видами рака [13]. Производные пирроло[3,4-с]-
4-замещенных 6-метокси-1Н-пирроло[3,4-с]пири-
пиридинов наряду с анальгетической активностью
[14] показывают активность против микобактерий
дин-1,3(2Н)-дионов путем циклопри-соединения
4-метоксиоксазолов к производными малеимида.
туберкулеза [15]. Разнообразная биологическая
активность производных пирролопиридина вызы-
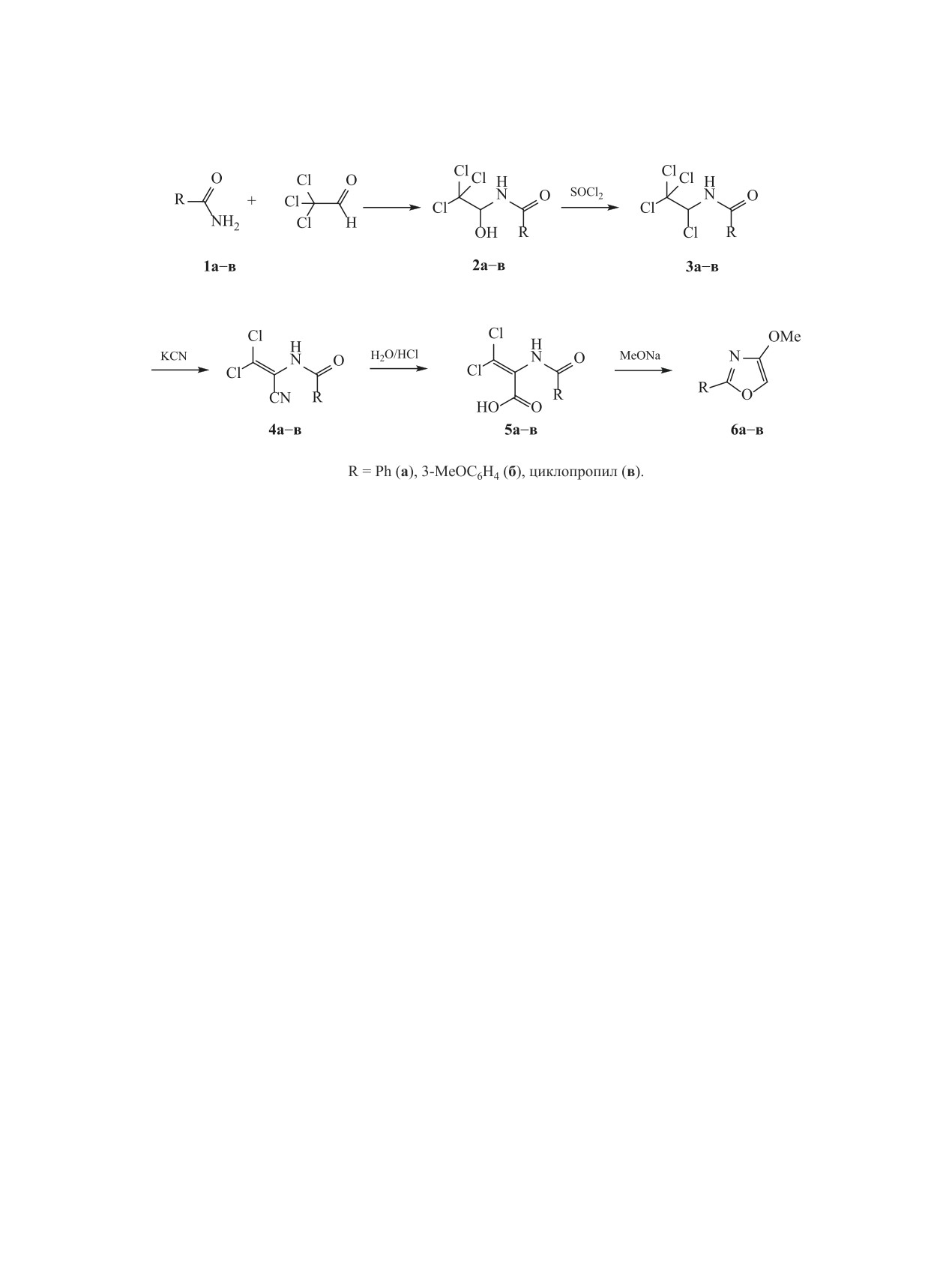
4-Метоксиоксазолы 6а-в были синтезированы
вает интерес к синтезу и изучению свойств новых
по схеме 1. В качестве исходных соединений ис-
соединений этого класса с целью поиска эффек-
пользовали продукты конденсации амидов 1а-в с
тивных лекарственных средств. Поэтому актуаль-
хлоралем, которые дают соединения 2. В дальней-
ной задачей является развитие методов синтеза
шем хлоральамиды 2 превращали в дихлоракрило-
конденсированных производных пирролопириди-
вые кислоты 5 через хлорпроизводные 3 и дихло-
нов.
ракрилонитрилы 4 (схема 1).
376
СИНТЕЗ НОВЫХ 1Н-ПИРРОЛО[3,4-С]ПИРИДИН-1,3(2Н)-ДИОНОВ
377
Схема 1.
Состав соединений 2-6 подтвержден данны-
С4-О образуют цвиттер-ионы Б и Б1 с последую-
ми элементного анализа, а строение - с помощью
щей их ароматизацией за счет отщепления моле-
ИК и ЯМР 1Н спектроскопии, а также хрома-
кулы воды.
то-масс-спектрометрии. Спектры ЯМР 1Н синте-
Существенное влияние на скорость реакции,
зированных соединений содержат сигналы всех
как и следовало ожидать, оказывает природа за-
структурных фрагментов; в хромато-масс-спек-
местителя R1 в 4-метоксиоксазолах. С увеличени-
трах присутствуют пики молекулярных ионов
ем донорных свойств увеличивается и скорость
[М + 1]+.
реакции, что приводит к уменьшению времени
Циклизацию кислот 5а-в в 4-метокси-1,3-окса-
конденсации. Реакция 4-метоксиоксазолов 6а, б с
золы 6а-в проводили при 240-часовом выдержи-
замещенными малеимидами 7а-ж проходит за 4 ч,
вании их в метанольном растворе в присутствии
а оксазола 6в - за 1 ч. Влияния заместителя R2 на
избытка метилата натрия. 4-Метокси-1,3-оксазолы
скорость реакции не наблюдалось. Продукты кон-
6 неустойчивы при комнатной температуре. Их
денсации 8а-в отфильтровывали и очищали пере-
нужно использовать сразу после выделения или
кристаллизацией из этилацетата.
хранить при температуре -14°С. В ИК спектрах
При сравнении ИК спектров соединений 6а-в
4-метокси-1,3-оксазолов
6 отсутствуют полосы
и 7а-ж с продуктами конденсации 8а-с наблюда-
поглощения, характерные для связей N-H и С=О
ется появление двух интенсивных полос погло-
дихлоракриловых кислот 5, что согласуется с уча-
щения в области 1709-1723 см-1, что обусловлено
стием ациламинных остатков в циклизации.
валентными колебаниями карбонильных групп.
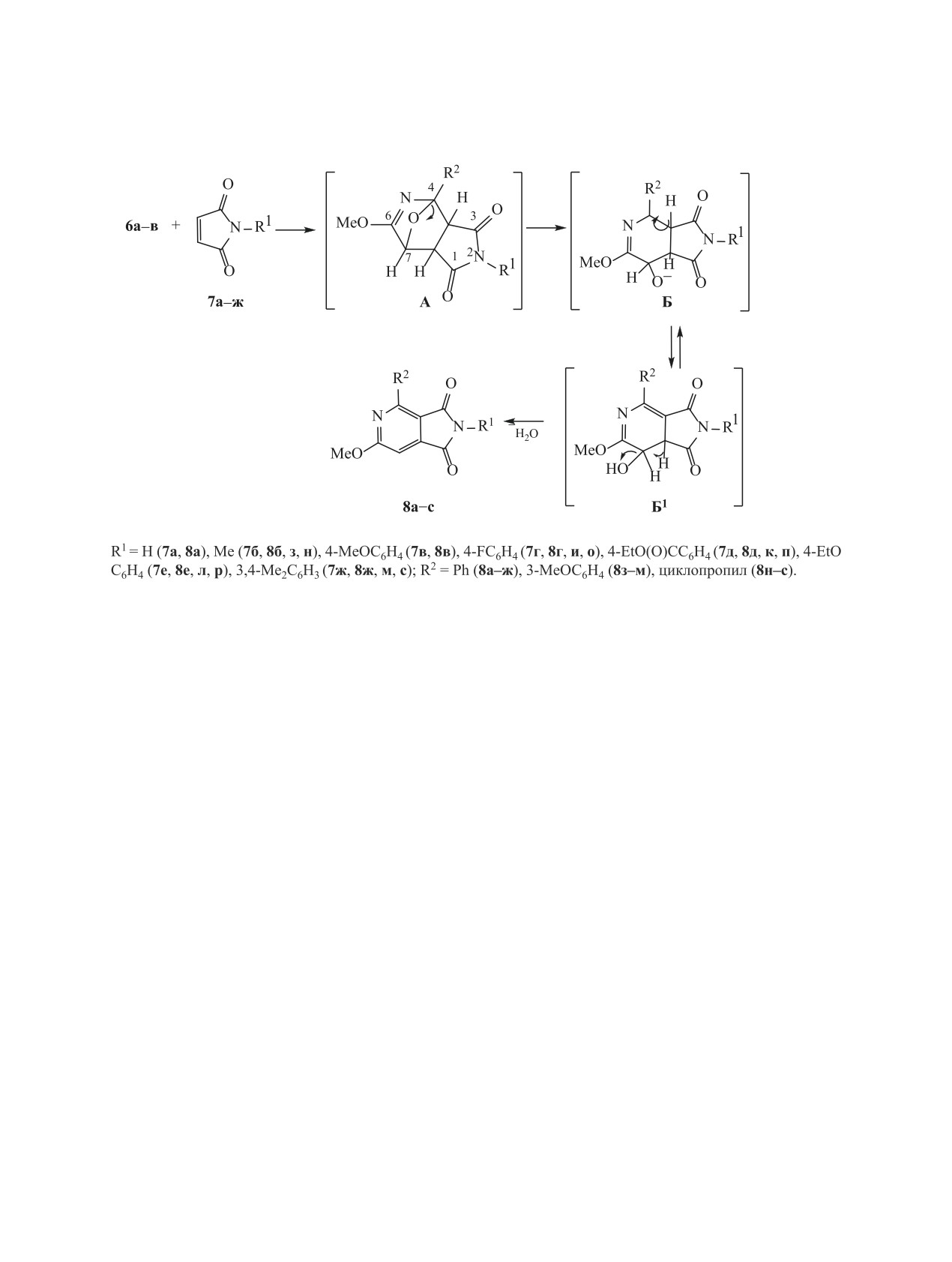
Кипячение эквимолярных количеств меток-
В спектрах ЯМР 1Н соединений 8а-с происходит
сиоксазола 6 и малеимида 7 в ксилоле в течение
смещение сигнала СН3О-группы (3.95-4.17 м. д.)
1-4 ч давало с удовлетворительными и хороши-
в пиридиновом цикле в более слабое поле по срав-
ми выходами продукты конденсации 8 (схема 2).
нению с оксазолом (3.73-3.85 м. д.), а вместо син-
Образование производных пирроло[3,4-c]пири-
глета (2Н, СН=СН) в области 6.67-6.87 м. д. ма-
дин-1,3(2Н)-дионов
8а-в можно представить
леимидов 7а-ж появляется синглет С7Н в области
следующим образом: малеимиды 7а-ж, как ди-
7.11-7.23 м. д. в спектрах пирроло[3,4-с]пиридинов
енофилы, циклоаннелируются к 2-замещенным
8а-с. В спектрах ЯМР 13С соединений 8ж, м при-
4-метоксиоксазолам 6а-в с образованием цикло-
сутствуют сигналы всех структурных фрагментов,
аддуктов А, которые в результате разрыва связей
что согласуется с литературными данными [28].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
378
КЛЮЧКО и др.
Схема 2.
Таким образом, 2-замещенные 4-метоксиокса-
впрыскивания - 1 мкл, УФ детекторы - 215, 254,
золы впервые были введены в реакцию Дильса-
285 нм; метод ионизации - химическая иониза-
Альдера с малеимидами, в результате которой
ция при атмосферном давлении (APCI), диапазон
были получены новые производные 6-метокси-
сканирования - m/z 80-1000. Элементный анализ
пирролопиридины. Этот подход позволяет рас-
проведен в аналитической лаборатории Инсти-
ширить спектр соединений этого класса, которые
тута биоорганической химии и нефтехимии им.
представляют интерес как потенциально биологи-
В.П. Кухаря Национальной академии наук Украи-
чески активные вещества.
ны. Содержание углерода и водорода определенно
весовым методом Прегля, азота - газометрическим
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
микрометодом Дюма, а хлора - титриметрическим
ИК спектры зарегистрированы на спектроме-
методом Шенигера
[29]. Температуры плавле-
тре Vertex-70 в таблетках KВr. Спектры ЯМР 1Н
ния измеряли на приборе Fisher-Johns. Контроль
и 13С получены на приборе Bruker AVANCE DRX-
за протеканием реакции и чистотой полученных
500 (500 и 125 МГц соответственно) в ДМСО-d6
соединений осуществляли методом тонкослой-
или CDCl3. Хромато-масс-спектры записаны при
ной хроматографии на пластинах Silufol UV-254 в
использовании жидкостной хромато-масс-спек-
системе хлороформ-метанол (10:0.2).
трометрической системы на высокоэффективном
N-(2,2,2-Трихлор-1-гидроксиэтил)арил(ци-
жидкостном хроматографе Agilent 1100 Series,
клопропил)амиды (2а-в) получены по описан-
оснащенным диодной матрицей с масс-селектив-
ной ранее методике [30]. Смесь 20 ммоль соедине-
ным детектором Agilent LC\MSD SL. Параметры
ния 1а-в, 22 ммоль хлораля и 0.1 мл конц. серной
хромато-масс-анализа: колонка Zorbax SB-C18
кислоты нагревали при 100-110°С в течение 2 ч,
1.8 мкм 4.6×15 мм (PN 821975-932); растворители:
затем обрабатывали водой. Осадок отфильтровы-
А - ацетонитрил-вода, 95:5, 0.1%-ная трифторук-
вали и промывали большим количеством воды.
сусная кислота; Б - 0.1%-ная водная трифторук-
Соединения 2а-в очищали кристаллизацией из
сусная кислота; поток элюента 3 мл/мин, объем
этанола.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ НОВЫХ 1Н-ПИРРОЛО[3,4-С]ПИРИДИН-1,3(2Н)-ДИОНОВ
379
N-(2,2,2-Трихлор-1-гидроксиэтил)бензамид
7.89 д (2Н, НAr, 3JHH 6.0 Гц), 9.06 д (1Н, NH, 3JHH
(2а). Выход 92%, т. пл. 118-120°С (т. пл. 133°С
8.6 Гц). Масс-спектр, m/z: 286 [M + H]+. Найдено,
[31]). ИК спектр, ν, см-1: 685, 806, 834, 879, 1011,
%: С 38.05; Н 2.93; Cl 49.85; N 5.06. С9Н7Cl4NО.
1115, 1278, 1351, 1490, 1531, 1578, 1636, 2864,
Вычислено, %: С 37.67; Н 2.46; Cl 49.42; N 4.88.
3066, 3325. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
3-Метокси-N-(1,2,2,2-тетрахлорэтил)бенза-
6.01-6.05 м (1Н, СН), 7.45-7.57 м (3Н, НAr), 7.77 д
мид (3б). Выход 78%, т. пл. 109-111°С. ИК спектр,
(1Н, ОН, 3JHH 6.0 Гц), 7.89 д (2Н, НAr, 3JHH 7.2 Гц),
ν, см-1: 630, 675, 697, 748, 798, 1180, 1254, 1328,
9.07 д (1Н, NH, 3JHH 7.4 Гц). Масс-спектр, m/z: 268
1442, 1569, 1655, 3270. Спектр ЯМР 1Н (CDCl3),
[M + H]+. Найдено, %: С 40.48; Н 3.21; Cl 39.72; N
δ, м. д.: 3.82 с (3Н, ОСН3), 6.01 д (1Н, СН, 3JHH
5.46. С9Н8Cl3NО2. Вычислено, %: С 40.26; Н 3.00;
8.8 Гц), 7.40-7.43 м (2Н, HAr), 7.50-7.52 м (2Н, НAr),
Cl 39.61; N 5.22.
9.00 д (1Н, NH, 3JHH 8.8 Гц). Масс-спектр, m/z: 316
3-Метокси-N-(2,2,2-трихлор-1-гидрокси-
[M + H]+. Найдено, %: С 38.05; Н 2.93; Cl 44.85; N
этил)бензамид (2б). Выход 90%, т. пл. 162-164°С.
4.50. С10Н9Cl4NО2. Вычислено, %: С 37.89; Н 2.86;
ИК спектр, ν, см-1: 695, 816, 854, 890, 1000, 1105,
Cl 44.74; N 4.42.
1288, 1361, 1496, 1588, 1635, 2860, 3056, 3320.
N-(1,2,2,2-Тетрахлорэтил)циклопропанкар-
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.80 с (3H,
боксамид (3в). Выход 64%, т. пл. 96-97°С. ИК
OCH3), 6.03-6.05 м (1Н, СН), 7.41-7.50 м (2Н,
спектр, ν, см-1: 693, 738, 782, 1056, 1190, 1280,
НAr), 7.75 д (1Н, ОН, 3JHH 6.0 Гц), 7.90 д (2Н, НAr,
1390. Спектр ЯМР 1Н (CDCl3), δ, м. д: 0.71-0.84 м
3JHH 6.7 Гц), 9.00 д (1Н, NH, 3JHH 7.2 Гц). Масс-
(4Н, CH2циклопропил), 1.80-1.85 м (1Н, CHциклопропил),
спектр, m/z: 298 [M + H]+. Найдено, %: С 40.47; Н
6.00 д (1Н, СН, 3JHH 8.7 Гц), 10.22 уш. с (1Н, NH).
3.41; Cl 35.72; N 4.80. С10Н10Cl3NО3. Вычислено,
Масс-спектр, m/z: 250 [M + H]+. Найдено, %: С
%: С 40.23; Н 3.38; Cl 35.62; N 4.69.
28.30; Н 3.05; Cl 56.75; N 5.63. С6Н7Cl4NО. Вычис-
N-(2,2,2-Трихлор-1-гидроксиэтил)цикло-
лено, %: С 28.72; Н 2.81; Cl 56.51; N 5.58.
пропанкарбоксамид
(2в). Выход
86%, т. пл.
N-(2,2-Дихлор-1-цианоэтенил)арил(цикло-
158-160°С. ИК спектр, ν, см-1: 680, 811, 863, 1000,
пропил)амиды (4а-в) получены по описанной
1111, 1270, 1348, 1485, 1516, 1570, 1630, 2860,
ранее методике [34]. К раствору 40 ммоль цианида
3061, 3320. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
калия в 12 мл воды при перемешивании и охлаж-
0.75-0.87 м (4Н, CH2 циклопропил), 1.80-1.86 м (1Н,
дении до -8°С прибавляли раствор 20 ммоль со-
CHциклопропил), 5.70-5.73 м (1Н, СН), 7.58 д (1Н, ОН,
единения 3 в 6 мл диоксана. Смесь нагревали до
3JHH 6.0 Гц), 8.81 д (1Н, NH, 3JHH 7.2 Гц). Масс-
20-25°С и перемешивали при этой температуре
спектр, m/z: 232 [M + H]+. Найдено, %: С 31.30; Н
еще 2 ч. Осадок отфильтровывали, промывали во-
3.62; Cl 46.00; N 6.34. С6Н8Cl3NО2. Вычислено, %:
дой и очищали кристализацией из бензола.
С 31.00; Н 3.47; Cl 45.75; N 6.02.
N-(2,2-Дихлор-1-цианоэтенил)бензамид (4а).
N-(1,2,2,2-Тетрахлорэтил)арил(циклопро-
Выход 88%, т. пл. 141-143°С (т. пл. 134-137°С [35]).
пил)амиды (3a-в) получены по описанной ранее
ИК спектр, ν, см-1: 648, 688, 887, 923, 1291, 1475,
методике [32]. Смесь 50 ммоль соединения 2а-в
1495, 1600, 1663, 3247. Спектр ЯМР 1Н (CDCl3),
и 5.5 мл (75 ммоль) хлористого тионила в 50 мл
δ, м. д.:
7.47-7.55 м (2Н, НAr), 7.63 т (1Н, HAr,
бензола кипятили в течение 4 ч до прекращения
3JHH 7.2 Гц), 7.82 c (1H, NH), 7.86 д (2Н, НAr, 3JHH
выделения хлористого водорода. Избыток хлори-
7.2 Гц). Масс-спектр, m/z: 241 [M + H]+. Найдено,
стого тионила удаляли в вакууме, остаток очищали
%:С 50.12; Н 2.81; Cl 29.65; N 11.65. С10Н6Cl2N2О.
перекристаллизацией из CCl4.
Вычислено, %: С 49.82; Н 2.51; Cl 29.41; N 11.62.
N-(1,2,2,2-Тетрахлорэтил)бензамид
(3a).
N-(2,2-Дихлор-1-цианоэтенил)-3-метокси-
Выход 88%, т. пл. 122-124°С (т. пл. 121-122°С
бензамид (4б). Выход 83%, т. пл. 125-127°С. ИК
[33]). ИК спектр, ν, см-1: 601, 672, 687, 742, 794,
спектр, ν, см-1: 687, 754, 896, 974, 1049, 1230, 1279,
1186, 1264, 1320, 1486, 1519, 1655, 3277. Спектр
1303, 1432, 1474, 1504, 1584, 1653, 3073, 3168.
ЯМР 1Н (CDCl3), δ, м. д.: 6.01 д (1Н, СН, 3JHH 8.6
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.82 с (3Н,
Гц), 7.44-7.48 м (2Н, НAr), 7.53-7.57 м (1Н, НAr),
ОСН3), 7.2 д (1Н, НAr, 3JHH 9.5 Гц), 7.44-7.51 м (3Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
380
КЛЮЧКО и др.
НAr), 10.64 c (1H, NH). Масс-спектр, m/z: 271 [M +
3,3-Дихлор-2-[(циклопропилкарбонил)ами-
H]+. Найдено, %: С 48.87; Н 3.15; Cl 26.43; N 10.62.
но]акриловая кислота (5в). Выход 34%, т. пл.
С11Н8Cl2N2О2. Вычислено, %: С 48.73; Н 2.97; Cl
209-211°С. ИК спектр, ν, см-1: 627, 663, 705, 884,
26.15; N 10.33.
941, 1196, 1228, 1302, 1400, 1419, 1508, 1590, 1657,
1708, 3243. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
N-(2,2-Дихлор-1-цианоэтенил)циклопропан-
0.73-0.80 м (4Н, CH2циклопропил), 1.82-1.88 м (1Н,
карбоксамид (4в). Выход 80%, т. пл. 161-163°С.
CHциклопропил), 3.06-3.08 уш. c (1Н, ОН), 10.09 с
ИК спектр, ν, см-1: 950, 1188, 1289, 1446, 1659,
(1Н, NH). Масс-спектр, m/z: 224 [M + H]+. Найдено,
3229. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.70-0.72 м
%: С 37.75; Н 3.87; Cl 31.61; N 6.50. С7Н7Cl2NО3.
(1Н, CH2циклопропил), 0.81-0.85 м (3Н, CH2циклопропил),
1.81-1.88 м (1Н, CHциклопропил), 3.57 уш. с (1Н,
Вычислено, %: С 37.53; Н 3.15; Cl 31.65; N 6.25.
NH). Масс-спектр, m/z: 205 [M + H]+. Найдено, %:
2-Арил(циклопропил)-4-метокси-1,3-оксазо-
С 41.24; Н 3.15; Cl 35.20; N 13.80. С7Н6Cl2N2О.
лы (6а-в) получены по описанной ранее методике
Вычислено, %: С 41.00; Н 2.95; Cl 34.58; N 13.66.
[37]. Смесь 28 ммоль дихлоракриловой кислоты 5,
42 мл (84 ммоль) 2 н. раствора метилата натрия и
3,3-Дихлор-2-[алканоил(ароил)амино]акри-
80 мл метанола перемешивали при 20-25°С в тече-
ловые кислоты (5а-в) получены по описанной
ние 240 ч. Избыток растворителя удаляли в вакуу-
ранее методике [36]. Соединение 4 (74 ммоль) су-
ме, остаток обрабатывали 150 мл воды и экстраги-
спендировали в 160 мл конц. хлористоводородной
кислоты, реакционнную смесь кипятили 15 мин и
ровали хлористым метиленом (3 × 30мл). Экстракт
промывали водой (4 × 5 мл) и сушили Na2SO4, рас-
охлаждали. Осадок отфильтровывали, промыва-
творитель удаляли в вакууме.
ли водой и прибавляли небольшими порциями к
320 мл конц. водного раствора NaHCO3. Нерас-
4-Метокси-2-фенил-1,3-оксазол (6а). Выход
творившийся осадок отфильтровывали, фильтрат
67%, т. пл. 65-67°С (гексан) (т. пл. 65-67°С [37]).
подкисляли конц. хлористоводородной кислотой
ИК спектр, ν, см-1: 660, 689, 721, 776, 838, 933, 983,
до pH 2. Осадок отфильтровывали, промывали во-
1047, 1066, 1105, 1173, 1254, 1304, 1352, 1450, 1498,
дой и очищали кристаллизацией из водного ацетона.
1599, 2839, 2937, 3117. Спектр ЯМР 1Н (CDCl3), δ,
3,3-Дихлор-2-(бензоиламино)акриловая кис-
м. д.: 3.82 c (3H, OCH3), 7.15 c (1H, C5H), 7.41-7.42
м (3Н, НAr), 7.97-7.99 м (2Н, HAr). Масс-спектр,
лота (5а). Выход 74%, т. пл. 219-221°С (т. пл. 190-
m/z: 176 [M + H]+. Найдено, %: С 68.75; Н 5.50; N
193°С, разл. [36]). ИК спектр, ν, см-1: 658, 679, 692,
8.04. С10Н9NО2. Вычислено, %: С 68.56; Н 5.18; N
797, 881, 1076, 1125, 1163, 1280, 1310, 1425, 1479,
8.00.
1581, 1599, 3236. Спектр ЯМР 1Н (ДМСО-d6), δ,
м. д.: 3.15-3.72 уш. с (1Н, ОН), 7.49-7.53 м (2Н,
4-Метокси-2-(3-метоксифенил)-1,3-оксазол
НAr), 7.59-7.62 м (1Н, НAr), 7.93 д (2H, HAr, 3JHH
(6б). Выход 67%, желтое масло. ИК спектр, ν, см-1:
7.5 Гц), 10.27 с (1Н, NH). Масс-спектр, m/z: 260
682, 738, 755, 1036, 1219, 1254, 1338, 1457, 1490,
[M + H]+. Найдено, %: С 46.42; Н 2.74; Cl 27.15; N
1594. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 3.85 c (6H,
5.49. С10Н7Cl2NО3. Вычислено, %: С 46.18; Н 2.71;
2OCH3), 6.98 д (1Н, НAr, 3JHH 8.0 Гц), 7.17 c (1Н,
Cl 27.26; N 5.39.
C5H), 7.32 т (1Н, НAr, 3JHH 8.0 Гц), 7.59 с (1Н, НAr),
7.60 д (1Н, НAr, 3JHH 8.0 Гц). Масс-спектр, m/z:
3,3-Дихлор-2-(3-метоксибензоиламино)акри-
206 [M + H]+. Найдено, %: С 64.58; Н 5.70; N 7.03.
ловая кислота (5б). Выход 49%, т. пл. 207-209°С.
С11Н11NО3. Вычислено, %: С 64.38; Н 5.40; N 6.83.
ИК спектр, ν, см-1: 668, 686, 700, 873, 993, 1184,
1208, 1240, 1276, 1297, 1313, 1414, 1478, 1504,
4-Метокси-2-циклопропил-1,3-оксазол
(6в).
1596, 1650, 1712, 3245. Спектр ЯМР 1Н (ДМСО-d6),
Выход 37%, желтое масло. ИК спектр, ν, см-1: 956,
δ, м. д.: 2.97 уш. с (1Н ОН), 3.81 с (3Н, ОСН3),
1027, 1055, 1096, 1155, 1273, 1608, 1651. Спектр ЯМР
7.18 д (1Н, НAr, 3JHH 7.0 Гц), 7.41-7.52 м (3Н, HAr),
1Н (CDCl3), δ, м. д: 0.96-1.02 м (4Н, СН2циклопропил),
10.23 с (1Н, NH). Масс-спектр, m/z: 290 [M + H]+.
1.92-1.95 м (1Н, СНциклопропил), 3.72 с (3Н, ОСН3),
Найдено, %: С 45.78; Н 3.33; Cl 24.65; N 5.05.
6.91 с (1Н, C5H). Масс-спектр, m/z: 140 [M + H]+.
С11Н9Cl2NО4. Вычислено, %: С 45.54; Н 3.13; Cl
Найдено, %: С 60.67; Н 6.81; N 10.29. С7Н9NО2.
24.44; N 4.83.
Вычислено, %: С 60.42; Н 6.52; N 10.07.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ НОВЫХ 1Н-ПИРРОЛО[3,4-С]ПИРИДИН-1,3(2Н)-ДИОНОВ
381
Замещенные
1Н-пиррол-2,5-дионы
(7а-ж)
НAr, 3JHH 8.6 Гц). Масс-спектр, m/z: 246 [M + H]+.
получены по методике [38].
Найдено, %: С 63.95; Н 4.75; N 5.94. С13Н11NО4.
Вычислено, %: С 63.67; Н 4.52; N 5.71.
1Н-Пиррол-2,5-дион (7а). Выход 91%, т. пл.
96-98°С (т. пл. 92-94°С [39]). ИК спектр, ν, см-1:
1-(4-Этоксифенил)-1Н-пиррол-2,5-дион (7е).
417, 625, 645, 679, 720, 725, 841, 936, 1138, 1153,
Выход 85%, т. пл. 116-118°С (т. пл. 133-134°С
1300, 1340, 1621, 1708, 1772, 1802. Спектр ЯМР 1Н
[44]). ИК спектр, ν, см-1: 519, 687, 719, 831, 1035,
(ДМСО-d6), δ, м. д.: 6.83 с (2Н, СН), 10.82 уш. с
1047, 1115, 1153, 1172,1256, 1301, 1401, 1415, 1476,
(1Н, NH). Масс-спектр, m/z: 98 [M + H]+. Найдено,
1518, 1660, 1704, 1750. Спектр ЯМР 1Н (CDCl3),
%: С 49.55; Н 3.20; N 14.30. С4Н3NО2. Вычислено,
δ, м. д : 1.41-1.43 м (3Н, СН3), 4.04-4.06 м (2Н,
%: С 49.49; Н 3.12; N 14.43.
СН2СН3), 6.82 с (2Н, СН), 6.97 д (2Н, НAr, 3JHH
8.8 Гц), 7.22 д (2Н, НAr, 3JHH 8.8 Гц). Масс-спектр,
1-Метил-1Н-пиррол-2,5-дион
(7б). Выход
94%, т. пл. 111-113°С (т. пл. 96°С [40]). ИК спектр,
m/z: 218 [M + H]+. Найдено, %: С 66.58; Н 5.35; N
6.67. С13Н11NО4. Вычислено, %: С 66.35; Н 5.10;
ν, см-1: 612, 631, 668, 696, 831, 940, 1180, 1253,
N 6.45.
1387, 1400, 1439, 1457, 1587, 1600, 1673, 1702,
1721, 1752, 1766, 3095, 3102. Спектр ЯМР 1Н
1-(3,4-Диметилфенил)-1Н-пиррол-2,5-дион
(ДМСО-d6), δ, м. д.: 2.96 с (3Н, СН3), 6.67 с (2Н,
(7ж). Выход 90%, т. пл. 130-132°С (т. пл. 152-
СН). Масс-спектр, m/z: 112 [M + H]+. Найдено, %:
154°С [45]). ИК спектр, ν, см-1: 442, 596, 610, 676,
С 54.30; Н 4.70; N 12.90. С5Н5NО2. Вычислено, %:
690, 711, 818, 830, 844, 883, 1080, 1146, 1375, 1390,
С 54.06; Н 4.54; N 12.61.
1414, 1449, 1710. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
1-(4-Метоксифенил)-1Н-пиррол-2,5-дион
2.29 с (6Н, 2СН3), 6.82 с (2Н, СН), 7.06-7.14 м (2Н,
НAr), 7.23 д (1Н, НAr, 3JHH 8.1 Гц). Масс-спектр,
(7в). Выход 94%, т. пл. 149-151°С (т. пл. 153-154°С
m/z: 202 [M + H]+. Найдено, %: С 71.88; Н 5.66; N
[41]). ИК спектр, ν, см-1: 445, 550, 600, 690, 711,
6.71. С12Н11NО2. Вычислено, %: С 71.63; Н 5.51;
800, 812, 830, 1072, 1145, 1213, 1225, 1252, 1371,
N 6.96.
1402, 1510, 1673, 1710, 1722, 1748. Спектр ЯМР 1Н
(CDCl3), δ, м. д.: 3.83 с (3Н, ОСН3), 6.83 с (2Н, СН),
4-Арил(циклопропил)-6-метокси-1Н-пирро-
6.98 д (2Н, HAr, 3JHH 8.8 Гц), 7.22 д (2Н, НAr, 3JHH
ло[3,4-c]пиридин-1,3(2Н)-дионы
(8а-с). Смесь
8.8 Гц). Масс-спектр, m/z: 204 [M + H]+. Найдено,
1.4 ммоль соединения 6 и 1.4 ммоль соединения
%: С 65.20; Н 4.66; N 7.10. С11Н9NО3. Вычислено,
7 в 3.5 мл ксилола кипятили в течение 4 ч для со-
%: С 65.02; Н 4.46; N 6.89.
единений 6а, б и 1 ч для соединения 6в. Осадок
отфильтровывали, промывали 1 мл бензола, суши-
1-(4-Фторфенил)-1Н-пиррол-2,5-дион
(7г).
ли на воздухе и очищали перекристаллизацией из
Выход 90%, т. пл. 136-138°С (т. пл. 136-138°С
этилацетата.
[42]). ИК спектр, ν, см-1: 450, 515, 599, 685, 713,
769, 819, 837, 1073, 1150, 1204, 1231, 1262, 1374,
6-Метокси-4-фенил-1Н-пирроло[3,4-c]пи-
1392, 1409, 1515, 1680, 1713, 1721, 1750. Спектр
ридин-1,3(2Н)-дион (8а). Выход 60%, т. пл. 225-
ЯМР 1Н (CDCl3), δ, м. д.: 6.84 с (2Н, СН), 7.14-7.16
227°С. ИК спектр, ν, см-1: 632, 685, 747, 1109, 1212,
м (2Н, HAr), 7.30-7.32 м (2Н, HAr). Масс-спектр,
1408, 1448, 1469, 1573, 1625, 1733, 2738, 3075,
m/z: 192 [M + H]+. Найдено, %: С 63.05; Н 3.50; N
3191. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д: 4.02 с
7.53. С10Н6FNО2. Вычислено, %: С 62.83; Н 3.16;
(3Н, ОСН3), 7.11 с (1Н, C7H), 7.49-7.50 м (3Н, НAr),
N 7.33.
7.99-8.00 д (2Н, НAr, 3JHH 5.6 Гц), 11.53 уш. с (1Н,
NH). Масс-спектр, m/z: 255 [M + H]+. Найдено, %:
Этил-4-(2,5-диоксо-2,5-дигидро-1H-пиррол-
1-ил)бензоат (7д). Выход 83%, т. пл. 113-115°С
С 65.95; Н 4.12; N 10.84. С14Н10N2О3. Вычислено,
%: С 66.14; Н 3.96; N 11.02.
(т. пл. 114-116°С [43]). ИК спектр, ν, см-1: 688,
703, 766, 828, 834, 857, 1108, 1144, 1175, 1256,
2-Метил-6-метокси-4-фенил-1Н-пирро-
1284, 1308, 1385, 1397, 1414, 1512, 1605, 1709,
ло[3,4-c]пиридин-1,3(2Н)-дион (8б). Выход 79%,
1716. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.38-1.40
т. пл. 153-154°С. ИК спектр, ν, см-1: 746, 1252,
м (3Н, CH2СН3), 4.36-4.39 м (2Н, СН2СН3), 6.87 с
1405, 1449, 1626, 1727. Спектр ЯМР 1Н (CDCl3),
(2Н, СН), 7.48 д (2Н, НAr, 3JHH 8.6 Гц), 8.14 д (2Н,
δ, м. д.: 3.18 с (3Н, СН3), 4.13 с (3Н, ОСН3), 7.11 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
382
КЛЮЧКО и др.
(1Н, C7H), 7.49-7.52 м (3Н, НAr), 8.08 м (2Н, НAr).
2-(3,4-Диметилфенил)-6-метокси-4-фе-
Масс-спектр, m/z: 269 [M + H]+. Найдено, %: С
нил-1Н-пирроло[3,4-c]-пиридин-1,3(2Н)-дион
66.96; Н 4.31; N 10.23. С15Н12N2О3. Вычислено, %:
(8ж). Выход 95%, т. пл. 211-212°С. ИК спектр,
С 67.16; Н 4.51; N 10.44.
ν, см-1: 748, 1384, 1473, 1629, 1720. Спектр ЯМР
1Н, (CDCl3), δ, м. д.: 2.31 с (6Н, 2СН3), 4.17 с (3Н,
6-Метокси-2-(4-метоксифенил)-4-фенил-
ОСН3), 7.13-7.28 м (4Н, НAr + C7H), 7.51-7.53 м
1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
(8в).
(3Н, НAr), 8.13-8.15 м (2Н, НAr). Спектр ЯМР 13С
Выход 80%, т. пл. 192-194°С. ИК спектр, ν, см-1:
(CDCl3), δс, м. д.: 19.5, 19.9, 54.9, 104.6, 114.7,
680, 747, 821, 1032, 1095, 1169, 1212, 1254, 1382,
124.2, 127.7, 127.8, 128.0, 128.1, 129.0, 130.2, 130.3,
1471, 1515, 1626, 1723. Спектр ЯМР 1Н (CDCl3), δ,
130.6, 135.7, 137.2, 137.6, 144.5, 156.3, 165.2, 166.1,
м. д.: 3.85 с (3Н, ОСН3), 4.17 с (3Н, ОСН3), 7.01 д
166.7. Масс-спектр, m/z: 359 [M + H]+. Найдено, %:
(2Н, НAr, 3JHH 8.8 Гц), 7.22 с (1Н, C7H), 7.34 д (2Н,
С 73.59; Н 4.82; N 7.85. С22Н18N2О3. Вычислено,
НAr, 3JHH 8.8 Гц), 7.51-7.53 м (3Н, НAr), 8.12-8.14 м
%: С 73.73; Н 5.06; N 7.82.
(2Н, НAr). Масс-спектр, m/z: 361 [M + H]+. Найде-
2-Метил-6-метокси-4-(3-метоксифенил)-
но, %: С 70.22; Н 4.41; N 7.90. С21Н16N2О4. Вычис-
1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
(8з).
лено, %: С 69.99; Н 4.48; N 7.77.
Выход 54%, т. пл. 155-157°С. ИК спектр, ν, см-1:
6-Метокси-4-фенил-2-(4-фторфенил)-
754, 986, 1248, 1375, 1405, 1435, 1473, 1625, 1721.
1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
(8г).
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 3.18 с (3Н, СН3),
Выход 45%, т. пл. 217-218°С. ИК спектр, ν, см-1:
3.91 с (3Н, ОСН3), 4.12 с (3Н, ОСН3), 7.06 д (1Н,
749, 1091, 1110, 1213, 1234, 1366, 1388, 1409, 1450,
НAr, 3JHH 8.3 Гц), 7.12 с (1Н, C7H), 7.42 т (1Н, HAr,
1471, 1515, 1625, 1721. Спектр ЯМР 1Н (CDCl3), δ,
3JHH 8.8 Гц), 7.71 д (2Н, НAr, 3JHH 7.7 Гц). Масс-
м. д.: 4.17 с (3Н, ОСН3), 7.17-7.23 м (3Н, C7H + HAr),
спектр, m/z: 299 [M + H]+. Найдено, %: С 64.48; Н
7.40-7.43 м (2Н, HAr), 7.51-7.52 м (3Н, HAr), 8.09-
4.63; N 9.44. С16Н14N2О4. Вычислено, %: С 64.42;
8.10 м (2Н, HAr). Масс-спектр, m/z: 349 [M + H]+.
Н 4.73; N 9.39.
Найдено, %: С 68.76; Н 3.54; N 7.83. С20Н13FN2О3.
6-Метокси-4-(3-метоксифенил)-2-(4-фторфе-
Вычислено, %: С 68.96; Н 3.76; N 8.04.
нил)-1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
4-(6-Mетокси-1,3-диоксо-4-фенил-1,3-ди-
(8и). Выход 43%, т. пл. 249-250°С. ИК спектр, ν,
гидро-2Н-пирроло[3,4-c]пиридин-2-ил)этил-
см-1: 754, 814, 1092, 1110, 1135, 1182, 1204, 1228,
бензоат (8д). Выход 49%, т. пл. 130-132°С. ИК
1357, 1470, 1514, 1576, 1598, 1626, 1721. Спектр
спектр, ν, см-1: 835, 1111, 1277, 1382, 1471, 1627,
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.88 с (3Н, ОСН3),
1722. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.38 т (3Н,
4.15 с (3Н, ОСН3), 7.10 д (1Н, НAr, 3JHH 5.6 Гц),
СН2СН3, 3JHH 7.4 Гц), 4.14 с (3Н, ОСН3), 4.37 к (2Н,
7.27 с (1Н, C7H), 7.33-7.34 м (2Н, НAr), 7.42-7.43
СН2СН3, 3JHH 7.0 Гц), 7.20 с (1Н, C7H), 7.49-7.51
м (1Н, HAr), 7.48-7.49 м (2Н, HAr), 7.67-7.69 м (2H,
м (3Н, НAr), 7.53 д (2H, НAr, 3JHH 8.8 Гц), 8.04-8.07
HAr). Масс-спектр, m/z: 379 [M + H]. Найдено, %:
м (2Н, НAr), 8.15 д (2H, НAr, 3JHH 8.8 Гц). Масс-
С 66.40; Н 3.75; N 7.28. С21Н15FN2О4. Вычислено,
спектр, m/z: 403 [M + H]+. Найдено, %: С 68.90; Н
%: С 66.66; Н 4.00; N 7.40.
4.65; N 7.18. С23Н18N2О5. Вычислено, %: С 68.65;
4-(6-Метокси-4-(3-метоксифенил)-1,3-ди-
Н 4.51; N 6.96.
оксo-1,3-дигидро-2Н-пирроло[3,4-c]пиридин-
6-Метокси-4-фенил-2-(4-этоксифенил)-
2-ил)этилбензоат (8к). Выход 80%, т. пл. 172-
1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
(8е).
173°С. ИК спектр, ν, см-1: 1105, 1250, 1277, 1380,
Выход 53%, т. пл. 191-193°С. ИК спектр, ν, см-1:
1413, 1472, 1512, 1628, 1721. Спектр ЯМР 1Н
1255, 1396, 1473, 1515, 1630, 1718. Спектр ЯМР 1Н
(CDCl3), δ, м. д.: 1.42 т (3Н, СН2СН3, 3JHH 7.0 Гц),
(CDCl3), δ, м. д.: 1.45 т (3Н, СН2СН3, 3JHH 7.0 Гц),
3.89 с (3Н, ОСН3), 4.17 с (3Н, ОСН3), 4.42 к (2Н,
4.10 к (2Н, СН2СН3, 3JHH 7.0 Гц), 4.15 c (3Н, ОСН3),
СН2СН3, 3JHH 7.0 Гц), 7.08 д (1Н, НAr, 3JHH 7.9 Гц),
7.01 д (2Н, HAr, 3JHH 8.8 Гц), 7.22 с (1Н, C7H), 7.31 д
7.23 с (1Н, C7H), 7.43 т (1Н, НAr, 3JHH 7.3 Гц), 7.57
(2Н, НAr, 3JHH 8.8 Гц), 7.51-7.54 м (3Н, НAr), 8.10-
д (2Н, НAr, 3JHH 8.3 Гц), 7.67-7.71 м (2Н, НAr),
8.13 м (2Н, НAr). Масс-спектр, m/z: 375 [M + H]+.
8.17 д (2Н, НAr, 3JHH 8.3 Гц). Масс-спектр, m/z:
Найдено, %: С 70.43; Н 5.04; N 7.78. С22Н18N2О4.
433 [M + H]+. Найдено, %: С 66.79; Н 4.82; N 6.42.
Вычислено, %: С 70.58; Н 4.85; N 7.48.
С24Н20N2О6. Вычислено, %: С 66.66; Н 4.66; N 6.48.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ НОВЫХ 1Н-ПИРРОЛО[3,4-С]ПИРИДИН-1,3(2Н)-ДИОНОВ
383
6-Метокси-4-(3-метоксифенил)-2-(4-этокси-
7.20-7.27 м (2Н, НAr), 7.38-7.42 м (2Н, НAr). Масс-
фенил)-1Н-пирроло[3,4-c]-пиридин-1,3(2Н)-ди-
спектр, m/z: 313 [M + H]+. Найдено, %: С 65.44; Н
он (8л). Выход 32%, т. пл. 178-180°С. ИК спектр,
4.01; N 8.53. С17Н13FN2О3. Вычислено, %: С 65.38;
ν, см-1: 1027, 1104, 1253, 1360, 1374, 1392, 1465,
Н 4.20; N 8.97.
1519, 1619, 1710, 1724. Спектр ЯМР 1Н (CDCl3),
4-(6-Метокси-4-циклопропил-1,3-диоксо-
δ, м. д.: 1.44 т (3Н, СН2СН3, 3JHH 7.1 Гц), 3.89 с
1,3-дигидро-2Н-пирроло[3,4-c]пиридин-2-ил)-
(3Н, ОСН3), 4.08 к (2Н, СН2СН3, 3JHH 7.1 Гц), 4.16
этилбензоат (8п). Выход 36%, т. пл. 174-176°С.
с (3Н, ОСН3), 7.00 д (2Н, НAr, 3JHH 8.8 Гц), 7.07 д
ИК спектр, ν, см-1: 762, 820, 927, 1019, 1107, 1269,
(1Н, НAr, 3JHH 8.1 Гц), 7.22 с (1Н, C7H), 7.30 д (2Н,
1382, 1470, 1597, 1623, 1715. Спектр ЯМР 1Н
НAr, 3JHH 8.8 Гц), 7.42 т (1Н, НAr, 3JHH 8.1 Гц), 7.70-
(CDCl3), δ, м. д.: 1.12-1.17 м (2Н, СН2циклопропил),
7.75 м (2Н, НAr). Масс-спектр, m/z: 405 [M + H]+.
1.28-1.33 м (2Н, СН2циклопропил), 1.42 т (3Н, СН2СН3,
Найдено, %: С 68.44; Н 5.14; N 6.82. С23Н20N2О5.
3JHH 7.2 Гц), 3.12-3.15 м (1Н, СНциклопропил), 3.98 с
Вычислено, %: С 68.31; Н 4.98; N 6.93.
(1Н, OСН3), 4.42 к (2Н, СН2СН3, 3JHH 7.2 Гц), 6.95
2-(3,4-Диметилфенил)-6-метокси-4-(3-ме-
с (1Н, C7H), 7.57 д (2Н, НAr, 3JHH 8.0 Гц), 8.19 д (2Н,
токсифенил)-1Н-пирроло-[3,4-c]пиридин-
НAr, 3JHH 8.0 Гц). Масс-спектр, m/z: 367 [M + H]+.
1,3(2Н)-дион (8м). Выход 50%, т. пл. 186-187°С.
Найдено, %: С 65.40; Н 5.01; N 7.47. С20Н18N2О5.
ИК спектр, ν, см-1: 1204, 1386, 1404, 1470, 1627,
Вычислено, %: С 65.57; Н 4.95; N 7.65.
1718, 1721. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
6-Метокси-4-циклопропил-2-(4-этоксифе-
2.32 с (6Н, СН3), 3.89 с (3Н, ОСН3), 4.16 с (3Н,
нил)-1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
ОСН3), 7.08 д (1Н, НAr, 3JHH 7.7 Гц), 7.15 д (1Н,
(8р). Выход 83%, т. пл. 184-185°С. ИК спектр,
НAr, 3JHH 7.7 Гц), 7.18 с (1Н, НAr), 7.22 с (1Н, C7H),
ν, см-1: 725, 938, 1103, 1115, 1150, 1172, 1248,
7.27 д (1Н, НAr, 3JHH 7.3 Гц), 7.42 т (1Н, НAr, 3JHH
1330, 1383, 1425, 1475, 1515, 1600, 1630, 1709.
7.7 Гц), 7.73 д (2Н, НAr, 3JHH 7.7 Гц). Спектр ЯМР
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.13-1.17 м (2Н,
13С (CDCl3), δС, м. д.: 19.5, 19.8, 54.9, 55.5, 104.7,
СН2циклопропил), 1.27-1.32 м (2Н, СН2циклопропил),
114.7, 115.5, 116.5, 116.6, 122.6, 124.2, 127.8, 129.0,
1.46 т (3Н, СН2СН3, 3JHH 6.7 Гц), 3.12-3.16 м (1Н,
130.2, 137.1, 137.3, 137.6, 144.6, 156.1, 159.3, 165.2,
СНциклопропил), 3.97 с (3Н, ОСН3), 4.08 к (2Н,
166.1, 166.7. Масс-спектр, m/z: 389 [M + H]+. Най-
СН2СН3, 3JHH 6.7 Гц), 6.92 с (1Н, C7H), 6.99 д (2Н,
дено, %: С 70.97; Н 5.00; N 7.29. С23Н20N2О4. Вы-
НAr, 3JHH 8.6 Гц), 7.29 д (2Н, НAr, 3JHH 8.6 Гц). Масс-
числено, %: С 71.12; Н 5.19; N 7.21.
спектр, m/z: 339 [M + H]+. Найдено, %: С 67.57; Н
2-Метил-6-метокси-4-циклопропил-1Н-пир-
5.52; N 8.17. С19Н18N2О4. Вычислено, %: С 67.45;
роло[3,4-c]пиридин-1,3(2Н)-дион
(8н). Выход
Н 5.36; N 8.28.
52%, т. пл. 158-160°С. ИК спектр, ν, см-1: 754,
2-(3,4-Диметилфенил)-6-метокси-4-цикло-
942, 986, 1172, 1273, 1325, 1384, 1437, 1450, 1474,
пропил-1Н-пирроло[3,4-c]-пиридин-1,3(2Н)-ди-
1591, 1619, 1711. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
он (8с). Выход 51%, т. пл. 145-147°С. ИК спектр, ν,
1.12-1.16 м (2Н, СН2циклопропил), 1.24-1.27 м (2Н,
см-1: 816, 1111, 1273, 1329, 1383, 1406, 1598, 1624,
СН2циклопропил), 3.07-3.12 м (1Н, СНциклопропил), 3.17
1706. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.13-1.17 м
с (3Н, СН3), 3.95 с (3Н, ОСН3), 6.85 с (1Н, C7H).
(2Н, СН2циклопропил), 1.27-1.32 м (2Н, СН2циклопропил),
Масс-спектр, m/z: 233 [M + H]+. Найдено, %: С
2.32 с (6Н, СН3), 3.12-3.18 м (1Н, СНциклопропил),
62.09; Н 5.03; N 12.16. С12Н12N2О3. Вычислено, %:
3.97 с (3Н, ОСН3), 6.94 с (1Н, C7H), 7.12 д (1Н, НAr,
С 62.06; Н 5.21; N 12.06.
3JHH 8.1 Гц), 7.17 с (1Н, HAr), 7.26 д (1Н, HAr, 3JHH
6-Метокси-4-циклопропил-2-(4-фторфе-
8.1 Гц). Масс-спектр, m/z: 323 [M + H]+. Найдено,
нил)-1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион
%: С 70.57; Н 5.62; N 8.74. С19Н18N2О3. Вычисле-
(8о). Выход 45%, т. пл. 173-176°С. ИК спектр, ν,
но, %: С 70.79; Н 5.63; N 8.69.
см-1: 522, 574, 759, 812, 836, 887, 910, 1129, 1386,
ФОНДОВАЯ ПОДДЕРЖКА
1472, 1513, 1603, 1630, 1712, 1770. Спектр ЯМР 1Н
(CDCl3), δ, м. д.: 1.16-1.21 м (2Н, СН2циклопропил),
Работа выполнена при финансовой поддержке
1.29-1.33 м (2Н, СН2циклопропил), 3.12-3.16 м (1Н,
Национального фонда исследований Украины
СНциклопропил), 3.99 с (3Н, ОСН3), 6.95 с (1Н, C7H),
(проект № 2020.01/0075).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
384
КЛЮЧКО и др.
КОНФЛИКТ ИНТЕРЕСОВ
Chibale K. // J. Med. Chem. 2015. Vol. 58. P. 9371. doi
10.1021/acs.jmedchem.5b01542
Авторы заявляют об отсутствии конфликта
16.
Katritzky A.R., Rees Ch.W. // Compr. Heterocycl. Chem.
интересов.
1984. Vol. 6. P. 196. doi 10.1002/jps.2600740232
17.
Turchi I.J. Oxazoles. New York: Wiley, 1986. P. 114.
CПИСОК ЛИТЕРАТУРЫ
18.
Boger D.L. // Tetrahedron. 1983. Vol. 39. N 18. P. 2869.
1.
Bean G.P. In: Pyrroles / Ed. R.A. Jones. New York: John
doi 10.1016/S0040-4020(01)92154-4
Wiley and Sons, 1990. Vol. 48. P. 105.
19.
Boger D.L. // Chem. Rev. 1986. Vol. 86. N 5. P. 781. doi
2.
Chemistry of Heterocyclic Compounds: Pyrroles, Part
10.1021/cr00075a004
One: The Synthesis and the Physical and Chemical
20.
Hassner A., Fischer B. // Heterocycles. 1993. Vol. 35.
Aspects of the Pyrrole Ring / Ed. R.A. Jones. New
N 2. P. 1441. doi 10.3987/REV-92-SR(T)6
York: John Wiley and Sons, 1992. Vol. 48. 742 p. doi
21.
Ducept P.C., Marsden S.P. // Arkivoc. 2002. Vol. 6.
10.1002/978047018732
P. 22. doi 10.3998/ark.5550190.0003.604
3.
Gossauer A. Die Chemie der Pyrrole. Berlin; New York:
22.
Bondock S. // Heteroatom Chem. 2005. Vol. 16. N 1.
Springer, 1974. 436 p.
P. 49. doi 10.1002/hc.20064
4.
Lehuédé J., Fauconneau R., Barrier L., Ouracow M.,
23.
Ju L., Li X., Lyu Q., Qi Y., Wang Ch. Pat. CN
Piriou A., Vierfond J.-M. // Eur. J. Med. Chem. 1999.
109956899A (2017).
Vol. 34. P. 991. doi 10.1016/S0223-5234(99)00111-7
24.
Bachmann Th., Rychlik M. // Molecules. 2018. Vol. 23.
5.
Bürli R.W., McMinn D., Kaizerman J.A., Hu W., Ge
N 9. P. 2117. doi 10.3390/molecules23092117
Y., Pack Q., Jiang V., Gross M., Gracia M., Tanaka R.,
25.
Toshikazu I., Hiroyuki N., Yasushi I., Kiyoshi M. // Bull.
Moser H.E. // Bioorg. Med. Chem. Lett. 2004. Vol. 14.
Chem. Soc. Japan. 1986. Vol. 59. N 10. P. 3197. doi
P. 1253. doi 10.1016/j.bmcl.2003.12.042
10.1246/bcsj.59.3197
6.
Bürli R.W., Jones P., McMinn D., Le Q., Duan J.-X.,
26.
Lossouarn A., Renault K., Bailly L., Frisby A., Le
Kaizerman J.A., Difuntorum S., Moser H.E. // Bioorg.
Nahenec-Martel P., Renard P.-Y., Sabot C. // Org.
Med. Chem. Lett. 2004. Vol. 14. P. 1259. doi 10.1016/j.
Biomol. Chem. 2020. Vol. 18. N 20. P 3874. doi 0.1039/
bmcl.2003.12.043
D0OB00403K
7.
Jonas R., Klockow M., Lues I., Prücher H., Schliep H.J.,
27.
Renault K., Jouanno L.-A., Lizzul-Jurse A., Renard P.-Y.,
Wurziger H. // Eur. J. Med. Chem. 1993. Vol. 28. P. 129.
Sabot C. // Chem. Eur. J. 2016. Vol. 22. N 51. P 18522.
doi 10.1016/0223-5234(93)90005-Y
doi 10.1002/chem.201603617
8.
Von der Saal W., Hoelck J.-P., Kampe W., Mertens A.,
28.
Dubois K.J., Fannes Ch.C., Compernolle F., Hoor-
Mueller-Beckmann B. // J. Med. Chem. 1989. Vol 32.
naert G.J. // Tetrahedron. 1996. Vol. 52. N 7. P. 2591.
P. 1481. doi 10.1021/jm00127a015
doi 10.1016/0040-4020(95)01084-X
9.
Denny W.A., Rewcastle G.W., Baguley B.C. // J. Med.
29.
Климова, В.А. Основные микрометоды анализа орга-
Chem. 1990. Vol. 33. P. 814. doi 10.1021/jm00164a054
нических соединений. M.: Химия, 1975.
10.
Toja E., Selva D., Schiatti P. // J. Med. Chem. 1984.
30.
Demydchuk B.A., Kondratyuk K.M., Korniyenko
Vol. 27. P. 610. doi 10.1021/jm00371a010
A.N., Brovarets V.S., Vasylyshyn R.Y., Tolmachev A.,
11.
Demopoulos V.J., Rekka E. // J. Pharm. Sci. 1995.
Lukin O. // Synth. Commun. 2012. Vol. 42. P. 2866. doi
Vol. 84. P. 79.
12.
Del Poeta M., Schell W.A., Dykstra C.C., Jones S.,
10.1080/00397911.2011.571356
Tidwell R.R., Czarny A., Bajic M., Bajic M., Kumar A.,
31.
Guirado A., Andreu R., Cerezo A., Galvez J. //
Tetrahedron. 2001. Vol. 57. N 23. P. 4925. doi 10.1016/
Boykin D., Perfect J.R. // Antimicrob. Agents
Chemother. 1998. Vol. 42. P. 2495. doi 10.1128/
S0040-4020(01)00434-3
AAC.42.10.2495
32.
Kasper F., Bottger H. // Zeit. Chem. 1987. Vol. 27. N 2.
13.
Mohamed M.S., Fathallah S.S. // Mini-Rev.
P 70. doi 10.1002/zfch.19870270215
Org. Chem. 2014. Vol. 11. P. 477. doi 10.2174/
33.
Bohme H., Eiden F., Schunemann D. // Arch.
1570193X113106660018
Pharm. 1961. Vol. 294. N 5. P 307. doi 10.1002/
14.
Muszalska I. // Acta Polonial Pharm. Drug. Res. 2010.
ardp.19612940509
Vol. 67. P. 233.
34.
Драч Б.С., Свиридов Э.П., Кисиленко А.А., Кирса-
15.
Westhuyzen R., Winks S., Wilson C.R., Boyle G.A.,
нов А.В. // ЖОрХ. 1973. Т. 9. Вып. 9. С. 1818.
Gessner R.K., de Melo C.R., Taylor D., de Kock C.,
35.
Драч Б.С., Свиридов Э.П., Лавренюк Т.Я. // ЖОрХ.
Njoroge M., Brunschwig Ch., Lawrence N., Rao S.P.S.,
1974. Т. 10. Вып. 6. С. 1271.
Sirgel F., Helden P., Seldon R., Moosa A., Warner D.P.,
36.
Драч Б.С., Миськевич Г.Н. // ЖОрХ. 1974. Т. 10.
Arista L., Manjunatha U.H., Smith P.W., Street L.J.,
Вып. 11. С. 2315.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ НОВЫХ 1Н-ПИРРОЛО[3,4-С]ПИРИДИН-1,3(2Н)-ДИОНОВ
385
37.
Драч Б.С., Седлов А.И., Миськевич Г.Н. // ЖОХ. 1978.
42. Pal B., Pradhan P.K., Jaisankar P., Giri V.S. // Synthesis.
Т. 14. Вып. 9. С. 1827.
2003. Vol. 10. P 1549. doi 10.1055/s-2003-40523
38.
Noland W.E., Lanzatella N.P., Venkatraman L.,
43. Колямшин О.А., Данилов В.А., Кольцов Н.И. // ЖОрХ.
Anderson N.F., Gullickson G.C. // J. Heterocycl. Chem.
2007. Т. 43. Вып. 3. С. 395; Kolyamshin O.A., Danilov
2009. Vol. 46. P 1154. doi 10.1002/jhet.198
V.A., Kol’tsov V.I. // Russ. J. Org. Chem. 2007. Vol. 43.
39.
Tawney P.O., Snyder R.H., Bryan C.E., Conger R.P.,
N 3. P 393. doi 10.1134/S1070428007030104
Dovell F.S., Kelly R.J., Stiteler C.H. // J. Org. Chem.
44. Roderick W.R. // J. Am. Chem. Soc. 1957. Vol. 79. N 7.
1960. Vol. 25. N 1. P 56. doi 10.1021/jo01071a017
P 1710. doi 10.1021/ja01564a050
40.
Mehta N.B., Philips A.P., Lui F.F., Brooks R.E. // J.
45. Jha A., Mukherjee Ch., Prasad A.K., Parmar V.S.,
Org. Chem. 1960. Vol. 25. N 6. P 1012. doi 10.1021/
Vadaparti M., Das U., De Clercq E., Balzarini J., Stables
jo01076a038
41.
Lu Ch.-D., Chen Zh.-Y., Liu H., Hu W.-H., Mi A.-Q.,
J.P., Shrivastav A., Sharma R.K., Dimmock J.R. //
Doyle M. P. // J. Org. Chem. 2004. Vol. 69. N 14.
Bioorg. Med. Chem. Lett. 2010. Vol. 20. N 5. P 1510.
P 4856. doi 10.1021/jo0497508
doi 10.1016/j.bmcl.2010.01.098
Synthesis of New 1Н-Pyrrolo[3,4-с]pyridine-1,3(2Н)-diones
S. V. Klyuchko, S. A. Chumachenko, O. V. Shablykin, and V. S. Brovarets*
V. P. Kukhar Institute of Bioorganic Chemistry and Petrochemistry, National Academy of Science of Ukraine,
Kyiv, 02094 Ukraine
*e-mail: brovarets@bpci.kiev.ua
Received December 23, 2020; revised December 23, 2020; accepted December 30, 2020
A method for the synthesis of new substituted 1H-pyrrolo[3,4-c]pyridine-1,3(2H)-dions was proposed based on
the Diels-Alder type reaction of 4-methoxy-1,3-oxazoles with maleimide derivatives.
Keywords: 4-methoxy-1,3-oxazole, pyrrolo[3,4-c]pyridine, maleimide, Diels-Alder reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021