ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 386-399
УДК 547.789.11:547.789.14
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-
2-[5-БРОМ-4-АРИЛ(ГЕТАРИЛ)-1,3-ТИАЗОЛ-2-ИЛ]-
АКРИЛОНИТРИЛОВ
© 2021 г. Н. А. Пахолкаа, В. Л. Абраменкоа, В. В. Доценкоb,c, Н. А. Аксеновc,
И. В. Аксеноваc, С. Г. Кривоколыскоa,d,*
a Лаборатория «ХимЭкс», Луганский государственный университет имени В. Даля, Луганск, 91034 Украина
b Кубанский государственный университет, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
d Луганский государственный медицинский университет имени Святителя Луки,
кв. 50-летия Обороны Луганска 1-г, Луганск, 91045 Украина
*e-mail: ksg-group-lugansk@mail.ru
Поступило в Редакцию 28 декабря 2020 г.
После доработки 28 декабря 2020 г.
Принято к печати 20 января 2021 г.
Бромирование (2Е)-3-арил(гетарил)-2-[4-арил(гетарил)-1,3-тиазол-2-ил]акрилонитрилов протекает
региоселективно по положению С5 тиазольного цикла с образованием ранее не описанных (2Е)-3-арил-
(гетарил)-2-[5-бром-4-арил(гетарил)-1,3-тиазол-2-ил]акрилонитрилов. Последние альтернативно были
получены реакцией альдегидов, цианотиоацетамида, α-бромкетонов и брома в присутствии триэтиламина
в ДМФА. Строение ключевых соединений доказано с привлечением методов спектроскопии 2D ЯМР и
рентгеноструктурного анализа.
Ключевые слова: 1,3-тиазолы, 5-бром-1,3-тиазолы, цианотиоацетамид, 2-цианотиоакриламиды, бро-
мирование
DOI: 10.31857/S0044460X21030033
Функционально замещенные тиазолы являются
Для наших исследований в качестве модель-
важными реагентами для тонкого органического
ных соединений были выбраны (2Е)-3-арил(гета-
синтеза [1-4], а также характеризуются широким
рил)-2-[4-арил(гетарил)-1,3-тиазол-2-ил]акрило-
спектром биологической активности и практи-
нитрилы общей формулы 1 (схема 1). Эти сое-
ческого применения (недавние обзорные работы
динения легко доступны по реакции Ганча или
см. [5-10]). В литературе широко представлены
различным вариантам этого синтеза с участием
многочисленные производные тиазола, обнаружи-
α-галогенкетонов с различными производны-
вающие антибактериальные, противогрибковые,
ми цианотиоацетамида [15, 16] - (2Е)-3-арил(-
противовоспалительные,
противоопухолевые,
гетарил)-2-цианотиоакриламидами
2
[17-31],
противотуберкулезные, антидиабетические, про-
4-арил-2,6-диамино-3,5-дициано-4Н-тиопиранами
тивовирусные и антиоксидантные и др. практи-
[29, 32-34], 4-арил-6-гидрокси-6-метил-5-[(арила-
чески полезные свойства. В числе наиболее зна-
мино)карбонил]-3-циано-1,4,5,6-тетрагидропири-
чимых представителей этой группы соединений
дин-2-тиолатами пиперидиния [22, 30] в присут-
стоит упомянуть витамин В1 - тиамин, низатидин,
ствии оснований (схема 1).
пенициллин, фанетизол, мелоксикам, ритонавир
[11-14]. По этой причине разработка доступных
[4-Арил(гетарил)-1,3-тиазол-2-ил]ацетонитри-
подходов к синтезу новых производных 1,3-тиазо-
лы вступают в реакцию Кнёвенагеля с альдегида-
ла представляется весьма актуальной задачей.
ми в присутствии AcONa в АсОН также с образова-
386
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
387
Схема 1.
нием 2-тиазолилакрилонитрилов 1 [17-20, 27, 28,
цианотиоацетамида 5 и α-бромкетонов 3а-г в при-
34-40]. Авторами работы [39] была показана воз-
сутствии каталитических количеств триэтиламина
можность получения 1,3-тиазолов 1 из продуктов
(способ 2) при кратковременном нагревании в
присоединения циклопентан(гексан)-1,1-дитиолов
ДМФА нами была синтезирована небольшая би-
к арилиденмалононитрилам - 1,3-дитиа-4-цикло-
блиотека исходных
2-тиазолилакрилонитрилов
1а-т. Показано, что бромирование соединений 1 в
гексенов, при нагревании их с фенацилбромидами
ДМФА или спиртах (метаноле, этаноле, н-бутано-
в этаноле. Приведены два примера многокомпо-
ле) при действии эквимолярного или двухкратного
нентного синтеза соединений 1 из ароматических
количества брома как при комнатной температуре,
альдегидов, цианотиоацетамида, фенацилброми-
так и при нагревании не затрагивает С=С связь
дов при 25°С в ДМФА в присутствии морфолина
акрилонитрильного фрагмента и региоселективно
[41].
-поло-
приводит к продуктам бромирования по С5
Данные по биологической активности 2-тиазо-
жению тиазольного цикла - 5-бромтиазолам 6 с
лилакрилонитрилов 1 ограничиваются нескольки-
высокими выходами (75-92%) (схема 2, метод а).
ми сообщениями об использовании их в качестве
Выбор ДМФА в качестве предпочтительного рас-
антибиотиков [28], ингибиторов сфингозинкиназы
творителя обусловлен тем, что исходные 2-тиазо-
[42, 43] и онкогенной тирозинкиназы ALK [44, 45],
лилакрилонитрилы 1 очень плохо растворимы в
пригодных для лечения или профилактики гипер-
спиртах. В этих случаях реакцию с бромом прихо-
пролиферативных процессов, воспалительных за-
дится проводить при кипячении и/или в условиях
болеваний и аллергии.
гетерогенной среды, что отражается на чистоте и
Реакцией 2-цианотиоакриламидов 2 с α-бром-
выходах целевых продуктов 6.
кетонами 3 (схема 2, способ 1) или многоком-
В случае тиазолов 1н, о, с, т бромирование ве-
понентным взаимодействием альдегида
4а,
дет к осмолению и образованию продуктов неу-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
388
ПАХОЛКА и др.
Схема 2.
становленного строения. При введении в реакцию
В качестве альтернативного способа получе-
соединений 1п, р бромирование, очевидно, затра-
ния 5-бромтиазолов 6а-е (выход 75-81%) нами
гивает 2-оксо-2Н-хроменовый фрагмент (положе-
предложено многокомпонентное взаимодействие
ния С4 или С4, С7). При этом образуются смеси
альдегидов 4а, б с цианотиоацетамидом 5, α-бром-
нескольких соединений, которые не удалось раз-
кетонами 3а-д и бромом в ДМФА в присутствии
делить из-за плохой растворимости ее компонен-
триэтиламина (схема 2, метод б). Такой подход
тов в доступных растворителях, включая ацетон,
позволяет существенно сократить время и расхо-
ДМСО и кипящий ДМФА. В связи с низкой рас-
ды, связанные с синтезом, очисткой и выделением
творимостью продуктов спектры ЯМР оказались
2-цианотиоакриламидов 2 и исходных тиазолила-
крилонитрилов 1.
малоинформативными для отнесения всех сигна-
лов к структуре индивидуальных продуктов реак-
Синтезированные соединения 1 и 6 представ-
ции.
ляют собой мелкокристаллические порошко-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
389
Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C и 1H-15N соединения 1б
δ, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBCa
1H-15N HMBC
7.32 д. д (1Н, Н4, тиен-2-
128.6 (C4, тиен-2-ил)
134.3 (С3, тиен-2-ил),
-
ил)
137.3 (С5, тиен-2-ил)
7.52 д (2Н, Н3, Н5, Ar)
128.9 (С3, С5, Ar)
127.9 (C2, C6, Ar), 132.2* (C1, Ar), 133.1*
-
(CСl), 154.0* (С4, тиазол-2-ил)
7.95 д (1Н, Н5, тиен-2-ил)
137.3 (С5, тиен-2-ил)
128.6 (C4, тиен-2-ил), 134.3 (С3, тиен-2-ил),
-
136.5* (C2, тиен-2-ил)
8.04 д (2Н, Н2, Н6, Ar)
127.9 (C2, C6, Ar)
116.3 (C5, тиазол-2-ил), 128.9 (С3, С5, Ar),
-
133.1* (CСl), 154.0* (С4, тиазол-2-ил)
8.06 д (1Н, Н3, тиен-2-ил)
134.3 (С3, тиен-2-ил)
136.5* (C2, тиен-2-ил), 128.6 (C4, тиен-2-ил)
-
8.29 с (1Н, Н5, тиазол-2-ил)
116.3 (C5, тиазол-2-ил)
132.2* (C1, Ar), 154.0* (С4, тиазол-2-ил),
311.4 (N)
162.2* (С2, тиазол-2-ил)
8.59 с (1Н, =СН)
138.4 (=CH)
100.7* (CC≡N), 116.5* (C≡N), 136.5* (C2,
-
тиен-2-ил), 162.2* (С2, тиазол-2-ил)
a Звездочкой обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР 13C DEPTQ.
образные вещества различных оттенков желтого,
сти 113.8-117.1 м. д., для 5-бромтиазолов 6 они
зеленого, реже коричневого цвета, хорошо раство-
ожидаемо смещаются в область сильного поля
римые в ацетоне, ДМФА, умеренно - в хлорофор-
(103.7-113.8 м. д.). В ИК спектрах соединений 1
ме и ДМСО. Строение полученных соединений
и 6 обнаруживаются полосы поглощения, соответ-
доказано с привлечением методов спектроскопии
ствующие валентным колебаниям сопряженной
ЯМР на ядрах 1Н и 13С (DEPTQ), ИК спектроме-
нитрильной группы (ν 2206-2229 см-1).
трии. Характерной особенностью спектров ЯМР
Соотнесение сигналов ядер углерода со струк-
1Н полученных соединений является наличие сиг-
турой соединения 1б проводили с применением
налов водорода акрилонитрильного фрагмента -
гетероядерной корреляционной спектроскопии
СН=С(СN) в области 8.05-8.62 м. д. и Н5 тиазола
ЯМР (см. таблицу). В спектрах ЯМР HSQC 1H-13C
(для соединений 1) при 8.04-8.33 м. д. В спектрах
наблюдаются все корреляции 1H-13C через одну
ЯМР 13С сигналы углеродов =С-Н акрилонитриль-
связь, которые позволили однозначно соотнести
ного фрагмента проявляются в области 122.9-
сигналы химических сдвигов ядер углерода, свя-
151.1 м. д., С2 тиазола - при 154.4-162.6 м. д., С4
занных с водородом. Наличие в спектрах ЯМР
тиазола - при 148.2-155.4 м. д. Сигналы атома
HMBC кросс-пиков для корреляций 1H-13C по-
С5 тиазола соединений 1 представлены в обла-
зволило соотнести атомы углерода соединения
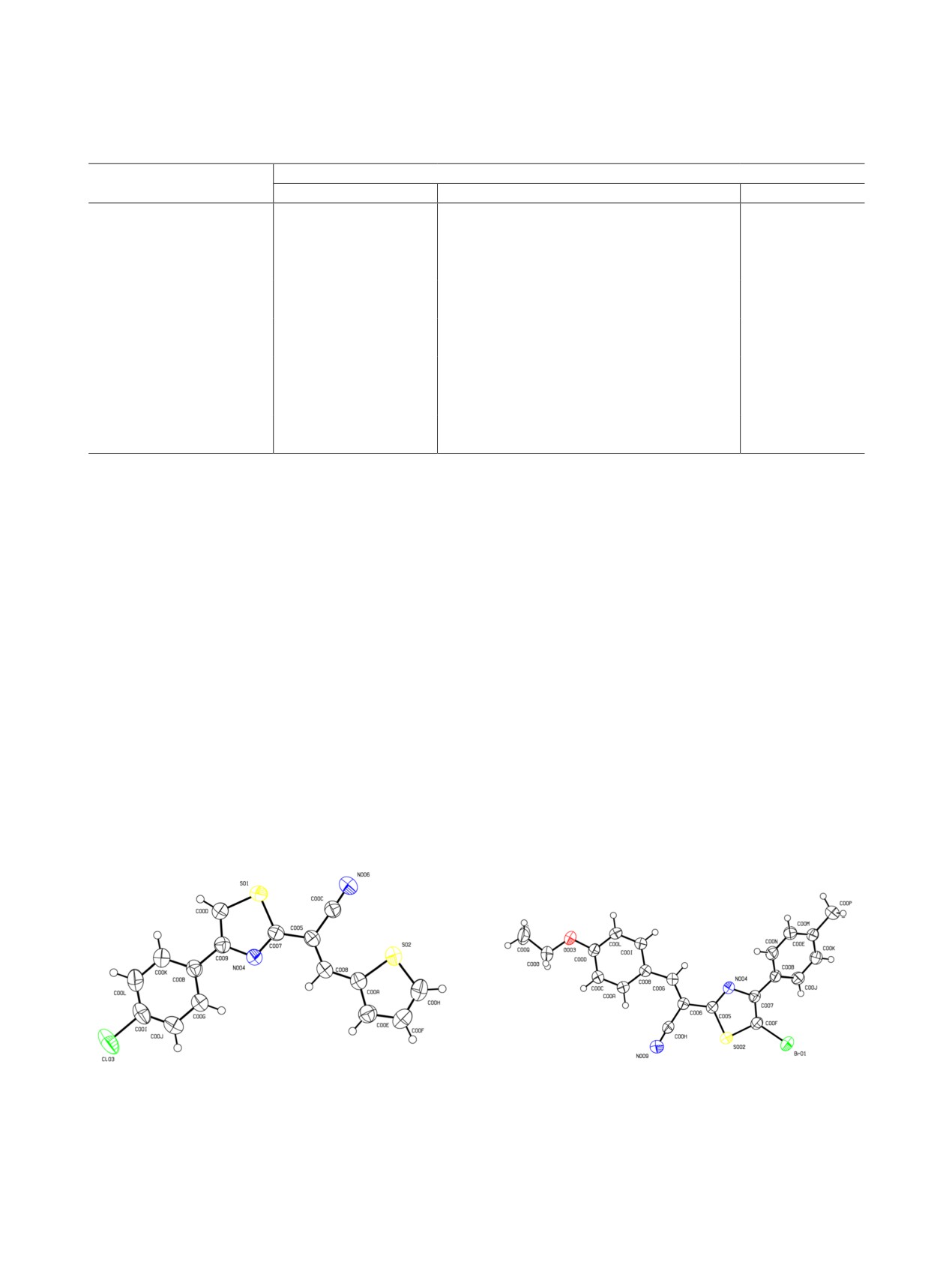
Рис. 1. Общий вид молекулы соединения 1б. Тепловые
Рис. 2. Общий вид молекулы соединения 6з. Тепловые
эллипсоиды неводородных атомов показаны на уровне
эллипсоиды неводородных атомов показаны на уровне
50%-ной вероятности нахождения атома.
50%-ной вероятности нахождения атома.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
390
ПАХОЛКА и др.
1б с наблюдаемой картиной спектров ЯМР 13С
тамида 5 и 1 капли триэтиламина в 10 мл ДМФА
(DEPTQ). В спектре 1H-15N HMBC обнаруживает-
перемешивали 5 мин, затем добавляли 5 ммоль
ся одиночный кросс-пик для корреляции ядер во-
α-бромкетона 3а-г. Полученную смесь доводили
дорода и атома азота тиазольного кольца. Помимо
до кипения, фильтровали через складчатый бу-
этого, строение соединений 1б и 6з было изучено
мажный фильтр. Через 12 ч осадок отфильтровы-
с привлечением рентгеноструктурного анализа
вали, промывали этанолом и гексаном, сушили 3 ч
(рис. 1, 2).
при 60°C.
Таким образом, нами показано, что броми-
(2Е)-2-[4-(4-Бромфенил)-1,3-тиазол-2-ил]-3-
рование
(2Е)-3-арил(гетарил)-2-[4-арил(гета-
(тиен-2-ил)акрилонитрил (1а). Выход 86% (спо-
рил)-1,3-тиазол-2-ил]акрилонитрилов носит регио-
соб 1), 81% (способ 2), желтый мелкокристалличе-
селективный характер и приводит к образованию
ский порошок, т. пл. 186-188°С (т. пл. 175-177°С
ранее не описанных
(2Е)-3-арил(гетарил)-2-[5-
[30]). ИК спектр, ν, см-1: 2219 сл (С≡N). Спектр
бром-4-арил(гетарил)-1,3-тиазол-2-ил]акрило-
ЯМР 1Н (ДМСО-d6), δ, м. д.: 7.31 д. д (1Н, Н4, тиен-
нитрилов с высокими выходами. Полученные
2-ил, 3JHH 4.3, 3JHH 4.7 Гц), 7.66 д (2Н, Н3, Н5, Ar,
соединения представляют собой перспективные
3JHH 8.4 Гц), 7.96 м (3Н, Н5, тиен-2-ил, Н2, Н6, Ar),
объекты для биоскрининга, их профиль биологи-
8.06 д (1Н, Н3, тиен-2-ил, 3JHH 4.7 Гц), 8.29 с (1Н,
ческой активности в настоящее время находится в
Н5, тиазол-2-ил), 8.57 с (1Н, =СН). Спектр ЯМР
стадии изучения.
13С DEPTQ (ДМСО-d6), δС, м. д.: 100.6* (CC≡N),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
116.4 (C5 тиазол), 116.5* (C≡N), 121.7* (CBr), 128.2
(C2, C6, Ar), 128.6 (C4, тиен-2-ил), 131.8 (С5, С5,
Спектры ЯМР 1Н записаны на ЯМР спектро-
Ar), 132.6* (C1, Ar), 134.2 (С3, тиен-2-ил), 136.4*
метре Bruker DPX-400 [400.40 (1Н), 100.63 (13С),
(C2, тиен-2-ил), 137.3 (С5, тиенил), 138.3 (=CH),
40.55 МГц (15N)] в ДМСО-d6 или CDCl3. Вну-
154.0* (С4, тиазол), 162.2* (С2, тиазол). Здесь и да-
тренний стандарт - ТМС или остаточные сигналы
лее звездочкой обозначены сигналы в противофа-
растворителя. ИК спектры регистрировали на ИК
зе. Найдено, %: С 51.60; H 2.58; 7.69. C16H9BrN2S2.
Фурье-спектрометре Bruker Vertex 70 с пристав-
Вычислено, %: C 51.48; H 2.43; N 7.50. M 373.3
кой НПВО на кристалле алмаза, спектральное раз-
решение ±4 см-1. Элементный анализ проводили
(2Е)-3-(Тиен-2-ил)-2-[4-(4-хлорфенил)-1,3-
на C,H,N-анализаторе Carlo Erba 1106. Контроль
тиазол-2-ил]акрилонитрил
(1б). Выход
79%
чистоты полученных соединений осуществляли
(способ 1), 75% (способ 2), оранжевый мелкокри-
методом ТСХ на пластинах Silufol UV254, элюент
сталлический порошок, т. пл. 191-193°С (т. пл.
- ацетон-гексан (1:1), проявитель - пары иода, УФ
173-175°С [30]). ИК спектр, ν, см-1: 2210 сл (С≡N).
детектор. Температуры плавления определяли на
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 7.32 д. д (1Н,
столике Кофлера и не корректировали.
Н4, тиен-2-ил, 3JHH 3.4, 3JHH 5.0 Гц), 7.52 д (2Н, Н3,
2-Цианотиоакриламиды 2 и цианотиоацетамид
Н5, Ar, 3JHH 8.6 Гц), 7.95 д (1Н, Н5, тиен-2-ил, 3JHH
5 были получены по известным методикам [46,
3.4 Гц), 8.04 д (2Н, Н2, Н6, Ar, 3JHH 8.6 Гц), 8.06
47], в других случаях использовали коммерчески
д (1Н, Н3, тиен-2-ил, 3JHH 5.0 Гц), 8.29 с (1Н, Н5,
доступные реагенты.
тиазол), 8.59 с (1Н, =СН). Спектр ЯМР 13С DEPTQ
(ДМСО-d6), δС, м. д.: 100.7* (CC≡N), 116.3 (C5, тиа-
Общая методика синтеза
(2Е)-3-арил(гет-
зол), 116.5* (C≡N), 127.9 (C2, C6, Ar), 128.6 (C4, ти-
арил)-2-[4-арил(гетарил)-1,3-тиазол-2-ил]акри-
лонитрилов (1а-т). Способ 1. Смесь 5 ммоль
ен-2-ил), 128.9 (С3, С5, Ar), 132.2* (C1, Ar), 133.1*
2-цианотиоакриламида 2, 5 ммоль α-бромкетона 3
(CСl), 134.3 (С3, тиен-2-ил), 136.5* (C2, тиен-2-ил),
в 10 мл ДМФА доводили до кипения и фильтрова-
137.3 (С5, тиен-2-ил), 138.4 (=CH), 154.0* (С4, ти-
ли через складчатый бумажный фильтр. Через 12 ч
азол), 162.2* (С2, тиазол). Найдено, %: 58.57; H
осадок отфильтровывали, промывали этанолом и
2.87; N 8.73. C16H9ClN2S2. Вычислено, %: C 58.44;
гексаном, сушили 3 ч при 60°C.
H 2.76; N 8.52. M 328.84.
Способ 2. Смесь 0.46 мл (5 ммоль) 2-тиофен-
(2Е)-3-(Тиен-2-ил)-2-[4-(1,1ʹ-бифенил-4-ил)-
карбальдегида 1а, 0.5 г (5 ммоль) цианотиоаце-
1,3-тиазол-2-ил]акрилонитрил (1в). Выход 88%
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
391
(способ 1), 77% (способ 2), ярко-желтый мелко-
δС, м. д.: 100.7 (CC≡N), 116.1 (C≡N), 117.0* (C5,
кристаллический порошок, т. пл. 203-205°С (т.
тиазол), 125.5 (C-Br), 127.9* (C2, C6, Ar1), 128.9*
пл. 190-191°С [29]). ИК спектр, ν, см-1: 2214 сл
(С3, С5, Ar1), 131.6* (C2, C6, Ar2), 131.7, 132.2 (2C1,
(С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 7.32
Ar1 и Ar2), 133.3* (С3, С5, Ar2), 133.1 (C-Сl), 144.2*
д. д (1Н, Н4, тиен-2-ил, 3JHH 3.9, 3JHH 4.8 Гц), 7.38 т
(=CH), 154.1 (С4, тиазол), 162.3 (С2, тиазол). Най-
(1Н, Ph, 3JHH 7.3 Гц), 7.48 д. д (2Н, Ph, 3JHH 7.3, 3JHH
дено, %: C 53.95; H 2.77; N 7.09. C18H10BrClN2S.
7.5 Гц), 7.73 д (2Н, Ph, 3JHH 7.5 Гц), 7.79 д (2Н,,
Вычислено, %: C 53.82; H 2.51; N 6.97. М 401.71.
Ar, 3JHH 8.3 Гц), 7.97 д (1Н, Н5, тиен-2-ил, 3JHH 3.9
(2Е)-3-(4-Бромфенил)-2-[4-(4-метоксифе-
Гц), 8.07 д (1Н, Н3, тиен-2-ил, 3JHH 4.8 Гц), 8.11 д
нил)-1,3-тиазол-2-ил]акрилонитрил (1е). Выход
(2Н,, Ar, 3JHH 8.3 Гц), 8.30 с (1Н, Н5, тиазол), 8.62
86%, лимонно-зеленый мелкокристаллический по-
с (1Н, =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6),
рошок, т. пл. 177-179°С. ИК спектр, ν, см-1: 2229
δС, м. д.: 100.8* (CC≡N), 115.8 (C5, тиазол), 116.6*
сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.80
(C≡N), 126.6 (2C, Ar), 126.8 (2C,, Ar), 127.1 (2C,,
с (3Н, МеО), 7.02 д [2Н, Н3, Н5, Ar1 (4-МеОС6Н4) ,
Ar), 127.7 (C4ʹ, Ar), 128.6 (C4, тиен-2-ил), 129.0
3JHH 8.9 Гц], 7.79 д [2Н, Н3, Н5, Ar2 (4-BrС6Н4), 3JHH
(2С, Ar), 132.5* (Ar), 134.2 (С3, тиен-2-ил), 136.5*
8.6 Гц], 7.94-7.97 м (4Н, наложение двух дублетов,
(C2, тиен-2-ил), 137.4 (С5, тиен-2-ил), 138.3 (=CH),
Н2, Н6, Ar1, 3JHH 8.9 Гц + Н2, Н6, Ar2, 3JHH 8.6 Гц),
139.5* (Ar), 140.1* (Ar), 154.9* (С4, тиазол), 162.1*
8.14 с (1Н, Н5, тиазол), 8.32 с (1Н, =СН). Спектр
(С2, тиазол). Найдено, %: C 71.56; H 3.96; N 7.81.
ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 55.2*
C22H14N2S2. Вычислено, %: C 71.32; H 3.81; N 7.56.
(МеО), 105.6 (CC≡N), 114.2* (2C,, Ar1), 114.4* (C5,
M 370.50.
тиазол), 116.2 (C≡N), 125.3, 126.1 (C-Br и С1, Ar1),
(2Е)-3-(Тиен-2-ил)-2-(4-тиен-2-ил-1,3-тиазол-
127.6* (2С, Ar1), 131.6* (C2, C6, Ar2), 131.8 (C1,
2-ил)акрилонитрил (1г). Выход 78% (способ 1),
Ar2), 132.4* (С3, С5, Ar2), 143.7* (=CH), 155.4 (С4,
74% (способ 2), желтый мелкокристаллический
тиазол), 159.6 (C-OMe), 161.7 (С2, тиазол). *Сиг-
порошок, т. пл. 134-136°С. ИК спектр, ν, см-1:
налы в противофазе. Найдено, %: C 57.72; H 3.47;
2212 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
N 7.26. C19H13BrN2OS. Вычислено, %: C 57.44; H
7.16 д. д (1Н, Н4, тиен-2-ил1, 3JHH 3.6, 3JHH 4.9 Гц),
3.30; N 7.05. M 397.30.
7.33 д. д (1Н, Н4, тиен-2-ил2, 3JHH 3.0, 3JHH 4.7 Гц),
(2Е)-3-(2,5-Диметоксифенил)-2-[4-(4-меток-
7.60 д (1Н, Н3, тиен-2-ил1, 3JHH 4.9 Гц), 7.66 д (1Н,
сифенил)-1,3-тиазол-2-ил]акрилонитрил
(1ж).
Н5, тиен-2-ил2, 3JHH 3.0 Гц), 7.98 д (1Н, Н5, тиен-
Выход 83%, оранжевый мелкокристаллический
2-ил1, 3JHH 3.6 Гц), 8.09 м (2Н, Н3, тиен-2-ил2, Н5,
порошок, т. пл. 154-156°С. ИК спектр, ν, см-1:
тиазол), 8.53 с (1Н, =СН). Спектр ЯМР 13С DEPTQ
2208 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м.
(ДМСО-d6), δС, м. д.: 100.5 (CC≡N), 114.1* (C5, ти-
д.: 3.78 с, 3.80 с, 3.87 с (9Н, 3МеО), 7.04 д [2Н,
азол), 116.5 (C≡N), 125.1*, 126.6*, 128.1*, 128.6*
Н3, Н5, Ar1 (4-МеОС6Н4), 3JHH 8.8 Гц], 7.15-7.17
(4С, тиен-2-ил), 134.3* (тиен-2-ил), 136.4, 136.9
м {2Н, Н3, Н4, Ar2 [2,5-(МеО)2С6Н3]}, 7.67 д (1Н,
(2C2, тиен-2-ил), 137.4* (тиен-2-ил), 138.3* (=CH),
Н6, Ar2, 4JHH 2.7 Гц), 7.94 д (2Н, Н2, Н6, Ar1, 3JHH
150.1 (С4, тиазол), 162.1 (С2, тиазол). Найдено, %:
8.8 Гц), 8.12 с (1Н, Н5, тиазол), 8.42 с (1Н, =СН).
C 56.14; H 2.93; N 9.51. C14H8N2S3. Вычислено, %:
Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.:
C 55.97; H 2.68; N 9.32. М 300.43.
55.2*, 55.6*, 56.3* (3МеО), 105.1 (CC≡N), 112.7*,
(2Е)-3-(4-Бромфенил)-2-[4-(4-хлорфенил)-
113.1* (C3, C4, Ar2), 114.0* (C5, тиазол), 114.3* (2С,
1,3-тиазол-2-ил]акрилонитрил (1д). Выход 91%,
Ar1), 116.5 (C≡N), 119.4* (C6Ar2), 121.3, 126.1 (2C1,
Ar1 и Ar2), 127.6* (2С, Ar1), 138.9* (=CH), 152.6,
желто-зеленый мелкокристаллический порошок,
т. пл. 164-166°С (т. пл. 160-161°С [39]). ИК спектр,
152.8 (2COMe), 155.5 (С4, тиазол), 159.6 (COMe),
ν, см-1: 2215 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
161.9 (С2, тиазол). Найдено, %: C 66.77; H 4.98; N
7.58. C21H18N2O3S. Вычислено, %: C 66.65; H 4.79;
δ, м. д.: 7.55 д (2Н, Н3, Н5, 4-ClС6Н4, 3JHH 8.6 Гц),
N 7.40. M 378.45.
7.81 д (2Н, Н3, Н5, 4-BrС6Н4, 3JHH 8.6 Гц), 7.98 д
(2Н, Н2, Н6, 4-BrС6Н4, 3JHH 8.6 Гц), 8.06 д (2Н, Н2,
(2Е)-2-[4-(4-Метилфенил)-1,3-тиазол-2-ил]-
Н6, 4-ClС6Н4, 3JHH 8.6 Гц), 8.35 с и 8.37 с (2Н, Н5,
3-(4-этоксифенил)акрилонитрил
(1з). Выход
тиазол, =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6),
91%, ярко-желтый мелкокристаллический поро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
392
ПАХОЛКА и др.
шок, т. пл. 118-120°С. ИК спектр, ν, см-1: 2219 сл
м. д.: 105.5* (CC≡N), 116.2* (C≡N), 116.4 (C5, тиа-
(С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.34
зол), 126.2 (2С, Ph), 128.6 (C4, Ph), 128.9 (2С, Ph),
т (3Н, ОСН2Ме, 3JHH 6.8 Гц), 2.34 с (3Н, Ме), 4.12
129.3 (2С, Ar), 131.4* (CCl), 131.5 (2С, Ar), 133.3*
к (2Н, ОСН2Ме, 3JHH 6.8 Гц), 7.11 д [2Н, Н3, Н5,
(С1, Ph), 136.4* (C1, Ar), 143.8 (=C-H), 155.4* (С4,
Ar1 (4-МеС6Н4), 3JHH 8.8 Гц], 7.27 д [2Н, Н3, Н5, Ar2
тиазол), 162.0* (С2, тиазол). Найдено, %: C 67.18;
(4-EtOС6Н4), 3JHH 7.8 Гц], 7.91 д (2Н, Н2, Н6, Ar2,
H 3.62; N 8.79. C18H11ClN2S. Вычислено, %: C
3JHH 7.8 Гц), 8.04 д (2Н, Н2, Н6, Ar1, 3JHH 8.8 Гц),
66.97; H 3.43; N 8.68. M 322.82.
8.14 с, 8.23 с (2Н, Н5, тиазол и =С-Н). Спектр ЯМР
(2Е)-3-(3-Бензилокси-4-метоксифенил)-2-[4-
13С DEPTQ (ДМСО-d6), δС, м. д.: 14.5 (ОСН2Ме),
(4-метилфенил)-1,3-тиазол-2-ил]акрилонитрил
20.9 (Ме), 63.6* (ОСН2Ме), 101.4* (CC≡N), 114.5
(1л). Выход 89%, желто-зеленый мелкокристалли-
(C5, тиазол), 115.2 (2С, Ar2), 117.0* (C≡N), 124.9*
ческий порошок, т. пл. 174-176°С. ИК спектр, ν,
(C1Ar2), 126.1 (2С, Ar2), 129.4 (2С, Ar1), 130.8*
см-1: 2214 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ,
(C1Ar1), 132.2 (2С, Ar1), 137.9* (С4, Ar1), 144.8
м. д.: 2.35 с (3Н, Ме), 3.88 с (3Н, МеО), 5.14 с (2Н,
(=CH), 155.3* (С4, тиазол), 161.5*, 162.6* (С4, Ar2
OCH2Ph), 7.21 д [1H, H5, Ar1 (3-BnO-4-MeOС6Н3),
и С2, тиазол). Найдено, %: C 73.02; H 5.39; N 8.38.
3JHH 8.7 Гц], 7.29 д [2Н, Н3, Н5, Ar2 (4-MeС6Н4),
C21H18N2OS. Вычислено, %: C 72.80; H 5.24; N
3JHH 8.2 Гц], 7.35 т (1Н, H4, Ph, 3JHH 7.1 Гц), 7.41 д. д
8.09. M 346.45.
(2Н, Н3, Н5, Ph, 3JHH 7.1, 3JHH 7.5 Гц), 7.48 д (2Н, Н2,
(2Е)-3-(3-Бром-4-гидрокси-5-метоксифе-
Н6, Ph, 3JHH 7.5 Гц), 7.76 д. д (1H, H6, Ar1, 3JHH 8.7,
нил)-2-[4-(3,4-диметилфенил)-1,3-тиазол-2-ил]-
4JHH 1.8 Гц), 7.85 д (1Н, Н2, Ar1, 4JHH 1.8 Гц), 7.92
акрилонитрил (1и). Выход 81%, ярко-желтый
д (2Н, Н2, Н6, Ar2, 3JHH 8.2 Гц), 8.16 с (1H, =СН),
мелкокристаллический порошок, т. пл. 207-209°С.
8.26 с (1Н, Н5, тиазол). Спектр ЯМР 13С DEPTQ
ИК спектр, ν, см-1: 3300 ш (ОН), 2224 сл (С≡N).
(ДМСО-d6), δС, м. д.: 20.9* (Me), 55.9* (MeO), 70.0
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.25 с и 2.29 с
(OCH2Ph), 101.6 (CC≡N), 112.3* (Ar1), 114.4* (Ar1),
(6Н, 2Ме), 3.90 с (3Н, МеО), 7.22 д и 7.75 д [2Н, H5,
114.6* (C5, тиазол), 117.1 (C≡N), 124.9* (С, Ar1),
H6, Ar1 (3,4-Me2С6Н3), 3JHH 7.7 Гц], 7.76 c, 7.79 c и
125.1 (C1, Ar2), 126.1* (2С, Ar2), 128.0* (2С, Ph),
7.94 c (3H, H2, Ar1 и H2, H6, Ar2), 8.13 c и 8.22 c (2H,
128.1* (С4, Ph), 128.5* (2С, Ph), 129.4* (2С, Ar2),
Н5, тиазол, =C-H), 10.66 уш. с (1Н, ОН). Спектр
130.8 (C1, Ar1), 136.5 (C1, Ph), 137.9 (C4Ar2), 144.9*
ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 19.2*, 19.5*
(=C-H), 147.7 (C3, Ar1), 152.5 (C-OMe), 155.3 (С4,
(2Me), 56.3* (MeO), 102.0 (CC≡N), 109.6 (C-Br),
тиазол), 162.6 (С2, тиазол). Найдено, %: C 73.83; H
112.3* (Ar2), 114.6* (C5, тиазол), 116.9 (C≡N),
5.19; N 6.52. C27H22N2O2S. Вычислено, %: C 73.95;
123.7* (Ar1), 124.6 (C1, Ar1 или, Ar2 ), 127.2* (Ar1),
H 5.06; N 6.39. M 438.55.
127.4* (Ar1), 129.9* (Ar2), 131.1 (C1, Ar2 или Ar1),
136.6, 136.7 (2CMe), 143.8* (=CH), 147.5, 148.2
(2Е)-3-(4-Бромфенил)-2-[4-(4-бромфенил)-
(C-OMe, C-OH), 155.5 (С4, тиазол), 162.2 (С2, тиа-
1,3-тиазол-2-ил]акрилонитрил (1м). Выход 93%,
зол). Найдено, %: C 57.25; H 4.04; N 6.59. C21H17Br
желто-зеленый мелкокристаллический порошок, т.
N2O2S. Вычислено, %: C 57.15; H 3.88; N 6.35. M
пл. 170-172°С (т. пл. 157-158°С [39]). ИК спектр,
441.35.
ν, см-1: 2214 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
δ, м. д.: 7.67 д (2Н, Н3, Н5, Ar1, 3JHH 8.6 Гц), 7.79 д
(2Е)-2-(4-Фенил-1,3-тиазол-2-ил)-3-(4-хлор-
фенил)акрилонитрил (1к). Выход 94%, свет-
(2Н, Н3, Н5, Ar2, 3JHH 8.6 Гц), 7.96 д (2Н, Н2, Н6, Ar1,
3JHH 8.6 Гц), 7.98 д (2Н, Н2, Н6, Ar2, 3JHH 8.6 Гц),
ло-зеленый мелкокристаллический порошок,
т. пл. 133-135°С (т. пл. 123-125°С [37, 39], 235-
8.33 с, 8.36 с (2Н, Н5, тиазол, =СН). Спектр ЯМР
237°С [36], очевидно, недостоверные данные). ИК
13С DEPTQ (ДМСО-d6), δС, м. д.: 105.5 (CC≡N),
спектр, ν, см-1: 2216 сл (С≡N). Спектр ЯМР 1Н
116.1 (C≡N), 117.1* (C5, тиазол), 121.8 (C-Br), 125.5
(ДМСО-d6), δ, м. д.: 7.38 т (1Н, H4 Ph, 3JHH 7.1 Гц),
(C-Br), 128.2* (2C, Ar), 131.6* (2C, Ar), 131.7 (C1,
7.47 д. д (2Н, Н3, Н5 Ph, 3JHH 7.1, 3JHH 7.5 Гц), 7.65
Ar), 131.8* (2С, Ar), 132.3* (2C, Ar), 132.5 (C1, Ar),
д (2Н, Н3, Н5, Ar, 3JHH 8.3 Гц), 8.01-8.06 м (4Н, Н2,
144.2* (=CH), 154.1 (С4, тиазол), 162.3 (С2, тиазол).
Н6, Ar и Н2, Н6 Ph), 8.29 с и 8.34 с (2Н, Н5, тиазол
Найдено, %: C 48.60; H 2.37; N 6.14. C18H10Br2N2S.
и =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС,
Вычислено, %: C 48.46; H 2.26; N 6.28. M 446.17.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
393
(2Е)-3-(2,5-Диметоксифенил)-2-[4-(3,4-ди-
3-ил, 3JHH 7.3, 3JHH 7.6 Гц), 7.48 д (1H, H8, хромен-
метоксифенил)-1,3-тиазол-2-ил]акрилонитрил
3-ил, 3JHH 8.3 Гц), 7.66 м (1H, H7, хромен-3-ил, 3JHH
(1н). Выход 90%, оранжевый мелкокристалли-
7.3, 3JHH 8.3, 4JHH 1.1 Гц), 7.76 д (1Н, Н6, Ar, 4JHH
ческий порошок, т. пл. 148-150°С. ИК спектр, ν,
1.5 Гц), 7.93-7.94 м (2Н, H2, Ar, H5 хромен-3-ил),
см-1: 2210 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ,
8.28 c, 8.51 c, 8.86 c (3H, =CH-, Н4, хромен-3-ил,
м. д.: 3.77 с, 3.80 с, 3.84 с, 3.87 с (12Н, МеО), 7.05
Н5, тиазол), 10.71 уш. с (1Н, ОН). Спектр ЯМР 13С
д {1Н, Н5, Ar1 [3,4-(MeO)2С6Н3], 3JHH 8.4 Гц}, 7.13
DEPTQ (ДМСО-d6), δС, м. д.: 56.3* (MeO), 101.4
д {1Н, Н3Ar2 [2,5-(MeO)2С6Н3], 3JHH 8.9 Гц), 7.16
(CC≡N), 109.7 (CBr), 112.1* (Ar), 116.0* (C5, тиа-
д. д (1Н, Н4, Ar2, 3JHH 8.9, 4JHH 2.7 Гц), 7.54 д (1Н,
зол), 116.9 (C≡N), 119.0, 119.9 (C3, C4(1), хромен-3-
Н2, Ar1, 4JHH 2.1 Гц), 7.57 д. д (1Н, Н6, Ar1, 3JHH 8.4,
ил), 121.1* (хромен-3-ил), 124.3 (С1, Ar), 124.9 (C6,
4JHH 2.1 Гц), 7.67 д (1Н, Н6, Ar2, 4JHH 2.7 Гц), 8.18
хромен-3-ил), 127.8* (Ar), 129.2* (хромен-3-ил),
с, 8.42 с (2Н, Н5, тиазол, =СН). Спектр ЯМР 13С
132.3 * (хромен-3-ил), 140.1* (C4, хромен-3-ил),
DEPTQ (ДМСО-d6), δС, м. д.: 55.5*, 55.6*, 55.6*
144.8* (=CH-), 148.2, 148.3 (С4, тиазол, C8(1), хро-
(3MeO), 56.3* (MeO), 105.1 (CC≡N), 109.8* (Ar1),
мен-3-ил), 152.7 (C-OMe), 158.8 (С-ОН, C2, хро-
111.9* (Ar1), 112.7* (Ar2), 113.1* (Ar2), 114.3* (C5,
мен-3-ил), 162.5 (С2, тиазол). Найдено, %: C 54.74;
тиазол), 116.5 (C≡N), 119.0* (Ar1), 119.3* (Ar2),
H 2.61; N 6.01. C22H13BrN2O4S. Вычислено, %: C
121.3 (C1, Ar1 или Ar2), 126.3 (С1, Ar2 или Ar1 ),
54.90; H 2.72; N 5.82. М 481.33.
138.9* (=CH), 148.9, 149.3, 152.6, 152.8 (4C-OMe),
(2Е)-3-(3-Бензилокси-4-метоксифенил)-2-
155.6 (С4, тиазол), 161.8 (С2, тиазол). Найдено, %:
[4-(2-оксо-2Н-хромен-3-ил)-1,3-тиазол-2-ил]-
C 64.54; H 5.07; N 7.00. C22H20N2O4S. Вычислено,
акрилонитрил (1р). Выход 93%, желто-зеленый
%: C 64.69; H 4.94; N 6.86. M 408.48.
мелкокристаллический порошок, т. пл. 261-263°С.
(2Е)-3-(3-Бром-4-гидрокси-5-метоксифе-
ИК спектр, ν, см-1: 2218 сл (С≡N), 1720 ср (С=О).
нил)-2-[4-(4-этилфенил)-1,3-тиазол-2-ил]акри-
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.88 с (3Н,
лонитрил (1о). Выход 77%, ярко-желтый мелко-
МеО), 5.15 с (2Н, OCH2Ph), 7.23 д (1H, H5, Ar, 3JHH
кристаллический порошок, т. пл. 203-205°С. ИК
8.8 Гц), 7.35 т (1Н, H4, Ph, 3JHH 7.2 Гц), 7.40-7.44
спектр, ν, см-1: 3292 ш (ОН), 2222 сл (С≡N). Спектр
м (3Н, Н3, Н5, Ph и Н6, хромен-3-ил), 7.48-7.50 м
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.20 т (3Н, CH2Me,
(3Н, Н2, Н6, Ph и Н8, хромен-3-ил), 7.67 д. д (1Н,
3JHH 7.6 Гц), 2.64 к (2Н, СН2Ме, 3JHH 7.6 Гц), 3.90 с
Н7, хромен-3-ил, 3JHH 7.6, 3JHH 8.1 Гц), 7.77 д. д
(3Н, МеО), 7.30 д [2Н, Н3, Н5, Ar1 (4-EtС6Н4), 3JHH
(1H, H6, Ar, 3JHH 8.8, 4JHH 1.5 Гц), 7.86 д (1Н, Н2,
8.2 Гц], 7.75 д [1Н, Н6, Ar2 (3-Br-4-HO-5-MeС6Н2),
Ar, 4JHH 1.5 Гц), 7.95 уш. д (1Н, Н5, хромен-3-ил,
4JHH 2.0 Гц], 7.91-7.93 м (3Н, Н2, Ar2 и H2, H6, Ar1),
3JHH 8.1 Гц), 8.33 с, 8.52 с, 8.88 с (3H, =СН, Н5, ти-
8.15 с, 8.21 с (2Н, Н5, тиазол, =СН), 10.65 уш. с
азол, Н4, хромен-3-ил). Спектр ЯМР 13С DEPTQ
(1Н, ОН). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС,
(ДМСО-d6), δС, м. д.: 55.9* (MeO), 70.0 (OCH2Ph),
м. д.: 15.4 (CH2Me), 27.9* (CH2Me), 56.3 (MeO),
101.2 (CC≡N), 112.3* (Ar), 114.3* (Ar), 116.0* (C5,
102.1* (CC≡N), 109.6* (CBr), 112.3 (Ar2), 114.7 (C5,
тиазол), 117.0 (C≡N), 119.0 (хромен-3-ил), 121.0*
тиазол), 116.9* (C≡N), 124.6* (C1, Ar2), 126.2 (2C,
(хромен-3-ил), 124.9* (Ar), 125.0 (С4(1), хромен-3-
Ar1), 127.4 (С, Ar2), 128.2 (2C, Ar1), 131.0* (C1, Ar1),
ил), 125.2* (хромен-3-ил), 128.0* (2С, Ph), 128.1*
143.8 (=CH), 144.2* (C4, Ar1), 147.5*, 148.2*, 155.4*
(С4, Ph), 128.5* (2С, Ph), 129.2* (хромен-3-ил),
(С4, тиазол, C-OMe, OH), 162.4* (С2, тиазол). Най-
129.7 (C1, Ar), 132.3* (хромен-3-ил), 136.4 (C1, Ph),
дено, %: C 57.43; H 4.05; N 6.66. C21H17BrN2O2S.
140.1* (С4, хромен-3-ил), 146.0* (=CH-), 147.7
Вычислено, %: C 57.15; H 3.88; N 6.35. M 441.35.
(C3, Ar), 148.2 (С4, тиазол), 152.7 (C-OMe), 158.3
(С8(1), хромен-3-ил), 158.8 (С2, хромен-3-ил), 162.8
(2Е)-3-(3-Бром-4-гидрокси-5-метоксифе-
нил)-2-[4-(2-оксо-2Н-хромен-3-ил)-1,3-тиазол-2-
(С2, тиазол). Найдено, %: C 70.94; H 4.37; N 5.56.
C29H20N2O4S. Вычислено, %: C 70.72; H 4.09; N
ил]акрилонитрил (1п). Выход 95%, ярко-желтый
5.69. M 492.56.
мелкокристаллический порошок, т. пл. > 300°С
(разл.). ИК спектр, ν, см-1: 3423 ш (ОН), 2206 сл
(2Е)-3-(5-Бромфур-2-ил)-2-[4-(4-фторфенил)-
(С≡N), 1700 ср (С=О). Спектр ЯМР 1Н (ДМСО-d6),
1,3-тиазол-2-ил]акрилонитрил (1с). Выход 75%,
δ, м. д.: 3.90 с (3H, MeO), 7.41 д. д (1H, H6, хромен-
бежево-оранжевый мелкокристаллический поро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
394
ПАХОЛКА и др.
шок, т. пл. 160-162°С. ИК спектр, ν, см-1: 2214 сл
и незамедлительно фильтровали через складчатый
(С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 6.95 д
бумажный фильтр. Через 12 ч осадок отфильтро-
(1Н, Н3, фур-2-ил, 3JHH 3.4 Гц), 7.28 д и 7.30 д (2Н,
вывали, промывали этанолом и гексаном, сушили
Н3, Н5, Ar, 3JHH 8.8 Гц), 7.33 д (1Н, Н4, фур-2-ил,
при 3 ч при 60°C.
3JHH 3.4 Гц), 8.03 д и 8.05 д (2Н, Н2, Н6, Ar, 3JHH 8.8
(2Е)-2-[5-Бром-4-(4-бромфенил)-1,3-тиазол-
Гц), 8.08 с, 8.22 с (2Н, Н5, тиазол, =СН). Спектр
2-ил]-3-тиен-2-илакрилонитрил
(6а). Выход
ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 100.1*
79% (метод а), 75% (метод б), ярко-желтый мел-
(CC≡N), 115.6, 115.9 (2C, Ar), 115.8 (C5, тиазол),
кокристаллический порошок, т. пл. 215-217°С.
115.9* (наложение сигналов C≡N и CBr), 116.1 (C4,
ИК спектр, ν, см-1: 2210 сл (С≡N). Спектр ЯМР 1Н
фур-2-ил), 123.0 (=СН), 128.3 (C3, фур-2-ил), 128.4,
(ДМСО-d6), δ, м. д.: 7.33 д. д (1Н, Н4, тиен-2-ил,
128.6 (2C, Ar), 150.7*, 154.4* (С2, тиазол), 161.0*,
3JHH 3.9, 3JHH 4.8 Гц), 7.74 д (2Н, Н3, Н5, Ar, 3JHH
163.4* (C-F), 161.9* (C2, фур-2-ил). Найдено, %: C
8.4 Гц), 7.87 д (2Н, Н2, Н6, Ar, 3JHH 8.4 Гц), 7.95
51.8; H 2.00; N 7.65. C16H8BrFN2OS. Вычислено,
д (1Н, Н5, тиен-2-ил, 3JHH 3.9 Гц), 8.10 д (1Н, Н3,
%: C 51.22; H 2.15; N 7.47. М 375.22.
тиен-2-ил, 3JHH 4.8 Гц), 8.54 с (1Н, =СН). Спектр
(2Е)-2-[4-(3,4-Метилендиоксифенил)-1,3-ти-
ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 100.6
азол-2-ил]-3-(5-метилфур-2-ил)акрилонитрил
(CC≡N), 105.7 (C5, тиазол-2-ил), 116.4 (C≡N), 122.9
(1т). Выход 76%, желто-оранжевый мелкокристал-
(C-Br, Ar), 129.2* (C2, C6, Ar), 130.7* (C4, тиен-2-
лический порошок, т. пл. 167-169°С. ИК спектр, ν,
ил), 132.0 (C1, Ar), 132.1* (С3, С5, Ar), 135.4* (С3,
см-1: 2220 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
тиен-2-ил), 136.8 (C2, тиен-2-ил), 138.4* (С5, тиен-
δ, м. д.: 2.41 с (3Н, Ме), 6.06 с (2Н, СН2), 6.48 д
2-ил), 139.9* (=CH), 151.8 (С4, тиазол-2-ил), 162.6
(1Н, Н4, фур-2-ил, 3JHH 3.0 Гц), 6.99 д (1Н, Н5, Ar,
(С2, тиазол-2-ил). Найдено, %: C 42.29; H 2.02; N
3JHH 8.6 Гц), 7.26 д (1Н, Н3, фур-2-ил, 3JHH 3.0 Гц),
6.45. C16H8Br2N2S2. Вычислено, %: C 42.50; H 1.78;
7.55-7.56 м (2Н, Н2, Н6, Ar), 8.04 с, 8.05 с (2Н,
N 6.20. M 452.19.
Н5, тиазола, =СН). Спектр ЯМР 13С DEPTQ (ДМ-
(2Е)-2-[5-Бром-4-(4-[4-хлорфенил)-1,3-тиа-
СО-d6), δС, м. д.: 13.9 (Ме), 97.7* (CC≡N), 101.3*
зол-2-ил]-3-тиен-2-илакрилонитрил (6б). Выход
(ОСН2О), 106.5 (Ar), 108.5 (Ar), 110.9 (С4, Het),
85% (метод а), 81% (метод б), ярко-желтый мел-
113.8 (C5, тиазол), 116.6* (C≡N), 120.3 (Ar), 122.9
кокристаллический порошок, т. пл. 205-207°С.
(=СН-), 127.8* (C1, Ar), 129.4 (C3, Het), 147.5*,
ИК спектр, ν, см-1: 2220 сл (С≡N). Спектр ЯМР 1Н
147.6*, 147.8*, 155.1*, 158.3*, 162.0* (C3, C4, Ar;
(ДМСО-d6), δ, м. д.: 7.32 д. д (1Н, Н4, тиен-2-ил,
C2, C5, Het; C2, С4, тиазол). Найдено, %: C 64.56; H
3JHH 3.7, 3JHH 4.9 Гц), 7.60 д (2Н, Н3, Н5, Ar, 3JHH
3.77; N 8.47. C18H12N2O3S. Вычислено, %: C 64.27;
8.7 Гц), 7.95-7.97 м (3Н, Н2, Н6, Ar; Н5, тиен-2-ил),
H 3.60; N 8.33. М 336.37.
8.10 д (1Н, Н3, тиен-2-ил, 3JHH 4.9 Гц), 8.54 с (1Н,
Общая методика синтеза (2Е)-3-арил(гета-
=СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС,
рил)-2-[5-бром-4-арил(гетарил)-1,3-тиазол-2-
м. д.: 100.1 (CC≡N), 105.1 (C5, тиазол-2-ил), 116.0
ил]акрилонитрилов (6а-м). а. К раствору или су-
(C≡N), 128.7* (C2, C6, Ar), 130.0* (C4, тиен-2-ил;
спензии 5 ммоль, тиазолилакрилонитрила 1а-м в
С3, С5, Ar), 131.2 (C1, Ar), 133.7 (C-Cl), 134.9* (С3,
10 мл ДМФА медленно по каплям добавляли 0.31
тиен-2-ил), 136.3 (C2, тиен-2-ил), 137.8* (С5, тиен-
мл (6 ммоль) брома. Реакционную смесь незамед-
2-ил), 139.4* (=CH), 151.3 (С4, , тиазол-2-ил), 162.1
лительно фильтровали через складчатый бумаж-
(С2, тиазол-2-ил). Найдено, %: C 47.38; H 2.12; N
ный фильтр. Через 12 ч осадок 5-бромтиазола от-
6.98. C16H8BrClN2S2. Вычислено, %: C 47.13; H
фильтровывали, промывали этанолом и гексаном,
1.98; N 6.87. M 407.74.
сушили 3 ч при 60°C.
(2Е)-2-[5-бром-4-(1,1ʹ-бифенил-4-ил)-1,3-тиа-
б. Смесь 5 ммоль альдегида 1а, б, 0.5 г (5 ммоль)
зол-2-ил]-3-тиен-2-илакрилонитрил (6в). Выход
цианотиоацетамида 5 и 1 капли триэтиламина в 10
82% (метод а), 75% (метод б), желто-оранжевый
мл ДМФА перемешивали 5 мин, затем добавляли 5
мелкокристаллический порошок, т. пл. 190-192°С.
ммоль α-бромкетона 3а-д. Полученную смесь до-
ИК спектр, ν, см-1: 2216 сл (С≡N). Спектр ЯМР
водили до кипения, затем охлаждали до комнатной
1Н (ДМСО-d6), δ, м. д.: 7.32 д. д (1Н, Н4, тиен-
температуры, добавляли 0.31 мл (6 ммоль) брома
2-ил, 3JHH 3.7, 3JHH 4.9 Гц), 7.40 т (1Н, Ph, 3JHH
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
395
7.5 Гц), 7.49 д. д (2Н, Ph, 3JHH 7.5, 3JHH 7.9 Гц), 7.74
но, %: 44.98; H 1.89; N 5.83. M 480.61.
д (2Н, Ph, 3JHH 7.9 Гц), 7.82 д (2Н, Ar, 3JHH 8.3 Гц),
(2Е)-2-[5-Бром-4-(4-метоксифенил)-1,3-тиа-
7.95 д (1Н, Н5, тиен-2-ил, 3JHH 3.7 Гц), 8.04 д (2Н,
зол-2-ил]-3-(4-бромфенил)-акрилонитрил
(6е).
Ar, 3JHH 8.3 Гц), 8.10 д (1Н, Н3, тиен-2-ил, 3JHH
Выход 88% (метод а), 79% (метод б), мелкокри-
4.9 Гц), 8.54 с (1Н, =СН). Спектр ЯМР 13С DEPTQ
сталлический порошок лимонного цвета, т. пл.
(ДМСО-d6), δС, м. д.: 100.3 (CC≡N), 104.6 (C5, тиа-
208-210°С. ИК спектр, ν, см-1: 2221 сл (С≡N).
зол-2-ил), 116.0 (C≡N), 126.7* (2C, Ar), 126.8* (2C,
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.82 с (3Н,
Ar), 127.9* (C4ʹ, Ar), 128.7* (C4, тиен-2-ил), 128.8*
МеО), 7.08 д [2Н, Н3, Н5, Ar1 (4-МеОС6Н4) , 3JHH
(2C, Ar), 129.0* (2С, Ar), 131.4 (Ar), 134.8* (С3, ти-
8.7 Гц], 7.80 д [2Н, Н3, Н5, Ar2 (4-BrС6Н4), 3JHH
ен-2-ил), 136.4 (C2, тиен-2-ил), 137.8* (С5, тиен-2-
8.6 Гц], 7.88 д (2Н, Н2, Н6, Ar1, 3JHH 8.7 Гц), 7.96 д
ил), 139.2* (=CH), 139.3 (Ar), 140.5 (Ar), 152.1 (С4,
(2Н, Н2, Н6, Ar2, 3JHH 8.6 Гц), 8.27 с (1Н, =СН). Най-
тиазол-2-ил), 161.9 (С2, тиазол-2-ил). Найдено, %:
дено, %: C 48.16; H 2.66; N 6.10. C19H12Br2N2OS.
C 59.06; H 3.09; N 6.39. C22H13BrN2S2. Вычислено,
Вычислено, %: С 47.92; Н 2.54; N 5.88. M 476.19.
%: C 58.80; H 2.92; N 6.23. M 449.39.
(2Е)-2-[5-Бром-4-(4-метоксифенил)-1,3-ти-
(2Е)-2-(5-Бром-4-тиен-2-ил-1,3-тиазол-2-ил)-
азол-2-ил]-3-(2,5-диметоксифенил)акрилони-
3-тиен-2-илакрилонитрил (6г). Выход 85% (ме-
трил (6ж). Выход 82% (метод а), желто-корич-
тод а), 78% (метод б), желтый мелкокристалли-
невый мелкокристаллический порошок, т. пл.
ческий порошок, т. пл. 185-187°С. ИК спектр, ν,
171-173°С. ИК спектр, ν, см-1: 2212 сл (С≡N).
см-1: 2221 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.77 с,
δ, м. д.: 7.31-7.34 м (2Н, Н4, тиен-2-ил1, Н4, тиен-
3.82 с, 3.85 с (9Н, 3МеО), 7.08 д [2Н, Н3, Н5, Ar1
2-ил2), 7.67 д (1Н, Н3, тиен-2-ил1, 3JHH 4.0 Гц), 7.76
(4-МеОС6Н4), 3JHH 8.7 Гц], 7.14 д {1Н, H3, Ar2
д (1Н, Н5, тиен-2-ил2, 3JHH 3.9 Гц), 7.95 д (1Н, Н5,
[2,5-(МеО)2С6Н3], 3JHH 9.0 Гц}, 7.19 д. д (1Н, Н4,
тиен-2-ил1, 3JHH 3.4 Гц), 8.11 д (1Н, Н3, тиен-2-ил2,
Ar2, 3JHH 9.0, 4JHH 2.7 Гц), 7.66 д (1Н, Н6, Ar2, 4JHH
3JHH 4.9 Гц), 8.49 с (1Н, =СН). Спектр ЯМР 13С
2.7 Гц), 7.86 д (2Н, Н2, Н6, Ar1, 3JHH 8.7 Гц), 8.32 с
DEPTQ (ДМСО-d6), δС, м. д.: 99.8 (CC≡N), 113.8
(1Н, =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6),
(C5, тиазол-2-ил), 115.8 (C≡N), 127.8*, 128.2*,
δС, м. д.: 55.3*, 55.6*, 56.4* (3МеО), 103.7, 104.6
131.4* (3С, тиен-2-ил), 135.2* (тиен-2-ил), 136.3,
(C5, тиазол-2-ил и CC≡N), 112.6*, 113.2* (C3, C4,
136.8 (2C2, тиен-2-ил), 138.0*, 139.6* (2С, тиен-2-
Ar2), 114.0* (2С, Ar1), 116.0 (C≡N), 119.9* (C6, Ar2),
ил), 140.6* (=CH), 146.0 (С4, тиазол-2-ил), 162.5
121.1, 124.8 (2C1, Ar1 и Ar2), 129.8* (2С, Ar1), 139.8*
(С2, тиазол-2-ил). Найдено, %: C 44.18; H 2.01; N
(=CH), 152.8 (2C-OMe), 155.4 (С4, тиазол-2-ил),
7.26. C14H7BrN2S3. Вычислено, %: C 44.33; H 1.86;
159.7 (C-OMe), 161.7 (С2, тиазол-2-ил). Найдено,
N 7.39. M 379.32.
%: C 55.36; H 3.92; N 6.32. C21H17BrN2O3S. Вычис-
(2Е)-3-(4-Бромфенил)-2-[5-бром-4-(4-хлорфе-
лено, %: C 55.15; H 3.75; N 6.13. M 457.35.
нил)-1,3-тиазол-2-ил]акрилонитрил (6д). Выход
(2Е)-2-[5-Бром-4-(4-метилфенил)-1,3-тиазол-
89% (метод а), 74% (метод б), светло-зеленый мел-
2-ил]-3-(4-этоксифенил)-акрилонитрил
(6з).
кокристаллический порошок, т. пл. 141-143°С.
Выход 88% (метод а), желтый мелкокристалли-
ИК спектр, ν, см-1: 2223 сл (С≡N). Спектр ЯМР 1Н
ческий порошок, т. пл. 163-165°С. ИК спектр, ν,
(CDCl3), δ, м. д.: 7.50 д [2Н, Н3, Н5, Ar1 (4-ClC6H4),
см-1: 2215 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
3JHH 8.4 Гц], 7.67 д (2Н, Н2, Н6, Ar1, 3JHH 8.4 Гц),
δ, м. д.: 1.35 т (3Н, ОСН2Ме, 3JHH 7.0 Гц), 2.37 с
7.71 д [2Н, Н3, Н5, Ar2 (4-BrC6H4), 3JHH 8.4 Гц], 7.82
(3Н, Ме), 4.14 к (2Н, ОСН2Ме, 3JHH 7.0 Гц), 7.13
д (2Н, Н2, Н6, Ar1, 3JHH 8.4 Гц), 8.18 с (1Н, =СН).
д [2Н, Н3, Н5, Ar1 (4-МеС6Н4), 3JHH 8.8 Гц], 7.33 д
Спектр ЯМР 13С DEPTQ (CDCl3), δС, м. д.: 102.1
[2Н, Н3, Н5, Ar2 (4-EtOС6Н4), 3JHH 8.1 Гц], 7.83 д
(CC≡N), 109.6 (C5, тиазол-2-ил), 115.9 (C≡N), 128.8
(2Н, Н2, Н6, Ar2, 3JHH 8.1 Гц), 8.04 д (2Н, Н2, Н6,
(CBr), 130.9* (C2, C6, Ar1), 131.4, 131.6 (2 C1, Ar1 и
Ar1, 3JHH 8.8 Гц), 8.17 с (1Н, =СН). Спектр ЯМР
Ar2), 131.9* (С3, С5, Ar1), 133.7* (C2, C6, Ar2), 134.9*
13С DEPTQ (ДМСО-d6), δС, м. д.: 14.5* (ОСН2Ме),
(С3, С5, Ar2), 138.9 (CСl), 151.1* (=CH), 153.1 (С4,
20.9* (Ме), 63.7 (ОСН2Ме), 100.9 (CC≡N), 103.7
тиазол-2-ил), 166.2 (С2, тиазол-2-ил). Найдено, %:
(C5, тиазол-2-ил), 115.3* (2С, Ar2), 116.4 (C≡N),
C 44.81; H 2.01; N 5.63. C18H9Br2ClN2S. Вычисле-
124.8 (C1, Ar2), 128.2* (2С, Ar2), 129.1* (2С, Ar1),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
396
ПАХОЛКА и др.
129.7 (C1Ar1), 132.5* (2С, Ar1), 138.6 (С4, Ar1),
(3-BnO-4-MeOС6Н3), 3JHH 8.7 Гц], 7.33-7.36 м [3Н,
145.9* (=CH), 152.5 (С4, тиазол-2-ил), 161.9, 162.6
Н3, Н5, Ar2 (4-MeС6Н4) и H4, Ph], 7.40 д. д (2Н, Н3,
(С4, Ar2 и С2, тиазол-2-ил). Найдено, %: C 59.11;
Н5, Ph, 3JHH 7.1, 3JHH 7.3 Гц), 7.47 д (2Н, Н2, Н6, Ph,
H 4.20; N 6.76. C21H17BrN2OS. Вычислено, %: C
3JHH 7.3 Гц), 7.74 д. д (1H, H6, Ar1, 3JHH 8.7, 4JHH
59.30; H 4.03; N 6.59. M 425.35.
1.6 Гц), 7.80-7.84 м (3Н, Н2, Ar1 и Н2, Н6, Ar2), 8.17
(2Е)-3-(3-Бром-4-гидрокси-5-метоксифе-
с (1H, =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6),
нил)-2-[5-бром-4-(3,4-диметилфенил)-1,3-тиа-
δС, м. д.: 20.9* (Me), 55.9* (MeO), 70.0 (OCH2Ph),
101.0 (CC≡N), 103.7 (C5, тиазол-2-ил), 112.3* (Ar1),
зол-2-ил]акрилонитрил (6и). Выход 75% (метод
114.3* (Ar1), 116.5 (C≡N), 124.9 (C1, Ar2), 125.3*
а), коричневый мелкокристаллический порошок,
т. пл. 187-189°С. ИК спектр, ν, см-1: 3301 ш (ОН),
(Ar1), 128.0* (2С, Ar2), 128.1* (С4, Ph),128.2* (2С,
2222 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ,
Ph), 128.6* (2С, Ar2), 129.2* (2С, Ph), 129.7 (C1,
м. д.: 2.28 уш. с (6Н, Ме), 3.88 с (3Н, МеО), 7.26
Ar1), 136.4 (C1, Ph), 138.6 (C4Ar2), 146.0* (=CH),
147.7 (C3, Ar1), 152.5, 152.8 (C-OMe, С4, тиазол-
уш. псевдосинглет (1Н), 7.63-7.72 м (3Н), 7.88 с
(1Н) (Ar1 и Ar2), 8.09 c (1H, =CH), 10.75 уш. с (1Н,
2-ил), 162.5 (С2, тиазол-2-ил). Найдено, %: C 62.44;
ОН). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м.
H 4.23; N 5.60. C27H21BrN2O2S. Вычислено, %: C
д.: 19.3*, 19.5* (2Me), 56.2* (MeO), 101.4 (CC≡N),
62.67; H 4.09; N 5.41. M 517.45.
103.8 (C5, тиазол-2-ил), 109.6 (CBr), 112.1* (Ar2),
(2Е)-2-[5-Бром-4-(4-бромфенил)-1,3-тиазол-
116.3 (C≡N), 124.4 (C1, Ar1), 125.7* (Ar1 или Ar2),
2-ил]-3-(4-бромфенил)акрилонитрил (6м). Вы-
127.8* (Ar1), 129.1* (Ar1), 129.5* (Ar2), 129.9 (C1,
ход 88% (метод а), светло-зеленый мелкокристал-
Ar2 или Ar1), 136.3, 137.3 (2CMe), 144.7* (=CH),
лический порошок, т. пл. 252-254°С. ИК спектр, ν,
147.9, 148.1 (C-OMe, C-OH), 152.7 (С4, тиазол-
см-1: 2224 сл (С≡N). Информативные спектры 1Н и
2-ил), 162.1 (С2, тиазол-2-ил). Найдено, %: C 48.76;
13С ЯМР в ДМСО-d6 или CDCl3 получить не уда-
H 3.34; N 5.49. C21H16Br2 N2O2S. Вычислено, %: C
лось из-за очень плохой растворимости соедине-
48.48; H 3.10; N 5.38. M 520.25.
ния в этих растворителях. Найдено, %: C 41.46; H
(2Е)-2-(5-Бром-4-фенил-1,3-тиазол-2-ил)-3-
1.88; N 5.59. C18H9Br3N2S. Вычислено, %: C 41.18;
(4-хлорфенил)акрилонитрил (6к). Выход 92%
H 1.73; N 5.34. М 525.06.
(метод а), светло-зеленый мелкокристаллический
Рентгеноструктурный анализ. Эксперимен-
порошок, т. пл. 175-177°С. ИК спектр, ν, см-1:
тальный материал для соединения 1б (C16H9ClN2S2)
2224 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
получен на автоматическом четырехкружном диф-
7.48 т (1Н, H4, Ph, 3JHH 6.5 Гц), 7.54 д. д (2Н,
рактометре Agilent Super Nova, Dual, Cu at zero,
Н3, Н5, Ph, 3JHH 6.5, 3JHH 7.1 Гц), 7.66 д (2Н, Н3,
Atlas S2 при 293(2) K. Структура расшифрована
Н5, Ar, 3JHH 8.3 Гц), 7.92 д (2Н, Н2, Н6, Ph, 3JHH
прямым методом в комплексе программ Olex2
7.1 Гц), 8.04 д (2Н, Н2, Н6, Ar, 3JHH 8.3 Гц), 8.29 с
[48] и ShelXD [49], и уточнена с помощью пакета
(1H, =СН). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС,
SHELXL [50]. Структура уточнена полноматрич-
м. д.: 105.1, 105.6 (CC≡N и C5, тиазол-2-ил), 115.6
ным МНК в анизотропном приближении для нево-
(C≡N), 128.3* (2С, Ph), 128.6* (2С, Ph), 129.1* (C4,
дородных атомов по F2. Основные характеристики
Ph), 129.4* (2С, Ar), 131.2 (CCl), 131.6* (2С, Ar),
эксперимента и параметры элементарной ячейки
132.3 (С1, Ph), 136.7 (C1, Ar), 144.9* (=CH), 152.7
соединения 1б: размер 0.551 × 0.138 × 0.125 мм,
(С4, тиазол-2-ил), 161.9 (С2, тиазол-2-ил). Найде-
кристаллическая система моноклинная, простран-
но, %: C 54.00; H 2.75; N 7.10. C18H10BrClN2S. Вы-
ственная группа P21/c, M 328.82; параметры ячей-
числено, %: C 53.82; H 2.51; N 6.97. M 401.71.
ки: а 17.6811(2) Å, b 5.56070(10) Å, с 16.5165(2) Å,
(2Е)-3-(3-Бензилокси-4-метоксифенил)-2-[5-
β 112.563(2)°, V 1499.59(4) Å3, Z 4, dвыч 1.456 г/см3,
бром-4-(4-метилфенил)-1,3-тиазол-2-ил]акри-
μ(CuKα) 4.793 мм-1, F(000) 672.0, область углов
лонитрил (6л). Выход 88% (метод а), оранжевый
съемки θ 5.412-152.79°; интервалы индексов отра-
мелкокристаллический порошок, т. пл. 159-161°С.
жений: -22 ≤ h ≤ 22, -6 ≤ k ≤ 4, -20 ≤ l ≤ 20; число
ИК спектр, ν, см-1: 2208 сл (С≡N). Спектр ЯМР 1Н
измеренных отражений 16443, число независимых
(ДМСО-d6), δ, м. д.: 2.37 с (3Н, Ме), 3.87 с (3Н,
отражений 3123 (Rint 0.0226, Rsigma 0.0132), число
МеО), 5.13 с (2Н, OCH2Ph), 7.21 д [1H, H5, Ar1
отражений с I > 2σ(I) 3123, число уточняемых па-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
397
раметров 191; R-факторы [I>2σ(I)]: R1 0.0301 (wR2
СПИСОК ЛИТЕРАТУРЫ
0.0816), R-факторы по всем отражениям: R1 0.0323
1.
Paladhi S., Jana B., Pathak S., Mannab S.K. // Arkivoc.
(wR2 0.0838), GOOF по F2 1.053, Δρmax и Δρmin 0.24
2019. P. 256. doi 10.24820/ark.5550190.p010.911
и -0.30 е·Å-3. Результаты РСА соединения 1б де-
2.
Alneyadi S.S. // Heterocycles. 2018. Vol. 96. N 5. P. 803.
doi 10.3987/REV-17-878
понированы в Кембриджский банк структурных
3.
Metwally M.A., Farahat A.A., Abdel-Wahab B.F. //
данных (CCDC 2047238).
J. Sulfur Chem. 2010. Vol. 31. N 4. P. 315. doi
Экспериментальный материал для соединения
10.1080/17415993.2010.482155
6з (C21H17BrN2OS) получен на автоматическом че-
4.
Song Y.X., Du D.M. // Org. Biomol. Chem. 2020.
Vol. 18. N 31. P. 6018. doi 10.1039/D0OB01261K
тырехкружном дифрактометре Agilent Super Nova,
5.
Rouf A., Tanyeli C. // Eur. J. Med. Chem. 2015. Vol. 97.
Dual, Cu at zero, Atlas S2 при 293(2) K. Структу-
P. 911. doi 10.1016/j.ejmech.2014.10.058
ра расшифрована прямым методом в комплексе
6.
Tawfik S.S., Liu M., Farahat A.A. // Arkivoc. 2020. P.
программ Olex2 [48] и ShelXD [49], и уточнена с
180. doi 10.24820/ark.5550190.p011.308
помощью пакета SHELXL [50]. Структура уточ-
7.
Chhabria M.T., Patel S., Modi P., Brahmkshatriya P.S. //
Curr. Top. Med. Chem. 2016. Vol. 16. N 26. P. 2841. doi
нена полноматричным МНК в анизотропном
10.2174/1568026616666160506130731
приближении для неводородных атомов по F2.
8.
Ali S.H., Sayed A.R. // Synth. Commun. 2020. doi
Основные характеристики эксперимента и па-
10.1080/00397911.2020.1854787
раметры элементарной ячейки соединения
6з:
9.
de Souza M.V.N. // J. Sulfur Chem. 2005. Vol. 26. N 4-5.
размер 0.38 × 0.134 × 0.067 мм, кристаллическая
P. 429. doi 10.1080/17415990500322792
10.
Mishra R., Sharma P.K., Verma P.K., Tomer I., Mathur
система моноклинная, пространственная группа
G., Dhakad P.K. // J. Heterocycl. Chem. 2017. Vol. 54.
P21/n, M 425.33; параметры элементарной ячей-
N 4. P. 2103. doi 10.1002/jhet.2827
ки: а 6.1987(2) Å, b 20.4716(8) Å, с 15.1233(5) Å, β
11.
Zhong J. // Nat. Prod. Rep. 2013. Vol. 30. P. 869. doi
95.974(3)°, V 1908.68(12) Å3, Z 4, dвыч 1.480 г/см3,
10.1039/c3np70006b
μ(CuKα) 4.049 мм-1, F(000) 864.0, область углов
12.
Sundeep K.M., Ramandeep K., Rohit B., Kapil K.,
Virender S., Ravi S., Rupinder K., Ravindra K.R. //
съемки θ 7.294-152.73°; интервалы индексов отра-
Bioorg. Chem. 2017. Vol. 75. P. 406. doi 10.1016/j.
жений: -7 ≤ h ≤ 7, -25 ≤ k ≤ 25, -19 ≤ l ≤ 18; число
bioorg.2017.10.014
измеренных отражений 37966, число независимых
13.
Hui-Zhen Z., Lin-Ling G., Hui W., Cheng-He Z. // Mini
отражений 3982 (Rint 0.0974, Rsigma 0.0407), число
Rev. Med. Chem. 2017. Vol. 17. N 2. P. 122. doi 10.21
отражений с I>2σ(I) 3982, число уточняемых па-
74/1389557516666160630120725
14.
Preeti A., Rakesh N., Surendra K.N., Sachin K.S.,
раметров 237; R-факторы [I>2σ(I)]: R1 0.0478 (wR2
Vikramjeet J. // Med. Chem. Res. 2016. Vol. 25. P.1717.
0.1347), R-факторы по всем отражениям: R1 0.0537
doi 10.1007/s00044-016-1610-2
(wR2 0.1387), GOOF по F2 1.028, Δρmax и Δρmin 0.38
15.
Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. //
и -1.01 еÅ-3. Результаты РСА соединения 6з депо-
Усп. хим. 2018. Т. 87. № 1. С. 1; Dyachenko V.D.,
нированы в Кембриджский банк структурных дан-
Dyachenko I.V., Nenajdenko V.G. // Russ. Chem. Rev.
2018. Vol. 87. N 1. P. 1. doi 10.1070/RCR4760
ных (CCDC 2047245).
16.
Магерамов А.М., Шихалиев Н.Г., Дяченко В.Д., Дя-
ФОНДОВАЯ ПОДДЕРЖКА
ченко И.В., Ненайденко В.Г. α-Цианотиоацетамид.
М.: Техносфера, 2018. 224 с.
Исследование выполнено при финансовой под-
17.
Abd El-Gilil Sh.M. // J. Mol. Struct. 2019. Vol. 1194.
держке Кубанского научного фонда в рамках на-
P. 144. doi 10.1016/j.molstruc.2019.04.048
учного проекта МФИ-20.1-26/20 (заявка № МФИ-
18.
Suntsova P.O., Eltyshev A.K., Pospelova T.A., Slepu-
khin P.A., Benassi E., Belskaya N.P. // Dyes Pigm. 2019.
20.1/45) и Министерства образования и науки
Vol. 166. P. 60. doi 10.1016/j.dyepig.2019.02.051
Российской Федерации (тема 0795-2020-0031).
19.
Bashandy M.S., Abd El-Gilil Sh.M. // Heterocycles.
КОНФЛИКТ ИНТЕРЕСОВ
2016. Vol. 92. N 3. P. 431. doi 10.3987/COM-15-13384
20.
Hussain S.M., El-Reedy A.M., El-Sharabasy S.A. //
Авторы заявляют об отсутствии конфликта
Tetrahedron. 1988. Vol. 44. N 1. P. 241. doi 10.1016/
интересов.
S0040-4020(01)85113-9
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
398
ПАХОЛКА и др.
21.
Дяченко В.Д. Литвинов В.П. // ХГС. 1998. № 2.
34.
Дяченко В.Д., Рыльская Т.А., Савчук С.В. // Вісн.
С. 213; Dyachenko V.D., Litvinov V.P. // Chem.
Харків. нац. унів. 2006. № 731. Хімія. Вип. 14(37).
Heterocycl. Compd. 1998. Vol. 34. N 2. P. 188. doi
С. 86.
10.1007/BF02315182
35.
Ahmed A.A.M., Mekky A.E.M., Elwahy A.H.M.,
22.
Кривоколыско С.Г., Дяченко В.Д., Нестеров В.Н.,
Sanad S.M.H. // Synth. Commun. 2020. Vol. 50. N 6.
Литвинов В.П. // ХГС. 2001. № 7. С. 929;
P. 796. doi 10.1080/00397911.2019.1689269
Krivokolysko S.G., Dyachenko V.D., Nesterov V.N.,
36.
Abdelhamid A.O., Zohdi H.F., Rateb N.M. // J. Chem.
Litvinov V.P. // Chem. Heterocycl. Compd. 2001.
Res. (S). 1995. P. 144.
Vol. 37. N 2. P. 855. doi 10.1023/A:1012499424379
37.
Abdelhamid A.O., Zohdi H.F., Rateb N.M., Abdelha-
23.
Дяченко В.Д., Литвинов В.П. // ЖОрХ. 1998. Т. 34.
mid A.O. // Phosphorus, Sulfur, Silicon, Relat.
Вып. 4. С. 592; Dyachenko V.D., Litvinov V.P. // Russ.
Elem. 1998. Vol. 133. N 1. P. 103. doi 10.1080/
J. Org. Chem. 1998. Vol. 34. N 4. P. 557.
10426509808032458
38.
Abdelbamid A.O., Al-Shehri S.M. // J. Chem. Res.
24.
Дяченко В.Д., Кашнер А.Ю., Самусенко Ю.В. // ЖОХ.
Miniprint. 1997. N 7. P. 1681.
2014. Т. 84. № 2. С. 266.; Dyachenko V.D., Kash-
39.
Шаранин Ю.А., Шестопалов А.М., Промонен-
ner A.Yu., Samusenko Yu. V. // Russ. J. Gen. Chem. 2014.
ков В.К., Родиновская Л.А. // ЖОрХ. 1984. Т. 20.
Vol. 84. N 2. P. 259. doi 10.1134/S1070363214020169
Вып. 7. С. 1539; Sharanin Yu.A., Shestopalov A.M.,
25.
Гончаренко М.П., Шаранин Ю.А., Туров А.В. //
Promonenkov V.K., Rodinovskaya L.A. // J. Org. Chem.
ЖОрХ. 1993. Т. 29. № 8. С. 1610; Goncharenko M.P.,
USSR. 1984. Vol. 20. N 7. P. 1402.
Sharanin Yu.A., Turov A.V. // Russ. J. Org. Chem. 1993.
40.
Schäfer V.H., Gewald K. // J. Prakt. Chem. 1974.
Vol. 29. N. 8. P. 1341.
Vol. 316. N 4. P. 684. doi 10.1002/prac.19743160421
26.
Nesterov V.N., Montoya N.G., Antipin M.Yu.,
41.
Дяченко И.В., Дяченко В.Д., Дороватовский П.В.,
Sanghadasa M., Clark R.D., Timofeeva T.V. // Acta
Хрусталев В.Н., Ненайденко В.Г. // ЖОрХ. 2019.
Crystallogr. (С). 2002. Vol. 58. P. o72. doi 10.1107/
Т. 55. № 2. С. 266; Dyachenko I.V., Dyachenko V.D.,
S0108270101020170
Dorovatovskii P.V., Khrustalev V.N., Nenaidenko V.G. //
27.
Khafagy M.M., El-Maghraby A.A., Hassan S.M.,
Russ. J. Org. Chem. 2019. Vol. 55. N 2. P. 215. doi
Bashandy M.S. // Phosphorus, Sulfur, Silicon,
10.1134/S1070428019020131
Relat. Elem. 2004. Vol. 179. P. 2113. doi
42.
Smith C.D., French K.J., Yun J.K. Pat. US 2004/0034075
10.1080/10426500490475049
A1 (2004).
28.
Hassan S.M., Abdel Aal M.M., El-Maghraby A.A.,
43.
Smith C.D., French K.J., Yun J.K. Pat. WO 03/105840
Bashandy M.S. // Phosphorus, Sulfur, Silicon,
A2 (2003). USA.
Relat. Elem.
2009. Vol.
184. P.
427. doi
44.
Gambacorti Passerini C., Gunby R.H., Zambon A.,
10.1080/10426500802176523
Scapozza L., Ahmed S., Goekjian P.G., Gueyrard D.,
29.
Дяченко В.Д. // ЖОХ. 2015. Т. 85. № 4. С. 618;
Popowycz F., Schneider C. Pat. EP 2 107 054 A1 (2009).
Dyachenko V.D. // Russ. J. Gen. Chem. 2015. Vol. 85.
45.
Gambacorti Passerini C., Gunby R.H., Zambon A.,
N. 4. P. 861. doi 10.1134/S1070363215040167
Scapozza L., Ahmed S., Goekjian P.G., Gueyrard D.,
30.
Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П. //
Popowycz F., Schneider C. Pat. WO 2009/121535 A2
ХГС. 1999. № 10. С. 1370; Krivokolysko S.G.,
(2009). USA.
Dyachenko V.D., Litvinov V.P. // Chem. Heterocycl.
46.
Brunskill J.S.A., De A., Ewing D.F. // J. Chem. Soc.
Compd. 1999. Vol. 35. N 10. P. 1190. doi 10.1007/
Perkin Trans. 1. 1978. N 6. P. 629. doi 10.1039/
BF02323378
P19780000629
31.
Дяченко И.В., Рамазанова Е.Ю., Дяченко В.Д. //
47.
Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
ЖОрХ. 2014. Т. 50. № 12. С. 1839; Dyachenko I.V.,
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
Ramazanova E.Yu., Dyachenko V.D. // Russ. J. Org.
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
Chem. 2014. Vol. 50. N 12. P. 1821. doi 10.1134/
Chem. Heterocycl. Compd. 2012. Vol. 48. P. 309. doi
S1070428014120185
10.1007/s10593-012-0991-5
32.
Дяченко В.Д., Чернега А.Н., Гарасевич С.Г. // ЖОХ.
48.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
2005. Т. 75. № 10. С. 1688; Dyachenko V.D., Cherne-
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
ga A.N, Garasevich S.G. // Russ. J. Gen. Chem. 2005.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Vol. 75. N 10. P. 1610. doi 10.1007/s11176-005-0475-8
49.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
33.
Дяченко В.Д. // ЖОрХ. 2006. Т. 42. № 5. С. 741;
P. 112. doi 10.1107/S0108767307043930
Dyachenko V.D. // Russ. J. Org. Chem. 2014. Vol. 42.
50.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
N 5. P.724. doi 10.1134/S1070428006050137
P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СИНТЕЗ И СТРОЕНИЕ (2E)-3-АРИЛ(ГЕТАРИЛ)-...
399
Synthesis and Structure of (2E)-3-Aryl(hetaryl)-2-[5-bromo-
4-aryl(hetaryl)-1,3-thiazol-2-yl]acrylonitriles
N. A. Pakholkaa, V. L. Abramenkoa, V. V. Dotsenkob,c, N. A. Aksenovc,
I. V. Aksenovac, and S. G. Krivokolyskoa,d,*
a Laboratory KhimEx, V. Dal Lugansk State University, Lugansk, 91034 Ukraine
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
d St. Luke Lugansk State Medical University, Lugansk, 91045 Ukraine
*e-mail: ksg-group-lugansk@mail.ru
Received December 28, 2020; revised December 28, 2020; accepted January 20, 2021
Bromination of (2E)-3-aryl(hetaryl)-2-[4-aryl(hetaryl)-1,3-thiazol-2-yl]acrylonitriles proceeds regioselectively
at the C5 atom of the thiazole ring with the formation of new (2E)-3-aryl(hetaryl)-2- [5-bromo-4-aryl(hetaryl)-
1,3-thiazol-2-yl]acrylonitriles. The latter were alternatively obtained by the reaction of aldehydes, cyanothioac-
etamide, α-bromoketones and bromine in the presence of triethylamine in DMF. Structure of the key compounds
was confirmed using 2D NMR spectroscopy and single crystal X-ray diffraction analysis.
Keywords: 1,3-thiazoles, 5-bromo-1,3-thiazoles, cyanothioacetamide, 2-cyanothioacrylamides, bromination
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021