ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 400-404
УДК 547.854.4
ОКИСЛЕНИЕ 5-ГИДРОКСИ-6-МЕТИЛУРАЦИЛА
В ЩЕЛОЧНЫХ ВОДНЫХ РАСТВОРАХ
© 2021 г. С. Ф. Петрова*, Т. Р. Нугуманов, А. В. Антипин, Н. Н. Кабальнова,
Ю. И. Муринов, С. П. Иванов
Уфимский Институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: petrova_sf89@anrb.ru
Поступило в Редакцию 18 декабря 2020 г.
После доработки 18 декабря 2020 г.
Принято к печати 30 декабря 2020 г.
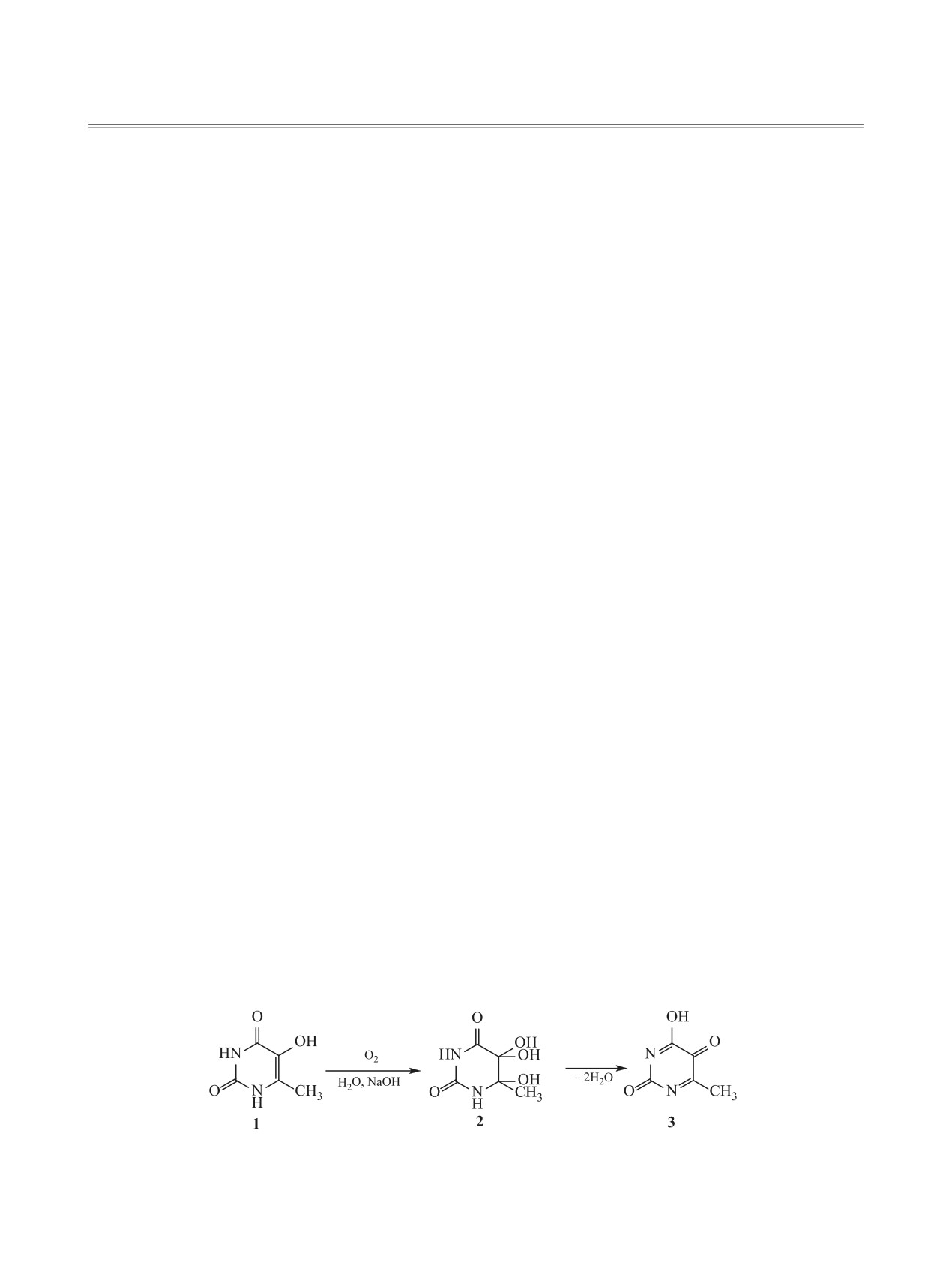
5-Гидрокси-6-метилурацил в щелочном водном растворе окисляется молекулярным кислородом. Мето-
дами УФ спектроскопии и дифференциальной манометрии изучено влияние температуры, концентрации
щелочи и кислорода на скорость реакции. С увеличением концентрации щелочи стехиометрия реакции
по кислороду приближается к 1. Расходование 5-гидрокси-6-метилурацила в водно-щелочной среде
связано с образованием анионной формы по гидроксильной группе.
Ключевые слова: 5-гидрокси-6-метилурацил, окисление, молекулярный кислород, щелочной водный
раствор
DOI: 10.31857/S0044460X21030045
Изучение стабильности лекарственных препа-
имодействует со щелочью в водной среде с образо-
ратов в водных растворах необходимо для опреде-
ванием
4-гидрокси-6-метилпиримидин-2,5-диона
ления условий их использования и хранения, по-
3 (схема 1) [4, 5].
скольку продукты превращения могут оказывать
5-Гидроксиурацил (изобарбитуровая кислота)
существенное влияние на биологическую актив-
в анаэробных условиях в щелочной среде терми-
ность. 5-Гидрокси-6-метилурацил 1 - терапевтиче-
чески стабилен даже при повышенных температу-
ская субстанция широкого спектра действия [1, 2].
рах, но подвергается окислительной деструкции
Данные о стабильности 5-гидроксипроизводных
при действии кислорода воздуха [6]. В присут-
урацила в щелочной среде немногочисленны. Ра-
ствии кислорода расходование 5-гидроксиурацила
нее спектрально-люминесцентным методом было
зависит от концентрации щелочи. При действии
установлено, что при окислении соединения 1 в
атмосферного кислорода в присутствии щелочи
водно-щелочных растворах образуется интермеди-
образуются 3-оксо-2-гидроксипропановая кислота
ат 5,5,6-тригидрокси-6-метилпиримидин-2,4-дион
и мочевина [7]. Для некоторых производных 5-ги-
2 [3]. По данным ВЭЖХ и ЯМР, соединение 1 вза-
дроксиурацила в атмосфере азота в 0.1 М. раство-
Схема 1.
400
ОКИСЛЕНИЕ 5-ГИДРОКСИ-6-МЕТИЛУР
АЦИЛА
401
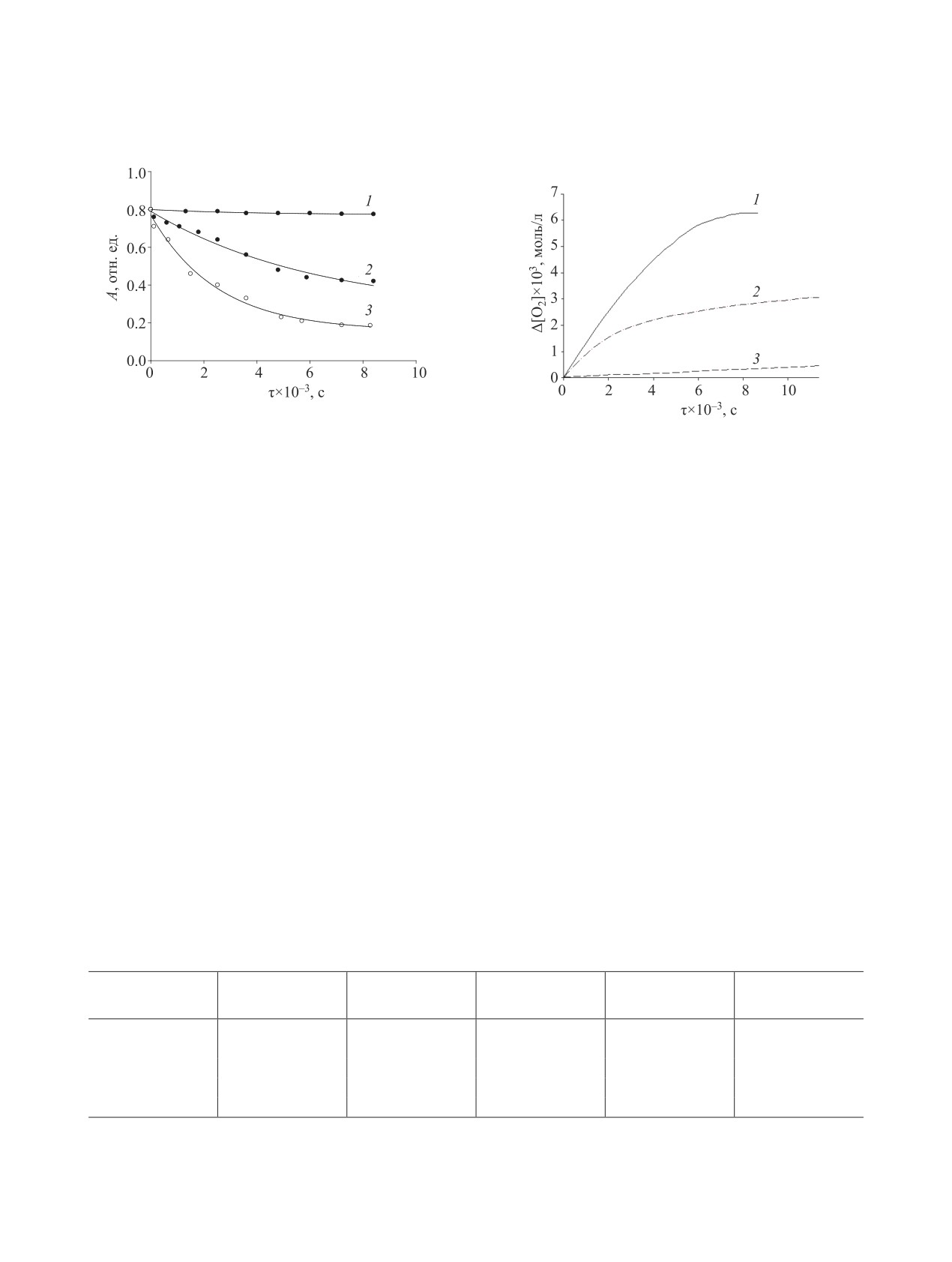
Рис. 1. Кинетические кривые расходования 5-гидрокси-
6-метилурацила: 1 - аргон; 2 - воздух; 3 - кисло-
Рис. 2. Кинетические кривые поглощения кислорода.
род (λmax 278 нм, [1]0 = 1×10-3 моль/л, [KOH]0 = 2×
[1]0 = 1×10-2 моль/л; [KОН]0 = 4×10-2 (1), 2×10-2 (2),
10-3 моль/л, 40°С).
1×10-2 моль/л (3), 45°С.
ре NaOH наблюдали трансформацию пиримиди-
ции щелочи возрастает количество поглощенного
нового цикла в имидазолиновый [8].
кислорода (табл. 1). Из количества поглощенного
кислорода следует, что с увеличением концентра-
При исследовании окисления соединения
1
ции щелочи стехиометрия реакции приближается
в щелочном водном растворе методом УФ спек-
к 1. Начальная скорость расходования соедине-
троскопии обнаружена линейная зависимость на-
ния 1 увеличивается с повышением температуры
чальной скорости расходования исходного 1 при
(табл. 2). Таким образом, начальная скорость рас-
увеличении концентрации щелочи (r2 0.993). Для
ходования 1 в водном щелочном растворе увели-
определения роли кислорода при расходовании со-
чивается с возрастанием количества кислорода,
единения 1 в водно-щелочной среде реакцию про-
щелочи и температуры.
водили в атмосфере аргона, кислорода и воздуха
(рис. 1); при пропускании кислорода через реакци-
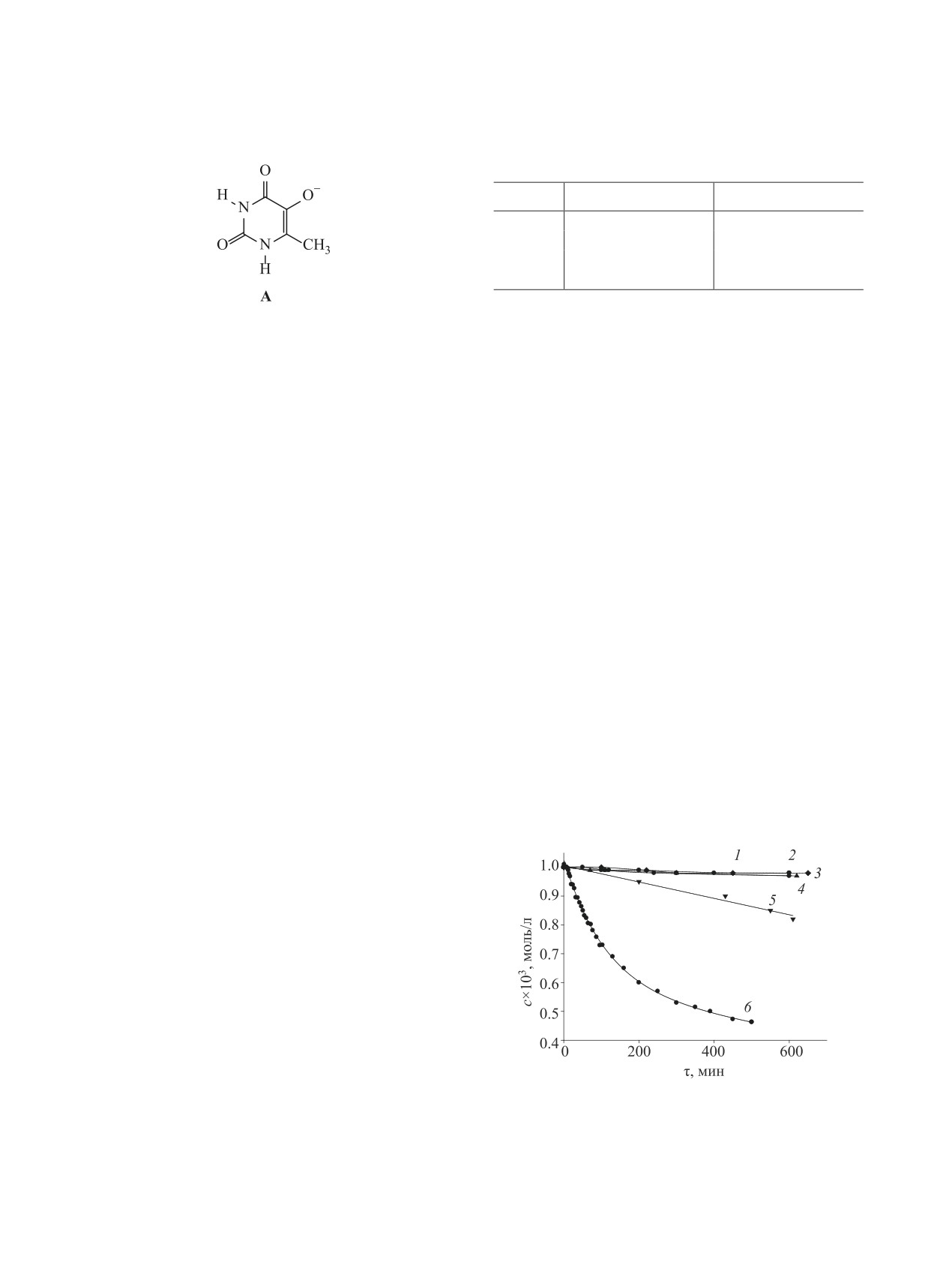
Согласно полученным ранее результатам, в ще-
онную массу (кривая 3) начальная скорость расхо-
лочной среде на первой ступени диссоциации со-
дования соединения 1 увеличивается. Количество
единения 1 происходит отрыв протона от гидрок-
сильной группы в положении 5 урацила с образо-
кислорода, израсходованного в реакции, определя-
ли на универсальной манометрической установ-
ванием аниона А (рKа1 8.93±0.02, схема 2) [9, 10].
ке. Типичные кинетические кривые поглощения
В аналогичных условиях методом ВЭЖХ из-
кислорода при различной концентрации щелочи
учено расходование метоксипроизводных: 5-ме-
приведены на рис. 2. С увеличением концентра-
токси-1,3,6-триметилурацила 4, 5-метокси-3,6-ди-
Таблица 1. Зависимость количества израсходованного кислорода при окислении 5-гидрокси-6-метилурацила от кон-
центрации щелочиа
[КОН]0,
∆[О2]×103,
∆[1]×103,
w0(O2)×107,
∆[О2]/∆[1]
keff×104, с-1
моль/л
моль/л
моль/л
моль/(л∙с)
0.01
0.41±0.06
0.96±0.08
0.42±0.08
0.36±0.03
0.036
0.02
3.00±0.10
5.60±0.10
0.54±0.08
9.80±0.10
0.98
0.04
6.30±0.10
8.00±0.06
13.40±0.50
1.34
0.08
5.30±0.10
8.00±0.06
0.78±0.12
12.80±0.50
1.28
0.10
7.20±0.10
8.00±0.05
11.70±0.80
1.17
а 45°С, [1]0 = 1×10-2 моль/л, keff = w0(O2)/[1]0.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
402
ПЕТРОВА и др.
Схема 2.
Таблица 2. Температурная зависимость начальной ско-
рости расходования 5-гидрокси-6-метилурацилаа
Т, °С
w0×107,·моль/(л∙с)
keff×104, с-1
40
0.84±0.03
0.84
50
1.16±0.07
1.16
60
1.38±0.11
1.38
70
1.65±0.10
1.65
а [1]0 = 1×10-3 моль/л, [KOH]0 = 2×10-3 моль/л, keff = w0/[1]0.
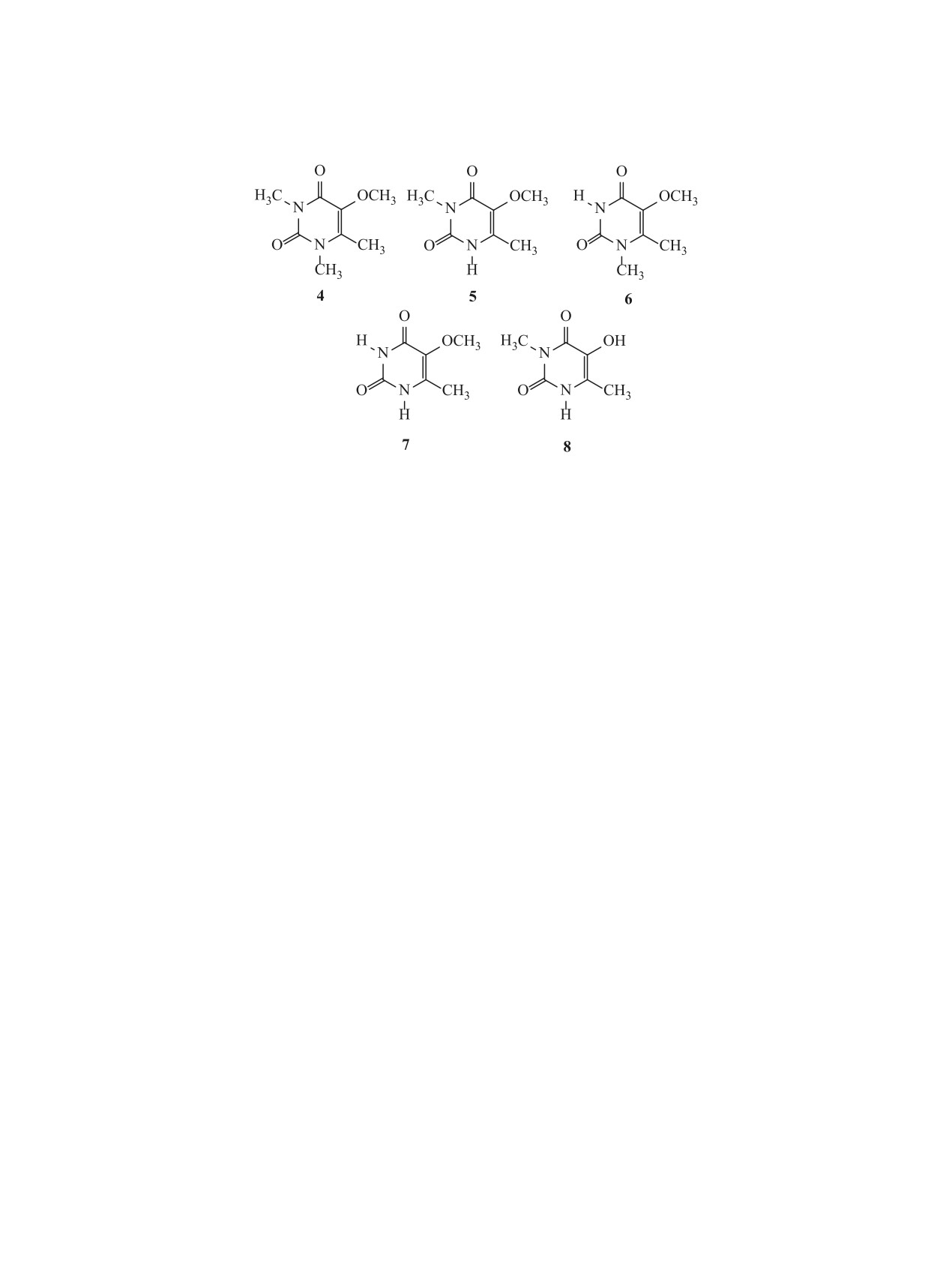
метилурацила
5,
5-метокси-1,6-диметилурацила
6, 5-метокси-6-метилурацила 7, а также 5-гидрок-
нения влияния следовых количеств 3d-металлов
си-3,6-диметилурацила 8 (схема 3), синтезирован-
добавляли 7.5 мл трилона Б (Уралхиминвест) (8×
ных по методикам [11, 12].
10-4 моль/л). Через определенные промежутки
Как видно из кинетических кривых (рис. 3), в
времени из реакционной смеси отбирали пробы
водной щелочной среде в присутствии эквимоляр-
и спектрофотометрически определяли концентра-
ного количества KOH расходуются соединения 1
цию соединения 1 на максимуме длины волны по-
(кривая 6) и 8 (кривая 5), а концентрации 5-ме-
лосы поглощения (λ 278 нм). Спектры поглощения
токсипроизводных 4-7 не изменяются. Начальная
снимали на спектрофотометре Shimadzu UV-1800
скорость расходования соединения 8 значительно
в области 200-340 нм в кварцевых кюветах тол-
меньше начальной скорости расходования 5-ги-
щиной 0.1 см, растворитель - бидистиллирован-
дрокси-6-метилурацил 1. Следовательно, расхо-
ная вода.
дование соединения 1 обусловлено образованием
анионной формы по гидроксильной группе.
Аналогично проводили опыты в атмосфе-
ре аргона и кислорода, при этом предварительно
Таким образом, в щелочном водном растворе
пропуская аргон или кислород через растворы
5-гидрокси-6-метилурацил нестабилен: его анион-
соединения 1 и щелочи в течение 15 мин. Опыты
ная форма реагирует с кислородом, при этом ско-
проводили в интервале температур 40-70°С при
рость реакции возрастает с увеличением концен-
атмосферном давлении. Температуру поддер-
трации щелочи и температуры.
живали постоянной с помощью термостата LOIP
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
LT-205 (Россия).
В качестве исходного вещества использовали
За расходованием соединений 1, 4-8 в водной
5-гидрокси-6-метилурацил, синтезированный по
щелочной среде следили методом ВЭЖХ на хро-
методике [12], с чистотой более 95% (ВЭЖХ [13]).
Гидроксид калия квалификации ХЧ (Реахим) ис-
пользовали без дополнительной очистки. Для
приготовления растворов и элюента применяли
бидистиллированную воду и ацетонитрил квали-
фикации ОСЧ (Криохром, Россия), которые филь-
тровали через мембранный фильтр ФМПА-0.45-
47 (ВЛАДиСАРТ, Россия).
Реакцию соединения 1 в водно-щелочной среде
проводили в двугорлом термостатируемом реакто-
ре. К 7.5 мл раствора соединения 1 (4×10-3 моль/л)
добавляли 0.75-7.5 мл раствора гидроксида калия
(4×10-2 моль/л). Исходную концентрацию щело-
чи определяли кислотно-основным титрованием
Рис. 3. Кинетические кривые расходования соеди-
фиксаналом HCl (0.01-0.1 моль/л) с использовани-
нений 1, 4-8 ([1, 4-8]0 = 1×10-3 моль/л, [KOH]0 = 1×
ем индикатора - фенолфталеина. С целью устра-
10-3 моль/л, 50°С): 1 - 4; 2 - 5; 3 - 6; 4 - 7; 5 - 8; 6 - 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
ОКИСЛЕНИЕ 5-ГИДРОКСИ-6-МЕТИЛУР
АЦИЛА
403
Схема 3.
матографе Waters Breeze (США) со спектрофо-
щий объем раствора 4 мл. Кинетику скорости по-
тометрическим детектором при λ 215 нм. Ис-
глощения кислорода рассчитывали дифференци-
пользовали колонку Zorbax RX C18 250×4.6 мм,
рованием сглаженной усреднением кинетической
5 мкм (Agilent, США), подвижная фаза - элю-
кривой, после повторного сглаживания находили
ент CH3CN-H2O, 3:97 (об%), скорость потока -
скорость на начальный момент времени.
1 мл/мин. Реакции проводили при 50°С. К 7.5 мл
ФОНДОВАЯ ПОДДЕРЖКА
раствора соединения 1, 4-8 (4×10-3 моль/л) до-
бавляли 7.5 мл раствора гидроксида калия (4×
Работа выполнена в рамках государствен-
10-3 моль/л) и 15 мл бидистиллированной воды.
ных заданий Министерства науки и высшего
Концентрацию соединений 1, 4-8 определяли по
образования
(№ AAAA-A20-120012090029-0 и
градуировочным графикам. Например, для по-
AAAA-A20-120012090025-2) с использованием
строения градуировочного графика навески 12.5,
оборудования Центров коллективного пользова-
5 и 3.6 мг соединения 1 переносили в мерные кол-
ния «Химия» и «Агидель» Уфимского федераль-
бы на 25 мл. Добавляли 15 мл элюента (CH3CN-
ного исследовательского центра РАН.
H2O, 3:97, об%) и растворяли при перемешивании.
КОНФЛИКТ ИНТЕРЕСОВ
Доводили объем растворителем до метки. Для по-
лученных растворов с концентрациями 3.5×10-3,
Авторы заявляют об отсутствии конфликта
1.4×10-3 и 1.0×10-3 моль/л записывали хромато-
интересов.
граммы. По средним значениям площадей пиков
СПИСОК ЛИТЕРАТУРЫ
соединения 1 для каждой концентрации строили
градуировочный график.
1. Мышкин В.А., Бакиров А.Б. Оксиметилурацил
(Очерки экспериментальной фармакологии). Уфа:
Определение количества поглощенного кис-
ДАР, 2001. 218 с.
лорода при окислении соединения 1 в щелочном
2. Гимадиева А.Р., Чернышенко Ю.Н., Абдрахманов И.Б.,
водном растворе проводили на универсальной
Мустафин А.Г. Синтез, модификации и биологиче-
манометрической дифференциальной установке
ская активность урацилов. Уфа: Гилем, 2013. 176 с.
[14, 15], коэффициент Генри 0.0256 [16]. Измене-
3. Петрова С.Ф., Остахов С.С., Иванов С.П., Нугу-
ние давления регистрировали в автоматическом
манов Т.Р., Муринов Ю.И., Хурсан С.Л. // Химия
режиме. К 3.3 мл термостатированного раство-
высоких энергий. 2018. Т. 52. Вып. 6. С. 468; Petrova
ра соединения 1 (1.2×10-2 моль/л) в воде добав-
S.F., Ostakhov S.S., Ivanov S.P., Nugumanov T.R., Muri-
ляли 0.065-0.6 мл раствора гидроксида калия
nov Y.I., Khursan S.L. // High Energy Chem. 2018.
(0.6 моль/л) и 0.1 мл трилона Б (0.1 моль/л). Об-
Vol. 52. N 6. P. 480. doi 10.1134/ S0023119318060116
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
404
ПЕТРОВА и др.
4.
Иванов С.П., Конкина И.Г., Байкова И.П., Спири-
11. Кривоногов В.П., Толстиков Г.А., Муринов Ю.И., За-
хин Л.В., Муринов Ю.И. // ХГС. 2002. № 11. С. 1609;
рудий Ф.А., Лазарева Д.Н., Исмагилова А.Ф., Волко-
Ivanov S.P., Konkina I.G., Baikova I.P., Spirikhin L.V.,
ва С.С., Сахаутдинова Г.М., Спирихин Л.В., Абдрах-
Murinov Yu.I. // Chem. Heterocycl. Compd. 2002. N 11.
манов И.Б., Кривоногова И.И. // Хим.-фарм. ж. 1993.
P. 1424. doi 10.1002/chin.200327138.
Т. 27. № 2. С. 38; Krivonogov V.P., Tolstikov G.A.,
5.
Петрова С.Ф., Нугуманов Т.Р., Лобов А.Н., Ива-
Murinov Yu.I., Zarudii F.S., Lazareva D.N., Ismagilova
нов С.П., Муринов Ю.И. // Вестн. Баш. унив. 2016.
A.F., Volkova S.S., Sakhautdinova G.M., Spirikhin
Т. 21. Вып. 3. С. 626.
L.V., Abdrakhmanov I.B., Krivonogova I.I. // Pharm.
6.
Garretth E., Nestleran H.J., Somodi A. // J. Org. Chem.
Chem. J. 1993. Vol. 27. N 2. P. 112. doi 10.1007/
1968. Vol. 33. N 9. P. 3460. doi 10.1021/jo01273a022
BF00781072
7.
Legay R., Massou S., Azéma J., Martino R., Malet-
12. Петрова С.П., Нугуманов Т.Р., Лобов А.Н., Спири-
Martino M. // J. Pharm. Biomed. Anal. 2014. Vol. 98. P.
хин Л.В., Муринов Ю.И., Иванов С.П. // ЖОХ. 2018.
446. doi 10.1016/j.jpba.2014.06.015
Т. 88. Вып. 1. С. 143; Petrova S.F., Nugumanov T.R.,
8.
Otter B.A., Falco E.A., Fox J.J. // J. Org. Chem. 1969.
Lobov A.N., Spirikhin L.V., Murinov Y.I., Ivanov S.P. //
Vol. 34. N 9. P. 2636. doi 10.1021/jo01261a032
Russ. J. Gen. Chem. 2018. Vol. 88. N 1. P. 143. doi
9.
Петрова С.Ф., Нугуманов Т.Р., Хазимуллина Ю.З.,
10.1134/S1070363218010231
Гимадиева А.Р. Иванов С.П. // ЖОХ. 2020.
13. Иванов С.П., Нугуманов Т.Р., Муринов Ю.И. // Баш.
Т. 90. Вып. 5. С. 690; Petrova S.F., Nugumanov T.R.,
хим. ж. 2007. Т. 14. Вып. 1. С. 42.
Khazimullina Yu.Z., Gimadieva A.R., Ivanov S.P. // Russ.
14. Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные
J. Gen. Chem. 2020. Vol. 90. N 5. P. 690. doi10.1134/
реакции окисления углеводородов в жидкой фазе.
S1070363220050059
М: Наука, 1965. 369 с.
10.
Петрова С.Ф., Нугуманов Т.Р., Спирихин Л.В.,
Муринов Ю.И., Иванов С.П. // ЖОХ. 2018. Т. 88.
15. Эмануэль Н.М., Галл Д. Окисление этилбензола. М.:
Вып. 6. С. 895; Petrova S.F., Nugumanov T.R.,
Наука, 1984. 376 с.
Spirikhin L.V., Murinov Y.I., Ivanov S.P. // Russ. J.
16. Коган В.Б., Фридман В.М., Кафаров В.В. Справоч-
Gen. Chem. 2018. Vol. 88. N 6. P. 1076. doi 10.1134/
ник по растворимости. М.: АН СССР, 1961. Т. 1.
S107036321806004X
Кн. 1. 970 c.
Oxidation of 5-Hydroxy-6-methyluracil
in Alkaline Aqueous Solutions
S. F. Petrova*, T. R. Nugumanov, A. V. Antipin, N. N. Kabal’nova,
Yu. I. Murinov, and S. P. Ivanov
Ufa Institute of Chemistry, Ufa Federal Research Centre of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: petrova_sf89@anrb.ru
Received December 18, 2020; revised December 18, 2020; accepted December 30, 2020
5-Hydroxy-6-methyluracil was found to be oxidized by molecular oxygen in an alkaline aqueous solution. The
effect of temperature, concentration of alkali and oxygen on the reaction rate was revealed by UV spectroscopy
and differential manometry. The reaction stoichiometry with respect to oxygen approaches 1 with an increase in
the alkali concentration. Using methylated model compounds, it was shown that the consumption of 5-hydroxy-
6-methyluracil in an aqueous alkaline medium is associated with the formation of the anionic form at the
hydroxyl group.
Keywords: 5-hydroxy-6-methyluracil, oxidation, molecular oxygen, alkaline aqueous solution
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021