ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 405-411
УДК 544.431
МЕХАНИЗМ ДЕГИДРОГАЛОГЕНИРОВАНИЯ
2,2-ДИ(4-ХЛОРФЕНИЛ)-1,1,1-ТРИХЛОРЭТАНА
В СРЕДЕ NaOH-ДИМЕТИЛФОРМАМИД:
КВАНТОВО-ХИМИЧЕСКИЙ ПОДХОД
© 2021 г. Е. А. Гузов, М. Б. Кужин, М. П. Копыткова, С. Г. Сибриков, В. Н. Казин*
Ярославский государственный университет имени П. Г. Демидова, ул. Советская 14, Ярославль, 150003 Россия
*е-mail: kaz@uniyar.ac.ru
Поступило в Редакцию 26 ноября 2020 г.
После доработки 28 декабря 2020 г.
Принято к печати 30 декабря 2020 г.
Проведено моделирование щелочного гидролиза амидного растворителя и реакции дегидрохлорирования
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана в среде NaOH-ДМФА. С использованием квантово-химиче-
ского анализа термодинамических параметров процесса, протекающего с участием конкурирующих
реагентов - гидроксид-аниона и аниона-интермедиата, предложен наиболее вероятный дегидрохлори-
рующий реагент и механизм реакции.
Ключевые слова: 2,2-диарил-1,1,1-трихлорэтаны, метод функционала плотности, щелочной гидролиз
ДМФА, гидроксид-анион, анионный комплекс, механизм дегидрохлорирования
DOI: 10.31857/S0044460X21030057
2,2-Диарил-1,1,1-трихлорэтаны и их произво-
рования 2,2-диарил-1,1,1-трихлорэтанов, влияние
дные используются при производстве разнообраз-
на них строения субстрата, природы реагента и
ных красителей и пигментов, биологически актив-
растворителя. Исследован механизм реакции деги-
ных добавок, полифункциональных органических
дрохлорирования 2,2-диарил-1,1,1-трихлорэтанов
реактивов, а также мономеров [1-3]. Полимеры с
с использованием неорганических солей в различ-
трихлорэтандиильной группой обладают негорю-
ных растворителях [7-10].
честью, однако не отличаются высокой термостой-
Несмотря на обилие информации по функци-
костью. Увеличение термостойкости достигается
онализации и преобразованию функций в про-
трансформацией трихлорэтандиильной группы в
изводных
2,2-диарил-1,1,1-трихлорэтана, число
дихлорэтендиильную и карбонильную [4].
публикаций о их реакционной способности при
Среди превращений различных типов наиболее
взаимодействии со щелочами в амидных рас-
важны реакции элиминирования и активирован-
творителях ограничено. N,N-Диметилформамид
ного ароматического нуклеофильного замещения
(ДМФА) и N,N-диметилацетамид (ДМАА), не
атомов галогена анионными реагентами [5]. В
будучи полностью инертными растворителями,
качестве дегидрохлорирующих агентов использу-
могут взаимодействовать с нуклеофильными ре-
ются безводные алкоголяты щелочных металлов,
агентами. Образующиеся продукты щелочного
твердые щелочи и их растворы в воде или в орга-
гидролиза амидных растворителей, прежде всего,
нических растворителях, пиридин, ароматические
промежуточный анион и диметиламин, могут уча-
и алифатические амины. В обзоре [6] рассмотрено
ствовать в качестве реагентов в процессах, проте-
разнообразие механизмов реакции дегидрохлори-
кающих наряду с основной реакцией. Система ще-
405
406
ГУЗОВ и др.
Схема 1.
Cl
C
Cl
CCl2
94-97%
NaOH (KOH),
R1 = R2 = H
ДМФА (ДМАА)
R1
R1
O2N
NO
2
NaOH (KOH),
H
H3C
CH3
ДМФА (ДМАА)
Cl
C
Cl
N
C
N
R1 = NO2; R2 = H
H3C
CH3
CCl3
CCl2
R2
R2
96-98%
NaOH (KOH),
ДМФА (ДМАА)
R1 = R2 = NO2
O2N
NO2
O2N
NO2
H3C
CH3
N
C
N
+
HO
C
OH
H3C
CH3
CCl2
CCl
2
NO2
NO
O2N
O2N
2
61-93%
лочь-амидный растворитель широко применяется
При взаимодействии
2,2-бис(3,5-дини-
для введения диметиламиногруппы в различные
тро-4-хлорфенил)-1,1,1-трихлорэтана со щелочью
молекулы [11-13].
в амидном растворителе, кроме дегидрохлориро-
вания, протекают реакции нуклеофильного заме-
Закономерности
взаимодействия
2,2-ди-
щения активированных атомов хлора на димети-
(4-хлорфенил)-1,1,1-трихлорэтана и его нитроза-
ламино- и гидроксигруппы с образованием смеси
мещенных аналогов со щелочью в амидном раство-
4,4ʹ-(2,2-дихлорэтен-1,1-диил)бис(N,N-диме-
рителе исследованы при 40-130°С и соотношени-
тил-2,6-динитроанилина) и 4,4ʹ-(2,2-дихлорэтен-
ях субстрат-щелочь-растворитель 1:(4-8):(30-40)
1,1-диил)бис(2,6-динитрофенола). Соотношение
[14], в частности рассматривалось поведение двух
продуктов реакции зависит от температуры: при
потенциальных реакционных центров - атомов
40-45°С выход производного диметиланилина со-
углерода трихлорэтандиильной мостиковой груп-
ставляет 61-64%, а при 100-110°С - 90-93%, что
пы и атомов углерода бензольных циклов, связан-
можно объяснить увеличением скорости гидроли-
ных с галогеном.
за ДМФА и возрастанием концентрации нуклео-
При взаимодействии
2,2-ди-(4-хлорфенил)-
фила Ме2NH с повышением температуры.
1,1,1-трихлорэтана с NaOH (KOH) в ДМФА
При наличии в исходных соединениях не-
(ДМАА) при 70-80°С происходит дегидрохлори-
скольких реакционных центров возникает необ-
рование, и образуется 2,2-ди-(4-хлорфенил)-1,1-
ходимость оценки реакционной способности суб-
дихлорэтен с выходом 94-97% (схема 1).
стратов, конкурирующих реагентов, возможности
В присутствии активирующих нитрогрупп на-
преимущественного протекания реакции по тому
ряду с дегидрохлорированием 2,2-ди-(3-нитро-4-
или иному реакционному центру и определения
хлорфенил)-1,1,1-трихлорэтана протекает реак-
механизмов различных типов реакций.
ция нуклеофильного замещения атомов хлора на
В качестве модельного соединения для кванто-
N,N-диметиламиногруппы, и образуется 4,4ʹ-(2,2-
во-химического исследования процессов, протека-
дихлорэтен-1,1-диил)бис(N,N-диметил-2-нитро-
ющих при взаимодействии со щелочью в амидном
анилин) с выходом 96-98% [15, 16].
растворителе, и для установления наиболее веро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНИЗМ ДЕГИДРОГАЛОГЕНИРОВАНИЯ 2,2-ДИ-(4-ХЛОРФЕНИЛ)-1,1,1-ТРИХЛОРЭТАНА
407
(а)
(б)
(в)
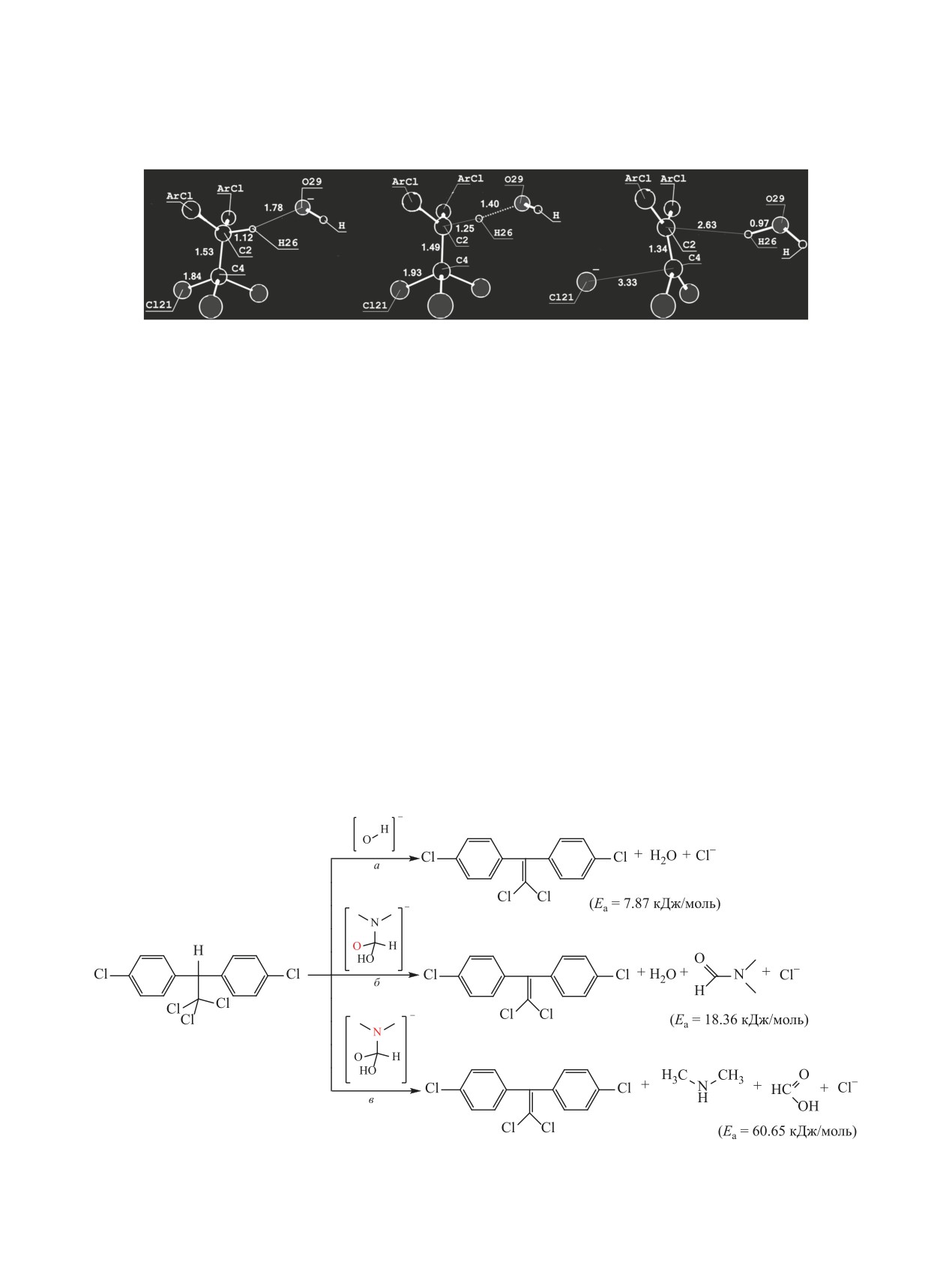
Рис. 1. Структуры и длины связей предреакционного комплекса (а), переходного состояния (б), постреакционного комплекса
(в) в реакции дегидрохлорирования 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана гидроксид-анионом.
ятного дегидрохлорирующего реагента и механиз-
комплекса (переходное состояние с одной мнимой
ма реакции нами выбран 2,2-ди-(4-хлорфенил)-
частотой 646.46 см-1). Визуализация результатов
1,1,1-трихлорэтан. Рассмотрены протекающие в
моделирования представлена на рис. 1. В струк-
данной системе реакции дегидрохлорирования
туре переходного состояния уменьшаются длины
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана гидрок-
связей Н26-О29 и С2-С4 с 1.78 до 1.40 и с 1.53 до
сид-анионом, щелочной гидролиз ДМФА, деги-
1.49 Å соответственно, а длина связи С2-Н26 уве-
дрохлорирование анионным комплексом (интер-
личивается с 1.12 до 1.25 Å. Происходит перерас-
медиат щелочного гидролиза).
пределение электронной плотности и увеличение
Гидроксид-анион - эффективный дегидрохло-
длины связи С4-Сl21 c 1.84 до 1.93 Å.
рирующий агент. К реакционным центрам при взаи-
В постреакционном комплексе происходит
модействии 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэ-
дальнейшее сокращение межатомного расстоя-
тана,
находящегося в антиперепланарной
ния С2-С4 с 1.49 до 1.34 Å. Образование кратной
конформации, с гидроксид-анионом относятся
связи С2=С4 (порядок связи 1.64) приводит к пере-
атомы кислорода реагента и водорода трихлорэ-
распределению электронной плотности. Гидрок-
тандиильной мостиковой группы.
сид-анион образует молекулу воды (длина связи
Моделирование реакции дегидрохлорирова-
Н26-О29 сокращается с 1.40 до 0.97 Å). Одновре-
ния предполагает формирование активированного
менное увеличение длины связи С4-Сl21 c 1.93 до
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
408
ГУЗОВ и др.
(а)
(б)
(в)
(г)
Рис. 2. Схема щелочного гидролиза ДМФА. (а) исходные реагенты, (б) промежуточный анионный комплекс, (в) переходное
состояние стадии разложения промежуточного аниона, (г) диметиламин и формиат-анион.
3.33 Å приводит к отщеплению атома Сl21 в виде
1.26 Å и разрывается связь O13-H14. В результате
хлорид-аниона (схема 2, а).
образуются два молекулярных фрагмента - фор-
миат-анион и диметиламин.
Энергия активации дегидрохлорирования 2,2-
ди-(4-хлорфенил)-1,1,1-трихлорэтана гидроксид-
По результатам квантово-химического моде-
анионом равна Еа 7.87 кДж/моль, а тепловой эф-
лирования щелочного гидролиза ДМФА, гидрок-
фект - ΔН -194.24 кДж/моль (экзотермический
сид-анион, присутствующий первоначально в
процесс).
системе NaOH-ДМФА, безбарьерно образует с
растворителем промежуточный анион, энергети-
По результатам квантово-химического иссле-
ческий барьер последующего разложения анион-
дования, щелочной гидролиз ДМФА (рис. 2) про-
ного комплекса составляет 99.77 кДж/моль. Это
текает в две стадии с образованием анионного
свидетельствует о стабильности комплекса, о воз-
комплекса между растворителем и гидроксид-а-
можности накапливаться в реакционной среде и
нионом с последующим разложением интерме-
диата до диметиламина и формиат-аниона. Атака
выступать в качестве дегидрохлорирующего аген-
та (процесс экзотермический, ΔН -105.02 кДж/моль).
гидроксид-иона на атом углерода ДМФА (рис. 2а)
приводит к образованию анионного комплек-
С учетом полученных результатов смоде-
са (рис. 2б). Этот экзотермический процесс (ΔН
лировано взаимодействие
2,2-ди-(4-хлорфе-
-43.9 кДж/моль) протекает безбарьерно, приво-
нил)-1,1,1-трихлорэтана с промежуточным ам-
дит к незначительному удлинению связи C2-N4 на
бидентным анионным комплексом. Возможны
0.11 Å и к локализации отрицательного заряда на
два направления его атаки на трихлорэтанди-
атоме кислорода (-0.952 е) карбонильной группы,
ильную мостиковую группу
2,2-ди-(4-хлорфе-
что придает комплексу значительную стабильность.
нил)-1,1,1-трихлорэтана: атомом кислорода (О-а-
Далее по координате реакции следует переход-
така) и атомом азота (N-атака) (схема 2, б, в).
Структуры предреакционного комплекса, переход-
ное состояние разложения промежуточного аниона
ного состояния и продуктов реакции дегидрохло-
(рис. 2в). Величина торсионного угла N4C2O13H14
рирования
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэ-
изменяется на 91.4° по сравнению со структурой
тана, образующихся в результате взаимодействия
аниона (рис. 2б), связь O13-H14 удлиняется с 0.97
с промежуточным анионом (О-атака), приведены
до 1.20 Å, а связь C2-N4 разрывается (межатомное
на рис. 3, с указанием длин связей.
расстояние изменяется с 1.50 до 1.84 Å). В пере-
ходном состоянии образуется связь N4-H14, длина
В структуре переходного состояния (рис. 3б)
которой составляет 1.32 Å. Из-за перераспределе-
уменьшается длина связи между атомом водорода
ния электронной плотности происходит уменьше-
(Н26) трихлорэтандиильной мостиковой группы и
ние длины связи С2-О13 с 1.48 до 1.39 Å. Длина
атомом кислорода (О29) аниона с 1.69 до 1.33 Å, а
связи N4-С2 увеличивается с 1.50 до 1.84 Å. В по-
связи С2-С4 - с 1.53 до 1.47 Å. Длины связей С4-
стреакционном комплексе сокращается межатом-
Сl21 и С2-Н26 возрастают с 1.84 до 1.98 и с 1.13 до
ное расстояние С2-О13 в формиат-ионе с 1.39 до
1.31 Å соответственно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНИЗМ ДЕГИДРОГАЛОГЕНИРОВАНИЯ 2,2-ДИ-(4-ХЛОРФЕНИЛ)-1,1,1-ТРИХЛОРЭТАНА
409
(а)
(б)
(в)
Рис. 3. Длины связей в предреакционном комплексе (а), переходном состоянии (б) и постреакционном комплексе (в) при
О-атаке 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана промежуточным анионом.
(а)
(б)
(в)
Рис. 4. Длины связей в предреакционном комплексе (а), переходном стоянии (б) и постреакционном комплексе (в) при
N-атаке 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана промежуточным анионом.
В постреакционом комплексе (рис. 3в) про-
соответственно. В результате N-атаки происходит
исходит отщепление хлора (Сl21) в виде хло-
уменьшение длины связи N32-H26 с 1.94 до 1.42 Å.
рид-аниона с образованием кратной связи С2=С4
В постреакционном комплексе по сравнению
(1.34 Å), что приводит к перераспределению элек-
с переходным состоянием происходит дальней-
тронной плотности и образованию 2,2-ди-(4-хлор-
шее сокращение межатомного расстояния между
фенил)-1,1-дихлорэтена. Связь С2-Н26 разрыва-
атомами С2 и С4 с 1.47 до 1.36 Å с образованием
ется, длина связи Н26-О29 уменьшается с 1.33 до
кратной связи межу ними, а также разрыв связей
0.97 Å, и образуется N,N-диметиламинометанди-
C2-H26 (2.14 Å) и С4-Сl21 (2.81Å) с отщеплением
ол, который распадается на воду и N,N-диметил-
хлорид-аниона. Сокращается длина связи H26-N32
формамид.
с 1.42 до 1.02 Å и разрывается связь С30-N32
Энергия активации реакции дегидрохлорирова-
(1.86 Å). Продукты реакции - 2,2-ди-(4-хлорфе-
ния 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана при
нил)-1,1-дихлорэтен, муравьиная кислота и диме-
О-атаке составляет 18.37 кДж/моль, а тепловой
тиламин. Энергия активации реакции дегидрохло-
эффект - ΔН -173.28 кДж/моль (экзотермический
рирования при N-атаке составляет 60.65 кДж/моль,
процесс).
а тепловой эффект - ΔН -113.42 кДж/моль (экзо-
По результатам расчета энергетического про-
термический процесс).
филя реакции дегидрохлорирования промежу-
Таким образом, квантово-химические расче-
точным анионом при N-атаке, в структуре пред-
ты показали, что гидроксид анион, образующий-
реакционного комплекса (рис.
4) происходит
ся при диссоциации гидроксида натрия в ДМФА,
сближение атома азота N32 аниона и атома водоро-
участвует в реакции щелочного гидролиза рас-
да Н26 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана.
творителя, образуя безбарьерно анионный ком-
В переходном состоянии увеличены длины связей
плекс. Учитывая стехиометрическое соотношение
C4-Cl21 и C2-H26 с 1.85 до 2.09 Å и с 1.18 до 1.39 Å
NaOH:ДМФА = (4-8):(30-40), можно предполо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
410
ГУЗОВ и др.
жить, что щелочь расходуется на образование
КОНФЛИКТ ИНТЕРЕСОВ
промежуточного аниона, который накапливается
Авторы заявляют об отсутствии конфликта
в реакционной среде и является основным деги-
интересов.
дрохлорирующим реагентом при взаимодействии
СПИСОК ЛИТЕРАТУРЫ
с 2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтаном.
1.
Русанов А.Л., Кештов М.Л., Кештова С.В., Петров-
Участие формиат-аниона и диметиламина в
ский П.В., Кундина Ю.Ф. // Высокомол. соед. 2000.
качестве дегидрохлорирующих агентов малове-
Т. 42. № 11. С. 1931; Rusanov A.L., Keshtov M.L.,
роятно в связи с высокой энергией разложения
Keshtova S.V., Petrovskii P.V., Kundina Yu.F. // Polymer
промежуточного аниона (Еа
99.77 кДж/моль).
Sci. (B). 2000. Vol. 42. N 11. P. 314.
Скорее всего, реакция дегидрохлорирования
2.
Кештов М.Л., Русанов А.Л., Киреев В.В., Кешто-
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана протека-
ва С.В., Петровский П.В., Кириллов А.А. // Высо-
ет при О-атаке анионным комплексом на атом во-
комол. соед. 2001. Т. 43. № 6. С. 963; Keshtov M.L.,
дорода трихлорэтандиильной мостиковой группы.
Rusanov A.L., Kireev V.V., Keshtova S.V., Petrov-
skii P.V., Kirillov A.A. // Polym. Sci. (A). 2001. Vol. 43. N 6.
По результатам квантово-химического ис-
P. 588.
следования
реакции
дегидрохлорирования
3.
Batanero B., Ramirez-Moreno M., Barba F. //
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэтана как ги-
Tetrahedron Lett. 2016. Vol. 57. P. 2290. doi 10.1016/j.
дроксид-анионом, так и промежуточным анио-
tetlet.2016.04.046
ном, отмечен ряд закономерностей, характерных
4.
Русанов А.Л., Булычева Е.Г., Казакова Г.В., Копей-
для механизма бимолекулярного элиминирования
кин В.В., Казин В.Н., Сибриков С.Г., Кештов М.Л.,
(E2). Это синхронное отщепление атомов хло-
Микитаев А.К. // Высокомол. соед. (Б). 1997. Т. 39.
ра и водорода от α- и β-углеродных атомов, од-
№2. С. 327; Rusanov A.L., Bulycheva E.G., Kazako-
ностадийность процесса, которой соответствует
va G.V., Kopeikin V.V., Kazin V.N., Sibrikov S.G., Kes-
htov M.L., Mikitaev A.K. // Polymer Sci. (B). 1997.
единственный максимум на профиле потенциаль-
Vol. 39. N 1-2. P. 38.
ной энергии; пять атомов переходного состояния
5.
Власов В.М. // Усп. хим. 2003. T. 72. № 8. С. 764;
O···H···C-C-Cl расположены практически в од-
Vlasov V.M. // Russ. Chem. Rev. 2003. Vol. 72. N 8.
ной плоскости.
P. 681. doi 10.1070/RC2003v072n08ABEH000809
В дальнейшем мы предполагаем изучить ме-
6.
Сибриков С.Г., Казин В.Н., Копейкин В.В. //
тодами квантовой химии реакции дегидрохло-
Изв. вузов. Сер. хим. и хим. технол. 1994. Т. 37.
рирования и активированного нуклеофильного
Вып. 10-12. С. 3.
замещения атомов хлора на диметиламино- и ги-
7.
Казин В.Н., Сибриков С.Г., Кужин М.Б., Савин-
дроксигруппы при взаимодействии нитрозаме-
ский Н.Г. // Баш. хим. ж. 2011. Т. 18. Вып. 3. С. 156.
щенных
2,2-ди-(4-хлорфенил)-1,1,1-трихлорэта-
8.
Казин В.Н., Кужин М.Б., Сирик А.В., Гузов Е.А. //
нов с системой щелочь-амидный растворитель.
ЖОрХ. 2016. Т.52. Вып. 9. С. 1290; Kazin V.N.,
Kuzhin M.B., Sirik A.V., Guzov E.A. // Russ. J. Org.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Chem. 2016. Vol. 52. N 9. Р. 1277. doi 10.1134/
Оптимизацию геометрии и расчет термодина-
S1070428016090049
мических параметров, поиск переходного состо-
9.
Казин В.Н., Кужин М.Б., Сибриков С.Г., Сирик А.В.,
яния и спуск по внутренней координате реакции
Гузов Е.А., Плахтинский В.В. // ЖОХ. 2017. Т. 87.
Вып. 3. С. 371; Kazin V.N., Kuzhin M.B., Sibrikov
выполняли в программном пакете Firefly 8.2 ме-
S.G., Sirik A.V., Guzov E.A., Plakhtinskii V.V. // Russ.
тодом функционала плотности, обменно-корреля-
J. Gen. Chem. 2017. Vol. 87. N 3. Р. 381. doi 10.1134/
ционным потенциалом B3LYP с базисным набо-
S1070363217030033
ром 6-31G++(d,p). Использована континуальная
10.
Гузов Е.А., Казин В.Н., Жукова А.А. // ЖОХ. 2018.
сольватационная модель PCM. Визуализация по-
Т. 88. Вып. 10. С. 1595; Guzov E.A., Kazin V. N., Zhu-
лученных расчетов выполнена в программном па-
kova A.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 10. Р.
кете Chemcraft.
2044. doi 10.1134/S1070363218100031
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНИЗМ ДЕГИДРОГАЛОГЕНИРОВАНИЯ 2,2-ДИ-(4-ХЛОРФЕНИЛ)-1,1,1-ТРИХЛОРЭТАНА
411
11. Yi P., Wei C., Yong T. // Jingxi Huagong Zhongjianti.
14. Сибриков С.Г., Казин В.Н., Копейкин В.В., Миро-
2008. Vol. 38. N 5. P. 25.
нов Г.С., Орлова Т.Н. // ЖОрХ. 1991. Т. 27. Вып. 2.
С. 382.
12. Deau E., Hedou D., Chosson E., Levacher V., Besson T. //
15. Казин В.Н., Сибриков С.Г., Кужин М.Б., Митро-
Tetrahedron Lett. 2013. Vol. 54. P. 3518. doi 10.1016/j.
фанова Г.П., Казина Е.Г., Сирик А.В. Пат. РФ
tetlet.2013.04.096
№ 2522553 (2014) // Б. И. 2014. № 18.
13. Belov P., Campanella V.L., Smith A.W., Priefer R. //
16. Сибриков С.Г., Казин В.Н., Копейкин В.В., Толмаче-
Tetrahedron Lett. 2011. Vol. 52. P. 2776. doi 10.1016/j.
ва И.М. // Изв. вузов. Сер. хим. и хим. технол. 1994.
tetlet.2011.03.111
Т. 37. Вып. 4-6. С. 59.
Mechanism of Dehydrohalogenation
of 2,2-Di(4-chlorophenyl)-1,1,1-trichloroethane
in NaOH-N,N-Dimethylformamide System:
A Quantum-Chemical Approach
E. A. Guzov, M. B. Kuzhin, M. P. Kopitkova, S. G. Sibrikov, and V. N. Kazin*
Demidov Yaroslavl State University, Yaroslavl, 150003 Russia
*e-mail: kaz@uniyar.ac.ru
Received November 26, 2020; revised December 28, 2020; accepted December 30, 2020
The processes of alkaline hydrolysis of an amide solvent and the dehydrochlorination reaction of 2,2-di(4-chlo-
rophenyl)-1,1,1-trichloroethane in NaOH-DMF system were simulated. A quantum-chemical analysis of the
thermodynamic parameters of the processes proceeding with the participation of competing reagents such as the
hydroxide anion and the intermediate anion of the DMF alkaline hydrolysis process in the system was carried
out. The most probable dehydrochlorinating reagent and the reaction mechanism were proposed.
Keywords: 2,2-diaryl-1,1,1-trichloroethanes, density functional theory, alkaline hydrolysis of DMF, hydroxide
anion, anionic complex, dehydrochlorination mechanism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021