ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 412-416
УДК 547.495.2
СОЛИ МОЧЕВИНЫ
С 1-ГИДРОКСИЭТИЛИДЕНДИФОСФОНОВОЙ
КИСЛОТОЙ
© 2021 г. С. Ю. Паньшинаa,b,*, А. А. Бакибаевa, В. С Мальковa, С. И. Белыхa,
К. Б. Жумановс, С. И. Горбинa, Н. В. Понаринa, О. А. Котельниковa
a Национальный исследовательский Томский государственный университет, пр. Ленина 36, Томск, 634050 Россия
b Национальный исследовательский Томский политехнический университет, Томск, 634050 Россия
c Таразский региональный университет имени М. Х. Дулати, Тараз, 080020 Казахстан
*e-mail: janim_svetatusik@mail.ru
Поступило в Редакцию 8 декабря 2020 г.
После доработки 8 декабря 2020 г.
Принято к печати 21 декабря 2020 г.
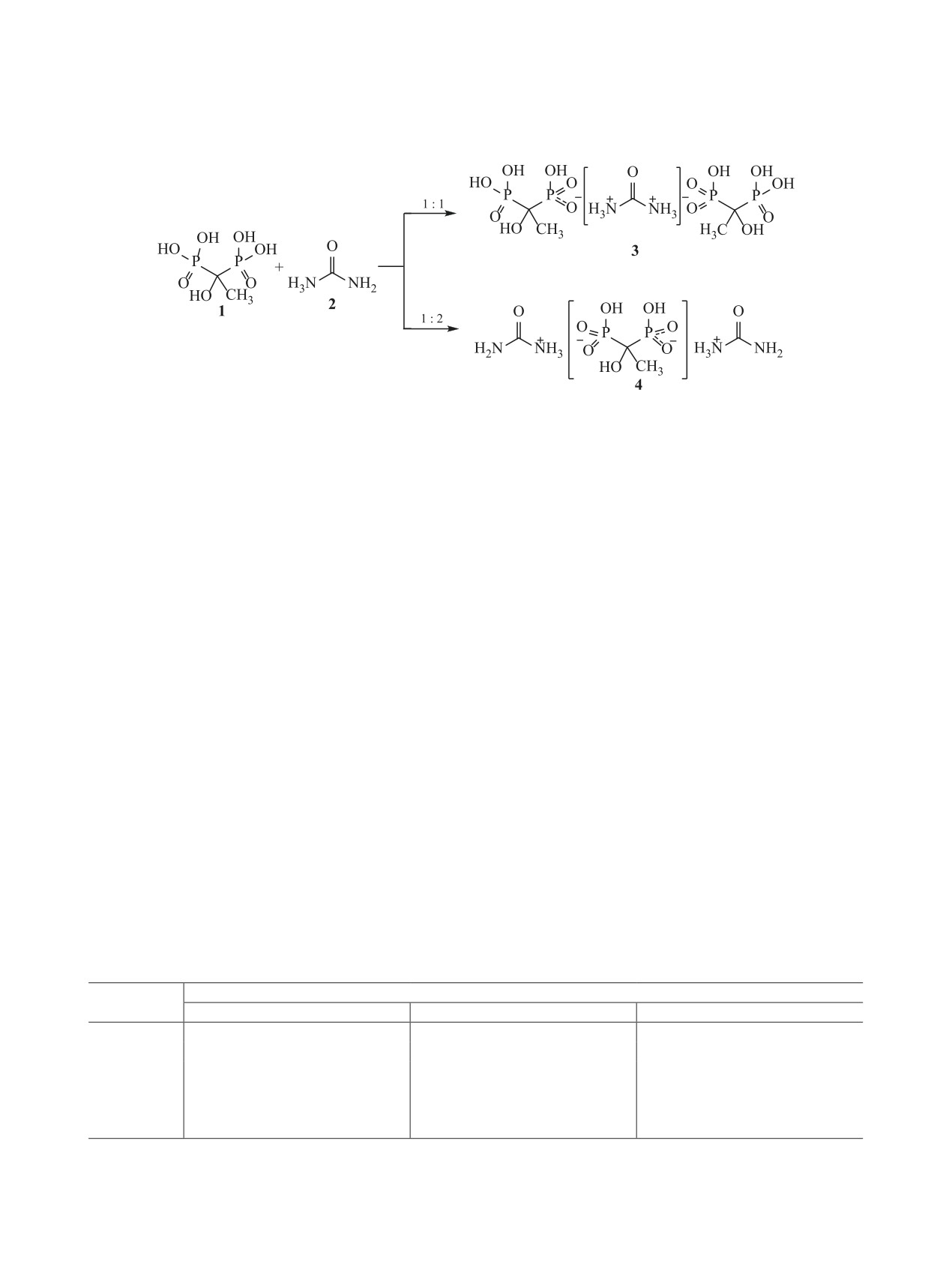
Впервые изучено взаимодействие мочевины с 1-гидроксиэтилидендифосфоновой кислотой в соотноше-
ниях 1:1, 1:2, 1:3, в результате которых показано, что продуктами реакций являются соли состава 1:2 или
2:1 - потенциально биологически активные комплексы. Полученные соединения охарактеризованы мето-
дами атомно-эмиссионной спектроскопии, ИК и ЯМР спектроскопии. По данным атомно-эмиссионного
анализа установлено, что увеличение количества мочевины от 3 молей и более на 1 моль 1-гидроксиэти-
лидендифосфоновой кислоты не вызывает повышения содержания мочевины в конечных продуктах. По
данным ЯМР, исследуемые соединения, в образовании которых участвуют фосфорильные группы 1-ги-
дроксиэтилидендифосфоновой кислоты, находятся в динамическом равновесии соль-свободная кислота.
Ключевые слова: мочевина, 1-гидроксиэтилидендифосфоновая кислота, комплексообразующие свой-
ства, фосфорильная группа
DOI: 10.31857/S0044460X21030069
Благодаря уникальным комплексообразующим
арилалкиламинами в различных соотношениях,
свойствам
1-гидроксиэтилидендифосфоновой
а также с аминометилированными каликс[4]-
кислоты 1 на их основе создано множество новых
резорцинаренами [2]. Сравнительно недавно уста-
фосфорорганических соединений, обладающих
новлено, что
1-гидроксиэтилидендифосфоновая
практически важными свойствами: регуляторов
кислота 1 является удобным катализатором в реак-
циях образования дигидропиримидонов и гликол-
содержания кальция в организме человека, бакте-
урилов из карбонильных соединений с активной
рицидных средств, ингибиторов коррозии, вспо-
метиленовой группой, мочевины и альдегидов как
могательных веществ в нефтедобыче и теплоэнер-
в традиционных условиях [3-5], так и в условиях
гетике и др. [1].
микроволнового синтеза [6]. С другой стороны, на
Среди многочисленных фосфорорганических
основе мочевины (cхема 1) создан не один деся-
соединений, полученных на основе 1-гидрокси-
ток высокоэффективных лекарственных препа-
этилидендифосфоновой кислоты 1, в гораздо мень-
ратов [7], гербицидов [8], удобрений [9] и других
шей степени представлены вещества, содержащие
биологически активных соединений, нашедших
азотистый фрагмент. Так, в ряде работ показано со-
применение в повседневной жизнедеятельности
леобразование 1-гидроксиэтилидендифосфоновой
человека, а для самой мочевины установлена са-
кислоты 1 с некоторыми высоконуклеофильными
мостоятельная биологическая роль [10, 11]. Созда-
412
СОЛИ МОЧЕВИНЫ С 1-ГИДРОКСИЭТИЛИДЕНДИФОСФОНОВОЙ КИСЛОТОЙ
413
Схема 1.
ны новые материалы на основе акрилатов мочевин,
свойств, в том числе обладают биологической ак-
функционализированных бисфосфонатами кислот
тивностью, на наш взгляд, значительный интерес
[12]. Также имеются сведения о получении разно-
представляет изучение взаимодействия данных
образных фосфазасоединений на основе мочеви-
соединений и получение продуктов с потенциаль-
ны с фосфорилирующими реагентами [13, 14], а о
ной биологической активностью на их основе.
взаимодействии
1-гидроксиэтилидендифосфоно-
С учетом вышесказанного целью нашего ис-
вой кислоты 1 с мочевиной есть упоминания [4, 5],
следования явилось изучение взаимодействия
однако прямого изучения данного взаимодействия
1-гидроксиэтилидендифосфоновой кислоты 1 с
не проводилось.
мочевиной 2 с в различных соотношениях (1:1, 1:2
Мочевина склонна к комплексообразованию с
и 1:3). Пути данных реакций и соответствующие
кислотами, причем состав полученных солей зави-
продукты 3, 4 представлены на схеме 1.
сит от кислотности последних [15, 16]. В развитие
Взаимодействие
1-гидроксиэтилидендифос-
этих работ сравнительно недавно были получены
фоновой кислоты 1 с мочевиной 2 в соотноше-
и изучены комплексы мочевины с высоколипо-
ниях 1:1, 1:2, 1:3 приводит к образованию солей
фильными органическими кислотами [17].
3 и 4. Полученные соединения охарактеризованы
Прежде всего, отметим, что ОЭДФ 1 от карбо-
методами ИК и ЯМР спектроскопии (табл. 1), а
новых кислот отличается некоторыми стереохи-
также атомно-эмиссионной спектроскопии (табл.
мическими особенностями, а именно тетраэдри-
2) В ИК спектрах полученных соединений 3 и 4
ческим строением фосфорильной группы, что в
имеются полосы поглощения в областях 2020-
конечном итоге определяет различие валентных
3030 см-1 (NH+), 1695 (С=О) и 3345, 3420 (NH2),
углов и длин связей по сравнению с карбоксиль-
что, в первую очередь, свидетельствует о соле-
ной группой в органических кислотах [18].
образной природе полученных соединений.
Поскольку мочевина и 1-гидроксиэтилиденди-
Совокупный анализ экспериментальных дан-
фосфоновая кислота 1 имеют множество полезных
ных, приведенных в табл. 1 и 2, позволяет отметить
Таблица 1. Данные ЯМР (D2O) для соединений 1-4
δ, м. д. (J, Гц)
№
1H
13C
31P
1
0.52 т (3H, CH3, J 16.4)
18.22 (CH3), 70.52, 69.01, 67.49
18.81 (Pкислота)
2
5.75 уш. с (4H, NH2)
162.74 (C=O)
-
1.34 т. т (6H, CH3, J 16.0, 2.3),
19.11 (CH3), 71.56, 70.09, 68.61,
18.34 (Pкислота), 3.95 д (Рсоль, J
3
6.84 д. т (4H, NH2, J 52.0, 9.1)
162.45 (C=O)
142.7), 4.48 д (Рсоль, J 104.6)
1.31 т. д (3H, CH3, J 16.0, 2.3),
19.11 (CH3), 71.56, 70.09, 68.61,
19.04 (Pкислота), 11.52 д. д (Рсоль,
4
6.83 д. т (8H, NH2, J 52.2, 10.1)
162.45 (C=O)
J 25.7, 11.4)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
414
ПАНЬШИНА и др.
Таблица 2. Данные атомно-эмиссионного анализа со-
схожий с фосфорильным сигналом 1-гидроксиэти-
единений 1-4
лидендифосфоновой кислоты 1, дублет дублетов
Т. пл.,
Выход,
Содержание фосфора, %
при 11.52 м. д. с J 25.7, 11.4 Гц. Мультиплетность
№
°C
%
вычислено
найдено
данных сигналов, вероятно, обусловлена наложе-
1
198
-
30.07
30.05
нием сигналов неэквивалентных атомов фосфора
2
133
-
-
-
PO3-группы.
3
172
82
26.24
25.50
Наличие в спектрах 31Р соединений 3 и 4, син-
4
160
89
19.00
19.75
глета схожего с сигналом самой 1-гидроксиэтили-
дендифосфоновой кислоты 1, и сигналов мульти-
плетного типа, вероятно, связано с динамическим
следующее. В спектрах ЯМР 1Н химический сдвиг
равновесием в растворе между солью и свободной
NH2-групп фрагмента мочевины 2 в синтезирован-
кислотой 1, не связанной с непротонированной
ных соединениях 3, 4 сдвигается в область слабого
мочевиной.
поля (на 1.1 м. д. по сравнению с самой мочеви-
Данные атомно-эмиссионного анализа (табл. 2)
ной) за счет протонирования. В спектре ЯМР 1Н
по определению содержания фосфора и спектро-
соли 3 сигнал NH3-группы мочевины проявляется
скопии ЯМР (табл. 1) полученных соединений
я виде уширенного дублета триплетов при 6.84 м. д
свидетельствуют о том, что при эквимолярных
с J 52.0, 9.1 Гц, что указывает на наличие ионов
соотношениях реагентов образуются соединения
NH+ в исследуемом соединении, сигналы которых
типа 3 (схема 1), в которых на молекулу мочевины
накладываются друг на друга. Сигнал NH3-группы
2 приходится 2 молекулы 1-гидроксиэтилиденди-
мочевинного фрагмента соединения 4 присутству-
фосфоновой кислоты 1. Увеличение количества
ет в спектре ЯМР 1Н в виде дублета триплетов при
мочевины 2 до 2 молей на 1 моль кислоты 1 дает
6.83 м. д. с константами спин-спинового взаимо-
соединение типа 4 (схема 1), а увеличение количе-
действия J 52.2, 10.1 Гц, что свидетельствует об
ства мочевины до 3 молей не вызывает симбатного
участии двух ионов NH+ в солеобразовании соеди-
повышения ее содержания в конечном продукте.
нения 4 и наложении их сигналов друг на друга.
Следует отдельно отметить, что дальнейшее уве-
личение количества мочевины вплоть до 8-крат-
Согласно данным ЯМР 13С, сигналы четвертич-
ного избытка, не позволило нам выделить устой-
ного атома углерода (до 2 м. д.) и СН3-группы (до
чивые соли с 1-гидроксиэтилидендифосфоновой
1.5 м. д.) фрагмента 1-гидроксиэтилидендифосфо-
кислотой, так как в этих случаях были получены
новой кислоты в соединениях 3 и 4 смещаются,
аддукты неустановленного состава, которые при
вследствие появления дезэкранирующего эффекта
сушке или хранении быстро разлагались с обиль-
при солеобразовании с мочевиной.
ным выделением аммиака.
В спектрах ЯМР 31Р соединения 3 обнару-
В процессе изучения солей мочевины с 1-ги-
жены 2 типа сигналов атомов фосфора: синглет
дроксиэтилидендифосфоновой кислотой
3 и
4
при 18.34 м. д. (близкий к химическому сдвигу
установлено, что последние визуально образуют
фосфорильной группы
1-гидроксиэтилиденди-
стабильные эмульсии и увеличивают гомоген-
фосфоновой кислоты 1) и два дублета при 3.95 (J
ность модельных косметических составов (кре-
142.7 Гц) и 4.48 м. д. (J 104.6 Гц) двух неэквива-
мов). Можно предположить, что полученные
лентных атомов фосфора фосфорильной группы,
комплексы
1-гидроксиэтилидендифосфоновой
так как при солеобразовании кислоты 1 с мочеви-
кислоты 1 с мочевиной (которая используется в
ной 2 для однозарядного аниона возможны два ва-
косметических составах для улучшения проник-
рианта распределения заряда. Так, две PO3-группы
новения косметических веществ через дермаль-
могут быть неэквивалентны: одна из них (фосфо-
ный барьер [11]), могут приводить к улучшению
натная группа) монопротонирована, а другая (фос-
проникновения косметического средства в кожу,
фоновая группа) - дипротонирована [17].
способствовать регулированию минерального об-
В спектрах ЯМР 31Р соединения 4 обнаруже-
мена в организме, замедлять окисление жирных
ны также 2 типа сигналов: синглет при 19.04 м. д.,
кислот и способствовать увлажнению. Получен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
СОЛИ МОЧЕВИНЫ С 1-ГИДРОКСИЭТИЛИДЕНДИФОСФОНОВОЙ КИСЛОТОЙ
415
ные комплексы
1-гидроксиэтилидендифосфоно-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
вой кислоты с мочевиной могут быть использо-
Дополнительные материалы для этой статьи до-
ваны в качестве специальных добавок, которые
ступны по doi 10.31857/S0044460X21030069 для
способны даже в малых дозировках увеличивать
авторизованных пользователей.
эффективность природных компонентов и одно-
временно уменьшать их количество в составе кос-
СПИСОК ЛИТЕРАТУРЫ
метического средства.
1.
Кабачник М.И., Дятлова Н.М., Медведь Т.Я.,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бихман Б.И., Уринович Е.М., Колпакова И.Д., Кри-
ницкая Л.В., Вельтищев Ю.Е., Юрьева Э.А., Ластов-
Температуры плавления определяли в откры-
ский Р.П. // Хим. пром. 1975. № 4. С. 254.
тых капиллярах с использованием анализатора
2.
Вагапова Л.И., Насирова З.А., Бурилова Е.А., Зо-
температур плавления Büchi M560 (Büchi, Швей-
бов В.В., Бурилов А.Р., Амиров Р.Р., Пудовик М.А. //
ЖОрХ. 2017. Т. 53. № 2. С. 310; Vagarova L.I., Nasiro-
цария). Спектры ЯМР регистрировали на спектро-
va Z.H., Burilova E.A., Zobov V.V., Burilov A.R., Amirov
метре Bruker AVANCE III HD (Bruker Corporation,
R.R., Pudovik N.A. // Russ. J. Org. Chem. 2017. Vol. 53.
Германия) c рабочей частотой 400 МГц в дейтери-
N 2. P. 312. doi 10.1134/S1070428017020324
рованной воде. В качестве внутренних стандартов
3.
Pansuriya A.M., Savant M.M., Bhuva C.V., Singh J.,
для спектров ЯМР 1H и 13С использовали тетра-
Naliapara Y.T. // Arkivoc. 2009. N 7. P. 79. doi 10.3998/
ark.5550190.0010.707
метилсилан, для спектров ЯМР 31P - 80%-ную
4.
Panshina S., Bakibaev A., Uhov A., Malkov V. // J.
фосфорную кислоту. Количественное содержание
Heterocycl. Chem. 2020. P. 1 doi 10.1002/jhet.4132
фосфора в полученных соединениях определя-
5.
Паньшина С.Ю., Пономаренко О.В., Бакибаев А.А.,
ли на атомно-эмиссионном спектрометре микро-
Мальков В.С. // ЖОрХ. 2020. Т. 56. № 12. С. 1836;
волновой плазмы Agilent 4100 MP-AES (Agilent
Panshina S.Yu., Ponomarenko O.V., Bakibaev A.A.,
Malkov V.S. // Russ. J. Org. Chem. 2020. Vol. 56. N 12.
Technologes, США). ИК спектры регистрировали
P. 2067. doi 10.1134/S1070428020120039
на спектрометре FTIR Bruker Alpha в диапазоне
6.
Savant М.M., Pansuriya A.M., Bhuva C.V., Kapuriya N.P.,
400-4000 см-1.
Naliapara Y.T. // Catal. Lett. 2009. Vol. 132. P. 281. doi
Методика получения солей. Смесь 20.6 г
10.1007/s10562-009-0112-y
7.
Машковский М.Д. Лекарственные средства. М.: Но-
(0.1 моль) кислоты 1 и 50 мл воды нагревали при
вая волна, 2012. C. 84
перемешивании до 90°C. Далее, вследствие эн-
8.
Захаренко В.А. Гербициды. М.: Агропромиздат, 1990.
дотермичности процесса, порционно добавляли
240 c.
12.0 г (0.2 моль) мочевины 2. По окончании при-
9.
Kiss S., Simihaian M. Improving Efficiency of Urea
бавления мочевины 2 выдерживали реакционную
Fertilizers by Inhibition of Soil Urease Activity.
Amsterdam: Springer, 2002. P. 43. doi 10.0.3.239/978-
смесь при 90°С в течение 2 ч. По завершении про-
94-017-1843-1
цесса отгоняли 25 мл воды, и смесь охлаждали.
10.
Williams A.C. In: Percutaneous Penetration Enhancers
Образовавшийся белый осадок отфильтровывали,
Chemical Methods in Penetration Enhancement / Eds N.
промывали 30 мл ацетона и сушили. Выход сое-
Dragicevic, H. Maibach. Heidelberg: Springer, 2015. P.
динения 4 28.6 г (89%). Синтез при соотношениях
301. doi 10.1007/978-3-662-47039-8_18
11.
Decaux G., Fabrice C.A., Kengne G., Soupart A. //
1:2 = 1:1 и 1:3 проводили аналогично. Выход сое-
Critical Care. 2010. Vol. 14. N 5. P. 1. doi 10.1186/
динения 3 составил 82%. При соотношении 1:2 =
cc9292
1:3 образовалась смесь соединений 3 и 4 в соотно-
12.
Guven M.N., Akyol E., Duman F.D., Yagci H.A.,
шении 25:75, согласно данным ЯМР 31P.
Karahan O., Avci D. // J. Polymer Sci. (A). 2017.
Vol. 55. N 19. P. 3195. doi 10.1002/pola.28684
ФОНДОВАЯ ПОДДЕРЖКА
13.
Gholivand K., Dorosti N., Shariatinia Z., Ghaziany F.,
Работа выполнена при финансовой поддержке
Sarikhani S., Mirshahi, M. // Med. Chem. Res. 2011.
Vol. 20. P. 1287. doi 10.1007/s00044-010-9466-3
Томского государственного университета
14.
Markalous F., Jerman Z., Beranek J., Cernik M.,
КОНФЛИКТ ИНТЕРЕСОВ
Touzin J. // Collect. Czech. Chem. Commun. 1972.
Vol. 37. P. 725. doi 10.1135/cccc19720725
Авторы заявляют об отсутствии конфликта
15.
Smith A.E. // Acta. Crystallogr. 1952. Vol. 5. P. 224. doi
интересов.
10.1107/S0365110X52000629
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
416
ПАНЬШИНА и др.
16. Боховкин И.М., Боховкина Ю.И. // ЖОХ. 1947. Т. 17.
Mol. Recogn. Chem. 1994. Vol. 18. P. 115. doi 10.1007/
Вып. 4. С. 621; Bokhovkin I.M. Bokhovkina Yu.I. //
BF00705815
USSR J. Gen. Chem. 1949. Vol. 19. N 5. P. 1002.
18. Uchtman V.A., Gloss R.A. // J. Phys. Chem. 1972.
17. Ahmad J., Freestone A. J., Hussain A. // J. Incl. Phenom.
Vol. 76. N 9. P. 1298. doi 10.1021/j100653a013
Urea Salts with 1-Hydroxyethylidenediphosphonic Acid
S. Yu. Panshinaa,b,*, A. A. Bakibaeva, V. S. Malkova, S. I. Belykha, K. B. Zhumanovc,
S. I. Gorbina, N. V. Ponarina, and O. A. Kotelnikova
a National Research Tomsk State University, Tomsk, 634050 Russia
b National Research Tomsk Polytechnic University, Tomsk, 634050 Russia
c M.Kh. Dulaty Taraz State University, Taraz, 080012 Kazakhstan
*e-mail: janim_svetatusik@mail.ru
Received December 8, 2020; revised December 8, 2020; accepted December 21, 2020
The reaction of urea with 1-hydroxyethylidenediphosphonic acid in the ratios of 1:1, 1:2, 1:3 was first studied.
As a result of the reactions, the corresponding 1:2 or 2:1 salts were formed, which can exhibit biological
activity. The synthesized compounds were characterized by atom emission spectroscopy, IR and NMR
spectroscopy. According to atom emission analysis, an increase in the amount of urea from 3 moles or more
per 1 mole of 1-hydroxyethylidenediphosphonic acid does not cause an increase in the urea content in the final
products. According to NMR spectroscopy data, compounds in the formation of which phosphoryl groups of
1-hydroxyethylidenediphosphonic acid are involved are in dynamic equilibrium salt-free acid.
Keywords: urea, 1-hydroxyethylidenediphosphonic acid, complexing properties, phosphoryl group
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021