ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 430-438
УДК 546.922;547-304.7;54.03
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ
ПЛАТИНЫ(II) С НИТРИЛЬНЫМИ И
ИЗОЦИАНИДНЫМИ ЛИГАНДАМИ: СИНТЕЗ,
СТРУКТУРА И ФОТОФИЗИЧЕСКИЕ СВОЙСТВА
© 2021 г. С. А. Каткова*, И. И. Елисеев, А. С. Михердов, Э. В. Соколова,
Г. Л. Старова, М. А. Кинжалов
Санкт-Петербургский государственный университет,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: s.katkova@spbu.ru
Поступило в Редакцию 8 декабря 2020 г.
После доработки 8 декабря 2020 г.
Принято к печати 14 декабря 2020 г.
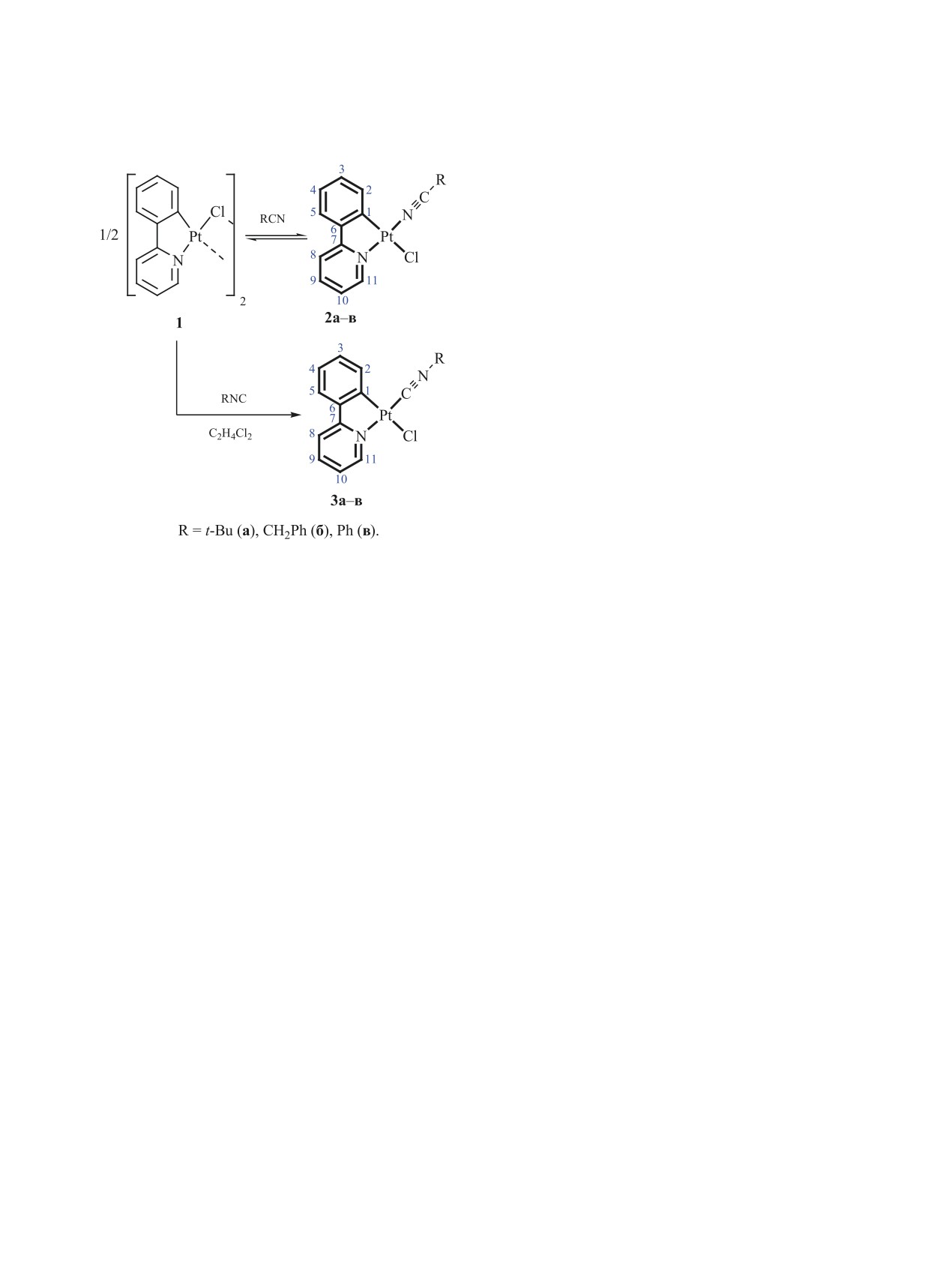
Синтезирована серия циклометаллированых комплексов платины(II) с нитрильными и изоцианидными
лигандами (NCR и CNR; R = t-Bu, Bn, Ph) из димера [{Pt(ppy)Cl}2] (Hppy - 2-фенилпиридин) и соответ-
ствующих нитрилов или изоцианидов с выходом 60-80%. Структура соединений установлена с помощью
масс-спектрометрии, ИК и ЯМР спектроскопии, а также с помощью рентгеноструктурного анализа. С
целью установления вклада различных межмолекулярных взаимодействий в кристаллическую упаковку
для полученных рентгеновских структур проведен анализ поверхности Хиршфельда. Изучены фотофи-
зические свойства полученных комплексов в растворе и твердой фазе.
Ключевые слова: комплексы платины, нитрилы, изоцианиды, люминесценция
DOI: 10.31857/S0044460X21030094
В последние годы изучение C,N-циклометал-
трия которых гарантирует отсутствие стерических
лированных комплексов платины(II) является
затруднений для образования межмолекулярных
интенсивно развивающимся направлением в ко-
нековалентных взаимодействий различных типов
ординационной и металлорганической химии бла-
[10], что, в свою очередь, повышает структурную
жесткость молекул в кристаллической упаковке, и
годаря интересным фотофизическим свойствам
тем самым снижает безызлучательное рассеива-
этого класса соединений [1-4]. Рациональное ва-
ние энергии [4, 11-14]. Описанные в литературе
рьирование циклометаллирующих (C^N) и вспо-
примеры циклометаллированных комплексов пла-
могательных (L1, L2) лигандов в соединениях вида
тины(II) с нитрильными или изоцианидными ли-
[Pt(C^N)(L1,L2)]Z обеспечивает тонкую настройку
гандами являются высокоэффективными люмино-
фотофизических свойств, что позволяет исполь-
форами [1, 15-20] и фотокатализаторами [21-23].
зовать соединения этого класса в качестве эмис-
Однако количество работ, посвященных изучению
сионного слоя в светоизлучающих устройствах
циклометаллированных комплексов платины(II) с
[5, 6], фотокатализаторов в органическом синтезе
подобными лигандами значительно ограничено.
и процессах получения водорода [7], сенсибилизи-
При этом исследований, в которых одновременно
рованных красителей в солнечных батареях [8] и
изучены комплексы с изоструктурными нитриль-
биосенсорах в диагностике заболеваний [9].
ными и изоцианидными лигандами в C,N-цикло-
Одними из типов вспомогательных лигандов
металлированных комплексах платины(II) ранее
являются нитрилы и изоцианиды, линейная геоме-
не производилось.
430
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
431
трах, зарегистрированных для суспензий стехио-
Схема 1.
метрических количеств хлормостикового димера 1
и нитрилов в MeOH.
Изоцианидные комплексы
[Pt(ppy)Cl{CNR}]
[R = t-Bu (3a), Bn (3б), Ph (3в)] получены взаи-
модействием хлормостикового димера 1 с двумя
эквивалентами CNR в 1,2-дихлорэтане. Соедине-
ния 3a-в выделены в виде аналитически чистых
желтых мелкокристаллических порошков с пре-
паративными выходами 72-80%. В отличие от ни-
трильных комплексов 2a-в, соединения 3a-в ста-
бильны как в твердом состоянии, так и в растворах
СH2Cl2, CHCl3, MeOH.
Ранее не описанные соединения 2б, в и 3a-в
охарактеризованы с помощью данных масс-спек-
трометрии высокого разрешения, ИК и ЯМР 1H,
13C{1H}, 195Pt{1H}, 1H-1H COSY/1H-1H NOESY
и 1H-13C HSQC/1H-13C HMBC спектроскопии, а
также методом РСА для комплексов 2в и 3б. По
данным спектроскопии ЯМР 1H, соединение 2a в
В данной работе нами получены и охарак-
растворе в CDCl3 частично превращается в соеди-
теризованы две серии циклометаллирован-
нение 1 и некоординированный нитрил уже спустя
ных комплексов платины(II) с нитрильными
15 мин после растворения, поэтому в растворе он
[Pt(ppy)Cl{NCR}] и изоцианидными
[Pt(ppy)
изучен в только с помощью методов масс-спектро-
Cl{CNR}] (R = t-Bu, Bn, Ph) лигандами (схема 1),
метрии и спектроскопии ЯМР 1H. Спектральные
а также изучены и сравнены их фотофизические
данные для соединения 3в полностью совпадают с
свойства в твердой фазе и растворе.
опубликованными ранее [20].
Синтез нитрильных комплексов платины(II)
В масс-спектрах растворов комплексов 2a-в и
[Pt(ppy)Cl{NCR}] [R = t-Bu (2a), Bn (2б), Ph (2в)]
3а-в в MeOH пик максимальной интенсивности
проводили при перемешивании суспензии хлормо-
соответствует иону [M - Cl]+ и имеет характери-
стикового димера [{Pt(ppy)Cl}2] 1 в соответствую-
стичное изотопное распределение. В ИК спектрах
щем нитриле, взятом в избытке, при 40°С в тече-
изоцианидных комплексов 3а-в наблюдается ин-
ние суток (схема 1). Соединения 2a-в выделены в
тенсивная полоса валентных колебаний связи C≡N
виде аналитически чистых желтых мелкокристал-
в области 2180-2200 см-1, характерная для изоци-
лических порошков с препаративными выходами
анидных комплексов платины(II) [18, 25-28]. В
60-70%. Комплексы 2a-в стабильны в твердом
случае нитрильных комплексов 2a-в полоса ва-
состоянии на воздухе при комнатной температуре,
лентных колебаний нитрильной группы находится
однако в растворах в CH2Cl2, CH(D)Cl3 или MeOH
около 2218-2277 см-1.
они превращаются в исходный хлормостиковый
Комплексы 2a-в и 3а-в демонстрируют один
димер 1 и соответствующий нитрил (полное пре-
набор сигналов в спектрах ЯМР
1H,
13C{1H},
вращение наблюдается через 6-24 ч, по данным
195Pt{1H}, что свидетельствует о присутствии в
спектроскопии ЯМР 1H). Как и в случае ранее опу-
растворе только одного изомера. Образование од-
бликованного комплекса [Pt(ppy)Cl{NCMe}] [24],
ного геометрического изомера в случае комплек-
образование нитрильных комплексов 2a-в и их
сов 2a-в и 3а-в с транс-(Сppy,Cl)-конфигураци-
разложение в растворе - равновесные процессы,
ей может быть объяснено термодинамическим
косвенным подтверждением чему является при-
транс-влиянием, когда комбинация транс-распо-
сутствие сигналов [Pt(ppy)Cl{NCR}]+ в масс-спек-
ложенных донорных атомов Cppy/Cl и Nppy/CCNR
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
432
КАТКОВА и др.
Рис. 1. Общий вид молекул комплексов (a) 2в и (б) 3б в кристалле.
(или Nppy/NNCR) наиболее предпочтительна [26].
геноструктурного анализа (рис. 1). Кристалличе-
Сигналы фрагмента ppy в спектрах ЯМР 1H и
ская структура комплекса 3в ранее описана нами
13C{1H} отнесены при помощи корреляционных
в работе [20] и ее обсуждение в данной работе
методов 2D спектроскопии ЯМР (1H-1H COSY,
приведено для сравнения. Кристаллографически
1H-13C HSQC, 1H-13C HMBC) и отнесение согласу-
независимая часть структур 2в и 3б представ-
ется с имеющимися литературными данными для
лена одной молекулой комплекса [Pt(ppy)Cl(L)]
других комплексов с фрагментом [Pt(ppy)] [29-31].
(рис. 1), а в случае комплекса 3в она состоит из
В спектрах ЯМР 1H соединений 2a-в и 3а-в от-
2 молекул. Значения наиболее важных длин свя-
личительным сигналом является высокочастотный
зей и валентных углов в комплексах приведены в
пик при 9.50-9.70 м. д., соответствующий протону
табл. 1 (для комплекса 3в выбрана молекула с
H11 фенилпиридинового фрагмента, высокочастот-
самими короткими связями). Во всех случаях в
ное смещение которого вызвано сильным дезэкра-
твердой фазе координированный к платине(II)
нированием атома азота [30-33]. Мультиплетный
атом углерода фенилпиридинового фрагмента и
характер сигнала обусловлен спин-спиновым вза-
нитрильный/изоцианидный лиганд находятся в
имодействием с магнитно-активным ядром 195Pt
цис-положении, что согласуется с ренгенострук-
[30]. Аналогично в спектрах ЯМР 13С изоцианид-
турными данными для других изоцианидных и
ных комплексов 3а-в сигналы атомов углерода
нитрильных комплексов галогенидов платины
фенилпиридинового фрагмента (C2-6, C8) имеют
с циклометаллированным фенилпиридиновым
мультиплетный характер. Сигнал атома платины
лингандом [16, 18]. Для изоцианидных комплек-
в спектрах ЯМР на ядрах 195Pt имеет химический
сов 3б и 3в cвязь Pt-C с изоцианидным лигандом
сдвиг в диапазоне -3945÷-3893 м. д., что являет-
примерно на 0.1 Å короче, чем аналогичная связь
ся характерным для циклометаллированных ком-
с углеродом фенилпиридинового фрагмента. Ана-
плексов платины(II) с изоцианидными лигандами
логичная ситуация наблюдается для комплекса 2в:
[18, 25].
связь Pt-N c нитрильным лигандом примерно на
Для доказательства структуры соединений
0.05 Å короче, чем связь Pt-N с азотом фенилпи-
2в и 3б в твердой фазе использован метод рент-
ридинового фрагмента. Во всех случаях тройная
Таблица 1. Значения некоторых длин связей и углов в комплексах 2в, 3б и 3в
№
R
d(Pt-C≡N), нм
d(Pt-N≡C), нм
d(Pt-Cppy)
d(Pt-Nppy)
d(C≡N)
Угол (CPtN)
Угол (CPtCl)
2в
Ph
-
1.960(5)
1.987(6)
2.008(4)
1.133(7)
81.7(2)
95.7(13)
3б
Bn
1.894(8)
-
2.009(9)
2.050(7)
1.148(11)
81.0(3)
94.7(2)
3в
Ph
1.891(4)
-
1.997(4)
2.068(4)
1.63(5)
81.3(1)
94.9(1)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
433
Таблица 2. Результаты анализа поверхности Хиршфельда для комплексов 2в, 3б и 3в
Комплекс
Вклады межатомных контактов в поверхность Хиршфельда, %
2в
H-H 38.7, C-H 28.1, Cl-H 13.8, C-C 5.6, N-H 4.5, C-N 2.9, Pt-C 2.5, Pt-H 2.2, C-Cl 1.3
3б
H-H 38.7, C-H 30.3, Cl-H 13.8, C-C 5.6, N-H 5.0, Pt-H 4.0, C-N 0.6, Pt-C 0.4, Pt-N 0.3, C-Cl 0.2, N-Cl 0.2
3в
H-H 44.3, C-H 21.4, Cl-H 13.5, C-C 8.2, C-N 4.7, N-H 2.2, Pt-C 3.9, Pt-H 0.6, Pt-N 0.6, C-Cl 0.3, N-Cl 0.3
Таблица 3. Фотофизические характеристики комплексов 2a-в и 3а-в
λmax, нма
τ,
Комплекс
λems, нм (λexc, нм)
(ε×10-3, см-1·М.-1)
мкс б
2а
276 (22.5), 325 (10.0), 350 (7.5), 385 пл (3.5)
480, 520, 560 пл (320)a
470, 520, 630 пл (350)б
0.1
2б
270 (30.0), 326 (15.0), 380 (5.0)
480, 520, 550 пл (325)a
490, 518, 575 пл (350)б
0.9
2в
326 (26.0), 380 (5)
480, 510, 550 (330)a
480, 517, 570б
0.5
3a
268 (37.2), 308 (10.0), 326 (9.3), 359 (3.9)
481, 512, 554 пл (350)a
592 пл (435)б
0.9
3б
285 (21.5), 320 (9), 326 (8), 380 (3.7)
482, 515, 549 пл (300)a
485, 516, 571 пл (360)б
1.2
3в
248 (36.5), 278 (19.6), 298 (15.6), 312 (12.2), 325 (10.1), 372 (3.4)
421, 446, 475, 506, 549 пл (320)a
480, 518, 548 пл (370)б
1.0
а 293 K, раствор в СH2Cl2 (5×10-4 М.).
б Твердая фаза.
связь C≡N в нитрильном или изоцианидном фраг-
гут влиять на фотофизические свойства комплек-
ментах имеет длину, сходную с длинами анало-
са. В случае последних взаимодействий для всех
гичных связей в других комплексах платины(II)
комплексов наблюдаются взаимодействия Pt-H и
[34, 35]. Все прочие длины связей хорошо согла-
Pt-C, однако не наблюдаются контакты Pt-Pt ха-
суются со значениями межатомных расстояний в
рактерные для бисизоцианидных и -нитрильных
других циклометаллированных нитрильных и изо-
комплексов платины(II) [26, 34-36, 39, 40].
цианидных комплексах платины(II) [15, 19, 36].
Для комплексов 2a-в и 3а-в получены фотофи-
зические характеристики в растворе в дихлорме-
Для того чтобы понять, какие именно межатом-
тане и в твердой фазе (табл. 3): зарегистрированы
ные контакты дают наибольший вклад в кристал-
спектры поглощения и эмиссии, а также опреде-
лическую упаковку, мы провели анализ поверхно-
сти Хиршфельда [37, 38] (табл. 2) для полученных
соединений 2в, 3б и ранее описанного комплекса
3в [20]. Для всех соединений анализ поверхно-
сти Хиршфельда показал, что наибольший вклад
в кристаллическую упаковку вносят межатомные
взаимодействия c участием атомов водорода. Од-
нако стоит отметить, что превалирование данных
контактов обусловлено большей фракцией атомов
водорода во всех структурах. Помимо контактов с
участием атомов водорода обнаружены взаимодей-
ствия между атомами углерода и атомами углерода
и азота, отвечающими за π-π-взаимодействия, а
Рис. 2. Спектры возбуждения (1) и эмиссии (2) в рас-
творе СH2Cl2 (5×10-4 М., 293 K) комплекса 2в.
также контактов с атомом платины, которые мо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
434
КАТКОВА и др.
лено время жизни возбужденного состояния лю-
плексы с изоцианидными лигандами стабильны в
минесценции. Электронные спектры поглощения
растворе в отличие от аналогичных комплексов с
комплексов в растворе (табл. 3, рис. 2) характери-
нитрильными лигандами, которые в растворе пе-
зуются несколькими типами оптических перехо-
реходят в хлормостиковый димер с элиминирова-
дов. Согласно литературным данным [15, 16, 18,
нием нитрильного лиганда. Кроме того, получен-
36, 41-43] высокоэнергетические интенсивные по-
ные изоцианидные комплексы могут выступать в
лосы поглощения в области λ 200-300 нм соответ-
качестве прекурсоров в синтезе N-гетероцикличе-
ствуют внутрилигандным π-π* переходам. Менее
ских и ациклических аминокарбеновых комплек-
интенсивные низкоэнергетические полосы погло-
сов [45-47] (M-NHC и M-ADC соответственно).
щения при 320-380 нм соответсвуют спин-разре-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
шенным переходам переноса заряда с лиганда на
лиганд (1LLCT, ppy, π→π*) и с металла на лиганд
В работе использовали коммерческие исходные
[1MLCT, dπ(Pt)→π*(ppy)] [5-7, 18, 29].
вещества и растворители (Aldrich) без дополни-
тельной очистки. 1,2-Дихлорэтан и CH2Cl2 пере-
В растворе нитрильные 2a-в и изоцианидные
гоняли над P2O5, диэтиловый эфир перегоняли над
3а-в комплексы имеют общий колебательно-струк-
металлическим натрием в присутствии бензофе-
турированный профиль эмиссии. Вместе с имею-
нонa. Хлормостиковый комплекс 1 синтезировали
щимися литературными данными, включающими
из K2[PtCl4] по методике [29].
данные по циклометаллированным комплексам
платины(II) с изоцианидными лигандами [7, 15,
Масс-спектрометрический анализ проводили на
44], это показывает, что в полученных комплексах
спектрометре Bruker micrOTOF (Bruker Daltonics)
орбитали CNR и NCR лигандов не вносят вклад в
с ионизацией электрораспылением. Раствори-
излучательное возбужденное состояние, и эмиссия
тель - метанол. Значения m/z приведены для сиг-
может быть связана с внутрилигандными 3LC (ppy)
налов изотопологов c наибольшим содержанием.
переходами (при участии влияния атома металла)
Инфракрасные спектры записаны на спектроме-
с небольшим участием 3MLCT-переходов. В соот-
тре Shimadzu FTIR-спектр 8400S (4000-400 см-1,
ветствии со смешанными 3LC/3MLCT-переходами,
образцы таблетированы с KBr). Спектры ЯМР 1H,
длины волн эмиссии λmax для всех полученных со-
13С{1H} и 195Pt{1H} регистрировали в растворе
единений практически одинаковы.
на спектрометре Bruker Avance II+ [400.13 (1Н),
Спектры эмиссии в твердой фазе имеют схожий
100.61 (13C), 86 МГц (195Pt)] при комнатной темпе-
профиль эмиссии с небольшим смещением макси-
ратуре, растворитель - СDCl3. Спектры поглоще-
мумов эмисии в длиноволновую область спектра,
ния зарегистрированы на спектрофотометре UV-
что связано с присутствующими в твердой фазе
1800 (Shimadzu). Спектры возбуждения, эмиссии
невалентными взаимодействиями. Спектр эмис-
и расчетное время жизни возбужденного состо-
сии изоцианидного комплекса 3а в твердой фазе
яния получены с помощью спектрофлуориметра
представлен в виде широкой бесструктурной по-
Fluorolog-3 (Horiba Jobin Yvon).
лосы с максимумом при 592 нм [25].
Синтез комплексов
2а-в. Суспензию
Большой стоксовский сдвиг полос излучения
[{Pt(ppy)Cl}2] 100 мг (0.13 ммоль) в 1 мл соот-
и значение времени жизни возбужденного состо-
ветствующего нитрила RCN (R = tBu, PhCH2, Ph)
яния в микросекундном интервале (0.1-0.9 мкс)
перемешивали при нагревании до 50°С в течение
указывают на триплетное происхождение люми-
24 ч до полной гомогенизации реакционной смеси,
несценции, т. е. фосфоресценцию.
затем добавляли 4 мл смеси толуола и Et2O (1:3).
Осадок отфильтровывали, промывали Et2O (2 ×
Таким образом, исследование C,N-циклометал-
4 мл) и сушили на воздухе. В случае tBuCN образо-
лированных комплексов платины(II) с изомерными
вывался люминесцирующий осадок светло-зеле-
нитрильными [Pt(ppy)Cl{NCR}] и изоцианидны-
ми [Pt(ppy)Cl{CNR}] (R = t-Bu, Bn, Ph) лигандами
ного цвета, который от. деляли и промывали Et2O
(2 × 4 мл) и сушили на воздухе.
показало, что оба типа лигандов оказывают схожее
влияние на фотофизические свойства. Однако ком-
[Pt(ppy)Cl(NCtBu)] (2a). Выход 73 мг (60%).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
435
ИК спектр, ν, см-1: 2231 (C≡N), 1485 (C=N). Спектр
(1H, H3, 3JHH 7.4, 1.5 Гц), 7.16 т. д (1H, H4, JHH 7.5,
ЯМР 1H, δ, м. д.: 1.59 с (9H, tBu), 7.10-7.17 м (3H,
1.4 Гц), 7.27 д. д. д (1H, H10, JHH 7.3, 5.8, 1.4 Гц),
H3, H4, H10), 7.26-7.28 м (1H, H5), 7.43-7.45 м (1H,
7.46 д. д (1H, H5, JHH 7.4, 1.2 Гц), 7.53 д. д (1H, H2,
H2), 7.61-7.63 м (1H, H8), 7.82 т. д (1H, H9, 3JHH 8.0,
J
7.6, 1.4 Гц), 7.71-7.73 м (1H, H8), 7.87 т. д (1H,
HH
1.5 Гц), 9.66 д. д (1H, H11, 3JHH 5.9, 3JPtH 45.3 Гц).
H9, JHH 7.9, 1.6 Гц), 9.50-9.59 м (1H, H11). Спектр
Масс-спектр, m/z: 432.1088 [M - Cl]+ (вычислено
ЯМР 13С, δС, м. д.: 30.31 (СН3), 58.50 [C(СН3)],
для C16H17N2Pt: 432.1034).
118.39 (C8, JCPt 35.4 Гц), 122.13 (C10, JCPt 26.8 Гц,
[Pt(ppy)Cl(NCCH2Ph)]
(2б). Выход
91 мг
сателлиты от Pt), 124.08 с с сателлитами от Pt
(70%). ИК спектр, ν, см-1: 2218 (C≡N), 1485 (C=N).
(C5, JCPt 40.0 Гц, сателлиты от Pt), 124.35 (C4),
Спектр ЯМР 1H, δ, м. д.: 4.22 с (2H, CH2), 7.01 т. д
131.20 (C3, JCPt 72.9 Гц, сателлиты от Pt), 136.81
(1H, H3, 3JHH 8.0, 1.2 Гц), 7.11-7.17 м (2H, H4, H10),
(C2, JCPt 106.9 Гц, сателлиты от Pt), 139.96 (C9),
7.33-7.47 м (7H, Ph, H2, H5), 7.60-7.62 м (1H, H8),
140.98 (C1), 144.11 (C6, JCPt 34.3 Гц, сателлиты
7.81 т. д (1H, H9, 3JHH = 8.0, 1.4 Гц), 9.63 д. д (1H,
от Pt), 148.55 (C11, JCPt 22.2 Гц, сателлиты от Pt),
H11, 3JHH 5.3, 3JPtH 45.8 Гц). Спектр ЯМР 13С, δС,
166.34 (C7); сигнал Cизоцианид не обнаружен. Спектр
м. д.: 25.58 (CH2), 118.30 (C8), 121.86 (C10), 123.62
ЯМР 195Pt{1H}: δPt -3945 м. д. Масс-спектр, m/z:
(C4), 124.13 (C5), 127.57 (Ph), 127.93 (Ph), 128.05
432.1038 [M - Cl]+ (вычислено для C16H17N2Pt:
(Ph), 128.28 (Ph), 128.81 (Ph), 129.14, 129.60,
432.1034).
130.38 (C3), 131.84 (C2), 132.15 (CN), 139.34 (C9),
[Pt(ppy)Cl(CNCH2Ph)]
(3б). Выход
104 мг
139.66 (C1), 143.85 (C6), 150.83 (C11), 167.69 (C7).
(80%), т. разл. 160°С. ИК спектр, ν, см-1: 2220
Масс-спектр, m/z: 466.0865 [M - Cl]+ (вычислено
(C≡N). Спектр ЯМР 1H, δ, м. д.: 5.01 с (2H, CH2),
для C19H15N2Pt: 466.0877).
6.95 т (1H, H3, 3JHH 7.1 Гц), 7.09 т (1H, H4, 3JHH
[Pt(ppy)Cl(NCPh)] (2в). Выход 86 мг (68%).
7.3 Гц), 7.22-7.29 м (2H, H10, Ph), 7.38-7.48 м (6H,
ИК спектр, ν, см-1: 2278 (C≡N), 1486 (C=N).
H2, H5, Ph), 7.67-7.69 м (1H, H8), 7.84 т (1H, H9, 3JHH
Спектр ЯМР 1H, δ, м. д.: 7.10-7.16 м (3H, H3, H4,
7.5 Гц), 9.50 д. д (1H, H11, 3JHH 5.5, 3JHPt 32.4 Гц).
H10), 7.35-7.49 м (1H, H5, H2), 7.58-7.66 м (3H, Ph,
Спектр ЯМР 13С, δС, м. д.: 48.57 (CH2), 118.50 (C8,
H8), 7.77 т (1H, Ph, 3JHH 7.6 Гц), 7.82-7.86 м (1H,
JCPt 36.6 Гц, сателлиты от Pt ), 122.14 (C10, JCPt
H9), 7.90 д (2H, Ph, 3JHH 7.6 Гц), 9.70 д. д (1H, H11,
25.5 Гц, сателлиты от Pt), 124.09 (C5), 124.42 (С4,
3JHH 5.8, 3JPtH 44.8 Гц). Спектр ЯМР 13С, δС, м. д.:
J
15.6 Гц, сателлиты от Pt), 127.18 (Ph), 129.05
CPt
118.35 (C8), 121.91 (C10), 123.72 (C4), 124.27 (C5),
(Ph), 129.32 (Ph), 131.08 (Ph), 131.19 (C3, JCPt 72.6
129.19, 129.58, 130.52 (C3), 131.79 (C2),
132.15
Гц, сателлиты от Pt), 136.13 (C2, JCPt 106.5 Гц, са-
(CN), 133.14 (Ph), 134.65 (Ph), 139.42 (C9), 139.90
теллиты от Pt), 140.11 (C9), 140.97 (C1), 143.94 (C6),
(C1), 143.66 (C6), 150.90 (C11), 167.70 (C7). Масс-
148.84 (C11, JCPt 23.0 Гц, сателлиты от Pt), 166.31
спектр, m/z: 452.0703 [M - Cl]+ (вычислено для
(C7); сигнал Cизоцианид не обнаружен. Спектр ЯМР
C18H13N2Pt: 452.0721).
195Pt{1H}: δPt -3943 м. д. Масс-спектр, m/z: 466.0875
Синтез комплексов
3а-в. К суспензии
[M - Cl]+ (вычислено для C19H15N2ClPt: 466.0867).
[{Pt(ppy)Cl}2]
100 мг
(0.13 ммоль) в
20 мл
Найдено, %: C 45.47; H 3.01; N 5.58. C19H15N2ClPt.
1,2-дихлорэтана при перемешивании и нагревании
Вычислено, %: C 44.03; H 3.12; N 5.33.
до 50°С прибавляли раствор изоцианида CNR (R =
Рентгеноструктурный анализ. Рентгено-
tBu, PhCH2; 0.26 ммоль) в 10 мл 1,2-дихлорэтана в
структурныи анализ комплексов
2в (CCDC
течение 1 ч. Смесь перемешивали при 80°С в тече-
1408594) и 3б (CCDC 1408607) выполняли на
ние 2 ч, затем упаривали до минимального объема
дифрактометре Xcalibur, Eos. Измерения проводи-
и добавляли 10 мл Et2O. Образованный осадок от-
ли при 100 K с использованием монохроматиче-
деляли и очищали перекристаллизацией из смеси
ского MoKα-излучения (λ 0.71073 нм). Структура
CH2Cl2-Et2O (2:1). Комплекс 3в получен по мето-
решена прямыми методами и уточнена с исполь-
дике, описанной в работе [20].
зованием программы SHELX [48] встроенной в
[Pt(ppy)Cl(CNtBu)] (3a). Выход 88 мг (72%),
комплекс OLEX2 [49]. Поправка на поглощение
т. разл. 165°С. ИК спектр, ν, см-1: 2206 (N≡C).
введена в программном комплексе CrysAlisPro эм-
Спектр ЯМР 1H, δ, м. д.: 1.69 с (9H, tBu), 7.10 т. д
пирически с помощью сферических гармоник, ре-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
436
КАТКОВА и др.
ализованных в алгоритме шкалирования SCALE3
2.
Li K., Tong G.S.M., Wan Q.Y., Cheng G., Tong W.Y.,
ABSPACK [50].
Ang W.H., Kwong W.L..Che C.M. // Chem. Sci. 2016.
Vol. 7. N 3. P. 1653. doi 10.1039/c5sc03766b
Комплекс 2в. C18H13N2ClPt, M 487.84, синго-
3.
Chi Y., Chou P.T. // Chem. Soc. Rev. 2010. Vol. 39. N 2.
ния моноклинная, пространственная группа P21/n,
P. 638. doi 10.1039/b916237b
a 8.1493(3) A, b 18.7526(7) A, c 10.4496(4) A, β
4.
Yam V.W.W., Law A.S.Y. // Coord. Chem. Rev. 2020.
105.839(4)°, V 1536.27(11) A3, Z 4, dвыч 2.109 г/см3,
Vol. 414. doi 10.1016/j.ccr.2020.213298
5.
Yang S.Y., Meng F.Y., Wu X.G., Yin Z., Liu X.Z., You C.F.,
μ 9.304 мм-1, размер кристалла 0.1×0.1×0.1 мм3;
Wang Y.F., Su S.J., Zhu W.G. // J. Mater. Chem. (C).
всего отражений 7103, независимых отражений c
2018. Vol. 6. N 21. P. 5769. doi 10.1039/c8tc01142g
I > 2σ(I) 3308 (Rint 0.0386), R1(|Fo| ≥ 4σF)/R1 (все
6.
Chan A.K.W., Ng M., Wong Y.C., Chan M.Y., Wong W.T.,
данные) 0.0326/0.0395, wR2(|Fo| ≥ 4σF)/wR2 (все
Yam V.W.W. // J. Am. Chem. Soc. 2017. Vol. 139. N 31.
данные) 0.0678/0.0719, ρmin/ρmax 2.38/-2.68 e/A3.
P. 10750. doi 10.1021/jacs.7b04952
7.
Schneider J., Du P.W., Jarosz P., Lazarides T.,
Комплекс 3б. C19H15N2ClPt, M 501.87, синго-
Wang X.Y., Brennessel W.W., Eisenberg R. // Inorg.
ния моноклинная, пространственная группа P21/n,
Chem. 2009. Vol. 48. N 10. P. 4306. doi 10.1021/
a 5.3540(3) A, b 14.3896(10) A, c 21.1589(10) A, β
ic801947v
90.169(5)°, V 1630.11(16) A3, Z 4, dвыч 2.045 г/см3,
8.
Pashaei B., Shahroosvand H., Graetzel M., Nazeerud-
μ 8.771 мм-1, размер кристалла 0.1×0.1×0.1 мм3;
din M.K. // Chem. Rev. 2016. Vol. 116. N 16. P. 9485.
всего отражений 7327, независимых отражений c
doi 10.1021/acs.chemrev.5b00621
I > 2σ(I) 3491 (Rint 0.0389), R1(|Fo| ≥ 4σF)/R1 (все
9.
Wong K.M.C., Tang W.S., Lu X.X., Zhu N.Y., Yam V.W.W. //
Inorg. Chem. 2005. Vol. 44. N 5. P. 1492. doi 10.1021/
данные) 0.0456/0.0616, wR2(|Fo| ≥ 4σF)/wR2 (все
ic049079p
данные) 0.1084/0.1084, ρmin/ρmax 3.26/-1.33 e/A3.
10.
Kinzhalov M. A., Kashina M.V., Mikherdov A.S.,
Анализ поверхностей Хиршфельда для кри-
Mozheeva E.A., Novikov A.S., Smirnov A.S., Ivanov D.M.,
сталлических структур комплексов 2в, 3б и 3в
Kryukova M.A., Ivanov A.Yu., Smirnov S.N., Kukush-
был проведен в рамках формализма нормализо-
kin V.Yu., Luzyanin K.V. // Angew. Chem. Int. Ed. 2018.
Vol. 57, N 39. P. 12785. doi 10.1002/anie.201807642
ванных длин контактов (dnorm) [38], основанного
11.
Solomatina A.I., Aleksandrova I.O., Karttunen A.J.,
на ван-дер-ваальсовых радиусах по Бонди [38] с
Tunik S.P..Koshevoy I.O. // Dalton Trans. 2017. Vol. 46.
помощью программы CrystalExplorer 3.1 [51].
N 12. P. 3895. doi 10.1039/c7dt00349h
12.
Wang W.Z., Zhang Y., Jin W.J. // Coord. Chem.
ФОНДОВАЯ ПОДДЕРЖКА
Rev. 2020. Vol. 404. P. 213107. doi 10.1016/j.
Работа выполнена при финансовой поддерж-
ccr.2019.213107
ке Совета на науке при Президенте РФ (МК-
13.
Koshevoy I.O., Krause M., Klein A. // Coord. Chem.
Rev. 2020. Vol. 405. P. 213094. doi 10.1016/j.
1476.2019.3) с использованием оборудования
ccr.2019.213094
ресурсных центров Санкт-Петербургского госу-
14.
Eremina A.A., Kinzhalov M.A., Katlenok E.A., Smir-
дарственного университета «Магнитно-резонанс-
nov A.S., Andrusenko E.V., Pidko E.A., Suslonov V.V.,
ные методы исследований», «Рентгенодифракци-
Luzyanin K.V. // Inorg. Chem. 2020. Vol. 59. N 4.
онные методы исследования», «Методы анализа
P. 2209. doi 10.1021/acs.inorgchem.9b02833
состава вещества» и «Образовательный центр по
15.
Diez A., Fornies J., Fuertes S., Lalinde E., Larraz C.,
направлению химия», «Оптические и лазерные
Lopez J.A., Martin A., Moreno M.T., Sicilia V. //
Organometallics. 2009. Vol. 28. N 6. P. 1705. doi
методы исследования вещества».
10.1021/om800845c
КОНФЛИКТ ИНТЕРЕСОВ
16.
Fornies J., Sicilia V., Borja P., Casas J.M., Diez A.,
Lalinde E., Larraz C., Martin A., Moreno M.T. // Chem.
Авторы заявляют об отсутствии конфликта
Asian J. 2012. Vol. 7. N 12. P. 2813. doi 10.1002/
интересов
asia.201200585
17.
Shahsavari H.R., Aghakhanpour R.B., Hossein-Abadi M.,
СПИСОК ЛИТЕРАТУРЫ
Haghighi M.G., Notash B., Fereidoonnezhad M. // New
1. Chen Y., Lu W., Che C.M. // Organometallics. 2013.
J. Chem. 2017. Vol. 41. N 24. P. 15347. doi 10.1039/
Vol. 32. N 1. P. 350. doi 10.1021/om300965b
c7nj03110f
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
437
18.
Martinez-Junquera M., Lara R., Lalinde E., More-
32.
Pazderski L., Pawlak T., Sitkowski J., Kozerski L.,
no M.T. // J. Mater. Chem. (C). 2020. Vol. 8. N 21.
Szlyk E. // Magn. Reson. Chem. 2009. Vol. 47. N 11.
P. 7221. doi 10.1039/d0tc01163k
P. 932. doi 10.1002/mrc.2491.
19.
Sivchik V.V., Grachova E.V., Melnikov A.S., Smirnov
33.
Kashina M.V., Kinzhalov M.A., Smirnov A.S., Iva-
S.N., Ivanov A.Y., Hirva P., Tunik S.P., Koshevoy I.O. //
nov D.M. , Novikov A.S., Kukushkin V.Yu. // Chem.
Inorg. Chem. 2016. Vol. 55. N 7. P. 3351. doi 10.1021/
Asian J. 2019. V. 14. N 21. P.
3915. doi 10.1002/
acs.inorgchem.5b02713
asia.201901127
20.
Katkova S.A., Kinzhalov M.A., Novikov A.S., Luzya-
34.
Михердов А.С., Тюфяков Н.Ю., Полукеев В.А., Бо-
nin K.V. // New J. Chem. 2021. Vol. 45. N 6. P. 2948. doi
ярский В.П. // ЖОХ. 2018. T. 88. Вып. 4. С. 631;
10.1039/D0NJ05457G
Mikherdov A.S., Tiuftiakov N.Yu., Polukeev V.A.,
Boyarskii V.P. // Russ. J. Gen. Chem. 2018. Vol. 88. N
21.
Anderson C., Crespo M., Morris J., Tanski J.M. // J.
Organomet. Chem. 2006. Vol. 691. N 26. P. 5635. doi
4. P. 713. doi 10.1134/S1070363218040151
35.
Кинжалов М.А., Кашина М.В., Михердов А.С.,. Кат-
10.1016/j.jorganchem.2006.09.012
кова С.А, Суслонов В.В. // ЖOX, 2018. T. 88. Вып.
22.
Wang H., Bisoyi H.K., Wang L., Urbas A.M., Bun-
6. С. 1000; Kinzhalov M.A., Kashina M.V., Mikherdov
ning T.J., Li Q. // Angew. Chem. Int. Ed. 2018. Vol. 57.
A.S., Katkova S. A., Suslonov V.V. // Russ. J. Gen. Chem.
N 6. P. 1627. doi 10.1002/anie.201712781
2018. Vol. 88. P. 1180. doi 10.1134/s107036321806021x
23.
Boterashvili M., Lahav M., Shankar S., Facchetti A.,
36.
Diez A., Fornies J., Larraz C., Lalinde E., Lopez J.A.,
van der Boom M.E. // J. Am. Chem. Soc. 2014. Vol. 136.
Martin A., Moreno M.T., Sicilia V. // Inorg. Chem. 2010.
N 34. P. 11926. doi 10.1021/ja5066587
Vol. 49. N 7. P. 3239. doi 10.1021/ic902094c
24.
Zaitceva O., Beneteau V., Ryabukhin D.S., Elise-
37.
McKinnon J.J., Jayatilaka D., Spackman M.A. // Chem.
ev I.I., Kinzhalov M.A., Louis B., Vasilyev A.V.,
Commun. 2007. Vol. N 37. P. 3814. doi 10.1039/
Pale P. // Tetrahedron. 2020. Vol. 76. N 14. P. 131029.
b704980c
doi 10.1016/j.tet.2020.131029
38.
Bondi A. // J. Phys. Chem. 1964. Vol. 68 P. 441. doi
25.
Каткова С.А., Лещев А.А., Михердов А.С., Кинжа-
10.1021/j100881a503
лов М.А. // ЖОХ. 2020. T. 90. № 4. C. 648; Katko-
39.
Ivanov D.M., Kirina Y.V., Novikov A.S., Starova G.L.,
va S.A., Leshchev A.A., Mikherdov A.S., Kinzhalov M.A. //
Kukushkin V.Y. // J. Mol. Struct. 2016. Vol. 1104. P. 19.
Russ. J. Gen. Chem. 2020. Vol. 90. N 4. P. 591. doi
doi 10.1016/j.molstruc.2015.09.027
10.1134/s1070363220040143
40.
Михердов А.С., Орехова Ю.А., Боярский В.П. //
26.
Кинжалов М.А., Кашина М.В., Михердов А.С., Кат-
ЖОХ. 2018. Т. 88. Вып. 10. С. 1677; Mikherdov A.S.,
кова С.А., Суслонов В.В. // ЖOX, 2018. T. 88. Вып. 6.
Orekhova Yu.A., Boyarskii V.P. // Russ. J. Gen.
С. 1000; Kinzhalov M.A., Kashina M.V., Mikherdov A.S.,
Chem. 2018. Vol. 88. N. 10. P. 2119. doi 10.1134/
Katkova S.A., Suslonov V.V. // Russ. J. Gen. Chem. 2018.
S1070363218100158
Vol. 88. N 6. P. 1180. doi 10.1134/s107036321806021x
41.
Jamshidi M., Babaghasabha M., Shahsavari H.R.,
27.
Кинжалов М.А., Золотарев А.А., Боярский В.П. //
Nabavizadeh S.M. // Dalton Trans. 2017. Vol. 46. N 45.
ЖCХ. 2016. T. 57. № 4. C. 861; Kinzhalov M.A.,
P. 15919. doi 10.1039/c7dt03599c
Zolotarev A.A., Boyarskiy V.P. // J. Struct. Chem. 2016.
42.
Forniés J., Fuertes S., Larraz C., Martín A., Sicilia V.,
Vol. 57. N 4. P. 822. doi 10.1134/s0022476616040302
Tsipis A.C. // Organometallics. 2012. Vol. 31. N 7. P.
28.
Kinzhalov M.A., Timofeeva S.A., Luzyanin K.V.,
2729. doi 10.1021/om201036z.
Boyarskiy V.P., Yakimanskiy A.A., Haukka M.,
43.
Solomatina A.I., Chelushkin P.S., Abakumova T.O.,
Kukushkin V.Y. // Organometallics. 2016. Vol. 35. N 2.
Zhemkov V.A., Kim M., Bezprozvanny I., Gurzhiy V.V.,
P. 218. doi 10.1021/acs.organomet.5b00936
Melnikov A.S., Anufrikov Y.A., Koshevoy I.O., Su S.H.,
29.
Kinzhalov M.A., Katkova, S.A., Doronina E.P., Novi-
Chou P.T., Tunik S.P. // Inorg. Chem. 2019. Vol. 58. N 1.
kov A.S., Eliseev I.I., Ilichev V. A., Kukinov A.A., Staro-
P. 204. doi 10.1021/acs.inorgchem.8b02204
va G.L., Bokach N.A. // Z. Kristallogr. Cryst. Mater.
44.
Kui S.C.F., Hung F.-F., Lai S.-L., Yuen M.-Y., Kwok
2018. Vol. 233. P. 795. doi 10.1515/zkri-2018-2075
C.-C., Low K.-H., Chui S.S.-Y., Che C.-M. // Chem.
30.
Pawlak T., Niedzielska D., Vícha J., Marek R., Pazder-
Eur. J. 2012. Vol. 18. N 1. P. 96. doi 10.1002/
ski L. // J. Organomet. Chem. 2014. Vol. 759. P. 58. doi
chem.201101880
10.1016/j.jorganchem.2014.02.016
45.
Mikherdov A.S., Kinzhalov M.A., Novikov A.S.,
31.
Niedzielska D., Pawlak T., Wojtczak A., Pazderski L.,
Boyarskiy V.P., Boyarskaya I.A., Dar’in D.V., Staro-
Szlyk E. // Polyhedron. 2015. Vol. 92. P. 41. doi
va G.L., Kukushkin V.Y. // J. Am. Chem. Soc. 2016.
10.1016/j.poly.2015.02.028
Vol. 138. N 42. P. 14129. doi 10.1021/jacs.6b09133
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
438
КАТКОВА и др.
46. Кинжалов М.А., Боярский В.П. // ЖОХ. 2015. Т. 85.
49. Dolomanov O., Bourhis L., Gildea R., Howard J.,
Вып. 10. С. 1681; Kinzhalov M.A. Boyarskii V.P. //
Puschmann H. // J. Appl. Crystallogr. 2009. Vol. 42.
Russ. J. Gen. Chem. 2015. Vol. 85. N 10. P. 2313. doi
P. 339. doi 10.1107/S0021889808042726
10.1134/s1070363215100175
50. CrysAlisPro A.T., Version 1.171.36.20 (release 27-06-
47. Kinzhalov M.A. Luzyanin K.V. // Coord. Chem. Rev.
2012).
2019. Vol. 399. doi 10.1016/j.ccr.2019.213014
51. Wolff S .K ., Grimwood D .J., McKinnon J.J ., Turner M.J.,
48. Sheldrick G.M. // Acta Crystallogr. 2008. Vol. 64. N 1.
Jayatilaka D., Spackman M.A. Crystal Explorer, Version
P. 112. doi 10.1107/S0108767307043930
3.1, University of Western Australia , 2012.
Cyclometallated Platinum(II) Complexes with Nitrile
and Isocyanide Ligands: Synthesis, Structure,
and Photophysical Properties
S. A. Katkova*, I. I. Eliseev, A. S. Mikherdov, E. V. Sokolova, G. L. Starova, and M. A. Kinzhalov
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: sa_katkova@mail.ru
Received December 8, 2020; revised December 8, 2020; accepted December 14, 2020
A series of cyclometallated platinum(II) complexes with nitrile and isocyanide ligands (NCR and CNR; R =
t-Bu, Bn, Ph) was synthesized from the dimer [{Pt(ppy)Cl}2] (Hppy = 2-phenylpyridine) and the correspond-
ing nitriles or isocyanides with a yield of 60-80%. Structure of the obtained compounds was established using
mass spectrometry, IR and NMR spectroscopy, as well as X-ray diffraction analysis. In order to establish the
contribution of various intermolecular interactions to the crystal packing for the obtained structures, the Hirsh-
feld surface analysis was preformed. The photophysical properties of the obtained complexes in solution and
solid phase were studied.
Keywords: platinum complexes, nitriles, isocyanides, luminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021